高纯度低分子量黄精多糖PSP-1-1、黄精寡糖PSO及方法和应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物医药处理领域,具体是高纯度低分子量黄精多糖PSP-1-1、黄精寡糖PSO及方法和应用。
背景技术
阿尔兹海默症(Alzheimer’s disease,AD)是一种渐进性的神经退行性疾病,主要临床表现为记忆障碍、思维缓慢、视空间技能损害、执行功能障碍以及人格和行为改变等。全球目前有接近5000万AD患者,而随着世界人口的老龄化问题加剧,据估计AD患者的数目在2050年将会翻三倍,达到1.5亿。已有的研究表明,AD患者的主要病理学特征是β-淀粉样蛋白聚集成老年斑,细胞内Tau蛋白异常和神经元死亡。β-淀粉样蛋白在脑内的沉积和异常表达是目前认为引发阿尔兹海默症的核心环节,以β-淀粉样蛋白为作用靶点,通过干扰APP代谢,从源头上减少β-淀粉样蛋白的产生,是目前治疗阿尔兹海默症的研究热点。Aβ单抗药物Aducanumab已获得FDA批准,一定程度上表明抑制或清除Aβ聚集是开发抗阿尔兹海默症的一种有效途径。
黄精(Polygonatum sibiricum Red.)是百合科黄精属多年生草本植物的根茎,其根茎味甘、性平,分布广泛、种类繁多,具有滋肾润肺、补脾益气等功效。临床上黄精具有抗衰老、抗氧化、提高免疫力、调节造血、抗肿瘤、降血糖等功效。黄精主要化学成分为多糖、甾体皂苷、蒽醌等。黄精多糖(Polygonatum sibiricum Polysaccharides,PSP)作为主要活性成分,被报道具有抗肿瘤、抗氧化、改善学习记忆等作用,但黄精多糖和黄精寡糖在治疗阿尔兹海默症的作用还并不明确。
尽管多糖已被报道具有多种生物活性,但原多糖一般分子量较大,不利于跨越细胞膜进入体内或结合生物活性位点发挥生物学活性,且生物利用率低。本发明提出低分子量的黄精多糖以及黄精寡糖的制备方法,并实验证明其生物活性要优于原多糖。目前还没有关于低分子量黄精多糖及黄精寡糖的制备方法及治疗AD的公开发明专利。仅在专利CN113501890B中描述了黄精粗多糖提取过程。
发明内容
本发明提供的方法简单有效的高纯度低分子量黄精多糖和寡糖的提取工艺和方法,以干燥的黄精为原料,获得黄精多糖PSP-1-1和黄精寡糖PSO,药理实验表明所述多糖和寡糖可以著延缓由Aβ引起的CL4176线虫瘫痪,具有潜在的治疗阿尔兹海默症的作用,能开发成治疗阿尔兹海默症的糖类药物。
为达此目的,本发明提供如下的技术方案:
本发明的第一个方面,提供了一种从高纯度低分子量黄精多糖PSP-1-1的制备方法,包括以下步骤:
S1、多糖提取:将干燥的黄精粉碎,使用纯水进行热浸提取,再经过过滤浓缩和醇沉后,获得黄精多糖粗品;
S2、多糖脱蛋白及脱色素:使用Sevage试剂和活性炭处理黄精多糖粗品,获得黄精多糖PSP;
S3、多糖纤维素柱分离:取黄精多糖溶于去离子水中,待完全溶解后离心,取上清液过滤,采用DE-52纤维素柱分离,依次采用纯水和不同浓度氯化钠溶液分段洗脱;使用苯酚-硫酸法跟踪检测洗脱液的吸光值,合并收集纯水洗脱组分,除盐浓缩、冷冻干燥,获得PSP-1;
S4、多糖凝胶色谱柱分离:取PSP-1溶于纯水中,待完全溶解后过滤,采用SephadexG-200分离,苯酚-硫酸法跟踪检测洗脱液的吸光值,合并收集主峰,浓缩干燥后,得到PSP-1-1。
在本发明中,Sevage试剂由三氯甲烷和正丁醇(5:1)组成。
优选的,所述步骤S1中纯水重量为黄精的10-30倍。
优选的,所述步骤S1中热浸提取的温度为70-100℃,时间为1-4h。
优选的,所述步骤S1中热水浸提次数为1-3次。
优选的,所述步骤S1中醇沉处理为:向浓缩后的提取物中滴加无水乙醇,直至乙醇含量为80%;将得到溶液于4℃放置过夜后,抽滤得到滤饼,之后冷冻干燥,得到黄精多糖粗品。
优选的,所述步骤S2中,先将黄精多糖粗品溶解于纯水中,加入1/5的Sevage试剂,剧烈震荡20-40min后,静置去除沉淀,重复8-20次;再加入10%(w/v)活性炭,搅拌处理后抽滤,将滤液醇沉,冷冻干燥,获得黄精多糖PSP。
优选的,所述步骤S3中,取黄精多糖PSP,加入10-30倍纯水溶解,待完全溶解后离心,取上清液过滤,采用DE52纤维素柱分离,依次以纯水、0.03、0.05、0.1、0.3、0.5M NaCl溶液洗脱,收集合并纯水洗脱组分,超滤管除盐,冷冻干燥,得到黄精多糖PSP-1。
优选的,所述步骤S4中,取黄精多糖PSP-1,加入2-10倍纯水溶解,过滤后经凝胶色谱柱Sephadex G-200分离,纯水洗脱,苯酚-硫酸法跟踪检测洗脱液的吸光值,合并收集主峰,浓缩干燥后,得到PSP-1-1。
本发明的第二个方面,提供了一种高纯度低分子量黄精多糖PSP-1-1,采用本发明所述的一种从高纯度低分子量黄精多糖PSP-1-1的制备方法制备。
优选的,黄精多糖PSP-1-1的总糖含量为99.2%,平均分子量为2.6kDa。
优选的,一种从高纯度低分子量黄精多糖PSP-1-1的制备方法,包括以下步骤:
S1、多糖提取:将干燥的黄精粉碎,使用纯水进行热浸提取,再经过过滤浓缩和醇沉后,获得黄精多糖粗品;
S2、多糖脱蛋白及脱色素:使用Sevage试剂和活性炭处理黄精多糖粗品,获得黄精多糖PSP;
S3、多糖纤维素柱分离:取黄精多糖溶于去离子水中,待完全溶解后离心,取上清液过滤,采用DE-52纤维素柱分离,依次采用纯水和不同浓度氯化钠溶液分段洗脱;使用苯酚-硫酸法跟踪检测洗脱液的吸光值,合并收集纯水洗脱组分,除盐浓缩、冷冻干燥,获得PSP-1;
S4、多糖凝胶色谱柱分离:取PSP-1溶于纯水中,待完全溶解后过滤,采用SephadexG-200分离,苯酚-硫酸法跟踪检测洗脱液的吸光值,合并收集主峰,浓缩干燥后,得到PSP-1-1。
优选的,所述步骤S1中纯水重量为黄精的10-30倍。
优选的,所述步骤S1中热浸提取的温度为70-100℃,时间为1-4h。
优选的,所述步骤S1中热水浸提次数为1-3次。
优选的,所述步骤S1中醇沉处理为:向浓缩后的提取物中滴加无水乙醇,直至乙醇含量为80%;将得到溶液于4℃放置过夜后,抽滤得到滤饼,之后冷冻干燥,得到黄精多糖粗品。
优选的,所述步骤S2中,先将黄精多糖粗品溶解于纯水中,加入1/5的Sevage试剂,剧烈震荡20-40min后,静置去除沉淀,重复8-20次;再加入10%(w/v)活性炭,搅拌处理后抽滤,将滤液醇沉,冷冻干燥,获得黄精多糖PSP。
优选的,所述步骤S3中,取黄精多糖PSP,加入10-30倍纯水溶解,待完全溶解后离心,取上清液过滤,采用DE52纤维素柱分离,依次以纯水、0.03、0.05、0.1、0.3、0.5M NaCl溶液洗脱,收集合并纯水洗脱组分,超滤管除盐,冷冻干燥,得到黄精多糖PSP-1。
优选的,所述步骤S4中,取黄精多糖PSP-1,加入2-10倍纯水溶解,过滤后经凝胶色谱柱Sephadex G-200分离,纯水洗脱,苯酚-硫酸法跟踪检测洗脱液的吸光值,合并收集主峰,浓缩干燥后,得到PSP-1-1。
本发明的第三个方面,提供了一种黄精寡糖PSO的制备方法,将本发明制备方法得到的黄精多糖PSP-1-1使用0.2M硫酸溶液水解,氢氧化钡中和,离心得到上清,80%醇沉,冷冻干燥后得黄精寡糖PSO。
本发明的第四个方面,提供了一种黄精寡糖PSO,所述黄精寡糖PSO采用本发明所述的一种黄精寡糖PSO的制备方法制备。
本发明的第五个方面,提供了本发明所述的高纯度低分子量黄精多糖PSP-1-1、本发明所述的黄精寡糖PSO在制备用于治疗和/或预防神经退行性疾病的药物中的用途。
本发明的第六个方面,提供了本发明所述的高纯度低分子量黄精多糖PSP-1-1、本发明所述的黄精寡糖PSO在制备用于治疗和/或预防阿尔兹海默症的药物中的用途。
与现有技术相比,本发明有益效果及显著进步在于:本发明对黄精的有效部位多糖进一步进行分离纯化,获得高纯度低分子量黄精多糖,并通过水解得到的黄精寡糖。对该多糖和寡糖进行药理活性检测,证明该多糖和寡糖均具有显著延缓由Aβ引起的线虫瘫痪作用,且活性优于多糖混合物,具有潜在的治疗阿尔兹海默症的作用,能开发成治疗阿尔兹海默症的糖类药物。
附图说明
为更清楚地说明本发明的技术方案,下面将对本发明的实施例所需使用的附图作一简单介绍。
显而易见地,下面描述中的附图仅是本发明中的部分实施例的附图,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图,但这些其他的附图同样属于本发明实施例所需使用的附图之内。
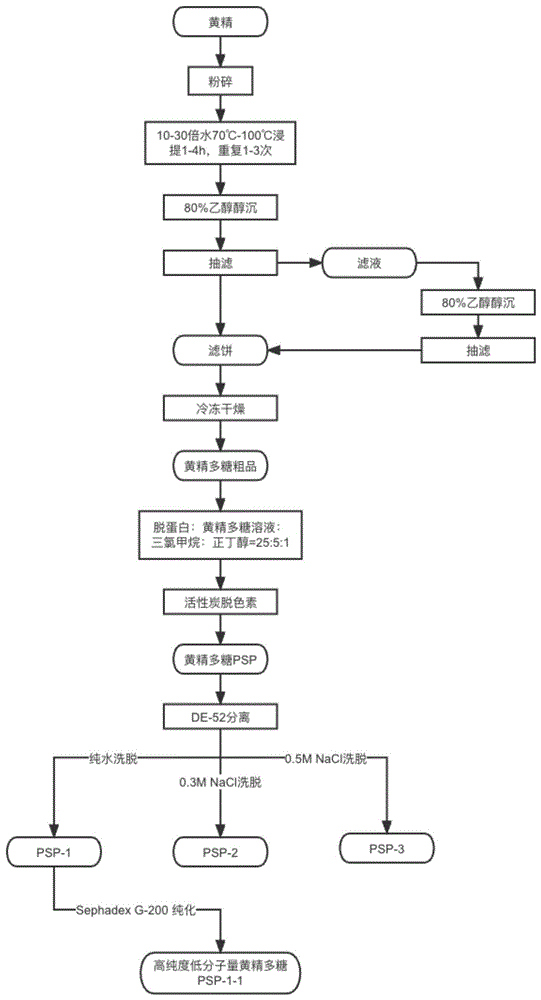
图1是根据本发明的一个实施方式的黄精多糖PSP-1-1的提取分离流程图;
图2是根据本发明的一个实施方式的黄精多糖的分离图,其中,图2A为DE-52纤维素柱分离图;图2B为Sephadex G-200G-2凝胶柱分离图;
图3是根据本发明的一个实施方式的黄精多糖PSP-1-1的HPGPC纯度鉴定图;
图4是根据本发明的一个实施方式的黄精寡糖PSO的提取流程图;
图5是根据本发明的一个实施方式的黄精多糖PSP-1-1的延长CL4176线虫瘫痪图;
图6是根据本发明的一个实施方式的黄精寡糖PSO的延长CL4176线虫瘫痪图。
具体实施方式
为使本发明实施例的目的、技术方案、有益效果及显著进步更加清楚,下面,将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述。
显然,所有描述的这些实施例仅是本发明的部分实施例,而不是全部的实施例;基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要理解的是:
对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
还需要说明的是,以下的具体实施例可以相互结合,对于其中相同或相似的概念或过程可能在某些实施例中不再赘述。
下面,以具体的实施例对本发明的技术方案进行详细说明。
实施例1黄精多糖的提取和分离纯化
黄精多糖PSP-1-1的提取分离流程图如图1所示。
1.1、多糖提取:取干燥黄精药材粉碎,加入20倍水量,90℃提取2次,每次2h。抽滤合并减压浓缩,加入无水乙醇至样品溶液中乙醇浓度达到80%,充分搅拌后,4℃放置过夜,过滤,按照同样方法沉淀2次,合并沉淀物并减压浓缩,冷冻干燥,得到黄精多糖粗品。
1.2、脱蛋白与脱色素:取10g含量黄精多糖粗品,加入400mL纯水溶解,加入1/5体积的Sevage试剂(三氯甲烷:正丁醇=5:1),剧烈震荡25min,静置分层,缓慢弃去下层有机溶剂及中间层变性蛋白质,保留上清液,重复8次。再加入10%(w/v)活性炭,搅拌处理后抽滤,将滤液醇沉,冷冻干燥,获得黄精多糖PSP。
将步骤1.1得到的黄精多糖粗品和步骤1.2得到的黄精多糖PSP进行比较,结果如表1所示。
表1黄精多糖PSP与黄精多糖粗品的比较
1.3、多糖的分离纯化
1)DE-52纤维素预处理
取100gDE-52纤维素干粉在去离子水中充分膨胀,洗涤除去杂质。先用0.5M NaOH浸泡半小时,纯水洗至中性,再用0.5M NaCl溶液浸泡半小时,纯水洗5次;再用0.5M NaOH浸泡半小时,纯水洗至中性。
2)装柱
装柱前先用去离子水将玻璃柱中底部空气排空,将预处理好的DEAE-52纤维素轻轻搅拌混匀,利用玻璃棒引流尽可能一次性将倾入色谱柱中,混悬液沿色谱柱内壁留下,防止气泡产生。装柱后检查柱床是否规整、是否有气泡或界面存在。
3)柱平衡及洗脱
纯水洗脱5个柱体积。取250mg PSP溶于10mL纯水中溶解,4000rpm离心5min,上清液过滤膜进一步除去杂质后全部均匀上样。依次以纯水、0.03、0.05、0.1、0.3、0.5M NaCl溶液分段洗脱。苯酚硫酸法跟踪检测洗脱液在490nm的吸光值(图2A)。合并收集主峰,得到PSP-1、PSP-2、PSP-3,超滤管除盐浓缩,冷冻干燥。结合活性跟踪检测结果(表2),得到PSP-1。
表2黄精多糖经过DE-52分离后各组分产率及活性检测
4)Sephadex G-200凝胶预处理
在室温下,将葡聚糖凝胶干粉浸泡于蒸馏水中至少24小时,并不断搅拌以保证凝胶溶胀,直至充分溶胀,凝胶体积不再变化。
5)Sephadex G-200凝胶装柱
将溶胀好的凝胶根据装柱要求一次性置入柱内,注意保持湿态装柱,并避免柱内产生气泡或断层。
6)Sephadex G-200的平衡及洗脱
用5个柱体积纯水平衡凝胶柱,取PSP-1,加入纯水,待完全溶解后离心,取上清液过滤后均匀上样,以纯水为洗脱剂,苯酚-硫酸法跟踪洗脱液在490nm的吸光值(图2B)。合并收集主峰,减压浓缩后真空干燥后,得到多糖PSP-1-1,称重。
实施例2黄精多糖PSP-1-1的鉴定
将实施例1得到的黄精多糖PSP-1-1进行糖含量测定、分子量测定及纯度鉴定:
采用苯酚-硫酸法测定黄精多糖PSP-1-1的总糖含量,并使用葡萄糖溶液制作标准溶液,经测定黄精多糖PSP-1-1的总糖含量为99.2%。
采用高效凝胶渗透色谱系统,TSKgel G3000PWxl(7.8*300mm,日本东曹),以不同分子量的标准葡聚糖(Dextran)制作标准曲线;设定柱温为40℃,以0.7% Na2SO4溶液作为流动相,流速为0.8mL/min,黄精多糖PSP-1-1浓度为5mg/mL,测定黄精多糖PSP-1-1的分子量。
如图3所示,经测定黄精多糖PSP-1-1HPGPC图谱为单一对称峰,相对分子质量为2.657kDa,多分散指数为1.3878,黄精多糖PSP-1-1为均一多糖。
实施例3黄精寡糖PSO的制备
黄精寡糖PSO的提取流程图如图4所示。
将实施例1得到的黄精多糖PSP-1-1加入30倍(w/v)0.2M硫酸溶液中,80℃加热1h,冷却后立即加入0.2M Ba(OH)2溶液中和。离心除去沉淀,加入乙醇,至乙醇含量为80%,4℃冷藏过夜后,将上清液除去酒精后冷冻干燥。
实施例4黄精多糖PSP-1-1和黄精寡糖PSO对由Aβ引起的CL4176线虫瘫痪的保护作用
将实施例1得到的黄精多糖PSP-1-1和实施例3得到的黄精寡糖PSO进行CL4176线虫瘫痪实验。CL4176线虫在其体壁肌肉细胞中特异性的转入了人类Aβ基因,该基因由温度诱导表达,即16℃培养至L3期后升高培养温度至23℃后能够诱导Aβ蛋白大量表达,而大量表达的Aβ会积聚在CL4176线虫的肌肉细胞间,使线虫表现出运动不协调的症状,研究称其为瘫痪表型。瘫痪实验步骤包括:
4.1、同步化后的CL4176线虫,计算虫密度,取一定体积的同步化线虫虫液置于0.6mL无菌离心管中,保证所取溶液中线虫虫数不少于30条,随后每管加入5μL OP50菌液、10μL药物,使用S-complete溶液将体系补至100μL,使用微量移液器轻轻吹打,混合均匀后转移至新鲜制备的35mm培养皿制备的NGM培养基上,置于16℃恒温培养箱中培养36小时。
4.2、36小时后,于显微镜下观察培养皿中线虫的生活状态,此时能够观察到培养皿中的线虫均发育至L3期,调高培养温度至23℃继续培养24小时。
4.3、在23℃培养24小时后,开始记录培养皿中线虫的瘫痪情况,每1小时观察并记录瘫痪线虫的数目(线虫瘫痪的判断标准:使用铂金丝轻轻触碰线虫的头部和尾部,若线虫身体无法动弹而仅有头部轻微摇动或者在线虫头部区域出现一个透明的圆形无菌圈时,则认为该线虫为瘫痪线虫)。
4.4、每小时记录培养皿中线虫瘫痪数目,直至培养皿中所有线虫瘫痪,该实验实验至少重复三次,使用使用Graphpad Prism 9统计分析所得到的实验结果,绘制瘫痪存活曲线以及线虫半数瘫痪时间柱状图(线虫半数瘫痪时间柱状图)。
结果如图5、图6所示,黄精多糖PSP-1-1和黄精寡糖PSO可以显著延缓由Aβ引起的CL4176线虫瘫痪时间。其中,p<0.05,*;p<0.01,**;p<0.001,***;表示与对照组相比的显著性差异程度。
综上所述,通过实施例可知,采用本方案对黄精的有效部位多糖进一步进行分离纯化,获得高纯度低分子量黄精多糖,并通过水解得到黄精寡糖。对该多糖和寡糖进行药理活性检测,证明该多糖和寡糖均具有显著延缓由Aβ引起的线虫瘫痪作用,且活性优于多糖混合物。表明黄精多糖PSP-1-1和黄精寡糖PSO有望成为治疗阿尔兹海默症的糖类候选药物。
在上述说明书的描述过程中:
术语“本实施例”、“本发明实施例”、“如……所示”、“进一步的”、“进一步改进的技术分方案”等的描述,意指该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中;在本说明书中,对上述术语的示意性表述不是必须针对相同的实施例或示例,而且,描述的具体特征、结构、材料或者特点等可以在任意一个或者多个实施例或示例中以合适的方式结合或组合;此外,在不产生矛盾的前提下,本领域的普通技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合或组合。
最后应说明的是:
以上各实施例仅用以说明本发明的技术方案,而非是对其的限制;
尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换,而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围,本领域技术人员根据本说明书内容所做出的非本质改进和调整或者替换,均属本发明所要求保护的范围。
- 一种多花黄精多糖的提取方法及多花黄精多糖的应用
- 一种多花黄精多糖的提取方法及多花黄精多糖的应用
