快速定量检测三七素的方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及化学分析测试领域,具体而言,涉及快速定量检测三七素的方法。
背景技术
三七[Panax notoginseng(Burk.)F.H.Chen]为五加科人参属多年生草本植物,味甘、微苦、性温,已有几百年的历史,是我国特有的名贵中药材,同时也被纳入到保健食品管理的中药品种当中,具有散瘀止血,消肿定痛、抗炎抗氧化、预防心血管疾病和保护肝脏等功效(国家药典委员会,2015)。三七不仅在中医药行业,还在食品和日化品产业中的应用发展迅猛,含有三七的中成药种类繁多,如三七注射液、云南白药、复方丹参滴丸、血塞通注射液等中成药,也逐渐被牙膏、护肤品等日化品所使用。据统计,全国以三七为原料的中成药品种有540多种,药品批号3600多个,涉及制药企业1350多家(刘立红et al.,2017)。三七素是三七起止血作用的主要活性成分,此外三七素的主要功效还包括抗炎(Yang et al.,2017)抗氧化(Huang et al.,2020)、抑制破骨细胞的形成(Cang et al.,2021)、减轻糖尿病肾病损伤(Jie et al.,2017)等。然而三七品质定量检测技术比较滞后,主流上仍以《药典》2020版中通过液相色谱法对皂苷定量检测来分析其品质,并没有对三七素含量标准进行规定。近些年来,有学者对三七素展开研究,但由于三七素的特点,常用的衍生化方法的样品前处理操作繁琐、耗时,且不能排除衍生物的干扰,大大制约了三七素的检测效率,不适用于大批量样品检测和市场推广。
发明内容
本发明旨在建立一种无需衍生化检测三七中三七素的液相色谱方法,适用于三七多样化产品的检测,不仅包括以三七根为主的三七粉,三七饮片等,还有三七花,三七叶为原料的产品的品质检测。
本发明提供的一种三七中三七素的快速定量检测方法,包括:
1)将猜测三七样品加入纯水中,提取,离心后取上清液,获得三七样品的初步水提取液;
2)将初步水提取液与100%的乙腈混合获得混合溶液,再经过超声处理和离心获得上清液,即为供高效液相色谱柱分析的三七样品的提取溶液;
3)采用超高效液相色谱-二极管阵列检测器系统分析所述三七样品的提取液;
其中,所述超高效液相色谱采用Syncronis HILIC 1.7um×2.1×150mm色谱柱;所述超高效液相色谱的条件如下:流动相A:乙腈,流动相B:80mM甲酸铵;75%A,25%B等度洗脱;所述二极管矩阵检测器的采集波长为215nm。
其中,所述流动相的流速为0.4mL/min。
其中,所述色谱柱的柱温为30℃。
其中,所述二极管矩阵检测器的光电分离度为1.2nm,采样速率为10pt/s。
优选的,所述步骤1)中,所述提取的方法为超声处理(30-50分钟,优选45分钟),离心的条件为10000rpm/min离心3min。
优选的,所述步骤1)中,三七样品与纯水的混合比例为0.1g:1ml。
优选的,所述步骤2)中,将初步水提取液后与100%乙腈体积比为3:7的比例混合获得混合液体。步骤2)中超声处理的时间为5-15分钟,优选10分钟。
优选的,所述步骤2)中,所述离心的条件为12000rpm/min离心3min。
其中,所述超高效液相色谱中使用三七素标准曲线。
本发明的三七中三七素的快速定量检测方法能够检测三七样本中的三七素,检测结果精确可靠。
本发明的三七中三七素的快速定量检测方法,利用超高效液相色谱-光电二极管矩阵检测器(UPLC-PDA)系统,并结合超声快速提取三七素技术,大大节省了检测时间,样品前处理时间加检测时间,共计9min,且没有衍生物的干扰,整体操作简单,适用于推广检测。
附图说明
图1示出了使用ACQUITY UPLC@BEH-C18 1.7um×2.1×50mm色谱柱的色谱图;
图2示出了使用ACQUITY UPLC@BEHHILIC 1.7um×2.1×50mm色谱柱的色谱图;
图3示出了使用Syncronis HILIC 1.7um×2.1×150mm色谱柱的色谱图;
图4示出了采用梯度洗脱1)的色谱图;
图5示出了采用梯度洗脱2)的的色谱图;
图6示出了采用等度洗脱3)的的色谱图;
图7示出了采用等度洗脱4)的的色谱图;
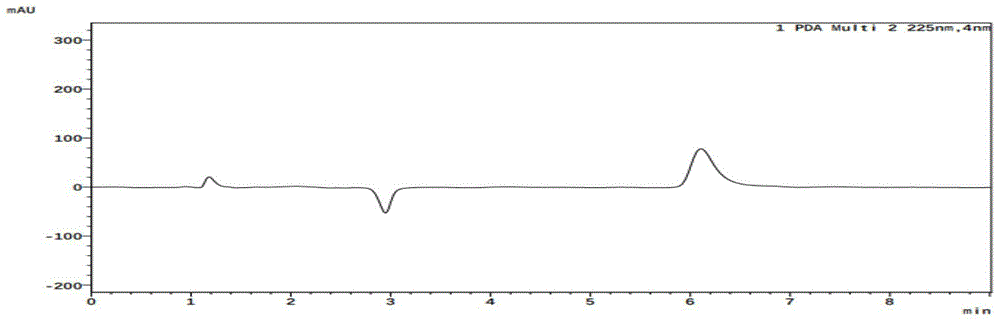
图8示出了采用195nm检测波长的色谱图;
图9示出了采用205nm检测波长的色谱图;
图10示出了采用215nm检测波长的色谱图;
图11示出了采用225nm检测波长的色谱图;
图12示出了采用235nm检测波长的色谱图;
图13示出了三七素的标准曲线;
图14示出了三七主根样品的色谱图;
图15示出了三七须根样品的色谱图;
图16示出了三七茎样品的色谱图;
图17示出了三七叶样品的色谱图。
具体实施方式
下述实施例中的方法,如无特别说明,均为常规方法。
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变化和改进。这些都属于本发明的保护范围。
三七中三七素的快速定量检测方法的建立
一、标准曲线配制
精确称取1mg三七素标品,溶于1000μL纯水中,制成单标品的储存液,置于-20℃保存。
浓度计算公式:c=m*B/V(c表示溶液浓度;m表示标品质量;B表示标品纯度;V表示溶剂体积)。然后将储存液与100%乙腈按照3:7的比例配比梯度稀释至400μg/mL、200μg/mL、100μg/mL、50μg/mL、25μg/mL、12.5μg/mL的系列标准曲线工作液。标准曲线工作液的配制重复上述方法。
二、样品前处理
称量0.1g干制三七粉样品(精确到mg),加入纯水1.0mL,振荡混匀,超声处理45min,10000rpm/min离心3min,取300μL上清液加入700μL乙腈(纯度100%)混匀,再次超声处理10min,12000rpm/min离心3min,取上清待用。超声频率37KHZ。
三、对色谱柱、洗脱条件和检测条件等仪器方法条件优化
1、色谱柱的优化
采用仪器岛津LC-30AD。色谱柱分别使用:ACQUITY UPLC@BEH-C18 1.7um×2.1×50mm;ACQUITY UPLC@BEH HILIC 1.7um×2.1×50mm;Syncronis HILIC 1.7um×2.1×150mm。流动相A:乙腈,流动相B:80mM甲酸铵,等度洗脱。流速0.4mL/min。柱温30℃,光电二极管矩阵检测器(PDA)的采集波长215nm。分离度1.2nm。采样速率10pt/s。
使用ACQUITY UPLC@BEH-C18 1.7um×2.1×50mm色谱柱没有产生信号(图1)。使用ACQUITY UPLC@BEH HILIC 1.7um×2.1×50mm色谱柱,三七素保留时间特别短,不符合要求(图2)。使用Syncronis HILIC 1.7um×2.1×150mm,三七素得到了较好的保留,且总用时较少(图3),因此,选择Syncronis HILIC色谱柱用于三七素的快速定量检测方法。
2、洗脱条件的优化
采用仪器岛津LC-30AD。色谱柱使用Syncronis HILIC1.7um×2.1×150mm。流动相A:乙腈,流动相B:80mM甲酸铵,流速0.4mL/min。柱温30℃,光电二极管矩阵检测器(PDA)的采集波长215nm。分离度1.2nm。采样速率10pt/s。采用梯度洗脱条件1(0-7min,20% A;7-8min,20%A-40%A),三七素出峰时间较晚,且出现了重叠的双峰状态(图4)。采用梯度洗脱条件2(0-7min,17% A;7-8min,17%A-40%A)(图5),三七素峰宽接近两分钟,且峰形不理想;采用等度洗脱条件3(20% A;80%B)(图6),三七素在15分钟左右出峰;采用等度洗脱条件4(25% A;75%B)(图7),三七素在6分钟左右出峰;因此,选择等度洗脱条件4用于三七素的快速定量检测方法。
3、检测波长的筛选
采用仪器岛津LC-30AD。色谱柱使用Syncronis HILIC 1.7um×2.1×150mm。流动相A:乙腈,流动相B:80mM甲酸铵,采用等度洗脱条件(25% A;75%B),流速0.4mL/min,柱温30℃。在四个检测波长195nm(图8)、205nm(图9)、215nm(图10)、225nm(图11)、235nm(图12)中,发现215nm波长下波形稳定,峰高较合适。因此,选择215nm检测波长用于三七素的快速定量检测方法。
通过优化确定用于三七素的快速定量检测方法的仪器方法为:采用仪器岛津LC-30AD;色谱柱Syncronis HILIC 1.7um×2.1×150mm;流动相A:乙腈,流动相B:80mM甲酸铵,25%A,75%B等度洗脱;流速0.4mL/min;上样量10uL;柱温30℃;光电二极管矩阵检测器(PDA)的采集波长分别为215nm;分离度1.2nm;采样速率10pt/s。
四、三七素的标准曲线的制作
通过上述优化后的条件(采用仪器岛津LC-30AD;色谱柱Syncronis HILIC 1.7um×2.1×150mm;流动相A:乙腈,流动相B:80mM甲酸铵:25%A,75%B等度洗脱;流速0.4mL/min;上样量10uL;柱温30℃;光电二极管矩阵检测器(PDA)的采集波长分别为215nm;分离度1.2nm;采样速率10pt/s。)对三七素标准品及三七样品进行检测。三七素的标准曲线图如图13所示,标准曲线线性良好,R
表1
三七各部位三七素检测
从云南省三七不同种植地区以三点采样法采集三七样品,每个采样点共采集20-30株,清洗干净,60℃烘箱烘干至恒重,分别分为三七主根、三七须根、三七茎和三七叶四个部分,通过上述三七中三七素快速定量检测方法进行检测。
分别称量0.1g三七各部分样品(精确到mg),加入纯水1.0mL,振荡混匀,超声处理45min,10000rpm/min离心3min,取300μL上清与700μL100%乙腈混合,超声10min,12000rpm/min离心3min,取上清液于进样小瓶,待用。
通过三七中三七素快速定量检测方法进行检测三七各部分中的三七素。采用仪器岛津LC-30AD;色谱柱Syncronis HILIC 1.7um×2.1×150mm;流动相A:乙腈,流动相B:80mM甲酸铵,25%A,75%B等度洗脱;流速0.4mL/min;上样量10uL;柱温30℃;光电二极管矩阵检测器(PDA)的采集波长为215nm;分离度1.2nm;采样速率10pt/s。
通过对三七各部分样品进行重复实验(n=8),测定所建立的三七中三七素快速定量检测方法的稳定性,分析结果发现RSD%均小于10%。三七各部分的回收率在85.45%-110.69%之间,表明所建立的三七中三七素快速定量检测方法准确稳定,可进行三七样本中三七素的检测(三七素各部位回收率见表2)。
实施例1、云南省三七不同种植地区
三七样品检测
2019年7月份从云南省三七不同种植地区以三点采样法采集三七样品,每个采样点共采集20-30株,清洗干净,60℃烘箱烘干至恒重,分别分为三七主根、三七须根、三七茎和三七叶,通过三七中三七素快速定量检测方法进行检测。
结果如表2所示,主根、须根、茎和叶中均含有三七素,但含量有明显差异,主要表现为三七地下部位(主根、须根)明显高于地上部位(茎、叶),三七素含量规律总体表现为须根>主根>叶>茎。三七主根、须根、茎和叶中三七素液相色谱图分别如图14、图15、图16、图17所示。
表2.三七素含量(mg/g)
/>
