一种C1酯酶抑制剂纯化工艺中蛋白含量的快速定量方法
文献发布时间:2023-06-19 19:30:30
技术领域
本发明属于医药生物技术领域,具体的,涉及一种C1酯酶抑制剂纯化工艺中蛋白含量的快速定量方法。
背景技术
人血浆中存在一种名为C1酯酶抑制剂(C1 esterase inhibitor,C1-INH)的蛋白,主要由肝脏合成,由478个氨基酸组成的单链糖蛋白,相对分子质量为104000,具有高度糖基化的结构,糖含量约占相对分子质量的30%,等电点为2.7~2.8,血浆中含量约为0.2mg/ml,热稳定性差。其功能为抑制补体因子1(C1)的酯水解活性,属于丝氨酸蛋白酶抑制剂家族,是人体补体系统的重要调节物质之一,在补体系统的经典途径和旁路途径中,均具有重要的调节作用。在激肽释放酶-激肽系统中,C1-INH能抑制活化的ⅩⅡ因子(FⅩⅡa)与激肽释放酶的活性,从而对缓激肽的形成造成影响。缓激肽可引起毛细血管扩张使其渗透性增强,从而导致血管内容物渗出形成人体组织局部水肿,即血管性水肿(HAE),HAE同样由C1-INH缺乏或功能障碍引起。C1-INH缺乏导致I型HAE,C1-INH功能障碍导致II型HAE,临床特点为皮肤黏膜反复发作、自限性、局限性、非凹陷性水肿,多发于四肢、面部及上呼吸道。当急性水肿发生在上呼吸道时常因喉头水肿导致患者窒息死亡。C1-INH的补充疗法用于恢复HAE患者缺失或功能失调的蛋白,通过血源性或重组C1-INH浓缩物按需治疗来控制HAE的发作。在疾病的多种治疗药物中,C1-INH浓缩制剂副作用小,安全性和有效性高,长期用于治疗HAE,其安全性、有效性及机体耐受性已得到验证,血浆来源的C1-INH浓缩制剂也成为儿童、孕妇、哺乳期女性患者的首选药物。
申请人正在进行从血浆中提取C1-INH的工艺研究,其中蛋白含量、效价、纯度是生产全过程质量控制的主要指标,蛋白含量根据免疫比浊法使用特定蛋白检测仪进行检测,效价与纯度均采用欧洲药典收录的方法进行检测,其中纯度为HPLC法。《中国药典》三部2020版通则和指导原则0731的蛋白质含量测定法收录了6种方法,分别是:凯氏定氮法、福林酚法(Lorry法)、双缩脲法、BCA法、考马斯亮蓝法(Brandford法)、紫外-可见光光度法。按照欧洲药典要求,C1-INH浓缩制剂比活性检测要求中,总蛋白的含量检测方法为凯氏定氮,该方法操作时间较长,一般需要2天,多用于成品检定。工艺开发过程中需要根据比活性结果进行超滤、配制等工艺操作,凯氏定氮法不能满足过程样品的快速检测需要。紫外-可见光光度法根据蛋白质分子中含有共轭双键的络氨酸、色氨酸等芳香族氨基酸,其在280nm波长处具最大吸光度,在一定范围内其吸光度大小与蛋白浓度成正比。该法操作简便快速,用于纯化蛋白质检测,一般供试品浓度在0.2~2mg/ml,但是准确度较差、干扰物质多。药典推荐按照通则0401紫外-可见光分光度法的吸收系数法或者对照品比较法计算供试品中蛋白质含量。我们根据多年的建立定量检测方法的经验,在已有高纯度的C1-INH可作为标准品的情况下,确定选用对照品比较法作为基础,并对其进行了优化,建立对照品蛋白浓度与A280的更宽广蛋白浓度的线性方程,然后根据供试品不同稀释度的A280带入方程计算,以均值作为该样品的蛋白浓度。同时对该方法进行了验证,并用于纯化工艺后半段高纯度样品的蛋白含量测定。
基于此,提出本发明
发明内容
本发明首先涉及一种C1酯酶抑制剂(C1 esterase inhibitor,C1-INH)的浓度测定方法,所述方法包括如下步骤:
(1)用注射用水稀释待测CI-INH样品;
(2)以280nm波长检测稀释样品的吸光度Y;
(3)带入修正后的经验公式,计算蛋白浓度,所述的经验公式为:
蛋白浓度X={10^[(LgY+0.382)/0.764]-0.05}×稀释倍数。
进一步的,使用酶标仪Spectromax Plus384和石英比色杯检测280nm波长下样品的吸光度Y;
进一步的,待测样品中,C1-INH蛋白的纯度高于85%,待测样品中C1-INH蛋白浓度范围在0.2~5.5mg/ml之间。
本发明还涉及所述的方法在C1酯酶抑制剂生产纯化过程中的蛋白纯度检测中的应用。
本发明还涉及所述的方法在C1酯酶抑制剂产品的蛋白含量检测中的应用。
本发明的有益效果在于:
1、大多数蛋白定量方法采用牛血清白蛋白或者免疫球蛋白作为标准品来测定待测样品的蛋白含量,若对蛋白定量的准确度要求特别高时,需使用纯化的目标蛋白绘制标准曲线。由于目前市场上没有C1-INH浓缩制剂的C1-INH蛋白浓度标准品,我们就自行制备纯度>95%的C1-INH中间品作为对照品,来绘制标准曲线去检测纯化过程样品。
2、A280法用石英比色杯作为容器在酶标仪上进行检测,将数据用软件处理,可快速得到不同拟合方程下的回收率,以确定最佳拟合方程和蛋白浓度线性范围。为了
3、通过实验发现冻干
4、一般A280法多用于研发阶段的精纯阶段样品蛋白含量检测,生物制品的成品、原液/半成品多为凯氏定氮法及双缩脲法。我们在新产品研发过程中考虑到最终检定方法与过程检定一致性的需要,将A280法检测结果与凯氏定氮法的结果进行比较,结论为该改良的A280法建立的经验公式具有
附图说明
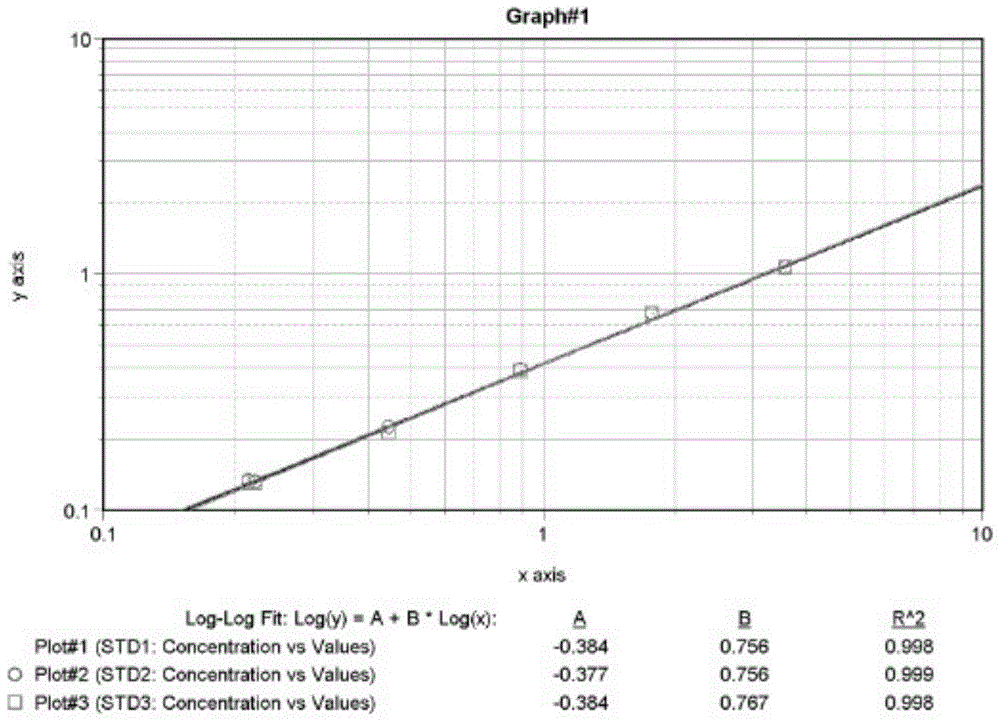
图1、三次实验的原始值拟合的标准曲线。
图2、三次实验的消光值拟合的标准曲线。
具体实施方式
材料与方法
样品
纯化工艺流程:原料样品→粗纯捕获→精纯→原液→半成品→成品
纯化工艺中间样品(C1-INH纯度>85%):精纯步骤样品、原液及半成品。
对照品:超滤后样品(凯氏定氮结果为10.7mg/ml);
以上所有样品均由申请人自行配置。
主要试剂及仪器
酶标仪Spectromax Plus384及配套Softmax 5.2软件;比色杯。
实施例1、定量检测方法的建立及验证
1.1、定量检测方法的建立
将对照品用注射用水进行分步稀释,共12个浓度,使其覆盖0.214~5.35mg/ml浓度范围。每个浓度样品配制1500微升,覆盖石英比色杯2/3的体积,读取A280值,重复6次,同理进行空白对照的操作。将对照品的A280值减去空白对照的A280值,得出吸光度差值即消光值,将消光值与理论蛋白浓度用不同方程拟合。标准曲线X轴为理论蛋白浓度,Y轴为对应的消光值,各稀释度回收率%=(回算值/理论值)*100、各稀释品消光值的CV、曲线的相关系数R
最佳拟合曲线方程的可接受标准为:各稀释度的回收率在100±15%之间,R
将供试品稀释到该方法确定的线性范围,将消光值值代入方程计算,检测结果CV<10%,取不同稀释度均值作为供试品的最终蛋白浓度。
A280结果显示,C1-INH对照品的蛋白浓度在0.214~5.35mg/ml之间时,其A280值在0.1~1.2之间。
表1结果显示,
若按照四参数方程进行线性拟合,则其线性范围在0.214~5.35mg/ml,R
若按照二次方程和双对数方程拟合,则其线性范围在0.214~3.567mg/ml,R
若按照一次函数进行线性拟合,则其线性范围在0.357mg/ml~2.14mg/ml,R
虽然四参数方程满足要求的线性范围最广,但是实际计算过程复杂,故舍去;
虽然一次函数的实际计算过程最简单,但是线性范围较窄,故舍去;
表1、用不同函数拟合标准曲线的结果
*该区间回收率在最高浓度时超过上限,实际可用范围在0.214~3.567mg/ml。
确定了双对数拟合方式后,我们对标准曲线的12个浓度分别进行了原始值(未减去空白对照)和消光值(吸光度差值)的双对数拟合,从各个浓度的回收率来看,用原始值拟合的回收率在92.264%~103.907%,R
表2、用原始值和消光值对标准曲线进行双对数拟合的结果比较
1.2、定量检测方法的验证
初步确定线性范围和拟合方式后验证该方法,将对照品用注射用水进行3倍稀释后作为浓度起点,随后进行2倍分步稀释,共5个蛋白浓度:3.567mg/ml(3倍稀释)、1.783mg/ml(6倍稀释)、0.892mg/ml(12倍稀释)、0.446mg/ml(24倍稀释)、0.223mg/ml(48倍稀释),此为标准品系列;
同时将对照品用WFI分别稀释4倍、15倍、40倍和50倍,对应为高(2.675mg/ml)、中(0.713mg/ml)、低(0.268mg/ml)3个质控品及最低检出限(0.214mg/ml)。
以上每个浓度平行测6次,取均值进行双对数拟合获得标准曲线及方程,计算标准品及质控品的蛋白含量的CV及回收率。
该过程重复3次。比较不同实验批次的标准曲线斜率和截距,确定线性范围和重复性。
准确度接受标准:批内和批间的蛋白含量回收率=(实测值/理论值)*100为100±15%;
精密度接受标准:批内和批间的蛋白含量CV均≤10%。
质控品和最低检测限的精密度和准确度结果见表3和表4,结果显示回收率均在100±6%以内,CV均在3%之内,说明分别使用原始值和消光值进行双对数拟合的方程均成立。3次原始值拟合标准曲线的重复性比较见图1,消光值拟合标准曲线的重复性比较见图2,可见三次实验的标准曲线几乎重合,说明其稳定性和重复性很好。
表3、原始值方程计算的精密度和准确度验证的结果汇总
表4、消光值方程计算的精密度和准确度验证的结果汇总
1.3、经验公式的确定
将三次线性范围验证的标准曲线的各个浓度的A280取均值,再次用双对数拟合获得方程如下:
原始均值方程:LgY=-0.382+0.764LgX,R
消光均值方程:LgY=-0.441+0.872LgX,R
由于使用消光值方程需要使用不同基质液稀释标准品消去空白对照后重新进行标准曲线的拟合,不利于快速在线检测,因此我们使用准确度更高的原始值拟合方程来进行经验公式的摸索。对含目标蛋白的多种基质液进行了A280检测,并用原始值公式进行了蛋白浓度计算;结果显示含有不同盐离子浓度以及氨基酸成分的基质液的A280值在0.038~0.051范围内,按照原始均值方程计算,对应的蛋白浓度在0.044mg/ml~0.064mg/ml之间,均值为0.05mg/ml;因此可以直接将待检样品的A280原始值(Y值)带入原始均值方程LgY=-0.382+0.764LgX计算蛋白浓度X(未调整值),X结果减去基质液的蛋白浓度均值0.05mg/ml再乘以稀释倍数即可得到相应的待检样品的蛋白浓度,即经验公式:
蛋白浓度X={10^[(LgY+0.382)/0.764]-0.05}×稀释倍数
同时我们还进行了样品添加实验进行准确度的再次验证,来验证经验公式适用于不同基质液的样品检测,即只需要检测样品的原始吸光值,通过经验公式计算即可获得准确的蛋白浓度,而不必重新制作标准曲线。采用上述蛋白浓度经验公式,避免了用不同基质液溶解对照品来作标准曲线来计算。
具体方法如下:
我们将对照品用不同基质液稀释10倍,检测其原始吸光值,用原始均值和消光均值方程及经验公式进行蛋白浓度和回收率的计算,结果显示按照经验公式计算的蛋白浓度,其回收率在96.636%~109.533%,优于原始均值和消光均值方程(含有氨基酸的基质液的样品配方3回收率超出85%~115%),符合准确度验证要求,结果见表5。
表5不同基质液及对应的标准品添加实验的结果汇总
实施例2、实际样品的检测及验证
2.1、A280法经验公式用于不同批次不同纯化阶段样品的检测,并与凯氏定氮法结果比较
结果显示改良的A280法检测用经验公式计算的结果与凯氏定氮法结果一致性好,样品2~7A280/凯氏定氮的系数值在0.93~1.04之间。样品1为初纯样品,由于该样品的纯度低于85%,故A280/凯氏定氮的系数值较高。因此A280的快速定量的经验公式适用于纯度高于85%的精纯阶段的C1-INH蛋白质含量计算,用于指导工艺研究的开发。具体结果见表6。
表6A280法与凯氏定氮法的检测结果比较
2.2A280法经验公式用于工艺精纯阶段样品的蛋白含量检测:
对精纯阶段关键样品进行不同方程的蛋白含量计算,比较不同稀释度所得结果的准确性。A280法用于过程关键样品的快速检测结果见表7。其中纳滤样品的凯氏定氮结果为10.6mg/ml,该样品的原始值公式计算结果均值为11.4445mg/ml;消光均值公式计算结果为11.960mg/ml;经验公式计算结果为10.695mg/ml,经验公式计算的蛋白含量结果均值与凯氏定氮法检测结果最接近,原始均值公式和消光均值公式计算的蛋白浓度偏高。同时由于成品配方中所含氨基酸对A280法检测结果的影响很小,在没有建立检测含氨基酸的凯氏定氮法(三氯醋酸法,蛋白含量=总氮-非蛋白氮)的情况下,可以用A280法经验公式初步获得半成品、成品的蛋白含量,这就更加凸显了A280法经验公式的重要性。
表7工艺过程样品的蛋白含量检测
最后需要说明的是,以上实施例仅用于帮助本领域技术人员理解本发明的实质,不用于限定本发明的保护范围。
