自分泌运动因子在判定卵泡发育程度中的应用
文献发布时间:2023-06-19 19:30:30
【技术领域】
本发明涉及生殖医学技术领域,具体涉及自分泌运动因子在判定卵泡发育程度中的应用。
【背景技术】
临床上现阶段对卵泡发育程度的监测一般通过B超和性激素检测。B超监测卵泡直径、卵泡数目等;性激素检测包括雌二醇(Estradiol,E2)、促黄体生成素(Luteinizinghormone,LH)、孕酮(Progesterone,P)等。同时,再参考抗缪勒管激素(anti-Mullerianhormone,AMH)和窦卵泡数(antral follicle count,AFC)等指标,用于判定卵泡发育程度。然而,卵泡发育的判定多依赖医生以往经验,不同患者性激素水平标准不同,B超数据也存在主观性。目前,仍缺少一种客观、统一、快速的判定卵泡发育程度的新方法。
在正常的女性生理周期中,刚来月经时卵巢内为始基卵泡,之后逐渐增大形成窦卵泡,一般直径为2-9mm。随着雌孕激素的分泌,卵泡腔逐渐增大并饱含卵泡液,卵母细胞周围包绕着多层颗粒细胞。在卵泡发育的最后阶段,卵泡液急骤增加,卵泡腔增大,直径可达18-23mm,称之为成熟卵泡;成熟卵泡破裂,即排出成熟卵子。在临床促排卵治疗中,由直径小的卵泡中取出的卵子成熟度、发育潜能低于直径大的卵泡卵子。在卵泡形成过程中,血浆蛋白通透性不断增加,使得血浆蛋白跨过血-卵屏障,与卵泡周围的颗粒细胞、卵母细胞及卵泡膜细胞的分泌物共同构成卵泡液。因此,卵泡液的成分与血浆、血清非常类似。有文献报道,血清脂肪酸、维生素D、补体C5a等均与卵泡液表达水平相关联。
自分泌运动因子(autotaxin,ATX)可以通过水解溶血磷脂酰胆碱生成溶血磷脂酸(lysophosphatidic acid,LPA)。溶血磷脂酸可促进小鼠卵丘颗粒细胞扩张,从而促进卵母细胞激活以及卵泡成熟,而其作用由自分泌运动因子引导发生。
本专利拟通过研究卵泡监测期间自分泌运动因子的血清浓度与卵泡发育程度的关联性,建立以自分泌运动因子血清浓度为参考的卵泡发育程度判定模型,并通过外部验证明确该模型的敏感度与特异性,以求评估其在临床应用的可能性。
【发明内容】
本发明的发明目的在于:针对上述存在的问题,提供自分泌运动因子在判定卵泡发育程度中的应用,具有更加准确的反应卵泡的成熟状态。
本发明的目的之一是提供:自分泌运动因子在判定卵泡发育程度中的应用。
本发明的目的之二是提供:一种评价卵泡发育程度的方法,
具体步骤如下:
(1)检测血清自分泌运动因子浓度值、雌二醇浓度值、窦卵泡个数;
(2)根据模型将检测的数据带入计算;
所述模型是:
模型1:Z1=-1.1786+0.0430×(血清自分泌运动因子浓度值/窦卵泡个数),确定Z1值;
模型2:Z2=-0.9799+0.0418×(血清自分泌运动因子浓度值/窦卵泡个数)-0.2787×(血清自分泌运动因子浓度值/血清雌二醇浓度值),确定Z2值;
(3)确定卵泡发育程度,
当模型1的Z1值>0.419时,判定当前卵泡为成熟;当模型1的Z1值≤0.419,判定当前卵泡为不成熟;
当模型2的Z2值>0.432时,判定当前卵泡为成熟;当模型2的Z2值≤0.432,判定当前卵泡为不成熟。
进一步说明,所述血清自分泌运动因子浓度是由以下操作得到:自分泌运动因子标准品设置2000ng/mL、750ng/mL、375ng/mL、125ng/mL、25ng/mL、0ng/mL 6个浓度;室温平衡30min后,将标准品和待检血清50μL分别加入包被抗自分泌运动因子抗体的酶标板中;然后,立即加入1:10新稀释的50μL酶结合液。敷上酶标板贴纸,置37℃孵育1小时;甩干板内液体,洗涤液洗涤3次,每孔300μL,每次2min;依次加入50μL过氧化氢和50μL四甲基联苯胺(TMB)显色液,显色10min。最后加入50μL终止液(硫酸),采用sunrise酶标仪于450nm波长下读数,记录OD值;根据标准曲线换算获得各样本自分泌运动因子浓度值。
进一步说明,所述雌二醇浓度值是由以下操作得到:检测设备为美国贝克曼库尔特公司DxI800全自动化学发光免疫测定分析系统,检测前用Access EstradiolCalibrators标准品校准;将血清样本添加到含包被着山羊抗兔-兔抗雌二醇的顺磁性颗粒和TRIS缓冲液的反应管中;20min后,添加雌二醇碱性磷酸酶结合物;温育后,将化学发光底物Lumi-Phos 530添加到反应管中,根据照度计进行光测量,换算获得血清雌二醇浓度值。
进一步说明,所述窦卵泡个数是由以下操作得到:在月经周期的第2-5天,做妇科阴道B超检查,记录卵泡直径在2-9mm的可募集的窦卵泡数,卵巢左右两侧均记录。
本发明的目的之三是提供:一种指示卵泡成熟的血清蛋白质,所述血清蛋白为自分泌运动因子。
和现有技术相比,本发明具有如下优点:
血清标志物的检测是一项非主观、高效、定量的判定卵泡发育程度的新方法。具体是通过检测血清自分泌运动因子浓度、雌二醇浓度、窦卵泡数值然后分别带入Z1、Z2模型中,通过模型指标值判定卵泡发育程度,并通过外部验证明确该模型的敏感度与特异性,实际证明其在临床应用中的可行性,这是一种辅以临床现行监测数据,更加准确的反应卵泡成熟状态的新方法。另外检测的数据易得,计算方法简单,操作可行性极高,具有很大的推广价值。
【附图说明】
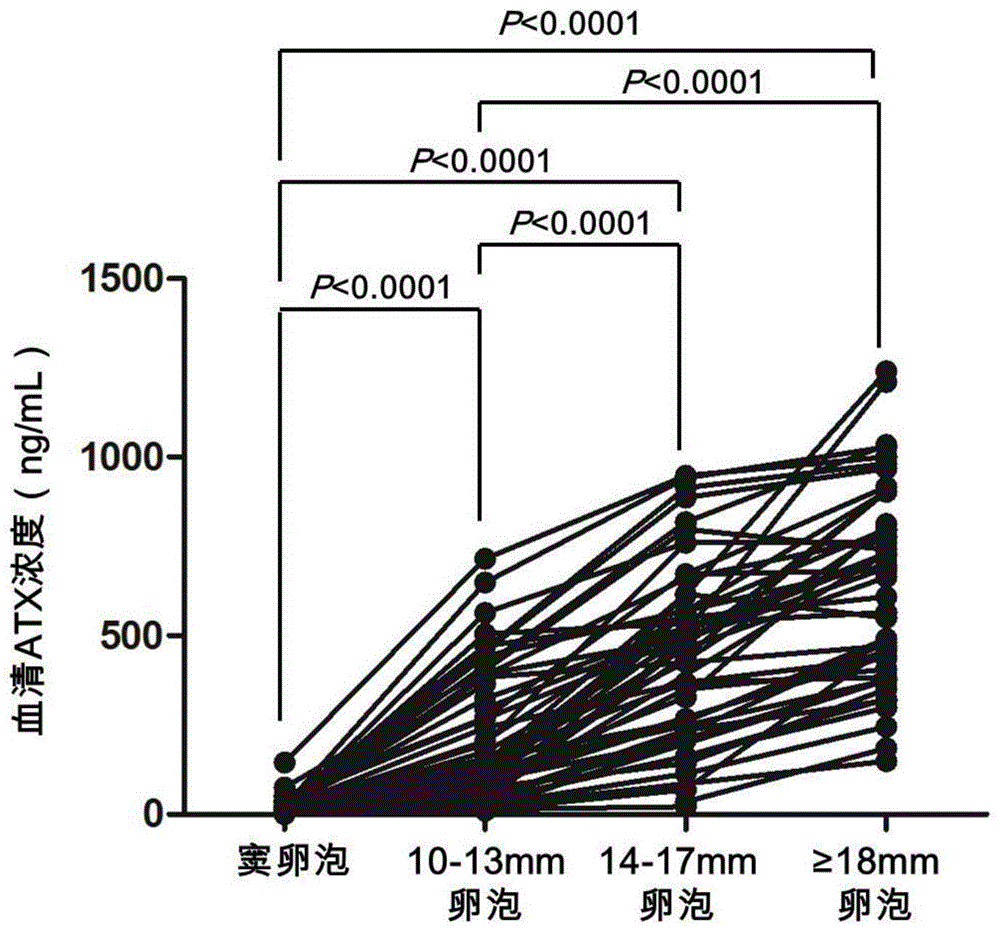
图1是本发明实验例中不同卵泡发育阶段血清ATX浓度图。
【具体实施方式】
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
实验例:
1对象和方法
1.1研究对象的纳入
本研究收集年龄在20-50周岁,月经规律,周期28-32天,基础内分泌正常,无内分泌/免疫和代谢性疾病,无肺结核/肝肾疾病,无吸烟酗酒史,术前3个月内未接受激素治疗,由于男方因素接受辅助生殖技术助孕(例如体外受精:in vitro fertilization,IVF;卵胞浆内单精子显微注射:intracytoplasmic sperm injection,ICSI)的病例。
2022年03月至2022年09月期间,收集IVF患者卵泡监测期间血清,根据B超监测结果分为窦卵泡组、10-13mm卵泡组、14-17mm卵泡组和≥18mm卵泡(成熟)组(训练组,48例,平均31.29±3.74岁)。另外,随机收集卵泡未成熟/成熟患者血清(验证组,42例,平均33.88±6.36岁)。
血清留取如下,所有参加者血样采用一次性真空不抗凝采血管,采集外周血3.0mL,4小时内离心(3000r/min,10min,4℃),吸上清后分装成各500μL,保存于-80℃冰箱。同时,收集患者临床资料、检测指标,病例采纳后分组编号,建立完整系统的病例数据库。临床数据包括年龄、AMH、AFC、卵泡检测期间血清E2、P、LH、B超监测数值等。
1.2酶联免疫实验
实验采用人ENPP2(ATX)ELISA试剂盒(CSB-EL007680HU;武汉华美)。ATX标准品由试剂盒提供,为2000ng/mL、750ng/mL、375ng/mL、125ng/mL、25ng/mL、0ng/mL 6个浓度。室温平衡30min后,将标准品和待检血清50μL(血清样本不稀释)分别加入包被抗ATX抗体的酶标板中。然后,加入1:10新稀释的50μL酶结合液。敷上酶标板贴纸,置37℃孵育1小时。甩干板内液体,洗涤液洗涤3次,每孔300μL,每次2min。依次加入50μL过氧化氢和50μL四甲基联苯胺(TMB)显色液,显色10min。最后加入50μL终止液(硫酸),采用sunrise酶标仪于450nm波长下读数,记录OD值。根据标准曲线换算获得各样本自分泌运动因子浓度值。
1.3抗缪勒管激素(AMH)检测
检测设备为罗氏Cobas e411电化学发光免疫分析仪,试剂为罗氏AMH检测试剂盒。检测前使用罗氏Calibrators进行校准,质控物为Perci Control AMH。室温平衡30min后,加入50μL血清样本、生物素化的抗AMH单克隆抗体、钌复合物标记的抗-AMH单克隆抗体反应形成抗原抗体夹心复合物;再加入包被包被链霉亲和素的磁珠微粒。将反应液吸入测量池中,给电极加以一定电压,使复合物发光并测量。根据发光强度,换算获得AMH值。
1.4性激素水平检测
检测设备为美国贝克曼库尔特公司DxI800全自动化学发光免疫测定分析系统,质控物由BIO-RAD公司提供。室温平衡30min后,进行检测。雌二醇E2检测:检测前用AccessEstradiol Calibrators标准品校准。将血清样本添加到含包被着山羊抗兔-兔抗雌二醇的顺磁性颗粒和TRIS缓冲液的反应管中。20min后,添加雌二醇碱性磷酸酶结合物。温育后,将化学发光底物Lumi-Phos 530添加到反应管中,根据照度计进行光测量,换算获得E2值。孕酮P检测:检测前用Access Progesterone Calibrators标准品校准。将血清样本添加到含兔抗孕酮抗体、孕酮碱性磷酸酶结合物以及包被着山羊抗兔捕获抗体的顺磁性颗粒的反应管中。温育后,将化学发光底物Lumi-Phos 530添加到反应管中,根据照度计进行光测量,换算获得P值。促黄体生成素LH检测:检测前用Access hLH Calibrators标准品校准。将样本和包被着山羊抗小鼠-小鼠抗hLH复合物的顺磁性颗粒和含蛋白质的TRIS缓冲液添加至反应管中。进行2次分离与清洗,将化学发光底物Lumi-Phos 530添加到反应管中,根据照度计进行光测量,换算获得LH值。
1.5 B超监测
在月经周期的第2-5天,做妇科阴道B超检查,记录卵泡直径在2-9mm的可募集的窦卵泡数,卵巢左右两侧均记录,获取窦卵泡数(AFC)。促排期间B超监测,记录B超监测日卵泡直径及数目。
1.6数据处理与分析
采用SPSS 16.0统计软件,P<0.05为差异有统计学意义。年龄以均数±标准差表示。采用Kruskal-Wallis检验分析多组间ATX表达差异,采用Dunn多重比较检验两组间ATX浓度值差异。采用Spearman相关分析明确ATX浓度及临床指标间的相关性。进一步通过Fisher判别建立血清ATX判别卵泡发育程度的模型,并进行内部和外部验证,获得模型的灵敏度和特异性。
2结果:
2.1血清ATX浓度与卵泡发育程度的相关性
我们收集了48例IVF患者卵泡监测期间血清,并根据B超监测结果分为窦卵泡组、10-13mm卵泡组、14-17mm卵泡组和≥18mm卵泡(成熟)组(平均31.29±3.74岁)。通过酶联免疫检测了ATX浓度。结果发现,血清ATX浓度在卵泡发育过程中存在显著改变(四组比较,P<0.0001),且各组间血清ATX浓度也存在显著差异(图1)。
2.2血清ATX浓度与临床指标的相关性
卵泡监测期间,血清E2、P、LH及B超结果是用于判定卵泡发育程度的重要指标。我们对48例患者181次监测的临床资料和血清ATX浓度进行了相关性分析,结果发现血清ATX与B超监测下卵泡直径、卵泡数目、性激素检查中的E2、LH、P等均存在显著相关性(均P<0.0001),且其与卵泡直径和E2存在重度相关(r
表1血清ATX浓度与临床检测指标的相关性
备注:
2.3建立Fisher判别模型
采用SPSS实现Fisher线性判别分类,将窦卵泡组、10-13mm卵泡组、14-17mm卵泡组设定为未成熟组,≥18mm卵泡组设定为成熟组,通过数据计算和分析,构建指示卵泡成熟的模型。同时,窦卵泡数为卵泡监测期间早期获得,并能评估最终卵泡数目的临床指标;E2为临床普遍应用的评价卵泡发育程度的指标,故加入模型辅助诊断:
模型1:Z1=-1.1786+0.0430×(血清ATX浓度值/窦卵泡个数)
当模型1 Z1>0.419判定为卵泡成熟,Z1≤0.419判定为卵泡为不成熟。模型1的正确率为77.90%,敏感度为72.50%,特异度为79.43%。内部验证(交叉验证)模型1的正确率为77.90%,敏感度为72.50%,特异度为79.43%。
模型2:Z2=-0.9799+0.0418×(血清ATX浓度值/窦卵泡个数)-0.2787×(血清ATX浓度值/血清E2浓度值)
当模型2 Z2>0.432判定为卵泡成熟,Z2≤0.432判定为卵泡为不成熟。模型2的正确率为78.45%,敏感度为75.00%,特异度为79.43%。内部验证(交叉验证)模型2的正确率为78.45%,敏感度为75.00%,特异度为79.43%。
2.4 Fisher判别模型的应用
采用建模以外的卵泡监测期间血清(卵泡未成熟血清8例,卵泡成熟血清34例,平均33.88±6.36岁)进行外部验证,将检测所得ATX浓度值、AFC、E2代入已构建的卵泡发育Fisher线性判别模型中,获得Z1、Z2值。
模型1判定结果的临床符合率为85.71%(36/42);模型2判定结果的临床符合率为88.10%(37/42)。表明血清ATX浓度指示卵泡发育程度具有较高的准确性,辅以现行临床指标准确性有所提高。各模型在临床应用时可根据本中心检测数据灵活选择,相互参照。
表2是本发明实验例验证组血清ATX浓度值及模型判定值
/>
上述说明是针对本发明较佳可行实施例的详细说明,但实施例并非用以限定本发明的专利申请范围,凡本发明所提示的技术精神下所完成的同等变化或修饰变更,均应属于本发明所涵盖专利范围。
