Leptin/Sirt5对BMP9诱导间充质干细胞成骨分化的影响
文献发布时间:2023-06-19 19:40:14
技术领域
本发明属于生物细胞技术领域,具体的说是Leptin/Sirt5对BMP9诱导间充质干细胞成骨分化的影响。
背景技术
BMP9是骨形态发生蛋白(BMP)家族的一员,在间充质干细胞(MSCs)中BMP9比BMP7或BMP2具有更大的成骨诱导潜能。BMP9可通过经典BMP/Smad通路和非经典BMP/Smad通路促进MSCs成骨分化,如Wnt/β-catenin和PI3K/Akt信号通路。其中,Wnt/β-catenin信号对成骨至关重要可在干细胞分化的早期被激活,但在成骨细胞成熟阶段被抑制[4]。Wnt/β-catenin活性可受多种因素调控,如Wnt配体、Wnt抑制因子1(Wif1)、Dickkopf 1(Dkk1)、骨硬化蛋白(SOST)等。此外,β-catenin还可以通过翻译后修饰进行调节,如β-catenin的磷酸化和乙酰化。在诱导前体细胞向成骨细胞分化时,BMP9可激活Wnt/β-catenin信号通路。但BMP9如何激活Wnt/β-catenin信号尚未完全阐明。
瘦素(Leptin)是由167个氨基酸组成的多肽,主要表达于白色脂肪组织、骨髓等组织。这种多肽最初是在遗传肥胖的大鼠身上发现的,Leptin在血浆中与其受体结合调节摄食和能量平衡,在调节体内能量代谢中发挥关键作用[8,9]。先前的研究表明,高水平的葡萄糖或Leptin通过促进丙二酰辅酶a的分泌来抑制糖酵解过程,丙二酰辅酶a是葡萄糖代谢的负反馈调节因子,通过促进糖酵解途径的关键调节因子丙二酰化来实现。在骨重建过程中,瘦素可以通过抑制成骨细胞增殖或通过增加NF-κB受体活化因子配体的表达来促进破骨细胞的吸收,从而调节骨形成与骨吸收之间的平衡。瘦素还通过下调c-myc和Cyclin D1[14]的表达抑制成骨细胞增殖。然而,其机制尚不明确。糖酵解是成骨分化过程中的主要能量来源,同时研究发现成骨关键通路Wnt/β-catenin可通过肝癌相关巨噬细胞激活糖酵解,促进上皮-间充质转化。瘦素可以通过促进丙二酰辅酶A的分泌来调节糖酵解过程。因此,瘦素可能通过修饰某些关键的成骨调节因子参与调控BMP9的成骨潜能。
Sirt5是一种NAD+依赖性蛋白脱酰基酶,定位于细胞质和线粒体,参与调节多种代谢途径。Sirt5可以通过去除靶点赖氨酸残基上的丙二酰化来调节糖酵解途径。丙二酰辅酶A是丙二酰化化合物的供体,可由丙二酰辅酶A脱羧酶代谢。丙二酰辅酶A通过促进关键靶点的丙二酰化来发挥代谢的负反馈调节作用。相反,Sirt5通过去甲基化恢复这些靶点的活性,从而正向调节代谢。Sirt5作为赖氨酸丙二酰化的全局调节因子,通过与丙二酰辅酶a维持内环境稳态在多种疾病中发挥重要作用。然而,Sirt5在成骨分化中的作用尚不清楚。
为了证明了瘦素对BMP9诱导的MSCs成骨分化的影响,并探讨Wnt/β-catenin和Sirt5是否参与这一过程,为此,本发明提供Leptin/Sirt5对BMP9诱导间充质干细胞成骨分化的影响。
发明内容
为了弥补现有技术的不足,解决上述至少一个问题,本发明提出的Leptin/Sirt5对BMP9诱导间充质干细胞成骨分化的影响。
本发明解决其技术问题所采用的技术方案是:本发明所述的Leptin/Sirt5对BMP9诱导间充质干细胞成骨分化的影响,该方法步骤如下所示:
S1:选用细胞培养,并对细胞进行重组腺病毒;
S2:建立大鼠去卵巢(OVX)模型,并通过ELISA法测量大鼠血清;
S3:提取选用细胞的 RNA,同时对cDNA制备,并对PCR、蛋白和Westernblot检测,同时对碱性磷酸酶(ALP)活性测定;
S4:小鼠颅骨缺损模型建立;
S5:液相色谱-串联质谱分析;
S6:共聚焦分析和免疫沉淀法,并记录统计数据。
优选的,所述S1的具体方法步骤如下所示:
选用细胞为贴壁培养的细胞HEK293、C3H10T1/2、3T3-L1和MC3T3-E1,同时将细胞在含有10%FBS、100 U/ml青霉素和100 μg/ml链霉素的杜尔贝科DMEM(High Glucose)培养基中培养,并置于37℃、5% CO2孵育箱中培养;并通过用AdEasy系统表达Leptin或LeptinsiRNA寡核苷酸的重组病毒,将重组腺病毒在HEK293细胞中包装,这些细胞被命名为AdBMP9、AdLeptin和AdsiLeptin;用绿色荧光蛋白(GFP)标记AdBMP9和AdLeptin,用红色荧光蛋白(RFP)标记AdsiLeptin;只表达单体RFP (AdRFP)或GFP (AdGFP)的腺病毒作为载体对照。
优选的,所述S2的具体方法步骤如下所示:
A1:选取雌性10只SD大鼠,随机分为OVA组和Sham组,将OVA组采用水合氯醛(4mg /kg)腹腔麻醉,俯卧位固定在手术台上,进行消毒,皮肤被放置在左大腿根部的上边缘,在背部中线处0.5 cm处开0.5 cm切口,用镊子沿腰大肌提起脂肪团的表面肌层,沿外侧边缘被切去约0.5 cm以找到左侧卵巢,摘除卵巢后,用5-0丝线结扎输卵管,右侧卵巢也通过同样的程序被切除;
A2:采用ELISA法测定OVX大鼠血清抗酒石酸酸性磷酸酶(TRACP)、骨钙素(OCN)和Leptin水平,用分光光度计(Varioskan 3020, Thermo Scientific)在450 nm处测量吸光度。
优选的,所述S3中提取选用细胞的 RNA,同时对cDNA制备的步骤如下所示:
B1:选用细胞经不同因素处理后,于24h、48后结束培养,弃培养基,用预冷的PBS清洗细胞两次,放置于冰上加入400μl TRIZOL裂解10min,用无酶枪头反复吹打,收集细胞裂解液于1.5mlEP管中,然后在EP管中加入200μl氯仿,缓慢颠倒混匀20秒,置于冰上等待5min, 4℃低温超速离心12000g,10min;
B2:取出EP管,用无酶枪头小心吸取上层液体大约400μl于另一EP管中,加入等体积异丙醇,颠倒混匀后静止10min,低温超速离心12000g,10min;
B3:弃上清液,加入75%乙醇(DEPC水配置)500μl,轻轻颠倒混匀3次,4℃低温离心7500g,5min,重复一次;
B4:缓慢匀速的将乙醇倒出,随后将空离20s,弃上清液,加入20μl DEPC水,测RNA浓度;
B5:逆转录,取5μl总RNA,2μl Reaction Buffer(5X), 0.5μl Oligo(dT) Primer,0.5μl Primer Script RT Enzyme Mix Ⅰ,2μl Random Hexamer Primer(100μM),总共10μl的体系,PCR反应程序:先在 37℃下,加热15min,在缓慢将温度升至85 37℃,,保持5s,倒入ddH2O定容至100μl,放置于-20℃保存。
优选的,所述S3中对PCR、蛋白和Western blot检测,同时对碱性磷酸酶(ALP)活性测定的方法步骤如下所示:
C1:取出3μl的cDNA与6μl SYBR Green和引物的混合物混匀, 配成9μl的PCR体系,放置实时荧光定量PCR仪中,反应程序:95℃、3min, 95℃、20s,66℃、10s, 循环3次;95℃ 、10s,55℃、 15s,70℃、1s,总共循环39次,65℃-95℃溶解分析,目的基因mRNA水平与β-actin的表达矫正归一化;
C2:将细胞接种于中,按照实验设计用试剂处理,在结束时间点,丢弃培养液,用冷磷酸盐缓冲盐水(PBS)冲洗细胞,将6孔板置于冰上,每孔加入300 μl的放射免疫沉淀(RIPA)裂解缓冲液(QS0006, Saimike, China Chongqing)5分钟,将裂解液收集到1.5 mlEP管中,4℃离心10分钟(12000 g),再将上清转移到新的1.5 ml EP管中,加入75 μl的加载缓冲液;
C3:混合物煮沸10分钟使其变性,用十二烷基硫酸钠聚丙烯酰胺凝胶分离蛋白,转移到PVDF膜上,用5%牛血清白蛋白阻塞90分钟,然后用tris缓冲盐水和Tween 20(TBST)冲洗膜3次,与一抗在4℃孵育过夜,再用TBST冲洗膜3次,并用辣根过氧化物酶(HRP)偶联二抗体孵育,数据由ChemiScope6200凝胶成像仪收集,使用ImageJ软件对数据进行量化;
C4:将细胞接种于24孔板中,按照实验设计用试剂处理,5或7天后,按照碱性磷酸酶试剂盒的说明进行组织化学染色,再用PBS轻轻清洗盘子并风干,用显微镜拍摄图像,用ImageJ软件对平板进行扫描和量化。
优选的,所述S4的具体方法步骤如下所示:
D1:将小鼠头盖骨手术部位的毛发拔掉,用一个直径3毫米的环钻小心翼翼地在头盖骨上钻了一个洞,然后根据实验设计,用AdGFP、AdBMP9、AdBMP9+AdLeptin或AdsiLeptin、AdBMP9+AdLeptin+Adβ-catenin、AdBMP9+AdsiLeptin+Adsiβ-catenin预处理C3H10T1/2细胞填充孔;
D2:8周后,所有小鼠安乐死,取出颅骨并用福尔马林固定,用于后续影像学评估;
D3:采用VivaCT 40μ-CT系统对颅骨缺损修复标本进行扫描,对原始数据进行进一步分析,并利用μ-CT 516.1软件进行三维重建。
优选的,所述S5的具体方法步骤如下所示:
E1:将富集的赖氨酸-丙二酰化多肽溶于溶剂A(0.1%FA,2%ACN)中,加载到自制的反相预柱(75μm ID×4 cm长,5μm粒径)上,溶剂B(0.1%甲酸,98%乙腈)在开始的26分钟内梯度从6%增加到23%,8分钟从23增加到35%,3分钟内增加到80%,然后在最后3分钟保持在80%;在EASY-nLC 1000 UPLC系统中,所有的梯度变化都是在恒定流速为400 nl/min的情况下进行的
E2:样品被置于NanoSpray电离源中,随后在Q Exactive
优选的,所述S6中共聚焦分析的方法步骤如下所示:
F1:将C3H10T1/2细胞置于激光共聚焦细胞培养皿中,分别用AdGFP、AdBMP9、AdLeptin、AdsiLeptin、AdBMP9和AdLeptin、AdBMP9和AdsiLeptin、siSirt5或AdBMP9和siSirt5处理,24 h后,用冷PBS(4℃)洗涤细胞,4%多聚甲醛固定15 min, PBS洗涤,0.3%Triton X-100处理20 min,再用冷PBS洗涤,4℃山羊血清阻塞1小时。
F2:细胞与抗β-catenin一抗4℃孵育过夜,细胞用冷PBS洗涤2次,用DyLight 594标记的荧光二抗孵育30分钟,用冷PBS洗涤2次,最后用二氨基苯基吲哚(DAPI)孵育细胞5min,然后用冷PBS洗涤两次,图像采用共聚焦显微镜拍摄。
优选的,所述S6中免疫沉淀法的方法步骤如下所示:
G1:细胞接种于6孔板中,按实验设计处理,30小时后,用PBS(4℃)清洗细胞,用RIPA裂解缓冲液处理细胞,其中含有蛋白酶和磷酸酶抑制剂;
G2:蛋白G磁珠先用RIPA裂解缓冲液进行预处理,随后裂解液用这些磁珠进行处理,防止蛋白与磁珠非特异性结合,裂解物与β-catenin、赖氨酸丙二酰化、Sirt5或兔IgG抗体在4℃孵育过夜,然后与蛋白G磁珠孵育;
G3:用RIPA裂解缓冲液仔细洗涤磁珠,收集的RIPA裂解缓冲液煮沸10分钟,将磁珠粒中洗脱出的蛋白质变形,最后对样品进行标准Western blot检测。
本发明的有益效果如下:
1.本发明所述的Leptin/Sirt5对BMP9诱导间充质干细胞成骨分化的影响,在C3H10T1/2细胞中,外源性敲低Leptin的表达可以增强BMP9所诱导的RUNX2、OPN、 ALP活性和基质矿化水平,而过表达Leptin则抑制。实验结果发现,Leptin敲低可以促进β-catenin的蛋白水平,并且对p-β-catenin没有影响。通过使用Adsiβ-catenin病毒与AdsiLeptin及AdBMP9联合使用处理细胞时,沉默Leptin对BMP9诱导RUNX2和ALP活性的增加作用可被部分逆转。在体内实验结果显示,Leptin敲低可以增强BMP9诱导颅骨缺损的面积和骨密度。通过质谱分析发现β-cateni可能存在赖氨酸丙二酰化修饰,同时这种修饰是由Leptin通过Sirt5,是赖氨酸丙二酰化全局调控因子,来调控。
附图说明
下面结合附图对本发明作进一步说明。
图1是大鼠血清Leptin水平的影响示意图;
图2是 Leptin在多种细胞系中的表达示意图;
图3是BMP9下调C3H10T1/2细胞中Leptin的mRNA和蛋白水平示意图;
图4是 Leptin对BMP9诱导成骨的经典通路蛋白Smad的关系示意图;
图5是Leptin对BMP9诱导C3H10T1/2细胞成骨分化中成骨指标的影响示意图;
图6是Leptin对BMP9诱导C3H10T1/2细胞β-catenin的影响示意图;
图7是Leptin对BMP9诱导Wnt/β-catenin通路下游靶点c-Myc的影响示意图;
图8是β-连环蛋白和/或Leptin对C3H10T1/2细胞中bmp9诱导的成骨标志物的影响示意图;
图9是Leptin和/或β-连环蛋白对bmp - 9诱导骨缺损修复的影响示意图;
图10是BMP9对C3H10T1/2细胞中β-catenin赖氨酸丙二醛化的影响示意图;
图11是Sirt5对Leptin诱导的β-连环蛋白丙二酰修饰的影响示意图;
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施方式,进一步阐述本发明。
本发明所述的Leptin/Sirt5对BMP9诱导间充质干细胞成骨分化的影响,该方法步骤如下所示:
S1:选用细胞培养,并对细胞进行重组腺病毒;
S2:建立大鼠去卵巢(OVX)模型,并通过ELISA法测量大鼠血清;
S3:提取选用细胞的 RNA,同时对cDNA制备,并对PCR、蛋白和Westernblot检测,同时对碱性磷酸酶(ALP)活性测定;
S4:小鼠颅骨缺损模型建立;
S5:液相色谱-串联质谱分析;
S6:共聚焦分析和免疫沉淀法,并记录统计数据。
优选的,所述S1的具体方法步骤如下所示:
选用细胞为贴壁培养的细胞HEK293、C3H10T1/2、3T3-L1和MC3T3-E1,同时将细胞在含有10%FBS、100 U/ml青霉素和100 μg/ml链霉素的杜尔贝科DMEM(High Glucose)培养基中培养,并置于37℃、5% CO2孵育箱中培养;并通过用AdEasy系统表达Leptin或LeptinsiRNA寡核苷酸的重组病毒,将重组腺病毒在HEK293细胞中包装,这些细胞被命名为AdBMP9、AdLeptin和AdsiLeptin;用绿色荧光蛋白(GFP)标记AdBMP9和AdLeptin,用红色荧光蛋白(RFP)标记AdsiLeptin;只表达单体RFP (AdRFP)或GFP (AdGFP)的腺病毒作为载体对照。
所述S2的具体方法步骤如下所示:
A1:选取雌性10只SD大鼠,随机分为OVA组和Sham组,将OVA组采用水合氯醛(4mg /kg)腹腔麻醉,俯卧位固定在手术台上,进行消毒,皮肤被放置在左大腿根部的上边缘,在背部中线处0.5 cm处开0.5 cm切口,用镊子沿腰大肌提起脂肪团的表面肌层,沿外侧边缘被切去约0.5 cm以找到左侧卵巢,摘除卵巢后,用5-0丝线结扎输卵管,右侧卵巢也通过同样的程序被切除;
A2:采用ELISA法测定OVX大鼠血清抗酒石酸酸性磷酸酶(TRACP)、骨钙素(OCN)和Leptin水平,用分光光度计(Varioskan 3020, Thermo Scientific)在450 nm处测量吸光度。
所述S3中提取选用细胞的 RNA,同时对cDNA制备的步骤如下所示:
B1:选用细胞经不同因素处理后,于24h、48后结束培养,弃培养基,用预冷的PBS清洗细胞两次,放置于冰上加入400μl TRIZOL裂解10min,用无酶枪头反复吹打,收集细胞裂解液于1.5mlEP管中,然后在EP管中加入200μl氯仿,缓慢颠倒混匀20秒,置于冰上等待5min, 4℃低温超速离心12000g,10min;
B2:取出EP管,用无酶枪头小心吸取上层液体大约400μl于另一EP管中,加入等体积异丙醇,颠倒混匀后静止10min,低温超速离心12000g,10min;
B3:弃上清液,加入75%乙醇(DEPC水配置)500μl,轻轻颠倒混匀3次,4℃低温离心7500g,5min,重复一次;
B4:缓慢匀速的将乙醇倒出,随后将空离20s,弃上清液,加入20μl DEPC水,测RNA浓度;
B5:逆转录,取5μl总RNA,2μl Reaction Buffer(5X), 0.5μl Oligo(dT) Primer,0.5μl Primer Script RT Enzyme Mix Ⅰ,2μl Random Hexamer Primer(100μM),总共10μl的体系,PCR反应程序:先在 37℃下,加热15min,在缓慢将温度升至85 37℃,,保持5s,倒入ddH2O定容至100μl,放置于-20℃保存。
所述S3中对PCR、蛋白和Western blot检测,同时对碱性磷酸酶(ALP)活性测定的方法步骤如下所示:
C1:取出3μl的cDNA与6μl SYBR Green和引物的混合物混匀, 配成9μl的PCR体系,放置实时荧光定量PCR仪中,反应程序:95℃、3min,95℃、20s,66℃、10s,循环3次;95℃、10s,55℃、15s,70℃、1s,总共循环39次,65℃-95℃溶解分析,目的基因mRNA水平与β-actin的表达矫正归一化;
C2:将细胞接种于中,按照实验设计用试剂处理,在结束时间点,丢弃培养液,用冷磷酸盐缓冲盐水(PBS)冲洗细胞,将6孔板置于冰上,每孔加入300μl的放射免疫沉淀(RIPA)裂解缓冲液(QS0006,Saimike,China Chongqing)5分钟,将裂解液收集到1.5ml EP管中,4℃离心10分钟(12000g),再将上清转移到新的1.5ml EP管中,加入75μl的加载缓冲液;
C3:混合物煮沸10分钟使其变性,用十二烷基硫酸钠聚丙烯酰胺凝胶分离蛋白,转移到PVDF膜上,用5%牛血清白蛋白阻塞90分钟,然后用tris缓冲盐水和Tween 20(TBST)冲洗膜3次,与一抗在4℃孵育过夜,再用TBST冲洗膜3次,并用辣根过氧化物酶(HRP)偶联二抗体孵育,数据由ChemiScope6200凝胶成像仪收集,使用ImageJ软件对数据进行量化;
C4:将细胞接种于24孔板中,按照实验设计用试剂处理,5或7天后,按照碱性磷酸酶试剂盒的说明进行组织化学染色,再用PBS轻轻清洗盘子并风干,用显微镜拍摄图像,用ImageJ软件对平板进行扫描和量化。
所述S4的具体方法步骤如下所示:
D1:将小鼠头盖骨手术部位的毛发拔掉,用一个直径3毫米的环钻小心翼翼地在头盖骨上钻了一个洞,然后根据实验设计,用AdGFP、AdBMP9、AdBMP9+AdLeptin或AdsiLeptin、AdBMP9+AdLeptin+Adβ-catenin、AdBMP9+AdsiLeptin+Adsiβ-catenin预处理C3H10T1/2细胞填充孔;
D2:8周后,所有小鼠安乐死,取出颅骨并用福尔马林固定,用于后续影像学评估;
D3:采用VivaCT 40μ-CT系统对颅骨缺损修复标本进行扫描,对原始数据进行进一步分析,并利用μ-CT 516.1软件进行三维重建。
所述S5的具体方法步骤如下所示:
E1:将富集的赖氨酸-丙二酰化多肽溶于溶剂A(0.1%FA,2%ACN)中,加载到自制的反相预柱(75μm ID×4cm长,5μm粒径)上,溶剂B(0.1%甲酸,98%乙腈)在开始的26分钟内梯度从6%增加到23%,8分钟从23增加到35%,3分钟内增加到80%,然后在最后3分钟保持在80%;在EASY-nLC 1000 UPLC系统中,所有的梯度变化都是在恒定流速为400nl/min的情况下进行的
E2:样品被置于NanoSpray电离源中,随后在Q Exactive
所述S6中共聚焦分析的方法步骤如下所示:
F1:将C3H10T1/2细胞置于激光共聚焦细胞培养皿中,分别用AdGFP、AdBMP9、AdLeptin、AdsiLeptin、AdBMP9和AdLeptin、AdBMP9和AdsiLeptin、siSirt5或AdBMP9和siSirt5处理,24h后,用冷PBS(4℃)洗涤细胞,4%多聚甲醛固定15min,PBS洗涤,0.3%Triton X-100处理20min,再用冷PBS洗涤,4℃山羊血清阻塞1小时。
F2:细胞与抗β-catenin一抗4℃孵育过夜,细胞用冷PBS洗涤2次,用DyLight 594标记的荧光二抗孵育30分钟,用冷PBS洗涤2次,最后用二氨基苯基吲哚(DAPI)孵育细胞5min,然后用冷PBS洗涤两次,图像采用共聚焦显微镜拍摄。
所述S6中免疫沉淀法的方法步骤如下所示:
G1:细胞接种于6孔板中,按实验设计处理,30小时后,用PBS(4℃)清洗细胞,用RIPA裂解缓冲液处理细胞,其中含有蛋白酶和磷酸酶抑制剂;
G2:蛋白G磁珠先用RIPA裂解缓冲液进行预处理,随后裂解液用这些磁珠进行处理,防止蛋白与磁珠非特异性结合,裂解物与β-catenin、赖氨酸丙二酰化、Sirt5或兔IgG抗体在4℃孵育过夜,然后与蛋白G磁珠孵育;
G3:用RIPA裂解缓冲液仔细洗涤磁珠,收集的RIPA裂解缓冲液煮沸10分钟,将磁珠粒中洗脱出的蛋白质变形,最后对样品进行标准Western blot检测。
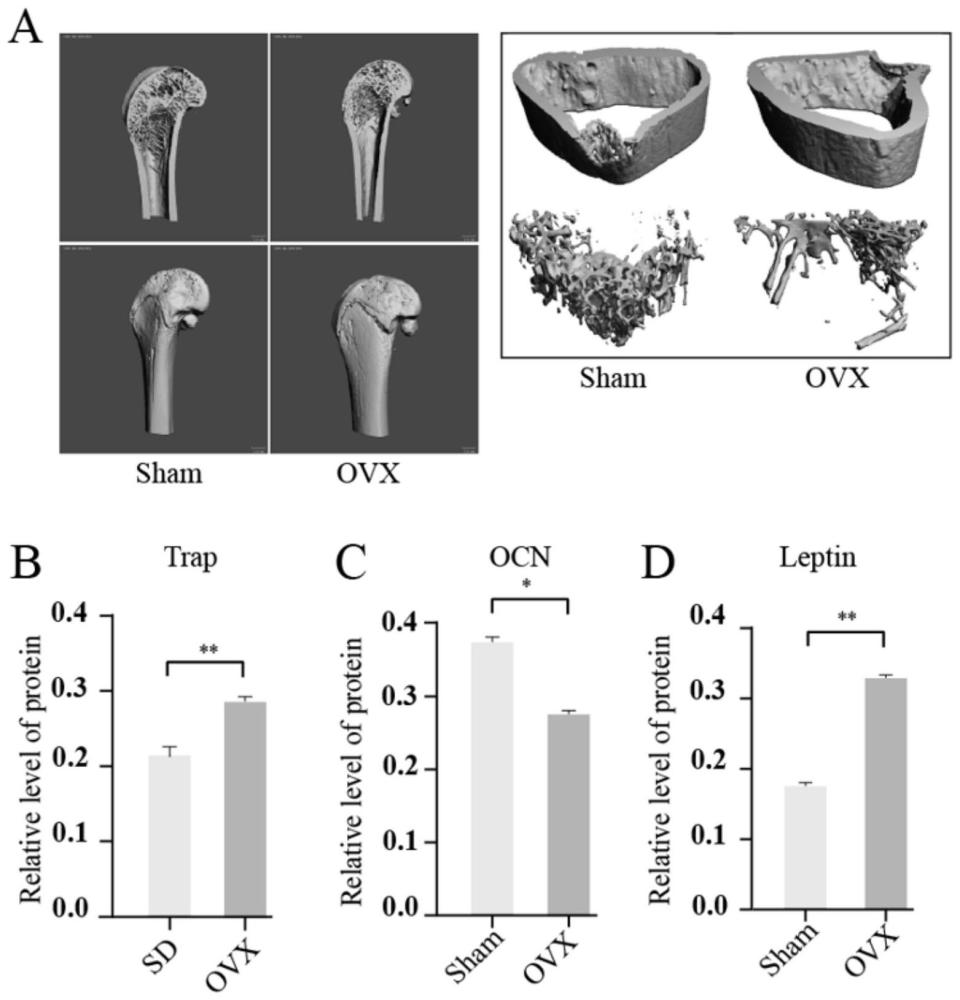
如图1A所示为股骨的Micro-CT扫描结果,通过OVX组与Sham组相比,OVX组大鼠股骨松质骨体积和小梁数量减少,随后,通过用ELISA法测定大鼠血清中TRACP、OCN和Leptin的水平;如图1B-D所示,OVX组与Sham组比较,OCN水平明显降低,TRACP和Leptin水平较Sham组明显升高,通过上述结果证实Leptin骨形成的负调控因子。
如图2所示,Western blot检测结果显示,选用细胞中均可检测到瘦素蛋白水平,但是C3H10T1/2细胞内源性瘦素水平低于其他细胞。
如图3表示C3H10T1/2细胞中BMP9对Leptin的影响;如图3B中PCR检测结果和如图3C中Western blot检测结果显示,BMP9显著降低了LeptinmRNA和蛋白水平;如图3D中ELISA检测培养液中Leptin的结果也表明,BMP9抑制了Leptin蛋白水平。
如图4E-J中利用AdEasy系统表达Leptin或Leptin siRNA寡核苷酸的重组腺病毒的结果显示;
如图5A-B所中PCR和Western blot检测结果显示,BMP9增加了Runx2的mRNA和蛋白水平,而AdLeptin的联合作用降低了Runx2的mRNA和蛋白水平;如图5C-F中组织化学染色和western blot检测结果显示,Leptin降低了BMP9诱导ALP活性和OPN蛋白水平的潜力;以上结果表明Leptin可以抑制C3H10T1/2细胞中BMP9的成骨潜能。
如图5G-H中PCR和western blot结果显示,BMP9增加了Runx2的mRNA和蛋白水平,而Runx2的mRNA和蛋白水平通过Leptin敲低而升高;如图5I-J表示,Leptin敲低可增强BMP9诱导的ALP活性;如图5K-J表示,Leptin敲低也可增加BMP9诱导的OPN mRNA和蛋白;以上结果表明,Leptin敲低可以明显促进BMP9的成骨潜能。
如图6A-B中Western blot结果显示,BMP9提高β-catenin水平,Leptin对其无明显影响,但明显降低BMP9增加β-catenin的能力,但是Leptin或/和BMP9对β-catenin (p-β-catenin)的磷酸化并没有明显影响;如图6C-D表示,沉默Leptin可增强BMP9诱导的β-catenin,但Leptin敲除对p-β-catenin没有明显影响;如图6E中共聚焦试验结果显示,BMP9增加β-catenin和核易位,Leptin抑制了β-catenin,但Leptin敲除促进了β-catenin的核易位。
如图7F-G中Western blot结果显示,BMP9增加了c-Myc水平,Leptin对其无明显影响,但明显降低了BMP9增加c-Myc的能力;如图7H-I表示,通过Leptin敲低,BMP9诱导的c-Myc升高,但Leptin敲低对c-Myc没有实质影响;以上数据表明,Leptin对BMP9成骨潜能的影响部分通过抑制Wnt/β-catenin信号介导。
如图8A中Western blot结果显示,瘦素降低了bmp9诱导的Runx2表达,而β-catenin可部分逆转Runx2表达;如图8B-C中ALP检测结果显示,瘦素显著降低了bmp9诱导的ALP活性,而β-catenin几乎逆转了这一作用;如图8D表示,瘦素敲低对促进bmp9诱导的Runx2的作用几乎被β-catenin敲低所消除;以上结果表明,瘦素对bmp9诱导的成骨分化的抑制作用可能部分通过降低Wnt/β-catenin信号介导。
如图9A所示,建立C3H10T1/2细胞模型,分别用AdGFP、AdBMP9、AdBMP9和AdLeptin或AdsiLeptin、AdBMP9 + AdLeptin和Adβ-catenin、AdBMP9 + AdsiLeptin和Adsiβ-catenin预处理C3H10T1/2细胞,收集细胞并植入缺陷部位;如图9B-C中μ-CT分析结果表明,BMP9明显促进缺损修复;Leptin降低了BMP9诱导骨缺损修复的潜能,而β-连环蛋白几乎逆转了这一潜能,相反,Leptin的下调增强了BMP9诱导骨缺损修复的潜力,而β-catenin的下调几乎消除了这种潜力;以上结果表明,Leptin抑制BMP9诱导骨形成的作用可能部分是通过降低Wnt/β-catenin信号活性介导的。
如图10A中Western blot结果显示,BMP9以浓度依赖性的方式降低丙二醛化水平;如图10B中免疫沉淀实验显示,β-catenin可被赖氨酸丙二酰化修饰,;如图10C中液相色谱-质谱分析结果证实,β-catenin可被丙二酰化修饰;如图10D中KEGG富集分析显示,丙二酰化修饰主要发生在代谢途径、脂肪酸氧化、柠檬酸循环等途径。
如图11A-B中Western blot结果显示,BMP9增加了Sirt5的水平,而Leptin不仅降低了Sirt5的水平,还降低了BMP9介导的Sirt5的升高;如图11C-D表示,Leptin敲低Sirt5升高,而BMP9诱导的Sirt5也敲低了;如11E中Westernblot结果显示,Sirt5敲低使总戊二酰化修饰水平升高,而β-catenin蛋白水平同时降低;图11F中免疫荧光染色和共荧光检测结果显示,BMP9使β-catenin的水平和核易位升高,而Sirt5敲低则使β-catenin的核易位明显降低;以上结果初步提示Leptin可通过Sirt5调节β-catenin;如图11G-H中Western blot结果显示,Leptin敲低联合BMP9上调β-catenin,降低丙二醛化,Sirt5敲低可部分逆转;如图11I中免疫沉淀分析显示,Sirt5可能与β-catenin相互作用,以上结果表明Leptin介导的Wnt/β-catenin信号的抑制可能部分源于通过下调Sirt5增加β-catenin丙二醛化。
总结:在C3H10T1/2细胞中,外源性敲低Leptin的表达可以增强BMP9所诱导的RUNX2、OPN、 ALP活性和基质矿化水平,而过表达Leptin则抑制。实验结果发现,Leptin敲低可以促进β-catenin的蛋白水平,并且对p-β-catenin没有影响。通过使用Adsiβ-catenin病毒与AdsiLeptin及AdBMP9联合使用处理细胞时,沉默Leptin对BMP9诱导RUNX2和ALP活性的增加作用可被部分逆转。在体内实验结果显示,Leptin敲低可以增强BMP9诱导颅骨缺损的面积和骨密度。通过质谱分析发现β-cateni可能存在赖氨酸丙二酰化修饰,同时这种修饰是由Leptin通过Sirt5,是赖氨酸丙二酰化全局调控因子,来调控。
上述前、后、左、右、上、下均以说明书附图中的图1为基准,按照人物观察视角为标准,装置面对观察者的一面定义为前,观察者左侧定义为左,依次类推。
在本发明的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明保护范围的限制。
以上显示和描述了本发明的基本原理、主要特征和优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 一种成骨诱导剂及在脂肪间充质干细胞成骨诱导分化中的应用
- 一种成骨诱导剂及在脂肪间充质干细胞成骨诱导分化中的应用
