醇酰基转移酶、工程菌株及其应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明属于生物技术领域。
背景技术
丁酸丁酯(butyl butyrate,简称BB)又称酪酸丁酯,是一种短链酯,具有菠萝香味。人们发现自然界中的酸甜风味通常是由于丁酸丁酯和其他短链酯的存在,丁酸丁酯存在于花朵、水果和发酵饮料中。根据《GB 1886.286—2016食品安全国家标准食品添加剂丁酸丁酯》,具有独特香味的丁酸丁酯可作为食品的香味添加剂,常用于糖果、饼干、汽水、面包、冰淇淋等食品中,也作为香料被广泛用在香水和化妆品中的;丁酸丁酸还具有优良的溶剂特性,被用做有机合成的原料和中间体,常用于合成硝化纤维素、虫胶、香豆酮树脂和涂料;丁酸丁酯本身具有高燃烧值,研究认为是最有前途的喷气机燃料混合物。
工业上合成丁酸丁酯常用化学催化法生产,通常是由正丁酸和正丁醇在催化剂作用下酯化而成,传统的生产工艺是以浓硫酸为催化剂,但存在副反应多、后处理工艺复杂、设备腐蚀严重以及废酸污染环境等弊端,人们开发了代替浓硫酸的新型催化剂如对甲苯磺酸、氨基磺酸、十二水合硫酸铁铵和固体超强酸等,使用这些化学催化剂具有催化时间短和酯化效率高的特点,但是还是存在污染环境,催化剂的回收利用步骤繁琐,后处理工艺复杂等问题。
近年来,生物合成丁酸丁酯成为趋势。主要有两种方法,一是酶法催化,酶法催化合成丁酸丁酯中比较成功的是用脂肪酶进行的,脂肪酶又名甘油酯水解酶,可催化三酰甘油水解生成游离脂肪酸和甘油,除了水解活性,还可催化酯化反应、转酯反应、氨解反应等,脂肪酶参与的催化酯化反应具有不需要辅酶、反应条件温和、副产物少等优点。但脂肪酶催化的酯化反应也有一些缺点:(1)使用脂肪酶的成本比较高,每克的价格高达百元。(2)催化时需额外加入丁醇或丁酸,如2016年,Fengxue Xin等使用可产丁醇的菌株Clostridiumsp.strain BOH3,以Candida rugosa来源的脂肪酶为催化剂,在含有70g/L的木糖中发酵产生丁醇,分别在48h和72h补加丁酸,以煤油为萃取剂,发酵122h时在有机相中检测到22.4g/L的丁酸丁酯;2017年,Zhong-Tian Zhang等人,使用一株丁酸梭菌C.tyrobutyricum ATCC25755,以葡萄糖为底物产丁酸,发酵中持续加入丁醇维持其终浓度为10g/L,使用Candidasp.来源的脂肪酶为催化剂,在将近125h时得到了34.7g/L的丁酸丁酯;(3)脂肪酶催化的反应为可逆反应,必须在反应体系中加入大量的萃取剂如十六烷、煤油等,及时移走产物,以利于酯化反应的进行。
二是发酵法,在发酵法研究中,使用醇酰基转移酶(Alcohol acyl-transferase,简称AAT)将丁酰辅酶A的丁酰基转移至丁醇上获得丁酸丁酯,目前用于合成丁酸丁酯的醇酰基转移酶一般为来自草莓(Fragaria ananassa)的SAAT或野草莓(Fragaria vesca)的VAAT,得到的菌株丁酸丁酯产量非常低。公开报道的有如下几项研究:2016年,DonovanS.Layton等人构建酸到醇的合成途径,有机酸在酰基CoA转移酶(ACT,acyl CoAtransferase)作用下转化成相应的酰基CoA,再由adhB生成醇,表达的SAAT可催化途径中的酰基CoA和醇生成酯,最终工程菌株可以在补加丁酸的情况下,利用葡萄糖发酵合成47.63mg/L的丁酸丁酯;2022年,Jong-Won Lee等使用蛋白融合标签和伴侣蛋白提高所构建途径中酶的可溶性表达,并表达SAAT,使丁酸丁酯的产量达到449.6mg/L。王菊芳等在酪丁酸梭菌中表达C.acetobutylicum ATCC824来源的adhE2和Fragaria vesca来源的VAAT,以葡萄糖为底物,在补加丁醇的条件下,可以合成3.78g/L的丁醇。总的来看,目前发酵法生产丁酸丁酯有两个问题,一是需要额外添加加丁酸或丁醇,这说明醇酰基转移酶的底物的来源受限,二是,关键酶醇酰基转移酶的活性不足,因此,本专利中使用丁醇生产菌EB243(董红军,等人.高产丁醇的大肠杆菌基因工程菌及其构建方法与应用.中国,CN201610204922.2017-10-24)为宿主,并挖掘新的高活性醇酰基转移酶。
发明内容
有鉴于此,本发明的目的是提供了一种高活性醇酰基转移酶,所述醇酰基转移酶氨基酸序列具有如SEQ ID NO1所示的氨基酸序列。
在本发明的具体实施例中,所述醇酰基转移酶来源于甜橙(Citrus sinensis)。
本发明还提供了醇酰基转移酶在制备丁酸丁酯中的应用。
进一步地,本发明提供的质粒,还包括:标签蛋白;所述标签蛋白包括:SUMO标签蛋白、TrxA标签蛋白和或his标签蛋白。
另外,本发明还提供了工程菌株,包括:权利要求1或2所述的醇酰基转移酶编码基因或权利要求4或5所述的质粒,转入具有丁醇和丁酰辅酶A合成能力的大肠杆菌获得的工程菌株。
在本发明的具体实施例中,所述具有丁醇和丁酰辅酶A合成能力的大肠杆菌优选为:丁醇生产菌EB243(保藏号为CGMCC No.12191)。
最后,本发明最后提供了所述的工程菌株在制备丁酸丁酯中的应用。
本发明公开的高活性的醇酰基转移酶来源于甜橙,其催化生产丁酸丁酯的活性远高于已报道的其他来源的醇酰基转移酶。利用该酶及其编码基因,生物发酵法生产丁酸丁酯,具有原料可再生、无需额外添加丁酸或丁醇,发酵过程操作方便等优点。
附图说明
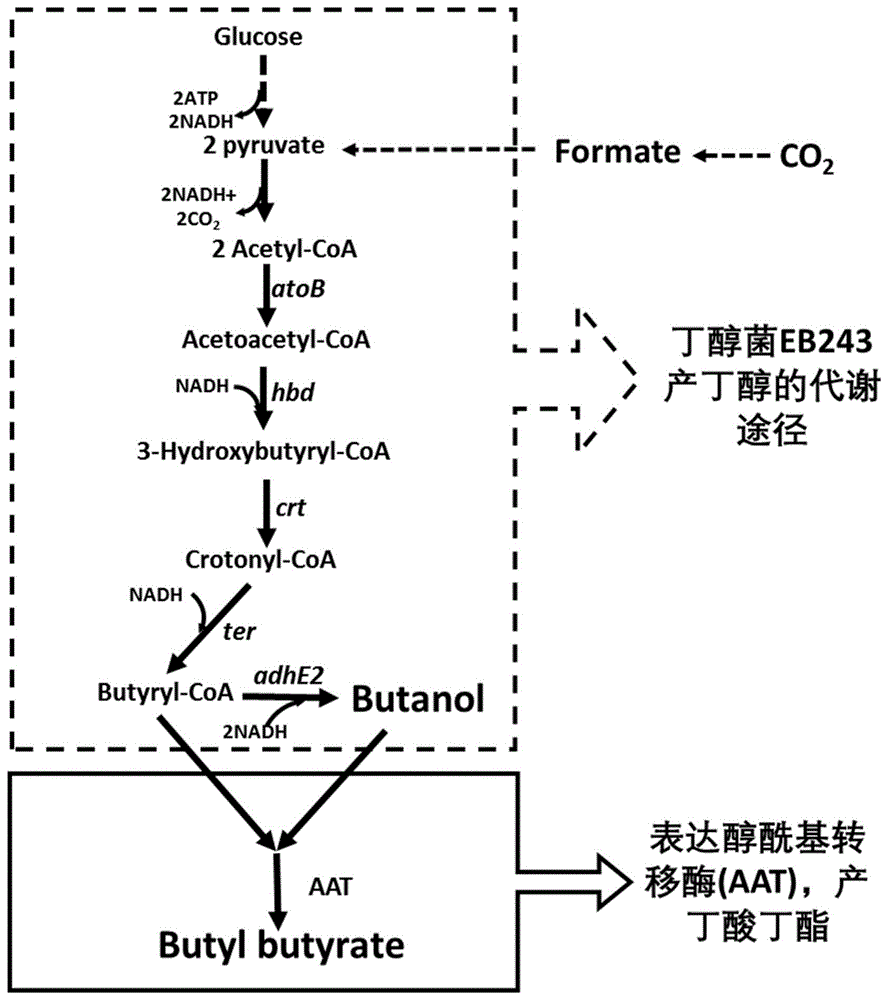
图1是改造丁醇(Butanol)生产菌EB243合成丁酸丁酯(Butyl butyrate)的示意图。
图2是气相色谱图。
其中,A是丁酸丁酯标准品的气相色谱谱图,B是工程菌株EB243 pED31的发酵萃取液的气相色谱谱图,C是工程菌株EB243 pED31-CsAAT-his的发酵萃取液的气相色谱谱图。
图3为甜橙(Citrus sinensis)来源的醇酰基转移酶CsAAT的表达质粒优选评价
具体实施方式
以下结合实施例对本发明作进一步详细说明,但并不因此将本发明限制在所述的实施例范围之中。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
为了突破高效发酵合成丁酸丁酯的瓶颈,发明人筛选了不同菌属来源且进化差异较大的关键酶醇酰基转移酶,找到来自甜橙(Citrus sinensis)的醇酰基转移酶,用合适的表达质粒表达后,具有较强的丁酸丁酯合成能力,可以催化丁酰辅酶A和丁醇反应产生丁酸丁酯。
本发明用的引物及序列信息如下:
注:引物序列横线处表示酶切位点
实施例1
表达醇酰基转移酶CsAAT编码基因序列优化及表达质粒及工程菌株EB243pED31-CsAAT-his的构建
将甜橙(Citrus sinensis)来源的醇酰基转移酶(简称CsAAT),Genebank ID NP_001275839.1,基因编码的氨基酸序列如SEQ ID NO.1所示,按大肠杆菌的密码子优化得到核酸序列如SEQ ID NO.2所示,得到合成的序列。合成的序列插入pET32a(+)(Solarbio/索莱宝,P3100-10)上EcoRI和XhoI酶切位点中间,得到质粒pET32a-CsAAT。使用引物CsAAT-NcoI-F和引物His-Xhol-R扩增CsAAT片段,所得片段使用限制性内切酶NcoI和XhoI酶切,pED31(Li H,Zhu T,Miao L,et al.Discovery of novel highly active and stableaspartate dehydrogenases[J].Scientific Reports,2017,7(1):7881.)质粒同样使用限制性内切酶NcoI和XhoI酶切,将酶切得到的片段插入pED31质粒上,用化学转化方法转化大肠杆菌DH5a(Tiangen/天根,CB101-01),复苏30min,取适量菌悬液涂布含有硫酸卡那霉素的LB平板,20度-38度过夜培养,取单克隆鉴定,将阳性单克隆提质粒进行测序,鉴定正确的质粒即为表达质粒pED31-CsAAT-his。将表达质粒使用电转的方法转化丁醇生产菌EB243(保藏号为CGMCC No.12191),得到工程菌EB243 pED31-CsAAT-his。
实施例2
利用SUMO标签蛋白促进酰基转移酶可溶性表达的表达质粒及工程菌株
质粒pET-N-his-PreScssion-SUMO(Beyotime/碧云天,D2918-1μg),使用XhoI和XbaI酶切得到含有SUMO的片段,插入质粒pED31上XhoI和XbaI酶切位点中间,得到质粒pED-SUMO-his。使用限制性内切酶EcoRI和XhoI酶切质粒pET32a-CsAAT得到CsAAT片段,将得到的片段分别插入质粒pED-SUMO-his的EcoRI和XhoI位点中间,得到表达质粒pED-SUMO-CsAAT-his。将得到的表达质粒分别电转入丁醇生产菌EB243(保藏号为CGMCC No.12191)中,得到工程菌株EB243 pED-SUMO-CsAAT-his。
实施例3
构建去除his标签蛋白的表达质粒及工程菌株
为了更好的评价his标签蛋白对蛋白活性的影响及对工程菌株产丁酸丁酯的影响,构建了相应表达质粒,对于表达质粒pED31-CsAAT-his和pED-SUMO-CsAAT-his,使用引物pED-reverse和CsAAT-no his扩出片段,回收后,去除模板,使用Gibson连接酶连接,用化转方法转化DH5a,复苏30min,取适量菌悬液涂布含有硫酸卡那霉素的LB平板,20度-38度过夜培养,取单克隆提质粒进行测序,去除his标签的质粒即为正确的pED31-CsAAT和pED-SUMO-CsAAT。
将得到的表达质粒pED31-CsAAT、pED-SUMO-CsAAT、分别电转入丁醇生产菌EB243(保藏号为CGMCC No.12191)中,得到工程菌株EB243 pED31-CsAAT、EB243 pED-SUMO-CsAAT。
实施例4
利用蛋白标签TrxA促进酰基转移酶可溶性表达的表达质粒及工程菌株
质粒pET32a-CsAAT分别使用XhoI和XbaI酶切得到含有TrxA及CsAAT的片段,插入质粒pED31上XhoI和XbaI酶切位点中间,得到表达质粒pED-TrxA-CsAAT-his;将得到的表达质粒pED-TrxA-CsAAT-his电转入丁醇生产菌EB243(保藏号为CGMCC No.12191)中,得到工程菌株EB243 pED-TrxA-CsAAT-his。
实施例5
不含醇酰基转移酶的质粒及工程菌株
将空质粒pED31,即不携带有醇酰基转移酶,电转入丁醇生产菌EB243(保藏号为CGMCC No.12191)中,得到工程菌株EB243 pED31。
实施例6
丁酸丁酯检测方法
将一定量的丁酸丁酯和丁酸乙酯溶解于十六烷中,制备成标准品。
发酵法合成丁酸丁酯的详细步骤见实施例7,使用十六烷作为萃取剂萃取发酵液中的丁酸丁酯,测定时取萃取相1ml,14000g离心5min,取上层清澈的萃取相待测。
丁酸丁酯的测定使用岛津装载FID检测器的岛津GC-2010气相进行测定,使用安捷伦的DB-WAX气相色谱柱(30m×0.25mm,0.50μm),柱温起始温度60℃,保持2min,以45℃/min升至85℃保持2min,;再以15℃/min上升至130℃,再以45℃/min上升至230℃,保持8min;载气He(99.999%),柱流量30mL/min。进样口温度225℃,检测器保持在235℃,进样量为1ul,分流比设为1:10。
检测结果如附图2所示,5.95min处的峰为丁酸丁酯,图2A为丁酸丁酯标准品的谱图;图2B为不含有醇酰基转移酶的工程菌株EB243 pED31,即携带空质粒菌株的发酵结果谱图,可以看到此处无丁酸丁酯的峰,说明工程菌株EB243本身不能合成丁酸丁酯;图2C为携带有醇酰基转移酶的工程菌株EB243 pED31-CsAAT-his的发酵结果谱图,出现丁酸丁酯的峰,经计算该菌株可合成1.29g/L的丁酸丁酯。
实施例7
工程菌株发酵合成丁酸丁酯
LB培养基:10g/L蛋白胨、5g/L酵母提取物和10g/L氯化钠
发酵培养基:20g/L葡萄糖、2g/L酵母提取物、6g/L磷酸氢二钾、2g/L磷酸二氢钠、1g/L硫酸铵、0.1g/L硫酸镁、0.01g/L氯化钙及微量元素母液1mL,微量元素母液8.3g/L氯化铁、8.4g/L氯化铁、0.13g/L二水合氯化铜、0.1g/L六水合氯化钴、0.1g/L硼酸、0.016g/L六水合氯化锰。
将工程菌株EB243 pED31-CsAAT-his、利用SUMO标签蛋白促溶的工程菌株EB243pED-SUMO-CsAAT-his、去除his标签蛋白的工程菌株EB243 pED31-CsAAT和EB243 pED-SUMO-CsAAT,及利用TrxA标签蛋白促溶的工程菌株EB243 pED-TrxA-CsAAT-his,及不含醇酰基转移酶质粒的菌株EB243 pED31,分别接于含有50ul/L硫酸卡那霉素的LB培养基中,于20度-38度、100rpm-250rpm过夜培养;取过夜培养物以5-20%的接种量,发酵培养基中,20度-38度、100rpm-250rpm培养6-9h后,加入发酵培养物体积10%-100%的萃取剂十六烷,同时加入0mM-0.5mM的诱导剂IPTG,随后的发酵在密封的容器内进行,20度-38度、100rpm-250rpm培养24h-96h后,取萃取剂测定丁酸丁酯的产量。
对于丁醇生产菌EB243,本身不具有合成丁酸丁酯的能力,所以携带空质粒的菌株,即不携带醇酰基转移酶的菌株,EB243 pED31也不能合成丁酸丁酯。
对于用pED31-his质粒表达醇酰基转移酶的工程菌株EB243 pED31-CsAAT-his,发酵得到丁酸丁酯的产量为1.29g/L;携带去除his标签质粒pED31-CsAAT的工程菌株EB243pED31-CsAAT,发酵得到的丁酸丁酯产量为1.26g/L。
对于用pED-SUMO-his质粒表达醇酰基转移酶CsAAT的工程菌株EB243pED-SUMO-CsAAT-his,发酵得到丁酸丁酯的产量为1.44g/L;携带去除his标签质粒pED-SUMO-CsAAT的工程菌株EB243 pED-SUMO-CsAAT,发酵可得到0.95g/L丁酸丁酯。携带TrxA标签质粒的工程菌株EB243 pED-TrxA-CsAAT-his,发酵仅得到0.13g/L的丁酸丁酯。
对比以上结果,说明自甜橙(Citrus sinensis)的醇酰基转移酶CsAAT在工程菌EB243中能合成丁酸丁酯;对比各种表达质粒,醇酰基转移酶CsAAT在pED-SUMO-his质粒上能展现出合成丁酸丁酯的优势,在质粒pED31-CsAAT-his、pED31-CsAAT、pED-SUMO-CsAAT上展现出合成丁酸丁酯的能力次之。
本部分的结果说明质粒pED-SUMO-CsAAT-his、pED31-CsAAT、pED31-CsAAT-his、pED-SUMO-CsAAT可以作为表达甜橙(Citrus sinensis)醇酰基转移酶CsAAT的优选质粒。
- 一种高产醇脱氢酶和酰基转移酶菌株及培养方法及应用
- 一种高效表达磷酸泛酰巯基乙胺基转移酶的基因工程菌株及其构建方法与应用
