一种快速的病原菌特异性酶促药敏分析方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属微生物检测领域,涉及一种快速的病原菌特异性酶促药敏分析方法,是一种快速分析病原菌表型药物敏感性方法,用于特异性地检测样品中病原菌表型抗生素敏感性。
背景技术
细菌性感染是由细菌引起的一类疾病,包括尿路感染、肺炎、脑膜炎、肠胃炎等多种类型。这些感染性疾病对人类健康造成了重大威胁,导致全球每年数百万人死亡。目前细菌性感染的治疗方法主要是以广谱抗生素为主的经验性疗法。在未充分明确病原菌的抗生素敏感性之前进行经验性抗生素治疗可能会导致抗菌药物的错误选择、用药剂量及时长不对和不必要的多种抗生素联用等不合理的抗生素使用。不当的抗生素使用不但会造成治疗效果不佳,还会引起新的耐药性细菌甚至多重耐药性细菌出现。细菌耐药性的出现已经成为威胁人民健康的主要公共卫生问题之一。耐药菌通常会在抗生素首次使用之后的1-7年内出现。到2017年,所有存在抗生素均发现了其对应的耐药菌。耐药性细菌感染将会大大增加败血症和器官功能衰竭的发生率,延长治疗时间,增加公共卫生负担。如果不采取干预措施,预计到2050年,耐药微生物引起的感染可能导致每年约1000万人死亡,超过癌症死亡人数。
随着新抗生素开发的速度放缓,如不采取措施遏制细菌耐药情况的进一步恶化,有效的抗生素药物将会越来越少,甚至将会面临无药可用的局面。因此,世界卫生组织建议应在给药前确定病原菌的抗生素敏感性,以抗生素的循证疗法代替经验性疗法、促进个性化抗生素疗法、加强抗生素管理和耐药性监测,从而保护现有抗生素并最大程度地减少新的多重耐药菌出现。
目前标准细菌药敏测试方法采用平板划线法经过夜培养分离样品中的病原菌,再通过选择性培养或PCR法鉴定细菌种类,然后利用肉汤稀释法或E-test测试抗生素敏感性。整个检测过程耗时3天,无法实现及时病原菌药敏分析。特别是对于系统性细菌感染,有研究表明,每延误治疗一小时,系统性细菌感染的存活率将下降7.6%。另外,标准的细菌药敏测试方法涉及多种不同原理的实验,操作复杂,严重依赖技术人员和微生物实验中心,不利于在给药前进行细菌药敏分析。因此,为实现及时有效的抗生素治疗,亟需研发出快速、准确且易操作的细菌敏感性分析方法。
发明内容
为解决以上所提出的病原菌分析时间长和操作复杂的问题,本发明的目的是提供一种快速的病原菌特异性酶促药敏分析方法,是一种可直接对生物样本中的病原菌进行快速表型抗生素敏感性检测的方法。本发明方法并非直接用于诊断和治疗。
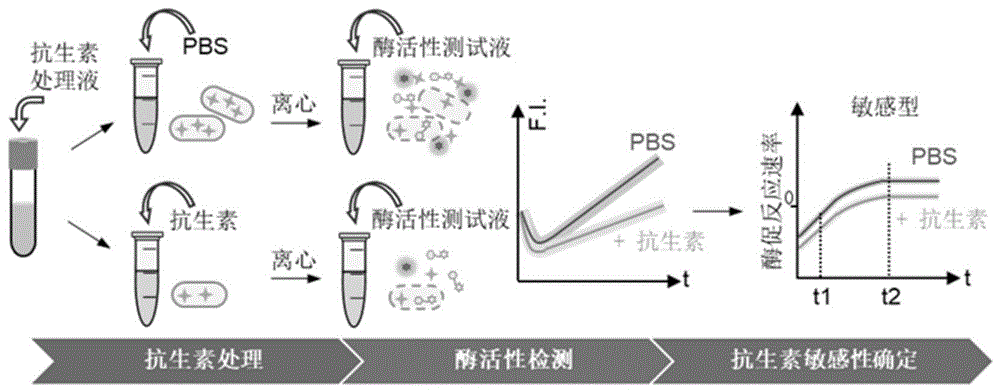
本发明提供的病原菌特异性酶促药敏分析方法由三步构成:(1)抗生素接触;(2)特异性代谢酶活性检测;(3)抗生素敏感性确定。上述步骤可在离心管内、96孔板中或微孔阵列芯片上,通过手动地,或借助液体操纵机器人,流体控制器等设备自动化地完成。
本发明方法所用的待测样品可以是尿液,血液,脑脊液等低粘度液体样品,也可以是痰液,阴道分泌物等高粘度液体样品。当待测样品为低粘度液体样品时,可直接通过离心,膜过滤,免疫磁分离或微流体芯片等方法,分离上述液体样品中的病原菌。当待测样品为高粘度样品时,需先加入磷酸盐缓冲液(PBS)对样品进行稀释,或加入二硫苏糖醇,二硫赤藓糖醇,蛋白酶(半碱蛋白酶)等以释放样品中的细胞,以便通过离心,膜过滤,磁分离或微流体芯片技术分离样品中的病原菌。
步骤(1)所述抗生素接触中,分离得到待测病原菌首先被均匀地重悬在处理液中,进一步地,重悬后的样品被均匀地分成两份,向其中一份加入抗生素,另一份加入等量的PBS作为对照,用于分析细菌的二元抗生素敏感性;或将重悬后的样品等分成4-6份,向其中一份加入PBS其余份中加入等体积2倍梯度稀释的抗生素,用于测定抗生素最小抑制浓度。将含有抗生素/PBS的处理液混合均匀后,放入水浴或加热器中进行恒温孵育。
所述处理液含有液体培养基、效应物和PBS。液体培养基可以是:不含右旋糖的胰蛋白胨大豆肉汤(Tryptone Soya Broth without dextrose,TSB-D)、Mueller Hinton,Muller Hinton 2、无葡萄糖脑心浸液肉汤(Brain Heart Infusion Broth withoutglucose)、M9肉汤(M9 Minimal Media)等,优选不含右旋糖的胰蛋白胨大豆肉汤。液体培养基的终浓度为1-50%v/v。液体培养基的作用是为细菌提供能量,维持细菌细胞活性,使细菌对抗生素产生快速响应。
所述效应物为相应特异性酶的底物类似物,包括:甲基-β-D-葡萄糖醛酸(Methyl-β-D-glucuronide,MetGlu)、异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactoside)、纤维二糖(Cellobiose)、羧甲基纤维素(Carboxymethylcellulose)、长链甘油三脂(Long chain triglycerides)等化合物。这些效应物分别对应激活肠杆菌中的葡萄糖醛酸酶,克雷伯氏菌中的半乳糖苷酶,肠球菌中的β葡糖苷酶,变形菌和葡萄球菌中的脂肪酶。效应物的终浓度为0-1mg/mL。效应物可以加速细菌对抗生素响应,缩短抗生素接触时间。
步骤(1)所述抗生素包括细胞壁抑制剂、膜穿孔剂、蛋白质合成抑制剂、DNA合成抑制剂、RNA合成抑制剂、叶酸合成抑制剂或ATP合成抑制剂。当进行二元抗生素敏感性分析时,抗生素浓度为临床实验室标准化协会(Clinical and Laboratory StandardsInstitute,CLSI)中规定的敏感细菌的抗生素突破浓度。
所述恒温孵育的水浴或加热器的温度为35-45℃,孵育时间为15-60min。
在进行步骤(2)所述特异性酶活性检测之前,需将步骤(1)恒温孵育抗生素接触后的细菌处理液,利用离心,膜过滤,磁分离或微流体芯片进行浓缩,浓缩倍率2-4倍。浓缩后的细菌悬液与酶活性测试液混合。将混合后的液体分装到3个离心管,或96孔板的3个孔中,或微流体芯片中的3个反应单元中,采用实时荧光曲线法测量抗生素接触细菌和对照细菌中酶的活性。
所述酶活性测试液含有细菌裂解剂和相应的酶荧光底物。细菌裂解剂可以是表面活性剂、细菌蛋白提取缓冲液、溶菌酶和膜穿孔剂中的一种或多种。其中表面活性剂选用Pluronic F127、Brij-35或Triton X-100;细菌蛋白提取缓冲液选用Bacterial ProteinExtraction Lysis Buffer;溶菌酶选为lysozyme;膜穿孔剂选用多粘菌素B(Polymyxin B,PMB)或多粘菌素E(Polymyxin E)。
当使用以上裂解剂中的一种或多种组合时,表面活性剂的终浓度为0.02-2.5wt%,细菌蛋白提取缓冲液的终浓度为10-30%v/v,溶菌酶的终浓度为0.05-0.25mg/mL,膜穿孔剂的终浓度为1-10μg/mL。
所述酶荧光底物为葡糖苷酸衍生物、吡喃半乳糖苷衍生物、葡糖苷衍生物或脂肪酸衍生物中的一种或多种。当酶荧光底物是葡糖苷酸衍生物时,选用6-氯-4-甲基伞形酮基β-D-葡糖苷酸(6-chloro-4-Methylumbelliferyl-β-D-glucuronide,6c-MUG)、4-甲基伞形酮基β-D-葡糖苷酸(4-Methylumbelliferyl-β-D-glucuronide)、荧光素二-β-D-葡糖苷酸(Fluorescein di-β-D-glucuronide)、试卤灵β-D-葡萄糖醛酸钠盐(Resorufinβ-D-glucuronide)等,优选6-氯-4-甲基伞形酮基β-D-葡糖苷酸,可检测肠杆菌中的葡萄糖醛酸酶活性。
当酶荧光底物是吡喃半乳糖苷衍生物时,选用荧光素二-β-D-吡喃半乳糖苷(Fluorescein di-β-D-galactopyranoside)、试卤灵-β-D-吡喃半乳糖苷(Resorufin-β-D-galactopyranoside)、苯基-β-D-吡喃半乳糖苷(Phenylβ-D-Galactopyranoside)、4-氨苯基β-D-吡喃半乳糖苷(4-Aminophenylβ-D-Galactopyranoside)、苯乙基β-D-吡喃半乳糖苷(Phenylethylβ-D-Galactopyranoside)、荧光素-β-D-吡喃半乳糖苷(Fluorescein monoβ-D-Galactopyranoside)、4-氯-3-吲哚基β-D-吡喃半乳糖苷(4-Chloro-3-indolylβ-D-galactopyranoside)等,优选试卤灵-β-D-吡喃半乳糖苷,可检测克雷伯氏菌中的半乳糖苷酶活性。
当酶荧光底物是葡糖苷衍生物时,选用七叶苷(Esculin),苯基-β-D-葡糖苷(Phenyl-β-D-glucopyranoside)、4-氨苯基-β-D-吡喃葡糖苷(4-Aminophenylβ-D-glucopyranoside)、试卤灵β-D-吡喃葡糖苷(Resorufinβ-D-glucopyranoside)、4-甲基伞形酮基6-磺基-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷(4-Methylumbelliferyl6-Sulfo-2-acetamido-2-deoxy-β-D-glucopyranoside)、苄基β-D-葡糖苷(Benzylβ-D-Glucopyranoside)、鬼臼根醇苷(Podorhizolβ-D-Glucopyranoside)等,优选试卤灵-β-D-吡喃葡糖苷,可检测肠球菌中的β葡糖苷酶活性。
当酶荧光底物是脂肪酸衍生物时,选用甘油三脂基荧光底物EnzChek lipasesubstrate、香豆素基荧光底物O-pivaloyloxymethyl umbelliferone、7-hydroxy-4-methylcoumarin、6,8-difluoro-4-methylumbelliferyl octanoate、6,8-difluoro-7-hydroxy-4-methylcoumarin等,优选甘油三脂基荧光底物EnzChek lipase substrate,可检测变形菌和葡萄球菌中的脂肪酶活性。
所述实时荧光曲线法测量酶的活性时,温度为37-50℃,荧光检测频率为1-2次/min,荧光检测时长为30-60min。
所述步骤(3),在确定细菌对测试抗生素的敏感性时,首先对步骤(2)采集到的所测样品的实时荧光曲线进行求导,其一阶导数为抗生素接触组和对照组的实时酶促反应速率,该酶促反应速率直接反应测试液体中酶的数量。进一步地,对抗生素接触组和对照组的实时酶促反应速率进行t-检验,分析上述两组间酶促反应速率差异,根据两组间实时酶促反应速率是否存在显著性差异判定病原菌对抗生素的二元敏感性。若抗生素接触组的实时酶促反应速率显著地小于对照组的实时酶促反应速率,则判定细菌对所测抗生素敏感。若抗生素接触组与对照组的实时酶促反应速率之间无显著性差异,则判定细菌具有耐药性。
在测定最小抑制浓度时,首先通过线性拟合法分析步骤(2)中采集的实时荧光曲线,求得不同抗生素浓度接触组和对照组的酶促反应速率。进一步地,采用one-way ANOVA分析相邻两个抗生素浓度接触组的酶促反应速率差异。当相邻两个抗生素浓度接触组的荧光增长速率不存在显著性差异时,较小的抗生素处理浓度即是最小抑制浓度。
所述线性拟合分析,需从实时荧光曲线的一阶导数为正数处开始至荧光测试结束。
所述t-检验和one-way ANOVA的显著性水平为0.05。
进一步地,利用本方法测试分离出的病原菌的种类和抗生素敏感性。本发明可用于检测分析肠杆菌,克雷伯氏菌,葡萄球菌,肠球菌,变形杆菌等多种病原菌。
本发明所涉及的技术采用新型的细菌抗生素敏感性表型标志物,具有以下特性:1)检测时间短:最快30min左右实现病原菌药敏分析;2)病原菌特异性高:特异性地测试病原菌的抗生素敏感性,鉴定病原菌种类,排除样品中共生菌对检测造成的不良影响;3)直接检测样品:无需进行病原菌分离及病原菌预培养,简化实验操作,缩短检测时间;4)适用性广:能够测试病原菌对多种不同类型的抗生素的敏感性;5)表型药敏分析:与标准方法一样,提供病原菌的表型药敏信息;6)多功能:一次实验可同时提供细菌的物种信息和药敏信息。同时该方法对大型仪器依赖小。
本发明带来的有益效果有:1)大幅缩短病原菌药敏分析时间。该方法直接检测生物样品中的病原菌,无需过夜细菌分离及预培养;选用的酶对抗生素响应速度快,减少抗生素接触时间;并且酶活性测试分辨率好,灵敏度高,快速反应细菌的抗生素响应。本发明将药敏分析时间由3天缩短至30分钟。2)简化实验操作。该方法可特异性地测试病原菌的药物敏感性,无需通过平板划线等方法去除样品中的共生菌;可同时鉴定病原菌种类,无需额外的细菌鉴定实验,如生化测试,PCR,测序,质谱。3)准确测定细菌种类和表型敏感性。该方法可测定细菌对抗生素的表型敏感性,结果与标准方法一致,同时能够提供病原菌的种属信息。4)降低检测成本。该方法所用试剂量小成本低,所用仪器均为实验室常规仪器,且节省了细菌分离和鉴定的试剂消耗,显著降低了病原菌药敏分析成本。本发明将有利于推广抗生素的循证疗法,对细菌性感染精准治疗和抗生素的合理使用有重要意义。
附图说明
图1为病原菌特异性酶促药敏分析检测流程图。
图2为氨苄青霉素敏感型细菌检测结果。
图3为氨苄青霉素耐药型细菌检测结果。
图4为大肠杆菌对多种类型抗生素的二元敏感性分析结果。
图5为多粘菌素对大肠杆菌的最小抑制浓度测定。
具体实施方式
为更好地理解本发明,同时清楚地展现本发明的性能,现结合实施例及附图,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
实施例以大肠杆菌为研究模型展示本发明所涉及检测方法的检测原理和性能,实施例包括:利用本发明测试敏感型和耐药型大肠杆菌对氨苄青霉素的不同响应;细菌对不同类型的抗生素敏感性测试;抗生素对细菌最小抑制浓度测定。
实施例1敏感型大肠杆菌对细胞壁抑制剂(氨苄青霉素)的响应
本实施例中的氨苄抗生素敏感型大肠杆菌为E.coli ATCC25922。利用本发明测试细菌敏感性的流程如附图1所示。首先,ATCC25922重悬在1.5mL处理液中,终浓度为7×10
抗生素接触后,处理液在4000rpm下离心5min。而后弃上清550μL,并用剩余200μL液体重悬细菌。取158.2μL的细菌悬液加入到161.8μL酶活性测试液中。酶活性测试液由以下构成:20μL Pluronic F127(20%wt),62.5μL细菌蛋白质提取缓冲液,1.5μL溶菌酶(40mg/mL),3.2μL PMB(500μg/mL),74.6μL 6c-MUG(3mg/mL)。含有细菌的酶活性测试液混合均匀后,按照每份100μL加入到96孔板中。利用酶标仪在375/460nm处每分钟测量一次反应液的荧光强度,酶标仪温度设置为42℃。
从图2可以看出,在检测酶活性时,氨苄青霉素接触组的荧光强度始终弱于对照组,且实时酶促反应速率在5min后显著小于对照组。结果说明,测试细菌的细胞活性被氨苄青霉素抑制,表现出对氨苄青霉素的敏感性。因此,ATCC25922被判定为氨苄青霉素的敏感菌,结果与该细菌特性相符。
实施例2耐药型大肠杆菌对细胞壁抑制剂(氨苄青霉素)的响应
本实施例中的氨苄抗生素耐药型大肠杆菌为从土壤中分离到的E.coli EK-19。将EK-19重悬在1.5mL处理液中,终浓度为9×10
抗生素接触后,处理液在4000rpm下离心5min。而后弃上清550μL,并用剩余200μL液体重悬细菌。取158.2μL的细菌悬液加入到161.8μL酶活性测试液中。酶活性测试液由以下构成:20μL Pluronic F127(20%wt),62.5μL细菌蛋白质提取缓冲液,1.5μL溶菌酶(40mg/mL),3.2μL PMB(500μg/mL),74.6μL 6c-MUG(3mg/mL)。含有细菌的酶活性测试液混合均匀后,按照每份100μL加入到96孔板中。利用酶标仪在375/460nm处每分钟测量一次反应液的荧光强度,酶标仪温度设置为42℃。
从图3可以看出,在检测酶活性时,氨苄青霉素接触组与对照组的荧光强度始终相似,分析这两组的实时酶促反应速率发现抗生素接触组和对照组的实时酶反应速率无显著性差异。结果说明,测试细菌的细胞活性不受氨苄青霉素影响,表现出对氨苄青霉素的耐药性。因此,EK-19被判定为氨苄青霉素的耐药菌,结果与该细菌特性相符。
实施例3大肠杆菌对膜穿孔剂(多粘菌素B)和蛋白质合成抑制剂(双氢链霉素)的敏感性分析
本实施例中的大肠杆菌为E.coli ATCC25922。ATCC25922重悬在2.25mL处理液中,终浓度为7.5×10
抗生素接触后,处理液在4000rpm下离心5min。而后弃上清550μL,并用剩余200μL液体重悬细菌。取158.2μL的细菌悬液加入到161.8μL酶活性测试液中。酶活性测试液由以下构成:20μL Pluronic F127(20%wt),62.5μL细菌蛋白质提取缓冲液,1.5μL溶菌酶(40mg/mL),3.2μL PMB(500μg/mL),74.6μL 6c-MUG(3mg/mL)。含有细菌的酶活性测试液混合均匀后,按照每份100μL加入到96孔板中。利用酶标仪在375/460nm处每分钟测量一次反应液的荧光强度,酶标仪温度设置为42℃。
从图4可以看出,在检测酶活性时,多粘菌素B接触组和双氢链霉素接触组的荧光强度明显弱于对照组,且实时酶促反应速率分别在3min和2min后显著小于对照组。结果说明,测试细菌的细胞活性被多粘菌素B和双氢链霉素所抑制。因此,ATCC25922被判定为多粘菌素B和双氢链霉素的敏感菌,结果与该细菌特性相符,显示出本发明测试细菌对多种类型抗生素敏感性的能力。
实施例4测定多粘菌素B对大肠杆菌的最小抑制浓度
本实施例中的大肠杆菌为E.coli ATCC25922。ATCC25922重悬在3mL处理液中,终浓度为7.5×10
抗生素接触后,处理液在4000rpm下离心5min。而后弃上清550μL,并用剩余200μL液体重悬细菌。取158.2μL的细菌悬液加入到161.8μL酶活性测试液中。酶活性测试液由以下构成:20μL Pluronic F127(20%v/v),62.5μL细菌蛋白质提取缓冲液,1.5μL溶菌酶(40mg/mL),3.2μL PMB(500μg/mL),74.6μL 6c-MUG(3mg/mL)。含有细菌的酶活性测试液混合均匀后,按照每份100μL加入到96孔板中。利用酶标仪在375/460nm处每分钟测量一次反应液的荧光强度,酶标仪温度设置为42℃。
从图5可以看出,随着PMB浓度增大时,抗生素接触组的酶促反应速率不断减小。利用one-way ANOVA分析不同抗生素浓度接触组之间的酶促反应速率的差异,发现2μg/mLPMB接触组的酶促反应速率相比于1μg/mL PMB接触组,无明显下降。结果说明1μg/mL PMB基本上能够完全抑制细菌的细胞活性,则PMB对ATCC25922的最小抑制浓度为1μg/mL。
上述实施例中采用的各处理液的组成和反应条件仅用于示例,本发明的方案中并不限于上述具体的数值,只要在权利要求书所述的范围内,均属于本发明的保护范围。
本领域的技术人员容易理解,以上所述仅为本发明的一个实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种血流感染病原菌微量肉汤快速荧光药敏检测方法
- 利用拉曼光谱快速鉴定多重感染病原菌及进行药敏实验的方法
