用于预测药物免疫治疗疗效的肠道菌群标志物模型及其构建方法
文献发布时间:2024-04-18 19:58:30
技术领域
本发明属于生物工程领域,涉及肠道菌群标志物模型,具体来说是用于预测免疫检查点抑制剂PD-1和/或PD-L1药物免疫治疗疗效的肠道菌群标志物模型及其构建方法。
背景技术
随着肿瘤免疫学的快速发展,肿瘤免疫治疗尤其是免疫检查点抑制剂(immunecheckpoint inhibitors,ICIs)的应用已然重塑了多种癌症治疗的新范式,为很多难治性晚期肿瘤患者带来了新的治疗选择和疾病的缓解。传统的ICIs药物,包括抗细胞毒性T淋巴细胞相关抗原4(CTLA-4)和靶向程序性死亡受体1(PD-1)/程序性死亡受体-配体1(PD-L1)的检查点抑制剂,已被批准用于治疗多种癌症,如黑色素瘤、非小细胞肺癌等。
然而有研究发现,ICIs对实体瘤的抑制率仅为10%~40%,这表明有很大一部分患者并不能从免疫疗法中获益。因此,寻找决定ICIs临床疗效的预测生物标志物,并设计合理的ICIs与其他治疗药物的联合治疗方案,是增强ICIs整体疗效的关键所在。
越来越多的研究表明,肠道菌群在肿瘤的发生和发展中扮演中重要的角色,并且可以协同ICIs治疗提高抗肿瘤疗效。补充特定的益生菌可以增强荷瘤小鼠对免疫检查点抑制剂药物治疗的疗效,粪便微生物群移植(FMT)在临床前期实验以及部分一期临床试验中已被证明可以增强免疫检查点抑制剂治疗疗效。因此,使用肠道微生物群作为评估患者接受ICIs药物的获益率的新型生物标志物具有很大的应用前景。最近,一些研究也提出了基于肠道微生物群的特定疾病预测模型和ICIs疗效。一组基线肠道微生物组构成的生物标志物可以预测从接受ICIs药物治疗中受益更多的候选患者。然而,这些回顾性数据分析多使用微生物组16S rRNA测序技术,研究所利用的分析方法也相对传统且纳入对象数目较少,高效且可重复的微生物预测模型的构建仍然处于不断探索和实践过程中。且由于肠道菌群的多样性特点,在不同研究队列内所筛选出的与疾病相关的特征性微生物群存在较大的差异,这一定程度上受限于不同研究队列的样本数目,患者来源,以及测序平台和测序策略等因素,基于更大规模更精准的微生物数据综合分析将具有重要的临床意义,以便临床医师根据肿瘤患者的个体差异制定使患者收益最大的治疗方案。
粪便肠道微生物定量技术:包括高通量测序技术(包括16S rRNA测序以及鸟枪法(Shotgun)宏基因组测序技术)以及实时荧光定量PCR可特异性检测粪便中肠道微生物群的相对丰度。随着高通量技术的普及应用,其高效,受众广,检测微生物群范围覆盖全等优点可以快速了解多个样本的肠道菌群的丰度特征。16S rRNA测序技术研究主要是是基于PCR扩增的细菌16S rRNA片段,主要研究群落的物种组成、物种间的进化关系以及群落的多样性;而鸟枪法(Shotgun)宏基因组测序技术能够获得微生物群落的所有基因序列,通过对序列的拼接组装,从而获得基因组的结构信息和功能信息,主要对微生物群落的组成及功能进行研究。相比于16SrRNA测序技术,宏基因组测序技术在种水平识别微生物群体结构及其功能中展现出更高的准确性。使用高通量测序技术了解肠道微生物群体构成对于开展肠道菌群与疾病之间的科学研究及临床实践应用不可或缺。整合多个研究队列的宏基因组测序数据,进行特异性的菌群筛选和分析能够辅助开发更加高效的微生物预测模型,以识别对免疫检查点抑制剂获益人群辅助临床医师开展个性化治疗方案。
发明内容
针对现有技术中的上述技术问题,本发明提供了用于预测免疫检查点抑制剂抗PD-1和/或PD-L1抗体药物免疫治疗疗效的肠道菌群标志物及其构建方法,所述的这种用于预测免疫检查点抑制剂PD-1和/或PD-L1药物免疫治疗疗效的肠道菌群标志物及其构建方法要解决现有技术对于肿瘤的免疫治疗效果不能及时预测的技术问题。
本发明提供了一种用于预测免疫检查点抑制剂PD-1和/或PD-L1抗体药物免疫治疗疗效的肠道菌群标志物组合,由十六个细菌靶点构成,所述的十六个细菌靶点为:
本发明还提供了一种用于预测免疫检查点抑制剂抗PD-1和/或PD-L1抗体药物免疫治疗疗效的试剂盒,所述的试剂盒含有检测下述肠道菌群标志物的试剂:Akkermansiamuciniphila、Bifidobacterium bifidum、[Eubacterium]hallii、Veillonella parvula、Lactobacillus mucosae、Hungatella hathewayi、Lactobacillus crispatus、Anaerobutyricum hallii、Eisenbergiella tayi、Roseburia intestinalis、Coprobacillus cateniformis、Streptococcus salivarius、Lachnospira eligens、Absiella dolichum、Faecalibacterium prausnitzii、Coprococcus eutactus。
本发明还提供了一种用于预测免疫检查点抑制剂抗PD-1和/或PD-L1抗体免疫治疗疗效的肠道菌群标志物组合在制备用于预测免疫检查点抑制剂抗PD-1和/或PD-L1抗体药物免疫治疗疗效的试剂盒中的用途。
本发明还提供了一种用于预测免疫检查点抑制剂PD-1/PD-L1药物免疫治疗疗效的肠道菌群标志物模型的构建方法,包括如下步骤:
1)基于治疗前基线水平的粪便肠道微生物的丰度,选择经文献报道的与免疫检查点抑制剂疗效相关的菌属;
2)使用机器学习算法进行模型构建和训练,获得在不同研究中稳定的微生物群标志物用于预测免疫检查点抑制剂治疗疗效;
3)采用粪便微生组16S rRNA测序或者宏基因组测序方法获取粪便微生物组的相对丰度特征,选择了十六个肠道菌作为预测治疗疗效的微生物;肠道菌群标志物为:
Akkermansia muciniphila、Bifidobacterium bifidum、[Eubacterium]hallii、Veillonella parvula、Lactobacillus mucosae、Hungatella hathewayi、Lactobacilluscrispatus、Anaerobutyricum hallii、Eisenbergiella tayi、Roseburia intestinalis、Coprobacillus cateniformis、Streptococcussalivarius、Lachnospira eligens、Absiella dolichum、Faecalibacteriumprausnitzii、Coprococcus eutactus;
4)基于预测治疗疗效的微生物群中十六个肠道菌中的菌群丰度可预测免疫检查点抑制剂治疗疗效;
5)模型预测评分计算公式需利用Python中随机森林Random Forest函数,使用predict()函数预测免疫治疗获益评分Response score(RS),并使用约登函数计算获益评分截断值RS=0.445071,若高于评分的患者为对免疫检查点抑制剂获益率高的人群,反之属于免疫治疗获益率低人群。
本发明系统性回顾了当前已发表研究(同时包含抗PD-1/PD-L1抗体免疫治疗患者治疗疗效等临床信息以及基线粪便微生物宏基因组测序信息的数据,N=568),使用软件mOTUs3对所有宏基因组测序原始数据进行数据处理及细菌基因组注释,在种属的水平对细菌丰度信息进行统计分析。最终在四个队列(合计568个患者)中筛选出个与免疫治疗疗效相关的菌属,构建出免疫治疗反应相关的微生物预测模型。肠道菌群特征与PD-1/PD-L1抗体治疗疗效在不同类别的肿瘤中或许存在共性。本发明经过数据补充与再分析,该肠道菌群构建的免疫检查点抑制剂治疗疗效预测模型具有在多种类型的肿瘤,如大肠癌/肺癌/黑色素瘤/胃癌等中应用前景并使患者获益的可能。
附图说明
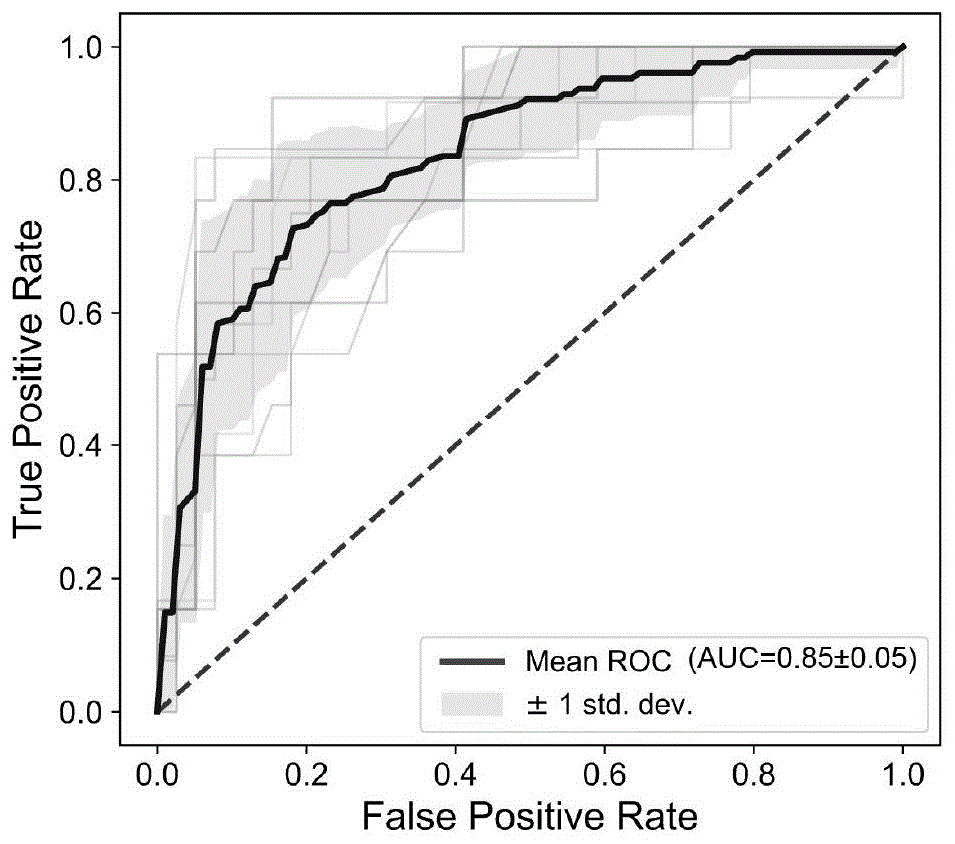
图1是迭代特征筛选后,使用最佳微生物群进行研究间交叉验证以及留一法验证结果。
图2是使用迭代特征筛选后,纳入模型AUC最佳微生物群特征的10折交叉验证的ROC曲线和曲线下最大面积AUC值。
图3.使用外部数据对训练集来源的随机森林模型进行验证。
具体实施方式
下面结合附图和具体的实施例来对本发明一种预测免疫治疗疗效相关的肠道微生物模型及其构建方法作进一步地详细阐述,以求更为清楚明了地理解其结构类型和使用方式,但不能以此来限定本发明专利的保护范围。
实施例1实验方法
使用新收泛癌队列进行外部验证
患者招募及临床样本收集
招募欲在临床行免疫治疗(抗PD-1和/或PD-L1抗体药物)的患者(泛癌种)患者共计150名,患者招募具体如下:
【纳入标准】1)经组织病理学明确诊断的肿瘤患者;2)有明确可测量病灶;3)门诊及住院临床资料清晰可查,能规律入院进行疗效评估(包括核磁共振、胸腹增强CT及骨显像等影像学资料);4)接受肿瘤免疫检查点抑制剂药物如抗PD1/PD-L1抑制剂等治疗的肿瘤患者。
【排除标准】1)既往3个月内患有全身严重感染、鼻咽及口腔炎症(如牙周炎、牙龈炎、扁桃体炎等)、呼吸道感染、软组织或皮肤感染、脓肿、心内膜炎;2)既往3个月内使用过以下药物:抗生素、非甾体类抗炎药、益生菌、激素、免疫抑制剂超过1周;3)既往有严重便秘、腹泻,或3个月内排便习惯发生较大变化;4)既往有肿瘤个人史(口腔癌、咽喉癌、食管癌等)、器官移植史,或严重的寄生虫病史、消化系统其他疾病史(如炎症性肠病、肝硬化等);5)3个月内患有创伤史、手术史等;6)既往3个月内存在消化性出血、梗阻、穿孔等情况;7)未受到良好控制的慢性代谢性、感染性或内分泌疾病(如高血压、糖尿病、高血脂、高尿酸、高嘌呤、甲状腺功能异常等);8)素食主义者或3个月内用餐习惯发生较大改变。
收集每位患者在接受免疫治疗前的基线样本数据(包括血浆、粪便标本)以及相应的临床信息(包括性别/年龄/体脂数/基础疾病/组织病理特点等),并纵向地在每一次治疗周期末收集一次粪便,建立免疫治疗样本库,部分患者收集初诊时的肿瘤组织标本(包括活检及手术标本);粪便标本采集方法如下:为防止收集的粪便受到尿液的污染,嘱研究对象排尿干净后再收集粪便。粪便标本质量至少5-10g,采集后的粪便标本保存于一次性无菌容器中,置于阴凉处(避免光照或高温),即刻迅速冻存于-80℃冰箱。
结果:最终总共收集来自接受抗PD-1/PD-L1抗体药物免疫治疗共计150名患者;对符合要求的患者粪便进行宏基因组测序分析。具体如下:
宏基因组测序技术及数据分析
1.粪便DNA提取:
采用HiPure Stool DNA Mini Kit提取试剂盒(中国)提取100-200mg粪便样本中总微生物基因组DNA。DNA提取物放-80℃冰箱保存。
2.DNA片段化(超声打断基因组DNA)
1)基因组DNA定量;1-500ng基因组DNA(50ul体系)
2)超声打断基因组DNA;50ul基因组DNA超声打断到250~300bp,超声打断仪工作条件;4℃水温,超声30s间隔30s,3个循环后取出样本,漩涡震荡混匀;取50ul使用1XVAHTSDNA Clean Beads进行纯化(70%乙醇洗两遍),加54ul水洗脱50ul。
3.DNA建库
步骤一:End Preparation
这一步骤将Input DNA末端补平,并在5’端进行磷酸化和3’端加dA尾。
1)将下表试剂解冻后颠倒混匀,于灭菌PCR管中配制如下反应:
2)使用移液器轻轻吹打混匀(请勿振荡混匀),并短暂离心将反应液收集至管底。
3)将PCR管置于PCR仪中,进行下述反应:
步骤二:Adapter Ligation
这一步骤将在End Preparation产物末端连接Adapter。
1)根据Input DNA量按Table 2稀释Adapter至合适浓度。
2)将Rapid Ligation buffer解冻后颠倒混匀,置于冰上备用。
3)在End Preparation步骤PCR管中配制如下反应:
4)使用移液器轻轻吹打混匀(请勿振荡混匀),并短暂离心将反应液收集至管底。
5)将PCR管置于PCR仪中,进行下述反应:
6)使用VAHTSDNA Clean Beads对反应产物进行纯化:
i.磁珠平衡至室温后,涡旋振荡混匀VAHTSDNA Clean Beads。
ii.吸取60ul VAHTSDNA Clean Beads至110ul Adapter Ligation产物中,涡旋振荡或使用移液器轻轻吹打10次充分混匀。
iii.室温孵育5min。
iv.将PCR管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约5min),小心移除上清。
v.保持PCR管始终置于磁力架中,加入200ul新鲜配制的80%乙醇漂洗磁珠,室温孵育30s,小心移除上清。
vi.重复步骤v,总计漂洗两次。保持PCR管始终置于磁力架中,开盖空气干燥磁珠5mins至无乙醇残留。vii.加23ul水,洗脱出20ul。
步骤三:PCR富集文库
1)将PCR Primer Mix 3、VAHTS HiFi Amplification Mix解冻后颠倒混匀,于灭菌PCR管中配制如下反应:
2)使用移液器轻轻吹打混匀(请勿振荡混匀),并短暂离心将反应液收集至管底。
3)反应结束后取3ul跑琼脂糖凝胶电泳,鉴定条带情况。
3)VAHTSDNA Clean Beads对反应产物进行纯化:
i.磁珠平衡至室温后,涡旋振荡混匀VAHTSDNA Clean Beads。
ii.吸取45ul VAHTSDNA Clean Beads至50μl Library Amplification产物中,涡旋振荡或使用移液器轻轻吹打10次充分混匀;
iii.室温孵育5min;
iv.将PCR管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约5min),小心移除上清;
v.保持PCR管始终置于磁力架中,加入200ul新鲜配制的80%乙醇漂洗磁珠,室温孵育30s,小心移除上清;
vi.重复步骤v,总计漂洗两次;
vii.保持PCR管始终置于磁力架中,开盖空气干燥磁珠5mins至无乙醇残留;
viii.将PCR管从磁力架中取出,加水洗33ul洗脱出30ul;
ix.文库定量并保存在-20度冰箱冻存。
质量检测
上机合格标准:核酸质量≥100ng以上,浓度大于2ng/μl,体积大于10μl。琼脂糖电泳条带片段大小≥500bp。
Illumina Nova6000测序
使用Nova6000(美国illumnia公司)上机;运行2天下机;原始数据转换成Fastq格式;
Illumina Novo-seq 6000测序及原始数据处理分析
委托上海逆耳生物科技有限公司采用Illumina Novaseq 6000平台对所有宏基因组文库进行双端测序。平均每个样本的测序下机数据量为11.9GB。对上机测序结果处理具体如下:然后使用Illumina Novaseq 6000平台采取2x150 bp双端测序策略进行测序。原始数据使用Trimmomatic过滤后通过Bowtie2与人类基因组(Homo sapiens genome assemblyhg37)进行比对,去除宿主DNA序列得到肠道菌群宏基因组学DNA序列,然后mOTUs2.0估计每个样品在不同物种水平(门phylum、纲class、目order、科family、属genus、种specie)的物种构成和丰度。
使用DIAMOND算法将肠道菌群宏基因组DNA序列与UniRef90数据库进行比对,使用HUMAnN2分层检索策略计算出每个样本在KEGG Orthologous(Kyoto Encyclopedia ofGenes and Genomes Orthologous)数据库的相对丰度。
验证结果
使用新收集粪便宏基因组数据队列(N=150),计算肠道菌群相对丰度,筛选出模型中16个特征性微生物群,利用训练集来源的模型分类器对每个患者对免疫检查点抑制剂响应度可能性进行预测,并计算训练数据集基于随机森林模型分类器曲线下最大面积(AUC=0.85)。提示发明者所开发的基于16个肠道微生物特征预测接受免疫检查点抑制剂的患者对免疫检查点抑制剂治疗疗效的模型具有一定可行性和可重复性。
图1是使用迭代特征筛选后,纳入模型AUC最佳微生物群特征的10折交叉验证的ROC曲线和曲线下最大面积AUC值。
图2是迭代特征筛选后,使用最佳微生物群进行研究间交叉验证以及留一法验证结果。
图3是使用外部数据对训练集来源的模型预测评分进行验证结果。
实施例2
本发明的目的在于挖掘开发高效新型生物标志物,提供一组用于预测ICIs药物疗效的肠道菌群标志物模型及其构建方法,能够基于基线肠道微生物多样性水平对使用免疫检查点抑制剂药物(抗PD1/PD-L1抗体药物)患者进行预测并划分高低获益人群。同时进一步针对肠道菌群功能分析提出潜在的功能机制探索。
本发明通过对现有已发表的研究进行文献回顾:收集现有已发表的关于程序性死亡受体-1/程序性死亡配体-1(PD1/PD-L1)免疫检查点抑制剂治疗的相关研究(N>40)。所纳入的研究具体需满足以下要求:1.单纯接受抗PD1/PDL1抗体药物治疗的患者;2.研究可以提供详细的临床信息(特别是包括使用免疫治疗患者免疫治疗疗效结局);3.研究提供可下载分析的原始宏基因组测序数据。
混杂因素处理
鉴于不同研究所纳入的研究对象的人群特征(包括肿瘤类型,性别占比,年龄及BMI等)可能存在差异,同时不同研究队列上机测序的测序时间,测序平台,测序深度等都可能存在差异,研究对所获得的可能作为影响研究目的的诸多因素作为混杂因素进行处理,对影响较大的混杂因素分区间进行阻断,最终纳入研究数目(N>40)的研究队列作为训练集(N=568)。
重要微生物标志物筛选
考虑到“研究”所占据的混杂因素较大,发明人使用微生物组研究中异质性的统一管道元分析方法(MMUPHin)基于“研究”对微生物丰度矩阵进行批量校正。进一步使用R软件(V.4.1.2)中“coin”包中实现的双面阻断Wilcoxon秩和检验逐一针对单个微生物标记物计算差异丰度的显著性,最终纳入P值<0.05的65个与免疫治疗疗效相关的肠道微生物进行后续特征筛选和模型构建。
微生物特征筛选和模型构建
发明人通过对训练集收集的患者的微生物特征及免疫治疗疗效结局进行整合分析,针对训练集数据(N=568),发明人对纳入的61个与免疫治疗疗效相关的微生物标记物进行迭代特征筛选,利用机器学习算法——随机森林算法构建决策树模型,使用根节点数(N=501),每一子节点占据上一节点的10%。使用迭代特征提取出16个用于构建模型的最佳微生物特征,如图1所示,可使得受试者操作曲线(ROC)下平均曲线最大面积(AUC)达到0.85。
为进一步验证所筛选出的模型中16个重要微生物特征在不同研究中都能得到稳定的应用,如图2所示,发明人通过在训练集所有研究中进行队列之间的交叉验证(study-by-study cross-validation)以及留一研究验证法(leave-one-subject-out(LOSO)cross-validation)进一步评估了在模型在不同研究队列中的稳定性和可重复性。结果表明,发明人所筛选出的16个重要特征性微生物群在不同研究队列中都能得到较为稳定的应用。
微生物疗效预测评分及应用
发明人利用训练集数据,输入所筛选出的16个模型微生物特征丰度矩阵,使用RandomFroest中的predict()函数预测患者免疫检查点抑制剂治疗疗效获益概率,并得到连续性变量——疗效预测获益评分(Response score,简称为RS),利用约登指数(Youdenindex)计算训练集数据中疗效预测获益评分的截断值(RS=0.445071)。并利用此截断值(RS=0.445071)作为阈值用于后续外部验证模型的评估。
进一步,发明人利用新收集的150个患者的宏基因组数据对所建立的预测模型进行外部验证,使用模型中16个微生物的相对丰度计算新收病例免疫检查点抑制剂获益评分,将高于RS截断值0.445071的患者预测为治疗获益率较高的患者,反之则为获益率较低的患者。最终将预测值与实际结局进行比较,通过RS得分预测患者接受抗PD1/PD-L1抗体免疫治疗疗效的微生物模型曲线下最大面积可达0.84(图3)。
- 用于预测免疫治疗疗效的肠道菌群标志物及其应用
- 免疫治疗疗效预测标志物及预测模型构建与应用
