包含塞马格鲁肽或其药学上可接受的盐的缓释制剂组合物
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及缓释制剂组合物。
背景技术
胰高血糖素样肽受体激动剂(GLP-1RA)是一组用于治疗2型糖尿病的药物并且在降低血糖水平方面非常有效。与例如磺酰脲类或美格列奈类等较老的胰岛素促分泌剂相比,GLP-1RA的优点为引起低血糖的风险较低,但是缺点为作用时间较短。
例如2型糖尿病等慢性疾病的治疗需要长期给药,因此能够减轻患者的负担的长效药物是优选的,并且倾向于更多地使用给药间隔较长的药物。将Byetta(第一个GLP-1RA药物)开发为每日两次的注射制剂,然后开发了每日一次的注射制剂,由此领先于市场。最近,每周一次的注射产品占领了大部分市场。
由于GLP-1RA药物的巨大成功和普及,对药效持续时间更长的每月或更长时间一次的药物的需求正在增加,并且也需要对其的开发。然而,由于技术限制,尚未实现给药间隔长于每周一次的长效药物。
同时,正在开发使用可生物降解的聚合物的缓释制剂以实现长期缓释效果,但是在这些制剂的情况下,使用具有缓慢药物释放的可生物降解的聚合物来延长药物释放持续时间并且防止初期突释。结果,存在如下问题:给药后,药物在相当长的一段时间(最短2-3周并且最长1个月以上)不释放,或者药物的累积释放率为30%以下。
发明内容
发明要解决的问题
本发明的目的在于提供包括缓释微球的缓释制剂,其能够实现药物的长期缓释而没有初期突释,并且在具有优异的生物利用度的同时没有释放延迟(滞后期)。
本发明的另一目的在于提供用于生产包括缓释微球的缓释制剂组合物的方法,所述缓释制剂组合物能够实现药物的长期缓释而没有初期突释,并且在具有优异的生物利用度的同时没有滞后期。
用于解决问题的方案
1.一种缓释制剂组合物,其包括:包含塞马格鲁肽或其药学上可接受的盐和聚(丙交酯-共-乙交酯)的缓释微球;
其中以缓释微球的3重量%以上且小于9重量%的量包含塞马格鲁肽或其药学上可接受的盐,并且
其中聚(丙交酯-共-乙交酯)是特性粘度为0.14至0.24dL/g的低粘度PLGA和特性粘度为0.32至0.44dL/g的高粘度PLGA的混合物。
2.根据上述1所述的缓释制剂组合物,其中混合物中低粘度PLGA与高粘度PLGA的重量比为1:0.2~5。
3.根据上述1所述的缓释制剂组合物,其中高粘度PLGA中丙交酯与乙交酯的摩尔比为50:45~55。
4.根据上述1所述的缓释制剂组合物,其中缓释微球通过如下来制备:将塞马格鲁肽或其药学上可接受的盐和聚(丙交酯-共-乙交酯)溶解于冰醋酸中并且使用超声波喷雾喷嘴将其喷雾,然后使用干燥的空气使溶剂挥发。
5.根据上述4所述的缓释制剂组合物,其中超声波喷雾喷嘴的频率为60kHz。
6.根据上述1所述的缓释制剂组合物,其中,在给予SD大鼠之后,在24小时内小于5%的塞马格鲁肽释放,并且在2周内30%以上释放或在4周内60%以上释放。
7.根据上述1所述的缓释制剂组合物,其中将组合物以1~3个月的间隔给予受试者。
8.根据上述1所述的缓释制剂组合物,其中聚(丙交酯-共-乙交酯)为缓释微球的91~97重量%。
9.根据上述1所述的缓释制剂组合物,其中缓释微球的平均粒径为15至25μm。
10.根据上述1所述的缓释制剂组合物,其中组合物用于治疗糖尿病、肥胖、非酒精性脂肪性肝炎或退行性脑部疾病。
11.根据上述10所述的缓释制剂组合物,其中退行性脑部疾病为选自由帕金森病、阿尔茨海默病、亨廷顿病、卢伽雷病、克雅氏病、中风和多发性硬化组成的组中的任一种。
12.一种用于生产缓释制剂组合物的方法,该方法包括:通过将塞马格鲁肽或其药学上可接受的盐和聚(丙交酯-共-乙交酯)溶解于有机溶剂中来制备混合溶液;并且
将混合溶液干燥以获得微球,
其中聚(丙交酯-共-乙交酯)是特性粘度为0.14至0.24dL/g的低粘度PLGA和特性粘度为0.32至0.44dL/g的高粘度PLGA的混合物。
13.根据上述12所述的方法,其中混合物中低粘度PLGA与高粘度PLGA的重量比为1:0.2~5。
14.根据上述12所述的方法,其中高粘度PLGA中丙交酯与乙交酯的摩尔比为50:45~55。
15.根据上述12所述的方法,其中混合溶液的干燥通过喷雾干燥法进行。
16.一种用于治疗糖尿病、肥胖、非酒精性脂肪性肝炎或退行性脑部疾病的方法,其包括对受试者给予根据上述1至10中任一项所述的缓释制剂组合物。
发明的效果
本发明的缓释制剂组合物能够实现药物的长期缓释而没有初期突释。此外,在具有优异的生物利用度的同时没有释放延迟现象。
可以将本发明的缓释制剂组合物以1个月以上的间隔给予受试者。
附图说明
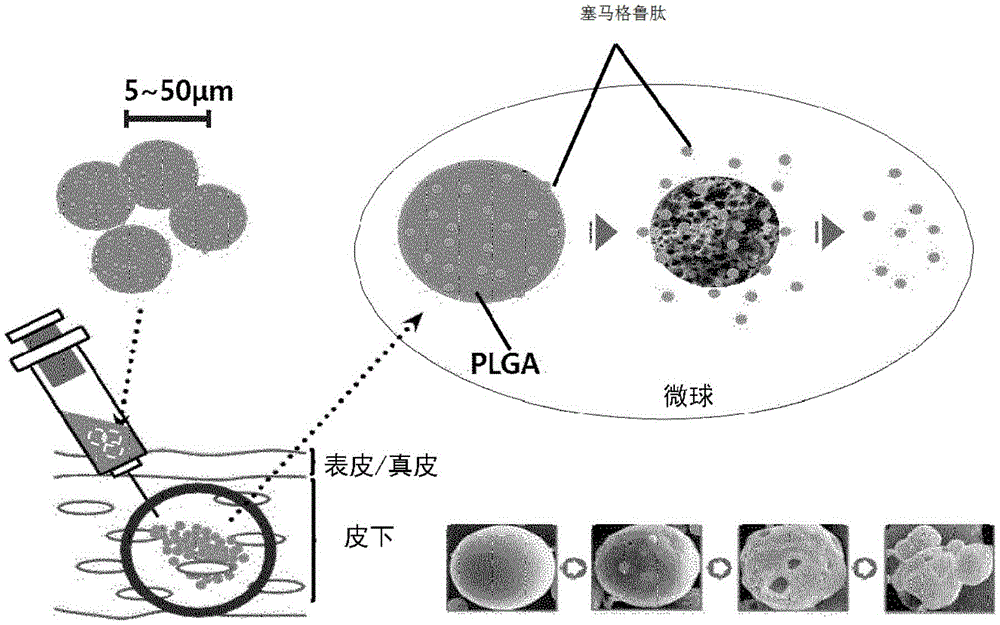
图1为简要地示出皮下注射本发明的缓释微球后塞马格鲁肽的释放的示意图。
图2分别示出实施例3和6和比较例1至4中制剂的缓释微球的体外初期释放评价结果(6小时后)。
图3示出在SD大鼠中皮下注射塞马格鲁肽和实施例3中的制剂的缓释微球(PT403)之后的线性时间依赖性降糖作用,其中注射后使用Accu-Chek测量血糖水平28天。
图4示出在对SD大鼠皮下注射塞马格鲁肽和实施例3中的制剂的缓释微球(PT403)之后体重的变化。
图5示出在对雄性8周龄的SD大鼠以4mpk的相同剂量给予塞马格鲁肽含量(装载量,LC)分别为3重量%、4重量%和6重量%(“wt.%”)的实施例3、4和6中的制剂之后随时间推移的血液中的药物浓度。
图6示出在对雄性8周龄的SD大鼠以4mpk的相同剂量给予塞马格鲁肽含量(装载量,LC)分别为3重量%、4重量%和6重量%的实施例3、4和6中的制剂之后随时间推移的塞马格鲁肽累积释放率。
图7示出在对雄性比格犬以4mpk的剂量给予实施例3中的制剂之后随时间推移的血液中的药物浓度。
图8示出在对雄性比格犬以4mpk的剂量给予实施例3中的制剂之后随时间推移的塞马格鲁肽累积释放率。
图9示出对雄性8周龄的大鼠以4mpk的相同剂量分别给予各自包含利拉鲁肽作为活性成分的比较例13和14中的制剂的微球之后随时间推移的血液中的药物浓度。
具体实施方式
本发明涉及包含塞马格鲁肽或其药学上可接受的盐的缓释微球以及包括其的组合物,所述缓释微球能够实现药物的长期缓释而没有初期突释,并且在具有优异的生物利用度的同时没有滞后期。
本发明提供一种缓释制剂组合物,其包括包含塞马格鲁肽或其药学上可接受的盐和聚(丙交酯-共-乙交酯)的缓释微球。
塞马格鲁肽为GLP-1受体激动剂,其可以如WO2006/097537、实施例4中所述来制备,并且也称为N
塞马格鲁肽的结构由下式1表示。
[式1]
本文中使用的“药学上可接受的盐”是指对患者相对无毒无害、不会由于由盐引起的副作用而降低塞马格鲁肽的有益功效的具有有效作用所需浓度的任何盐,并且可以为酸加成盐或碱加成盐。在塞马格鲁肽的药学上可接受的盐中,酸加成盐可以包括例如塞马格鲁肽的盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乙酸盐、乳酸盐、水杨酸盐、柠檬酸盐、酒石酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、富马酸盐、葡萄糖酸盐、葡萄糖醛酸盐、蔗糖盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、二葡萄糖酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、富马酸盐、盐酸盐、2-羟基乙磺酸盐(羟乙基磺酸盐)、烟酸盐、2-萘磺酸盐、草酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、苦味酸盐、新戊酸盐、丙酸盐、琥珀酸盐、酒石酸盐、硫氰酸盐、磷酸盐、谷氨酸盐或碳酸氢盐。
在塞马格鲁肽的药学上可接受的盐中,碱加成盐可以包括例如塞马格鲁肽的碱金属盐、碱土金属盐或季铵盐。
本发明的包含塞马格鲁肽或其药学上可接受的盐和聚(丙交酯-共-乙交酯)的缓释微球的重量可以在以下范围内:20至6000mg、20至4000mg、100至6000mg、100至4000mg、500至6000mg、500至4000mg、1000至6000mg、1000至4000mg、1500至6000mg、1500至4000mg、2000至6000mg、2000至4000mg、2400至6000mg、2400至4000mg、或2400至3600mg。
本发明的缓释微球中包含的塞马格鲁肽或其药学上可接受的盐基于缓释微球的总重量可以小于9重量%,优选3重量%以上且小于9重量%、或3重量%以上且8.8重量%以下、3重量%以上且8.5重量%以下、3重量%以上且8.2重量%以下、3重量%以上且8重量%以下、或3重量%以上且6重量%以下。当塞马格鲁肽或其药学上可接受的盐的含量为3重量%以上且10重量%以下时,生物利用度是优异的。然而,当塞马格鲁肽或其药学上可接受的盐的含量为9重量%以上时,初期释放率快速增加。因此,优选以基于缓释微球的总重量为3重量%以上且小于9重量%的量包含塞马格鲁肽或其药学上可接受的盐。
本发明的缓释微球中包含的聚(丙交酯-共-乙交酯)(PLGA)可以是特性粘度为0.14至0.24dL/g的低粘度PLGA和特性粘度为0.32至0.44dL/g的高粘度PLGA的混合物。在低粘度PLGA和高粘度PLGA的混合物中,特性粘度为0.14至0.24dL/g的低粘度PLGA与特性粘度为0.32至0.44dL/g的高粘度PLGA的重量比可以为1:0.2~5、1:0.2~3、1:0.3~5、1:0.3~3、1:0.5~5、1:0.5~3、1:0.5~2、1:1~5、1:1~3、1:1~2.5、1:1.5~2.5或1:1.8~2.2,并且优选1:1.8~2.2。
如果缓释微球中包含的聚(丙交酯-共-乙交酯)仅由低粘度PLGA构成,则塞马格鲁肽的初期释放量变得过大,并且如果其仅由高粘度PLGA构成,则存在如下问题:塞马格鲁肽的初期释放量小,但是可能会出现滞后期并且使总体释放量减少而使生物利用度劣化。
本发明的缓释微球可以包含其中混合有特性粘度为0.14至0.24dL/g的低粘度PLGA和特性粘度为0.32至0.44dL/g的高粘度PLGA的聚(丙交酯-共-乙交酯)混合物,优选低粘度PLGA和高粘度PLGA以1:0.2~5的重量比混合,并且更优选低粘度PLGA和高粘度PLGA以1:1.8~2.2的重量比混合,从而塞马格鲁肽的初期突释不发生,同时还没有滞后期但是具有优异的生物利用度。
本发明的聚(丙交酯-共-乙交酯)(PLGA)的特性粘度(IV)为在将其以0.1%(W/V)的浓度溶解于氯仿中之后使用乌氏粘度计在25℃下测得的粘度。
特性粘度为0.14至0.24dL/g的低粘度PLGA中丙交酯与乙交酯的摩尔比可以为80~45:50、80~70:50、75~50:50、70~45:50、65~50:50或55~45:50,并且优选55~45:50。在商购可得的材料中,特性粘度为0.14至0.24dL/g的低粘度PLGA的实例可以包括可从Evonik获得的RG502、RG502H、RG752H和RG752S。
特性粘度为0.32至0.44dL/g的高粘度PLGA中丙交酯与乙交酯的摩尔比可以为80~45:50、75~50:50、70~45:50、65~50:50或55~45:50,并且优选55~45:50。在商购可得的材料中,特性粘度为0.32至0.44dL/g的高粘度PLGA的实例可以包括可从Evonik获得的RG503、RG503H、RG653H、RG752H和RG753S。
本发明的缓释微球中包含的混合有特性粘度为0.14至0.24dL/g的低粘度PLGA和特性粘度为0.32至0.44dL/g的高粘度PLGA的聚(丙交酯-共-乙交酯)的混合物可以以基于微球的总重量为80重量%以上或90重量%以上、并且更具体地为90~99重量%、90~97重量%、90~96重量%、91~99重量%、91~97重量%、91~96重量%、92~99重量%、92~97重量%、92~96重量%、93~99重量%、93~97重量%、93~96重量%、94~99重量%、94~97重量%或94~96重量%的量来包含。
本发明的缓释微球可以包含例如3重量%以上且小于9重量%的塞马格鲁肽或其药学上可接受的盐和90~97重量%或91~97重量%的聚(丙交酯-共-乙交酯),此外,可以进一步包含额外的包衣材料、添加剂或赋形剂。
在将包含本发明的缓释微球的缓释制剂组合物给予Sprague Dawley大鼠(SD大鼠)之后,塞马格鲁肽在24小时内可释放5%以下,此外,在2周内释放30%以上或在4周内释放60%以上。
在本发明的一个实施方案中,在将本发明的缓释微球给予SD大鼠之后,确认到塞马格鲁肽在24小时内可释放5%以下、在2周内释放30%以上并且在4周内释放60%以上(图6和表7)。此外,确认到塞马格鲁肽在比格犬中在24小时内可释放5%以下、在2周内释放30%以上并且在4周内释放60%以上(图8和表8)。
可以将本发明的缓释微球用赖氨酸来包衣,并且施加至缓释微球的赖氨酸可以以基于100重量份包衣前的缓释微球为0.01至5重量份、0.01至3重量份、0.01至1重量份、或0.1至1重量份(parts by weight)(“重量份(wt.parts)”)并且优选0.2至0.8重量份或0.4至0.6重量份的量来包含。
取决于待给药的受试者,在单次给药的情况下,包括本发明的缓释微球的缓释制剂组合物可以维持作用持续3周或1个月以上,因此,本发明的缓释制剂组合物可以以1个月至2个月、1个月至1.5个月或1个月的间隔给药。
在本发明的一个实施方案中,确认到在对大鼠给予本发明的缓释微球之后,塞马格鲁肽持续释放3周以上(T last=35天)。此外,确认到在给予比格犬之后,塞马格鲁肽持续释放4周以上(T last=63天)。通常,根据作为待给药对象的动物物种,已知物种越大,则药物的吸收、分布、代谢等的时间越长,并且药物的释放和持续时间越长(异速增长(allometric scaling))。因此,在一个实施方案中,还确认到塞马格鲁肽的药物作用的持续时间在比格犬中比在大鼠中更长。出于同样的原因,当给予具有更大对象尺寸的人时,药物作用的持续时间比给予比格犬时更长。因此,当给予人类时,在一次给药的情况下,药物作用可以持续1个月以上,并且更具体地,药物作用可以持续1个月至3个月、1个月至2个月或1个月至1.5个月。
本发明的缓释微球的平均粒径可以为5~50μm、5~40μm、5~30μm、10~50μm、10~40μm、10~30μm、10~25μm、15~50μm、15~40μm、15~30μm、或15~25μm。如本文中所使用的,“平均粒径(D50)”意指粒度分布曲线中对应于体积%的50%的粒径。
本发明的缓释微球的跨度值为2以下,并且更具体地,跨度值可以为0.1~2、0.1~1.8、0.3~2、0.3~1.8、0.5~2、0.5~1.8、0.8~2、0.8~1.8、1~2、1~1.8、或1~1.6。
本发明的缓释微球或包括其的缓释制剂组合物可以进一步包括本发明所属领域中常用于药物制剂的添加剂和赋形剂。
本发明的缓释微球可以进一步包括选自由聚乙烯醇、白蛋白、聚乙烯基吡咯烷酮和明胶等组成的组中的至少一种保护胶体。保护胶体材料用于防止包含塞马格鲁肽的微球之间的聚集并且改善分散性。保护胶体的含量基于缓释微球的总重量优选为0.02~1.0重量%。
根据本发明的包括缓释微球的缓释制剂组合物可以用于治疗糖尿病、肥胖、非酒精性脂肪性肝炎(NASH)或退行性脑部疾病。
退行性脑部疾病可以为选自由帕金森病、阿尔茨海默病、亨廷顿病、卢伽雷病、克雅氏病、中风和多发性硬化组成的组中的任一种。
本发明的缓释微球可以通过如下来制备:将塞马格鲁肽或其药学上可接受的盐和聚(丙交酯-共-乙交酯)溶解于冰醋酸中,通过超声波喷雾喷嘴将其喷雾,然后使用干燥的空气使溶剂挥发。
本发明提供用于生产缓释微球的方法,所述缓释微球能够实现药物的长期缓释而没有初期突释,并且在具有优异的生物利用度的同时没有滞后期。
用于生产本发明的缓释制剂组合物的方法可以包括:通过将塞马格鲁肽或其药学上可接受的盐和聚(丙交酯-共-乙交酯)溶解于有机溶剂中来制备混合溶液,并且将混合溶液干燥以获得微球。
在用于生产本发明的缓释制剂组合物的方法中,与塞马格鲁肽或其药学上可接受的盐一起溶解的聚(丙交酯-共-乙交酯)的种类可以与如上针对本发明的缓释微球所述基本上相同。
关于用于生产本发明的缓释制剂组合物的方法,可以适当地调整溶解在有机溶剂中的塞马格鲁肽与聚(丙交酯-共-乙交酯)的重量比,以使所制备的缓释微球中的塞马格鲁肽的含量变为小于9重量%,并且优选3重量%以上且小于9重量%、3重量%以上且8.8重量%以下、3重量%以上且8.5重量%以下、3重量%以上且8.2重量%以下、3重量%以上且8重量%以下、或3重量%以上且6重量%以下。
有机溶剂可以为选自由氯仿、乙酸乙酯、二氯甲烷、甲乙酮、具有1至5个碳原子的醇、冰醋酸、甲酸、二甲亚砜和N-甲基吡咯烷酮组成的组中的一种或其混合溶剂,并且优选冰醋酸。
关于用于生产本发明的缓释制剂组合物的方法,可以使用喷雾干燥法作为通过将混合溶液干燥来获得微球的方法。
喷雾干燥法可以通过如下来进行:将其中溶解有塞马格鲁肽或其药学上可接受的盐和聚(丙交酯-共-乙交酯)的混合溶液以5~20mL/min、5~15mL/min或5~10mL/min的流速供给至喷雾干燥器,然后给送100~200℃、100~150℃或120~150℃的干燥的空气。此外,喷雾干燥器的频率可以为40~80kHz、50~70kHz或55~75kHz,并且优选60kHz。
用于生产本发明的制剂组合物的方法可以在将混合溶液干燥以获得微球的步骤之后进一步包括通过将干燥的微球悬浮在包含溶解在其中的盐酸赖氨酸的水溶液中的赖氨酸包衣。
包含溶解在其中的盐酸赖氨酸的水溶液中的盐酸赖氨酸的浓度可以为0.01M至1M,并且优选0.1M至0.6M。当盐酸赖氨酸的浓度低于0.01M时,微球的表面无法充分地用赖氨酸包衣。另一方面,当浓度高于1M时,盐酸赖氨酸过饱和,这是效率低下的。
此外,包含溶解在其中的盐酸赖氨酸的水溶液可以进一步包含1%(W/V)聚乙烯醇。
本发明提供用于治疗糖尿病、肥胖、非酒精性脂肪性肝炎或退行性脑部疾病的方法,其包括:对受试者给予根据本发明的包括缓释微球的缓释制剂组合物。
退行性脑部疾病可以为选自由帕金森病、阿尔茨海默病、亨廷顿病、卢伽雷病、克雅氏病、中风和多发性硬化组成的组中的任一种。
本发明的包括缓释微球的缓释制剂组合物可以经由口服或肠胃外途径给药,并且优选经由肠胃外途径例如静脉内给药、皮下给药、肌内给药或腹膜内给药。
根据本发明的缓释制剂组合物的有效剂量可以基于患者的年龄、疾病的类型和严重程度以及患者的病况来适当地调整。例如,其可以为基于活性成分的量为0.1~10mg/周。剂量可以一次性给予或以分次剂量给予。
下文中,将通过实施例更详细地描述本发明。
制备例:缓释微球的制备和制备的微球的粒径
1)缓释微球的制备(实施例1-6和比较例1-12)
将作为GLP-1激动剂的塞马格鲁肽和作为可生物降解的聚合物的聚(乳酸-共-乙醇酸)(PLGA)或聚(乳酸)PLA完全溶解于冰醋酸中以获得混合溶液,然后进行喷雾干燥法以制备微球。用于制备微球的可生物降解的聚合物的种类在下表1中示出,并且用于制备各种包含塞马格鲁肽的微球的组合物在下表2中示出。对于PLGA,使用从Evonik商购可得的Resomers。如下表1中所述,PLGA75A、PLGA75B、PLGA65B、PLGA50A和PLGA50B分别表示所使用的RG752H、RG753H、RG653H、RG502H和RG503H,其为从Evonik商购可得的Resomers。
[表1]
喷雾干燥法通过如下来进行:使用液体蠕动泵(Master flex)将所制备的混合溶液以7.5mL/min的流速给送至装配有超声波喷嘴(Sonictopia,60kHz)的喷雾干燥器(EIN系统),在50%和75%之间调节振荡器(Sonictopia,60kHz)的功率,并且供给135℃的干燥空气。将通过喷雾干燥法制备的微球分散在包含1%(W/V)聚乙烯醇(Mitsubishi ChemicalCorporation)和0.5M L-盐酸赖氨酸(Merck)作为保护胶体的水溶液中,然后搅拌3小时。此后,通过过滤来收集微球并且将其用蒸馏水洗涤,通过向其中添加10% D-甘露醇(ROQUETTE)和0.5% L-盐酸赖氨酸(Merck)溶液来使其悬浮,然后冻干以获得本发明的缓释微球。表2示出用于各缓释微球制剂的可生物降解的聚合物的种类和混合比。
[表2]
表3示出用于通过喷雾干燥法来制备缓释微球的可生物降解的聚合物(PLGA和PLA)、药物(塞马格鲁肽)和溶剂的量。
[表3]
2)所制备的微球的粒径的测量
定量地测量所制备的微球的平均粒径和分布。具体地,将180mg微球和10mL 1%PVA导入50mL锥形管中,然后给送至超声波发生器中1分钟以使其分散,然后将产物置于粒径分析仪(CILAS,French)中以测定粒径。作为粒径均匀性的指标,跨度值通过以下等式1来计算。
[等式1]
跨度值=(D90-D10)/D50
表4示出所制备的微球的平均粒径和跨度值。
[表4]
实验例1:微球的体外释放的测量
将包含100μg塞马格鲁肽的微球悬浮于其中包含3mL释放溶液(0.5%PVA+0.1M磷酸盐缓冲液(pH 7.0))的玻璃容器中,并且密封以防止水的泄漏。然后,将容器置于预热至37℃的水中,然后使其以20rpm的速度旋转。在经过预定的时间之后,收集样品并且进行HPLC分析。结果,确认到表现出的初期释放率取决于药物装载量以及可生物降解的聚合物的种类和混合比而不同。
通常,证实了初期释放随着药物含量更高而逐渐增加,并且当药物含量超过9%时,初期释放快速增加(参见图2)。因此,可以确定,在没有快速的初期释放的情况下,微球中药物的最大装载量小于9%(w/w)。
表5在以下示出取决于药物(塞马格鲁肽)装载量的初期释放变化(体外释放实验,在经过6小时和24小时之后)。
[表5]
在仅使用低粘度聚合物或使用两种不同低粘度聚合物的混合物的情况下,可以看出初期释放高(比较例5、6、9、11和12)。另一方面,当使用高粘度聚合物时,初期释放低(比较例7、8和10)。此外,当使用高粘度聚合物和低粘度聚合物的混合物时,还可以看出初期释放低(实施例1、2和3)。表6示出取决于聚合物的种类及其混合比的初期释放变化(体外释放实验,在经过24小时之后)。
[表6]
如上表6所述,在由高粘度聚合物构成的微球的情况下,初期释放低,但是滞后期变得更长并且总释放量低,由此导致低的生物利用度。结果,i)没有初期突释,ii)长期缓释是可能的,iii)没有滞后期,并且iv)不适合作为具有优异的生物利用度的缓释制剂的组分。另一方面,在混合和使用高粘度聚合物和低粘度聚合物的情况下,确认到可以防止初期突释,并且研究大鼠中的PK特征以确定是否可以抑制延迟释放(参见实验例3)。
实验例2:针对包含塞马格鲁肽的缓释微球的血糖控制和体重减轻效果的实验(体内实验)
进行口服葡萄糖耐量试验(OGTT)来确认本发明的包含塞马格鲁肽的缓释微球的降血糖作用。首先,通过将8周龄的SD大鼠(18只大鼠;每组中6只大鼠)分为3组来进行实验。分为阴性对照组(对照)、阳性对照组(API)和实施例3制剂给药组(PT403)),其中阳性对照组(API)皮下注射一次0.123mpk的塞马格鲁肽,并且实施例3制剂给药组(PT403)皮下注射实施例3制剂4mpk。
给药后,进行总计5次OGTT(第1天、第7天、第16天、第21天和第28天),并且将2g/kg葡萄糖口服给予禁食18小时的SD大鼠。给予葡萄糖之后即刻和在15、30、60、90、120和180分钟之后,从尾部采血以测量血糖。
如图3中所示,给予实施例3的制剂(PT403)的组引起葡萄糖水平以时间依赖性方式降低,并且,特别地,维持降血糖作用直至约第21天。另一方面,阳性对照组(API)在第1天具有降血糖作用,但是在第7天恢复常态(图3)。此外,与OGTT分析并行,随时间推移测量每只大鼠的体重,并且实施例3制剂给药组(PT403)与阳性对照组(API)以及阴性对照组相比显示约10%的统计学上显著的体重减轻(图4)。
因此,可以看出本发明的包含塞马格鲁肽的缓释制剂组合物为仅单次给药即能够长时间维持效果的制剂。
实验例3:缓释微球在大鼠中根据塞马格鲁肽含量的药代动力学特征(实施例3、4和6的制剂)
将包含塞马格鲁肽的微球给予8周龄的SD大鼠,并且以规律的时间间隔采血以评价血液中的药物浓度和评价微球中的药物在体内的释放模式。用于PK实验的制剂为实施例3、4和6的制剂。给予大鼠的药物(塞马格鲁肽)的量为相同的4mpk,而无论何种制剂。
在对8周龄的雄性SD大鼠皮下(SC)注射实施例3、4和6的制剂之后,随时间推移观察血液中的塞马格鲁肽浓度。在注射后1小时、3小时、6小时、24小时、第3天、第5天、第7天、第9天、第11天、第14天、第16天、第18天、第21天、第24天、第28天、第31天和第35天,从颈静脉采集0.5ml血液并且在-80℃下保存。此后,进行LC-MS/MS分析。
通过由随时间推移的血药浓度曲线(图5)计算曲线下面积(AUC)来比较相对生物利用度。结果,确认到生物利用度随着药物含量增加而增加。特别地,确认到塞马格鲁肽的含量为6重量%的实施例6的微球显示出最佳生物利用度。
表7示出实施例3、4和6的在SD大鼠中的PK参数,而表8示出塞马格鲁肽的累积释放率。
[表7]
[表8]
实验例4:包含塞马格鲁肽的缓释微球在比格犬中的药代动力学特征(实施例3的制剂)
在大鼠之后,作为用于比格犬中的PK实验的制剂,使用实施例3的制剂。此外,给予的药物的量为与实验例3中相同的4mpk。
在对雄性比格犬皮下(SC)注射实施例3的制剂之后,随时间推移观察血液中的塞马格鲁肽浓度。在注射后1小时、3小时、6小时、24小时、或第3天、第5天、第7天、第9天、第11天、第14天、第16天、第18天、第21天、第23天、第25天、第28天、第31天、第35天、第38天、第42天、第45天、第49天、第56天、第63天和第70天,从颈静脉采集1ml血液并且在-80℃下保存。此后,进行LC-MS/MS分析。
通过由随时间推移的血药浓度曲线(图7)计算曲线下面积(AUC)来比较相对生物利用度。此外,在比格犬中确认到,与SD大鼠相比,塞马格鲁肽的释放持续时间更长。
表9示出实施例3的制剂在比格犬中的PK参数,而表10示出塞马格鲁肽的累积释放率。
[表9]
[表10]
实验例5:包含利拉鲁肽的缓释微球在大鼠中的药代动力学特征
除了代替包含塞马格鲁肽的实施例3的制剂将包含利拉鲁肽的比较例13和14的制剂皮下(SC)注射至大鼠、然后观察随时间推移血液中的利拉鲁肽浓度以外,进行与实验例3中相同的过程。
表11示出比较例13和14的制剂的组分。
[表11]
在注射后1小时、3小时、24小时、或第3天、第5天、第7天、第9天、第11天、第14天、第17天、第21天、第24天和第28天,从颈静脉采集0.5ml血液并且在-80℃下保存。此后,进行LC-MS/MS分析以通过由随时间推移的血药浓度曲线(图9)计算曲线下面积(AUC)来比较相对生物利用度。
结果,虽然利拉鲁肽为具有与本发明的塞马格鲁肽相似的结构的同一GLP-1RA家族的肽,但是几乎没有观察到其自身的药物释放。由此,可以看出即使在相同条件下使用可生物降解的聚合物也难以预期在所包含的肽的种类不同时会表现出何种效果。
- 用于激光束加工的模具、激光束加工装置和用于激光束加工的方法
- 一种激光冲击强化曲面结构的方法
- 一种激光光束终端指向检测与校正方法及激光加工装置
- 一种末端带光热材料的可更换激光刀头及激光治疗装置
- 一种大型结构现场激光冲击强化的末端动光束装置
- 一种移动式动光束激光冲击强化设备及强化方法
