用于调节叉头框P3(FOXP3)基因表达的组合物和方法
文献发布时间:2024-04-18 20:01:23
相关申请
本申请要求于2020年3月11日提交的美国临时申请号62/988,044的优先权权益,其全部内容通过引用并入本文。
序列表
本申请包含已以ASCII格式电子提交并通过引用全文并入本文的序列表。所述ASCII副本创建于2021年3月10日,其被命名为131717-00420_SL.txt,且其大小为1,166,669字节。
背景技术
健康的免疫系统保护身体以抵抗疾病和感染。但是如果免疫系统出现故障,它会错误地攻击健康的细胞、组织和器官。这些以自身免疫性疾病或病症为特征的攻击可以影响身体的任何部分,削弱身体功能,甚至危及生命。一些较常见的自身免疫性疾病包括IPEX综合征(IPEX)、1型糖尿病、多发性硬化、系统性红斑狼疮(SLE)和类风湿性关节炎(RA)。
总的来说,这些疾病影响美国超过2400万人(参见,Progress in AutoimmuneDiseases Research,https://www.niaid.nih.gov/sites/de fault/files/adccfinal.pdf)。另有八百万人具有指示一个人可能患自身免疫性疾病的机会的自身抗体、血液分子。自身免疫性疾病正变得越来越普遍。
治疗取决于疾病,但在大多数情况下,一个重要的目标是减轻炎症。皮质类固醇或其他降低免疫反应的药物通常是处方药。
调节性T细胞(Treg)是起到抑制免疫反应的作用的特定T细胞亚群,从而维持体内平衡和自身耐受性。研究表明,Treg能够抑制T细胞增殖和细胞因子产生,并且在预防或治疗自身免疫性疾病中起重要作用。叉头框(Forkhead box)P3(FOXP3)是控制天然T细胞分化成调节性T细胞(Treg)的主要转录因子,并且已经显示出FOXP3的强制过表达赋予T细胞以Treg表型。
Treg的体外产生已经是靶向自身免疫性病症的离体疗法领域内的一项重要工作。但是,许多产生Treg的策略既不能引起导致Treg的基因的持续表达,也不产生具有抑制表型的Treg。
因此,本领域需要治疗自身免疫性疾病如IPEX综合征的组合物和方法。
发明内容
本发明提供用于通过靶向FOXP3表达控制区来调节叉头框P3(FOXP3)基因的表达(例如,增加或降低表达)的试剂和组合物。FOXP3基因可以存在于细胞,例如哺乳动物细胞,如哺乳动物体细胞(例如人或小鼠体细胞,例如天然T细胞)中。本发明还提供使用本发明的试剂和组合物调节将受益于调节FOXP3基因的表达的受试者(例如患有或易患FOXP3相关疾病的受试者)体内FOXP3基因的表达或治疗所述受试者的方法。
因此,在一个方面,本发明提供位点特异性叉头框P3(FOXP3)破坏剂,其包含靶向FOXP3表达控制区的位点特异性FOXP3靶向部分。
在一个实施方案中,位点特异性FOXP3靶向部分包含聚合物分子。聚合物分子可以包括聚酰胺、多核苷酸、编码特异性结合FOXP3表达控制区的DNA结合域或其片段的多核苷酸、或肽核酸(PNA)。
在另一个实施方案中,表达控制区包含FOXP3转录起始位点(TSS)上游的区域。
在一些实施方案中,表达控制区包含在含有第一和第二FOXP3相关锚定序列的锚定序列介导的结合体(conjunction)内的一个或多个FOXP3相关锚定序列。
在另一个实施方案中,FOXP3相关锚定序列包含CCCTC结合因子(CTCF)结合基序。
在另一个实施方案中,FOXP3相关锚定序列介导的结合体包含所述结合体内部的一个或多个转录控制元件。在一个实施方案中,FOXP3相关锚定序列介导的结合体包含所述结合体外部的一个或多个转录控制元件。
在一个实施方案中,FOXP3相关锚定序列位于转录控制元件的约500kb内。在另一个实施方案中,FOXP3相关锚定序列位于转录控制元件的约300kb内。在另一个实施方案中,锚定序列位于转录控制元件的10kb内。
在另一个实施方案中,表达控制区包含FOXP3特异性转录控制元件。在另一个实施方案中,转录控制元件包含FOXP3启动子。在另一个实施方案中,转录控制元件包括转录增强子。在另一个实施方案中,转录控制元件包括转录阻遏物。
在一个实施方案中,位点特异性FOXP3破坏剂包括与表2中任何一个核苷酸序列的完整核苷酸序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%核苷酸同一性的核苷酸序列。
在另一个实施方案中,位点特异性FOXP3破坏剂包含编码特异性结合FOXP3表达控制区的锌指多肽(ZNF)或转录激活物样效应物(TALE)多肽的DNA结合域或其片段的多核苷酸。
在一个实施方案中,TALE或ZNF多肽的DNA结合域包含与表1B中所列的任何一个氨基酸序列的完整氨基酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸同一性的氨基酸序列。
在另一个实施方案中,位点特异性FOXP3破坏剂包括核苷酸修饰,例如,脱氧核苷酸、3’-末端脱氧胸腺嘧啶(dT)核苷酸、2’-O-甲基修饰的核苷酸、2’-氟代修饰的核苷酸、2’-脱氧修饰的核苷酸、脱碱基核苷酸、包含5’-硫代磷酸酯基的核苷酸、包含5’-甲基膦酸酯基的核苷酸、包含3’-硫代磷酸酯基的核苷酸或包含3’-甲基膦酸酯基的核苷酸。
在另一个实施方案中,聚合物分子包含肽核酸(PNA)。
在一个方面,本发明提供一种载体。所述载体包含本文描述的发明的上述方面或任何其他方面的各种实施方案的位点特异性FOXP3破坏剂。在一个实施方案中,载体是病毒表达载体。
在另一个方面,本发明提供一种细胞。所述细胞提供本文描述的发明的上述方面或任何其他方面的各种实施方案的位点特异性FOXP3破坏剂或载体。
在一个实施方案中,位点特异性FOXP3破坏剂存在于组合物中。在另一个实施方案中,组合物包括药物组合物。在另一个实施方案中,药物组合物包括脂质制剂。在又一个实施方案中,脂质制剂包含一种或多种阳离子脂质、一种或多种非阳离子脂质、一种或多种基于胆固醇的脂质、或一种或多种PEG修饰的脂质、或前述的任何组合。在一个实施方案中,药物组合物包括脂质纳米颗粒。
在另一个方面,本发明提供位点特异性FOXP3破坏剂。位点特异性FOXP3破坏剂包含编码融合蛋白的核酸分子,所述融合蛋白包含靶向FOXP3表达控制区的位点特异性FOXP3靶向部分和效应物分子。
在一个实施方案中,位点特异性FOXP3靶向部分包含编码特异性结合FOXP3表达控制区的锌指多肽(ZNF)或转录激活物样效应物(TALE)多肽的DNA结合域或其片段的多核苷酸。
在另一个实施方案中,效应物分子包含多肽或编码多肽的核酸分子。在又一个实施方案中,融合蛋白包含肽-核酸融合物。
在又一个实施方案中,效应物选自由核酸酶、物理阻断剂、表观遗传募集剂和表观遗传CpG修饰剂及前述的任何组合组成的组。
在一个实施方案中,效应物包括CRISPR相关蛋白(Cas)多肽或编码Cas多肽的核酸分子。在另一个实施方案中,Cas多肽是无酶活性的Cas多肽。在另一个实施方案中,位点特异性FOXP3破坏剂还包括人核酸外切酶1(hEXO1)的催化活性结构域。
在另一个实施方案中,表观遗传募集剂包含转录增强子或转录阻遏物。
在一个实施方案中,转录增强子是VPR(VP64-p65-Rta)。
在一个实施方案中,VPR包含与DALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLSGGPKKKRKVGSQYLPDTDDRHRIEEKRKRTYETFKSIMKKSPFSGPTDPRPPPRRIAVPSRSSASVPKPAPQPYPFTSSLSTINYDEFPTMVFPSGQISQASALAPAPPQVLPQAPAPAPAPAMVSALAQAPAPVPVLAPGPPQAVAPPAPKPTQAGEGTLSEALLQLQFDDEDLGALLGNSTDPAVFTDLASVDNSEFQQLLNQGIPVAPHTTEPMLMEYPEAITRLVTGAQRPPDPAPAPLGAPGLPNGLLSGDEDFSSIADMDFSALLGSGSGSRDSREGMFLPKPEAGSAISDVFEGREVCQPKRLRPFHPPGSPWANRPLPASLAPTPTGPVHEPVGSLTPAPVPQPLDPAPAVTPEASHLLEDPDEETSQAVKALREMADTVIPQKEEAAICGQMDLSHPPPRGHLDELTTTLESMTEDLNLDSPLTPELNEILDTFLNDECLLHAMHISTGLSIFDTSLF(SEQ ID NO:64)的完整氨基酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸同一性的氨基酸序列。
在一个实施方案中,转录增强子包含2个、3个、4个或5个VPR。
在一个实施方案中,转录增强子是p300。
在一个实施方案中,p300包含与IFKPEELRQALMPTLEALYRQDPESLPFRQPVDPQLLGIPDYFDIVKSPMDLSTIKRKLDTGQYQEPWQYVDDIWLMFNNAWLYNRKTSRVYKYCSKLSEVFEQEIDPVMQSLGYCCGRKLEFSPQTLCCYGKQLCTIPRDATYYSYQNRYHFCEKCFNEIQGESVSLGDDPSQPQTTINKEQFSKRKNDTLDPELFVECTECGRKMHQICVLHHEIIWPAGFVCDGCLKKSARTRKENKFSAKRLPSTRLGTFLENRVNDFLRRQNHPESGEVTVRVVHASDKTVEVKPGMKARFVDSGEMAESFPYRTKALFAFEEIDGVDLCFFGMHVQEYGSDCPPPNQRRVYISYLDSVHFFRPKCLRTAVYHEILIGYLEYVKKLGYTTGHIWACPPSEGDDYIFHCHPPDQKIPKPKRLQEWYKKMLDKAVSERIVHDYKDIFKQATEDRLTSAKELPYFEGDFWPNVLEESIKELEQEEEERKREENTSNESTDVTKGDSKNAKKKNNKKTSKNKSSLSRGNKKKPGMPNVSNDLSQKLYATMEKHKEVFFVIRLIAGPAANSLPPIVDPDPLIPCDLMDGRDAFLTLARDKHLEFSSLRRAQWSTMCMLVELHTQSQD(SEQ ID NO:65)的完整氨基酸序列具有至少约85%85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
在另一个实施方案中,表观遗传CpG修饰剂包含DNA甲基化酶、DNA去甲基化酶、组蛋白修饰剂、组蛋白转乙酰酶或组蛋白脱乙酰酶。
在一个实施方案中,效应物分子包含锌指多肽。在另一个实施方案中,效应物分子包含转录激活物样效应物核酸酶(TALEN)多肽。
在一些实施方案中,位点特异性FOXP3破坏剂进一步包含编码第二融合蛋白的第二核酸分子,其中所述第二融合蛋白包含靶向第二FOXP3表达控制区的第二位点特异性FOXP3靶向部分和第二效应物分子,其中所述第二FOXP3表达控制区不同于所述FOXP3表达控制区。
在一个实施方案中,第二效应物不同于第一效应物。
在一个实施方案中,第二效应物与第一效应物相同。
在一个实施方案中,融合蛋白和第二融合蛋白可操作地连接。
在一个实施方案中,融合蛋白和第二融合蛋白包含与选自由dCas9-P300和dCas9-VPR组成的组的多肽的完整氨基酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸序列同一性的氨基酸序列。
在一个实施方案中,融合蛋白是由多核苷酸编码,该多核苷酸包含与选自由dCas9-P300 mRNA和dCas9-VPR mRNA组成的组的多核苷酸的完整核苷酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%核苷酸序列同一性的核苷酸序列。
在一个方面,本发明提供位点特异性FOXP3破坏剂。所述破坏剂包括编码融合蛋白的核酸分子,其中所述融合蛋白包含与选自由dCas9-P300和dCas9-VPR组成的组的多肽的完整氨基酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸同一性的氨基酸序列。
在一个方面,本发明提供位点特异性FOXP3破坏剂。位点特异性FOXP3破坏剂包含编码dCas-P300的氨基酸序列的多核苷酸,所述dCas-P300包含MAPKKKRKVGIHGVPAADKKYSIGLAIGTNSVGWAVITDEYKVPSKKFKVLGNTDRHSIKKNLIGALLFDSGETAEATRLKRTARRRYTRRKNRICYLQEIFSNEMAKVDDSFFHRLEESFLVEEDKKHERHPIFGNIVDEVAYHEKYPTIYHLRKKLVDSTDKADLRLIYLALAHMIKFRGHFLIEGDLNPDNSDVDKLFIQLVQTYNQLFEENPINASGVDAKAILSARLSKSRRLENLIAQLPGEKKNGLFGNLIALSLGLTPNFKSNFDLAEDAKLQLSKDTYDDDLDNLLAQIGDQYADLFLAAKNLSDAILLSDILRVNTEITKAPLSASMIKRYDEHHQDLTLLKALVRQQLPEKYKEIFFDQSKNGYAGYIDGGASQEEFYKFIKPILEKMDGTEELLVKLNREDLLRKQRTFDNGSIPHQIHLGELHAILRRQEDFYPFLKDNREKIEKILTFRIPYYVGPLARGNSRFAWMTRKSEETITPWNFEEVVDKGASAQSFIERMTNFDKNLPNEKVLPKHSLLYEYFTVYNELTKVKYVTEGMRKPAFLSGEQKKAIVDLLFKTNRKVTVKQLKEDYFKKIECFDSVEISGVEDRFNASLGTYHDLLKIIKDKDFLDNEENEDILEDIVLTLTLFEDREMIEERLKTYAHLFDDKVMKQLKRRRYTGWGRLSRKLINGIRDKQSGKTILDFLKSDGFANRNFMQLIHDDSLTFKEDIQKAQVSGQGDSLHEHIANLAGSPAIKKGILQTVKVVDELVKVMGRHKPENIVIEMARENQTTQKGQKNSRERMKRIEEGIKELGSQILKEHPVENTQLQNEKLYLYYLQNGRDMYVDQELDINRLSDYDVAAIVPQSFLKDDSIDNKVLTRSDKARGKSDNVPSEEVVKKMKNYWRQLLNAKLITQRKFDNLTKAERGGLSELDKAGFIKRQLVETRQITKHVAQILDSRMNTKYDENDKLIREVKVITLKSKLVSDFRKDFQFYKVREINNYHHAHDAYLNAVVGTALIKKYPKLESEFVYGDYKVYDVRKMIAKSEQEIGKATAKYFFYSNIMNFFKTEITLANGEIRKRPLIETNGETGEIVWDKGRDFATVRKVLSMPQVNIVKKTEVQTGGFSKESILPKRNSDKLIARKKDWDPKKYGGFDSPTVAYSVLVVAKVEKGKSKKLKSVKELLGITIMERSSFEKNPIDFLEAKGYKEVKKDLIIKLPKYSLFELENGRKRMLASAGELQKGNELALPSKYVNFLYLASHYEKLKGSPEDNEQKQLFVEQHKHYLDEIIEQISEFSKRVILADANLDKVLSAYNKHRDKPIREQAENIIHLFTLTNLGAPAAFKYFDTTIDRKRYTSTKEVLDATLIHQSITGLYETRIDLSQLGGDKRPAATKKAGQAKKKKGRAIFKPEELRQALMPTLEALYRQDPESLPFRQPVDPQLLGIPDYFDIVKSPMDLSTIKRKLDTGQYQEPWQYVDDIWLMFNNAWLYNRKTSRVYKYCSKLSEVFEQEIDPVMQSLGYCCGRKLEFSPQTLCCYGKQLCTIPRDATYYSYQNRYHFCEKCFNEIQGESVSLGDDPSQPQTTINKEQFSKRKNDTLDPELFVECTECGRKMHQICVLHHEIIWPAGFVCDGCLKKSARTRKENKFSAKRLPSTRLGTFLENRVNDFLRRQNHPESGEVTVRVVHASDKTVEVKPGMKARFVDSGEMAESFPYRTKALFAFEEIDGVDLCFFGMHVQEYGSDCPPPNQRRVYISYLDSVHFFRPKCLRTAVYHEILIGYLEYVKKLGYTTGHIWACPPSEGDDYIFHCHPPDQKIPKPKRLQEWYKKMLDKAVSERIVHDYKDIFKQATEDRLTSAKELPYFEGDFWPNVLEESIKELEQEEEERKREENTSNESTDVTKGDSKNAKKKNNKKTSKNKSSLSRGNKKKPGMPNVSNDLSQKLYATMEKHKEVFFVIRLIAGPAANSLPPIVDPDPLIPCDLMDGRDAFLTLARDKHLEFSSLRRAQWSTMCMLVELHTQSQDSGGKRPAATKKAGQAKKKKGSYPYDVPDYA(SEQ ID NO:10)的氨基酸序列。
在另一个方面,本发明提供位点特异性FOXP3破坏剂。位点特异性FOXP3破坏剂包含编码dCas-VPR的氨基酸序列的多核苷酸,所述dCas-VPR包含MAPKKKRKVGIHGVPAADKKYSIGLAIGTNSVGWAVITDEYKVPSKKFKVLGNTDRHSIKKNLIGALLFDSGETAEATRLKRTARRRYTRRKNRICYLQEIFSNEMAKVDDSFFHRLEESFLVEEDKKHERHPIFGNIVDEVAYHEKYPTIYHLRKKLVDSTDKADLRLIYLALAHMIKFRGHFLIEGDLNPDNSDVDKLFIQLVQTYNQLFEENPINASGVDAKAILSARLSKSRRLENLIAQLPGEKKNGLFGNLIALSLGLTPNFKSNFDLAEDAKLQLSKDTYDDDLDNLLAQIGDQYADLFLAAKNLSDAILLSDILRVNTEITKAPLSASMIKRYDEHHQDLTLLKALVRQQLPEKYKEIFFDQSKNGYAGYIDGGASQEEFYKFIKPILEKMDGTEELLVKLNREDLLRKQRTFDNGSIPHQIHLGELHAILRRQEDFYPFLKDNREKIEKILTFRIPYYVGPLARGNSRFAWMTRKSEETITPWNFEEVVDKGASAQSFIERMTNFDKNLPNEKVLPKHSLLYEYFTVYNELTKVKYVTEGMRKPAFLSGEQKKAIVDLLFKTNRKVTVKQLKEDYFKKIECFDSVEISGVEDRFNASLGTYHDLLKIIKDKDFLDNEENEDILEDIVLTLTLFEDREMIEERLKTYAHLFDDKVMKQLKRRRYTGWGRLSRKLINGIRDKQSGKTILDFLKSDGFANRNFMQLIHDDSLTFKEDIQKAQVSGQGDSLHEHIANLAGSPAIKKGILQTVKVVDELVKVMGRHKPENIVIEMARENQTTQKGQKNSRERMKRIEEGIKELGSQILKEHPVENTQLQNEKLYLYYLQNGRDMYVDQELDINRLSDYDVAAIVPQSFLKDDSIDNKVLTRSDKARGKSDNVPSEEVVKKMKNYWRQLLNAKLITQRKFDNLTKAERGGLSELDKAGFIKRQLVETRQITKHVAQILDSRMNTKYDENDKLIREVKVITLKSKLVSDFRKDFQFYKVREINNYHHAHDAYLNAVVGTALIKKYPKLESEFVYGDYKVYDVRKMIAKSEQEIGKATAKYFFYSNIMNFFKTEITLANGEIRKRPLIETNGETGEIVWDKGRDFATVRKVLSMPQVNIVKKTEVQTGGFSKESILPKRNSDKLIARKKDWDPKKYGGFDSPTVAYSVLVVAKVEKGKSKKLKSVKELLGITIMERSSFEKNPIDFLEAKGYKEVKKDLIIKLPKYSLFELENGRKRMLASAGELQKGNELALPSKYVNFLYLASHYEKLKGSPEDNEQKQLFVEQHKHYLDEIIEQISEFSKRVILADANLDKVLSAYNKHRDKPIREQAENIIHLFTLTNLGAPAAFKYFDTTIDRKRYTSTKEVLDATLIHQSITGLYETRIDLSQLGGDKRPAATKKAGQAKKKKGRADALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLSGGPKKKRKVGSQYLPDTDDRHRIEEKRKRTYETFKSIMKKSPFSGPTDPRPPPRRIAVPSRSSASVPKPAPQPYPFTSSLSTINYDEFPTMVFPSGQISQASALAPAPPQVLPQAPAPAPAPAMVSALAQAPAPVPVLAPGPPQAVAPPAPKPTQAGEGTLSEALLQLQFDDEDLGALLGNSTDPAVFTDLASVDNSEFQQLLNQGIPVAPHTTEPMLMEYPEAITRLVTGAQRPPDPAPAPLGAPGLPNGLLSGDEDFSSIADMDFSALLGSGSGSRDSREGMFLPKPEAGSAISDVFEGREVCQPKRIRPFHPPGSPWANRPLPASLAPTPTGPVHEPVGSLTPAPVPQPLDPAPAVTPEASHLLEDPDEETSQAVKALREMADTVIPQKEEAAICGQMDLSHPPPRGHLDELTTTLESMTEDLNLDSPLTPELNEILDTFLNDECLLHAMHISTGLSIFDTSLFSGGKRPAATKKAGQAKKKKGSYPYDVPDYA(SEQ ID NO:11)的氨基酸序列。
在一个方面,本发明提供一种载体。载体包含编码本文描述的发明的上述方面或任何其他方面的各种实施方案的位点特异性FOXP3破坏剂的核酸分子。在一个实施方案中,载体是病毒表达载体。
在另一个方面,本发明提供一种细胞。细胞包含位点特异性FOXP3破坏剂或本文描述的发明的上述方面或任何其他方面的各种实施方案的载体。
在一个实施方案中,位点特异性FOXP3破坏剂存在于组合物中。在另一个实施方案中,组合物包括药物组合物。在另一个实施方案中,药物组合物包括脂质制剂。在又一个实施方案中,脂质制剂包含一种或多种阳离子脂质、一种或多种非阳离子脂质、一种或多种基于胆固醇的脂质、或一种或多种PEG修饰的脂质、或前述的任何组合。在一个实施方案中,药物组合物包括脂质纳米颗粒。
在一个方面,本发明提供调节细胞中叉头框P3(FOXP3)表达的方法。方法包括使所述细胞与位点特异性FOXP3破坏剂接触,所述破坏剂包含靶向FOXP3表达控制区的位点特异性FOXP3靶向部分和效应物分子,从而调节所述细胞中FOXP3的表达。
在一个实施方案中,表达的调节是增加细胞中FOXP3的表达。在另一个实施方案中,表达的调节是降低细胞中FOXP3的表达。在另一个实施方案中,位点特异性FOXP3靶向部分包含聚合物分子。在又一个实施方案中,聚合物分子包含聚酰胺。在一个实施方案中,聚合物分子包含多核苷酸。
在另一个实施方案中,表达控制区包含FOXP3转录起始位点(TSS)上游的区域。
在另一个实施方案中,表达控制区包含在含有第一和第二FOXP3相关锚定序列的锚定序列介导的结合体内的一个或多个FOXP3相关锚定序列。在另一个实施方案中,FOXP3相关锚定序列包含CCCTC结合因子(CTCF)结合基序。
在一个实施方案中,FOXP3相关锚定序列介导的结合体包含结合体内部的一个或多个转录控制元件。在另一个实施方案中,FOXP3相关锚定序列介导的结合体包含结合体外部的一个或多个转录控制元件。
在另一个实施方案中,锚定序列位于转录控制元件的约500kb内。在另一个实施方案中,锚定序列位于转录控制元件的约300kb内。在又一个实施方案中,锚定序列位于转录控制元件的10kb内。
在一个实施方案中,表达控制区包含FOXP3特异性转录元件。在另一个实施方案中,转录元件包含FOXP3启动子。在另一个实施方案中,转录控制元件包含转录增强子。在另一个实施方案中,转录控制元件包含转录阻遏物。
在另一个实施方案中,位点特异性FOXP3破坏剂包含与表2中的任何核苷酸序列的完整核苷酸序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%核苷酸同一性的核苷酸序列。
在一个实施方案中,位点特异性FOXP3破坏剂包含编码特异性结合FOXP3表达控制区的锌指多肽(ZNF)或转录激活物样效应物(TALE)多肽的DNA结合域或其片段的多核苷酸。
在一些实施方案中,TALE或ZNF的DNA结合域包含与从表1B中所列的氨基酸序列选择的氨基酸序列的完整氨基酸序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸同一性的氨基酸序列。
在另一个实施方案中,位点特异性FOXP3破坏剂包含核苷酸修饰。
在另一个实施方案中,聚合物分子包含肽核酸(PNA)。
在一个实施方案中,效应物分子包含多肽。在另一个实施方案中,多肽包含融合蛋白,所述融合蛋白包含靶向FOXP3表达调控区的位点特异性FOXP3靶向部分和效应物分子。在另一个实施方案中,融合蛋白包含肽-核酸融合物分子。
在另一个实施方案中,效应物选自由核酸酶、物理阻断剂、表观遗传募集剂和表观遗传CpG修饰剂及前述的任何组合组成的组。在又一个实施方案中,效应物包括CRISPR相关蛋白(Cas)多肽或编码Cas多肽的核酸分子。在另一个实施方案中,Cas多肽是无酶活性的Cas多肽。在一个实施方案中,效应物进一步包含人核酸外切酶1(hEXO1)的催化活性结构域。
在一个实施方案中,表观遗传募集剂包含转录增强子或转录阻遏物。
在一些实施方案中,转录增强子是VPR。
在一些实施方案中,VPR包含与DALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLSGGPKKKRKVGSQYLPDTDDRHRIEEKRKRTYETFKSIMKKSPFSGPTDPRPPPRRIAVPSRSSASVPKPAPQPYPFTSSLSTINYDEFPTMVFPSGQISQASALAPAPPQVLPQAPAPAPAPAMVSALAQAPAPVPVLAPGPPQAVAPPAPKPTQAGEGTLSEALLQLQFDDEDLGALLGNSTDPAVFTDLASVDNSEFQQLLNQGIPVAPHTTEPMLMEYPEAITRLVTGAQRPPDPAPAPLGAPGLPNGLLSGDEDFSSIADMDFSALLGSGSGSRDSREGMFLPKPEAGSAISDVFEGREVCQPKRLRPFHPPGSPWANRPLPASLAPTPTGPVHEPVGSLTPAPVPQPLDPAPAVTPEASHLLEDPDEETSQAVKALREMADTVIPQKEEAAICGQMDLSHPPPRGHLDELTTTLESMTEDLNLDSPLTPELNEILDTFLNDECLLHAMHISTGLSIFDTSLF(SEQ ID NO:64)的完整氨基酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸同一性的氨基酸序列。
在一些实施方案中,转录增强子包含2个、3个、4个或5个VPR。
在一些实施方案中,转录增强子是p300。
在一些实施方案中,p300具有与IFKPEELRQALMPTLEALYRQDPESLPFRQPVDPQLLGIPDYFDIVKSPMDLSTIKRKLDTGQYQEPWQYVDDIWLMFNNAWLYNRKTSRVYKYCSKLSEVFEQEIDPVMQSLGYCCGRKLEFSPQTLCCYGKQLCTIPRDATYYSYQNRYHFCEKCFNEIQGESVSLGDDPSQPQTTINKEQFSKRKNDTLDPELFVECTECGRKMHQICVLHHEIIWPAGFVCDGCLKKSARTRKENKFSAKRLPSTRLGTFLENRVNDFLRRQNHPESGEVTVRVVHASDKTVEVKPGMKARFVDSGEMAESFPYRTKALFAFEEIDGVDLCFFGMHVQEYGSDCPPPNQRRVYISYLDSVHFFRPKCLRTAVYHEILIGYLEYVKKLGYTTGHIWACPPSEGDDYIFHCHPPDQKIPKPKRLQEWYKKMLDKAVSERIVHDYKDIFKQATEDRLTSAKELPYFEGDFWPNVLEESIKELEQEEEERKREENTSNESTDVTKGDSKNAKKKNNKKTSKNKSSLSRGNKKKPGMPNVSNDLSQKLYATMEKHKEVFFVIRLIAGPAANSLPPIVDPDPLIPCDLMDGRDAFLTLARDKHLEFSSLRRAQWSTMCMLVELHTQSQD(SEQ ID NO:65)的完整氨基酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸同一性的氨基酸序列。
在另一个实施方案中,表观遗传CpG修饰剂包含DNA甲基化酶、DNA去甲基化酶、组蛋白修饰剂、组蛋白转乙酰酶或组蛋白脱乙酰酶。
在另一个实施方案中,效应物分子包含锌指多肽。
在另一个实施方案中,效应物分子包含转录激活物样效应物核酸酶(TALEN)多肽。
在一个实施方案中,融合蛋白包含无酶活性的Cas多肽和表观遗传募集剂多肽。
在另一个实施方案中,融合蛋白包含酶活性Cas多肽和表观遗传CpG修饰剂多肽。
在一些实施方案中,位点特异性FOXP3破坏剂还包含编码第二融合蛋白的第二核酸分子,其中所述第二融合蛋白包含靶向第二FOXP3表达控制区的第二位点特异性FOXP3靶向部分和第二效应物分子,其中所述第二FOXP3表达控制区不同于FOXP3表达控制区。
在一个实施方案中,第二效应物不同于第一效应物。
在一个实施方案中,第二效应物与第一效应物相同。
在一个实施方案中,融合蛋白和第二融合蛋白可操作地连接。
在一个实施方案中,融合蛋白和第二融合蛋白包含与选自由dCas9-P300和dCas9-VPR组成的组的多肽的完整氨基酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸序列同一性的氨基酸序列。
在一个实施方案中,融合蛋白是由多核苷酸编码,该多核苷酸包含与选自由dCas9-P300 mRNA和dCas9-VPR mRNA组成的组的多核苷酸的完整核苷酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%核苷酸序列同一性的核苷酸序列。
在一个方面,本发明提供位点特异性FOXP3破坏剂。破坏剂包含编码融合蛋白的核酸分子,其中所述融合蛋白包含与选自由dCas9-P300和dCas9-VPR组成的组的多肽的完整氨基酸序列具有至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%氨基酸同一性的氨基酸序列。
在一个实施方案中,位点特异性破坏剂、效应物或位点特异性破坏剂和效应物两者存在于载体中。在另一个实施方案中,位点特异性破坏剂和效应物存在于同一载体中。在另一个实施方案中,位点特异性破坏剂和效应物存在于不同的载体中。在另一个实施方案中,载体是病毒表达载体。
在一个实施方案中,位点特异性破坏剂、效应物、或位点特异性破坏剂和效应物两者存在于组合物中。在另一个实施方案中,位点特异性破坏剂和效应物存在于同一组合物中。在另一个实施方案中,位点特异性破坏剂和效应物存在于不同的组合物中。在又一个实施方案中,组合物包括药物组合物。在一个实施方案中,药物组合物包括脂质制剂。在另一个实施方案中,脂质制剂包含一种或多种阳离子脂质、一种或多种非阳离子脂质、一种或多种基于胆固醇的脂质、或一种或多种PEG修饰的脂质、或前述的任何组合。在另一个实施方案中,药物组合物包括脂质纳米颗粒。
在另一个实施方案中,细胞是哺乳动物细胞。在另一个实施方案中,哺乳动物细胞是体细胞。在另一个实施方案中,哺乳动物细胞是原代细胞。
在一个实施方案中,接触在体外进行。在另一个实施方案中,接触在体内进行。在另一个实施方案中,接触离体进行。
在一个实施方案中,方法还包括向受试者施用细胞。
在另一个实施方案中,细胞在受试者体内。
在另一个实施方案中,受试者患有FOXP3相关疾病。在另一个实施方案中,FOXP3相关疾病选自由IPEX综合征(IPEX)、1型糖尿病、多发性硬化、系统性红斑狼疮(SLE)和类风湿性关节炎(RA)组成的组。
在一个方面,本发明提供治疗患有FOXP3相关疾病的受试者的方法。方法包括向受试者施用治疗有效量的位点特异性FOXP3破坏剂,所述破坏剂包含靶向FOXP3表达控制区的位点特异性FOXP3靶向部分和效应物分子,从而治疗所述受试者。在一个实施方案中,FOXP3相关疾病是IPEX综合征,并且位点特异性FOXP3破坏剂增加受试者中FOXP3的表达。在另一个实施方案中,位点特异性FOXP3破坏剂和效应物分子同时施用于受试者。在另一个实施方案中,位点特异性FOXP3破坏剂和效应物分子依次施用于受试者。在一个实施方案中,效应物分子在位点特异性FOXP3破坏剂的施用之前被施用于受试者。在另一个实施方案中,位点特异性FOXP3破坏剂在效应物分子的施用之前被施用于受试者。
在本文描述的发明的上述方面或任何其他方面的各种实施方案中,细胞是免疫细胞。在一个实施方案中,免疫细胞是天然T细胞或调节性T细胞(Treg)。在另一个实施方案中,
在一个实施方案中,本发明的位点特异性FOXP3破坏剂包括与GD-28448的完整核苷酸序列具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%核苷酸同一性的第一核苷酸序列,与GD-28449的完整核苷酸序列具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%核苷酸同一性的第二核苷酸序列,和与GD-28450的完整核苷酸序列具有至少85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%核苷酸同一性的第三核苷酸序列。
附图说明
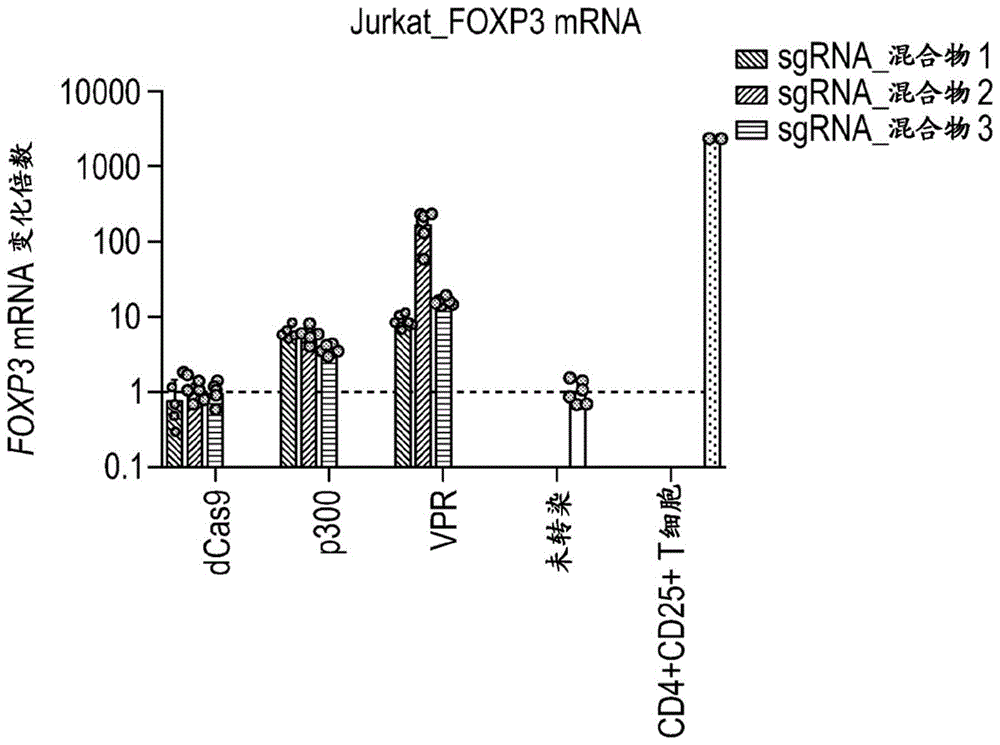
图1A和1B是描述使Jurkat细胞与所示的位点特异性FOXP3靶向部分的混合物和包含dCas、dCas9和p300、或dCas9和VPR的效应物分子接触后FOXP3表达的激活的图表。
图1A显示用dCas9+sgRNA混合物(1、2或3)或用dCas9-p300+sgRNA混合物(1、2或3)或用dCas9-VPR+sgRNA混合物(1、2或3)转染后48小时的FOXP3 mRNA水平的qPCR定量。
图1B显示测定转染后72小时FOXP3阳性的Jurkat细胞的百分比的FACS实验的定量。所有转染均使用Lipofectamine Messeger Max试剂(Thermofisher)按照制造商的说明书进行。
图2是描绘使Jurkat细胞与位点特异性FOXP3靶向部分的混合物和包含dCas9和p300或dCas9和VPR的效应物分子接触后FOXP3表达的激活的图表。仅有sgRNA混合物2和dCas9+VPR的组合显示出mRNA水平和蛋白质水平的显著高的FOXP3激活。
图3A和3B是描绘使细胞与所示的位点特异性FOXP3靶向部分的混合物和包含dCas9、dCas9和p300、或dCas9和VPR的效应物分子接触后天然T细胞的激活的图表。
图3A显示用dCas9+sgRNA混合物-2或用dCas9-p300+sgRNA混合物-2或用dCas9-VPR+sgRNA混合物-2转染后58小时的FOXP3mRNA水平的qPCR定量。图3B显示测定转染后72小时FOXP3阳性的天然T细胞的百分比的FACS实验的定量。所有转染均按照制造商的说明书使用MaxCyte电穿孔缓冲液和ATx电穿孔系统进行。“程序T细胞2”和“程序T细胞3”是仪器上的用于用mRNA+sgRNA电穿孔T细胞以递送到细胞中的两种电穿孔设置。
具体实施方式
本发明提供用于通过靶向FOXP3表达控制区来调节叉头框P3(FOXP3)基因的表达(例如,增加或降低表达)的试剂和组合物。FOXP3基因可以在细胞,例如哺乳动物细胞,如哺乳动物体细胞,例如哺乳动物天然T细胞(例如人或小鼠天然T细胞)中。本发明还提供使用本发明的试剂和组合物来调节将受益于调节FOXP3基因的表达的受试者(例如患有或易患自身免疫性疾病的受试者)体内FOXP3基因的表达和/或治疗该受试者的方法。
本发明的试剂在本文中称为位点特异性FOXP3破坏剂,并描述于以下部分II中。
I.定义
为了更容易理解本发明,首先定义某些术语。此外,应当注意的是,无论何时记载参数的值或值的范围,其是指所述值中间的值和范围也是本发明的一部分。
本文所用冠词“一(a)”和“一个(an)”是指该冠词的语法宾语的一个或多于一个(即至少一个)。举例来说,“一个元件”意指一个元件或多于一个元件,例如多个元件,例如元件混合物(pool),如sgRNA。
除非上下文另有明确说明,本文所用术语“包括”是指短语“包括但不限于”,并且可与短语“包括但不限于”互换使用。本文所用术语“或”是指术语“和/或”,并且可与术语“和/或”互换使用。
本文所用术语“约”是指在本领域的典型公差范围内。例如,“约”可以理解为平均值的约2个标准偏差。在某些实施方案中,约意指±10%。在某些实施方案中,约意指±5%。当约存在于一系列数字或范围前时,应理解“约”可修饰该系列或范围中的每个数字。
数字或一系列数字前的术语“至少”应理解为包括与术语“至少”相邻的数字以及逻辑上可包括的所有随后的数字或整数,如从上下文可清楚看出的。例如,核酸分子中核苷酸数目必须是整数。例如,“21个核苷酸的核酸分子中的至少18个核苷酸”意指18、19、20或21个核苷酸具有指定性质。当“至少”存在于一系列数字或范围前时,应理解“至少”可以修饰该系列或范围中的每个数字。
如本文所用,“不多于”或“小于”应理解为与该短语相邻的值以及逻辑上较低的值或整数(如从上下文的逻辑上可知的),至零。当“不多于”存在于一系列数字或范围前时,应理解“不多于”可以修饰该系列或范围中的每个数字。
如本文所用,术语“基本上”是指表现出感兴趣的特征或性质的总体或接近总体范围或程度的定性条件。本领域普通技术人员将理解,生物和化学现象很少(如果有的话)进行到完成和/或进行到结束或者实现或避免绝对结果。因此,术语“基本上”可用于本文的一些实施方案中以体现许多生物和化学现象中固有的完全性的潜在缺乏。
如本文所用,术语“叉头框P3”或“FOXP3”是指编码众所周知的FOX蛋白家族成员的基因,其是控制天然T细胞分化成调节性T细胞(Treg)的主要转录因子。FOX蛋白属于转录调节因子的叉状头/翅膀状螺旋家族(forkhead/winged-helix family),并被认为在转录过程中通过类似的DNA结合相互作用发挥控制作用。在调节性T细胞模型系统中,FOXP3转录因子作为参与调节性T细胞功能的基因的启动子,并且可以在刺激T细胞受体后抑制关键基因的转录。该基因的功能缺陷可导致X连锁多内分泌腺病肠病伴免疫失调综合征(或IPEX,也称为X-连锁自身免疫-免疫缺陷综合征)以及许多癌症。FOXP3的核苷酸和氨基酸序列是已知的,并且可以在例如GenBank登录号NM_014009.4和NM_001114377.2中找到,其各自的全部内容通过引用并入本文。人类X染色体基因组区域的核苷酸序列,包括FOXP3的内源性启动子和FOXP3编码序列,也是已知的,并且可以在例如NC_000023.11(49250436-49264932)中找到。FOXP3 mRNA存在两种常见转录物变体,其序列可见于GenBank登录号NM_014009.4和NM_001114377.2。自本申请提交之日起,上述各GenBank登录号的全部内容通过引用并入本文。
如本文所用,术语“位点特异性FOXP3破坏剂”是指特异性结合靶FOXP3表达控制区并例如调节FOXP3基因表达的任何试剂。本发明的位点特异性FOXP3破坏剂可以包含“位点特异性FOXP3靶向部分”。
如本文所用,术语“位点特异性FOXP3靶向部分”是指特异性结合FOXP3表达控制区(例如,FOXP3基因的转录控制区,例如,转录起始位点上游周围/接近上游的DNA区域、启动子、增强子或阻遏物;或例如在FOXP3相关锚定序列介导的结合体内的FOXP3相关锚定序列)的部分。示例性的“位点特异性FOXP3靶向部分”包括但不限于聚酰胺、核酸分子(例如RNA、DNA或经修饰的RNA或DNA)、多肽、蛋白质核酸分子和融合蛋白。
如本文所用,术语“特异性结合”或“特异性地结合”是指在发生结合的环境中区分可能的结合配偶体的能力。在一些实施方案中,当存在其他潜在的破坏剂时,与一种特定靶标相互作用(例如优先地相互作用)的破坏剂被称为“特异性结合”至与其相互作用的靶标(即表达控制区)。在一些实施方案中,通过检测或测定破坏剂与其靶标之间的结合程度来评估特异性结合;在一些实施方案中,通过检测或测定破坏剂-靶标复合物的解离程度来评估特异性结合。在一些实施方案中,通过检测或测定破坏剂与其靶标和另一实体之间的替代相互作用的竞争的能力来评估特异性结合。在一些实施方案中,通过在一定浓度范围内进行这种检测或测定来评估特异性结合。
如本文所用,术语“表达控制区”或“表达控制结构域”是指基因组DNA中存在的调节细胞中靶基因表达的区域或结构域。与表达控制区相关的功能可以例如通过募集或阻断募集刺激基因表达的转录因子直接影响靶基因的表达。与表达控制区相关的功能可以例如通过引入表观遗传修饰或募集引入诱导调节靶基因表达的染色体拓扑结构改变的表观遗传修饰的其他因子间接地影响靶基因的表达。表达控制区可以在基因的蛋白质编码序列的上游和/或下游,并且包括例如转录控制元件,例如转录起始位点上游周围/接近上游的DNA区域、启动子、增强子或阻遏物;和锚定序列和锚定序列介导的结合体。
如本文所用,术语“转录控制元件”是指控制基因转录的核酸序列。转录控制元件包括例如锚定序列、锚定序列介导的结合体、转录起始位点上游周围/接近上游的DNA区域、启动子、转录增强子和转录阻遏物。
转录起始位点(TSS)是转录在基因序列的5’末端开始的位置。TSS上游周围/接近上游的DNA区域可通过例如募集转录因子来调节基因的表达。TSS上游周围/接近上游的DNA区域中的一个或多个核苷酸的修饰状态的改变(例如甲基化)或一个或多个染色质蛋白的修饰状态的改变(例如乙酰化)可以调节基因的表达。
启动子是通过RNA聚合酶识别以启动特定基因转录的DNA的区域,通常位于基因转录起始位点的5’末端的上游。
“转录增强子”增加基因转录。“转录沉默子”或“转录阻遏物”降低基因转录。增强和沉默序列的长度可以是约50-3500个碱基对,并且可影响基因转录长达约1兆碱基。
如本文所用,术语“基因”是指编码具有功能的分子(例如蛋白质)的核苷酸序列。基因包含转录的序列(例如3’UTR)、非转录的序列(例如启动子)、翻译的序列(例如外显子)和非翻译的序列(例如内含子)。
如本文所用,术语“靶基因”是指被靶向以调节表达(例如增加或降低)的FOXP3基因。在一些实施方案中,FOXP3靶基因是靶向的基因组复合物的一部分(例如具有其基因组序列的至少一部分作为靶基因组复合物的一部分的FOXP3基因,例如在锚定序列介导的结合体内部),该基因组复合物由本文所述的一种或多种位点特异性破坏剂靶向。在一些实施方案中,调节包括靶基因的表达的激活。在一些实施方案中,FOXP3基因通过使FOXP3基因或可操作连接至FOXP3基因的转录控制元件与本文所述的一种或多种位点特异性破坏剂接触来调节。在一些实施方案中,FOXP3基因在细胞中(例如受试者(例如患有FOXP3相关疾病或自身免疫性疾病的受试者)体内的细胞)中异常表达(例如过表达)。在一些实施方案中,FOXP3基因在细胞(例如受试者(例如患有FOXP3相关疾病或自身免疫性疾病的受试者)体内的细胞)中异常表达(例如表达不足)。
如本文所用,术语“锚定序列”是指由充分结合以形成锚定序列介导的结合体(例如复合体)的成核剂(nucleating agent)识别的核酸序列。在一些实施方案中,锚定序列包含一个或多个CTCF结合基序。在一些实施方案中,锚定序列不位于基因编码区内。在一些实施方案中,锚定序列位于基因间隔区内。在一些实施方案中,锚定序列不位于增强子或启动子内。在一些实施方案中,锚定序列位于距离任何转录起始位点至少400bp、至少450bp、至少500bp、至少550bp、至少600bp、至少650bp、至少700bp、至少750bp、至少800bp、至少850bp、至少900bp、至少950bp或至少1kb处。在一些实施方案中,锚定序列位于与基因组印记、单等位基因表达和/或单等位基因表观遗传标记不相关的区域内。在一些实施方案中,锚定序列具有选自以下的一种或多种功能:结合内源性成核多肽(例如CTCF)、与第二锚定序列相互作用以形成锚定序列介导的结合体、或与锚定序列介导的结合体外的增强子隔离。在本发明的一些实施方案中,提供了可特异性靶向一个或多个特定锚定序列而不靶向其他锚定序列(例如,在不同背景下可包含成核剂(例如CTCF)结合基序的序列)的技术;这种被靶向的锚定序列可称为“靶锚定序列”。在一些实施方案中,调节靶锚定序列的序列和/或活性,而不调节可能存在于同一系统中(例如在同一细胞中和/或在一些实施方案中在同一核酸分子上,例如同一染色体上)作为其他被靶向的锚定序列的一种或多种其他锚定序列的序列和/或活性。在一些实施方案中,锚定序列包含或是成核多肽结合基序。在一些实施方案中,锚定序列与成核多肽结合基序相邻。
如本文所用,术语“锚定序列介导的结合体(anchor sequence-mediatedconjunction)”是指这样的DNA结构(在一些情况下是复合体),其由DNA中的至少两个锚定序列被一种或多种多肽(例如成核多肽)或一种或多种蛋白质和/或核酸实体(例如RNA或DNA)(其结合锚定序列使得锚定序列之间空间接近及功能性连接)的物理相互作用或结合而实现和/或维持。
如本文所用,术语“基因组复合体”是通过多种蛋白质和/或其他组分(可能包括基因组序列元件)之间或之中的相互作用将一条或多条染色体上彼此间隔开的两个基因组序列元件集合在一起的复合体。在一些实施方案中,基因组序列元件是与复合体的一种或多种蛋白质组分结合的锚定序列。在一些实施方案中,基因组复合体可包含锚定序列介导的结合体。在一些实施方案中,基因组序列元件可以是或可包含CTCF结合基序、启动子和/或增强子。在一些实施方案中,基因组序列元件包括启动子和/或调控区(例如增强子)中的至少一个或两者。在一些实施方案中,复合体的形成在基因组序列元件处和/或通过蛋白质组分中的一种或多种与基因组序列元件的结合而成核。如本领域技术人员将理解,在一些实施方案中,通过复合体形成,基因组位点的共定位(例如结合)改变了基因组序列元件处或附近(在一些实施方案中包括在它们之间)的DNA拓扑结构。在一些实施方案中,基因组复合体包含含有一个或多个环的锚定序列介导的结合体。在一些实施方案中,本文所述的基因组复合体通过成核多肽(例如CTCF和/或黏连蛋白)成核。在一些实施方案中,本文所述的基因组复合体可包括例如CTCF、黏连蛋白、非编码RNA(例如eRNA)、转录机器蛋白(例如RNA聚合酶、一种或多种转录因子,例如选自由TFIIA、TFIIB、TFIID、TFIIE、TFIIF、TFIIH等组成的组)、转录调控因子(例如Mediator、P300、增强子结合蛋白、阻遏物结合蛋白、组蛋白修饰剂等)等中的一种或多种。在一些实施方案中,本文所述的基因组复合体包括一种或多种多肽组分和/或一种或多种核酸组分(例如一种或多种RNA组分),其在一些实施方案中可彼此和/或与一种或多种基因组序列元件(例如锚定序列、启动子序列、调控序列(例如增强子序列))相互作用,以将基因组DNA的片段限制为拓扑构型(例如环),当复合体未形成时基因组DNA的片段不采取该拓扑构型。
如本文所用,“效应物分子”是指能够调节生物活性(例如酶活性)、基因表达、锚定序列介导的结合体或细胞信号传导的分子。示例性效应物描述于下文第II部分中,并且在一些实施方案中包括例如核酸酶、物理阻断剂、表观遗传募集剂(例如转录增强子或转录阻遏物)和表观遗传CpG修饰剂(例如DNA甲基化酶、DNA去甲基化酶、组蛋白修饰剂、组蛋白转乙酰酶或组蛋白脱乙酰酶)及前述的任何组合。
II.本发明的位点特异性FOXP3破坏剂
本发明提供位点特异性FOXP3破坏剂,在本发明的一个方面,其包括靶向FOXP3表达控制区的位点特异性FOXP3靶向部分。在另一个方面,本发明的位点特异性破坏剂包括靶向FOXP3表达控制区的位点特异性FOXP3靶向部分和效应物分子。如本领域普通技术人员将理解的,此类破坏剂是位点特异性的,并且因此特异性结合至例如细胞内的FOXP3表达控制区(例如一个或多个转录控制元件和/或一个或多个靶锚定序列),而不结合非靶向的表达控制区(例如在同一细胞内)。
FOXP3是控制天然T细胞分化成调节性T细胞(Treg)的主要转录因子,并且已显示FOXP3的强制过表达赋予T细胞以Treg表型。本发明的特征在于,当与DNA靶向部分融合时,效应物分子(例如染色质重塑剂)的使用可诱导导致靶向基因(例如FOXP3基因)的转录增加的特定基因组区域处的表观遗传改变。在某些实施方案中,使用与FOXP3基因的转录起始位点(TSS)上游周围/上游处的DNA区域互补的单指导RNA(sgRNA),使与dCas9(其为DNA靶向部分)融合的效应物分子(p300-核心或VPR)靶向FOXP3基因座,并引起组蛋白乙酰化的改变。这些表观遗传变化触发了最终导致在天然T细胞中激活FOXP3并诱导分化为Treg的机制。这些Treg可基于细胞表面标记(例如,CD127)和/或基于其中Treg杀死在混合培养物中孵育的效应T细胞的抑制表型来鉴定。
Treg的体外产生已经是靶向自身免疫性病症的离体治疗领域中的重要工作。但是,许多产生Treg的策略既不引起导致Treg的基因的持续表达,也不产生具有抑制表型的Treg。本发明的特征在于直接靶向Treg产生和维持途径中的主要调节转录因子FOXP3的方法,其使用靶向部分(例如,dCas9、TALE或ZFP)以将效应物分子(例如,激活物)直接递送至作用位点以增强FOXP3基因的激活。
本发明的位点特异性FOXP3破坏剂包含靶向FOXP3表达控制区的位点特异性FOXP3靶向部分。由位点特异性靶向部分靶向的表达控制区可以是例如转录控制元件或锚定序列,例如,锚定序列介导的结合体内的锚定序列。
因此,本发明的位点特异性FOXP3破坏剂可例如通过调节转录起始位点上游周围/接近上游的DNA区域、内源性启动子、增强子或阻遏物的基因的表达来调节基因(即FOXP3)的表达;可改变调控区的甲基化;可改变染色质蛋白的乙酰化,可引入一个或多个突变,例如核苷酸的取代、添加或缺失;可改变至少一个锚定序列;可以例如通过改变结合成核分子的结合亲和力改变至少一个结合成核分子结合位点;可以通过例如至少一个锚定序列(例如CTCF结合基序)中的取代、添加或缺失来改变至少一个共同核苷酸序列(例如CTCF结合基序)的取向。
在某些实施方案中,本文所述的位点特异性破坏剂和组合物靶向包含一个或多个FOXP3特异性转录控制元件的表达控制区以调节细胞中的表达。可被靶向的FOXP3特异性转录控制元件包括FOXP3转录起始位点上游周围或接近上游的DNA区域、FOXP3特异性启动子、FOXP3特异性增强子、FOXP3特异性阻遏物和FOXP3相关锚定序列。在一个实施方案中,FOXP3特异性转录控制元件调节免疫细胞中的表达,例如FOXP3转录起始位点上游周围或接近上游的DNA区域。
例如,位点特异性破坏剂可包括位点特异性靶向部分,例如编码特异性靶向并结合FOXP3表达控制区(例如,FOXP3内源性启动子区)的转录激活物样效应物(TALE)多肽或锌指(ZNF)多肽的DNA结合域或其片段的核酸分子;和效应物分子,例如包括调节(例如增强或阻遏)自内源性启动子的靶基因表达以调节基因表达的转录增强子或转录阻遏物的效应物分子。在一个实施方案中,破坏剂是“双顺反子核酸分子”,即能够由单一信使RNA分子、第一和第二位点特异性靶向部分(例如,编码特异性靶向并结合FOXP3表达控制区(例如FOXP3内源性启动子区)的转录激活物样效应物(TALE)多肽或锌指(ZNF)多肽的DNA结合域或其片段的核酸分子)和效应物分子(例如包括调节(例如增强或阻遏)自内源性启动子的靶基因表达以调节基因表达的转录增强子或转录阻遏物的效应物分子)来制备两种融合蛋白。
在本发明的一些实施方案中,位点特异性破坏剂可包括位点特异性靶向部分(例如核酸分子,如靶向FOXP3转录起始位点上游周围或接近上游的FOXP3内源性DNA区域的指导RNA)和效应物分子(例如包括调节(例如增强或阻遏)自内源性启动子的靶基因表达以调节基因表达的转录增强子或转录阻遏物的效应物分子)。
在本发明的某些实施方案中,本文所述的位点特异性破坏剂和组合物靶向包含例如锚定序列介导的结合体(包含第一和第二FOXP3相关锚定序列)内的一个或多个FOXP3相关锚定序列的表达控制区,以改变二维染色质结构(例如锚定序列介导的结合体),从而例如通过修饰DNA(例如基因组DNA)中的锚定序列介导的结合体来调节细胞(例如受试者内的细胞)中的表达。
在一个方面,本发明包括含有靶向FOXP3表达控制区的位点特异性FOXP3靶向部分的位点特异性FOXP3破坏剂,所述FOXP3表达控制区包含锚定序列介导的结合体内的一个或多个FOXP3相关锚定序列。破坏剂结合(例如特异性结合)特定锚定序列介导的结合体以改变锚定序列介导的结合体(例如具有通过结合成核分子结合的两个或更多个DNA基因座的物理相互作用的锚定序列介导的结合体)的拓扑结构。
锚定序列介导的结合体的形成可迫使转录控制元件与FOXP3基因相互作用或空间限制转录控制元件的活性。因此,改变锚定序列介导的结合体允许调节FOXP3表达而不改变被调节的FOXP3基因的编码序列。
在一些实施方案中,本发明的位点特异性破坏剂和组合物通过一个或多个锚定序列和结合成核分子之间的物理干扰来调节与锚定序列介导的结合体相关的FOXP3基因的表达。例如,DNA结合小分子(例如小沟或大沟结合剂)、肽(例如锌指、TALE、新的或经修饰的肽)、蛋白质(例如CTCF、具有受损的CTCF结合和/或内聚结合亲和力的经修饰的CTCF)、或核酸(例如ssDNA、经修饰的DNA或RNA、肽寡核苷酸缀合物、锁核酸、桥接核酸、聚酰胺和/或形成三链体的寡核苷酸)可以物理地防止结合成核分子与一个或多个锚定序列相互作用以调节FOXP3基因表达。
在一些实施方案中,本发明的位点特异性破坏剂和组合物通过锚定序列的修饰(例如表观遗传修饰如组蛋白修饰,或基因组编辑修饰)调节与锚定序列介导的结合体相关的FOXP3基因的表达。例如,与包含FOXP3基因的锚定序列介导的结合体相关的一个或多个锚定序列可以被靶向以用于基因组编辑,例如Cas9介导的基因组编辑。
在一些实施方案中,本发明的位点特异性破坏剂和组合物调节与锚定序列介导结合体相关的FOXP3基因的表达,例如激活或抑制转录,例如诱导染色质的表观遗传改变或基因组编辑。
在一些实施方案中,锚定序列介导的结合体包含一个或多个锚定序列、FOXP3基因和一个或多个转录控制元件(如增强或沉默元件)。在一些实施方案中,转录控制元件在锚定序列介导的结合体内、部分地在锚定序列介导的结合体内或在锚定序列介导的结合体外。
在一个实施方案中,锚定序列介导的结合体包括环,如染色体内环。在某些实施方案中,锚定序列介导的结合体具有多个环。一个或多个环可包括第一锚定序列、核酸序列、转录控制元件和第二锚定序列。在另一个实施方案中,至少一个环依次包括第一锚定序列、转录控制元件和第二锚定序列;或第一锚定序列、核酸序列和第二锚定序列。在另一个实施方案中,核酸序列和转录控制元件中的一个或两者位于环内或环外。在另一个实施方案中,一个或多个环包含转录控制元件。
在一些实施方案中,锚定序列介导的结合体包括TATA盒、CAAT盒、GC盒或CAP位点。
在一些实施方案中,锚定序列介导的结合体包含多个环,并且其中锚定序列介导的结合体在一个或多个环中包含锚定序列、核酸序列和转录控制元件中的至少一种。
在一个方面,本发明的位点特异性破坏剂和组合物可以向锚定序列介导的结合体引入靶向改变,以用结合锚定序列的破坏剂调节核酸序列的表达。在一些实施方案中,通过靶向锚定序列介导的结合体内的一个或多个核苷酸进行取代、添加或缺失来改变锚序列介导的结合体。
在一些实施方案中,通过包含激活环或排除阻遏环来激活表达,例如转录。在一个这样的实施方案中,锚定序列介导的结合体包含增加核酸序列(例如这样的FOXP3编码核酸)转录的转录控制序列。在另一个这样的实施方案中,锚定序列介导的结合体排除降低核苷酸序列(例如这样的FOXP3编码核酸)的表达(例如转录)的转录控制元件。
在一些实施方案中,通过包含阻遏环或排除激活环来阻遏表达,例如转录。在一个这样的实施方案中,锚定序列介导的结合体包括降低核酸序列(例如这样的FOXP3编码核酸序列)的表达(例如转录)的转录控制元件。在另一个这样的实施方案中,锚定序列介导的结合体排除增加核酸序列(例如这样的FOXP3编码核酸)转录的转录控制序列。
每个锚定序列介导的结合体包含一个或多个锚定序列,例如多个。可以操纵或改变锚定序列以破坏天然存在的环或形成新环(例如,形成外源环或形成具有外源或改变的锚定序列的非天然存在的环)。此类改变通过改变含有FOXP3基因的全部或一部分的DNA的二维结构来调节FOXP3基因表达,例如通过由此调节FOXP3基因与转录控制元件(例如增强和沉默/阻遏序列)相互作用的能力。在一些实施方案中,通过取代、添加或缺失锚定序列介导的结合体的锚定序列内一个或多个核苷酸来修饰染色质结构。
锚定序列可以彼此不连续。在具有不连续锚定序列的实施方案中,第一锚定序列可以与第二锚定序列间隔约500bp至约500Mb、约750bp至约200Mb、约1kb至约100Mb、约25kb至约50Mb、约50kb至约1Mb、约100kb至约750kb、约150kb至约500kb、或约175kb至约500kb。在一些实施方案中,第一锚定序列与第二锚定序列间隔约500bp、600bp、700bp、800bp、900bp、1kb、5kb、10kb、15kb、20kb、25kb、30kb、35kb、40kb、45kb、50kb、55kb、60kb、65kb、70kb、75kb、80kb、85kb、90kb、95kb、100kb、125kb、150kb、175kb、200kb、225kb、250kb、275kb、300kb、350kb、400kb、500kb、600kb、700kb、800kb、900kb、1Mb、2Mb、3Mb、4Mb、5Mb、6Mb、7Mb、8Mb、9Mb、10Mb、15Mb、20Mb、25Mb、50Mb、75Mb、100Mb、200Mb、300Mb、400Mb、500Mb或其间的任何大小。
在一个实施方案中,锚定序列包含共同的核苷酸序列,例如CTCF结合基序:
N(T/C/G)N(G/A/T)CC(A/T/G)(C/G)(C/T/A)AG(G/A)(G/T)GG(C/A/T)(G/A)(C/G)(C/T/A)(G/A/C)(SEQ ID NO:1),其中N是任何核苷酸。
CTCF-结合基序也可以是相反取向的,例如,(G/A/C)(C/T/A)(C/G)(G/A)(C/A/T)GG(G/T)(G/A)GA(C/T/A)(C/G)(A/T/G)CC(G/A/T)N(T/C/G)N(SEQ ID NO:2)。
在一个实施方案中,锚定序列包含SEQ ID NO:1或SEQ ID NO:2或与SEQ ID NO:1或SEQ ID NO:2具有至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%同一性的核苷酸序列。
在一些实施方案中,锚定序列介导的结合体包含至少第一锚定序列和第二锚定序列。第一锚定序列和第二锚定序列可以各自包含共同核苷酸序列,例如各自包含CTCF结合基序。在一些实施方案中,第一锚定序列和第二锚定序列包含不同的序列,例如,第一锚定序列包含CTCF结合基序,且第二锚定序列包含CTCF结合基序以外的锚定序列。在一些实施方案中,每个锚定序列包含共同核苷酸序列和该共同核苷酸序列的一侧或两侧上的一个或多个侧翼核苷酸。
可以形成结合体的两个CTCF结合基序(例如连续的或非连续的CTCF结合基序)可以任何取向存在于基因组中,例如,以相同的取向(串联),或者5’→3’(左串联,例如包含SEQ ID NO:1的两个CTCF结合基序)或者3’→5’(右串联,例如包含SEQ ID NO:2的两个CTCF结合基序),或者会聚取向,其中一个CTCF结合基序包含SEQ ID NO:1且另一个包含SEQ IDNO:2。CTCFBSDB 2.0:CTCF结合基序和基因组组构的数据库(http://insulatordb.uthsc.edu/)可用于鉴定与靶基因(例如FOXP3)相关的CTCF结合基序。
在一些实施方案中,通过改变至少一个共同核苷酸序列(例如结合成核分子结合位点)的取向来改变锚定序列介导的结合体。
在一些实施方案中,锚定序列包含结合成核分子结合位点,例如CTCF结合基序,并且本发明的位点特异性破坏剂在至少一个结合成核分子结合位点中引入改变,例如改变对于结合成核分子的结合亲和力。
在一些实施方案中,通过引入外源锚定序列来改变锚定序列介导的结合体。加入非天然存在的或外源性锚定序列以形成或破坏天然存在的锚定序列介导的结合体,例如通过诱导形成改变核酸序列的转录的非天然存在的环。
在一些实施方案中,锚定序列介导的结合体包含FOXP3基因和一个或多个(例如2、3、4、5个或其他的)除FOXP3基因以外的基因。
在一些实施方案中,锚定序列介导的结合体与一个或多个(例如2、3、4、5或更多个)转录控制元件相关。在一些实施方案中,FOXP3基因与一个或多个转录控制元件不连续。在FOXP3基因与转录控制元件不连续的一些实施方案中,基因可以与一个或多个转录控制元件间隔约100bp至约500Mb、约500bp至约200Mb、约1kb至约100Mb、约25kb至约50Mb、约50kb至约1Mb、约100kb至约750kb、约150kb至约500kb、或约175kb至约500kb。在一些实施方案中,基因与转录控制元件间隔约100bp、300bp、500bp、600bp、700bp、800bp、900bp、1kb、5kb、10kb、15kb、20kb、25kb、30kb、35kb、40kb、45kb、50kb、55kb、60kb、65kb、70kb、75kb、80kb、85kb、90kb、95kb、100kb、125kb、150kb、175kb、200kb、225kb、250kb、275kb、300kb、350kb、400kb、500kb、600kb、700kb、800kb、900kb、1Mb、2Mb、3Mb、4Mb、5Mb、6Mb、7Mb、8Mb、9Mb、10Mb、15Mb、20Mb、25Mb、50Mb、75Mb、100Mb、200Mb、300Mb、400Mb、500Mb或其间的任何大小。
在一些实施方案中,锚定序列介导的结合体的类型可有助于确定如何通过改变锚定序列介导的结合体来调节基因表达,例如位点特异性靶向部分的选择。例如,锚定序列介导的结合体的一些类型包括锚定序列介导的结合体内的一个或多个转录控制元件。通过破坏锚定序列介导的结合体的形成(例如改变一个或多个锚定序列)破坏这样的锚定序列介导的结合体可能降低锚定序列介导的结合体内FOXP3基因的转录。
在一些实施方案中,FOXP3基因的表达受与锚定序列介导的结合体相关的一个或多个转录控制元件调控、调节或影响。在一些实施方案中,锚定序列介导的结合体包含FOXP3基因和一个或多个转录控制元件。例如,FOXP3基因和一个或多个转录控制序列至少部分位于锚定序列介导的结合体(例如1型锚定序列介导的结合体)内。锚定序列介导的结合体也可称为“1型,EP亚型”。在一些实施方案中,FOXP3基因具有确定的表达状态,例如处于其天然状态,例如处于患病状态。例如,FOXP3基因可具有高水平的表达。通过破坏锚定序列介导的结合体,由于先前对锚定序列介导的结合体内的转录开放的DNA发生构象变化,FOXP3基因的表达可以降低(例如降低转录),例如,由在FOXP3基因和增强序列之间产生额外距离的DNA的构象变化引起的转录降低。在一个实施方案中,相关的FOXP3基因和一个或多个转录控制序列(例如增强序列)位于锚定序列介导的结合体内。锚定序列介导的结合体的破坏降低了FOXP3基因的表达。在一个实施方案中,与锚定序列介导的结合体相关的FOXP3基因是至少部分地位于锚定序列介导的结合体内的一个或多个转录控制元件可及的。
在一些实施方案中,FOXP3基因的表达通过一个或多个转录控制元件调控、调节或影响,所述转录控制元件与锚定序列介导的结合体相关,但由于锚定序列介导的结合体而不可及。例如,与FOXP3基因相关的锚定序列介导的结合体破坏了一个或多个转录控制元件调控、调节或影响FOXP3基因表达的能力。转录控制序列可以与FOXP3基因分开,例如至少部分地位于锚定序列介导的结合体的相对侧,例如作为FOXP3基因的锚定序列介导的结合体的内部或外部,例如由于锚定序列介导的结合体的接近,FOXP3基因是转录控制元件不可及的。在一些实施方案中,一个或多个增强序列通过锚定序列介导的结合体(例如2型锚定序列介导的结合体)与FOXP3基因隔开。
在一些实施方案中,由于锚定序列介导的结合体,FOXP3基因是一个或多个转录控制元件不可及的,并且锚定序列介导的结合体的破坏允许转录控制元件调控、调节或影响FOXP3基因的表达。在一个实施方案中,FOXP3基因在锚定序列介导的结合体的内部和外部且是一个或多个转录控制元件不可及的。锚定序列介导的结合体的破坏增加了转录控制元件的可及性以调控、调节或影响FOXP3基因表达,例如,转录控制元件增加FOXP3基因的表达。在一个实施方案中,FOXP3基因在锚定序列介导的结合体内部,且是至少部分地位于锚定序列介导的结合体外部的一个或多个转录控制元件不可及的。锚定序列介导的结合体的破坏增加了FOXP3基因的表达。在一个实施方案中,FOXP3基因至少部分位于锚定序列介导的结合体外部且是位于锚定序列介导的结合体内部的一个或多个转录控制元件不可及的。锚定序列介导的结合体的破坏增加了FOXP3基因的表达。
A.FOXP3位点特异性靶向部分
本发明的位点特异性FOXP3靶向部分靶向FOXP3表达控制区,并且可包含聚合物或聚合物分子,例如聚酰胺(即,通过酰胺结合连接的重复单元的分子,例如多肽)、核苷酸的聚合物(例如指导RNA、编码TALE多肽或锌指多肽的核酸分子)、肽核酸(PNA)或氨基酸的聚合物(例如肽或多肽,例如融合蛋白)等。合适的位点特异性FOXP3靶向部分、组合物及此类试剂和组合物的使用方法如在下文和在PCT公开WO 2018/049073中所述,其全部内容通过引用方式明确并入本文。
在一个实施方案中,本发明的位点特异性破坏剂包含位点特异性FOXP3靶向部分,所述位点特异性FOXP3靶向部分包含核酸分子(例如指导RNA(或gRNA))或指导RNA和效应物或其片段,或编码效应物或其片段的核酸分子。
在另一个实施方案中,本发明的位点特异性破坏剂包含位点特异性FOXP3靶向部分,所述位点特异性FOXP3靶向部分包含编码锌指多肽(ZNF)转录激活物样效应物(即TALEDNA结合域,或TALE)多肽的多肽(例如,DNA结合域)或其片段的核酸分子,所述核酸分子被工程化为特异性靶向FOXP3表达控制区以调节FOXP3基因的表达。
在另一个实施方案中,本发明的位点特异性破坏剂包含位点特异性FOXP3靶向部分,所述位点特异性FOXP3靶向部分包含多核苷酸,例如与效应物多肽或其片段连接的PNA(例如核酸gRNA)。
在另一个实施方案中,本发明的位点特异性破坏剂包含位点特异性FOXP3靶向部分和效应物,所述位点特异性FOXP3靶向部分包含融合物分子,例如编码转录激活物样效应物(TALE)多肽或锌指(ZNF)多肽的DNA结合域或其片段的核酸分子。
在一个实施方案中,此类位点特异性破坏剂包含第二融合蛋白,其中所述第二融合蛋白包含靶向第二FOXP3表达控制区的第二位点特异性FOXP3靶向部分和第二效应物分子,其中所述第二FOXP3表达控制区不同于所述FOXP3表达控制区。
在另一个实施方案中,本发明的位点特异性破坏剂包含位点特异性FOXP3靶向部分,所述位点特异性FOXP3靶向部分包含融合物分子,例如编码包含Cas多肽和例如表观遗传募集剂或表观遗传CpG修饰剂的融合蛋白的核酸分子。
在又一个实施方案中,本发明的位点特异性破坏剂包含位点特异性FOXP3靶向部分,所述位点特异性FOXP3靶向部分包含融合物分子,例如包含Cas多肽和例如表观遗传募集剂或表观遗传CpG修饰剂的融合蛋白。
如本文所用,在其最广泛的意义上,术语“核酸”是指并入或可并入寡核苷酸链中的任何化合物和/或物质。在一些实施方案中,核酸是通过磷酸二酯键并入或可并入多核苷酸链中的化合物和/或物质。从上下文将清楚看出,在一些实施方案中,“核酸”是指单个核酸残基(例如,核苷酸和/或核苷);在一些实施方案中,“核酸”是指包含单个核酸残基的多核苷酸链。在一些实施方案中,“核酸”是或包含RNA;在一些实施方案中,“核酸”是或包含DNA。在一些实施方案中,“核酸”是包含锁核酸分子和脱氧核酸分子的“混合物”。在一些实施方案中,核酸是、包含或由一个或多个天然核酸残基组成。在一些实施方案中,核酸是、包含或由一种或多种核酸类似物组成。在一些实施方案中,核酸类似物与核酸的不同之处在于其不采用磷酸二酯主链。例如,在一些实施方案中,核酸是、包含或由一个或多个“肽核酸”组成,其是本领域内已知的且在主链中具有肽键而不是磷酸二酯键,被认为在本发明的范围内。或者或另外,在一些实施方案中,核酸具有一个或多个硫代磷酸酯和/或5’-N-亚磷酰胺连接而不是磷酸二酯键。在一些实施方案中,核酸是、包含或由一种或多种天然核苷(例如腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷)组成。在一些实施方案中,核酸是、包含或由一种或多种核苷类似物(例如,2-氨基腺苷、2-硫代胸苷、肌苷、吡咯-嘧啶、3-甲基腺苷、5-甲基胞苷、C-5丙炔基-胞苷、C-5丙炔基-尿苷、2-氨基腺苷、C5-溴尿苷、C5-氟尿苷、C5-碘尿苷、C5-丙炔基-尿苷、C5-丙炔基-胞苷、C5-甲基胞苷、2-氨基腺苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、0(6)-甲基鸟嘌呤、2-硫代胞苷、甲基化碱基、插入碱基及其组合)组成。在一些实施方案中,与天然核酸中的那些相比,核酸包含一种或多种修饰的糖(例如,2’-氟代核糖、核糖、2’-脱氧核糖、阿拉伯糖和己糖)。在一些实施方案中,核酸具有编码功能性基因产物(例如RNA或蛋白质)的核苷酸序列。在一些实施方案中,核酸包括一个或多个内含子。在一些实施方案中,核酸是通过从天然来源分离、通过基于互补模板的聚合的酶促合成(体内或体外)、在重组细胞或系统中复制和化学合成中的一种或多种制备的。在一些实施方案中,核酸的长度为至少3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、160、170、180、190、20、225、250、275、300、325、350、375、400、425、450、475、500、600、700、800、900、1000、1500、2000、2500、3000、3500、4000、4500、5000或更多个残基。在一些实施方案中,核酸是部分或全部单链的;在一些实施方案中,核酸是部分或全部双链的。在一些实施方案中,核酸具有核苷酸序列,所述核苷酸序列包含至少一个编码多肽或是编码多肽的序列的互补序列的元件。在一些实施方案中,核酸具有酶活性。
如本文所用,术语“肽”、“多肽”和“蛋白质”是指由通过肽键或通过除肽键以外的方式共价连接的氨基酸残基构成的化合物。蛋白质或肽必须包含至少两个氨基酸且对可构成蛋白质的或肽的序列的氨基酸的最大数目没有限制。多肽包括包含通过肽键或通过除肽键以外的方式彼此连接的两个或更多个氨基酸的任何肽或蛋白质。如本文所用,该术语是指许多类型的短链(其在本领域内通常也被称为例如肽、寡肽和寡聚体)以及长链(其在本领域内通常被称为蛋白质)。
在某些实施方案中,多肽是或可包含嵌合蛋白或“融合蛋白”。如本文所用,“嵌合蛋白”或“融合蛋白”包含可操作地连接至异源第二多肽(即不同于第一蛋白的多肽)的第一蛋白的全部或部分(优选生物活性部分)。在融合蛋白中,术语“可操作地连接”意指第一蛋白或其片段和异源多肽相互框内融合。异源多肽可以与第一蛋白或片段的氨基末端或羧基末端融合。
“聚酰胺”是具有通过酰胺结合连接的重复单元的聚合物分子。蛋白质是天然聚酰胺的示例。在一些实施方案中,聚酰胺包含肽核酸(PNA)。
“肽核酸”(“PNA”)是其中PNA中的一个或多个氨基酸单元具有含酰胺的主链的分子,例如氨乙基-甘氨酸,类似于肽主链,其中用核酸侧链代替氨基酸侧链。已知肽核酸(PNA)以比它们的寡核苷酸对应物更高的亲和力杂交互补的DNA和RNA。PNA的这一特征不仅使它们成为与核酸侧链的稳定杂合体,而且同时中性主链和疏水侧链产生多肽内的疏水单元。核酸侧链包括但不限于嘌呤或嘧啶侧链,例如腺嘌呤、胞嘧啶、鸟嘌呤、胸腺嘧啶和尿嘧啶。在一个实施方案中,核酸侧链包括本文所述的核苷类似物。
在一个实施方案中,本发明的位点特异性FOXP3靶向部分包含聚酰胺。用于本发明的试剂和组合物的合适的聚酰胺是本领域内已知的。
在一个实施方案中,本发明的位点特异性FOXP3靶向部分包含多核苷酸。在一些实施方案中,多核苷酸的核苷酸序列编码FOXP3基因或FOXP3表达产物。在一些实施方案中,多核苷酸的核苷酸序列不包括FOXP3编码序列或FOXP3表达产物。例如,在一些实施方案中,本发明的位点特异性FOXP3靶向部分包含与靶表达控制区(例如启动子、锚定序列或转录起始位点上游周围或接近上游的DNA区)杂交的多核苷酸。在一些实施方案中,多核苷酸的核苷酸序列是转录起始位点上游周围或接近上游的靶DNA区的互补序列,或具有与靶序列的互补序列至少80%、至少85%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%同一性的序列。
本发明的多核苷酸可以包括脱氧核苷酸、核糖核苷酸、经修饰的脱氧核苷酸、经修饰的核糖核苷酸(例如化学修饰,例如改变主链连接、糖分子和/或核酸碱基的修饰)和人工核酸。在一些实施方案中,多核苷酸包括但不限于基因组DNA、cDNA、肽核酸(PNA)、或肽寡核苷酸缀合物、锁核酸(LNA)、桥接核酸(BNA)、聚酰胺、三链体形成寡核苷酸、经修饰的DNA、反义DNA寡核苷酸、tRNA、mPvNA、rPvNA、经修饰的RNA、miRNA、gRNA和siRNA或其他RNA或DNA分子。
在一些实施方案中,本发明的多核苷酸的长度为约2至约5000nt、约10至约100nt、约50至约150nt、约100至约200nt、约150至约250nt、约200至约300nt、约250至约350nt、约300至约500nt、约10至约1000nt、约50至约1000nt、约100至约1000nt、约1000至约2000nt、约2000至约3000nt、约3000至约4000nt、约4000至约5000nt或其间的任何范围。
本发明的多核苷酸可以包括核苷,例如嘌呤或嘧啶,例如腺嘌呤、胞嘧啶、鸟嘌呤、胸腺嘧啶和尿嘧啶。在一些实施方案中,多核苷酸包含一种或多种核苷类似物。核苷类似物包括但不限于如5-氟尿嘧啶;5-溴尿嘧啶、5-氯尿嘧啶、5-碘尿嘧啶、次黄嘌呤、黄嘌呤、4-乙酰胞嘧啶、4-甲基苯并咪唑,5-(羧基羟甲基)尿嘧啶、5-羧甲基氨基甲基-2-硫代尿苷、5-羧甲基氨基甲基尿嘧啶、二氢尿嘧啶、二氢尿苷、β-D-半乳糖基奎宁苷(beta-D-galactosylqueosine)、肌苷、N6-异戊烯基腺嘌呤、1-甲基鸟嘌呤、1-甲基肌苷、2,2-二甲基鸟嘌呤、2-甲基腺嘌呤、2-甲基鸟嘌呤、3-甲基胞嘧啶、5-甲基胞嘧啶、N6-腺嘌呤、7-甲基鸟嘌呤、5-甲氨基甲基尿嘧啶、5-甲氧基氨基甲基-2-硫尿嘧啶、β-D-甘露糖基奎宁苷(beta-D-mannosylqueosine)、5’-甲氧基羧甲基尿嘧啶、5-甲氧基尿嘧啶、2-甲硫基-N6-异戊烯基腺嘌呤、尿嘧啶-5-羟乙酸(v)、怀俄丁氧苷(wybutoxosine)、假尿嘧啶、奎宁苷(queosine)、2-巯基胞嘧啶、5-甲基-2-硫脲嘧啶、2-硫尿嘧啶、4-硫尿嘧啶、5-甲基尿嘧啶、尿嘧啶-5-羟乙酸甲酯、尿嘧啶-5-羟乙酸(v)、5-甲基-2-硫尿嘧啶、3-(3-氨基-3-N-2-羧丙基)尿嘧啶、(acp3)w、2,6-二氨基嘌呤、3-硝基吡咯、肌苷、硫尿苷、辫苷(queuosine)、怀俄苷(wyosine)、二氨基嘌呤、异鸟嘌呤、异胞嘧啶、二氨基嘧啶、2,4-二氟甲苯、异喹啉、吡咯并[2,3-]吡啶和任何其他能够与嘌呤或嘧啶侧链碱基配对的核苷类似物。
在一些实施方案中,本发明的位点特异性FOXP3靶向部分包含编码多肽的多核苷酸,所述多肽包含锌指多肽(ZNF)或转录激活物样效应物(TALE)多肽的DNA结合域(DBD)或其片段,所述多核苷酸被工程化以特异性靶向FOXP3表达控制区以调节FOXP3基因的表达。
特异性结合目标DNA靶区域(例如FOXP3表达控制区)的这种锌指多肽的设计和制备是本领域内众所周知的。例如,锌指(ZNF)蛋白包含特异性结合核苷酸三联体的DNA结合基序。因此,为了设计和制备本发明的位点特异性FOXP3靶向部分,可以使用模块化组装方法,该方法包括结合能够各自识别特定的3-碱基对DNA序列的单独的锌指DNA结合域以产生识别长度在9个碱基对至24个碱基对范围内的特定靶位点的3-指、4-指、5-指、6-指、6-指或8-指的锌指多肽。另一种合适的方法可包括2-指模块以产生具有多达6个单独锌指的ZNF多核苷酸。参见例如Shukla VK等,Nature.459(7245)2009:437-41;Dreier B等,JBC.280(42)2005:35588-97;Dreier B等,JBC 276(31)2001:29466-78;Bae KH等,NatureBiotechnology.21(3)2003:275-80。
在一些实施方案中,本发明的位点特异性FOXP3靶向部分包含编码多肽的多核苷酸,所述多肽包含锌指的DNA结合域(DBD)或其片段,所述多核苷酸被工程化为特异性靶向FOXP3表达控制区以调节FOXP3基因的表达。编码结合适用于本发明的核苷酸三联体的锌指的示例性氨基酸序列提供于下表1A中。(参见,例如Gersbach等,Synthetic Zinc FingerProteins:The Advent of Targeted Gene Regulation and Genome ModificationTechnologies)。
表1A.
/>
/>
锌指DNA结合域包含N-端区域和C-端区域,其间具有结合靶DNA序列的“指”。N-端区域的长度通常为7个氨基酸。C-端区域长度通常为6个氨基酸。因此,N-端区域通常包含氨基酸序列X
DNA结合域中的每个指侧邻位于该指N-端的N-端主链和位于该指C-端的C-端主链。指的N-端主链的长度通常为11个氨基酸,在第3和第6位具有两个保守半胱氨酸(C)。因此,指的N-端主链通常包含氨基酸序列X
四个核苷酸三联体的“指”氨基酸序列是未知的,但是,如果这样的三联体在感兴趣的靶区域中被鉴定,则两个“接头跨度序列”(接头跨度1和接头跨度2)可用于规避该问题。如果三联体的“指”氨基酸序列不可用,则接头跨度1用于跳过一个碱基对。如果三联体的“指”氨基酸序列不可用,则接头跨度2用于跳过2个碱基对。接头跨度1的长度通常为12个氨基酸。接头跨度2的长度通常为16个氨基酸。因此,接头跨度1通常包含氨基酸序列X
表1B提供用于本发明的示例性锌指DNA结合域的氨基酸序列及其相应的靶区域。
在一些实施方案中,适用于本发明的破坏剂的锌指DNA结合域包含与表1B中提供的锌指DNA结合域的任何一个的完整氨基酸序列具有至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%氨基酸同一性的氨基酸序列。
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
/>
类似地,特异性结合目标DNA靶区域(例如FOXP3表达控制区)的这类TALE多肽的设计和制备是本领域众所周知的。例如,TALE DNA结合域包含重复的高度保守的33-34氨基酸的序列,其具有不同的第12和第13氨基酸。这两个位置(称为重复可变双残基(RVD))是高度可变的,并显示与特定核苷酸识别的强相关性。氨基酸序列和DNA识别之间的这种直接关系允许通过选择含有适当RVD的重复片段的组合来工程化特异性DNA结合域。参见,例如BochJ Nature Biotechnology.29(2)2011:135-6;Boch J等,Science.326(5959)2009:1509-12;Moscou MJ&Bogdanove AJ Science.326(5959)2009:1501。
在一些实施方案中,包含多核苷酸的本发明的位点特异性FOXP3靶向部分包含指导RNA(或gRNA)或编码指导RNA的核酸。gRNA是包含例如引导效应物至FOXP3表达控制元件所必需的“支架”序列的短合成RNA分子,其可以例如包含靶向含FOXP3表达控制元件的基因组靶序列的约20个核苷酸位点特异性序列。
通常,指导RNA序列被设计为具有约17至约24个核苷酸(例如19、20或21个核苷酸)的长度并且与靶序列互补。定制gRNA发生器和算法在商业上可得以用于有效的指导RNA的设计。基因编辑也已使用嵌合“单指导RNA”(“sgRNA”)实现,其为模拟天然存在的crRNA-tracrRNA复合体且包含tracrRNA(用于结合核酸酶)和至少一种crRNA(以引导核酸酶至用于编辑的靶序列)的工程化(合成)单RNA分子。化学修饰的sgNA也已被证实在基因组编辑中是有效的;参见,例如Hendel等(2015)Nature Biotechnol.,985-991。
在某些实施方案中,本发明的位点特异性FOXP3靶向部分包含指导RNA(或gRNA)或编码指导RNA和蛋白质或肽的核酸。在一些实施方案中,蛋白质或肽包含CRISPR相关蛋白(CaS)多肽或其片段(例如,Cas9多肽或其片段)。在一个实施方案中,合适的Cas多肽是无酶活性的Cas多肽,例如“死Cas多肽”或“dCaS”多肽。
包含多核苷酸(例如gRNA)的示例性位点特异性FOXP3靶向部分提供于下表2中。在一些实施方案中,多核苷酸包含与表2中核苷酸序列的任何一个的完整核苷酸序列具有至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%同一性的核苷酸序列。
应当理解,尽管表2中的序列被描述为经修饰的(或未修饰的),但本发明所涵盖的核酸分子(例如位点特异性破坏剂)可以包含表2中所列的未修饰的或与本文所述修饰不同的任何一个序列。还应当理解,尽管表2中的一些序列在用作本发明的位点特异性靶向部分中的RNA分子(例如指导RNA)时具有“Ts”,但“Ts”可被“Us”替代。
在一些实施方案中,包含多核苷酸(例如gRNA)的位点特异性FOXP3靶向部分包含与锚定序列互补的核苷酸序列。在一个实施方案中,锚定序列包含CTCF结合基序或共有序列:N(T/C/G)N(G/A/T)CC(A/T/G)(C/G)(C/T/A)AG(G/A)(G/T)GG(C/A/T)(G/A)(C/G)(C/T/A)(G/A/C)(SEQ ID NO:1),其中N是任何核苷酸。CTCF结合基序或共有序列也可以是相反取向的,例如(G/A/C)(C/T/A)(C/G)(G/A)(C/A/T)GG(G/T)(G/A)GA(C/T/A)(C/G)(A/T/G)CC(G/A/T)N(T/C/G)N(SEQ ID NO:2)。在一些实施方案中,核酸序列包含与CTCF结合基序或共有序列互补的序列。
在一些实施方案中,多核苷酸包含与锚定序列至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%互补的核苷酸序列。
在一些实施方案中,多核苷酸包含与CTCF结合基序或共有序列至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%互补的核苷酸序列。在一些实施方案中,多核苷酸选自由gRNA和与锚定序列互补的序列或包含与锚定序列至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%互补的序列的序列组成的组。
在一些实施方案中,包含本发明的多核苷酸的位点特异性FOXP3靶向部分是RNAi分子。RNAi分子包括RNA或RNA样结构,其通常包含15-50个碱基对(例如约18-25个碱基对)并且具有与细胞内表达的靶基因中的编码序列相同(互补)或几乎相同(基本上互补)的核碱基序列。RNAi分子包括但不限于:短干扰RNA(siRNA)、双链RNA(dsRNA)、微RNA(miRNA)、短发夹RNA(shRNA)、部分双链体(meroduplexe)和dicer底物(美国专利号8,084,599、8,349,809和8,513,207)。在一个实施方案中,本发明包括抑制编码本文所述多肽(例如结合成核分子)的基因的表达的组合物。
RNAi分子包含与靶基因的全部或片段基本上互补或完全互补的序列。RNAi分子可以在内含子和外显子之间的边界处补充序列,以防止新产生的特定基因的核RNA转录物成熟为用于转录的mRNA。与特定基因互补的RNAi分子可与该基因的mRNA杂交并阻止其翻译。反义分子可以是DNA、RNA或其衍生物或杂合物。这种衍生分子的示例包括但不限于肽核酸(PNA)和基于硫代磷酸酯的分子,例如脱氧核糖核酸胍(DNG)或核糖核酸胍(R G)。
RNAi分子可以作为体外合成的“即用型”RNA或作为转染至细胞内的反义基因(其在转录后将产生RNAi分子)提供给细胞。与mRNA的杂交导致通过RNAse H降解杂交分子和/或抑制翻译复合体的形成。两者都导致不能产生原始基因的产物。
与目标转录物杂交的RNAi分子的长度应为约10个核苷酸,约15或30个核苷酸之间,或约15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或更多个核苷酸。反义序列与靶向的转录物的同一性程度应为至少75%、至少80%、至少85%、至少90%或至少95%。
RNAi分子还可以包含突出端,即通常不成对的突出核苷酸,其不直接参与由本文定义的有义链和反义链对的核心序列正常形成的双螺旋结构。RNAi分子可在每个有义链和反义链上独立包含约1-5个碱基的3’和/或5’突出端。在一个实施方案中,有义链和反义链均包含3’和5’突出端。在一个实施方案中,一条链的一个或多个3’突出端核苷酸与另一条链的一个或多个5’突出端核苷酸配对。在另一个实施方案中,一条链碱基的一个或多个3’突出端核苷酸不与另一条链的一个或多个5’突出端核苷酸配对。RNAi分子的有义链和反义链可包含或不包含相同数目的核苷酸碱基。反义链和有义链可形成双链体,其中仅5’端具有平端,仅3’端具有平端,5’端和3’端均为平端,或5’端和3’端均不是平端。在另一个实施方案中,突出端中一个或多个核苷酸包含硫代磷酸、硫代磷酸酯、脱氧核苷酸反向(3’-3’连接)核苷酸或是经修饰的核糖核苷酸或脱氧核苷酸。
小干扰RNA(siRNA)分子包含与靶mRNA的约15至约25个连续核苷酸相同的核苷酸序列。在一些实施方案中,siRNA序列从二核苷酸AA开始,包含约30-70%(约50-60%、约40-60%、或约45%-55%)的GC含量,并且与其引入其中的哺乳动物基因组中除靶标以外的任何核苷酸序列不具有高百分比同一性,例如通过标准BLAST检索确定。
siRNA和shRNA类似于内源性微RNA(miRNA)基因的加工途径中的中间体(Bartel,Cell 116:281-297,2004)。在一些实施方案中,siRNA可作为miRNA发挥作用且反之亦然(Zeng等,Mol Cell 9:1327-1333,2002;Doench等,Genes Dev 17:438-442,2003)。与siRNA类似,微RNA使用RISC以下调靶基因,但与siRNA不同,大多数动物miRNA不切割mRNA。相反,miRNA通过翻译抑制或polyA去除和mRNA降解减少蛋白质输出(Wu等,Proc Natl Acad SciUSA 103:4034-4039,2006)。已知的miRNA结合位点在mRNA 3’UTR内;miRNA似乎靶向与miRNA 5’末端的核苷酸2-8几乎完全互补的位点(Rajewsky,Nat Genet 38Suppl:S8-13,2006;Lim等,Nature 433:769-773,2005)。该区域被称为种子区域。因为siRNA和miRNA是可互换的,外源性siRNA下调具有与siRNA的种子互补性的mRNA(Birmingham等,Nat Methods3:199-204,2006)。3’UTR内的多个靶位点给出更强的下调(Doench等,Genes Dev 17:438-442,2003)。
已知的miRNA序列的列表可以在由研究组织维护的数据库中找到,例如WellcomeTrust Sanger Institute、Perm Center for Bioinformatics、Memorial SloanKettering Cancer Center和European Molecule Biology Laboratory等。已知的有效siRNA序列和同源结合位点也在相关文献中充分描述。通过本领域内已知的技术容易地设计和生产RNAi分子。此外,存在增加发现有效且特异性序列基序的机会的计算工具(Pei等,2006;Reynolds等,2004;Khvorova等,2003;Schwarz等,2003;Ui-Tei等,2004;Heale等,2005;Chalk等,2004;Amarzguioui等,2004)。
RNAi分子调节由基因编码的RNA的表达。因为多个基因可以相互共享一定程度的序列同源性,在一些实施方案中,RNAi分子可以被设计为靶向具有足够序列同源性的一类基因。在一些实施方案中,RNAi分子可包含与在不同基因靶标之间共有的或对特定基因靶标独特的序列互补的序列。在一些实施方案中,RNAi分子可被设计为靶向在若干基因之间具有同源性的RNA序列的保守区,从而靶向基因家族中的若干基因(例如不同的基因异构体、剪接变体、突变基因等)。在一些实施方案中,RNAi分子可被设计为靶向单一基因的特定RNA序列所特有的序列。
在一些实施方案中,RNAi分子靶向结合成核分子(例如CTCF、黏连蛋白、USF1、YY1、TATA-盒结合蛋白相关因子3(TAF3)、ZNF143)中的序列,或促进锚定序列介导的结合体的形成的另一多肽,或表观遗传修饰剂,例如参与翻译后修饰的酶,其包括但不限于DNA甲基化酶(例如DNMT3a、DNMT3b、DNMTL),DNA去甲基化酶(例如催化5-甲基胞嘧啶氧化成5-羟甲基胞嘧啶和更高级氧化衍生物的TET家族酶),组蛋白甲基转移酶,组蛋白脱乙酰酶(例如HDAC1、HDAC2、HDAC3),去乙酰化酶1、2、3、4、5、6或7,赖氨酸特异性组蛋白去甲基化酶1(LSD1),组蛋白-赖氨酸-N-甲基转移酶(Setdbl),常染色质组蛋白-赖氨酸N-甲基转移酶2(G9a),组蛋白-赖氨酸N-甲基转移酶(SUV39H1),zeste同源物2增强子(EZH2),病毒赖氨酸甲基转移酶(vSET),组蛋白甲基转移酶(SET2),蛋白质-赖氨酸N-甲基转移酶(SMYD2)等。在一个实施方案中,RNAi分子靶向蛋白质脱乙酰酶,例如去乙酰化酶1、2、3、4、5、6或7。在一个实施方案中,本发明包括包含靶向结合成核分子(例如CTCF)的RNAi的组合物。
在一些实施方案中,位点特异性FOXP3靶向部分包含肽或蛋白质部分。在一些实施方案中,位点特异性破坏剂包含融合蛋白。在一些实施方案中,效应物是肽或蛋白质部分。肽或蛋白质部分可包括但不限于肽配体、抗体片段、或结合受体(如细胞外受体)的靶向适体、神经肽、激素肽、肽药物、毒性肽、病毒或微生物肽、合成肽和激动剂或拮抗剂肽。
示例性肽或蛋白质包括DNA结合蛋白、CRISPR组分蛋白、结合成核分子、显性负性结合成核分子、表观遗传修饰剂或其任何组合。在一些实施方案中,肽包括核酸酶、物理阻断剂、表观遗传募集剂和表观遗传CpG修饰剂及前述的任何片段和组合。在一些实施方案中,肽包括蛋白质的DNA结合域,例如螺旋-转角-螺旋基序、亮氨酸拉链、Zn-指、TATA盒结合蛋白、转录因子。
肽或蛋白质可以是直链或支链的。肽或蛋白质部分可具有约5至约200个氨基酸、约15至约150个氨基酸、约20至约125个氨基酸、约25至约100个氨基酸、约20-70个氨基酸、约20-80个氨基酸、约20-90个氨基酸、约30-100个氨基酸、约30-60个氨基酸、约30-80个氨基酸、约35-85个氨基酸、约40-100个氨基酸、或约50-125个氨基酸或其间的任何范围的长度。
如上所述,在一些实施方案中,本发明的位点特异性FOXP3靶向部分包含融合蛋白。
在一些实施方案中,本发明的融合蛋白包括靶向FOXP3表达控制区的位点特异性FOXP3靶向部分和效应物分子。在其他实施方案中,本发明的融合蛋白包含效应物分子。示例性效应物分子如下文所述且在一些实施方案中包括例如核酸酶、物理阻断剂、表观遗传募集剂(例如转录增强子或转录阻遏物)和表观遗传CpG修饰剂(例如DNA甲基化酶、DNA去甲基化酶、组蛋白修饰剂、组蛋白转乙酰酶或组蛋白脱乙酰酶)及前述的任何组合。
例如,位点特异性靶向部分可包含gRNA和效应物,例如核酸酶,例如Cas9,例如野生型Cas9、切口酶Cas9(例如Cas9 D10A)、死亡Cas9(dCas9)、eSpCas9、Cpf1、C2C1或C2C3、或编码此类核酸酶的核酸。核酸酶和gRNA的选择取决于靶向的突变是否为核苷酸的缺失、取代或添加,例如对靶序列的核苷酸的缺失、取代或添加。无催化活性的核酸内切酶(例如死亡Cas9(dCas9,例如D10A;H840A))与(一个或多个)效应物结构域的全部或一部分(例如生物活性部分)拴系的融合产生嵌合蛋白,所述嵌合蛋白可通过一个或多个RNA序列(例如DNA识别元件,其包括但不限于锌指阵列、sgRNA、TAL阵列、本文所述肽核酸)连接至多肽以将组合物引导至特定DNA位点,从而调节一个或多个靶核酸序列的活性和/或表达(例如使DNA序列甲基化或去甲基化)。
在一个实施方案中,本发明的融合蛋白可包含效应物分子,其包含例如CRISPR相关蛋白(Cas)多肽或其片段(例如Cas9多肽或其片段)和表观遗传募集剂或表观遗传CpG修饰剂。
在一个实施方案中,合适的Cas多肽是无酶活性的Cas多肽,例如“死Cas多肽”或“dCas”多肽。
适用于本文所述方法和组合物的示例性Cas多肽如下所述。使用本领域已知的方法,Cas多肽可与本文所述多种试剂和/或分子中的任何一种融合;这样得到的融合物分子可用于多种公开的方法。
在一个方面,本发明包括包含蛋白质及与将蛋白质靶向位点特异性靶序列的至少一种指导RNA(gRNA)或反义DNA寡核苷酸组合的组合物,所述蛋白质包含作用于DNA的结构域(例如效应物)(例如核酸酶结构域,例如Cas9结构域,例如dCas9结构域;DNA甲基转移酶、去甲基化酶、脱氨酶),其中所述组合物在人细胞中有效改变靶基因的表达。在一些实施方案中,酶结构域是Cas9或dCas9。在一些实施方案中,蛋白质包含两个酶结构域,例如dCas9和甲基化酶或去甲基化酶结构域。
在一个方面,本发明包括包含蛋白质及与将蛋白质靶向位点特异性靶序列的至少一种指导RNA(gRNA)或反义DNA寡核苷酸组合的组合物,所述蛋白质包含含有转录控制元件的结构域(例如效应物)(例如核酸酶结构域,例如Cas9结构域,例如dCas9结构域;转录增强子;转录阻遏物),其中所述组合物在人细胞中有效改变靶基因的表达。在一些实施方案中,酶结构域是Cas9或dCas9。在一些实施方案中,蛋白质包含两个酶结构域,例如dCas9和转录增强子或转录阻遏物结构域。
如本文所用,“效应物结构域的生物活性部分”是维持效应物结构域的功能(例如完全地、部分地、最低限度地)的部分(例如“最小”或“核心”结构域)。
本文所述的嵌合蛋白还可以包含接头,例如氨基酸接头。在一些方面,接头包含2个或更多个氨基酸,例如一个或多个GS序列。在一些方面,Cas9(例如dCas9)与两个或更多个效应物结构域(例如,DNA甲基化酶或在DNA去甲基化中起作用的酶或蛋白乙酰转移酶或脱乙酰酶)的融合包括在结构域之间的一个或多个散布的接头(例如GS接头)。在一些方面,dCas9与具有散布的接头的2-5效应物结构域融合。
在一些实施方案中,位点特异性FOXP3靶向部分包含结合成核分子、编码结合成核分子的核酸或其组合。在一些实施方案中,锚定序列介导的结合体通过结合至第一锚定序列的第一结合成核分子、结合至非邻接的第二锚定序列的第二结合成核分子以及第一和第二结合成核分子之间的缔合介导。在一些实施方案中,结合成核分子可以例如通过竞争性结合(内源性结合成核分子与其结合位点的结合)破坏。
结合成核分子可以是例如CTCF、黏连蛋白、USF1、YY1、TATA-盒结合蛋白相关因子3(TAF3)、ZNF143结合基序或促进锚定序列介导的结合体形成的另一种多肽。结合成核分子可以是内源多肽或其他蛋白质,例如转录因子,例如自身免疫调节剂(AIRE),另一种因子,例如X-失活特异性转录物(XIST),或被工程化以识别特定目标DNA序列的工程化多肽,例如具有锌指、亮氨酸拉链或用于序列识别的bHLH结构域。结合成核分子可以调节锚定序列介导的结合体内或周围的DNA相互作用。例如,结合成核分子可以将其他因子募集至锚定序列,其改变锚定序列介导的结合体的形成或破坏。
结合成核分子还可以具有用于同源或异源二聚化的二聚化结构域。一种或多种结合成核分子(例如内源的和工程化的)可以相互作用以形成锚定序列介导的结合体。在一些实施方案中,结合成核分子被工程化以进一步包括稳定结构域(例如粘聚相互作用结构域)以稳定锚定序列介导的结合体。在一些实施方案中,结合成核分子被工程化以结合靶序列,例如调节靶序列结合亲和力。在一些实施方案中,选择或工程化结合成核分子,使其对锚定序列介导的结合体内的锚定序列具有选择的结合亲和力。可以通过使用CTCF中携带失活突变的细胞和染色体构象捕获或基于3C的方法(例如Hi-C或高通量测序)来鉴定结合成核分子及它们相应的锚定序列,以在不存在CTCF的情况下检测拓扑相关的结构域,例如远端DNA区域或基因座之间的拓扑相互作用。也可鉴定长程DNA相互作用。其他分析可包括使用诱饵(例如黏连蛋白、YY1或USF1、ZNF143结合基序和MS)的ChlA-PET分析以识别与诱饵相关的复合体。
B.效应物分子
用于本发明组合物和方法的效应物分子包括调节生物活性的那些,例如增强或减弱酶活性、基因表达、细胞信号传导和细胞或器官功能。本发明优选的效应物分子是核酸酶、物理阻断剂、表观遗传募集剂(例如转录增强子或转录阻遏物)和表观遗传CpG修饰剂(例如DNA甲基化酶、DNA去甲基化酶、组蛋白修饰剂、组蛋白转乙酰酶或组蛋白脱乙酰酶)及前述的任何组合。
其他效应物活性也可包含结合调节蛋白以调节调节子的活性(例如转录或翻译)。效应物分子还可包含本文所述的激活剂或抑制剂(或“负效应物”)功能。在另一个实施例中,效应物分子可抑制底物与受体结合并抑制其活化,例如纳曲酮和纳洛酮结合阿片样物质受体而不激活它们并阻断受体结合阿片样物质的能力。效应物分子还可调节蛋白质稳定性/降解和/或转录物稳定性/降解。例如,蛋白质可以通过多肽辅因子,泛素,靶向降解到蛋白质上以标记它们用于降解。在另一个实施例中,效应物分子通过阻断酶的活性位点来抑制酶活性,例如甲氨蝶呤是四氢叶酸的结构类似物,其是二氢叶酸还原酶的辅酶,其与二氢叶酸还原酶的结合比天然底物更紧密1000倍并抑制核苷酸碱基合成。
在一些实施方案中,效应物分子是化学品,例如调节胞嘧啶(C)或腺嘌呤(A)的化学品(例如亚硫酸氢钠、亚硫酸氢铵)。在一些实施方案中,效应物分子具有酶活性(甲基转移酶、去甲基化酶、核酸酶(例如Cas9)、脱氨酶)。在一些实施方案中,效应物分子在空间上阻碍锚定序列介导的结合体的形成或RNA聚合酶与启动子的结合。
具有效应物活性的效应物分子可以是本文所述的具有差PK/PD的小分子、肽、融合蛋白、核酸、纳米颗粒、适体或药物试剂(pharmacoagent)中的任何一种。
在一些实施方案中,效应物分子是抑制剂或“负效应物分子”。在调节锚定序列介导的结合体的形成的负效应物分子的情况下,在一些实施方案中,负效应物分子的特征在于负效应物分子存在时与不存在时相比,内源成核多肽的二聚化减少。例如,在一些实施方案中,负效应物分子是或包含内源成核多肽的二聚化结构域的变体或其二聚化部分。
例如,在某些实施方案中,通过使用显性负性效应物(例如识别并结合锚定序列(例如CTCF结合基序)但具有失活的(例如突变的)二聚化结构域(例如不能形成功能性锚定序列介导的结合体的二聚化结构域)的蛋白质)来改变(例如破坏)锚定序列介导的结合体。例如,可以改变CTCF的锌指结构域,使其结合特定的锚定序列(通过加入识别侧翼核酸的锌指),同时改变同源二聚化结构域以防止工程化CTCF和CTCF的内源形式之间的相互作用。
在一些实施方案中,效应物分子包含对靶锚定序列介导的结合体内的锚定序列具有选择的结合亲和力的合成结合成核分子(该结合亲和力与靶锚定序列相关的内源性结合成核分子的亲和力相比可以是至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、或者更高或更低。合成结合成核分子可以与内源结合成核分子具有30-90%、30-85%、30-80%、30-70%、50-80%、50-90%的氨基酸序列同一性)。结合成核分子可以例如通过竞争性结合(内源性结合成核分子与其锚定序列的结合)破坏。在更多的一些实施方案中,结合成核分子被工程化以结合锚定序列介导的结合体中的新锚定序列。
在一些实施方案中,显性负性效应物分子具有识别特定DNA序列(例如锚定序列、CTCF锚定序列、侧翼为赋予序列特异性的序列)的结构域和在锚定序列附近提供空间存在的第二结构域。第二结构域可包含显性负性的结合成核分子或其片段、干扰结合成核分子序列识别的多肽(例如,肽/核酸的氨基酸主链或PNA),赋予空间干扰的与小分子连接的核苷酸序列、或DNA识别元件和空间阻断剂的任何其他组合。
在一些实施方案中,效应物分子是表观遗传修饰剂。可用于本文所述方法和组合物的表观遗传修饰剂包括影响例如DNA甲基化/去甲基化、组蛋白乙酰化/去乙酰化和RNA相关沉默的试剂。在一些实施方案中,效应物序列特异性靶向表观遗传酶(例如产生或去除表观遗传标记(例如乙酰化和/或甲基化)的酶)。示例性的表观遗传效应物可通过包含位点特异性靶向部分的位点特异性破坏剂靶向包含例如转录控制元件或锚定序列的表达控制区。
在一些实施方案中,效应物分子包含基因编辑系统的一个或多个组分。基因编辑系统的组分可用于多种情况,其包括但不限于基因编辑。例如,这些组分可用于靶向物理修饰、遗传修饰和/或表观遗传修饰FOXP3序列的试剂。
示例性基因编辑系统包括成簇的规律间隔短回文重复(CRISPR)系统、锌指核酸酶(ZFN)和基于转录激活物样效应物的核酸酶(TALEN)。ZFN、TALEN和基于CRISPR的方法描述于例如Gaj等,Trends Biotechnol.31.7(2013):397-405;基因编辑的CRISPR方法描述于例如Guan等,Application of CRISPR-Cas system in gene therapy:Pre-clinicalprogress in animal model.DNA Repair 2016July 30[Epub ahead of print];Zheng等,Precise gene deletion and replacement using the CRISPR/Cas9 system in humancells.BioTechniques,Vol.57,No.3,September 2014,pp.115-124。
CRISPR系统是最初在细菌和古细菌中发现的适应性防御系统。CRISPR系统使用称为CRISPR相关或“Cas”核酸内切酶(例如Cas9或Cpf1)的RNA指导的核酸酶以切割外源DNA。在典型的CRISPR/Cas系统中,核酸内切酶通过靶向单链或双链DNA序列的序列特异性、非编码“指导RNA”被引导至靶核苷酸序列(例如基因组中待序列编辑的位点)。已经确定了三类(I-III)CRISPR系统。II类CRISPR系统使用单个Cas核酸内切酶(而不是多个Cas蛋白)。一种II类CRISPR系统包括II型Cas核酸内切酶例如Cas9、CRISPR RNA(“crRNA”)和反式激活crRNA(“tracrRNA”)。crRNA包含“指导RNA”,通常是对应于靶DNA序列的约20个核苷酸的RNA序列。crRNA还包含与tracrRNA结合以形成通过RNase III切割的部分双链结构的区域,从而产生crRNA/tracrRNA杂合体。然后crRNA/tracrRNA杂合体指导Cas9核酸内切酶识别和切割靶DNA序列。靶DNA序列通常必须与对给定Cas核酸内切酶具有特异性的“前间区序列邻近基序”(“PAM”)相邻;然而,PAM序列出现在整个给定的基因组中。从各种原核物种中鉴定的CRISPR核酸内切酶具有独特的PAM序列要求;PAM序列的示例包括5’-NGG(酿脓链球菌)、5’-NNAGAA(嗜热链球菌CRISPR1)、5’-NGGNG(嗜热链球菌CRISPR3)和5’-NNNGATT(脑膜炎奈瑟菌)。一些核酸内切酶(例如Cas9核酸内切酶)与富含G的PAM位点(例如5’-NGG)相关,及在PAM位点上游(从5’开始)3个核苷酸的位置进行靶DNA的平端切割。另一种II类CRISPR系统包含V型核酸内切酶Cpfl,其小于Cas9;示例包括AsCpfl(来自氨基酸球菌属)和LbCpfl(来自毛螺菌科物种)。Cpf1相关CRISPR阵列被加工为成熟crRNA而不需要tracrRNA;换句话说,Cpf1系统仅需要Cpf1核酸酶和crRNA来切割靶DNA序列。Cpf1核酸内切酶与富含T的PAM位点(例如5’-TTN)相关。Cpf1也可以识别5’-CTA PAM基序。Cpf1通过引入具有4-或5-核苷酸5’突出端的偏移的或错列的双链断裂切割靶DNA,例如,用位于编码链上PAM位点下游(从3’开始)18个核苷酸和互补链上PAM位点下游23个核苷酸的5-核苷酸偏移或错列切口切割靶DNA;由这种偏移切割产生的5-核苷酸突出端允许通过同源重组的DNA插入比通过平端切割的DNA处的插入更精确的基因组编辑。参见,例如Zetsche等(2015)Cell,163:759-771。
多种CRISPR相关(CaS)基因或蛋白可用于本发明,并且Cas蛋白的选择将取决于所述方法的特定条件。
CaS蛋白的具体示例包括II类系统,其包括Cas1、Cas2、Cas3、Cas4、Cas5、Cas6、Cas7、Cas8、Cas9、Cas10、Cpf1、C2C1或C2C3。在一些实施方案中,Cas蛋白(例如Cas9蛋白)可来自多种原核物种中的任何一种。在一些实施方案中,选择特定的Cas蛋白(例如特定的Cas9蛋白)以识别特定的前间区序列邻近基序(PAM)序列。在一些实施方案中,位点特异性靶向部分包括序列靶向多肽,例如酶,例如Cas9。在某些实施方案中,Cas蛋白(例如Cas9蛋白)可从细菌或古细菌获得或使用已知方法合成。在某些实施方案中,Cas蛋白可来自革兰氏阳性细菌或革兰氏阴性细菌。在某些实施方案中,Cas蛋白可以来自链球菌(例如,化脓性链球菌、嗜热链球菌)、隐球菌、棒状杆菌、嗜血杆菌、真杆菌、巴氏杆菌、普雷沃菌、韦永氏球菌或海杆菌。在一些实施方案中,编码两种或更多种不同Cas蛋白的核酸或者两种或更多种Cas蛋白可被引入细胞、受精卵、胚胎或动物中,例如以允许包含相同、相似或不同PAM基序的位点的识别和修饰。在一些实施方案中,Cas蛋白被修饰以使核酸酶失活(例如核酸酶缺陷型Cas9)并募集转录激活子或阻遏物,例如E.coli Pol的共同亚单位,VP64,p65的活化结构域,KRAB或SID4X,以诱导表观遗传修饰,例如组蛋白乙酰转移酶、组蛋白甲基转移酶和去甲基化酶、DNA甲基转移酶和在DNA去甲基化中发挥作用的酶(例如催化5-甲基胞嘧啶氧化成5-羟甲基胞嘧啶和更高级氧化衍生物的TET家族酶)。
出于基因编辑的目的,CRISPR阵列可以被设计为包含对应于所希望的靶DNA序列的一个或多个指导RNA序列;参见,例如Cong等,(2013)Science,339:819-823;Ran等,(2013)Nature Protocols,8:2281-2308。Cas9需要gRNA序列的至少约16或17个核苷酸用于发生DNA切割;对于Cpf1,需要gRNA序列的至少约16个核苷酸以实现可检测的DNA切割。
虽然野生型Cas9在gRNA靶向的特定DNA序列处产生双链断裂(DSB),但是许多具有修饰的功能性的CRISPR核酸内切酶是可用的,例如Cas9的“切口酶”形式仅产生单链断裂;无催化活性的Cas9(“dCas9”)不切割靶DNA,但通过空间位阻干扰转录。dCas9还可以与异源效应物融合以抑制(CRISPRi)或激活(CRISPRa)靶基因的表达。例如,Cas9可以与转录沉默子(例如KRAB结构域)或转录激活因子(例如dCas9-VP64融合物)融合。与FokI核酸酶融合的无催化活性的Cas9(dCas9)(“dCas9-FokI”)可被用于在与两个gRNA同源的靶序列处产生DSB。参见,例如公开并可获自Addgene存储库的众多CRISPR/Cas9质粒(Addgene,75SidneySt.,Suite 550A,Cambridge,MA 02139;addgene.org/crispr)。引入两个单独的双链断裂(每个双链断裂由单独的指导RNA引导)的“双切口酶”Cas9被Ran等,(2013)Cell,154:1380-1389描述为实现更准确的基因组编辑。
用于编辑真核生物的基因的CRISPR技术公开于美国专利申请公布2016/0138008A1和US2015/0344912A1中,和美国专利8,697,359、8,771,945、8,945,839、8,999,641、8,993,233、8,895,308、8,865,406、8,889,418、8,871,445、8,889,356、8,932,814、8,795,965和8,906,616中。Cpfl核酸内切酶和相应的指导RNA和PAM位点公开于美国专利申请公开2016/0208243A1中。
在一些实施方案中,效应物包含上文所述的CRISPR系统的一种或多种组分。
在一些实施方案中,用于本发明的试剂、组合物和方法中的合适的效应物包括例如核酸酶、物理阻断剂,表观遗传募集剂(例如转录增强子或转录阻遏物)和表观遗传CpG修饰剂(例如DNA甲基化酶、DNA去甲基化酶、组蛋白修饰剂、组蛋白转乙酰酶或组蛋白脱乙酰酶)及前述的任何组合。
合适的效应物包括多肽或其变体。如本文所用,术语“变体”是指通过在前体多肽(例如“亲本”多肽)中掺入一个或多个氨基酸插入、取代或缺失而衍生的多肽。在某些实施方案中,变体多肽与亲本多肽的完整氨基酸序列具有至少约85%的氨基酸序列同一性,例如约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或约100%的氨基酸序列同一性
本文所用的术语“序列同一性”是指核酸或氨基酸分子对之间的比较,即两个氨基酸序列之间或两个核苷酸序列之间的相关性。通常,对序列进行比对以便获得最高阶匹配。用于测定序列同一性的方法是已知的,并且可以通过商业上可获得的计算机程序来测定,所述计算机程序可以计算两个或更多个序列之间的同一性百分比。这种计算机程序的典型示例是CLUSTAL。
示例性效应物包括泛素、作为泛素连接酶抑制剂的双环肽、转录因子、DNA和蛋白质修饰酶(例如拓扑异构酶)、拓扑异构酶抑制剂(如拓扑替康)、DNA甲基转移酶(例如DNMT家族(例如DNMT3a、DNMT3b、DNMTL))、蛋白质甲基转移酶(例如病毒赖氨酸甲基转移酶(vSET)、蛋白质-赖氨酸N-甲基转移酶(SMYD2)、脱氨酶(例如FOXP3 EC、UG1)、组蛋白甲基转移酶(例如zeste同源物2增强子(EZH2))、PRMT1、组蛋白-赖氨酸-N-甲基转移酶(Setdb1)、组蛋白甲基转移酶(SET2)、常染色质组蛋白-赖氨酸N-甲基转移酶2(G9a)、组蛋白-赖氨酸N-甲基转移酶(SUV39H1)和G9a)、组蛋白脱乙酰酶(例如HDAC1、HDAC2、HDAC3)、在DNA去甲基化中发挥作用的酶(例如催化5-甲基胞嘧啶氧化成5-羟甲基胞嘧啶和更高级氧化衍生物的TET家族酶)、蛋白质去甲基化酶(例如KDMIA和赖氨酸特异性组蛋白去甲基化酶1(LSD1))、解旋酶(例如DHX9)、乙酰基转移酶、脱乙酰酶(例如去乙酰化酶1、2、3、4、5、6或7)、激酶、磷酸酶、DNA嵌入剂(例如溴化乙锭、sybr绿和普罗黄素)、外排泵抑制剂(例如类肽如苯丙氨酸精氨酰-萘酰胺,或喹啉衍生物)、核受体激活剂和抑制剂、蛋白酶体抑制剂、酶的竞争性抑制剂(例如涉及溶酶体贮积病的那些)、锌指蛋白、TALEN、来自蛋白的特定结构域(例如KRAB结构域、VP64结构域、p300结构域(例如p300核心结构域)、MeCP2结构域、MQ1结构域、DNMT3a-3L结构域、TET1结构域和/或TET2结构域)、蛋白质合成抑制剂、核酸酶(例如Cpf1、Cas9、锌指核酸酶)、其一种或多种的融合物(例如dCas9-DNMT、dCas9-FOXP3 EC、dCas9-UGl、dCas9-VP64、dCas9-p300核心、dCas9-KRAB、dCas9-KRAB-MeCP2、dCas9-MQ1、dCas9-DNMT3a-3L、dCas9-TET1、dCas9-TET2和dCas9-MC/MN)。
在一些实施方案中,用于本发明的试剂、组合物和方法中的合适的核酸酶包含Cas9多肽或其酶活性部分。在一个实施方案中,Cas9多肽或其酶活性部分进一步包含人核酸外切酶1(hEXO1)的催化活性结构域,例如5’至3’核酸外切酶活性和/或RNase H活性。在其他实施方案中,合适的核酸酶包括转录激活物样效应物核酸酶(TALEN)。在其他实施方案中,合适的核酸酶包括锌指蛋白。
如本文所用,术语TALEN是广义的,并且包括能够切割双链DNA而无需另一个TALEN帮助的单体TALEN。术语TALEN也用于指一对TALEN的一个或两个成员,所述一对TALEN被工程化为在相同位点共同工作以切割DNA。共同工作的TALEN可称为左TALEN和右TALEN,其涉及DNA的手性(handedness)。参见USSN 12/965,590;USSN 13/426,991(US 8,450,471);USSN 13/427,040(US 8,440,431);USSN 13/427,137(US 8,440,432);和USSN 13/738,381,其全部内容通过引用并入本文。
TAL效应物(TALE)是黄单胞菌分泌的蛋白质。DNA结合域包含高度保守的33-34个氨基酸的序列,第12和第13个氨基酸除外。这两个位置是高度可变的(重复可变双残基(RVD))并显示与特定核苷酸识别的强相关性。氨基酸序列和DNA识别之间的这种简单关系允许通过选择含有适当RVD的重复片段的组合来进行特定DNA结合结构域的工程化。
来自FokI核酸内切酶末端的非特异性DNA切割结构域可用于构建在酵母测定中具有活性的杂合核酸酶。这些试剂在植物细胞和动物细胞中也具有活性。最初的TALEN研究使用野生型FokI切割结构域,但是一些随后的TALEN研究也使用具有设计以提高切割特异性和切割活性的突变的FokI切割结构域变体。FokI结构域作为二聚体发挥作用,其需要两个具有针对有正确取向和间隔的靶基因组中位点的独特DNA结合域的构建体。TALE DNA结合域和FokI切割结构域之间的氨基酸残基数目和两个单独的TALE结合位点之间的碱基数目都是用于获得高水平活性的参数。TALE DNA结合域和FokI切割结构域之间的氨基酸残基数目可以通过多个TAL效应物重复序列和FokI核酸内切酶结构域之间间隔区(不同于间隔区序列)的引入来修饰。间隔区序列可以是12-30个核苷酸,例如12-15、12-20、20-25或15-30个核苷酸。
TALE结合域的氨基酸序列和DNA识别之间的关系允许可设计的蛋白质。在这种情况下,人工基因合成是有问题的,因为在TALE结合域中发现的重复序列的不适当退火。对此的一个解决方案是使用公众可获得的软件程序(DNAWorks)来计算适合于在两步PCR中组装的寡核苷酸;寡核苷酸组装后进行全基因扩增。还报道了许多用于产生工程化TALE构建体的模块组装方案。两种方法都提供了工程化DNA结合域的系统方法,其在概念上类似于用于产生锌指DNA识别域的模块组装方法。
一旦TALEN基因被组装,就将它们插入质粒;然后用质粒转染表达基因产物的靶细胞并进入细胞核以进入基因组。TALEN可用于通过诱导双链断裂(DSB)来编辑基因组,细胞以修复机制应答所述双链断裂。用这种方式,它们可用于校正基因组中的突变,例如引起疾病的突变。
如本文所用,“锌指多肽”或“锌指蛋白”是通过被称为锌指的金属稳定结构域以序列特异性方式结合DNA、RNA和/或蛋白质的蛋白质。锌指蛋白是具有DNA切割结构域和DNA结合锌指结构域的核酸酶。锌指多肽可以通过融合核酸内切酶的非特异性DNA切割结构域和位点特异性DNA结合锌指结构域来制备。这样的核酸酶是用于基因编辑的强大工具,并且可被组装以诱导双链断裂(DSB)位点特异性地进入基因组DNA中。ZFN允许特定基因破坏(如在DNA修复期间),靶向的基因可以通过诱变的非同源末端连接(NHEJ)破坏或通过同源重组(HR)修饰(如果提供密切相关的DNA模板)。
锌指核酸酶是通过融合核酸内切酶FokI的非特异性DNA切割结构域和位点特异性DNA结合锌指结构域制备的嵌合酶。由于锌指蛋白(ZFP)的柔性性质,ZFN可以被组装,其诱导双链断裂(DSB)位点特异性地进入基因组DNA中。ZFN允许特定基因破坏(如在DNA修复期间),靶基因可以通过诱变的非同源末端连接(NHEJ)破坏或通过同源重组(HR)修饰(如果提供密切相关的DNA模板)。
在一些实施方案中,用于本发明的试剂、组合物和方法的合适的物理阻断剂包括gRNA、反义DNA或三链体形成寡核苷酸(其可靶向表达控制单元)空间阻断转录控制元件或锚定序列。gRNA识别特定DNA序列,并且还包括干扰例如结合成核分子序列以用作空间阻断剂的序列。在一些实施方案中,gRNA与一种或多种用作空间存在的肽组合,例如S-腺苷甲硫氨酸(SAM)。在其他实施方案中,物理阻断剂包括无酶活性的Cas9多肽或其片段(例如dCas9)。
在一个实施方案中,表观遗传募集剂激活或增强靶基因的转录。在一些实施方案中,用于本发明的试剂、组合物和方法的合适的表观遗传募集剂包含VP64结构域或p300核心结构域。
在一个实施方案中,表观遗传募集剂沉默或阻遏靶基因的转录。在一些实施方案中,用于本发明的试剂、组合物和方法的合适的表观遗传募集剂包含KRAB结构域或MeCP2结构域。
在一个实施方案中,用于本发明的试剂、组合物和方法的合适的表观遗传募集剂包含dCas9-VP64融合物、dCas9-p300核心融合物、dCas9-KRAB融合物或dCas9-KRAB-MeCP2融合物。
如本文所用,“VP64”是包含用甘氨酸-丝氨酸(GS)接头连接的VP16(单纯疱疹病毒蛋白16,氨基酸437-447*:DALDDFDLDML(SEQ ID NO:95))的四个串联拷贝的转录激活因子。在一个实施方案中,VP64在C末端还包含转录因子p65和Rta。包含p65和Rta的VP64有时被称为“VPR”或“VP64-p65-Rta”。VP64-p65-Rta或VPR是通过向C末端的Vp64添加转录因子p65和Rta而产生的。因此,这三种转录因子都可以靶向同一基因。与单独使用Vp64相反,使用三种转录因子可导致靶基因表达的增加。VP64的GenBank登录号是ADD60007.1,p65的GenBank登录号是NP_001138610.1,Rta的GenBank登录号是AAA66528.1
VPR的示例性氨基酸序列如下:
DALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLGSDALDDFDLDMLSGGPKKKRKVGSQYLPDTDDRHRIEEKRKRTYETFKSIMKKSPFSGPTDPRPPPRRIAVPSRSSASVPKPAPQPYPFTSSLSTINYDEFPTMVFPSGQISQASALAPAPPQVLPQAPAPAPAPAMVSALAQAPAPVPVLAPGPPQAVAPPAPKPTQAGEGTLSEALLQLQFDDEDLGALLGNSTDPAVFTDLASVDNSEFQQLLNQGIPVAPHTTEPMLMEYPEAITRLVTGAQRPPDPAPAPLGAPGLPNGLLSGDEDFSSIADMDFSALLGSGSGSRDSREGMFLPKPEAGSAISDVFEGREVCQPKRLRPFHPPGSPWANRPLPASLAPTPTGPVHEPVGSLTPAPVPQPLDPAPAVTPEASHLLEDPDEETSQAVKALREMADTVIPQKEEAAICGQMDLSHPPPRGHLDELTTTLESMTEDLNLDSPLTPELNEILDTFLNDECLLHAMHISTGLSIFDTSLF(SEQ IDNO:64)。
如本文所用,“p300核心结构域”是指人乙酰转移酶p300的催化核心。包含p300的蛋白质的GenBank登记号是NP_001420.2。
p300的示例性氨基酸序列如下:
IFKPEELRQALMPTLEALYRQDPESLPFRQPVDPQLLGIPDYFDIVKSPMDLSTIKRKLDTGQYQEPWQYVDDIWLMFNNAWLYNRKTSRVYKYCSKLSEVFEQEIDPVMQSLGYCCGRKLEFSPQTLCCYGKQLCTIPRDATYYSYQNRYHFCEKCFNEIQGESVSLGDDPSQPQTTINKEQFSKRKNDTLDPELFVECTECGRKMHQICVLHHEIIWPAGFVCDGCLKKSARTRKENKFSAKRLPSTRLGTFLENRVNDFLRRQNHPESGEVTVRVVHASDKTVEVKPGMKARFVDSGEMAESFPYRTKALFAFEEIDGVDLCFFGMHVQEYGSDCPPPNQRRVYISYLDSVHFFRPKCLRTAVYHEILIGYLEYVKKLGYTTGHIWACPPSEGDDYIFHCHPPDQKIPKPKRLQEWYKKMLDKAVSERIVHDYKDIFKQATEDRLTSAKELPYFEGDFWPNVLEESIKELEQEEEERKREENTSNESTDVTKGDSKNAKKKNNKKTSKNKSSLSRGNKKKPGMPNVSNDLSQKLYATMEKHKEVFFVIRLIAGPAANSLPPIVDPDPLIPCDLMDGRDAFLTLARDKHLEFSSLRRAQWSTMCMLVELHTQSQD(SEQ ID NO:65)。
如本文所用,“KRAB”是指存在于基于人锌指蛋白的转录因子(KRAB锌指蛋白)中的KrüppeL相关盒(KRAB)转录阻遏域。
如本文所用,“MeCp2”是指甲基CpG结合蛋白2,其例如通过结合至包含甲基化DNA的启动子来阻遏转录。
在一个实施方案中,表观遗传CpG修饰剂甲基化DNA并使转录失活或阻遏转录。在一些实施方案中,用于本发明的试剂、组合物和方法的合适的表观遗传CpG修饰剂包含MQ1结构域或DNMT3a-3L结构域。
在一个实施方案中,表观遗传CpG修饰剂去甲基化DNA并激活或刺激转录。在一些实施方案中,用于本发明的试剂、组合物和方法的合适的表观遗传募集剂包含TET1或TET2结构域。
如本文所用,“MQ1”是指原核DNA甲基转移酶。
如本文所用,“DNMT3a-3L”是指DNA甲基转移酶、Dnmt3a和Dnmt3L的融合物,其是无催化活性的,但直接与Dnmt3a的催化结构域相互作用。
如本文所用,“TET1”是指由TET1基因编码的TET酶家族的成员“10-11易位甲基胞嘧啶双加氧酶1”。TET1是以铁和α-酮戊二酸依赖性方式通过5-mC的氧化催化经修饰的DNA碱基5-甲基胞嘧啶(5-mC)转化为5-羟甲基胞嘧啶(5-hmC)(哺乳动物中活性DNA去甲基化的初始步骤)的双加氧酶。胞嘧啶碱基C5位的甲基化是哺乳动物基因组的表观遗传修饰,其在转录调节中起重要作用。除了它在DNA去甲基化中的作用之外,它在染色质调节中还起着更普遍的作用。在转录活性和多梳阻遏基因的启动子处优先结合富含CpG的序列。参与O-GlcNAc转移酶OGT向活性基因的富含CpG的转录起始位点处的募集,从而促进通过OGT的组蛋白H2B GlcNAc糖基化(GlcNAcylation)。示例性TET1核苷酸和氨基酸序列可见于GenBank登录号:NM_030625.3、NP_085128.2。
如本文所用,“TET2”是指由TET1基因编码的TET酶家族的成员“10-11易位2(TET2)”。与TET1类似,TET2是催化经修饰的基因组碱基5-甲基胞嘧啶(5mC)转化为5-羟甲基胞嘧啶(5hmC)的双加氧酶,并在活性DNA去甲基化中起关键作用。TET2偏好CpG基序中的5-羟甲基胞嘧啶。TET2还介导5hmC随后转化为5-甲酰基胞嘧啶(5fC)和5fC转化为5-羧基胞嘧啶(5caC)。5mC向5hmC、5fC和5caC的转化可能构成胞嘧啶去甲基化的第一步。胞嘧啶碱基C5位的甲基化是哺乳动物基因组的表观遗传修饰,其在转录调节中起重要作用。除了它在DNA去甲基化中的作用之外,它还参与O-GlcNAc转移酶OGT向活性基因的富含CpG的转录起始位点的募集,从而促进通过OGT的组蛋白H2B GlcNAc糖基化。示例性的核苷酸和氨基酸序列可见于GenBank登录号:NM_001127208.2、NP_001120680.1。
在一些实施方案中,用于本发明的试剂、组合物和方法的合适的表观遗传募集剂包含MQ1结构域、DNMT3a-3L、TET1或TET2结构域。在一个实施方案中,用于本发明的试剂、组合物和方法的合适的表观遗传募集剂包含dCas9-MQ1融合物、dCas9-DNMT3a-3L融合物、或dCas9-TET1融合物或-dCase9-TET2融合物。
III.本发明的位点特异性FOXP3破坏剂和包含本发明的位点特异性FOXP3破坏剂的组合物的递送
本发明的破坏剂向细胞(例如受试者如人类受试者(例如有需要的受试者,如患有与FOXP3相关的病症,例如自身免疫性疾病(如IPEX综合征)的受试者)内的细胞)的递送可以许多不同的方式实现。例如,递送可以通过使细胞与本发明的破坏剂在体外、离体或在体内接触来进行。体内递送可通过向受试者施用包含破坏剂的组合物(例如脂质组合物)来直接进行。或者,体内递送可通过施用一种或多种编码并指导在受试者细胞内表达破坏剂的载体来间接进行。下面进一步讨论这些可选方案。向细胞的体外引入包括本领域内已知的方法,如电穿孔和脂质转染。进一步的方法如下文所描述和/或是本领域内已知的。
在一些实施方案中,破坏剂包含编码融合蛋白的核酸分子,所述融合蛋白包含特异性靶向和结合FOXP3表达控制区的位点特异性FOXP3靶向部分,例如编码转录激活物样效应物(TALE)多肽或锌指(ZNF)多肽的DNA结合域的多核苷酸或其片段;和效应物分子(例如VPR)。
在其他实施方案中,破坏剂包含指导RNA和编码效应物分子的mRNA。指导RNA与mRNA的比率可以是约100:1至约1:100(wt:wt)。
通常,本发明的位点特异性FOXP3破坏剂的任何递送方法(体外、离体或体内)可适用于本发明的破坏剂(参见,例如Akhtar S.和Julian RL.,(1992)Trends Cell.Biol.2(5):139-144和WO94/02595,其全部内容通过引用并入本文)。对于体内递送,用于递送本发明的位点特异性FOXP3破坏剂考虑的因素包括,例如破坏剂的生物稳定性、非特异性作用的预防和靶组织中破坏剂的累积。破坏剂的非特异性作用可通过局部施用(例如通过直接注射或植入到组织中或局部施用包含破坏剂的组合物)最小化。对治疗部位的局部施用最大化破坏剂的局部浓度,限制破坏剂对全身组织的暴露(否则全身组织可被破坏剂损害或其可降解破坏剂),并允许施用总剂量较低的破坏剂。
为了全身施用位点特异性FOXP3破坏剂以治疗疾病(例如FOXP3相关疾病),破坏剂(例如包含含有核酸分子的位点特异性靶向部分的破坏剂)可被修饰或者可选地使用药物递送体系递送;这两种方法用于防止包含核酸分子的位点特异性靶向部分通过内切核酸酶和外切核酸酶在体内的快速降解。包含含有核酸分子的位点特异性靶向部分的破坏剂的修饰或药物载体也允许破坏剂对靶组织的靶向和避免不期望的脱靶效应。例如,本发明的破坏剂可以通过与亲脂性基团(例如胆固醇)的化学缀合进行修饰以增强细胞摄取并防止降解。
或者,本发明的破坏剂可以使用药物递送系统(例如纳米颗粒、树枝状大分子、聚合物、脂质体或阳离子递送系统)递送。带正电荷的阳离子递送系统促进破坏剂(例如带负电荷的分子)的结合,并且还增强在带负电荷的细胞膜处的相互作用以允许细胞对破坏剂的有效摄取。阳离子脂质、树枝状大分子或聚合物可以与破坏剂结合,或被诱导以形成包封破坏剂的囊泡或胶束(参见例如Kim SH.等,(2008)Journal of Controlled Release 129(2):107-116)。当全身施用时,囊泡或胶束的形成进一步防止破坏剂的降解。制备和施用阳离子复合物的方法完全在本领域技术人员的能力范围内(参见,例如Sorensen,DR.等,(2003)J.Mol.Biol 327:761-766;Verma,UN.等,(2003)Clin.Cancer Res.9:1291-1300;Arnold,AS等,(2007)J.Hypertens.25:197-205,其通过全文引用并入本文)。可用于本发明的破坏剂的全身递送的药物递送系统的一些非限制性示例包括DOTAP(Sorensen,DR.等,(2003),同上;Verma,UN.等,(2003),同上)、Oligofectamine、“固体核酸脂质颗粒”(Zimmermann,TS.等,(2006)Nature 441:111-114)、心磷脂(Chien,PY.等,(2005)CancerGene Ther.12:321-328;Pal,A.等,(2005)Int J.Oncol.26:1087-1091)、聚乙烯亚胺(Bonnet ME.等,(2008)Pharm.Res.Aug 16 Epub ahead of print;Aigner,A.(2006)J.Biomed.Biotechnol.71659)、Arg-Gly-Asp(RGD)肽(Liu,S.(2006)Mol.Pharm.3:472-487)和聚酰胺胺(Tomalia,DA.等,(2007)Biochem.Soc.Trans.35:61-67;Yoo,H.等,(1999)Pharm.Res.16:1799-1804)。在一些实施方案中,破坏剂(例如gRNA或mRNA)与环糊精形成复合物用于全身施用。用于施用的方法和包含环糊精的药物组合物可以在美国专利号7,427,605中找到,其全部内容通过引用并入本文。
本发明的破坏剂可以掺入到适合施用的药物组合物中。这样的组合物通常包括一个或多个种类的破坏剂和药学上可接受的载体。如本文所用,术语“药学上可接受的载体”旨在包括与药物施用相容的任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。此类介质和试剂用于药物活性物质的用途是本领域众所周知的。除非任何常规介质或试剂与活性化合物不相容,否则其在组合物中的用途是预期的。补充活性化合物也可掺入组合物中。
本发明的药物组合物可以多种方式施用,其取决于是否需要局部或全身治疗以及待治疗的区域。施用可以是局部(包括眼、阴道、直肠、鼻内、经皮肤)、口服或肠胃外。肠胃外施用包括静脉滴注、皮下、腹膜内或肌内注射、或鞘内或心室内施用。
施用途径和位点可被选择以增强包含位点特异性靶向部分的破坏剂向特定位置的递送或靶向。例如,为了靶向肝细胞,可以使用静脉内注射。可以通过施用气溶胶形式的破坏剂靶向肺细胞。可通过肛门施用靶向空肠细胞。
用于局部施用的制剂可包括透皮贴剂、软膏剂、洗剂、乳膏、凝胶、滴剂、栓剂、喷雾剂、液体和粉末。常规的药物载体、水性、粉末或油性基质、增稠剂等可能是必需的或期望的。有涂层的避孕套、手套等也可能是有用的。
用于口服施用的组合物包括粉末或颗粒、水中的悬浮液或溶液、糖浆、酏剂或非水性介质、片剂、胶囊、锭剂或糖锭。在片剂的情况下,可以使用的载体包括乳糖、柠檬酸钠和磷酸的盐。各种崩解剂(例如淀粉)和润滑剂(例如硬脂酸镁、十二烷基硫酸钠和滑石)常用于片剂中。对于胶囊形式的口服施用,有用的稀释剂是乳糖和高分子量聚乙二醇。当口服使用需要水性悬浮液时,核酸组合物可以与乳化剂和悬浮剂组合。如果需要,可以加入某些甜味剂或调味剂。
用于静脉内施用的组合物可包括无菌水溶液,其还可含有缓冲剂、稀释剂和其他合适的添加剂。
用于肠胃外施用的制剂可以包括无菌水溶液,其还可含有缓冲剂、稀释剂和其他合适的添加剂。对于静脉内使用,可以控制溶质的总浓度以使制备物等渗。
在一个实施方案中,本发明的破坏剂组合物的施用是肠胃外的,例如静脉内(例如作为大丸剂或作为可扩散的输注液)、皮内、腹膜内、肌内、鞘内、心室内、颅内、皮下、经粘膜、口腔、舌下、内窥镜、直肠、口服、阴道、局部、肺部、鼻内、尿道或眼部。施用可由受试者或另一个人(例如健康护理提供者)提供。组合物可以测量的剂量或在递送计量剂量的分配器中提供。下面更详细地讨论选定的递送模式。
在某些实施方案中,本发明的破坏剂是多核苷酸,例如mRNA,并且在脂质纳米颗粒(LNP)中配制。
A.包含本发明的位点特异性FOXP3破坏剂的组合物
本发明的位点特异性FOXP3破坏剂可以使用一种或多种赋形剂配制成组合物(例如药物组合物)以:(1)增加稳定性;(2)增加细胞转染;(3)允许持续或延迟释放(例如,从贮库型制剂);(4)改变生物分布(例如将破坏剂靶向特定组织或细胞类型);(5)增强编码蛋白的体内翻译;和/或(6)改变编码蛋白的体内释放曲线。除了常规赋形剂之外,例如任何和所有溶剂、分散介质、稀释剂或其他液体载体、分散或悬浮助剂、表面活性剂、等渗剂、增稠剂或乳化剂、防腐剂,本发明的组合物中所用的赋形剂可包括但不限于类脂质、脂质体、脂质纳米颗粒、聚合物、脂质复合物、核-壳纳米颗粒、肽、蛋白质、用核酸分子转染的细胞、经修饰的核酸分子或RNA(例如用于移植到受试者中)、透明质酸酶、纳米颗粒模拟物及其组合。因此,本发明的药物组合物可以包含一种或多种赋形剂,每种的量使得其一起增加破坏剂的稳定性,增加破坏剂的细胞转染,增加经修饰的核酸或mRNA编码的蛋白质的表达,和/或改变破坏剂的释放曲线。此外,本发明的破坏剂可以使用自组装核酸纳米颗粒配制(参见,例如美国专利公开号2016/0038612A1,其通过全文引用并入本文)。
i.类脂质
类脂质的合成已被广泛描述并且含有这些化合物的制剂尤其适用于本发明的破坏剂(例如包含含有核酸分子(例如含有经修饰的核酸分子或mRNA)的位点特异性FOXP3靶向部分的破坏剂)的递送(参见Mahon等,Bioconjug Chem.201021:1448-1454;Schroeder等,J Intern Med.2010267:9-21;Akinc等,Nat Biotechnol.2008 26:561-569;Love等,Proc Natl Acad Sci USA.201 0 107:1864-1869;Siegwart等,Proc Natl Acad SciUSA.2011108:12996-3001;所有这些文献在此全文引入)。
例如,类脂质已用于有效递送双链小干扰RNA分子、单链核酸分子、经修饰的核酸分子或经修饰的mRNA。(参见,例如美国专利公布2016/0038612A1)。可制备含有这些类脂质的复合物、胶束、脂质体或颗粒,并且因此提供包含核酸分子的位点特异性FOXP3靶向部分的有效递送,如通过在类脂质制剂的施用(例如通过局部和/或全身施用)后编码的蛋白质的产生所判断的。类脂质复合物可通过各种方式施用,其包括但不限于静脉内、肌内、皮内、腹膜内或皮下途径。
包含例如核酸分子的位点特异性FOXP3靶向部分的体内递送可受到许多参数的影响,所述参数包括但不限于制剂组成、颗粒PEG化的性质、装载程度(degree of loading)、多核苷酸与脂质的比率和生物物理参数,例如但不限于粒度(Akinc等,Mol Ther.2009 17:872-879;其全部内容通过引用并入本文)。例如,聚(乙二醇)(PEG)脂质的锚定链长度的小变化可导致对体内功效的显著影响。可使用具有不同类脂质的制剂(包括但不限于五[3-(1-月桂基氨基丙酰基)]-三亚乙基四胺盐酸盐(TETA-5LAP;也称为98NI2-5,参见Murugaiah等,Analytical Biochemistry,401:61(2010);其内容通过引用整体并入本文))、C12-200(包括衍生物和变体)和MDI。
在一个实施方案中,将包含位点特异性FOXP3靶向部分(包含例如核酸分子)的破坏剂与类脂质配制用于全身静脉内施用以靶向肝脏的细胞。例如,包含含有位点特异性FOXP3靶向部分(其包含核酸分子)的破坏剂和42%98NI2-5、48%胆固醇和10%PEG-脂质的脂质摩尔组合物的最终优化的静脉内制剂(具有总脂质与核酸分子的约7.5比1的最终重量比,和PEG脂质上的C14烷基链长度,具有约50-60nm的平均粒度)可导致制剂在肝脏中大于90%的分布(参见,Akinc等,Mol Ther.2009 17:872-879;其全部内容通过引用并入本文)。在另一个实例中,使用C12-200类脂质(参见,例如PCT公开号WO2010/129709,其通过全文引用方式并入本文)的静脉内制剂可用于将包含含有核酸分子的位点特异性FOXP3靶向部分的破坏剂递送至肝细胞,所述制剂具有50/10/38.5/1.5摩尔比的C12-200/双硬脂酰磷脂酰胆碱/胆固醇/PEG-DMG,具有总脂质与核酸分子的7:1的重量比,并且平均粒度为80nm(参见,Love等,Proc Natl Acad Sci USA.2010 107:1864-1869;其全部内容通过引用并入本文)。在另一个实施方案中,含MDI类脂质的制剂可用于在体内将包含含有核酸分子的位点特异性FOXP3靶向部分的破坏剂有效递送至肝细胞。用于肌内或皮下途径的优化类脂质制剂的特性可根据靶细胞类型和制剂通过细胞外基质扩散到血流中的能力而显著变化。尽管由于内皮窗孔的尺寸,小于150nm的粒度可能是有效的肝细胞递送所期望的(参见,Akinc等,Mol Ther.2009 17:872-879;其全部内容通过引用并入本文),使用类脂质配制的核酸分子将制剂递送到其他细胞类型(包括但不限于内皮细胞、骨髓细胞和肌细胞)可能不受类似的尺寸限制。已经报道了使用类脂质制剂将siRNA体内递送至其他非肝细胞例如骨髓细胞和内皮(参见Akinc等,Nat Biotechnol.200826:561-569;Leuschner等,NatBiotechnol.2011 29:1005-1010;Cho等,Adv.Funct.Mater.2009 19:3112-3118;8thInternational Judah Folkman Conference,Cambridge,Mass.Oct.8-9,2010;其中每一个的全部内容均通过引用并入本文)。对于递送至骨髓细胞(例如单核细胞),类脂质制剂可具有类似的组分摩尔比。类脂质和其他组分(包括但不限于双硬脂酰磷脂酰胆碱、胆固醇和PEG-DMG)的不同比率可用于优化用于递送至不同细胞类型(包括但不限于肝细胞、骨髓细胞、肌肉细胞等)的制剂。例如,组分摩尔比可包括但不限于50% CI2-200、10%双硬脂酰磷脂酰胆碱、38.5%胆固醇和1.5% PEG-DMG(参见Leuschner等,Nat Biotechnol 2011 29:1005-1010;其全部内容通过引用并入本文)。用于通过皮下、皮内或肌内递送局部递送至细胞(例如但不限于脂肪细胞和肌肉细胞)的类脂质制剂的使用可以不需要全身递送所需的所有制剂组分,并且因此,可仅包含类脂质和本文所述的包含含有例如核酸分子的位点特异性FOXP3靶向部分的破坏剂。
不同类脂质的组合可用于通过增加细胞转染和/或增加其中所含的编码蛋白质的翻译来提升制剂的功效(参见Whitehead等,Mol.Ther.2011,19:1688-1694,其整体内容通过引用并入本文)。
在一个实施方案中,类脂质可由烷基胺与丙烯酸酯的共轭加成制备。作为非限制性示例,类脂质可通过PCT专利公开号WO2014/028487中所述的方法制备,其全文内容通过引用方式并入本文。在一个实施方案中,类脂质可包含如PCT专利公开号WO2014/028487所述的具有式(I)、式(II)、式(III)、式(IV)或式(V)的化合物,其全文内容通过引用方式并入本文。在一个实施方案中,类脂质可以是可生物降解的。
ii.脂质体、脂质复合物和脂质纳米颗粒
本发明的破坏剂可以使用一种或多种脂质体、脂质复合物或脂质纳米颗粒配制。在一个实施方案中,本发明的药物组合物包括脂质体。脂质体是主要由脂质双层构成的人工制备的囊泡,并且可以用作营养物和药物制剂的施用的递送载体。脂质体可以具有不同的大小,例如但不限于直径可以是数百纳米且可包含一系列由狭窄的水性隔室分开的同心双层的多层囊泡(MLV),直径可以小于50nm的小单细胞囊泡(SUV),以及直径可以在50和500nm之间的大单层囊泡(LUV)。脂质体设计可包括但不限于调理素或配体,以改善脂质体对不健康组织的附着或激活事件(例如但不限于内吞作用)。脂质体可包含低或高pH以改善药物制剂的递送。脂质体的形成可取决于物理化学特性,例如但不限于包埋的药物制剂和脂质体成分,脂质囊泡分散于其中的介质的性质,包埋的物质的有效浓度及其潜在毒性,囊泡的应用和/或递送过程中涉及的任何其他过程,用于预期应用的囊泡的最优化尺寸、多分散性和保质期,以及安全有效的脂质体产品的批次间再现性和大规模生产的可能性。
作为非限制性示例,脂质体(例如合成膜囊泡)可以通过美国专利公开号2013/0177638、2013/0177637、2013/0177636、201/30177635、2013/0177634、2013/0177633、2013/0183375、2013/0183373、2013/0183372和2016/0038612和PCT专利公开号WO2008/042973中所述的方法、设备和装置来制备,其中每一个通过全文引用方式并入本文。
在一个实施方案中,本文所述的药物组合物可以包括但不限于脂质体,例如由1,2-二油酰基氧基-N,N-二甲基氨基丙烷(DODMA)脂质体、来自Marina Biotech(Bothell,Wash.)的DiLa2脂质体、1,2-二亚油基氧基-3-二甲基氨基丙烷(DLin-DMA)、2,2-二亚油基-4-(2-二甲基氨基乙基)-[1,3]-二氧戊环(DLin-KC2-DMA)和MC3(US20100324120;其通过全文引用并入本文)形成的那些,和可递送小分子药物的脂质体,例如但不限于来自JanssenBiotech,Inc.(Horsham,Pa.)的
在一个实施方案中,药物组合物可以包含可形成以递送本发明的破坏剂的脂质体。包含位点特异性FOXP3靶向部分的破坏剂可以被脂质体包封和/或其可以包含在水性核中,然后该水性核可以被脂质体包封(参见,例如PCT专利公开号WO2012/031046、WO2012/031043、WO2012/030901和WO2012/006378以及美国专利公开号2013/0189351、2013/0195969和201/30202684,其中每一个通过全文引用方式并入本文)。
在另一个实施方案中,用于本发明的脂质体可被配制用于靶向递送。作为非限制性示例,脂质体可被配制用于靶向递送至肝脏。这样的脂质体可以包括但不限于美国专利公开号2013/0195967中描述的脂质体,其全部内容通过引用并入本文。
在一个实施方案中,包含脂质体和破坏剂的制剂可以肌内、皮内或静脉内施用。
在另一个实施方案中,本发明的脂质制剂可以包括至少一种阳离子脂质、增强转染的脂质和至少一种包含连接至脂质部分的亲水头部基团的脂质(国际公布号WO2011076807和美国公布号20110200582;其中每一个通过全文引用方式并入本文)。在另一个实施方案中,本发明的脂质制剂是脂质囊泡,其可具有官能化的脂质双层之间的交联(参见美国专利公开号2012/0177724,其全部内容通过引用并入本文)。
在一个实施方案中,包含破坏剂的制剂是可包含至少一种脂质的脂质纳米颗粒(LNP)。所述脂质可选自但不限于DLin-DMA、DLin-K-DMA、98NI2-5、CI2-200、DLin-MC3-DMA、DLin-KC2-DMA、DODMA、PLGA、PEG、PEG-DMG、PEG化脂质和氨基醇脂质。在另一个方面,脂质可以是阳离子脂质,例如但不限于DLin-DMA、DLin-D-DMA、DLin-MC3-DMA、DLin-KC2-DMA、DODMA和氨基醇脂质。氨基醇阳离子脂质可以是美国专利公开号2013/0150625中描述的和/或通过该专利描述的方法制备的脂质。
在一个实施方案中,阳离子脂质可选自但不限于PCT公布号WO2012/040184、WO2011/153120、WO2011/149733、WO2011/090965、WO2011/043913、WO2011/022460、WO2012/061259、WO2012/054365、WO2012/044638、WO2010/080724、WO2010/21865、WO2008/103276、WO2013/086373和WO2013/086354、美国专利号7,893,302、7,404,969、8,283,333、8,466,122和8,569,256以及美国专利公布号2010/0036115、2012/0202871、2013/0064894、2013/0129785、2013/0150625、2013/0178541、2013/0225836和2014/0039032中所描述的阳离子,其中每一个通过全文引用方式并入本文。在另一个实施方案中,阳离子脂质可以选自但不限于PCT公开号WO2012/040184、WO0111/53120、WO2011/149733、WO2011/090965、WO2011/043913、WO2011/022460、WO2012/061259、WO2012/054365、WO2012/044638和WO2013/116126或美国专利公开号2013/0178541和2013/0225836中所描述的式A;其中每一个通过全文引用方式并入本文。在又一个实施方案中,阳离子脂质可选自但不限于PCT公开号WO2008/103276的式CLI-CLXXIX、美国专利号7,893,302的式CLICLXXIX、美国专利号7,404,969的式CLICLXXXXII和美国专利公开号2010/0036115的式I-VI、美国专利公开号2013/0123338的式I;其中每一个通过全文引用方式并入本文。
在一个实施方案中,阳离子脂质可通过本领域已知的方法和/或PCT公开号WO2012/040184、WO2011/153120、WO2011/149733、WO2011/090965、WO2011/043913、WO2011/022460、WO2012/061259、WO2012/054365、WO2012/044638、WO2010/080724、WO2010/21865、WO2013/126803、WO2013/086373和WO2013/086354中所述的方法合成;其中每一个通过全文引用方式并入本文。
在一个实施方案中,可用于本文所述的破坏剂的制剂和/或用于递送的脂质可以是可裂解的脂质。作为非限制性示例,可裂解脂质和/或包含可裂解脂质的药物组合物包括PCT专利公布号WO2012/170889中所描述的那些,其通过全文引用方式并入本文。作为另一个非限制性示例,可裂解脂质可以是PCT专利公开号WO2012/170889中所描述的HGT4001、HGT4002、HGT4003、HGT4004和/或HGT4005,其通过全文引用方式并入本文。
在一个实施方案中,可用于本文所述的破坏剂的制剂和/或递送的聚合物可包括但不限于聚(乙二醇)(PEG)、聚乙烯亚胺(PEI)、二硫代双(琥珀酰亚胺丙酸酯)(DSP)、二甲基-3,3’-二硫代双丙酰亚胺(DTBP)、聚(乙烯亚胺)双氨基甲酸酯(PEIC)、聚(L-赖氨酸)(PLL)、组氨酸修饰的PLL、聚(N-乙烯基吡咯烷酮)(PVP)、聚(丙烯亚胺)(PPI)、聚(酰胺基胺)(PAMAM)、聚(酰胺基乙烯亚胺)(SS-PAEI)、三亚乙基四胺(TETA)、聚(β-氨基酯)、聚(4-羟基-L-脯氨酸酯)(PHP)、聚(烯丙胺)、聚(α-[4-氨基丁基])-L-乙醇酸(PAGA)、聚(D,L-乳酸-共乙醇酸)(PLGA)、聚(N-乙基-4-乙烯基溴化吡啶)、聚(磷腈)(PPZ)、聚(磷酸酯)(PPE)、聚(氨基磷酸酯)(PPA)、聚(N-2-羟丙基甲基丙烯酰胺)(pHPMA)、聚(2-(二甲氨基)乙基甲基丙烯酸酯)(pDMAEMA)、聚(2-氨基乙基丙烯磷酸酯)(PPE_EA)、壳聚糖、半乳糖基化壳聚糖、N-十二烷基化壳聚糖、组蛋白、胶原和葡聚糖精胺。在一个实施方案中,聚合物可以是惰性聚合物,例如但不限于PEG。在一个实施方案中,聚合物可以是阳离子聚合物,例如但不限于PE1、PLL、TETA、聚(烯丙胺)、聚(N-乙基-4-乙烯基溴化吡啶)、pHPMA和pDMAEMA。在一个实施方案中,聚合物可以是可生物降解的PE1,例如但不限于DSP、DTBP和PEIC。在一个实施方案中,聚合物可以是可生物降解的,例如但不限于组氨酸修饰的PLL SSPAEI、聚(β-氨基酯)、PHP、PAGA、PLGA、PPZ、PPE、PPA和PPE-EA。
在一个实施方案中,本发明的LNP制剂可以根据PCT公开号WO2011/127255或WO2008/103276中描述的方法制备,其中每一个通过全文引用方式并入本文。作为非限制性示例,包含位点特异性FOXP3靶向部分的破坏剂可以包封在如PCT公开号WO2011/127255和/或WO2008/103276中所描述的LNP制剂中;其中每一个通过全文引用并入本文。作为另一个非限制性示例,如本文所述的包含位点特异性FOXP3靶向部分的破坏剂可以配制在纳米颗粒中以通过如美国专利公开号2012/0207845和PCT公开号WO2014/008334中所述的肠胃外途径递送;其中每一个通过全文引用方式并入本文。
在一个实施方案中,本文所述的LNP制剂可以肌内施用。LNP制剂可包含本文所述的阳离子脂质,例如但不限于DLin-DMA、DLin-KC2-DMA、DLin-MC3-DMA、DODMA和C12-200。
在一个实施方案中,本文所述的包含如本文所述破坏剂的LNP制剂可以皮内施用。LNP制剂可包含本文所述的阳离子脂质,例如但不限于DLin-DMA、DLin-KC2-DMA、DLin-MC3-DMA、DODMA和C12-200。
纳米颗粒制剂可以包含偶联物,例如磷酸酯偶联物、聚合物偶联物、增强纳米颗粒递送的偶联物,如美国专利公开号US20160038612A1中所描述。
在一个实施方案中,脂质纳米颗粒制剂包含如美国专利公开号US 20100324120中所描述的DLin-MC3-DMA。
在一个实施方案中,脂质纳米颗粒包含脂质化合物或其药学上可接受的盐、互变异构体或立体异构体、或脂质纳米颗粒制剂,如美国专利号US10723692B2、美国专利公开号US20200172472A1、US20200163878A1、US20200046838A1、US20190359556A1、US20190314524A1、US20190274968A1、US20190022247A1、US20180303925A1、US20180185516A1、US20160317676A1、国际专利公开号:WO20200146805A1、WO2020081938A1、WO2019089828A1、WO2019036030A1、WO2019036028A1、WO2019036008A1、WO2018200943A1、WO2018191719A1、WO2018107026A1、WO2018081480A1中所描述,其中每一个通过全文引用方式并入本文(Acuitas Therapeutics,Inc.)。
在一个实施方案中,脂质纳米颗粒包含氨基脂质或其药学上可接受的盐、互变异构体或立体异构体、或脂质纳米颗粒制剂,其由Tekmira Pharmaceuticals Corp.描述于US9139554B2、US9051567B2、US8883203B2、美国专利公开US20110117125A1中,其中每一个通过全文引用方式并入本文。在一个具体示例中,US9139554B2中描述的化合物是DLin-kC2-DMA。
在一个实施方案中,脂质纳米颗粒包含氨基脂质或其药学上可接受的盐、互变异构体或其立体异构体、或脂质纳米颗粒制剂,其由Arbutus Biopharma Corp.描述于US10561732B2、US9938236B2、US9687550B2、美国专利公开US20190240354A1、US20170027658A1、WO2020097493A1、WO2020097520A1、WO2020097540A1、WO2020097548A1中,其中每一个通过全文引用方式并入本文。
脂质纳米颗粒可被工程化以改变颗粒的表面性质,从而使脂质纳米颗粒可穿透粘膜屏障。粘液位于粘膜组织上,例如但不限于口腔(例如口腔和食道膜和扁桃体组织)、眼、胃肠道(例如胃、小肠、大肠、结肠、直肠)、鼻、呼吸道(例如鼻、咽、气管和支气管膜)、生殖器(例如阴道、宫颈和尿道膜)。出于更高的药物封装效率和提供多种药物的缓释递送的能力而言优选的大于10-200nm的纳米颗粒已被认为太大而不能通过粘膜屏障快速扩散。粘液连续地分泌、脱落、丢弃或消化并再循环,因此大多数捕获颗粒可在数秒内或数小时内被从粘膜组织中去除。已经被低分子量聚乙二醇(PEG)致密地涂覆的大聚合物纳米颗粒(直径为200nm-500nm)通过粘液扩散仅比相同颗粒在水中扩散低4-6倍(Lai等,PNAS 2007 104(5):1482-487;Lai等,Adv Drug Deliv Rev.200961(2):158-171;其中每一个通过全文引用方式并入本文)。纳米颗粒的转运可以使用渗透率和/或荧光显微镜技术(其包括但不限于荧光漂白后荧光恢复(FRAP)和高分辨率多颗粒跟踪(MPT))来测定。作为非限制性示例,可穿透粘膜屏障的组合物可以根据美国专利号8,241,670或国际专利公开号WO 2013110028中所描述制备,其中每一个通过全文引用方式并入本文。
在一个实施方案中,如本文所述的包含位点特异性FOXP3靶向部分的破坏剂被配制为脂质复合物,例如但不限于ATUPLEX
在一个实施方案中,还可以构建这样的制剂或改变组合物,使得它们在体内被动或主动地被引导至不同的细胞类型,所述细胞类型包括但不限于肝细胞、免疫细胞、肿瘤细胞、内皮细胞、抗原呈递细胞和白细胞(Akinc等,Mol Ther.2010 18:1357-1364;Song等,Nat Biotechnol.2005 23:709-717;Judge等,J Clinlnvest.2009 119:661-673;Kaufmann等,Microvasc Res 2010 80:286-293;Santel等,Gene Ther 200613:1222-1234;Santel等,Gene Ther 2006 13:1360-1370;Gutbier等,Pulm Pharmacol.Ther.2010 23:334-344;Basha等,Mol.Ther.2011 19:2186-2200;Fenske和Cullis,Expert Opin DrugDeliv.20085:25-44;Peer等,Science.2008 319:627-630;Peer和Lieberman,GeneTher.2011 18:1127-1133;前述所有均通过全文引用方式并入本文)。制剂被动靶向肝细胞的一个示例包括基于DLin-DMA、DLin-KC2-DMA和DLin-MC3-DMA的脂质纳米颗粒制剂,其已显示结合载脂蛋白E并促进这些制剂在体内结合并被摄取至肝细胞中(Akinc等,MolTher.2010 18:1357-1364;其通过全文引用方式并入本文)。制剂也可通过在其表面上的不同配体的表达(例如但不限于叶酸、转铁蛋白、N-乙酰半乳糖胺(GaINAc))和抗体靶向方法而被选择性靶向(Kolhatkar等,Curr Drug Discov Technol.2011 8:197 -206;Musacchio和Torchilin,Front Biosci.201116:1388-1412;Yu等,Mol Membr BioI.2010 27:286-298;Patil等,Crit Rev Ther Drug Carrier Syst.2008 25:1-61;Benoit等,Biomacromolecules.2011 12:2708-2714;Zhao等,Expert Opin Drug Deliv.2008 5:309-319;Akinc等,Mol Ther.2010 18:1357-1364;Srinivasan等,Methods Mol BioI.2012820:105-116;Ben-Arie等,Methods Mol Biol.2012 757:497-507;Peer 2010J ControlRelease.20:63-68;Peer等,Proc Natl Acad Sci USA.2007 104:4095-4100;Kim等,Methods Mol BioI.2011 721:339-353;Subramanya等,Mol Ther.2010 18:2028-2037;Song等,Nat Biotechnol.2005 23:709-717;Peer等,Science.2008 319:627-630;Peer和Lieberman,Gene Ther.2011 18:1127-1133;前述所有均通过全文引用并入本文)。
在一个实施方案中,本发明的包含位点特异性FOXP3靶向部分的破坏剂可被配制为固体脂质纳米颗粒。固体脂质纳米颗粒(SLN)可以是平均直径在10至1000nm之间的球形。SLN具有可以溶解亲脂性分子的固体脂质核心基质,并且可以用表面活性剂和/或乳化剂稳定。在另一个实施方案中,脂质纳米颗粒可以是自组装脂质-聚合物纳米颗粒(参见,Zhang等,ACS Nano,2008,2(8),pp 1696-1702;其内容通过全文引用并入本文)。作为非限制性示例,SLN可以是PCT公开号WO2013/105101中描述的SLN,其内容通过全文引用并入本文。作为另一个非限制性示例,SLN可以通过PCT公开号WO2013/105101中描述的方法或工艺制备,其内容通过全文引用并入本文。
脂质体、脂质复合物或脂质纳米颗粒可用于改善包含含有例如核酸分子的位点特异性FOXP3靶向部分的破坏剂指导蛋白质产生的功效,因为这些制剂可能能够增加核酸分子的细胞转染;和/或增加编码蛋白(例如本发明的效应物)的翻译。一个这样的示例包括使用脂质封装以能够有效地全身递送复合载体(polyplex)质粒DNA(Heyes等,Mol Ther.200715:713-720;其通过全文引用并入本文)。本发明的脂质体、脂质复合物或脂质纳米颗粒还可以提高包含含有例如核酸分子的位点特异性FOXP3靶向部分的破坏剂的稳定性。脂质体、脂质复合物或脂质纳米颗粒被描述于美国专利公开号2016/0038612中,其通过全文引用方式并入本文。
在一个实施方案中,包含位点特异性FOXP3靶向部分的破坏剂可被配制用于受控释放和/或靶向递送。如本文所用,“受控释放”是指符合特定释放模式以实现治疗结果的药物组合物或化合物释放曲线。在一个实施方案中,如本文所述,包含位点特异性FOXP3靶向部分的破坏剂可以被包封在本文所述的和/或本领域已知的用于受控释放和/或靶向递送的递送剂中。如本文所用,术语“包封”意指封装、包围或包裹。当涉及本发明的化合物的制剂时,包封可以是基本上的、完全的或部分的。术语“基本上包封”是指至少大于50、60、70、80、85、90、95、96、97、98、99、99.9、99.9或大于99.999%的本发明的药物组合物或破坏剂可以被封装、包围或包裹在递送剂内。“部分包封”或“部分包封的”意指少于10、10、20、30、40或50或更少的本发明的药物组合物或破坏剂可以被封装、包围或包裹在递送剂内。有利地,可以通过使用荧光和/或电子显微照片测量本发明的药物组合物或化合物的逃逸或活性来测定包封。例如,至少1、5、10、20、30、40、50、60、70、80、85、90、95、96、97、98、99、99.9、99.99%或大于99.99%的本发明的药物组合物或破坏剂被包封在递送剂中。
在一个实施方案中,如本文所述的包含位点特异性FOXP3靶向部分的破坏剂可以包封在治疗性纳米颗粒中。治疗性纳米颗粒可通过本文所述和本领域已知的方法配制,例如但不限于PCT公布号WO2010/005740、WO2010/030763、WO2010/005721、WO2010/005723、WO2012/054923、美国专利公布号2201/10262491、2010/0104645、2010/0087337、2010/0068285、2011/0274759、2010/0068286、2012/0288541、2013/0123351、2013/0230567、2013/0236500、2013/0302433、2013/0302432、1013/0280339和2013/0251757以及美国专利号8,206,747、8,293,276、8,318,208、8,318,211、8,623,417、8,617,608、8,613,954、8,613,951、8,609,142、8,603,534和8,563,041;其中每一个通过全文引用并入本文。在另一个实施方案中,治疗性聚合物纳米颗粒可通过美国专利公布号2012/0140790中所述的方法制备,其通过全文引用并入本文。作为非限制性示例,治疗性纳米颗粒可包含约4至约25重量%的破坏剂和约10至约99重量%的包含聚(乳酸)的二嵌段聚(乳酸)-聚(乙二醇)共聚物(如美国专利公开号2013/0236500中所描述,其通过全文引用并入本文)。作为另一个非限制性示例,纳米颗粒可包含约0.2至约35重量%的破坏剂和约10至约99重量%的二嵌段聚(乳酸)-聚(乙二醇)共聚物(如美国专利公布号2013/0280339和2010251757和美国专利号8,652,528中所述,其中每一个通过全文引用并入本文)。
在一个实施方案中,配制在治疗性纳米颗粒中的破坏剂可以肌内、皮内或静脉内施用。
在一个实施方案中,破坏剂可以在具有高玻璃化转变温度的治疗性纳米颗粒中递送,例如但不限于美国专利公开号2014/0030351和2011/0294717中描述的纳米颗粒,其中每一个通过全文引用并入本文。
在一个实施方案中,治疗性纳米颗粒可被配制用于持续释放。如本文所用,“持续释放”是指药物组合物或化合物符合在特定时间段内的释放速率。该时间段可包括但不限于数小时、数天、数周、数月和数年。作为非限制性示例,持续释放纳米颗粒可以包括聚合物和本发明的破坏剂(参见PCT公开号WO2010075072和美国专利公开号2010/0216804、2011/0217377、2012/0201859、2013/0243848和2013/0243827,其中每一个通过全文引用并入本文)。
在一个实施方案中,本发明的破坏剂可以包封在合成纳米载体中、连接至合成纳米载体和/或与合成纳米载体缔合。合成纳米载体包括但不限于PCT公开号WO2010/005740、WO2010/030763、WO2012/13501、WO2012/149252、WO2012149255、WO2012149259、WO2012149265、WO2012149268、WO2012149282、WO2012149301、WO2012149393、WO2012149405、WO2012149411和WO2012149454以及美国专利公开号20110262491、20100104645、20100087337、20120244222和US20130236533以及美国专利号8,652,487中所描述的那些,其中每一个通过全文引用并入本文。合成纳米载体可以使用本领域已知的和/或本文所述的方法配制。作为非限制性示例,合成纳米载体可以通过PCT公开号WO2010005740、WO2010030763和WO201213501以及美国专利公开号20110262491、20100104645、20100087337和20120244222中描述的方法配制,其中每一个通过全文引用并入本文。在另一个实施方案中,合成纳米载体制剂可以通过PCT公开号WO2011072218和美国专利号8,211,473中描述的方法冻干;其中每一个通过全文引用并入本文。在又一个实施方案中,本发明的制剂(包括但不限于合成纳米载体)可以通过美国专利公开号20130230568中描述的方法冻干或重构,其通过全文引用并入本文。
在一个实施方案中,包含破坏剂的合成纳米载体可以肌内、皮内或静脉内施用。
在一些实施方案中,破坏剂可以使用较小的LNP配制用于递送。这样的颗粒可以包含从小于0.1μm至高达1000μm的直径,例如但不限于小于0.1μm、小于1.0μm、小于5μm、小于10μm、小于15μm、小于20μm、小于25μm、小于30μm、小于35μm、小于40μm、小于50μm、小于55μm、小于60μm、小于65μm、小于70μm、小于75μm、小于80μm、小于85μm、小于90μm、小于95μm、小于100μm、小于125μm、小于150μm、小于175μm、小于200μm、小于225μm、小于250μm、小于275μm、小于300μm、小于325μm、小于350μm、小于375μm、小于400μm、小于425μm、小于450μm、小于475μm、小于500μm、小于525μm、小于550μm、小于575μm、小于600μm、小于625μm、小于650μm、小于675μm、小于700μm、小于725μm、小于750μm、小于775μm、小于800μm、小于825μm、小于850μm、小于875μm、小于900μm、小于925μm、小于950μm、小于975μm。
在另一个实施方案中,破坏剂可以使用较小的LNP配制用于递送,所述较小的LNP可以包含约1nm至约100nm、约1nm至约10nm、约1nm至约20nm、约1nm至约30nm、约1nm至约40nm、约1nm至约50nm、约1nm至约60nm、约1nm至约70nm、约1nm至约80nm、约1nm至约90nm、约5nm至约100nm、约5nm至约10nm、约5nm至约20nm、约5nm至约30nm、约5nm至约40nm、约5nm至约50nm、约5nm至约60nm、约5nm至约70nm、约5nm至约80nm、约5nm至约90nm、约10至约50nm、约20至约50nm、约30至约50nm、约40至约50nm、约20至约60nm、约30至约60nm、约40至约60nm、约20至约70nm、约30至约70nm、约40至约70nm、约50至约70nm、约60至约70nm、约20至约80nm、约30至约80nm、约40至约80nm、约50至约80nm、约60至约80nm、约20至约90nm、约30至约90nm、约40至约90nm、约50至约90nm、约60至约90nm和/或约70至约90nm的直径。
在一个实施方案中,破坏剂可以配制在较小的LNP中,并且可以肌内、皮内或静脉内施用。
在一个实施方案中,破坏剂可以使用PCT专利公开号WO2013063468或美国专利号8,440,614中描述的药物包封微球配制用于递送,其中每一个通过全文引用方式并入本文。在另一个方面,氨基酸、肽、多肽、脂质(APPL)可用于将本发明的破坏剂递送至细胞(参见PCT专利公开号WO2013063468,其通过全文引用并入本文)。
在一个方面,脂质纳米颗粒可以是PCT专利公开号WO2013059922中描述的限制尺寸的脂质纳米颗粒,其通过全文引用并入本文。限制尺寸的脂质纳米颗粒可以包含围绕水性核心或疏水性核心的脂质双层;其中所述脂质双层可包含磷脂,例如但不限于二酰基磷脂酰胆碱、二酰基磷脂酰乙醇胺、神经酰胺、鞘磷脂、双氢鞘磷脂、脑磷脂、脑苷脂、C8-C20脂肪酸二酰基磷脂酰胆碱和I-棕榈酰-2-油酰磷脂酰胆碱(POPC)。在另一个方面,限制尺寸的脂质纳米颗粒可包含聚乙二醇-脂质,例如但不限于DLPEPEG、DMPE-PEG、DPPC-PEG和DSPE-PEG。
在一个实施方案中,可以使用PCT专利公开号WO2013063530(其通过全文引用并入本文)中描述的递送方法将本发明的破坏剂递送、定位和/或聚集于特定位置。作为非限制性示例,可以在向受试者递送破坏剂之前、同时或之后向受试者施用空的聚合物颗粒。一旦与受试者接触,空的聚合物颗粒就经历体积变化,并在受试者体内的特定位置处被捕获、嵌入、固定或诱捕。
在一个实施方案中,破坏剂可被配制在活性物质释放系统中(参见例如美国专利公开号20130102545,其通过全文引用并入本文)。活性物质释放系统可以包括:1)至少一种键合至寡核苷酸抑制链的纳米颗粒,所述寡核苷酸抑制链与催化活性核酸杂交,和2)与至少一种键合至治疗活性物质的底物分子键合的化合物(例如,本发明的破坏剂),其中所述治疗活性物质通过催化活性核酸对底物分子的裂解而释放。
在一个实施方案中,本发明的纳米颗粒可以是水溶性纳米颗粒,例如但不限于在PCT公开号WO2013090601中描述的那些,其通过全文引用并入本文。纳米颗粒可以是具有致密两性离子配体的无机纳米颗粒以显示良好的水溶性。纳米颗粒还可以具有小的流体动力学直径(HD),相对于时间、pH和盐度的稳定性以及低水平的非特异性蛋白质结合。
在一个实施方案中,本发明的纳米颗粒是隐形纳米颗粒或靶标特异性隐形纳米颗粒,例如但不限于美国专利公开号20130172406(Bind)、US20130251817(Bind)、2013251816(Bind)和20130251766(Bind)中所述的那些,其中每一个通过全文引用并入本文。隐形纳米颗粒可以包含二嵌段共聚物和化学治疗剂。这些隐形纳米颗粒可以通过美国专利公开号20130172406、20130251817、2013251816和20130251766中描述的方法制备,其每一个通过全文引用并入本文。作为非限制性示例,隐形纳米颗粒可以靶向癌细胞,例如美国专利公开号20130172406、20130251817、2013251816和20130251766中描述的纳米颗粒,其中每一个通过全文引用并入本文。
在一个实施方案中,包含本发明的破坏剂的隐形纳米颗粒可以肌内、皮内或静脉内施用。
在一个实施方案中,本发明的破坏剂可在包含多种阳离子脂质的脂质纳米颗粒中被配制和/或递送,例如但不限于美国专利公开号20130017223中描述的脂质纳米颗粒,其通过全文引用并入本文。作为非限制性示例,LNP制剂可以包含第一阳离子脂质和第二阳离子脂质。作为另一个非限制性示例,LNP制剂可以包含DLin-MC2-DMA和DLinMC4-DMA。作为另一个非限制性示例,LNP制剂可以包含DLin-MC3-DMA和CI2-200。在一个实施方案中,LNP制剂包含多种阳离子脂质(例如但不限于美国专利公开号US20130017223中描述的那些,其通过全文引用并入本文),并且可以肌内、皮内或静脉内施用。
在一个实施方案中,如本文所述的破坏剂可以在包含阳离子脂质DLin-MC3-DMA和中性脂质DOPE的脂质纳米颗粒中配制和/或递送。脂质纳米颗粒还可包含基于PEG的脂质和胆固醇或抗氧化剂。包含DLin-MC3-DMA和DOPE和破坏剂的这些脂质纳米颗粒制剂可以肌内、皮内或静脉内施用。
在一个实施方案中,包含DLin-MC3-DMA和DOPE的脂质纳米颗粒可包含PEG脂质,例如但不限于季戊四醇PEG酯四琥珀酰亚胺基和季戊四醇PEG醚四硫醇、PEGc-DOMG、PEG-DMG(1,2-二肉豆蔻酰-sn-甘油、聚乙二醇单甲醚)、PEG-DSG(1,2-二硬脂酰-sn-甘油、聚乙二醇单甲醚)、PEG-DPG(1,2-二棕榈酰-sn-甘油、聚乙二醇单甲醚)、PEG-DSA(与1,2-二硬脂酰氧基丙基-3-胺偶联的PEG)、PEG-DMA(与1,2-二肉豆蔻酰氧基丙基-3-胺偶联的PEG)、PEG-c-DNA、PEG-c-DMA、PEG-S-DSG、PEG-c-DMA、PEG-DPG、PEG-DMG 2000和本文所述和/或本领域内已知的那些。
在一个实施方案中,包含DLin-MC3-DMA和DOPE的脂质纳米颗粒可包含0.5%至约3.0%、约1.0%至约3.5%、约1.5%至约4.0%、约2.0%至约4.5%、约2.5%至约5.0%和/或约3.0%至约6.0%的PEG脂质的脂质摩尔比。
在一个实施方案中,包含DLin-MC3-DMA和DOPE的脂质纳米颗粒可包含25.0%胆固醇至约50.0%胆固醇、约30.0%胆固醇至约45.0%胆固醇、约35.0%胆固醇至约50.0%胆固醇和/或约48.5%胆固醇至约60%胆固醇。在一个实施方案中,制剂可以包含选自由28.5%、31.5%、33.5%、36.5%、37.0%、38.5%、39.0%、43.5%和48.5%组成的组的胆固醇百分比。
在一个实施方案中,包含DLin-MC3-DMA和DOPE的脂质纳米颗粒可包含25.0%抗氧化剂至约50.0%抗氧化剂、约30.0%抗氧化剂至约45.0%抗氧化剂、约35.0%抗氧化剂至约50.0%抗氧化剂和/或约48.5%抗氧化剂至约60%抗氧化剂。在一个实施方案中,制剂可包含选自由28.5%、31.5%、33.5%、36.5%、37.0%、38.5%、39.0%、43.5%和48.5%组成的组的抗氧化剂百分比。
本发明的破坏剂可以使用天然和/或合成聚合物配制。可用于递送的聚合物的非限制性示例包括但不限于来自
聚合物制剂可以允许破坏剂的持续或延迟释放(例如,在肌内、皮内或皮下注射后)。破坏剂的改变的释放曲线可导致例如编码蛋白在延长的时间段内的翻译。聚合物制剂也可用于增强破坏剂的稳定性。例如,可生物降解的聚合物先前已经用于保护经修饰的mRNA以外的核酸免于降解,并且已经显示出导致有效负荷在体内的持续释放(Rozema等,Proc Natl Acad Sci USA.2007104:12982-12887;Sullivan等,Expert Opin DrugDeliv.20107:1433-1446;Convertine等,Biomacromolecules.2010Oct.1;Chu等,AccChern Res.2012Jan.13;Manganiello等,Biomaterials.201233:2301-2309;Benoit等,Biomacromolecules.201112:2708-2714;Singha等,Nucleic Acid Ther.20112:133-147;deFougerolles Hum Gene Ther.200819:125-132;Schaffert和Wagner,GeneTher.200816:1131-1138;Chaturvedi等,Expert Opin Drug Deliv.20118:1455-1468;Davis,Mol Pharm.2009 6:659-668;Davis,Nature 2010464:1067-1070;其中每一个通过全文引用并入本文)。
在一个实施方案中,药物组合物可以是持续释放制剂。在另一个实施方案中,持续释放制剂可以用于皮下递送。持续释放制剂可包括但不限于PLGA微球、乙烯乙酸乙烯酯(EVAc)、泊洛沙姆、
B.本发明的载体编码的位点特异性FOXP3破坏剂
包含含有例如核酸分子的位点特异性FOXP3靶向部分的破坏剂可以由插入DNA或RNA载体中的转录单元表达(参见,例如Couture,A,等,TIG.(1996),12:5-10;WO00/22113、WO00/22114和US6,054,299)。在一些实施方案中,根据所用的特定构建体和靶组织或细胞类型,表达是持续的(数月或更长)。这些转基因可以作为可以是整合或非整合载体的线性构建体、环状质粒或病毒载体引入。转基因也可被构建为允许其作为染色体外质粒遗传(Gassmann等,(1995)Proc.Natl.Acad.Sci.USA 92:1292)。破坏剂的不同组分(例如gRNA和效应物)可位于可共同引入(例如通过转染或感染)靶细胞中的单独表达载体上。或者,每个单独的组分可以通过位于同一表达质粒上的启动子转录。
破坏剂表达载体的递送可以是全身的,例如通过静脉内或肌内施用,通过施用至从患者外植的靶细胞后再引入所述患者,或通过允许引入所需靶细胞中的任何其他方式。
在某些实施方案中,本文所述的核酸或编码本文所述的蛋白质(例如效应物)的核酸被并入载体(例如病毒载体)中。
包含含有核酸分子的位点特异性FOXP3靶向部分的破坏剂的单个链或多个链可以从表达载体中的启动子转录。当要表达两条单独的链以产生例如dsRNA时,可将两个单独的表达载体共引入(例如通过转染或感染)靶细胞中。或者,核酸分子的每条单独链可通过均位于同一表达质粒上的启动子转录。在一个实施方案中,核酸分子表达为通过接头多核苷酸序列接合的反向重复多核苷酸,使得核酸分子具有茎和环结构。
表达载体通常是DNA质粒或病毒载体。与真核细胞相容的表达载体,优选与脊椎动物细胞相容的表达载体,可用于产生用于本文所述的破坏剂的表达的重组构建体。
用于破坏剂的重组表达的构建体通常将需要调控元件(例如启动子、增强子等)以确保破坏剂在靶细胞中的表达。
天然或合成核酸的表达通常通过将编码目的核酸的核酸可操作地连接至调控区(例如启动子)并将构建体并入表达载体中来实现。载体可适于真核生物中的复制和整合。
适合于可操作地连接至核酸分子的调控区(例如启动子)可以可操作地连接至调控区(例如启动子),可以来自任何物种。任何类型的启动子都可以可操作地连接至核酸序列。启动子的示例包括但不限于组织特异性启动子、组成型启动子和对特定刺激有反应或无反应的启动子(例如诱导型启动子)。其他启动子元件(例如增强序列)调节转录起始的频率。通常,这些位于起始位点上游30-110bp的区域中,尽管最近发现许多启动子也包含起始位点下游的功能元件。启动子元件之间的间隔通常是灵活的,使得当元件相对于彼此反转或移动时,启动子功能得到保留。在胸苷激酶(tk)启动子中,在活性开始下降之前,启动子元件之间的间隔可以增加到相隔50bp。取决于启动子,单个元件可以协同或独立地发挥作用以激活转录。
合适启动子的一个示例是立即早期巨细胞病毒(CMV)启动子序列。该启动子序列是能够驱动与其可操作地连接的任何多核苷酸序列的高水平表达的强组成型启动子序列。合适的启动子的另一个示例是延伸生长因子-1a(EF-1a)。但是,也可以使用其他组成型启动子序列,其包括但不限于猿病毒40(SV40)早期启动子、小鼠乳腺肿瘤病毒(MMTV)、人免疫缺陷病毒(HIV)长末端重复序列(LTR)启动子、MoMuLV启动子、禽白血病病毒启动子、Epstein-Barr病毒立即早期启动子、鲁斯氏肉瘤病毒启动子以及人基因启动子,例如但不限于肌动蛋白启动子、肌球蛋白启动子、血红蛋白启动子和肌酸激酶启动子。
此外,本发明不应限于使用组成型启动子。诱导型启动子也被认为是本发明的一部分。诱导型启动子的使用提供了一种分子开关,当需要这样的表达时,该开关能够开启可操作地连接的多核苷酸序列的表达,或当不需要表达时,能够关闭该表达。诱导型启动子的示例包括但不限于金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子和四环素启动子。
可用于核酸构建体的其他调控区包括但不限于转录和翻译终止子、起始序列、聚腺苷酸化序列、翻译控制序列(例如内部核糖体进入片段,IRES)、增强子、诱导型元件或内含子。这样的调控区可以不是必需的,尽管它们可以通过影响转录、mRNA的稳定性、翻译效率等来增加表达。这样的调控区可以根据需要被包含在核酸构建体中以获得核酸在细胞中的最佳表达。但是,在没有这些附加元件的情况下有时可以获得足够的表达。
待引入的表达载体还可以包含选择标记基因或报道基因或两者,以促进寻求转染或通过病毒载体感染的细胞群体中的表达细胞的鉴定和选择。在其他方面,选择标记可以携带在DNA的单独片段上并用于共转染程序。选择标记和报道基因都可以与合适的转录控制序列侧接以能够在宿主细胞中表达。有用的选择标记包括例如抗生素抗性基因,如neo等。选择标记的非限制性示例包括嘌呤霉素、更昔洛韦、腺苷脱氨酶(ADA)、氨基糖苷磷酸转移酶(neo、G418、APH)、二氢叶酸还原酶(DHFR)、潮霉素-B-磷酸转移酶、胸核激酶(TK)和黄嘌呤-鸟嘌呤磷酸核糖基转移酶(XGPRT)。这些标记可用于选择培养中的稳定转化体。其他选择标记包括荧光多肽,如绿色荧光蛋白或黄色荧光蛋白。
信号肽也可被包括并可被使用,使得编码的多肽被引导至特定的细胞位置(例如细胞表面)。
报道基因可用于鉴定潜在转染的细胞和评价转录控制序列的功能。通常,报道基因是一种不存在于受体来源中或不由受体来源表达且编码的多肽的表达通过一些容易检测的性质(例如酶活性)显现的多肽的基因。在将DNA引入受体细胞后的合适时间测定报道基因的表达。合适的报道基因可包括编码荧光素酶、β-半乳糖苷酶、氯霉素乙酰转移酶、分泌型碱性磷酸酶的基因或绿色荧光蛋白基因(例如,Ui-Tei等,2000 FEBS Letters 479:79-82)。合适的表达系统是众所周知的,并且可以使用已知技术制备或商购获得。通常,展现出报道基因最高表达水平的具有最小5’侧翼区的构建体被鉴定为启动子。这样的启动子区可以与报道基因连接并用于评价试剂调节启动子驱动的转录的能力。
对于载体和构建体要考虑的其他方面是本领域已知的。
在一些实施方案中,载体(例如病毒载体)包含破坏剂,所述破坏剂包含含有核酸分子的位点特异性FOXP3靶向部分。
可与本文所述的方法和组合物一起使用的病毒载体系统包括但不限于:(a)腺病毒载体(例如Ad5/F35载体);(b)逆转录病毒载体,包括但不限于慢病毒载体(包括有整合能力的或整合缺陷的慢病毒载体)、莫洛尼鼠白血病病毒等;(c)腺相关病毒载体;(d)单纯疱疹病毒载体;(e)SV 40载体;(f)多瘤病毒载体;(g)乳头瘤病毒载体;(h)小核糖核酸病毒载体;(i)痘病毒载体,例如正痘病毒(例如牛痘病毒载体),或禽痘病毒(例如金丝雀痘病毒或鸡痘病毒);和(j)辅助依赖性或无肠腺病毒。复制缺陷型病毒也可能是有利的。不同的载体将并入或不并入细胞的基因组中。如果需要,构建体可以包括用于转染的病毒序列。或者,构建体可被掺入能够附加型复制的载体中,例如EPV和EBV载体。参见,例如美国专利号6,534,261;6,607,882;6,824,978;6,933,113;6,979,539;7,013,219和7,163,824,其中每一个通过全文引用并入本文。
载体,包括源自逆转录病毒(例如慢病毒)的那些,是实现长期基因转移的合适工具,因为它们允许转基因长期且稳定的整合及其在子代细胞中的增殖。载体的示例包括表达载体、复制载体、探针生成载体和测序载体。表达载体可以病毒载体的形式提供给细胞。病毒载体技术是本领域众所周知的,并且描述于各种病毒学和分子生物学手册中。
在一个实施方案中,用于本发明的合适的病毒载体是腺相关病毒载体,如重组腺相关病毒载体。
重组腺相关病毒载体(rAAV)是基于缺陷型和非致病性细小病毒腺相关2型病毒的基因递送系统。所有载体均源自仅保留位于转基因表达盒侧翼的AAV 145bp反向末端重复序列的质粒。由于向转导细胞的基因组中的整合,有效的基因转移和稳定的转基因递送是该载体系统的关键特征。(Wagner等,Lancet 351:9117 1702-3(1998),Kearns等,GeneTher.9:748-55(1996))。根据本发明可以使用AAV血清型,其包括AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8和AAV9。
复制缺陷型重组腺病毒载体(Ad)可以高滴度产生,并且容易感染许多不同的细胞类型。大多数腺病毒载体被工程化以使转基因取代Ad E1a、E1b和/或E3基因;随后,复制缺陷型载体在提供反式缺失基因功能的人293细胞中扩增。Ad载体可以在体内转导多种类型的组织,包括不分裂的分化细胞,例如在肝、肾和肌肉中发现的那些。传统的Ad载体具有大承载能力。临床试验中使用Ad载体的示例涉及用肌内注射进行抗肿瘤免疫的多核苷酸疗法(Sterman等,Hum.Gene Ther.7:1083-9(1998))。在临床试验中使用腺病毒载体进行基因转移的其他示例包括Rosenecker等,Infection 24:15-10(1996);Sterman等,Hum.GeneTher.9:71083-1089(1998);Welsh等,Hum.Gene Ther.2:205-18(1995);Alvarez等,Hum.Gene Ther.5:597-613(1997);Topf等,Gene Ther.5:507-513(1998);Sterman等,Hum.Gene Ther.7:1083-1089(1998)。
包装细胞用于形成能够感染宿主细胞的病毒颗粒。这些细胞包括包装腺病毒的293细胞和包装逆转录病毒的ψ2细胞或PA317细胞。用于基因治疗的病毒载体通常由将核酸载体包装至病毒颗粒中的生产细胞系产生。载体通常包含包装和随后整合入宿主(如果适用)中所需的最小病毒序列,其他病毒序列被编码要表达的蛋白质的表达盒取代。缺失的病毒功能由包装细胞系反式提供。例如,用于基因治疗的AAV载体通常仅具有包装和整合入宿主基因组所必需的来自AAV基因组的反向末端重复(ITR)序列。病毒DNA包装在细胞系中,该细胞系包含编码其他AAV基因(即rep和cap),但缺乏ITR序列的辅助质粒。细胞系也被作为辅助者的腺病毒感染。辅助病毒促进AAV载体的复制和来自辅助质粒的AAV基因的表达。由于缺乏ITR序列,辅助质粒没有被大量包装。腺病毒的污染可以通过例如对热处理比AAV更敏感的腺病毒来减少。
IV.本发明的方法
A.细胞中FOXP3表达的调节
本发明还提供使用本文所述的试剂和组合物来调节细胞中叉头框P3(FOXP3)的表达的方法。所述方法包括使细胞(例如天然T细胞)与位点特异性FOXP3破坏剂接触,所述破坏剂包含靶向FOXP3表达控制区的位点特异性FOXP3靶向部分和效应物分子,从而调节细胞中FOXP3的表达。位点特异性破坏剂、效应物或位点特异性破坏剂和效应物两者可以存在于组合物中,例如上述组合物。在一些实施方案中,位点特异性破坏剂和效应物存在于相同的组合物中。在其他实施方案中,位点特异性破坏剂和效应物存在于不同的组合物中。在一些实施方案中,本发明的方法包括使细胞与两种位点特异性FOXP3破坏剂(第一和第二试剂)接触。两种位点特异性FOXP3破坏剂可存在于相同组合物(例如药物组合物,例如包含LNP的药物组合物)中,或存在于单独组合物(例如药物组合物,例如包含LNP的药物组合物)中。细胞可以在一个时间与第一位点特异性FOXP3破坏剂接触,且在第二个时间与第二位点特异性FOXP3破坏剂接触,或者细胞可以同时与两种试剂接触。
相比于例如未与位点特异性FOXP3破坏剂接触的细胞,FOXP3的表达可增加或降低。基因表达的调节可通过本领域已知的任何方法评估。例如,表达的调节可以通过使用本领域内技术人员已知的常规方法(例如RNA印迹法、qRT-PCR)测定例如细胞、多个细胞和/或组织样品中基因的mRNA表达水平;通过使用本领域内技术人员已知的常规方法(例如蛋白质印迹、免疫学技术)测定基因的蛋白质水平来测定。
在受试者中FOXP3基因表达或FOXP3蛋白产生的水平或疾病标记或症状的背景下,术语“降低的”是指这种水平的统计上显著的降低。降低可以是例如至少20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%、或低于检测方法的检测水平。在某些实施方案中,靶标的表达被正常化,即朝向未患此类病症的个体在正常范围内能接受的水平降低或降低到该水平。如本文所用,受试者中的“降低”可指降低受试者细胞中的基因表达或蛋白质产生不需要降低受试者的所有细胞或组织中的表达。例如,如本文所用,受试者中的降低可包括受试者肝脏中基因表达或蛋白质产生的降低。
术语“降低的”还可以与正常化疾病或病症的症状结合使用,即将患有自身免疫性疾病或FOXP3相关疾病的受试者的水平朝向未患有自身免疫性疾病或FOXP3相关疾病的正常受试者的水平降低以减小两者之间的差异或降低到正常受试者的水平。如本文所用,如果疾病与症状的升高值相关,则“正常”被认为是正常的上限。如果疾病与症状的降低值相关,则“正常”被认为是正常的下限。
在受试者中FOXP3基因表达或FOXP3蛋白产生的水平或疾病标记或症状的背景下,术语“增加的”是指这种水平的统计上显著的增加。增加可以是例如至少20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%、或高于检测方法的检测水平。在某些实施方案中,靶标的表达被正常化,即朝向未患此类病症的个体在正常范围内能接受的水平增加或增加到该水平。如本文所用,受试者中的“增加”可指增加受试者细胞中的基因表达或蛋白质产生不需要增加受试者的所有细胞或组织中的表达。例如,如本文所用,受试者中的增加可包括受试者肝脏中基因表达或蛋白质产生的增加。
术语“增加的”还可以与正常化疾病或病症的症状结合使用,即将患有FOXP3相关疾病或自身免疫性疾病的受试者的水平朝向未患有FOXP3相关疾病或自身免疫性疾病的正常受试者的水平增加以减小两者之间的差异或增加到正常受试者的水平。如本文所用,如果疾病与症状的升高值相关,则“正常”被认为是正常的上限。如果疾病与症状的降低值相关,则“正常”被认为是正常的下限。
在一些实施方案中,用于本发明方法的合适细胞是哺乳动物细胞。在一些实施方案中,细胞是体细胞。在一些实施方案中,细胞是原代细胞。例如,在一些实施方案中,细胞是哺乳动物体细胞。在一些实施方案中,哺乳动物体细胞是原代细胞。在一些实施方案中,哺乳动物体细胞是非胚胎细胞。
B.免疫细胞的体外产生
接触步骤可以在体外、在体内(即,细胞可以在受试者体内)或离体进行。在一些实施方案中,接触细胞是离体进行的,并且方法在所述接触步骤之前还包括从受试者移除所述细胞(例如哺乳动物细胞)的步骤。在一些实施方案中,方法在接触步骤之后还包括步骤(b)向受试者施用细胞(例如哺乳动物细胞)。
本发明提供产生免疫细胞(例如Treg)的方法,其在本发明的一个方面包括本发明的位点特异性FOXP3破坏剂。FOXP3破坏剂可以调节(例如,增加)FOXP3基因的表达持续足以将免疫细胞引导至分化途径或改变激活状态(例如,诱导天然T细胞分化成Treg细胞或激活Treg细胞)的一段时间。
用于操纵免疫细胞的方法
在一个实施方案中,本发明提供操纵细胞,例如免疫细胞或其亚群(例如Treg或天然T细胞)的方法。在本文中,术语“操纵”包括例如靶细胞的激活、分裂、分化、生长、扩增、重编程、免疫失能、沉默、衰老、凋亡或死亡。
可以操纵多种细胞,例如免疫细胞,其中包括来自受试者的新鲜样品、原代培养细胞、永生化细胞、细胞系、杂交瘤等。待操纵的细胞还可以包括干细胞,例如胚胎干细胞、诱导多能干细胞、动员外周血干细胞。经过操纵的细胞可用于各种免疫治疗应用以及用于研究。
在本发明的某些实施方案中,可以通过使用本发明的FOXP3破坏剂培养包含免疫细胞的样品(例如,获取自受试者(例如能够受益于FOXP3表达调节的受试者)的样品)离体操纵细胞。
在某些实施方案中,待操纵的免疫细胞可以是从脐带血或外周血分离的天然T细胞。可通过使细胞与本发明的FOXP3破坏剂接触来操纵(例如分化和/或激活)天然T细胞。在一些实施方案中,天然T细胞可进一步与抗原或抗原呈递细胞接触以分化成抗原特异性Treg。在一些实施方案中,待操纵的免疫细胞可以是Treg细胞。可以通过使细胞与本发明的FOXP3破坏剂接触来操纵(例如,激活)Treg。
从样品(例如来自受试者的样品)中分离前述T细胞的方法是本领域已知的并在下文描述。
如本文所用,术语“调节性T细胞”、“Treg细胞”或“Treg”(也称为“抑制性T细胞”),是指调节免疫系统、维持对自身抗原的耐受性并预防自身免疫性疾病的T细胞群体。Treg是免疫抑制性的,并且通常抑制或下调效应T细胞的诱导和增殖。Treg表达生物标记CD4、FOXP3和CD25,并且被认为源自与天然CD4细胞相同的谱系。
如本文所用,术语“天然T细胞”是指已在骨髓中分化并在胸腺中成功地经历了中枢选择的阳性和阴性过程的T细胞群体。其中,存在天然形式的辅助T细胞(CD4+)和细胞毒性T细胞(CD8+)。与激活或记忆T细胞不同,天然T细胞被认为是成熟的,并且在外周中没有遇到其同源抗原。
T细胞群的扩增
在相关实施方案中,本发明还涉及用于扩增某些免疫细胞(例如来自免疫细胞群体的天然T细胞或Treg)的方法,例如扩增包含在样品中的Treg或天然T细胞的方法,所述样品包含B细胞、树突细胞、巨噬细胞、浆细胞等。在另一个实施方案中,本发明还涉及用于扩增特定T细胞群体(例如扩增分化/激活的Treg)的方法。
在一个实施方案中,通过使用本发明的FOXP3破坏剂培养含有免疫细胞的样品来离体扩增(例如,生长或分化)免疫细胞,例如Treg。在一个实施方案中,离体T细胞扩增可通过如下步骤进行:首先从样品中分离Treg或天然T细胞,随后通过使它们与本发明的FOXP3破坏剂接触来刺激T细胞,使得Treg被激活和/或扩增。
在本发明的一个实施方案中,T细胞是从受试者获得的原代T细胞。T细胞可以获取自许多来源,其中包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、脾脏组织和肿瘤。在本发明的某些实施方案中,可以使用本领域可获得的任何数量的原代T细胞和/或T细胞系。
对全血计数的研究显示全血中T细胞的数量非常低。例如,根据Stem CellTechnologies,Vancouver,BC,CANADA公开的产品目录(Document#23629,VERSION 2.1.0),全血中的白细胞群体为约0.1-0.2%(由于红细胞占数量优势),其中T细胞占总白细胞群体的约7-24%。在T细胞中,CD4+T细胞占总白细胞群体的约4-20%(转化为在全血中的总细胞群体的低于0.04%),CD8+T细胞占总白细胞群体的约2-11%(转化为在全血中的总细胞群体的低于0.022%)。因此,在本发明的某些实施方案中,本发明的方法可以与本领域已知其他用于富集免疫细胞(例如天然T细胞或Treg)的技术联用。富集步骤可以在样品与本发明的FOXP3破坏剂接触之前进行。在另一个实施方案中,富集步骤可以在样品已经与本发明的FOXP3破坏剂接触之后进行。
在一个实施方案中,可以使用FICOLL分离来富集Treg群体。在一个实施方案中,来自个体的循环血液的细胞通过单采血液成分法或白细胞单采血液成分法获得。单采血液成分法产物通常含有淋巴细胞,其中包括T细胞、单核细胞、粒细胞、B细胞、其他有核白细胞、红细胞和血小板。可以洗涤通过单采血液成分法收集的细胞以去除血浆部分并将细胞置于合适的缓冲液或培养基中用于随后的处理步骤。然后用磷酸盐缓冲盐水(PBS)洗涤细胞。或者,洗涤溶液缺少钙并且可以缺少镁或者可以缺少许多(如果不是全部的话)二价阳离子。还可以根据制造商的说明书使用半自动“流通”离心机。洗涤后,可将细胞重悬于多种生物相容性缓冲液中,例如无钙、无镁的PBS。或者,可以去除单采血液成分法样品中不需要的成分,并将细胞直接重悬于培养基中。
在另一个实施方案中,外周血或全血T细胞可通过裂解红细胞并消耗单核细胞来富集,例如通过PERCOLL
根据本发明,可以可选地采用各种分类技术。例如,还可以使用针对细胞特有表面标记的抗体的组合进一步分类扩增或操纵的T细胞群体。优选的方法是通过磁性免疫粘附或流式细胞术的细胞分类和/或选择,其使用针对所选细胞上存在的细胞表面标记的单克隆抗体的混合物。例如,为了富集Treg,可能需要选择通常表达CD4+、CD25+、CD62Lhi、GITR+和FoxP3+的调节性T细胞。
为了分离期望的细胞群体,可以改变细胞和支架表面的浓度。在某些实施方案中,可能预期显著降低FOXP3破坏剂和T细胞混合在一起的体积(即,增加细胞的浓度),以确保细胞与FOXP3破坏剂的最大接触。例如,在一个实施方案中,使用20亿个细胞/ml的浓度。在一个实施方案中,使用10亿个细胞/ml的浓度。在另一个实施方案中,使用大于1亿个细胞/ml。在另一个实施方案中,使用1000万、1500万、2000万、2500万、3000万、3500万、4000万、4500万或5000万个细胞/ml的细胞浓度。在又一个实施方案中,使用7500万、8000万、8500万、9000万、9500万或1亿个细胞/ml的细胞浓度。在进一步的实施方案中,可以使用1.25亿或1.5亿个细胞/ml的浓度。使用高浓度可导致增加的细胞产量、细胞激活和细胞扩增。此外,高细胞浓度的使用允许更有效地捕获可能弱表达目标靶抗原的细胞。
在一个实施方案中,本发明可以包括本领域已知的样品制备方法。例如,T细胞可在洗涤步骤后冷冻并在使用前解冻。冷冻和随后的解冻通过去除细胞群体中的粒细胞和一定程度的单核细胞来提供更均匀的产物。在去除血浆和血小板的洗涤步骤之后,可以将细胞悬浮在冷冻溶液中。虽然许多冷冻溶液和参数是本领域已知的并且在本文中是有用的,但是提供了一种方法,其涉及使用含有20%DMSO和8%人血清白蛋白的PBS,或含有例如HESPAN和PLASMALYTE A的其他合适的细胞冷冻介质,然后将细胞以1°/分钟的速率冷冻至-80℃并储存在液氮储存罐的气相中。可以使用其他受控的冷冻方法以及在-20℃或液氮中的立即不受控冷冻。
在本发明的背景下,还考虑了在可能需要如本文所述的扩增细胞之前的时间段从受试者处收集血样或白细胞去除术产物。因此,可以在任何必要的时间点收集待扩增的细胞来源,以及分离并冷冻期望的细胞,例如T细胞,以随后在用于将受益于T细胞疗法的任何数量的疾病或病症的T细胞疗法中使用,例如本文所述的那些。在一个实施方案中,血液样品或白细胞单采取自一般健康的受试者。在某些实施方案中,血液样品或白细胞单采取自处于发展疾病危险中但尚未发展疾病的一般健康受试者,分离目标细胞并冷冻以备后用。在某些实施方案中,可以扩增、冷冻T细胞,并在随后的时间使用。在某些实施方案中,在被诊断为本文所述的特定疾病之后不久但在任何治疗之前,从患者处收集样品。
在相关的实施方案中,本发明涉及用于获得CD4+/FOXP3+或CD4+/FOXP3-细胞的多克隆群体的方法。方法包括使本发明的FOXP3破坏剂与受试者的生物样品接触,从而激活和任选地扩增样品中存在的T细胞群体;使样品中的T细胞和用于检测CD4+细胞的试剂接触;进一步使T细胞和用于检测FOXP3+细胞的试剂接触;以及从样品中分离检测到的CD4+/FOXP3+或CD4+/FOXP3-T细胞的亚群。在这些实施方案中,用于CD4+和/或FOXP3+T细胞的检测和/或分离的试剂优选是特异性结合CD4+和FOXP3标记的抗体或其抗原结合片段。
在另一个实施方案中,本发明涉及获得天然T细胞群体的方法。用于分离天然T细胞的方法是本领域已知的,例如,使用商业上可获得的试剂盒,例如STEMCELLTechnologies的EasySep
在某些实施方案中,可以进一步扩增已经分化/激活的免疫细胞。例如,激活的Treg可以在某些细胞因子(例如IL-2)存在下培养以进一步扩增。
因此,在另一个方面,本发明提供包含FOXP3破坏剂的免疫细胞。在一些实施方案中,FOXP3破坏剂可以在免疫细胞中存在足够长的一段时间,以诱导免疫细胞例如天然T细胞分化为Treg或激活Treg。在某些实施方案中,免疫细胞可含有一种或多种调节(例如激活)FOXP3基因表达的遗传修饰。在FOXP3破坏剂从细胞中消失或以非常低的水平保留在细胞中后,这种遗传修饰可以存在于细胞中。因此,即使在FOXP3破坏剂停止发挥作用后,FOXP3基因的表达仍可保持激活。
在这种情况下,可以通过位点特异性FOXP3破坏剂引入遗传修饰。遗传修饰包括在靶序列(例如FOXP3基因的TSS上游周围/接近上游的DNA区)上的一个或多个核苷酸添加、缺失或取代。遗传修饰可以是靶序列的一个或多个核苷酸的表观遗传修饰(例如甲基化/去甲基化)或靶序列(例如FOXP3基因的TSS上游周围/接近上游的DNA区)处的一个或多个染色质蛋白的表观遗传修饰(例如乙酰化/脱乙酰化)。
C.本发明的体内方法
本发明的体内方法可包括向受试者施用本发明的试剂、组合物或细胞。
在一个实施方案中,通过提供本发明的FOXP3破坏剂来在体内操纵(例如激活)免疫细胞,例如天然T细胞或Treg,使得免疫细胞(例如天然T细胞或Treg)与破坏剂接触。为了促进接触,FOXP3破坏剂可以在受试者中施用,例如皮下或静脉内施用。
如本文所用,术语“受试者”是指生物体,例如哺乳动物(例如人类、非人类哺乳动物、非人类灵长类动物、灵长类动物、实验室动物、小鼠、大鼠、仓鼠、沙鼠、猫或狗)。在一些实施方案中,人类受试者是成人、青少年或儿童受试者。在一些实施方案中,受试者患有疾病或病症。在一些实施方案中,受试者患有疾病、病症或病状,例如可如本文提供治疗的疾病、病症或病状。在一些实施方案中,受试者易患疾病、病症或病状;在一些实施方案中,易患病受试者易患疾病、病症或病状和/或显示出增加的患疾病、病症或病状的风险(与在参照受试者或群体中观察到的平均风险相比)。在一些实施方案中,受试者表现出疾病、病症或病状的一种或多种症状。在一些实施方案中,受试者不表现出疾病、病症或病状的特定症状(例如疾病的临床表现)或特征。在一些实施方案中,受试者不表现出疾病、病症或病状的任何症状或特征。在一些实施方案中,受试者是患者。在一些实施方案中,受试者是被诊断和/或治疗和/或已经被诊断和/或治疗的个体。
受益于本发明方法的受试者包括患有自身免疫性疾病的受试者、处于自身免疫性疾病风险中的受试者、患有“FOXP3相关疾病”或处于“FOXP3相关疾病”风险的受试者。
因此,本发明还提供治疗有此需要的受试者的方法。本发明的治疗方法包括以治疗有效量向受试者(例如,将受益于FOXP3表达的调节的受试者,例如患有自身免疫性疾病或FOXP3相关疾病的受试者)施用本发明的试剂、组合物或细胞。在一些实施方案中,本发明的方法包括向受试者施用两种位点特异性FOX3P破坏剂(第一和第二试剂)。两种位点特异性FOX3P破坏剂可以存在于相同的组合物,例如药物组合物,例如包含LNP的药物组合物中,或存在于单独的组合物,例如药物组合物,例如包含LNP的药物组合物中。受试者可以在一个时间被施用第一位点特异性FOX3P破坏剂,且在第二个时间被施用第二位点特异性FOX3P破坏剂,或者受试者可以同时被施用两种试剂。
此外,本发明提供了通过向受试者施用预防有效量的本发明的试剂、组合物或细胞来预防受试者中的至少一种症状的方法,其中所述受试者是将受益于FOXP3表达的调节的受试者,例如患有自身免疫性疾病或FOXP3相关疾病的受试者。
如本文所用,“治疗有效量”旨在包括当施用于患者以治疗患有自身免疫性疾病或FOXP3相关疾病的受试者时,足以实现疾病治疗(例如通过减少、减轻或维持现有疾病或疾病的一种或多种症状或其相关并发症)的试剂或组合物或细胞的量。“治疗有效量”可根据试剂或组合物、如何施用、疾病及其严重程度和待治疗患者的病史、年龄、体重、家族史、遗传组成、由FOXP3基因表达介导的病理过程的阶段、先前或伴随治疗的类型(如果有的话)和其他个体特征而变化。
如本文所用,“预防有效量”旨在包括当施用于尚未经历或展现出FOXP3相关疾病的症状但可能易患FOXP3相关疾病的受试者时,足以在具有临床意义的时间段中预防或延迟疾病或疾病的一种或多种症状的发展或进展的试剂或组合物或细胞的量。“预防有效量”可以根据试剂或组合物、如何施用、疾病的风险程度及待治疗患者的病史、年龄、体重、家族史、遗传组成、先前或伴随治疗的类型(如果有的话)和其他个体特征而变化。
如本文所用,“预防(prevention)”或“防止(preventing)”当用于提及将受益于FOXP3基因表达的激活或FOXP3蛋白的产生的疾病、病症或病状时,是指受试者将发展出与此类疾病、病症或病状相关的症状(例如Treg或FOXP3基因功能障碍的征兆或症状)的可能性的降低。
“治疗有效量”或“预防有效量”也包括以适用于任何治疗的合理益处/风险比产生一定的期望的局部或全身作用的试剂或组合物或细胞的量。本发明的方法中使用的试剂和组合物或细胞可以足够的量施用以产生适用于此类治疗的合理的益处/风险比。在一些实施方案中,治疗有效量或预防有效量以单次剂量施用;在一些实施方案中,需要多个单位剂量来递送治疗或预防有效量。
如本文所用,当特定疾病、病症或病状的一种或多种症状在量值(例如强度、严重度等)和/或频率上降低时,可使用短语“症状减轻”。在一些实施方案中,特定症状发作的延迟被认为是降低该症状频率的一种形式。
当待治疗的的受试者是哺乳动物(例如人类)时,组合物或细胞可以通过本领域已知的任何方式施用,其中包括但不限于口服、腹膜内或肠胃外途径,包括颅内(例如脑室内、实质内和鞘内)、静脉内、肌内、皮下、透皮、气道(气溶胶)、鼻、直肠和局部(包括口腔和舌下)施用。在某些实施方案中,组合物通过静脉内输注或注射施用。在某些实施方案中,组合物通过皮下注射施用。
如本文所用,术语“FOXP3相关疾病”包括将受益于FOXP3基因表达、复制或蛋白质活性的调节(例如增加)的疾病、病症或病状,例如自身免疫性疾病或与Treg功能障碍相关的疾病。FOXP3相关疾病的非限制性示例包括自身免疫性疾病,例如,IPEX综合征(IPEX)、1型糖尿病、多发性硬化、系统性红斑狼疮(SLE)、类风湿性关节炎(RA)、失弛缓症、艾迪生氏病、成人史迪尔氏病、血中丙球蛋白贫乏、斑秃、淀粉样变性、强直性脊柱炎、抗GBM/抗TBM肾炎、抗磷脂综合征、自身免疫性血管性水肿、自身免疫性自主神经异常、自身免疫性脑脊髓炎、自身免疫性肝炎、自身免疫性内耳疾病(AIED)、自身免疫性心肌炎、自身免疫性卵巢炎、自身免疫性睾丸炎、自身免疫性胰腺炎、自身免疫性视网膜病、自身免疫性荨麻疹、轴突和神经元神经病(AMAN)、Baló病、白塞病、良性黏膜类天疱疮、大疱性类天疱疮、Castleman病(CD)、乳糜泻、恰加斯氏病、慢性炎症性脱髓鞘性多发性神经病(CIDP)、慢性复发性多灶性骨髓炎(CRMO)、ChurgStrauss综合征(CSS)或嗜酸性肉芽肿(EGPA)、瘢痕性类天疱疮、Cogan综合征、冷凝集素病、先天性心脏传导阻滞、柯萨奇心肌炎、CREST综合征、克罗恩病、疱疹样皮炎、皮肌炎、德维克病(视神经脊髓炎)、盘状狼疮、Dressier综合征、子宫内膜异位症、嗜酸性食管炎(EoE)、嗜酸性筋膜炎、结节性红斑、原发性混合冷球蛋白血症、埃文斯综合征、纤维肌痛、纤维化肺泡炎、巨细胞动脉炎(颞动脉炎)、巨细胞心肌炎、肾小球肾炎、Goodpasture综合征、肉芽肿性多血管炎、格雷夫斯病、格林巴利综合征、桥本甲状腺炎、溶血性贫血、过敏性紫癜(HSP)、妊娠疱疹或妊娠类天疱疮(PG)、化脓性汗腺炎(HS)(反常性痤疮)、低丙种球蛋白血症、IgA肾病、IgG4相关硬化性疾病、免疫性血小板减少性紫癜(ITP)、包涵体肌炎(IBM)、间质性膀胱炎(IC)、青少年关节炎、青少年糖尿病(1型糖尿病)、幼年性肌炎(JM)、川崎病、Lambert-Eaton综合征、白细胞破碎性血管炎、扁平苔藓、硬化苔藓、结膜炎、线性IgA病(LAD)、狼疮、慢性莱姆病、梅尼埃病、显微镜下多血管炎(MPA)、混合结缔组织病(MCTD)、莫伦氏溃疡、穆夏-哈伯曼病、多灶性运动神经病(MMN)或MMNCB、重症肌无力、肌炎、嗜睡症、新生儿狼疮、视神经脊髓炎、中性粒细胞减少症、眼瘢痕性类天疱疮、视神经炎、回文风湿病(PR)、PANDAS、副肿瘤性小脑变性(PCD)、阵发性夜间血红蛋白尿(PNH)、ParryRomberg综合征、睫状体平坦部炎(外周葡萄膜炎)、Parsonage-Turner综合征、天疱疮、外周神经病、周围性脑脊髓炎、恶性贫血(PA)、POEMS综合征、结节性多动脉炎、I、II、III型多腺体综合征、风湿性多肌痛、多发性肌炎、心肌梗死后综合征、心包切开术后综合征、原发性胆汁性肝硬化、原发性硬化性胆管炎、孕激素皮炎、银屑病、银屑病性关节炎、纯红细胞再生障碍(PRCA)、坏疽性脓皮病、雷诺现象、反应性关节炎、反射性交感神经营养不良、复发性多软骨炎、不宁腿综合征(RLS)、腹膜后纤维化、风湿热、结节病、施密特综合征、巩膜炎、硬皮病、干燥综合征、精子和睾丸自身免疫、僵人综合征(SPS)、亚急性细菌性心内膜炎(SBE)、Susac综合征、交感性眼炎(SO)、高安氏动脉炎、颞动脉炎/巨细胞动脉炎、血小板减少性紫癜(TTP)、Tolosa-Hunt综合征(THS)、横贯性脊髓炎、溃疡性结肠炎(UC)、未分化结缔组织病(UCTD)、葡萄膜炎、血管炎、白癜风、小柳原田病(Vogt-Koyanagi-Harada Disease)。
在一个实施方案中,FOXP3相关疾病选自由IPEX综合征(IPEX)、1型糖尿病、多发性硬化、系统性红斑狼疮(SLE)和类风湿性关节炎(RA)组成的组。
关于各种疾病或病症的体征和症状的进一步细节是在本文中提供的并且是本领域熟知的(参见,例如,ghr.nlm.nih.gov)。
根据本发明的方法的试剂或组合物或细胞的施用可导致患有FOXP3相关疾病或病症的患者中FOXP3相关疾病或病症的严重程度、体征、症状或标记的降低。在此背景下的“降低”是指这种水平的统计学上显著的降低。降低(绝对降低或受试者中升高的水平与正常水平之间的差异的降低)可以是例如至少约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或95%、或至低于所用测定的检测水平。
根据本发明的方法的试剂或组合物或细胞的施用可以稳定地或瞬时地调节靶基因的表达,或可以稳定地或瞬时地增加Treg的量或激活水平。在一些实施方案中,表达的调节持续至少约1小时至约30天,或至少约2小时、6小时、12小时、18小时、24小时、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天或更长时间或其间的任何时间。在一些其他实施方案中,表达的调节持续不超过约30分钟至约7天、或不超过约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、24小时、36小时、48小时、60小时、72小时、4天、5天、6天、7天或其间的任何时间。在某些实施方案中,Treg的量可以增加约至少5%至约10倍、或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多或其间的任何值。在某些实施方案中,激活的Treg(例如,特征为FOXP3表达增加的Treg)的百分比可以增加约至少5%至约10倍、或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多或其间的任何值。在一些实施方案中,在Treg或Treg群体中FOXP3的表达可以增加约至少5%至约10倍、或至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍或更多或其间的任何值。
试剂或组合物或细胞可以向受试者施用一次,或者,可以在一段时间内进行多次施用。例如,可以在一次治疗期间或在一段时间内给予受试者两次、三次、四次、五次或多次施用。在一些实施方案中,可以在一个治疗期间或在作为治疗方案的一段时间内给予受试者六次、八次、十次、十二次、十五次或二十次或更多次施用。
在一些实施方案中,可以根据需要施用(例如,只要与疾病、病症或病状相关的症状持续)。在一些实施方案中,可指示在受试者的剩余生命中重复施用。治疗期可以变化并且可以是例如一天、两天、三天、一周、两周、一个月、两个月、三个月、六个月、一年或更久。
可以例如通过测定疾病进展、疾病缓解、症状严重程度、疼痛减轻、生活质量、维持治疗效果所需的药物剂量、疾病标记的水平或适合于待治疗或靶向预防的给定疾病的任何其他可测量参数来评估疾病的治疗或预防的功效。通过测量这些参数中的任何一个或参数的任何组合来监测治疗或预防的功效在本领域技术人员的能力范围内。如本文所讨论,待测量的具体参数取决于受试者所患的自身免疫性疾病或FOXP3相关疾病。
在后读数与初始读数的比较为医生提供了治疗是否有效的指示。通过测量这些参数中的任何一个或参数的任何组合来监测治疗或预防的功效在本领域技术人员的能力范围内。与试剂或组合物的施用相关,“有效对抗”自身免疫性疾病或FOXP3相关病症是指以临床上合适的方式施用对具有统计学意义的至少一部分患者产生有益的效果,例如症状的改善、治愈、疾病的减少、生命的延长、生活质量的改善或通常被熟悉FOXP3相关病症的治疗的医生认为是积极的其他效果。
当疾病状态的一个或多个参数存在统计学上显著的改善,或没有恶化或发展预期的症状时,治疗或预防效果是明显的。例如,疾病的可测量参数的至少10%、优选至少20%、30%、40%、50%或更多的有利变化可表明有效治疗。还可以使用本领域已知的给定疾病的实验动物模型来判断给定试剂或组合物的功效。当使用实验动物模型时,治疗的功效在观察到标记或症状的统计学显著的减少时被证实。
或者,可通过由诊断领域内技术人员基于临床上接受的疾病严重程度分级表确定的疾病严重程度的降低来测量功效。导致例如使用适当分级表确定的疾病严重程度的减轻的任何积极变化表示使用本文所述的试剂或组合物进行的适当治疗。
如本文所用,术语“治疗(treating)”或“处理(treatment)”是指有益的或期望的结果,包括但不限于减轻或缓解与自身免疫性疾病相关的一种或多种体征或症状或降低FOXP3基因表达或FOXP3蛋白产生。“治疗”还可以指相比于未治疗时的预期存活期,存活期延长。
D.组合方法
本发明还提供激活Treg细胞的组合方法。在某些实施方案中,通过FOXP3激活的Treg的体外或离体分化或激活可与TGFβ的刺激组合,例如通过将TGFβ包含在如本文所述的体外或离体培养细胞时使用的生长培养基中。TGFβ是T细胞分化中的重要生长因子并且已知用于触发FOXP3激活。
接下来通过以下实施例描述本发明。但是,在说明书中任何地方使用这些和其他实施例仅是说明性的,而不以任何形式限制本发明或任何示例形式的范围和含义。本发明不限于这里描述的任何特定的优选实施方案。本发明的许多修改和变化对于本领域技术人员是显而易见的,并且可以在不脱离其精神和范围的情况下做出。本申请全文(包括附图)引用的所有参考文献、专利和公开的专利申请的内容通过引用并入本文。
实施例
实施例1.Jurkat细胞中的FOXP3激活
此实施例描述了在Jurkat细胞中使用位点特异性FOXP3破坏剂的FOXP3表达的激活,如通过FOXP3 mRNA水平和蛋白质水平的提高所测量的,所述位点特异性FOXP3破坏剂包含靶向FOXP3表达控制区的位点特异性FOXP3靶向部分(即sgRNA)和包含dCas9、dCas9和p300或dCas9和VPR的效应物。
为了理解本发明的激活剂对FOXP3基因表达的影响,根据制造商的建议,用dCas9-或dCas9-p300-或dCas9-VPR-编码mRNA与靶向转录起始位点(TSS)周围和上游的不同区域的sgRNA和Lipofectamine Messeger Max一起转染Jurkat细胞(人白血病T细胞系)。使用三个指导RNA的混合物,并发现一个混合物与p300(9倍)和VPR(100倍)一起激活FOXP3 mRNA(图1A)。发现sgRNA的混合物与VPR蛋白组合诱导FOXP3蛋白产生。当用sgRNA(混合物2)和编码dCas9-VPR的mRNA的组合处理后通过FACS分析时,百分之八(8%)的细胞变成FOXP3阳性(图1B)。
当使用指导物混合物或单个指导物时,可以实现VPR激活反应。不希望受理论束缚,据信在该实验中观察到的激活是多个效应物/激活剂将更多的激活机器募集到靶位点的结果(图2)。实施例1和2中使用的指导混合物总结于表2中。
实施例2.天然T细胞中的FOXP3激活
此实施例描述了在天然T细胞中使用位点特异性FOXP3破坏剂的FOXP3表达的激活,如通过FOXP3 mRNA水平和蛋白质水平的提高所测量的,所述位点特异性FOXP3破坏剂包含靶向FOXP3表达控制区的位点特异性FOXP3靶向部分(即sgRNA)和包含dCas9、dCas9和p300或dCas9和VPR的效应物。
对于天然T细胞中的激活,使用制造商推荐的电穿孔设置,用MaxCyte Atx的电穿孔转染与上文详述的Jurkat实验中优化的相同的mRNA和3种sgRNA指导物组合(混合物2),以比较单独的dCas9和dCas9-p300或dCas9-VPR激活剂融合物的作用。如在Jurkat细胞中那样,发现VPR在FOXP3 mRNA表达方面引起最大反应(与单独的dCas9相比高达600倍),如通过qPCR所测定的;其中10%至14%的细胞被测定为FOXP3
表2:位点特异性FOXP3靶向部分一以下每个部分中的前20个核苷酸包含所述部分的靶向部分。
/>
表3:位点特异性FOXP3靶向部分一实施例1和2中使用的FOXP3指导物的核苷酸序列和基因组中的互补靶序列
注:
*:所有单指导物长度均为100个核苷酸。所示的20mer靶区域是具有用于dCas9结合的以下80nt序列的SpCas9 PAM单指导RNA的一部分:5’-GTTTTAGAGCTAGAAATAGCAAGTTAAAATAAGGCTAGTCCGTTATCAACTTGAAAAAGTGGCACCGAGTCGGTGCTTTT-3’(SEQ ID NO:132)。
#:混合物编号与图1A和1B中的那些相同。
**:混合物2在Jurkat细胞中强烈地诱导上调反应,并成功地用于激活天然T细胞中的FOXP3。
表4:位点特异性FOXP3靶向部分
/>
表5.用于核酸序列表示中的核苷酸单体的缩写。应当理解,当这些单体存在于寡核苷酸中时,它们通过5’-3’-磷酸二酯键相互连接。
/>
/>
- 一种太赫兹倍频链路、发射设备及直接调制通信系统
- 一种太赫兹调制单元、太赫兹调制器及雷达发射系统
