一种靶向TROP2和CD3的双特异性抗体及其制备方法与应用
文献发布时间:2024-05-31 01:29:11
技术领域
本发明涉及基因工程抗体技术领域,尤其涉及一种靶向TROP2 和CD3的双特异性抗体及其制备方法与应用。
背景技术
抗体药物是以细胞工程技术和基因工程技术为主体的抗体工程技术制备的生物大分子药物,具有特异性高、性质均一、可针对特定靶点定向制备等优点。单克隆抗体在临床上主要应用于以下三个方面:肿瘤治疗、免疫性疾病治疗以及抗感染治疗。其中,肿瘤治疗是目前单克隆抗体应用最为广泛的领域,目前已经进入临床试验和上市的单克隆抗体产品中,用于肿瘤治疗的产品数量占比大概为50%。单克隆抗体治疗肿瘤是一种针对病变细胞特异靶点刺激免疫系统杀伤靶细胞的免疫疗法,为了增强抗体的效应功能,特别是提高杀伤肿瘤细胞的效果,人们尝试多种方法改造抗体分子。
获取特异性抗体的方法有多种。传统的杂交瘤技术通过免疫小鼠或大鼠,将其脾脏细胞与骨髓瘤细胞融合,然后进行稀释(至一个细胞每孔)培养,用酶联免疫法(ELISA)检测杂交瘤细胞上清与免疫抗原的结合,进而筛选可分泌与抗原特异性结合抗体的单克隆细胞株。这种鼠源抗体如果应用于临床药物研发,则需要通过杂合抗体技术(chimerization)、人源化技术(humanization)等基因工程手段进行去免疫原性改造。为了从起始阶段就消除未来临床必须解决的免疫原性问题,转基因鼠技术(transgenic mouse)通过替换鼠源抗体可变区为人源抗体可变区,使得获得的单克隆抗体的可变区序列主体上就是人源的,然后再进一步替换恒定区就可以获得全人源单克隆抗体。另外一个技术就是噬菌体表面呈现(phage display)技术。噬菌体表面呈现技术是在试管中构建工程抗体,一般是单链抗体或Fab形式。但是组成工程抗体的基因片段来源于人免疫细胞的基因库,所以获得的抗体是全人源的。已有多个噬菌体技术获得的抗体进入临床研究或获得批准,用于各个方面的疾病治疗。
在单克隆抗体的基础上,为了进一步提高药效和减少毒副作用,以单克隆抗体为基础的新抗体药物,包括药物偶联抗体(Antibody drug conjugate,ADC),双特异性抗体(bispecific antibody,bsAb)以及CAR-T(chimeric antigen receptor T cells)等新型蛋白和细胞药物的发展极为迅速。其中,基于双特异性构建的细胞桥(cell-bridging)双抗,由于具有连接免疫T细胞和癌靶细胞的能力,显著提高了杀伤活性和特异性,具有突破性的临床价值,受到了较多的关注。
双特异性抗体可通过多种途径获得,其制备方法主要有:化学偶联法、杂交-杂交瘤法和基因工程抗体制备法。化学偶联法是将2个不同的单克隆抗体用化学偶联的方式连接在一起,制备的双特异性单克隆抗体,这是最早的双特异性单克隆抗体。杂交-杂交瘤法是通过细胞杂交法或者三元杂交瘤的方式产生双特异性单克隆抗体,这些细胞杂交瘤或者三元杂交瘤是通过建成的杂交瘤融合,或者建立的杂交瘤和从小鼠的淋巴细胞融合而得到的,只能用于生产鼠源的双特异性抗体,因此,其应用受到了极大的限制。而随着分子生物学技术的迅速发展,出现了基因工程人源化或全人源的双特异性抗体的多种构建模式,主要包括双特异性微抗体、双链抗体、单链双价抗体、多价双特异性抗体四类。目前,国际上已有数种基因工程双特异性抗体药物进入临床试验阶段,并显示有较好的应用前景。
滋养层细胞表面抗原2(TROP2)是由TACSTD2基因编码表达的细胞表面糖蛋白,又名肿瘤相关钙离子信号转导子2(TACSTD2)、表皮糖蛋白1(EGP-1)、胃肠肿瘤相关抗原(GA733-1)、表面标志物 1(M1S1),最早于人胎盘滋养层鉴定到的细胞表面糖蛋白,后来被发现高度表达于大部分人的实体肿瘤癌细胞中,且仅受限或有限地表达于正常人组织。TROP2属于GA733蛋白家族,与上皮细胞黏附分子 (EpCAM,又称TROP1、TACSTD1)有较高结构序列相似性,同源性达49%。TROP2由323个氨基酸构成,其中信号肽含26个氨基酸,胞外区248个氨基酸,跨膜区23个氨基酸,胞质区26个氨基酸,其结构示意图如图1的A所示。TROP2主要通过调节钙离子信号通路、细胞周期蛋白表达及降低纤黏蛋白黏附作用促进肿瘤细胞生长、增殖和转移。TROP2也可以与Wnt信号级联中的β-连环蛋白相互作用,因而对细胞核癌基因的转录及细胞的增殖起作用。大量临床研究和文献报道表明,TROP2在乳腺癌、胰腺癌、胆囊癌、结肠癌、胃癌、非小细胞肺癌、前列腺癌、子宫癌和口腔鳞癌等上皮癌中过表达,而在成年人正常组织中很少表达或不表达;TROP2在肿瘤组织中的过表达与患者的预后不良和癌细胞的转移密切相关,同时影响患者的总生存率。因此,TROP2已成为肿瘤分子靶向治疗中引人注目的靶标。
TROP2是一种跨膜蛋白,其细胞外结构域在多种肿瘤细胞上分布广泛,因此成为了靶向治疗的天然候选。TROP2的组织表达局限性使得治疗的毒性降低,这也是靶向TROP2治疗的优势所在。以 TROP2为靶点的抗体、抗体偶联物以及联合用药等多种形式的药物正处于研发中。抗TROP2抗体与其他化疗药物偶联的效用已在各种临床前研究中得到证实。用于治疗TROP2过表达的上皮恶性肿瘤的抗体偶联药物(ADC)IMMU-132已获FDA批准上市(2020年4月)。新型抗体偶联药物Sacituzumab govitecan(IMMU-132)是以TROP2 为靶点,利用人源化抗体hRS7作为靶向载体与伊立替康活性代谢产物SN38偶联而成,可用于治疗多种上皮恶性肿瘤如乳腺癌(三阴乳腺癌)、卵巢癌、小细胞肺癌等。此外,其他人源化的抗TROP2IgG-SN-38偶联物,如抗TROP2 hRS7-CL2A-SN-38抗体偶联药物,已被证明在多种肿瘤细胞系(Calu-3、Capan-1、BxPC-3和COLO-205) 的异种移植模型中具有显著的特异性抗癌作用。综上所述,开发一种抗TROP2的特异抗体,尤其是具备良好的TROP2抗原结合性的完全人源化抗TROP2抗体具有重要意义。
T细胞表面的CD3分子由4个亚基δ、ε、γ、ζ组成,其分子质量分别为18.9kDa,23.1kDa,20.5kDa和18.7kDa,其长度分别为171、207、182、164个氨基酸残基,其共同组成6条肽链,常与 T细胞受体(T cell receptor,TCR)紧密结合形成含有8条肽链的 TCR-CD3复合体,其结构示意图见图1的B。该复合体具有T细胞活化、信号转导以及稳定TCR结构的功能。CD3胞质段含有免疫受体酪氨酸活化基序(immunoreceptor tyrosine-basedactivation motif, ITAM),TCR识别并结合由MHC(major histo-compatibility complex)分子提呈的抗原肽,导致CD3的ITAM的保守序列中的酪氨酸残基被T细胞内的酪氨酸蛋白激酶p56lck磷酸化,然后募集其它含有SH2 (Scr homology 2)结构域的酪氨酸蛋白激酶(如ZAP-70)。ITAM的磷酸化以及与ZAP-70的结合是T细胞活化信号传导过程早期阶段的重要生化反应之一。因此,CD3分子的功能是转导TCR识别抗原所产生的活化信号。基于CD3的功能,开发一种可用于免疫治疗的、同时结合TROP2和CD3的双特异性抗体具有重要意义。
发明内容
本发明提供一种靶向TROP2和CD3的双特异性抗体及其制备方法与应用,用以解决现有技术中缺少具备良好的TROP2抗原结合性的完全人源化抗TROP2抗体的缺陷。
具体地,本发明提供以下技术方案:
本发明提供一种TROP2抗体,其包括重链可变区和轻链可变区,所述重链可变区具有SEQ ID NO.2所示的氨基酸序列;
轻链可变区具有SEQ ID NO.1所示的氨基酸序列。以上抗体为具有更高的TROP2结合亲和力的TROP2抗体。
本发明提供的抗体可变区氨基酸序列模式为FR1-CDR1-FR2- CDR2-FR3-CDR3-FR4。在本申请中,FR(框架区)和CDR(高变区)的区域划分基于Kabat命名系统。在此,FR1~4代表4个框架区域,CDR1~3代表3个高变区。FR1~4可以是从恒定区序列分离而来(比如人免疫球蛋白轻重链类、亚类或亚家族最常用的氨基酸),也可以是从单独的人抗体框架区分离而来或从不同的框架区基因组合而来。
可选的,以上所述的TROP2抗体的重链的Fc片段为人或人源化抗体的Fc片段,所述人或人源化抗体为IgG1、IgG2、IgA、IgE、IgM、 IgG4或IgD。
优选地,TROP2抗体的重链、轻链与前述序列相比具有满足以下二者中至少一个:a)结合相同抗原表位;b)序列同一性大于70%、 80%、85%、90%、97%、98%或99%的氨基酸序列。
本发明提供的人源抗人TROP2抗体以4.35nM-7.5nM的亲和力结合于人TROP2。该抗体结合于表达TROP2的细胞,所述的细胞可以为人上皮恶性肿瘤(胃癌、宫颈癌、乳腺癌、肺癌、前列腺癌、结肠癌、食道癌、胰癌、头颈癌、卵巢癌、子宫内粘膜浆液性乳头癌等肿瘤)细胞。
本发明还提供含有以上所述的TROP2抗体的单链抗体、Fab抗体、微型抗体、嵌合抗体、全抗体免疫球蛋白IgG1、IgG2、IgA、IgE、 IgM、IgG4或IgD、双特异性抗体、多特异性抗体。
本发明还提供抗人CD3单链抗体,18F5-A scFv(氨基酸序列如SEQ ID NO.3所示)、18F5-B scFv(氨基酸序列如SEQ ID NO.4所示)、 18F5-C scFv(氨基酸序列如SEQ ID NO.5所示)、18F5-D scFv(氨基酸序列如SEQ ID NO.6所示)。
本发明提供结合TROP2和CD3的双特异性抗体或其活性片段,其包括:具有SEQ IDNO.7,SEQ ID NO.8,SEQ ID N SEQ ID NO.9, SEQ ID NO.10,SEQ ID NO.11所示的氨基酸序列。
优选的,所述双特异性抗体包括第一结构域,结合人滋养层细胞表面抗原2(TROP2),以及,第二结构域,结合人T细胞表面抗原 CD3,其中,第一结构域包括重链可变区和轻链可变区,重链可变区和轻链可变区为如以上所述的TROP2抗体的重链可变区和轻链可变区。
优选地,所述双特异性抗体的第一结构域为2个通过二硫键连接的完整的轻链-重链对,其重链和轻链的氨基酸序列为以上所述的 TROP2抗体的重链和轻链的氨基酸序列。
本发明的双特异性抗体优选设计为以下结构:第一结构域包含2 个完整的轻链-重链对,第二结构域包含2个单链抗体,通过如下任意一种方式连接而成的对称结构:
(1)所述第二结构域的2个单链抗体的N端分别通过连接肽与所述第一结构域的第一恒定区(CH1)的C端连接;
(2)所述第二结构域的2个单链抗体的C端分别通过连接肽与所述第一结构域的2条铰链区(hinge)的N端连接;
本发明发现,针对上述第一结构域和第二结构域的序列,具有上述对称结构的双特异性抗体与其它结构的双特异性抗体相比,能够更好地保留第一结构域和第二结构域的原抗体的特异性抗原结合能力,同时具有优异的结合TROP2和CD3的生物学功能,在生产工艺和药用性能等方面具有明显优势。本发明开发了具有上述抗体分子结构的结合TROP2和CD3的双特异性抗体,该双特异性抗体具有特异性的靶向作用,并能够高效激发具有导向性的免疫反应,杀伤肿瘤细胞。
优选地,用于第一结构域和第二结构域连接的连接肽的氨基酸序列为(GGGGX)n,其中,X为Gly或Ser,n为1-4的自然数。
作为具有上述结构的双特异性抗体的示例,在上述TROP2抗体和CD3抗体的基础上,本发明构建了同时结合TROP2和CD3的双特异性抗体,
在本发明的优选实施例中,所述双特异性抗体重链的氨基酸序列为YT03-A-HC(SEQ ID NO.7)、YT03-B-HC(SEQ ID NO.9)、 YT03-C-HC(SEQ ID NO.10)、YT03-D-HC(SEQID NO.11)中的任一项。
和/或,所述双特异性抗体轻链的氨基酸序列如SEQ ID NO.8所示。
以上所公开和要求保护的SEQ ID NO.1-11所示序列包括“保守序列修饰”,即不明显影响和改变所述抗体或含有所述氨基酸序列抗体的结合特征的核苷酸和氨基酸序列修饰。所述保守序列修饰包括核苷酸或氨基酸替换、添加或缺失。可以通过本领域的标准技术,如定点诱变和PCR介导的诱变等将修饰导入SEQ ID NO.1-11中,保守氨基酸替换包括氨基酸残基被具有相似侧链的氨基酸残基或其他氨基酸残基代替。本领域中,已经定义了具有相似侧链的氨基酸残基的家族。这些家族包括具有碱性侧链的氨基酸(如赖氨酸、精氨酸、组氨酸),具有酸性侧链的氨基酸(如天冬氨酸、谷氨酸),具有不带电的极性侧链的氨基酸(如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸),具有非极性侧链的氨基酸(如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸),具有β分支侧链的氨基酸(如苏氨酸、缬氨酸、异亮氨酸)和具有芳香侧链的氨基酸(如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,优选用来自于同一侧链家族的另一种氨基酸残基代替人抗TROP2抗体中的非必须氨基酸残基。
因此,以上公开的具有所述氨基酸序列的抗体和/或含有以上公开的氨基酸序列的抗体包括基本上由经保守序列修饰的相似序列编码的,或含有经保守序列修饰的相似序列的抗体,均应视为本发明的范畴。
本发明还提供编码所述TROP2抗体的核酸分子以及编码所述结合TROP2和CD3的双特异性抗体或其活性片段的核酸分子。
考虑到密码子的简并性,编码本发明所述抗体的基因可在其编码区,在不改变氨基酸序列的条件下,对编码上述抗体的基因序列进行修改,获得编码相同抗体的基因。本领域技术人员可以根据表达抗体宿主的密码子偏爱性,人工合成改造基因,以提高抗体的表达效率。
本发明还提供含有所述核酸分子的生物材料,所述生物材料包括重组DNA、表达盒、载体、宿主细胞、工程菌或细胞系。
其中,所述载体包括但不限于克隆载体、表达载体,可为质粒载体、病毒载体、转座子等载体。
所述宿主细胞或细胞系可以为来源于微生物或动物的细胞或细胞系。
本发明还提供所述TROP2抗体、所述的抗人CD3单链抗体、或所述结合TROP2和CD3的双特异性抗体的制备方法,其包括:将编码所述抗体的核酸导入宿主细胞中,获得稳定表达所述双特异性抗体的宿主细胞;培养宿主细胞,经分离纯化获得所述抗体。
在制备所述TROP2抗体或、所述的抗人CD3单链抗体、所述结合TROP2和CD3的双特异性抗体时,本领域技术人员可根据需要选择本领域常规的宿主细胞、表达载体、将表达载体导入宿主细胞的方法以及抗体的分离纯化方法。
基于本发明提供的TROP2抗体、所述的抗人CD3单链抗体、以及结合TROP2和CD3的双特异性抗体的功能,本发明提供TROP2 抗体、所述的抗人CD3单链抗体、结合TROP2和CD3的双特异性抗体或其活性片段、编码所述抗体的核酸分子、含有所述核酸分子的生物材料的如下任一种应用:
(1)在制备用于诊断、预防或治疗TROP2表达的相关疾病的药物中的应用;
(2)在制备用于诊断、预防或治疗以TROP2为靶标的疾病的药物中的应用;
(3)在制备用于杀伤TROP2表达的细胞的药物中的应用;
(4)在制备TROP2和/或CD3的检测试剂中的应用;
(5)在制备适用于CAR-T疗法的相关试剂中的应用;
(6)在制备免疫毒素或标记抗体中的应用。
以上所述的TROP2表达的相关疾病优选为高表达/过度表达 TROP2的肿瘤,特别是表达TROP2的上皮恶性肿瘤(包括但不限于胃癌、宫颈癌、乳腺癌、肺癌、前列腺癌、结肠癌、食道癌、胰癌、头颈癌、卵巢癌、子宫内粘膜浆液性乳头癌等肿瘤)。
优选地,所述药物为抗肿瘤药物。
以上所述的标记抗体可为放射性同位素标记抗体。
本发明提供的双特异性抗体本身可用于治疗和诊断。抗体可以被标记、交联或偶联及与其他蛋白或多肽分子融合表达形成复合物(如细胞毒性物质、放射性毒素和/或化学分子等)用于诊断和治疗。
本发明提供包含所述TROP2抗体、所述抗人CD3单链抗体、或所述结合TROP2和CD3的双特异性抗体的多特异性抗体、融合蛋白、免疫毒素、药物或检测试剂。
以上所述的免疫毒素包含以各种形式连接于细胞毒性剂的 TROP2抗体或双特异性抗体。
所述的各种连接形式为抗体被标记、体外交联或分子偶联。所述细胞毒性剂包括化学分子、放射性同位素、多肽、毒素及其他对细胞具有杀伤或诱导细胞死亡特性的物质。
以上所述的融合蛋白,包含本发明提供的上述TROP2抗体或双特异性抗体以及具有某种功能的其他蛋白或多肽分子的复合物。
具体地,所述的融合蛋白可为将抗体基因与免疫毒素或细胞因子基因连接构建重组表达载体,通过哺乳动物细胞或其他表达系统获得重组融合蛋白分子。
以上所述的所述药物、检测试剂还可包含药学领域和检测试剂领域允许的其它有效成分或辅料(例如:抗体的组分和药理学上可接受的递送分子或溶液。其中,治疗用组分为无菌,可低温冻干)。
本发明提供的抗TROP2的抗体及其双特异性抗体,能够抑制 TROP2所诱导的一种或多种生物学活性。这些抗体通过与TROP2结合后复合物被内化从而消耗细胞表面的TROP2而发挥作用。TROP2 拮抗剂所具有的所有干扰功能均应平等地视为本发明的目的。
本发明的有益效果在于:
本发明利用基因工程和抗体工程方法构建包含单链抗体和完整单克隆抗体结构的结合TROP2和CD3的双特异性抗体,该双特异性抗体融合蛋白保留了完整的单克隆抗体结构,而且具有高度稳定的对称结构,更好地保留了抗CD3单链抗体和抗TROP2单克隆抗体的生物学功能,实现了一个双特异性抗体分子同时具有优异的抗TROP2 和抗CD3两个单克隆抗体的生物学功能,能够在肿瘤细胞和免疫效应细胞之间搭建桥梁,有效激活免疫效应细胞和导向性免疫反应,显著增强了免疫细胞杀伤肿瘤细胞的功效,同时最大程度地降低了ADCC效应,具有较高的安全性。此外,本发明提供的双特异性抗体由于具有结构完全对称的特点,在进行宿主表达时,不会产生其它结构的蛋白异构体,从而大大降低了提取和纯化工艺的难度,具有制备简单、产量高的优势,在肿瘤的免疫治疗中具有广阔的应用前景。
本发明的双特异性抗体能够同时结合免疫细胞和肿瘤细胞,导向T免疫反应,特异性有效杀伤肿瘤细胞,可研发为上皮恶性肿瘤的抗体药物。
本发明提供的TROP2和CD3的双特异性抗体同时具有优异的抗 TROP2和抗CD3抗体的生物学功能,能够在肿瘤细胞和免疫效应细胞之间搭建桥梁,有效激活免疫效应细胞和导向性免疫反应,显著增强了免疫细胞杀伤肿瘤细胞的功效,在相关肿瘤的免疫治疗中具有良的应用前景。
附图说明
为了更清楚地说明本发明或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明背景技术中TROP2的蛋白结构及TCR结构示意图,其中,A为TROP2抗原的结构,来源:Goldenberg DM,Stein R,Sharkey RM.The emergence of trophoblastcell-surface antigen 2(TROP-2)as a novel cancer target.Oncotarget.2018Jun 22;9(48):28989-29006.doi: 10.18632/oncotarget.25615.PMID:29989029;PMCID:PMC6034748;B 为T细胞受体(TCR)复合体结构及其中CD3的组成。来源: https://www.researchgate.net/publication/299549376。
图2为本发明实施例1中流式细胞仪(FACS)分析不同乳癌细胞系表达的TROP2与双抗F7AK3的结合。
图3为本发明实施例1Biacore测定F7A对人TROP2抗原的亲和力,其中纵坐标为结合反应单位(RU)。
图4为本发明实施例2FACS分析人源化18F5克隆(hu18F5-A, hu18F5-B,hu18F5-C,hu18F5-D)对人T细胞的结合。
图5为本发明实施例3mFIST双抗示意图。
图6为本发明实施例4SDS-PAGE分析YT03-A,YT03-B,YT03-C, YT03-D,其中,泳道1为YT03-A,泳道2为YT03-B,泳道3为YT03-C,泳道4为YT03-D,泳道5为Marker 11-245kDa。
图7为本发明实施例5YT03系列分子与MDA-MB-468细胞的流式结合。
图8为本发明实施例5YT03系列分子与JurkatE6.1细胞的流式结合。
图9为本发明实施例6YT03系列分子介导human T细胞对靶细胞MDA-MB-468-LP的杀伤曲线。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合本发明中的附图,对本发明中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1抗体F7A结合及功能验证
为了验证获得的TROP2抗体克隆F7A是否结合纯化的TROP2 抗原以及细胞膜表面表达的TROP2,F7A抗体(氨基酸序列如SEQ ID NO.1,SEQ ID NO.2)的IgG重链基因和轻链基因分别被克隆至真核表达载体pcDNA3.1,共转染表达,得到F7AK3双抗形式的蛋白,它可以用Potein-A进行亲和纯化,也可以用(HRP或荧光素)标记抗人Fc抗体进行检测。
获得了F7AK3蛋白后,以流式细胞仪检测了F7AK3对表达 TROP2的细胞系(MCF7,MDA-MB-231,MDA-MB-468及HCC1395) 的结合,证实了F7AK3中的F7A能特异性结合细胞膜表面的TROP2 抗原(见图2)。由此验证了该抗体与人细胞表面抗原TROP2的结合能力。
为测定F7A对人TROP2抗原的亲和力,以Biacore分析了F7A 对人TROP2抗原的Kd值(图3),其值为4.35nM。
实施例2抗CD3单链抗体人源化克隆的结合验证
抗人CD3特异性抗体来自专利WO 2016/116626 Al中描述的克隆18F5。经改造后获得四株亲和力不同的克隆18F5-A(氨基酸序列如SEQ ID NO.3所示),18F5-B(氨基酸序列如SEQ ID NO.4所示), 18F5-C(氨基酸序列如SEQ ID NO.5所示),18F5-D(氨基酸序列如SEQID NO.6所示)。
为了验证获得的CD3抗体克隆18F5-A(氨基酸序列如SEQ ID NO.3所示),18F5-B(氨基酸序列如SEQ ID NO.4所示),18F5-C (氨基酸序列如SEQ ID NO.5所示),18F5-D(氨基酸序列如SEQ ID NO.6所示)是否结合T细胞表面的CD3抗原,18F5-A(氨基酸序列如SEQID NO.3所示),18F5-B(氨基酸序列如SEQ ID NO.4所示), 18F5-C(氨基酸序列如SEQ IDNO.5所示),18F5-D(氨基酸序列如SEQ ID NO.6所示)以单链抗体形式克隆至pcDNA3.1中,与人 Fc基因融合,表达纯化后获得scFv-Fc形式的蛋白。以流式细胞仪检测了这些scFv-Fc对表达CD3的人T的结合,证实了这些人源化改造的克隆18F5-A(氨基酸序列如SEQ ID NO.3所示),18F5-B(氨基酸序列如SEQ ID NO.4所示),18F5-C(氨基酸序列如SEQ ID NO.5 所示),18F5-D(氨基酸序列如SEQ ID NO.6所示)都能特异性结合人T细胞膜(见图4),由此验证了这些单链抗体与人T细胞表面抗原CD3的结合能力。
实施例3 TROP2×CD3双特异性抗体设计
本实施例以肿瘤细胞表面抗原TROP2和免疫细胞表面抗原CD3 作为靶点,设计双特异性抗体。
结合蛋白质结构设计软件和大量的人工实验筛选,本发明在多种结合TROP2和CD3的双特异性抗体结构中筛选确定了包括单链抗体单元和单克隆抗体单元的具有对称结构的双特异性抗体结构。本发明将这种技术平台称之为FIST(fusion of IgG and scFvtechnology)。例如,抗TROP2单克隆抗体单元可以作为IgG抗体,包括2个完整的轻链-重链对(即含有完整的Fab和Fc结构域,重链和轻链之间通过二硫键连接),抗CD3可以作为单链抗体单元,包括2个单链抗体 (ScFv)。单链抗体和单克隆抗体之间采用连接肽连接,对于单链抗体和单克隆抗体的连接方式,可以设计下述连接方式,由此获得对称结构的双特异性抗体,其结构示意图如图5所示的mFIST。
mFIST设计的双抗让两个抗体结合单元具有适中的空间距离,同时具有对称型结构,而且两个结合单元的功能都能得到完全体现。Fc 的效应功能、长半衰期功能赋予了所产生双抗的优异生物学性质和药学性质,是研发双抗药物的最优选择之一。
实施例4 TROP2×CD3双特异性抗体的制备
将F7A抗体基因分别与18F5的四株人源化克隆进行组合,获得根据实施例2中设计中mFIST形式的4种双特异性抗体。它们的编码基因并克隆至表达载体pCEH4及pCELK,共转染表达后得到的4 个双特异性抗体克隆YT03-A(重链氨基酸序列如SEQ ID NO.7所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-B(重链氨基酸序列如 SEQ ID NO.9所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-C (重链氨基酸序列如SEQ ID NO.10所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-D(重链氨基酸序列如SEQ ID NO.11所示,轻链氨基酸序列如SEQ ID NO.8所示)。将这些mFIST双抗表达质粒转染CHO-K1,表达制备双抗蛋白。
为获得高纯度的双特异性抗体,按照以下步骤进行纯化。(1)料液预处理:发酵培养的上清液通过2000rpm离心,10min,然后用 0.22μM滤膜过滤处理。(2)亲和层析:用Mabselect SuRe亲和层析柱(购自GE公司,货号18-5438-02)捕获经过预处理的发酵液中的抗体,用平衡缓冲液(10mM PB,0.1M NaCl,pH7.0)充分平衡层析柱后,过亲和层析柱,用洗脱缓冲液(0.1M柠檬酸酸,pH 3.0)洗脱。 (3)阳离子交换层析:经亲和层析制备的样品,进一步通过分子筛交换层析纯化,缓冲液(50mM PBS,0.2Man Na
将YT03-A(重链氨基酸序列如SEQ ID NO.7所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-B(重链氨基酸序列如SEQ ID NO.9 所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-C(重链氨基酸序列如SEQ ID NO.10所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-D(重链氨基酸序列如SEQ ID NO.11所示,轻链氨基酸序列如 SEQ ID NO.8所示)经表达和纯化成功制备得到了4个双特异性抗体, SDS-PAGE分析如下图(图6);这些双抗蛋白的单体含量如表1所示。
表1.两种不同形式的双抗SDS-PAGE纯度分析
实施例5流式分析法检测双特异性抗体与TROP2细胞及T细胞的结合
为验证YT03系列抗体,包括YT03-A(重链氨基酸序列如SEQ ID NO.7所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-B(重链氨基酸序列如SEQ ID NO.9所示,轻链氨基酸序列如SEQ ID NO.8 所示),YT03-C(重链氨基酸序列如SEQ ID NO.10所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-D(重链氨基酸序列如SEQ ID NO.11所示,轻链氨基酸序列如SEQ ID NO.8所示)对TROP2细胞系及T细胞的结合,以FACS方法分析它们对人T细胞及表达TROP2 的乳癌细胞系的结合。
取乳腺癌细胞系MDA-MB-468、CD3
经FACS检测显示,4个以F7A构建的靶向TROP2的双抗YT03-A (重链氨基酸序列如SEQ ID NO.7所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-B(重链氨基酸序列如SEQID NO.9所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-C(重链氨基酸序列如SEQ IDNO.10所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-D(重链氨基酸序列如SEQ IDNO.11所示,轻链氨基酸序列如SEQ ID NO.8 所示)对靶细胞的结合率及MFI相当,构建的4个分子都与目标靶细胞正常结合。同时,4个双抗分子都能与JurkatE6.1结合,即它们都能与人CD3分子结合。
表2.YT03系列双抗分子与MDA-MB-468细胞的流式结合阳性率与MFI
表3.YT03系列分子与JurkatE6.1细胞的流式结合阳性率与MFI
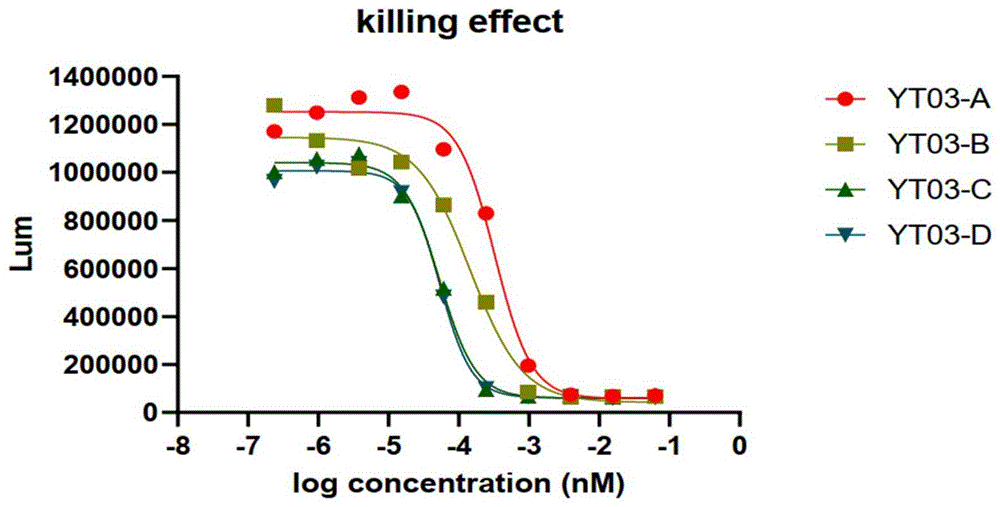
实施例6双特异性抗体介导的体外细胞杀伤效率检测
本实施例分别以MDA-MB-468-lp为靶细胞,用anti-CD3/CD28 beads激活PBMC,得到活化的T细胞作为免疫效应细胞,检测双特异性抗体YT03-A(重链氨基酸序列如SEQ IDNO.7所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-B(重链氨基酸序列如SEQ ID NO.9所示,轻链氨基酸序列如SEQ ID NO.8所示),YT03-C(重链氨基酸序列如SEQ ID NO.10所示,轻链氨基酸序列如SEQ ID NO.8所示), YT03-D(重链氨基酸序列如SEQ ID NO.11所示,轻链氨基酸序列如 SEQ ID NO.8所示)介导的靶细胞的杀伤作用。具体实验步骤如下:
1)靶细胞准备:于T75细胞培养瓶中培养靶细胞,使用0.25%胰酶消化掉细胞,吹匀后计数,1000rpm,离心5min,PBS洗涤一次。靶细胞离心洗涤后用X-VIVO
2)效应细胞准备:以活化后的T细胞为效应细胞。将冻存在液氮罐中的PBMC取出(参考细胞冻存与复苏)解冻,加入含有 X-VIVO
3)抗体稀释:采用X-VIVO
4)检测:通过靶细胞中的luciferase对荧光素酶的催化发光检测效应细胞对靶细胞的杀伤效率。
将过夜培养的细胞吹匀后取出60ul到白色不透明板中,再加入 60ul荧光素酶底物,使用SynergyHT检测luminescence模式下的相对光强(RLU)。
5)数据处理:使用graphpad prism9进行四参数曲线分析得到双抗对靶细胞杀伤的EC
将所有检测孔的靶细胞杀伤比例对应的抗体浓度转变为log10,以此作为横坐标、RLU作为纵坐标制作曲线。YT03-A(重链氨基酸序列如SEQ ID NO.7所示,轻链氨基酸序列如SEQ ID NO.8所示), YT03-B(重链氨基酸序列如SEQ ID NO.9所示,轻链氨基酸序列如 SEQID NO.8所示),YT03-C(重链氨基酸序列如SEQ ID NO.10所示,轻链氨基酸序列如SEQ IDNO.8所示),YT03-D(重链氨基酸序列如SEQ ID NO.11所示,轻链氨基酸序列如SEQ ID NO.8所示) 对敏感细胞株MDA-MB-468-lp的杀伤浓度-梯度曲线如图9所示; YT03不同分子对TROP2
表4.YT03双特异性抗体介导的靶细胞杀伤EC50测定
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 靶向KIF20A阳性胰腺癌双特异性抗体NK细胞及制备方法和应用
- 一种结合TROP2的抗体及靶向TROP2和CD3的双特异性抗体及其制备方法与应用
- 支持VHT私有MCS的方法、装置、电子设备及介质
