靶标检测
文献发布时间:2023-06-19 10:46:31
本申请要求于2018年4月19日提交的美国临时申请第62/660,075号和于2018年7月30日提交的美国临时申请第62/711,784号的权益和优先权,这些美国临时申请中的每一个的内容以全文引用的方式并入本文中。
技术领域
本发明总体上涉及微生物和分子的分析和检测。
背景技术
检测微生物和分子是人类医学、兽医学、农业、工业微生物学和科学研究中的重要应用的基础。传染性疾病诊断是微生物检测发挥核心作用的一个重要的领域。
由一系列病原体引起的传染性疾病是死亡的主要原因。例如,艰难梭菌(C.difficile)居CDC的紧急威胁级别微生物类别之首,其引起比任何其它病原体更致命的医院感染。在美国,艰难梭菌感染(CDI)每年造成估计450,000例感染、29,000例死亡和10-60亿美元的医疗保健费用。艰难梭菌感染引起可能导致伪膜性结肠炎、中毒性巨结肠、多器官衰竭和死亡的严重腹泻。不幸的是,常规的艰难梭菌检测方法缺乏灵敏度和特异性。
艰难梭菌是一种常见的共生革兰氏阳性孢子形成厌氧肠道微生物,在医院患者中的定植率高达50%。大多数受感染的患者都携带有呈其休眠和良性孢子形式的艰难梭菌。由于当其它肠道微生物被抗菌剂清除时肠道代谢物发生变化从而诱发微生物孢子发芽并变得具有毒性,因此服用抗生素的患者感染艰难梭菌的风险更高。毒性产毒艰难梭菌菌株会分泌包含毒素B和毒素A的细胞病变毒素。基于粪便中的毒素水平,可以将无感染的定植患者与患有艰难梭菌感染的患者区分开。患有艰难梭菌感染的患者的毒素B水平高于定植的未感染患者。
快速商业免疫测定可用于检测粪便样品中的艰难梭菌毒素,但临床灵敏度不足以检测所有艰难梭菌感染患者,因为其具有显著高于临床阈值的若干ng/ml的分析灵敏度。基于黄金标准细胞毒性中和测定(CCNA)的更敏感的测试是可商购获得的,但速度慢(需要1-3天才能得到结果)、可能具有主观性并且对于常规临床应用而言过于昂贵。
与目前的快速免疫测定测试相比,核酸扩增测试(NAAT)具有高的临床灵敏度。然而,这些测试检测到艰难梭菌基因组的存在,但不能区分被艰难梭菌孢子良性定植的患者与患有艰难梭菌感染的患者。虽然只有患有严重腹泻的患者才应该测试艰难梭菌感染,但医院中的许多患者由于其它原因(如泻药、药物反应和病毒感染)而出现腹泻。这些患者中有很大一部分被呈良性孢子形式的艰难梭菌定植并且没有活动性感染。因此,来自此类患者的样品产生假阳性结果。因此,虽然具有临床灵敏度,但基于核酸的测定缺乏临床特异性并且阳性预测值相对较差。
从毒素免疫测定转向基于核酸的测定的医院已经发现艰难梭菌感染诊断率增加了50-100%,部分原因是来自定植但未感染患者的假阳性增加。假阳性是有问题的,因为患者可能会接受不必要的抗生素疗法,而抗生素疗法实际上增加了未感染患者引发艰难梭菌感染的风险。假阳性还会增加医院的经济负担。
可用的快速毒素免疫测定的灵敏度相对较低和基于核酸的测试缺乏临床特异性,使得当前市场上没有具有高临床灵敏度和特异性的可区分定植患者与患有活动性艰难梭菌感染的患者的单一CDI诊断测试。
发明内容
本发明提供了需要最少的样品制备的用于检测样品中的微生物和生物标志物的方法和装置。临床医生获得样品并将其直接放入筒中,以检测所需的临床分析物(或靶标)。
本发明的某些实施例涉及用于检测靶标微生物的方法、装置和试剂盒,这些方法、装置和试剂盒可用于快速、灵敏且准确地对样品中的靶标微生物进行计数。在本发明的一方面,提供了一种用于测定样品中的靶标微生物的存在的方法。例如,该靶标微生物可以是艰难梭菌或其组分,并且检测确定受试者是否患有艰难梭菌感染。该方法包含测试来自受试者的粪便样品中是否存在艰难梭菌或其组分,如毒素A或毒素B。例如,本发明的方法的某些实施例对于使用粪便样品的30分钟艰难梭菌毒素B测试,分析灵敏度为45pg/ml的,并且对于使用粪便样品的30分钟艰难梭菌毒素A测试,分析灵敏度为365pg/ml。因此,本发明提供了对靶标微生物的快速、灵敏的检测。
本发明的方法和装置需要最少的样品制备,由此节省与微生物检测和分析相关的时间和成本。例如,当使用粪便样品测试艰难梭菌的毒素A和毒素B时,样品制备仅需要将粪便稀释于测定缓冲液中,然后在添加测定试剂之前将其通过尼龙网过滤器以去除大微粒。与其它测试方法相比,没有洗涤步骤并且取消逐步添加试剂的简单样品制备减少了大量的实践时间、降低了成本并简化了仪器。
本发明的方法涉及对靶标进行检测和计数。靶标是待检测的实体。例如,本发明的方法可用于检测细胞、蛋白质、核酸和碳水化合物。本申请中的实例证明了对所分泌的分子的检测。然而,本发明可用于检测广泛范围的分子和细胞,包含生物标志物、激素、细胞表面蛋白、细胞内蛋白、核酸和完整细胞。
本发明可以通过用靶标结合性光子和磁性标记物标记靶标来对这些靶标进行检测和计数。作为实例,由受试者获得的液体样品在引入到盒或筒中之后进行分析,该盒或筒包含底部具有检测表面的成像孔。该成像孔的底表面涂覆有染料垫试剂,这些染料垫试剂包括密度剂和吸收光的染料。该筒还含有涂覆有结合剂的磁性和荧光粒子,例如与靶标特异性地结合的抗体。当添加液体样品时,该染料垫溶解,从而形成较低密度的不透明水层。这些磁性和荧光粒子以及样品形成上测定层。该靶标与该测定层中的荧光和磁性标记物结合。将该筒放置在磁体上方,该磁体吸引所有磁性粒子通过染料垫层,从而将这些磁性粒子沉积在该成像孔的检测表面上。与磁性粒子和荧光粒子结合的靶标也会沉积在该成像表面上,并且可以进行成像和计数。该染料垫用于将该样品和未结合的荧光标记物与该检测表面光学隔离。这可以大大提高该样品成像时的信噪比水平,由此最小化或消除该用户对样品制备的需要和洗涤步骤。
在一些实例中,该样品是人类粪便样品或来源于人类粪便,并且这些靶标是病原体,如艰难梭菌。示例性靶标包含由艰难梭菌分泌的毒素A和毒素B。在另一个实例中,这些靶标包括致死因子——一种从炭疽杆菌(Bacillus anthracis)中分泌的致死毒素的亚基。本领域技术人员知道在考虑本公开时显而易见的许多另外的靶标。
在一些实施例中,该检测步骤进一步包括对这些靶标进行计数。通过观察来自这些荧光标记的靶标的这些荧光粒子的荧光在检测表面上对所关注的靶标进行检测和计数。该检测步骤包括数字成像。数字成像包括照射这些荧光粒子,并在光电阵列检测器上检测从这些荧光粒子发射的信号。可以使用任何适合的数字成像装置。在某些实施例中,检测不采用大于5×的光学放大率或不采用放大。在一些实施例中,使用该盒或筒来执行该方法的步骤。该筒预装载有荧光粒子和磁性粒子。该筒包含:收容储器,用户将该样品引入到该收容储器中;染料垫和检测表面,该染料垫和该检测表面设置在与混合孔流体连通的成像孔中;以及彼此平行的多个成对的成像孔和混合孔组。该筒还可以包含过滤器,该过滤器从该样品中过滤微粒,如可能阻断该筒内流体流动的大微粒。
本发明的某些方面涉及在该盒中的多个通道中并行执行测定。第一通道包括样品检测。第二通道包括阳性对照。该阳性对照包括对引入已知量的所关注的靶标的阳性对照样品中的靶标进行检测和计数。第三通道包括中和对照。该中和对照包括对引入中和结合剂的中和对照样品中的靶标进行检测和计数,这些中和结合剂隔离所关注的靶标,由此防止对这些靶标进行荧光标记。该方法进一步包括计算来自样品的检测信号与从该中和对照检测到的信号的比率。该方法进一步包括确定该比率是否超过阈值。
在某些实施例中,这些光子标记物可以包括荧光粒子、荧光团、化学发光剂、生物发光剂、共振光散射粒子、光吸收或显色信号传导剂、量子点或上转换磷光体。
在某些实施例中,粒子试剂与结合分子缀合,这些结合分子与所关注的靶标或其组分结合。结合分子的实例包含抗体或其抗原结合片段或适体。在某些实施例中,所关注的靶标是从病原体中分泌的毒素,如从艰难梭菌中分泌的毒素A和毒素B。
本发明的某些方面涉及一种盒或筒。该筒包括收容储器,用户将样品引入到该收容储器中。该筒还可以包括用于将该样品引入到荧光粒子和磁性粒子中的混合孔以及用于对来自该样品的靶标进行检测和计数的成像孔。该成像孔与该混合孔流体连通。在本发明的一些实施例中,该筒进一步包括彼此平行的多个成对的成像孔和样品孔组。该筒进一步包括用于在混合和检测之前从该样品中过滤微粒的过滤器。
该成像孔进一步包括染料垫和检测表面。该染料垫包括密度介质和染料,该密度介质使该样品中的未结合的样品和未结合的荧光粒子远离该检测表面,该染料干扰光从该样品中的未结合的荧光粒子传输。当施加磁场穿过该染料垫时,该磁场将这些磁性粒子牵引穿过该染料垫到该检测表面。在一些实施例中,该染料垫在该筒内的该成像孔中以干燥或冻干状态提供,直到被样品润湿为止。例如,在一些实施例中,该染料垫在该筒中呈干燥形式,并且提供使呈干燥形式的染料垫水合的样品。
在本发明的一些实施例中,该筒进一步包括具有已知量的靶标的阳性对照样品。在一些实例中,该筒包含中和对照样品,该中和对照样品包含该样品和与这些靶标结合以减少复合物形成的游离结合分子。
在某些方面,本发明的方法进一步包括对阳性对照样品中的靶标进行检测和计数,该阳性对照包括已知量的靶标。例如,在某些实施例中,该方法进一步包含用阳性对照样品重复这些步骤,该阳性对照样品包含该样品和已知量的靶标。该方法还可以包含用中和对照样品重复这些步骤,该中和对照样品包含该样品和与这些靶标结合以减少复合物形成的游离结合分子。该方法还可以包含执行阳性对照和中和对照两者。该方法可以包含确定从该样品计数的靶标是否超过从该中和对照样品计数的靶标的阈值。该方法可以包含确定从该样品计数的靶标与从该中和对照样品计数的靶标的比率是否超过阈值。该方法还可以包含确定从该阳性对照样品计数的靶标是否超过阈值。
在一些实施例中,本发明的方法以可以使得能够检测小分子靶标的竞争性形式进行。在此类实例中,这些磁性粒子和荧光粒子彼此结合以形成复合物,并且这些靶标与这些磁性粒子或荧光粒子中的一种结合,以减少所形成的复合物的数量。
在某些方面,本发明提供了一种试剂盒,该试剂盒包含荧光粒子、磁性粒子和液体密度试剂或干燥密度试剂。这些荧光粒子和磁性粒子与样品中的所关注的靶标结合,以形成这些靶标的复合物。该试剂盒还可以被调配成用于竞争性测定,其中这些荧光粒子和磁性粒子彼此结合以形成复合物,并且这些靶标与这些荧光粒子或磁性粒子结合,以减少所形成粒子的复合物的数量。该试剂盒可以进一步包含游离结合剂和/或已知量的靶标。该试剂盒可以进一步包含具有检测表面的筒、多个筒或具有多个孔以允许执行对照测试的筒。在某些实施例中,该液体密度试剂或干燥密度试剂储存在该筒中。该试剂盒可以进一步包含安置在该液体密度试剂或干燥密度试剂中的染料或染料垫。在某些实施例中,该染料干扰光到或从这些荧光粒子的传输。在某些实施例中,这些光子标记物包含荧光粒子、荧光团、化学发光剂、生物发光剂、共振光散射粒子、光吸收或显色信号传导剂、量子点或上转换磷光体。在其它实施例中,这些荧光粒子和磁性粒子与结合分子缀合,这些结合分子与所关注的靶标或其组分独立地结合。结合分子的实例包含抗体或其抗原结合片段或适体。靶标的示例性组分是分泌组分,如艰难梭菌毒素A或毒素B。
附图说明
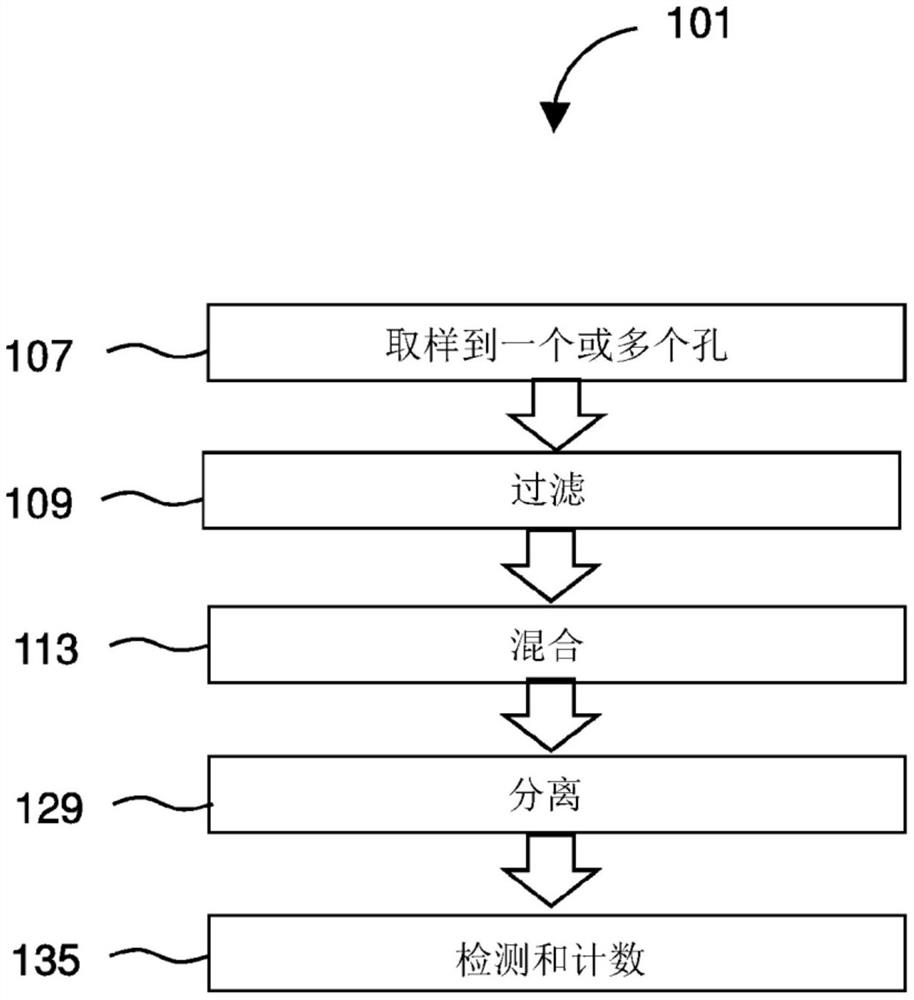
图1是本发明的方法的示例性实施例的流程图。
图2示出了本发明的方法的示例性实施例。
图3示出了根据本发明的筒的示例性实施例。
图4示出了用于本发明的仪器的示例性实施例。
图5示出了本发明的示意性表示。
图6示出了艰难梭菌毒素B测试的非放大图像,其示出已被毒素B分子栓系到磁性粒子的单独显微荧光粒子,这些显微荧光粒子通过染料垫被吸引并沉积在检测表面上。
图7是描绘测定器皿中的染料和垫如何消除对洗涤步骤的需要的图。
图8示出了含有覆盖具有或不具有染料的垫层的未结合粒子的孔的图像,其证明染料和垫从未结合的荧光粒子中消除背景的有效性。
图9描绘了艰难梭菌毒素B测试的分析灵敏度。
图10描绘了艰难梭菌毒素B测试的测定精度曲线。
图11描绘了艰难梭菌毒素B测试的剂量反应和动态范围。
图12是在使用临床样品的艰难梭菌毒素B测试中被称为阳性的阈值的图形表示。
图13描绘了使用临床样品的艰难梭菌毒素B测试的结果。
图14示出了毒素A性能(FoD)。
图15示出了针对磁性粒子和荧光粒子的抗体对的毒素A临床样品测试。
图16示出了针对磁性粒子和荧光粒子的抗体对的毒素A临床样品测试。
图17示出了将板用于使用毒素A的新鲜临床样品的数据的图。
图18示出了将板用于使用毒素B的新鲜临床样品的数据的图。
图19-21示出了用于检测艰难梭菌毒素B的技术。
图22示出了用于检测艰难梭菌毒素B的平台工作流程。
图23-25示出了检测艰难梭菌毒素B的分析结果。
图26示出了检测炭疽杆菌毒素致死因子的测定概述。
图27示出了用于检测炭疽杆菌毒素致死因子的工作流程。
图28示出了检测炭疽杆菌毒素致死因子的结果。
图29示出了用于检测炭疽杆菌毒素致死因子的未经掺加的样品和经过掺加的样品的群体的信号分布。
图30示出了检测炭疽杆菌毒素致死因子的结果动态范围结果。
图31示出了在没有样品制备或洗涤步骤的情况下检测靶标。
图32示出了炭疽测试的分析性能。
图33示出炭疽测试的实例1。
图34示出炭疽测试的实例2。
图35示出了对实例2的NHP吸入炭疽样品的测试。
图36示出了筒中的AST工作流程。
图37示出了传统FISH与多路径FISH的比较。
图38示出了UTI ID测试:微量滴定板研究。
图39示出了对UTI病原体的高分析灵敏度。
图40示出了UTI AST测试:微量滴定板研究。
图41示出了UTI AST准确度。
图42示出了针对不同接种物水平的多路径快速AST稳健性。
图43示出了多种微生物样品对快速AST结果的影响。
图44示出了来自UTI ID/AST的结果。
图45示出了选项1 UTI ID/AST概要。
图46示出了FISH探针包容性。
图47示出了FISH探针排外性。
图48示出了示例平台筒。
具体实施方式
本发明的方法和装置通过简单的光学设备、最少的样品制备和快速的周转时间列举了单独靶标。本发明可以超灵敏地检测复杂样品中的信息靶标。例如,其可以直接在最小限度处理的粪便样品中检测低水平的致病性艰难梭菌毒素。作为另一个实例,本发明的方法和装置可以用于检测引起炭疽的低浓度毒素。
使用本发明的方法进行的艰难梭菌毒素B的测定证明了与CCNA参考方法相当的性能,该参考方法对毒素B高度敏感并且用于对艰难梭菌毒素测试的监管审批。发现粪便样品中30分钟艰难梭菌毒素B测试的分析灵敏度较高(例如,45pg/ml),并且发现粪便样品中30分钟艰难梭菌毒素A测试的分析灵敏度为365pg/ml。而且,经测试的临床样品的准确度与细胞毒性测定(一种灵敏的参考方法)的准确度相当。
本发明的方法和装置需要最少的样品制备,由此节省与微生物检测和分析相关的时间和成本。染料垫的使用允许以最少的样品处理进行检测,因为适当的垫将样品和未结合的荧光粒子与检测表面光学隔离。具体地,本发明的方法的制备仅涉及将粪便稀释于测定缓冲液中,并且在添加测定试剂之前使其穿过尼龙网过滤器以去除大微粒。与其它测试方法相比,没有洗涤步骤并且取消逐步添加试剂的简单样品制备减少了大量的实践时间、降低了成本并简化了仪器。
图1图示了用于检测靶标的方法101。方法101优选地包含获得疑似含有所关注的靶标的样品,如来自患有感染的患者的粪便样品。可以将样品递送107到收集管、孔、储器或筒中以根据本文中的步骤进行处理。例如,患者可以使用采集杯采集粪便样品并将其递送给临床医生。样品可以被冷冻。临床医生可以使用一次性移液管(如1mL塑料刻度移液管)将样品的一部分转移107到测试装置或筒的收容储器中。该方法可以进一步包含过滤109样品,因为粪便样品具有微粒的潜在性高。为了鉴定或检测样品中靶标的存在,方法101包含将样品与仅与特定靶标结合的荧光粒子和磁性粒子混合113。例如,荧光粒子和磁性粒子可以与独立地与选自细胞、蛋白质、核酸、碳水化合物和糖的靶标结合的分子缀合。在一个实例中,靶标包括艰难梭菌的毒素A和毒素B中的至少一种。在一个实例中,这些靶标包括致死因子——一种从炭疽杆菌中分泌的致死毒素的亚基。方法101进一步包含从样品中分离129结合的和未结合的磁性粒子。与靶标结合的磁性粒子与样品的剩余部分分离。与磁性粒子结合的靶标也将与荧光粒子结合。因此,如果存在靶标,则靶标将与磁性粒子和荧光粒子结合,并与样品的剩余部分分离。方法进一步包含通过观察来自与靶标结合的荧光粒子的荧光来对靶标进行检测135和计数。
图2示出了根据本发明的方法。方法通过用靶标结合性光子和磁性标记物标记靶标来对这些靶标进行检测和计数。作为实例,由受试者获得的液体样品在引入到盒或筒中之后进行分析,该盒或筒包含底部具有检测表面的成像孔。该成像孔的底表面涂覆有染料垫试剂,这些染料垫试剂包括密度剂和吸收光的染料。该筒还含有涂覆有结合剂的磁性和荧光粒子,例如与靶标特异性地结合的抗体。当添加液体样品时,该染料垫溶解,从而形成较低密度的不透明水层。这些磁性和荧光粒子以及样品形成上测定层。该靶标与该测定层中的荧光和磁性标记物结合。将该筒放置在磁体上方,该磁体吸引所有磁性粒子通过染料垫层,从而将这些磁性粒子沉积在该成像孔的检测表面上。与磁性粒子和荧光粒子结合的靶标也会沉积在该成像表面上,并且可以进行成像和计数。该染料垫用于将该样品和未结合的荧光标记物与该检测表面光学隔离。这可以大大提高该样品成像时的信噪比水平,由此最小化或消除该用户对样品制备的需要和洗涤步骤。
图2示出了通过使用所施加的磁场牵引靶标穿过密度梯度介质将磁性粒子结合靶标与未结合的荧光粒子和剩余样品分离。密度介质可以如图所示在管或孔内供应(并且可以包含染料以提供“染料垫”),使得分离可以包含将磁性粒子结合靶标分布在染料垫上方并且使用磁场牵引结合的靶标穿过染料垫并且到达成像表面上,从而使未结合的探针留在染料垫的表面上。然后,检测步骤可以包含使用数字成像对成像表面进行成像。因此,如所示出的,混合步骤包含将样品暴露于与所关注的靶标结合的磁性粒子,并且分离步骤包含使用磁场将结合的靶标拉离未结合的标记物。优选地,分离步骤包含将磁性粒子结合靶标分布在染料垫的表面上方,并使用磁场牵引结合的靶标穿过染料垫并且到达成像表面上,从而使未结合的标记物留在染料垫的表面上。
如所讨论的,分离的实施例利用密度梯度介质染料垫,该密度梯度介质染料垫可以包含用于提供染料垫和密度剂的染料。染料垫803可以包括密度剂(如碘克沙醇)和光吸收染料。染料垫可以在暴露于样品之前任选地干燥或冻干,该样品进一步包含吸收光的染料。染料垫形成密度高于含有样品和测定试剂的测定层的水层。染料垫可以单独地或组合地(并且在各种浓度下)包含各种密度剂,包含例如蔗糖、泛影酸盐、碘克沙醇(akaOptiPrep)、NaCl、CsCl、Percoll或白蛋白。实施例还可以并入有其它密度剂,包含其它常用密度剂,如泛影酸钠、其它糖、寡糖、合成聚合物(例如,Ficoll)和如溴化钾等各种盐等。实施例可以使用染料来匹配用于光子检测的各种不同激发和发射方案与所使用的光子标记物的对应光子信号传导特性。例如,染料甲苯胺蓝O可以与荧光标记物德克萨斯红(磺酰罗丹明)一起使用。一个实施例使用65μL等分试样的染料垫试剂,即2mg/mL的铬变素R2和10%v/v的OptiPrep(60%w/v的碘克沙醇溶液)加5%w/v的海藻糖,该海藻糖移液到测定孔中。染料垫可以是预先等分在96孔半面积直径底部透明的黑色板中或等分到筒的成像孔中的15%OptiPrep和5mg/mL的铬变素R2。参考孔915,可以通过制备碘克沙醇或聚乙烯吡咯烷酮(包含任何任选染料)的溶液并在孔915中干燥或冻干该溶液以形成染料垫915来形成染料垫903。然后,染料垫915将基本上是固体(例如,干燥的,例如,孔915可以以任何取向储存(包含倒置)直到使用)。当液体样品被递送到孔915中时,液体使染料垫803再水合。实际上,本文全篇公开和讨论的用于本方法的试剂可以以干燥或冻干的形式提供以供后期使用。这使得能够制备试剂并将其干燥地装载到筒上,然后该筒可以被运输或储存并随后用于本公开的方法中。
用于检测微生物和分子的方法和装置的某些实施例使用与靶标特异性抗体缀合的磁性粒子。
图3示出了可用于执行该方法的盒或筒901的一个实施例。筒901包含混合孔911。可能包括所关注的靶标201的样品被递送到混合孔911中。样品在被递送到混合孔911之前可以穿过过滤器955。样品可以是包括微粒的粪便样品。使样品穿过过滤器将降低筒堵塞的风险。可以使用任何合适的过滤器,如0.45微米膜过滤器、0.45μm硝化纤维素过滤器、0.65μm硝化纤维素过滤器或0.6μm聚碳酸酯过滤器。
筒901还包含与所关注的靶标结合的磁性粒子605;和与检测表面805相邻的染料垫。当施加磁场穿过染料垫803时,磁场将磁性粒子605牵引穿过该染料垫到透明壁。染料垫803包括密度梯度介质801的溶液,该密度梯度介质进一步包含从未结合的荧光粒子200吸收光的染料。在所描绘的实施例中,染料垫803和检测表面805(如透明壁)设置在与混合孔911流体连通的成像孔915中。染料垫803在筒内的成像孔中以干燥或冻干状态提供,直到被样品润湿为止。
如所示出的,筒可以包含彼此平行的多个成对的成像孔/混合孔组。在此,筒901示出为包含8个平行的“通道”,其中每个通道包含分隔孔901、混合孔911和成像孔915。筒的实施例可以包含2组8个通道,使得图4中的图片看起来大约相同,因为另外的8个通道将处于八个可见通道后面(筒是3维物体)。可以根据如高度h、长度l和宽度w等尺寸来描述筒(其中宽度w是垂直于图3中的页面测量的)。高度h可以介于约3cm与10cm之间。长度l可以介于约5cm与12cm之间。宽度w可以介于约0.5cm与3cm之间。例如,在一个实施例中,h为约6cm,l为约8cm,并且w为约2cm。
筒901优选地包含收容储器925,在该收容储器中,用户可以将样品移液到筒中。在某些实施例中,筒901包含可滑动门931,该可滑动门包括通道穿过其的垫圈。当门931定位在第一位置处时,收容储器925至少与第一分隔孔907流体连通。当门931处于第二位置时,收容储器925、第一分隔孔907和第一混合孔911全部彼此密封。当门931处于第三位置时,第一分隔孔907和第一混合孔911彼此流体连通。
筒901可以包含配件935,该配件用于联接到外部仪器以从其接收气动压力,从而将来自收容储器925的样品划分(此后为“分隔”)到分隔孔927中并且随后将液体从分隔孔907传递到对应的混合孔911中。
染料垫803包括密度剂801和吸收光的染料。染料垫803可以在筒内的成像孔中以干燥或冻干状态提供,直到被样品润湿为止。
图4示出了用于对筒901内的样品执行靶标鉴定和分析的示例性仪器1001(例如,分析仪)。仪器1001可以用于与筒901相互作用以执行方法101和本发明所涉及的过程。仪器1001可以包含用于显示提示、结果、报告129和接收命令的用户界面1003(例如,触摸屏)。仪器1001可以包含多个工作站。仪器可以包含用于运输筒的传送带1005、用于容纳处理和任选的温育设备的上部隔室1007以及用于容纳电子设备、成像和气动设备的下部隔室1009。仪器1001可以包含用于收容多个分析筒并对其进行分类的输入机构1013(例如,装载架或托盘)。仪器1001还可以包含用于在仪器内移动筒的传送带1005和推进器机构。仪器1001还可以包含任务调度器。仪器1001优选地由计算机控制,以自动操纵分析筒、执行微生物鉴定和分析并生成结果。仪器1001可以包含用于执行本发明的方法的多个子系统。
仪器1001的子系统可以包含气动子系统、磁性子系统、蛤壳式加热器和成像子系统1023。磁性子系统可以包含例如永磁体或电磁体,该永磁体或电磁体用于提供磁场B来牵引分析筒的检测表面上的磁性粒子和靶标以进行成像。成像子系统可以是如在美国专利第9,643,180号和第8,021,848号中描述的用于捕获靶标图像的子系统,这些美国专利均通过引用并入本文中;以及相对于仪器1001的成像模块操纵筒的检测表面的工作台。成像子系统1023可以与计算机可操作地相关联以提供图像处理、分析和显示能力。气动子系统可操作以驱动样品和试剂在筒内的移动。
在一些实施例中,推进器机构(例如,机械输送器臂)可操作以在仪器1001内的各个子系统之间移动筒901。在本发明的一些实施例中,推动器机构在传送带1005与仪器的各个子系统之间转移筒。推进器机构将筒推上或拉下传送带1005。传送带1005旋转以使筒定位在子系统中的另一个子系统附近,并且然后推进器可以施加力以使筒滑动到子系统上。在一些实施例中,仪器包含用于管理仪器1001内的分析筒的任务调度器。该任务调度器可操作以控制移动,如分析筒中的每一个在多个子系统之间的运输和转移。在一些实施例中,每个筒在子系统中花费的时间也可以由任务调度器管理。任务调度器可以根据需要在各个子系统上预留时间,以对分析筒中的每一个进行分析。在本发明的一些实施例中,任务调度器可以通过鉴定筒的内容物来管理筒的移动(即,待执行的分析的步骤/参数)。
在一些实施例中,仪器1001还可以包含读取器,该读取器可操作以分析筒上的唯一标识符(例如,条形码)。筒的内容物和所需的处理可以与筒上的条形码相关联。仪器1001可以通过读取器来读取唯一条形码,并将唯一条形码与供任务调度器执行的特定指令集相关联。仪器优选地包含用于控制本文所述的操作的计算机(例如,在界面1003内或连接到该界面)。计算机优选地包含耦接到非暂时性存储器装置的处理器。存储器优选地存储可由处理器执行以使系统操纵仪器1001内的分析筒并获得和处理标记微生物的图像的指令。
处理器是指执行处理操作的任何装置或装置系统。处理器将通常包含用于提供中央处理单元(CPU)的芯片,如单核或多核芯片。可以由来自英特尔公司(Intel)或AMD公司的芯片提供处理。处理器可以是任何合适的处理器,如英特尔公司(加利福尼亚州圣克拉拉)以XEON E7商标销售的微处理器或AMD公司(加利福尼亚州桑尼维尔)以OPTERON 10200商标销售的微处理器。
存储器是指以机器可读格式存储数据或指令的装置或装置系统。存储器可以包含一个或多个指令集(例如,软件),该一个或多个指令集在由计算机的处理器中的一个或多个处理器执行时可以实现本文所述的方法或功能中的一些或全部。优选地,计算机包含非暂时性存储器,如固态驱动器、闪存驱动器、磁盘驱动器、硬盘驱动器、订户身份模块(SIM)卡、安全数字卡(SD卡)、微型SD卡或固态驱动器(SSD)、光学和磁性介质等或其组合。
输入/输出装置是一种用于将数据转移到计算机中或从计算机转移到仪器的机构或系统。示例性输入/输出装置包含视频显示单元(例如,液晶显示器(LCD)或阴极射线管(CRT))、字母数字输入装置(例如,键盘)、光标控制装置(例如,鼠标)、条形码扫描仪、读取器、磁盘驱动单元、信号生成装置(例如,扬声器)、触摸屏、加速度计、麦克风、蜂窝射频天线和网络接口装置,该网络接口装置可以是例如网络接口卡(NIC)、Wi-Fi卡或蜂窝调制解调器。输入/输出装置可以用于使用户能够控制仪器和显示结果,并生成从筒的分析中获得的报告。
因此,仪器可以与筒一起使用以执行本发明的方法,该方法用于通过将样品与特异于结合所关注的靶标的磁性粒子和荧光粒子混合来检测微生物;从样品中分离样品中结合的和未结合的磁性粒子,其中与靶标结合的磁性粒子与样品分离;以及通过观察来自与靶标结合以示出样品中靶标的存在的荧光标记物的荧光对靶标进行检测和计数。混合步骤优选地包含将样品暴露于与所关注的靶标结合的磁性粒子和荧光粒子。检测步骤优选地包含使用数字成像对荧光标记的靶标进行成像。
所关注的靶标可以是任何类型的细胞或分子。在某些实施例中,靶标包括艰难梭菌的毒素A和毒素B中的至少一种。在其它实施例中,靶标包括致死因子——一种从炭疽杆菌中分泌的致死毒素的亚基。在一些情况下,靶标是病原体。
本发明提供了用于检测靶标(如艰难梭菌毒素)的方法和试剂盒,这些方法和试剂盒比商业免疫测定更灵敏、比细胞毒性中和测定(CCNA)更快速并且比核酸测试更具特异性。该技术可以通过简单的光学设备、最少的样品制备和样品-应答格式的快速周转时间来列举个别靶标。还证明与用于艰难梭菌毒素测试的监管审批的高度敏感的毒素B细胞毒性测定参考方法在性能上相当。
本发明提供了用于直接在复杂患者样品中快速和灵敏检测诊断标志物的新颖方法。如以下所例证的,发现30分钟艰难梭菌毒素B测试在粪便样品中的分析灵敏度为45pg/ml,这比主要的酶免疫测定(EIA)敏感15倍以上。而且,经测试的临床样品的准确度与CCNA的准确度相当。独特的染料垫形式允许以最少的样品处理进行检测,因为其将样品和未结合的标记物与检测表面光学隔离。具体地,可以仅在测定缓冲液中稀释粪便,并且在添加测定试剂之前使其穿过尼龙网过滤器以去除大微粒。当与其它EIA相比,简单的样品制备、没有洗涤步骤并且取消逐步添加试剂为减少大量的实践时间、降低成本和简化仪器提供了可能。总的来说,本发明以一种用于精确和灵敏地检测艰难梭菌毒素和其它靶标(例如,微生物和其组分)的有前途的技术为特征。
本发明的独特之处在于其快速且灵敏地检测广泛范围的分析物的能力。除了检测如分子(包含但不限于毒素、核酸和生物标志物)等靶标之外,这些方法还可以对细胞病原体(细菌、真菌和寄生虫)、病毒和诊断上重要的人类细胞进行检测和计数。在此所描述的方法可以用于同时测试单个样品的多种分析物,包含诊断信息性人类细胞(例如,嗜中性粒细胞)、毒素(例如,艰难梭菌毒素B)、病毒(例如,诺如病毒)和生物标志物(例如,细胞因子)。
用于实施本发明的一般方法、试剂盒和分析仪描述于WO 03/036290、WO03/073817、WO 2010/036808、WO 2010/036827和WO 2010/036829中,这些文献中的每一个的内容通过引用并入本文中。
本发明的方法采用与所关注的靶标例如微生物(例如,艰难梭菌)、细胞或其组分,如分泌的物质(例如,艰难梭菌毒素A或毒素B)结合的标记粒子和磁性粒子来形成复合物。
复合物被放置或形成在器皿中的液体层中。该方法采用至少两个液体层,复合物最初存在于覆盖层中,该覆盖层通过垫层与器皿的检测表面分离。垫层比覆盖层更致密。磁性粒子——无论是未结合的还是复合的——都可以通过磁力穿过覆盖层和垫层移动,以将磁性粒子和与其结合的任何东西沉积在器皿的检测区域附近的检测区中。未结合的标记粒子、靶标和其它样品组分保留在覆盖层中。然后可以通过对检测区中的标记粒子的数量进行计数来检测样品中的靶标的量。在某些实施例中,垫可以进一步包含染料,该染料阻断信号从覆盖层中的未结合的标记粒子中产生或发射。
该方法还可以采用一个或多个对照。例如,该方法可以采用阳性对照,其中样品的等分试样被掺入已知量的靶标,如分泌物质(例如,艰难梭菌毒素A或毒素B),以形成复合物。然后用未经掺加的样品完成测定。阳性对照可以用于确定样品中的组分是否正在抑制测定的任何部分。由于阳性对照样品含有已知量的靶标,因此检测到的靶标的量应与掺入量成比例。如果检测到的量显著低于预期量,则可以确定样品正在干扰测定,并且样品的测定无效。例如,如果在阳性对照中检测到的量小于预期量的95%、90%、85%、80%、75%、70%、65%、60%、50%或一些其它分数,则样品的测定可能无效。当然,如果样品中存在的靶标比掺入物多,则阳性对照将产生比预期更高的靶标量。那么这种样品不会无效。
该方法可以可替代地或另外地包含中和对照,其中样品被掺入结合分子,这些结合分子干扰标记粒子和/或磁性粒子或两者的结合。所添加的结合分子可以与标记粒子和磁性粒子上的结合分子相同或不同。中和对照可以用于确定对靶标不具特异性的背景计数。该背景可以从在样品测定中检测到的量中减去。可替代地,来自中和样品的量可以用于设定用于确定阳性结果的阈值。例如,对于被认为是阳性的测定样品,检测到的靶标的量可能需要大于阈值。可替代地或另外地,对于被认为是阳性的测定样品,来自测定样品的信号与来自中和对照的信号的比率可能需要大于阈值(或者相反比率可能需要低于阈值)。在一个实例中,对于阳性样品,来自中和对照的信号与来自样品测定的信号的比率小于0.75、0.7、0.65、0.6、0.55、0.5、0.45或0.4,例如小于0.5。
此外,该测定不需要或只需要最少的样品制备。本发明在通过采用对单独标记的靶标进行检测和列举而无需洗涤步骤来传递高灵敏度的同时简化了测试操作。样品来源的范围可以很广泛。人类样品可以包含例如尿液、粪便、血液、血清、血浆、唾液、鼻分泌物、脑脊液、皮肤、伤口和许多其它物质。工业样品可以包含食品、饮料和药品,并且环境样品可以包含水、空气或表面样品。在一个实施例中,例如,对于艰难梭菌或其它肠道微生物,样品是粪便样品(例如,成形的、半成形的或未成形的)或来源于粪便的样品。例如,粪便样品可以被稀释和过滤以去除大微粒。
标记粒子可以是本领域已知的任何合适的粒子,例如,标记粒子可以是聚苯乙烯、玻璃或乳胶珠或量子点。粒子可以由任何可检测部分标记,通常为光学可检测部分,如荧光团、化学发光剂、生物发光剂、共振光散射粒子、光吸收或显色信号传导剂、量子点或上转换磷光体。可替代地,粒子可以是天然可检测的,例如光学可检测的。例如,粒子可以通过荧光、吸收、光散射、磷光或发光来检测。磁性粒子是本领域已知的并且包含顺磁性和超顺磁性粒子。
可以以有利于形成一个靶标(例如,生物标志物或分子)的复合物的量提供标记粒子和磁性粒子。鉴于在样品中发现的靶标的预期或最大量,可以通过提供过量的粒子来确定此量。以这种方式,本发明允许通过确定检测区中的标记粒子的数量来对样品中存在的单独靶标进行计数。
结合分子是本领域已知的并且包含抗体或其抗原结合片段或适体。取决于靶标(例如,微生物),结合分子还可以包含与细胞表面受体或标志物结合的配体或其它化合物。
染料垫可以单独地或组合地(并且在各种浓度下)包含各种密度剂,包含例如蔗糖、泛影酸盐、碘克沙醇(商品名
当反应介质对激发光或其它照明光以及产生成像信号的反射光或发射光基本上透明时,检测区外部的未结合的标记粒子可能为图像提供较大的非特异性光学信号。在垫中加入染料可以用于消除或减少由存在于检测区外部的未结合的标记粒子产生的信号。例如,在适当浓度下的染料使得能够对检测表面处或附近的检测区中的荧光进行检测,同时对来自器皿的剩余部分中的未结合的标记粒子的信号进行遮蔽。当信号传导部分具有荧光时,所使用的染料可以具有与荧光信号传导部分的激发或发射波长重叠的吸光度,或者可以吸收激发和发射的光。例如,当荧光信号传导部分为黄绿色时,可用于本发明的染料包含铬变素2R和酸性红1。适用于此光谱区域和其它光谱区域的许多其它染料对于熟悉本领域的人员是已知的,如印度墨水或直接黑(Direct Black),如19或168。
致密垫层和染料的组合提供了一种用于对标记靶标进行成像而无需洗涤的高效方法。该方法可以消除由未结合的标记粒子和靶标以外的标记实体产生的背景信号。垫可以确保只有通过与磁性粒子缔合而穿过致密层的靶标才能到达检测区。染料阻止了对由覆盖的本体反应混合物中的游离标记粒子引起的信号进行检测,由此分离出沉积在检测区内的与磁性粒子复合的标记靶标的信号。
在所述方法中可以采用呈液体或干燥形式的垫和染料。在一个实施例中,具有或不具有染料的垫在器皿中呈液体形式,并且样品(或对照)被添加在垫上方。在另一个实施例中,具有或不具有染料的垫在器皿中呈干燥形式,并且液体的添加使该垫水合。有利地,具有或不具有染料的干燥的垫可以被来自样品(或对照)的液体水合。在向器皿中添加样品(或对照)时,来自样品(或对照)的液体使干燥的试剂水合以形成垫层,该垫层然后使样品的剩余部分与检测表面分离。
这些方法采用具有检测表面或检测区域的一个或多个器皿,在该检测表面或检测区域上,通过选择来沉积标记靶标,用于随后的检测。器皿通常具有支持标记靶标的光学检测的性质和特征。这些性质和特征可以包含光学上合适的材料、几何形状和用于聚焦的基准特征。
通常,包含检测区域的器皿的面是光学透明的,其性质非常适合于检测用于标记靶标的标记粒子。例如,如果要检测荧光,则光学窗口在靶标的对应光谱方案中的波长处应该是非荧光的。器皿在特定波长下的入射光反射率也将较低,这也可能通过增加背景信号而干扰成像。
可以保护图像表面免受尘埃、擦伤和污染。这可能有益于限制可能使成像复杂化的非特异性背景或伪影。保护表面的一些手段包含并入物理支座、支脚或屏障,或者用箔片或塑料盖覆盖光学表面。可替代地,可以使用铰接或滑动的门来保护表面。这些保护特征可以在成像发生之前去除,或者可以在成像过程中自动去除。可替代地,这些特征可能不是移动特征,如将是保护性或耐刮擦涂层的情况。
器皿或检测表面可以是塑料,如环烯烃共聚物、丙烯酸、聚苯乙烯和其它透明材料。也可以由玻璃(如硼硅酸盐玻璃、熔融石英、石英等)制成。其它材料包含但不限于PDMS、RTV、光学粘合剂和层压材料。器皿或检测表面可以具有内置光学过滤功能,该内置光学过滤功能可以包含涂层或结构组合物,如阻断或吸收某些能量波长的层压材料或另外的物理层。
检测可以使用阵列光电探测器,例如CMOS或CCD。可以调整检测器的大小以检测单个图像中的整个检测区。检测还可以不采用光学放大或采用5×或更小的光学放大率。通常,该方法采用大面积检测。例如,检测器将通常检测至少一个横截面尺寸为1mm(例如,至少1cm)的区域。
洗涤意指从容器中,物理地从靶标中去除含有不期望的组分的液体的过程,与不期望的组分相反,这些靶标与不期望的组分两者中之一保留在容器中。
不需要洗涤的测试意指在不使用洗涤步骤的情况下检测靶标的测试。
垫、密度垫、液体垫、垫层或液体密度垫意指比覆盖层更致密的基本液体层。在本发明中,在选择前,垫存在于位于检测表面与液体层之间的器皿中,该液体层包含样品和测试试剂。该垫提供了测试试剂与检测表面之间的物理隔离。使用选择,标记粒子和与磁性粒子复合的靶标穿过该垫移动并沉积在检测区中。未与磁性粒子复合的标记粒子被垫的致密液体层排除在检测区之外。
染料意指添加到反应中的物质或混合物,该物质或混合物干扰光到或从标记粒子的产生或传输。该染料减少或消除了源自检测区外部的信号,同时允许检测来源于检测区内的标记粒子的信号。对于荧光标记的粒子,染料可以吸收具有荧光激发频率、荧光发射频率或两者的光。各种染料性质可以用于此目的,包含光散射和吸光度。在各个实施例中,染料使信号减少至少50%、75%、85%、90%、95%、99%或甚至大于99%。
染料垫意指包含染料的垫。染料垫同时提供了从检测区物理排除本体反应(作为染色垫的密度的函数)同时防止或减少信号从覆盖反应到检测器的传输(作为致密层中包含的染料的函数)。
在一些实施例中,靶标意指微生物(例如,艰难梭菌)或其组分,例如分泌产物(如艰难梭菌毒素A或毒素B),其可能存在于样品中并且通过本发明测试其存在。该术语还包含来自多细胞生物体(例如,如人等哺乳动物)的细胞及其组分。
结合分子意指与靶标特异性地结合的分子或分子复合物。结合分子的实例是抗体、其抗原结合片段和适体。
粒子意指大小小于50微米的基质。粒子群体或粒子批次的大小定义为粒子样品的最长对正交尺寸的平均测量结果。许多粒子具有固体的一些特性。然而,分子支架或复合物(可能不是刚性的)也被定义为粒子。例如,树枝状大分子或其它分支分子结构被认为是粒子。类似地,脂质体是另一种类型的粒子。粒子可以与信号元件关联或缀合。粒子通常被称为反映其尺寸或几何形状的术语。例如,术语纳米球、纳米粒子或纳米珠用于指沿任何给定轴测量小于1微米的粒子。类似地,术语微球、微粒或微珠用于指沿任何给定轴测量小于1毫米的粒子。粒子的实例包含胶乳粒子、聚丙烯酰胺粒子、磁铁矿微粒、铁磁流体(磁性纳米粒子)、量子点等。
荧光粒子或标记粒子意指可以与靶标特异性结合并产生信号的粒子。
大致平面的表面或基板意指可以与虚平面平行对齐使得当测量从表面上的任何1mm×1mm正方形中的点到虚平面上的最接近点的距离时平均距离的绝对值小于50微米的表面。
检测表面意指大致平面的基板的表面。检测表面对标记粒子的信号是透明的。
检测区域意指由本发明同时分析的器皿的区域。检测区域的最长线性尺寸通常大于1mm,例如大于5mm、10mm或15mm。例如,由包含采集透镜和CCD芯片的光学装置同时成像的载玻片的部分可能测量为0.8cm×0.5cm。然后检测区域为0.4cm
检测区意指可以检测靶标的体积。检测区的横截面尺寸与检测区域的相同,但深度对应于可以检测和鉴定的标记粒子的深度。因此,检测区的深度取决于用于对阳性信号进行评分的阈值标准。当使用光学检测时,检测区的深度取决于光学景深。
同时检测检测区域的一部分中的靶标意指在一步骤中检测来自大致平面的检测表面的一部分的信号。
样品意指针对靶标的存在由本发明扫描的材料。
光电探测器意指将光子信号转换为电信号的人造装置或仪器。光电检测器的实例包含CCD检测器、CMOS检测器、光电倍增管检测器和光电二极管检测器,例如雪崩光电二极管。
“照射”意指用电磁辐射辐照。可以使用各种波长的电磁辐射照射。其包含例如波长在X射线、UV、可见光或红外光谱区域中的辐射。注意,照射辐射不一定在可见范围内。优选在190到1100nm的范围内照射。
微生物意指单细胞生物体(例如,细菌、原生生物、古细菌或真菌)或病毒。
在一个实施例中,该方法实现了单分子计数并在没有放大的情况下对单独靶标进行计数。图5示出了这些方法如何在不使用放大的情况下检测用荧光纳米粒子标记的靶标。照射荧光粒子标记的靶标会使标记的靶标发射光子。光子冲击在数码相机(如手机中的相机)的CMOS芯片上,该芯片包含独立光敏像素元件的阵列。因此,直接位于单独靶标上方的像素元件在所得图像中作为白点“点亮”(图6)。本发明以一种染料垫层为特征,该染料垫层允许该方法以最少的样品制备快速且特异性地计数复杂粪便样品中的靶标,例如微生物(例如,艰难梭菌毒素分子)或其组分(图7)。将可能含有靶标的液体样品添加到底部透明的器皿中,该底部透明的器皿含有两种类型的干燥试剂:染料(例如,直接黑)和密度剂(OptiPrep)。器皿的底表面处的干燥染料垫试剂在水合时形成致密层。靶标特异性荧光和磁性纳米粒子稳定在小的冻干球(约1mm直径)中。磁性纳米粒子涂覆有对靶标例如微生物(例如,艰难梭菌毒素分子)或其组分上的一个抗原位点具有特异性的抗体,并且荧光纳米粒子涂覆有与相同靶标上的不同抗原位点结合的互补抗体。在干燥试剂被样品水合后,形成两个层:致密染料垫层和测定层。在测定层中,靶标分子与磁性和荧光纳米粒子结合,从而将其栓系在一起。高浓度(约109/ml)和小尺寸(200-500nm)的粒子仅通过扩散混合就能驱动快速结合动力学,这通过消除对机械混合功能的需要而简化了仪器。将器皿或筒放置在永磁体上方持续3分钟吸引磁性粒子——以及通过靶标分子与其栓系的任何荧光粒子——穿过染料垫层,从而将其沉积在检测区中。所捕获的荧光粒子通过非放大数字成像即时进行成像和计数。计算机会即时地列举指示存在的靶标的数量的发光像素。在低分析物浓度下,与跨检测区域集成信号的更常见方法相比,对单独标记的靶标进行数字计数产生更好的信噪比。非放大成像允许瞬间对大视场成像——从而允许在大体积样品中快速检测到少量靶标。该方法的创新非放大数字成像方法带来的关键技术优势是该技术能够迅速检测极低水平的靶标并且组分成本非常低。因为单个分子可以在低靶标浓度下将荧光粒子栓系到磁性粒子,所以对磁性沉积的标记粒子的数量进行计数对应于所捕获的靶标分子的数量。染料垫消除或减少了样品制备和洗涤步骤。图8示出染料垫完全阻断数千万个高度荧光的未结合粒子的强烈荧光。
染料垫层被动地形成了吸收光的激发和发射波长的致密着色层。该层防止光到达测定层中的未结合的荧光粒子(有数百万个,否则其将会非常明亮)。类似地,染料垫在光学上和物理上使样品与检测表面隔离,从而使得测定对甚至最困难的样品基质也具有稳健性,而无需用户进行大量的样品制备。
除了以上讨论的方法之外,该方法还可以用作竞争性测定,其中磁性粒子与靶标竞争物缀合。形成了至少两种类型的复合物,一种复合物在磁性粒子与标记粒子之间形成,而另一种复合物在靶标与磁性粒子或标记粒子之间形成。当存在时,靶标通过与粒子中的一个粒子结合并防止其与另一个粒子结合来减少在磁性粒子或标记粒子之间形成的复合物的数量。通过减少在不存在靶标的情况下形成的磁性粒子与标记粒子的复合物的数量来间接地检测靶标。如将理解的,用于确定阳性结果或来自对照的有效测定的阈值将在竞争性测定中反转。
本发明还提供了用于执行本文所描述的方法的试剂盒。这些试剂盒包含在水合时形成垫的标记粒子、磁性粒子和液体垫试剂或干燥试剂。这些试剂盒可以进一步包含具有检测表面的器皿或筒,其中液体或干燥垫试剂任选地储存在该器皿中。试剂盒可以进一步包含例如与液体或干燥垫试剂混合或单独地储存的染料。试剂盒可以进一步包含阳性对照(例如,预定量的通常纯化的靶标)和/或中和对照(例如,游离结合分子)所需的试剂。
贯穿本公开已经参考和引用了其它文献,如专利、专利申请、专利出版物、杂志、书籍、论文、网页内容。出于所有目的,所有此类文献特此以全文引用的方式并入本文中。
根据本文档的全部内容,包含对本文所引用的科学和专利文献的参考,除了在本文中示出并且描述的那些之外,本发明的各种修改以及其许多另外的实施例对于本领域技术人员将变得显而易见。本文的主题含有可以适应于在本发明的各个实施例和其等效物中实践本发明的重要信息、例示和指导。
关于以下非限制性实施例对本发明进行描述。具体地,尽管实例说明了对艰难梭菌毒素B的检测,但是这些方法也可以用于其它靶标。除非另有说明,否则在实例中具体描述的装置的任何元件通常都可以与本发明的装置或试剂盒一起采用。
试剂.荧光微粒(500nm)购自赛默飞世尔科技公司(Thermo Fisher Scientific,马萨诸塞州沃尔瑟姆)。聚苯乙烯羧酸盐磁性粒子(292nm)购自艾德特克公司(Ademtech,法国佩萨克)。用于捕获磁性粒子的磁体来自德克斯特磁性技术公司(Dexter MagneticTechnologies,伊利诺伊州埃尔克格罗夫)。微量滴定板(96孔透明底部、半面积黑色板)来自葛莱娜第一生化公司(Greiner Bio-One,北卡罗来纳州门罗)。从艰难梭菌(核糖核酸型087)中纯化的天然毒素B标准物购自列表实验室公司(List Laboratories,加利福尼亚州坎贝尔)。针对艰难梭菌毒素B产生的小鼠单克隆抗体来自BBi Solutions公司(英国加的夫)和Fitzgerald公司(马萨诸塞州阿克顿)。嗜异性阻断剂(HBR-11)来自Scantibodies公司(加利福尼亚州桑堤)。牛血清白蛋白(BSA)、酪蛋白、酸水解酪蛋白(Hy-酪蛋白SF)、
临床样品.去鉴定的废弃粪便样品从贝斯以色列女执事医疗中心(Beth IsraelDeaconess Medical Center,马萨诸塞州波士顿)和探索生命科学公司(Discovery LifeSciences,加利福尼亚州洛斯奥索斯)获得。这些样品经过12个月的时间段采集。排除了成型粪便样品(半固体或固体)和2岁以下儿童的样品。将样品在4℃下储存在临床微生物学实验室中持续3-7天,并且将样品用冰或冰袋转移到实验室中的冷藏箱中以维持>4℃。在收到样品后,将其用水稀释到40%并且制成一次性等分试样,并且然后在-80℃下储存直至使用。汇集的阴性粪便样品由14种单独的粪便样品制成,这些单独的粪便样品通过实时PCR被评分为艰难梭菌阴性。在测试之前,向样品中添加粪便稀释剂,使得测定混合物中的最终组成为8%粪便、4mg/ml酪蛋白、8mg/ml Hy-酪蛋白SF、50mM Tris-HCI,其pH为7.3,补充有1mg/ml HBR-11和蛋白酶抑制剂混合物,稀释比例为1:150。经过稀释的粪便样品在测试前通过10微米尼龙网过滤器(PluriSelect公司,美国圣地亚哥)过滤以去除微粒。
成像系统.成像系统是一种能够从微量滴定板的选定孔中自动捕获图像数据的定制仪器和软件,其使用来自Prior科技公司(马萨诸塞州洛克兰)的高精度线性平台将每个孔定位在基于荧光的图像采集子系统上。该仪器可以以4个独立的颜色通道成像,并使用物镜、照明LED、荧光滤光片组和相机。物镜的视场被设计成捕获整个微量滴定板孔的图像。照明模块光源由每个颜色通道2个高功率LED组成。使用每像素量化12位的3.1MP索尼IMX265单色传感器用相机捕获一系列荧光图像帧。然后通过合并多个帧来形成每个孔的最终图像。对于艰难梭菌毒素B测试,使用470/40nm激发滤光片和515/30nm发射滤光片,并在20毫秒曝光下捕获了2个帧。
含有染料垫的微量滴定板的制备.通过向经表面-等离子体处理的96孔微量滴定板的每个孔中添加50μL含有0.25mg直接黑19、50mM pH为7.5的Tris-HCI中的10%(v/v)OptiPrep的溶液并且在60℃下干燥3小时来制备染料垫。将经过干燥的板干燥储存长达1个月。
抗体缀合磁性和荧光粒子的制备.使用由粒子制造商(法国佩萨克艾德特克公司和马萨诸塞州沃尔瑟姆赛默飞世尔科技公司)推荐的标准缀合方法通过羧基连接(EDC/NHS化学)使抗毒素B单克隆抗体与磁性和荧光粒子缀合。通过可见光吸收对经过缀合的磁性粒子进行定量,并且使用流式细胞术对经过缀合的荧光粒子进行定量,用于随后的测定调配物。
艰难梭菌毒素B测试.为了制备测定混合物,用粪便稀释剂、7e8粒子/毫升的抗体缀合磁性粒子、1.1e7粒子/毫升的抗体缀合荧光粒子和指示量的毒素B(稀释在含有2mg/mlBSA、0.05%w/v Tween-20和0.05%v/v Proclln-300的50mM pH为7.8的Tris-HCI缓冲液中)的混合物或仅空白缓冲液将粪便稀释至8%。将100μL测定混合物移液到每个干燥的含染料垫的孔中。在35℃下温育30分钟后,通过将测定板放置在德克斯特磁体上3分钟来下拉磁性粒子。然后使用成像系统对板进行成像,并且如下所述对信号进行定量。
图像分析.如下所示,针对每个采集的图像对荧光粒子的数量进行定量。用固定的像素阈值对图像进行遮蔽,从而创建二进制图像,其中强度高于阈值的所有像素都被设置为1。使用连通性分析对来自图像的像素进行分组,使得每个活动像素与在x或y图像方向上紧邻的所有活动像素分为一组。然后对像素组或斑点进行处理以确定一组参数,如面积(像素数量)、斑点强度(斑点中所有像素的总强度)和紧密度
检测极限、空白极限、动态范围和精度曲线.使用汇集的阴性粪便样品执行这些测量。艰难梭菌毒素B测试的检测极限是通过运行样品的不含分析物的24个复制品和12个各自具有7种毒素B浓度的复制品来确定的。空白极限、检测极限和精度曲线是根据临床和实验室标准研究所(CLSI)指南确定的。
测试艰难梭菌临床样品.如上所述,使用3孔测定(对于每个样品,测试、阳性对照和中和对照)测试了320个临床样品。每个被检查的样品由两个操作员独立地测试。对于阳性对照,向包含患者样品的测定混合物中掺入100pg/ml的艰难梭菌毒素B以检测基质抑制作用。对于中和对照,该测定被掺入2.5μg/ml的艰难梭菌抗毒素B抗体以确认未中和样品中的任何信号是毒素B检测的结果。
细胞毒性中和测定(CCNA).已经用于测试的样品的等分试样被冷冻在干冰上送往CCNA的微生物专家公司(Microbiology Specialists Inc.,德克萨斯州休斯顿)。在接收后,检查样品的完整性,并使用MRC-5成纤维细胞和Quidel细胞毒性试剂(Quidel公司,目录号:03-05000)执行CCNA。使用样本稀释剂稀释5倍并在2000到6000×g下离心10分钟,以使固体材料沉淀。通过无菌的0.45微米膜过滤器过滤上清液,该上清液用于与适当对照接种组织培养板,并且将板在35℃下温育24-48小时。在24小时内观察阳性样品的特异性细胞病变效应发展,而阴性样品则保持长达48小时。
数据分析.使用JMP和Graph Pad Prism软件分析数据。使用克洛珀-皮尔森(Clopper-Pearson)分析确定置信区间。
实例1:样品中艰难梭菌毒素B的检测
该方法使用数字成像无需放大即可检测用荧光染色纳米粒子标记的分子。照射荧光纳米粒子标记物使其发射光子,使用1:1f/4中继透镜收集这些光子。由粒子发射的光冲击在数码相机的CMOS芯片上的一小簇像素上,从而在最终图像中形成白点。在低分析物浓度下,与简单地集成来自整个检测区域的信号相比,对单独标记的靶标进行数字计数会产生更好的信噪比。非放大成像允许对大视场进行成像,从而使得能够在几毫秒内检测大体积样品中的少量靶标分子。
首先将样品与稀释剂和靶标特异性免疫试剂混合,所述靶标特异性免疫试剂由涂覆有对艰难梭菌毒素B具有特异性的互补抗体的荧光和磁性粒子组成。然后,将测定混合物添加到底部透明的微量滴定孔中,该微量滴定孔的底部已经涂覆有干燥的染料垫试剂。染料垫试剂是吸收可见光的染料(这些实验中为直接黑19)和密度剂碘克沙醇(OptiPrep
实例2:评估分析性能.
为了评估粪便基质中艰难梭菌毒素B测试的分析灵敏度,使用了汇集的粪便样品,该汇集的粪便样品包含14种随机选择的临床样品,这些临床样品在通过实时PCR艰难梭菌测试进行测试时给出了阴性结果。以一系列两倍稀释液的形式测试掺有艰难梭菌毒素B的汇集样品。该方法得到了艰难梭菌毒素B的检测极限为45pg/ml(图9)。当使用不同的PCR阴性粪便样品池时,也观察到类似的结果。在45pg/ml的毒素B浓度下,与毒素B分子的数量相比,反应含有大约100倍过量的磁性粒子。在这种分析物浓度下,磁性粒子和荧光粒子必须平均由单个毒素B分子栓系在一起,从而证实该方法通过成像而无需放大来检测单个分子。此外,图10中的精度曲线示出图9中所示数据的变异系数(CV)低于10%,这证明了该方法在低毒素B浓度下得到可重现结果的可能性。
图11示出了在含有一定浓度范围的外源性添加的纯化艰难梭菌毒素B的汇集粪便样品中的艰难梭菌毒素B测试的剂量反应。在高达大约1μg/ml的4-5个数量级的浓度范围内,数据基本上是线性的,超过该浓度范围则反应进入平台期。值得注意的是,覆盖此范围超过了临床报道的艰难梭菌毒素B的最高水平——约100ng/ml。
实例3:通过测定对照检测和缓解基质效应
阳性和中和测定对照被设计成促进样品基质效应的检测和随后缓解。对含有临床样品和测定试剂的混合物的相等的等份试样并行执行测定对照和毒素B测试。阳性对照包含限定量的掺入毒素(100pg)。低于预期结果的阳性对照信号的偏差指示阴性测定干扰(测定抑制)。中和对照含有毒素B中和抗体,这些中和抗体隔离临床样品中的毒素B,从而使其在测定中无法检测到。以这种方式,中和对照将来源于样品中的毒素B的特异性信号与非特异性信号区分开来。非特异性信号可能是由荧光粒子或自动荧光样品组分在检测表面上的分析物非依赖性沉积引起的。在这项工作中,临床样品的训练集用于根据经验建立信号、中和和干扰阈值,以优化相对于细胞毒性测定参考方法的诊断准确度。
图12以图形方式表明通过艰难梭菌测试进行的阳性和阴性调用的决策矩阵。决策矩阵包含2个阈值,一个是信号阈值(在x轴上),而另一个是中和阈值(在y轴上)。只有超过信号阈值以及中和阈值的样品才被称为阳性。这在图12和13中的右下象限中被可视化为正调用,并且在其它三个象限中为负调用。另外,如果在阳性对照中检测到干扰(与预期信号相比,变化>75%),则宣布样品无效。
实例4:艰难梭菌毒素B测试在临床样品上的准确度
艰难梭菌毒素B测试用于分析来自疑似患有艰难梭菌感染的患者的320个临床粪便样品。样品一式两份地进行测试。将来自该样品训练集的结果与毒素B细胞毒性测定参考方法的结果进行比较。接受者工作特征曲线分析用于根据经验开发测定阈值以优化准确度。在320个临床样品中,仅一个样品(两个复制品)被排除在该分析之外,因为其示出对阳性对照的抑制率超过98%。
图13绘出了训练集结果。数据表明,所选阈值有效地区分阳性样品和阴性样品。使用细胞毒性测定评定为阳性的样品(红点)几乎完全落在右下象限内,这表示具有显著可中和信号的样品。相反,通过参考测试评定为阴性的样品(蓝点)几乎完全落在其它三个象限之一中,这三个象限表示具有低信号、不可中和信号或两者的结果。表1比较了艰难梭菌毒素B测试与参考细胞毒性试测定的结果。
表1:艰难梭菌毒素B测试与细胞毒性测定(微孔板)的比较
使用所选阈值,当与细胞毒性测定参考方法相比时,本文所呈现的新方法达到97.0%的灵敏度(95%Cl,91.4%-99.4%);98.3%的特异性(95%Cl,96.8%-99.2%);和98.2%的准确度(95%Cl,96.7%-99.0%)。
实例5:提高艰难梭菌测定的性能和添加艰难梭菌毒素A
以上所示的表1显示了微孔板测定性能。表2显示了筒/分析仪性能。
表2:艰难梭菌毒素B测试与细胞毒性测定(筒/分析仪)的比较
为了选择毒素A抗体对,总共筛选了144个毒素A抗体对。图14示出了毒素A LoD(抗体对J/L)(1/2LoD)。对具有荧光粒子L的磁性粒子G(图15)以及具有荧光粒子L的磁性粒子J(图16)进行了抗体对的毒素A临床样品测试。基于对临床样品的LoD和性能测试选择毒素A的抗体。毒素A和毒素B的LoD均符合产品要求。毒素B的LoD为45pg/mL。毒素A的LoD为365pg/mL。此外,使用毒素A(图17)和毒素B(图18)对新鲜临床样品进行测试示出优异的性能。
表3显示了筒/分析仪性能。
表3:艰难梭菌毒素A+B测试与细胞毒性测定(筒/分析仪)的比较
实例6:快速单分子计数方法直接在粪便样品中灵敏地检测艰难梭菌毒素B
背景.开发了基于新颖数字成像技术的超灵敏多路径艰难梭菌毒素B测试,该测试可以在很少或没有样品制备的情况下对粪便样品中的个别靶标分子进行计数。艰难梭菌胃肠道感染的当前测试可能不准确。艰难梭菌毒素免疫测定通常缺乏临床灵敏度。核酸扩增测试具有优异的临床灵敏度,但由于其不能将患有艰难梭菌感染的患者与艰难梭菌生物体携带者患者区分开来,因此其临床特异性减弱。因为毒素的产生是艰难梭菌感染的标志,所以超敏感艰难梭菌毒素测试(如本报告中所呈现的测试)可以解决与当前测试相关的问题并提供检测患有这种毁灭性感染的患者的改进的准确度。
技术方法.多路径艰难梭菌毒素B测试使用非放大数字成像对已经由毒素分子栓系在一起的靶标特异性磁性和荧光粒子进行计数。该方法包含使用新颖染料垫,该新颖染料垫消除了对样品制备和洗涤步骤的需要。对临床粪便样品进行测试以估计检测极限、不精确度和动态范围。通过将新毒素测试的结果与用于毒素检测的敏感细胞毒性参考方法的结果进行比较来评估达到良好临床准确度的可能性。
技术.所使用的技术包含染料垫,这消除了样品制备和洗涤。该技术具有30分钟的测试周转时间。所使用的技术包含阳性和中和内部对照。所有步骤都在自动化分析仪上的筒中进行。所有试剂都稳定在筒中。图19-21中示出了所使用的技术。
平台工作流程.图22中示出了标记为附图标记1的样品筒和标记为附图标记2的样品分析仪。
分析结果.图23-25中示出了分析结果。
干扰.发现20种通常与腹泻粪便样品相关的潜在干扰物质对掺有毒素B的样品的测定结果没有影响。
包容性.对来自表示常见核糖核酸型(027,106,014,002,017,001,078,036,087)的菌株的毒素的分析示出,当掺入到汇集的粪便样品中时,剂量/反应类似。
排外性/交叉反应性.粪便样品中的毒素测定性能是在存在23种常见的脱靶物种>1e8 CFU/mL的情况下进行评估的。这些物种都不抑制掺入的毒素B的检测,也不产生假阳性结果。
临床可行性结果.
半手动分析.来自疑似患有艰难梭菌感染的患者的320个临床未成形粪便样品的训练集用于选择参数,以产生相对于细胞毒性中和测定(CCNA)参考测试的最佳准确度。使用微量滴定板和手动移液步骤进行测定。将商业酶免疫测定和PCR测试的结果与CCNA结果进行比较。
表4:多路径30分钟测试与CCNA的比较
表5:核酸扩增测试与CCNA的比较
表6:酶免疫测定测试与CCNA的比较
全自动化分析.在自动化多路径分析仪原型和多路径耗材筒上测试了随机的样品子集并将结果与CCNA结果进行了比较。
表7:多路径分析仪测试与CCNA的比较
局限性.该测试仅检测艰难梭菌毒素B,而不检测毒素A或二元毒素。这项研究不是盲目的,并且其将样品视为优化参数的训练集。只测试了未成形的粪便样品,这些粪便样品不具有用于子分析的相关患者信息,并且其不是新鲜的而是在-80℃下冷冻的。
结论.所呈现的数据证明了超灵敏多路径技术对艰难梭菌毒素B得到快速、准确、易于使用的测试的可能性。该技术还应该对各种其它重要的传染性疾病应用具有价值。
实例7:直接从血液样品中快速且灵敏地检测炭疽杆菌毒素致死因子
摘要.所分泌的致死因子(LF)——致死毒素的亚基——是炭疽杆菌感染的最早已知的生物标志物,从而使其成为用于检测暴露于这种潜在致命病原体的诊断逻辑靶标。目前还没有用于炭疽LF检测的快速(产生结果的时间少于30分钟)、足够简单以在医师办公室实验室中使用并且足够灵敏以在感染早期检测到低浓度的LF(<100pg/mL)的商业方法。可以在不制备样品的情况下对添加到一次性筒中的小体积(<60mL)静脉或手指针刺全血进行多路径炭疽测试。一旦装载到分析仪中,测试就会自动进行而无需用户进一步输入。从样品装载到诊断结果的时间不到20分钟,并且在平台上可以同时处理多达20个样品。使用掺有纯LF蛋白的全血样品确定的检测极限(LoD)<60pg/mL。测定的动态范围覆盖5个对数的LF浓度,这是鉴于炭疽感染过程中观察到的广泛范围的LF浓度的重要性能指标。在易于使用、快速得出结果时间和高灵敏度的情况下,多路径炭疽测试潜在地填补了炭疽诊断工具包中的重要空白。
测定综述.图26中示出了测定综述。
工作流程.目前正在开发的多路径平台不需要样品制备。向储存在筒中的样品稀释剂中添加静脉全血或手指针刺血液。将筒装载到多路径分析仪上。分析仪在<20分钟内提供诊断读数。图27中示出了工作流程。
分析灵敏度.将致死因子连续稀释到静脉全血样品中,然后通过多路径平台运行。空白极限被确定为比24个独立制备的空白样品的平均值高出3个标准偏差。通过确定致死因子的最低插值浓度来确定分析灵敏度,在该最低插值浓度下,95%的数据点预计位于空白极限之上。跨一组血液样品可以看到相当的性能。图28中示出了结果。
掺入到全血样品中的致死因子的检测.在多路径平台上一式两份地运行全静脉血液的48个阴性单独的患者样品。然后将致死因子在150pg/mL下掺入到相同的48个样品中,并且在多路径平台上一式两份地运行。图29和以下表8和9中示出了未经掺加的样品和经过掺加的样品的群体的信号分布,如使用4000个荧光单位的信号截止点的假定诊断性能一样。
表8:经过掺加与未经掺加的比较
表9:诊断性能
对微生物干扰的稳健性.多路径系统正确鉴定致死因子的存在或缺乏的能力是在各种常见微生物存在的情况下进行测试的,这些微生物根据CLSI指南在1E7 cfu/mL下掺入到全血中。多路径系统能够在所有情况下正确检测致死因子的存在或缺乏。
表10:针对潜在微生物干扰物的致死因子的存在
对化学干扰的稳健性.多路径平台正确鉴定致死因子存在或缺乏的能力是在存在各种潜在干扰物质的情况下测试的。根据CLSI指南在推荐浓度下测试常见的潜在干扰内源性和外源性物质。多路径平台能够在所有情况下正确检测致死因子的存在或缺乏。
表11:针对潜在化学干扰物的致死因子的存在
动态范围.多路径平台的致死因子的动态范围为超过1E5 pg/mL。将致死因子从1μg/mL连续稀释到100pg/mL,并掺入到汇集的人血浆中。然后在多路径平台上针对每个掺入水平一式三份地运行样品。图30中示出了结果。
概述.在多路径平台上运行的多路径炭疽测试需要最少的样品制备,在<20分钟内返回结果,并且可以在全血中检测低至<60pg/mL的大动态范围内的致死因子,同时展现出对常见干扰物质和生物体的稳健性,从而在公众暴露于炭疽杆菌的情况下为医疗保健提供者提供医疗需求点的快速测试解决方案。
使用本文中的方法进行的测试挽救生命、降低成本并减少耐药性。患者在感染开始时接受靶向窄谱疗法。这些方法降低了发病率、死亡率和住院时间,并减少了耐药性的传播。
所使用的技术解决了独特的广泛范围的关键市场应用。从临床样品中获得概念验证数据,并使用了工作平台原型。存在降低抗生素不适当使用的压力(POC,医院)以及医院降低感染率的巨大财务压力。
该平台为医院、诊所和医师办公室实验室提供高性能、快速、负担得起的测试。两用平台适用于关键的临床和公共卫生应用,并且为所有主要综合征感染提供快速AST并为毒素和病原体提供快速超灵敏测试。
该技术在30分钟内检测感染并对分子、细胞、病毒和毒素进行计数,并且在4小时内检测病原体的表型AST。该技术直接使用样品(血液、鼻拭子、粪便、尿液),无需样品制备。该技术是高度敏感且特异性的并对单独靶标(如生物标志物/毒素的低pg/mL LoD)进行计数,其中细菌检测与qPCR(-10CFU/mL)相当。该技术在1到3倍的时间内确定抗生素易感性。所有试剂都包含在筒中。正在开发的测试解决了重要的医学应用,如生物防御测试,像炭疽测试和针对艰难梭菌、UTI ID/AST和CAUTI ID/AST的商业测试。图31示出了在没有样品制备或洗涤步骤的情况下检测靶标。染料垫消除了用户样品制备和洗涤步骤。
分析仪包含外壳以及测定稳健性、减少测试时间和细菌生长所需的热控件。筒架装载接口与安全相关。分析仪包含内置计算机和集成的结果分析和数据库以及图形用户界面和触摸屏。分析仪具有工业设计和较小的占地面积。示例性分析仪的尺寸为H18"×W20"×25"D。另一个示例性分析仪的尺寸为H15"×W15"×24"D。
软件包含分析仪用户界面、软件开发质量程序、自动化图像和结果分析、结果数据库、无需软件更新即可扩展测试菜单的软件、筒装载和垃圾筒监测软件以及自动化结果验证测试。
筒包含设计用于管道中的所有测试的通用模块化筒。筒将孔的数量从6个增加到16个,改进了射流技术(即,最大限度地减少起泡),减少了零件计数,同时增加了孔的数量,减少了组装步骤,并将气动端口从5个减少到1个。
炭疽测试
测试包括在生物威胁事件后检测炭疽。该测试检测血液样品中的致死因子(LF)。LF是由炭疽杆菌分泌的毒素亚基,在吸入炭疽感染早期出现,并且游离或与保护性抗原(致死毒素)复合出现。该测试包含手指针刺或静脉全血样品(70uL)。如果>150pg/ml血液,则测试结果为阳性。内部对照提高了准确度。
图32中示出了分析性能。图33示出了实例1,并且图34示出了实例2。测试在不同的4天一起进行。测试了4名患者的静脉血样品。复制品为n
快速ID/AST测试中存在值。目前的ID/AST测试需要花费几天来确定最佳疗法。可能会开出不必要或无效的抗生素。经验性广谱抗生素疗法增加耐药性。快速AST的目标是在开始时开出窄谱疗法,并且只治疗受感染的患者。对临床医生和患者的价值包含改善患者预后、减少抗生素耐药性和改善抗生素管理。图36中示出了筒中的AST工作流程。
开发了一种多路径ID/AST的流线型FISH方法。提供了与其它快速AST方法相比的关键竞争性优势。该测试检测差别生长后的特异性病原体,并进行非无菌和多种微生物感染的快速AST。结果是流线型经典荧光原位杂交(FISH)。图37中示出了传统FISH与多路径FISH的比较。
UTI ID/AST测试确定患者是否不具有UTI(<10K总CFU/mL尿液)、患者是否被4种最常见UTI病原体之一感染以及4种主要抗生素中哪一种是有效的。工作流程包含将尿液直接添加到含有生长培养基的筒中。如果对UTI病原体之一呈阳性,则反射至AST。产生目标的时间:ID在30分钟内,AST在4小时内。
UTI ID测试:图38中示出了微量滴定板的研究。图39示出了对UTI病原体的高分析灵敏度。测试时间为30分钟,30%的尿液掺有病原体,并且测试了4种不同的尿液样品。该方法检测<10K·CFU/ml尿液,这是UTI的常见阈值。
UTI AST测试:图40中示出了微量滴定板的研究。图41示出了UTI AST准确度。该方法将多路径AST(4小时)与培养液微量稀释参考测试(18小时)进行比较。包含4种物种(每种7-10个菌株)、3-4个Abx,其中在200次观察中有1次小误差,并且没有非常大或大的误差。与参考方法相比,多路径AST示出了较高的精确度。
图42示出了针对不同接种物水平的多路径快速AST稳健性。针对3个物种和4种抗生素,测试了对覆盖4个数量级的接种物的AST的影响,所有样品100%基本上一致。在接种物覆盖4个数量级时,未观察到接种物效应。
图43示出了多种微生物样品对快速AST结果的影响。所添加的非靶标细菌包含表皮葡萄球菌、藤黄微球菌(Micrococcus luteus)、微小棒状杆菌(Corynebacteriumminutissimum)、金黄色葡萄球菌、鲍曼不动杆菌(Acinetobacter baumannii)、弗氏柠檬酸杆菌(Citrobacter freundii)和肺炎克雷伯菌NDM1。在存在高水平的其它细菌的情况下,对大肠杆菌运行多路径AST。将大肠杆菌MIC与5种抗生素的参考测试进行比较。与参考方法相比,84个样品的基本一致性>98%。在存在1E7 CFU/mL的分泌碳青霉烯酶的肺炎克雷伯菌NDM1的情况下,亚胺培南的大肠杆菌MIC不受影响。因此,快速AST结果不受多种微生物样品的影响。
图44示出了来自UTI ID/AST的结果。使用ID/AST在平台上测试了耐药性和敏感性大肠杆菌菌株。方法包含在32ug/ml氯法齐明中温育4小时后测量生长倍数。示出了平台上自动化快速多路径AST的潜力。图45示出了选项1 UTI ID/AST概要。
探索了跨一系列血液样品的LF测试性能。来自54名患者的全血样品。在LF测定中,每个样品都在未掺有和掺有150pg/ml的LF的情况下进行测试。除了单个例外之外,所有样品都被正确鉴定为经过掺加或未经掺加。下表12和表13中示出了结果。图46示出了FISH探针包容性。图47示出了FISH探针排外性。测试了55个菌株的交叉反应性和微生物干扰规范。
表12:结果
表13:条件
平台和工作流程
可以使用多路径平台。平台是台式、样品-应答实验室仪器(分析仪)。不需要样品制备或培养/分离。在一个筒中测试一个样品,以进行生物体鉴定(ID)或抗生素易感性测试(AST)或其组合/变体。每8小时轮流运行大约40个患者样品。测试大约在1/2小时(ID)和4小时(AST)内得出测试结果。测试菜单:可扩展的筒条形码包含测试和样品标识。位置:医师办公室、急诊处或医院实验室。大小:大约15"(38mm)宽,15"(38mm)高,24"(61mm)深。功率:120-240VAC,50-60Hz。计算机:内部。通信:通过客户网络/LIS或手动通过USB端口。
工作流程步骤包含:1)将1-5个筒装载到可拆卸的支架中;2)将由测试指定的样品(例如,血液、尿液、粪便)分配到筒中,其中所有试剂都包含在筒中;3)将支架装载到分析仪中;4)使用触摸屏启动运行并报告结果;5)清空可移动垃圾箱(至多20个筒)。
分析仪具有旋转的圆盘传送带和推动器以运输和培育至多20个筒。分析仪具有用于处理和培育筒的上部隔室(如在35℃下)以及包括电子设备、光学器件和气动装置的下部隔室。图48中示出了示例样品筒。筒包含至多16个孔,每个孔可以执行至多4次测定。
平台用户界面(UI)可以报告结果。触摸屏U1用于启动/监测运行以及显示、打印和输出测试结果。在筒最终成像后,软件会生成结果并将所有测试数据存储在数据库中。Ul还提供了一种对数据库进行查询、分选和其它数据管理功能的手段。软件具有实验室信息系统(LIS)API,用户可以访问该LIS API,以自动将数据上传到其LIS。用户可以配置本地或网络打印机。软件具有控制访问的用户标识和权限级别。
- 一种基于检测试纸的靶标物半定量检测方法及检测试纸
- 一种多靶标miRNA检测微流控芯片、检测方法及其快速定量检测系统
