一种基于肽段同位素稀释质谱法的IgG抗体定值方法
文献发布时间:2023-06-19 11:52:33
技术领域
本发明涉及生物化学检测技术领域,特别是涉及一种基于肽段同位素稀释质谱法的IgG 抗体定值方法。
背景技术
对通过均匀性、稳定性检验合格样料的特性值进行测量,在标准物质技术领域称为表征化(英文为characterize,即对材料特性进行测量);由计量权威部门对表征化获得的样料特性的量值进行计量学溯源性(以下简称溯源性)确认和相应测量不确定度评定合理性确认,在标准物质技术领域称为定值(英文为certify,即对测量获得的结果进行认证确认)。因此,对有证标准物质的定值,实际上应分为两步:首先是对经过均匀性、稳定性检验合格的样料特性值进行测量,也就是表征化;然后是对测量结果的溯源性和测量不确定度评定的合理性进行有效性确认。
随着生命科学和生物产业的发展,蛋白质标准物质的应用越来越广泛,需求也越来越大。蛋白质含量标准物质被广泛应用于农业、食品、临床等各个领域,蛋白质的准确测量关系到国家安全、大众健康和贸易公平,在临床检验、生物医药等重要领域起着关键作用。面对动态的生命活动过程,识别和测定蛋白质这一复杂的生物大分子,认识其生理功能是非常艰巨和繁重的工作。蛋白质含量的计量需要建立蛋白质含量相应的量值溯源与传递体系,使得多肽和蛋白质含量测定能够溯源到SI单位,保证蛋白质含量测定的准确、可比。然而,目前蛋白质溯源链较长,定值结果不确定度大,仍需要完善提升已有方法并建立全新的基、标准装置和基、标准方法,降低蛋白质测定结果的不确定度。
同位素稀释质谱法(IDMS)是应用稳定同位素进行化学分析的一种方法,在测定蛋白质含量时,该方法将一定量的同位素标记化合物添加到样品中,这些同位素标记化合物可以是同位素标记的元素、氨基酸、肽段或蛋白质。待同位素与样品混合均匀后进行水解或酶解的操作,再通过质谱技术检测反应后非标记物和标记物的比例,由此对蛋白质进行准确定量。该方法现在是蛋白质标准物质定值的主要技术手段之一。
现在常用的ID-MS法是基于氨基酸的同位素稀释质谱法,而这类方法因为无法区分来自蛋白样品或杂质的氨基酸,因此对定值的蛋白纯度要求很高,一般要大于95%。针对IgG抗体这类结构复杂的蛋白样品,对于其标准物质定值技术的研究现在还很少,需要发展新的特异性更高的定值方法对氨基酸同位素稀释质谱法进行补充。
发明内容
本发明的目的是提供一种基于肽段同位素稀释质谱法的IgG抗体定值方法,测定结果可以溯源到SI单位,同时3条特征肽段来自人源IgG恒定区,因此人源IgG抗体标准物质均可采用该方法定值。
本发明采用的技术方案具体如下:
一种基于肽段同位素稀释质谱法的人源IgG抗体定值方法,基于该方法定值的IgG抗体纯度需在90%以上,且不含有其他非目标人源IgG杂质;
具体包括以下步骤:
(1)特征肽段选择:根据人源IgG恒定区的氨基酸序列,确定ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK三条人源IgG恒定区肽段为定值的特征肽段;序列如 SEQID NO:1-3所示;
(2)合成三条特征肽段:ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK,以及三条同位素标记肽段:AL*PAPIEK,GPSVFPL*APSSK,DSTYSL*SSTLTLSK进行人源IgG 抗体蛋白的定量;
(3)特征肽段纯度的准确测定;
(4)特征肽段质谱参数的优化:一是特征肽段质谱分析离子对的确定,分析合成的标记和非标记特征肽段的母离子和子离子,调节碰撞能量选择信号最强的离子确定为定量离子对;二是对定量离子对的各质谱参数进行优化;
(5)采用液相系统串联质谱对特征肽段进行质谱分析,质谱采集采用多反应监测(MRM) 模式;
(6)特征肽段线性范围的确定;
(7)准确称量待测体积的人源IgG抗体蛋白溶液,加入并称量相应体积的同位素内标溶液;使特征肽段与内标肽段摩尔比为1:1;按溶液中所含人源IgG抗体蛋白质量,根据三条肽段的纯度计算酶切后所得三条目标肽段的质量,配制相应浓度标准肽段及同位素内标肽段;
(8)人源IgG抗体蛋白样本分析前处理的主要步骤有:酶切条件优化、人源IgG抗体蛋白酶切、浓缩样品;
(9)在最优酶解条件下将人源IgG抗体蛋白充分酶解,根据标准曲线计算酶解后特征性肽段的含量,根据人源IgG抗体蛋白的分子量计算溶液中人源IgG抗体蛋白的浓度作为标准物质的定值结果。标准曲线是以标准溶液中非标记肽段与标记肽段质量比为横坐标,以标准溶液中非标记肽段与标记肽段在质谱中峰面积比为纵坐标拟合而来。
其中,所述步骤(1)中,3条肽段在该单克隆抗体恒定区序列中的位置如下:
轻链恒定区,序列如SEQ ID NO:4所示:
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTE QDSK
重链恒定区,序列如SEQ ID NO:5或6所示:
ASTK
ASTK
其中,*表示终止。大部分重链恒定区最后一个氨基酸是K,但有的抗体会把最后一个氨基酸切掉,如CD-20抗体的重链末尾没有K。
其中,所述步骤(2)中,合成用于定值的三条特征肽段ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK,以及相应的同位素标记肽段AL(
其中,所述步骤(3)中,以亮氨酸、缬氨酸、脯氨酸或苯丙氨酸标准物质为标准,以同位素标记亮氨酸、缬氨酸、脯氨酸和/或苯丙氨酸为内标,采用氨基酸同位素稀释质谱法对合成的三条非标记的特征肽段进行准确定量。
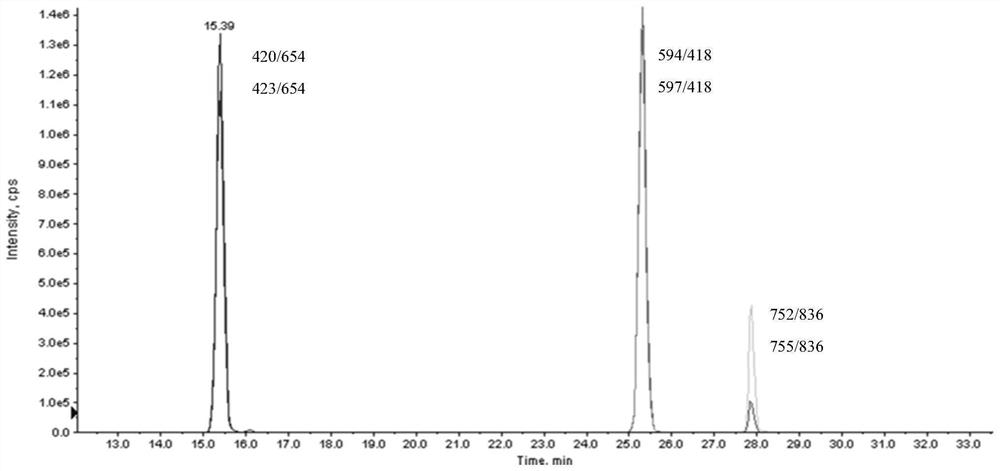
其中,所述步骤(4)中,特征肽段质谱分析离子对的确定需要对特征性肽段质谱参数进行优化,一是分析研究合成的标记和非标记特征肽段的母离子和子离子,调节碰撞能量选择信号最强的离子进行研究,确定为定量离子对。选择以下MRM离子对:ALPAPIEK(420→654), AL*PAPIEK(423→654),DSTYSLSSTLTLSK(752→836),DSTYSL*SSTLTLSK(755→836), GPSVFPLAPSSK(594→418),GPSVFPL*APSSK(597→418)。二是对定量离子对的各质谱参数进行优化,使其质谱响应最强。
其中,所述步骤(5)中,采用液相系统串联质谱对特征肽段进行质谱分析,流动相A: 98%水,2%乙腈,0.1%甲酸,流动相B:98%乙腈,2%水,0.1%甲酸,流速200nL/min,流动相B 5min 5%,30min10%,31min 100%,35min 100%,36min 5%,48min 5%;质谱采用正离子方式检测;扫描方式为多反应监测(MRM);
其中,所述步骤(6)中,需要确定特征肽段线性范围,将三条特征肽段分别配成2.8μM 的肽段溶液,将合成的标记肽段溶液与各浓度标准肽段溶液按质量比0.5-1.5充分混合,根据标准肽段与标记肽段峰面积比为参考,计算标准肽段在浓度范围1.96~4.2μM之间的线性, R
其中,所述步骤(7)中,准确称量待测体积的人源IgG抗体蛋白溶液,加入并称量相应体积的同位素内标溶液;待测人源IgG抗体蛋白的特征肽段浓度应该在确定的线性范围内;使特征肽段与内标肽段摩尔比为1:1;按溶液中所含人源IgG抗体蛋白质量,根据三条肽段的纯度计算酶切后所得三条目标肽段的质量,配制相应浓度标准肽段及同位素内标肽段;
其中,所述步骤(8)中,样本分析前处理的主要步骤包括:酶切条件优化、人源IgG抗体蛋白酶切、浓缩样品;
1)对蛋白酶切条件进行优化:优化方法为用重量法称取内标肽段储备液配置内标肽段的混合液,使混合液中每条肽段的摩尔浓度与抗体酶解后各肽段的摩尔浓度相等。再用重量法将抗体蛋白溶液与内标肽段混合液按1:1质量比混合,随后酶解,比较不同酶切条件下酶切肽段与内标肽段的质谱峰面积比,取峰面积比最高时的酶切条件作为该人源IgG抗体蛋白优化后的酶切条件。
2)比较了多个酶切条件,优化后的人源IgG抗体蛋白酶切条件为,取人源IgG抗体蛋白溶液与内标肽段混合液按1:1质量比混合,然后用等质量水稀释一倍后,按照体积比3:1加入乙腈;加入Lys-C蛋白酶(1:50)37℃反应16h。再按照酶的质量/总蛋白质量(w/w)=1:15,加入胰蛋白酶液37℃酶切24小时,在酶切时间点为4、8、12小时样品中补加胰蛋白酶液。
3)浓缩样品:采用真空离心浓缩法对样品进行浓缩,用0.1mL 0.1%甲酸溶液复溶,上机进行液相质谱检测。
其中,所述步骤(9)中,根据下述公式,计算酶切溶液中ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK的含量,
式中:c-为样品中ALPAPIEK(GPSVFPLAPSSK或DSTYSLSSTLTLSK)的含量(mg/g);m
I
I
R
R
M:样品质量(g);
P:ALPAPIEK(GPSVFPLAPSSK或DSTYSLSSTLTLSK)的纯度。
根据人源IgG抗体蛋白和特征肽段的分子量计算溶液中人源IgG抗体蛋白的浓度作为标准物质的定值结果。
同现有技术相比,本发明方法的突出效果在于:
(1)与现有技术中的基于LC-MS/MS法对单克隆抗体定量不同的是,本发明基于肽段同位素稀释质谱法的IgG抗体定值方法采用了基于氨基酸分析的IDMS法对内标肽段进行了含量测定,因此抗体的含量值可以通过肽段再逐步溯源到国家氨基酸标准物质,最后溯源到 SI单位制,保证了定量结果的准确可靠。
(2)本发明建立的抗体蛋白质定值方法,标准物质具有量值溯源性,含量测定结果可以直接溯源到SI单位。
(3)本发明所建立的用于定值的三条特征肽段:ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK,均来源于人源IgG恒定区,可应用于所有含有这几条特征肽段的IgG抗体的同位素稀释质谱法定值。
(4)本发明所建立的抗体蛋白酶切方法不需要进行蛋白质样品的还原、烷基化以及样品脱盐处理,极大地简化了样品前处理的复杂性,同时可以高效地酶切出目标特征肽段。
下面结合附图说明和具体实施例对本发明所述的基于肽段同位素稀释质谱法的IgG抗体定值方法作进一步说明。
附图说明
图1为3条标准肽段在1.96~4.2μM之间的色谱图与标准曲线;其中,A为肽段AK-8;B为肽段GK-12;C为肽段DK-14。
图2为酶解条件的优化;其中,A为酶解时间的优化;B为酶使用量的优化。
图3为酶解后特征性肽段在AB5500中MRM色谱保留峰。
图4为不同反应体系下酶解产物色谱图,其中,A为优化前酶切反应体系;B为优化后酶切反应体系。
具体实施方式
实施例1
基于肽段同位素稀释质谱法对2019-nCoV新型冠状病毒刺突糖蛋白(S蛋白)人源IgG 单克隆抗体(新冠S蛋白人源IgG单抗)的定值,基于该方法定值的IgG抗体纯度需在90%以上,且不含有其他非目标人源IgG杂质,具体包括如下步骤:
(1)特征肽段选择
选择ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK三条肽段为基于肽段同位素稀释质谱法的新冠S蛋白人源IgG单抗定值的特征肽段,序列如SEQ ID NO:1-3所示;
(2)合成用于新冠S蛋白人源IgG单抗蛋白定量的特性肽段
通过化学合成的方式得到三条特征肽段:ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK,以及三条同位素标记肽段:AL*PAPIEK,GPSVFPL*APSSK, DSTYSL*SSTLTLSK,合成的肽段HPLC纯度需大于98%。
(3)特征肽段纯度的准确测定
将合成的肽段水解成氨基酸,定量添加同位素标记氨基酸,以国家氨基酸标准物质为标准建立高效液相色谱-同位素稀释质谱方法测定水解液中稳定氨基酸含量,并据此计算特征肽段纯度。对于特征肽段ALPAPIEK,用于定量的氨基酸为亮氨酸(L)和异亮氨酸(I);对于特征肽段GPSVFPLAPSSK,用于定量的氨基酸为缬氨酸(V)和亮氨酸(L);对于特征肽段 DSTYSLSSTLTLSK,用于定量的氨基酸为亮氨酸(L)。
(4)特征肽段质谱参数的优化
特征肽段质谱分析离子对的确定需要对特征性肽段质谱参数进行优化,一是分析合成的标记和非标记特征肽段的母离子和子离子,调节碰撞能量选择信号最强的离子确定为定量离子对。选择以下MRM离子对:ALPAPIEK(420→654),AL*PAPIEK(423→654),DSTYSLSSTLTLSK(752→836),DSTYSL*SSTLTLSK(755→836),GPSVFPLAPSSK (594→418),GPSVFPL*APSSK(597→418)。二是对定量离子对的各质谱参数进行优化,使其质谱响应最强。
(5)特征肽段液质分析
采用液相系统串联质谱对特征肽段进行质谱分析,流动相A:98%水,2%乙腈,0.1%甲酸,流动相B:98%乙腈,2%水,0.1%甲酸,流速200nL/min,流动相B 5min 5%,30min10%, 31min 100%,35min 100%,36min 5%,48min 5%;质谱采用正离子方式检测;扫描方式为多反应监测(MRM)。
(6)特征肽段线性范围的确定
将三条特征肽段分别配成2.8μM的肽段溶液,将合成的标记肽段溶液与各浓度标准肽段溶液按质量比0.5-1.5充分混合,根据标准肽段与标记肽段峰面积比为参考,计算标准肽段在浓度范围1.96~4.2μM之间的线性,R
图1显示三条标准肽段浓度在1.96~4.2μM之间,线性均较好,R2≥0.998。
(7)配置添加内标的新冠S蛋白人源IgG单抗蛋白溶液和标准肽段溶液
准确称量待测体积的新冠S蛋白人源IgG单抗蛋白溶液,加入并称量相应体积的同位素内标溶液;使特征肽段与内标肽段摩尔比为1:1;按溶液中所含新冠S蛋白人源IgG单抗蛋白质量,根据三条肽段的纯度计算酶切后所得三条目标肽段的质量,配制相应浓度标准肽段及同位素内标肽段;
(8)新冠S蛋白人源IgG单抗蛋白的酶切条件优化
重量法称取内标肽段储备液配置内标肽段的混合液,使混合液中每条肽段的摩尔浓度与抗体酶解后各肽段的摩尔浓度相等。再用重量法将抗体蛋白溶液与内标肽段混合液按1:1质量比混合。在不同条件下,酶切效率高低以酶解特征性肽段与内标肽段的峰面积比为参考依据,每个样品重复测定三次,并根据三次重复的结果计算平均值和标准方差。如图2所示,显示了对酶切时间和酶使用量的优化。
(9)新冠S蛋白人源IgG单抗蛋白酶切
取新冠S蛋白人源IgG单抗蛋白溶液与内标肽段混合液按1:1质量比混合,然后用等质量水稀释一倍后,按照体积比3:1加入乙腈;加入Lys-C蛋白酶(1:50)37℃反应16h。再按照酶的质量/总蛋白质量(w/w)=1:25,加入胰蛋白酶液37℃酶切24小时,在酶切时间点为4、8、12小时样品中补加胰蛋白酶液。
采用真空离心浓缩法对样品进行浓缩,用0.1mL 0.1%甲酸溶液复溶,上机进行液相质谱检测。酶解后特征性肽段在AB5500中MRM色谱保留峰如图3所示。
(10)新冠S蛋白人源IgG单抗蛋白样品中特征肽段含量的计算
根据下述公式,计算酶切溶液中ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK的含量,
式中:c-为样品中ALPAPIEK(GPSVFPLAPSSK或DSTYSLSSTLTLSK)的含量(mg/g);m
I
I
R
R
M:样品质量(g);
P:ALPAPIEK(GPSVFPLAPSSK或DSTYSLSSTLTLSK)的纯度。
根据新冠S蛋白人源IgG单抗的分子量149.2KDa和特征肽段的分子量计算溶液中新冠S 蛋白人源IgG单抗蛋白的浓度作为新冠S蛋白人源IgG单抗标准物质的定值结果。基于肽段分析的IDMS法对新冠S蛋白人源IgG单抗的定值结果如下表1所示。
表1基于肽段分析的IDMS法对新冠S蛋白人源IgG单抗的含量测定结果(ug/g)
实施例2
基于肽段同位素稀释质谱法对anti-CD20 IgG单克隆抗体(anti-CD20 IgG单抗)的定值,基于该方法定值的IgG抗体纯度需在90%以上,且不含有其他非目标人源IgG杂质,具体包括如下步骤:
(1)特征肽段选择
选择ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK三条肽段为基于肽段同位素稀释质谱法的anti-CD20 IgG单抗定值的特征肽段,序列如SEQ ID NO:1-3所示;
anti-CD20 IgG单抗(序列如SEQ ID NO:7-8所示)以及特征肽段的位置如下所示:
轻链:
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPA RFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPITFGQGTRLEIKRTVAAPSVFIFPPSDEQL KSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSK
重链:
EVQLVESGGGLVQPGRSLRLSCAASGFTFNDYAMHWVRQAPGKGLEWVSTISWNSGS IGYADSVKGRFTISRDNAKKSLYLQMNSLRAEDTALYYCAKDIQYGNYYYGMDVWGQGT TVTVSSASTK
(2)合成用于anti-CD20 IgG单抗蛋白定量的特性肽段
通过化学合成的方式得到三条特征肽段:ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK,以及三条同位素标记肽段:AL*PAPIEK,GPSVFPL*APSSK, DSTYSL*SSTLTLSK。合成的肽段HPLC纯度需大于98%。
(3)特征肽段纯度的准确测定
将合成的肽段水解成氨基酸,定量添加同位素标记氨基酸,以国家氨基酸标准物质为标准建立高效液相色谱-同位素稀释质谱方法测定水解液中稳定氨基酸含量,并据此计算特征肽段纯度。对于特征肽段ALPAPIEK,用于定量的氨基酸为亮氨酸(L)和异亮氨酸(I);对于特征肽段GPSVFPLAPSSK,用于定量的氨基酸为缬氨酸(V)和亮氨酸(L);对于特征肽段 DSTYSLSSTLTLSK,用于定量的氨基酸为亮氨酸(L)。
(4)特征性肽段质谱参数的优化
特征肽段质谱分析离子对的确定需要对特征性肽段质谱参数进行优化,一是分析合成的标记和非标记特征肽段的母离子和子离子,调节碰撞能量选择信号最强的离子确定为定量离子对。选择以下MRM离子对:ALPAPIEK(420→654),AL*PAPIEK(423→654),DSTYSLSSTLTLSK(752→836),DSTYSL*SSTLTLSK(755→836),GPSVFPLAPSSK (594→418),GPSVFPL*APSSK(597→418)。二是对定量离子对的各质谱参数进行优化,使其质谱响应最强。
(5)特征肽段液质分析
采用液相系统串联质谱对特征肽段进行质谱分析,流动相A:98%水,2%乙腈,0.1%甲酸,流动相B:98%乙腈,2%水,0.1%甲酸,流速200nL/min,流动相B 5min 5%,30min10%, 31min 100%,35min 100%,36min 5%,48min 5%;质谱采用正离子方式检测;扫描方式为多反应监测(MRM)。
(6)特征肽段线性范围的确定:
将三条特征肽段分别配成2.8μM的肽段溶液,将合成的标记肽段溶液与各浓度标准肽段溶液按质量比0.5-1.5充分混合,根据标准肽段与标记肽段峰面积比为参考,计算标准肽段在浓度范围1.96~4.2μM之间的线性,R
(7)配置添加内标的人源IgG抗体蛋白溶液和标准肽段溶液
准确称量待测体积的人源IgG抗体蛋白溶液,加入并称量相应体积的同位素内标溶液;使特征肽段与内标肽段摩尔比为1:1;按溶液中所含人源IgG抗体蛋白质量,根据三条肽段的纯度计算酶切后所得三条目标肽段的质量,配制相应浓度标准肽段及同位素内标肽段。
(8)anti-CD20 IgG单抗的酶切条件优化
重量法称取内标肽段储备液配置内标肽段的混合液,使混合液中每条肽段的摩尔浓度与抗体酶解后各肽段的摩尔浓度相等。再用重量法将抗体蛋白溶液与内标肽段混合液按1:1质量比混合。在不同条件下,酶切效率高低以酶解特征性肽段与内标肽段的峰面积比为参考依据,每个样品重复测定三次,并根据三次重复的结果计算平均值和标准方差。
(9)anti-CD20 IgG单抗蛋白酶切
取anti-CD20 IgG单抗蛋白溶液与内标肽段混合液按1:1质量比混合,然后用等质量水稀释一倍后,按照体积比3:1加入乙腈;加入Lys-C蛋白酶(1:50)37℃反应16h。再按照酶的质量/总蛋白质量(w/w)=1:25,加入胰蛋白酶液37℃酶切24小时,在酶切时间点为4、8、 12小时样品中补加胰蛋白酶液。
(10)anti-CD20 IgG单抗蛋白样品中特征肽段含量的计算
根据下述公式,计算酶切溶液中ALPAPIEK,GPSVFPLAPSSK,DSTYSLSSTLTLSK,的含量,
式中:c-为样品中ALPAPIEK(GPSVFPLAPSSK或DSTYSLSSTLTLSK)的含量(mg/g);m
I
I
R
R
M:样品质量(g);
P:ALPAPIEK(GPSVFPLAPSSK或DSTYSLSSTLTLSK)的纯度。
根据anti-CD20 IgG单抗蛋白的分子量148.7KDa和特征肽段的分子量计算溶液中anti-CD20 IgG单抗蛋白的浓度作为anti-CD20 IgG单抗标准物质的定值结果。基于肽段分析的IDMS法对anti-CD20 IgG单抗的定值结果如下表2所示。
表2基于肽段分析的IDMS法对anti-CD20 IgG单抗的含量测定结果(mg/g)
本发明方法中对IgG抗体的酶切条件进行了优化,为突出此优化的有益效果,还进行了以下对比例实验。
对比例
分别采用常规酶切方法和优化后的酶切条件对实施例1中的2019-nCoV新型冠状病毒刺突糖蛋白(S蛋白)人源IgG单克隆抗体进行了酶切。
常规酶切方法:用50mM的碳酸氢铵将样本稀释至1mg/mL,取单抗蛋白10ug(1mg/mL,10μL),加入1%Rapigest 1.1ul,混匀,60℃变性30min;100mmol/L DTT 1.2μL,混匀,56℃孵育45min;反应结束后,加入500mmol/L IAM 1.4μL,室温避光反应30min;加入DTT4.1ul 终止IAM。变性还原烷基化后,样本加胰蛋白酶液(1:25)37℃反应24h。
采用优化后的酶切条件:取人源IgG抗体蛋白溶液与内标肽段混合液按1:1质量比混合,然后用等质量水稀释一倍后,按照体积比3:1加入乙腈;加入Lys-C蛋白酶(1:50)37℃反应16h。再按照酶的质量/总蛋白质量(w/w)=1:25,加入胰蛋白酶液37℃酶切24小时,在酶切时间点为4、8、12小时样品中补加胰蛋白酶液。
由图4可以看出,50mM NH
以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
序列表
<110> 中国计量科学研究院
<120> 一种基于肽段同位素稀释质谱法的IgG抗体定值方法
<130> DS201-053
<160> 8
<170> SIPOSequenceListing 1.0
<210> 1
<211> 8
<212> PRT
<213> 特征肽段1(Artificial Sequence)
<400> 1
Ala Leu Pro Ala Pro Ile Glu Lys
1 5
<210> 2
<211> 12
<212> PRT
<213> 特征肽段2(Artificial Sequence)
<400> 2
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10
<210> 3
<211> 14
<212> PRT
<213> 特征肽段3(Artificial Sequence)
<400> 3
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
1 5 10
<210> 4
<211> 107
<212> PRT
<213> 轻链恒定区(Artificial Sequence)
<400> 4
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 5
<211> 330
<212> PRT
<213> 重链恒定区1(Artificial Sequence)
<400> 5
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 6
<211> 329
<212> PRT
<213> 重链恒定区2(Artificial Sequence)
<400> 6
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 7
<211> 214
<212> PRT
<213> anti-CD20 IgG单抗轻链(Artificial Sequence)
<400> 7
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Ile
85 90 95
Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 8
<211> 450
<212> PRT
<213> anti-CD20 IgG单抗重链(Artificial Sequence)
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Lys Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Ile Gln Tyr Gly Asn Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Glu Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly
450
- 一种基于肽段同位素稀释质谱法的IgG抗体定值方法
- 一种基于肽段同位素稀释质谱法的IgG抗体定值方法
