一种细菌细胞膜/DNA四面体复合物及其制备方法和用途
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物药物技术领域,具体涉及一种细菌细胞膜/DNA四面体复合物及其制备方法和用途。
背景技术
大量研究表明,自组装合成的DNA四面体作为一种新型的核酸纳米药物,能够促进多种干细胞(脂肪干细胞、骨髓干细胞、神经干细胞等)再生,并且其自身的抗炎抗氧化功能也使其可以应用于多种疾病的治疗中。此外,这种三维的四面体结构拥有出色的生物安全性及灵活的可编辑性且可以被多数细胞通过内吞途径摄取。因此,DNA四面体常被用作药物载体,多种核酸序列(适配体、siRNA、microRNA等)及化疗药物(紫杉醇、阿霉素等)被孵育、化学连接或者其他方式负载于其上,并被大量携载入细胞从而发挥相应作用。
公告号为CN109663134B的专利申请公开了采用DNA四面体载5-氟尿嘧啶和AS1411,其抗癌效果显著著强于5-氟尿嘧啶,并且安全性更好。5-氟尿嘧啶是作为最常见的尿嘧啶抗代谢类药物,进入体内后,转化成为氟尿嘧啶脱氧核苷酸(F-dUMP),与胸苷酸合成酶的活性中心共价结合,抑制其酶活性,从而使脱氧核苷酸缺乏,影响DNA合成。此外,氟尿嘧啶核苷(FUMP)能够以伪代谢物形式掺入DNA和RNA中影响细胞功能产生细胞毒性。AS1411是由26个碱基组成的富含鸟嘌呤的寡核苷酸序列,它可以形成G-四联体,不仅可以特异性地与肿瘤细胞核膜上高表达的核仁素相结合,起到核酸适配体的作用,还可以通过与核仁素形成复合物,引起核仁素再分配,抑制核糖体的生物合成并诱导肿瘤细胞的凋亡。AS1411和5-氟尿嘧啶修饰的DNA四面体同时具有肿瘤细胞靶向性及杀伤性,首先通过AS1411靶向肿瘤细胞,DNA四面体将5-氟尿嘧啶携载入肿瘤细胞并释放,影响肿瘤细胞DNA及RNA的合成,发挥肿瘤细胞的杀伤作用。
新的研究表明,微生物存在于肿瘤细胞和免疫细胞内,表明这些微生物可以影响肿瘤微环境的状态。肿瘤组织的微生物与正常组织的微生物明显不同,某些微生物在肿瘤组织中特异性聚集,使其成为强大的治疗靶点。
肿瘤与肿瘤微环境密切相关,肿瘤可以通过释放细胞信号分子影响其微环境,促进血管的生成和诱导免疫耐受,而微环境中的免疫细胞可影响癌细胞的增长和发育。肿瘤微环境是指肿瘤细胞存在的周围微环境,包括周围的血管、免疫细胞、成纤维细胞、骨髓源性炎性细胞、各种信号分子和细胞外基质。肿瘤微环境通常呈现整体缺氧及酸性环境,肿瘤及周围组织细胞会大量凋亡,导致炎症浸润及炎症因子分泌,且肿瘤本身的发生发展也会引发相应的免疫反应。T细胞作为细胞免疫的主体类群,在肿瘤免疫细胞杀伤中具有重要作用。而在肿瘤微环境中,T细胞中CD8阳性T亚型可以对肿瘤细胞造成杀伤作用。
经AS1411和5-氟尿嘧啶共同修饰的DNA四面体是一种新型的DNA纳米药物,它同时具有肿瘤细胞靶向性及杀伤性:首先通过DNA适配体AS1411靶向肿瘤细胞,DNA四面体药物运输载体将5-氟尿嘧啶携载入肿瘤细胞并释放,影响肿瘤细胞DNA及RNA的合成,发挥肿瘤细胞的杀伤作用。体外应用时,其对肿瘤细胞有较为理想的杀伤作用,但应用于体内时,药物对肿瘤的浸润性差,聚集于肿瘤组织的药物浓度较低,导致其对实体瘤的生长抑制作用欠佳。同时,AS1411和5-氟尿嘧啶共同修饰的DNA四面体不能影响肿瘤微环境的免疫细胞,起到免疫增强的作用。
发明内容
尽管5-氟尿嘧啶和AS1411修饰的DNA四面体在体外具有较为理想的肿瘤细胞毒性,但应用于体内肿瘤时,由于药物的肿瘤浸润性较差,而对实体瘤的治疗效果不好。为了解决上述问题,本发明提供了一种细菌细胞膜/DNA四面体复合物及其制备方法和用途。本发明针对DNA四面体药物肿瘤浸润性差,体内应用效果不理想的问题,以细菌细胞膜为载体,借细菌细胞膜对肿瘤外聚集的细菌生物膜的天然趋化性,将四面体药物运载至肿瘤组织,并精准作用于肿瘤细胞,提高四面体药物在体内的药物疗效。
本发明提供了一种细菌细胞膜/DNA四面体复合物,它是将细菌细胞膜作为药物载体,载DNA四面体后得到的复合物。
进一步地,所述复合物是将细菌和DNA四面体混合孵育后得到的复合物。
进一步地,所述孵育时细菌浓度为10
进一步地,所述孵育时细菌浓度为10
进一步地,所述孵育的温度为37℃;和/或,所述孵育的时间为10~30min;
优选地,所述孵育的时间为15min。
进一步地,所述孵育后还包括提纯,步骤如下:离心,收集沉淀,戊二醛溶液固定,洗涤,再次离心;
优选地,所述离心的条件为8000~10000rpm离心5~10min;
和/或,所述戊二醛溶液的浓度为2~5%;
和/或,所述固定的时间为10~30min。
进一步地,
所述细菌为变异链球菌;
和/或,所述DNA四面体由四条DNA单链自组装合成;所述四条DNA单链的核苷酸序列分别如SEQ ID NO.1、SEQ ID NO.2、SEQ ID NO.3和SEQ ID NO.5所示;SEQ ID NO.3所示的核苷酸序列5’端连接5-氟尿嘧啶。
进一步地,所述DNA四面体的合成方法包括以下步骤:将四条DNA单链加入到TM缓冲液中,95℃维持10min,降温到4℃维持30min以上,即得;
优选地,所述四条DNA单链为等摩尔比的四条DNA单链。
本发明还提供了一种制备前述的细菌细胞膜/DNA四面体复合物的方法,它包括如下步骤:
(1)将细菌浓度调整至10
(2)将DNA四面体浓度调整至500~4000nM;
(3)将二者混合后孵育,即得;
优选地,步骤(1)中,将细菌浓度调整至10
和/或,步骤(2)中,将DNA四面体浓度调整至2000nM;
和/或,步骤(3)中,所述孵育的温度为37℃;和/或,所述孵育的时间为10~30min;
和/或,步骤(3)中,所述孵育后还包括提纯,步骤如下:离心,收集沉淀,戊二醛溶液固定,洗涤,再次离心;
更优选地,步骤(3)中,所述孵育的时间为15min;
和/或,步骤(3)中,所述离心的条件为8000~10000rpm离心5~10min;
和/或,所述戊二醛溶液的浓度为2~5%;
和/或,所述固定的时间为10~30min。
本发明还提供了前述的细菌细胞膜/DNA四面体复合物在制备抗肿瘤药物中的用途;
优选地,所述肿瘤为人口腔鳞癌。
本发明还提供了一种抗肿瘤药物,它是以前述的细菌细胞膜/DNA四面体复合物为活性成分,加上药学上可接受的辅料制备而成。
与现有技术相比,本发明的有益效果为:
本发明基于DNA四面体纳米药物,将细菌细胞膜作为药物载体,利用细菌细胞膜对细菌肿瘤生物膜的天然趋化性,将DNA四面体纳米药物运送至特异性聚集于肿瘤周围的细菌生物膜上,同时释放药物,使其能够精准应用于肿瘤细胞。本发明细菌细胞膜优选变异链球菌细胞膜。本发明不仅拥有良好的肿瘤生物膜趋化性,大大增强了药物对实体瘤的浸润性,并且细菌载体能够影响肿瘤微环境的免疫细胞,起到免疫增强作用,最终增强了药物对肿瘤生长的抑制作用。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
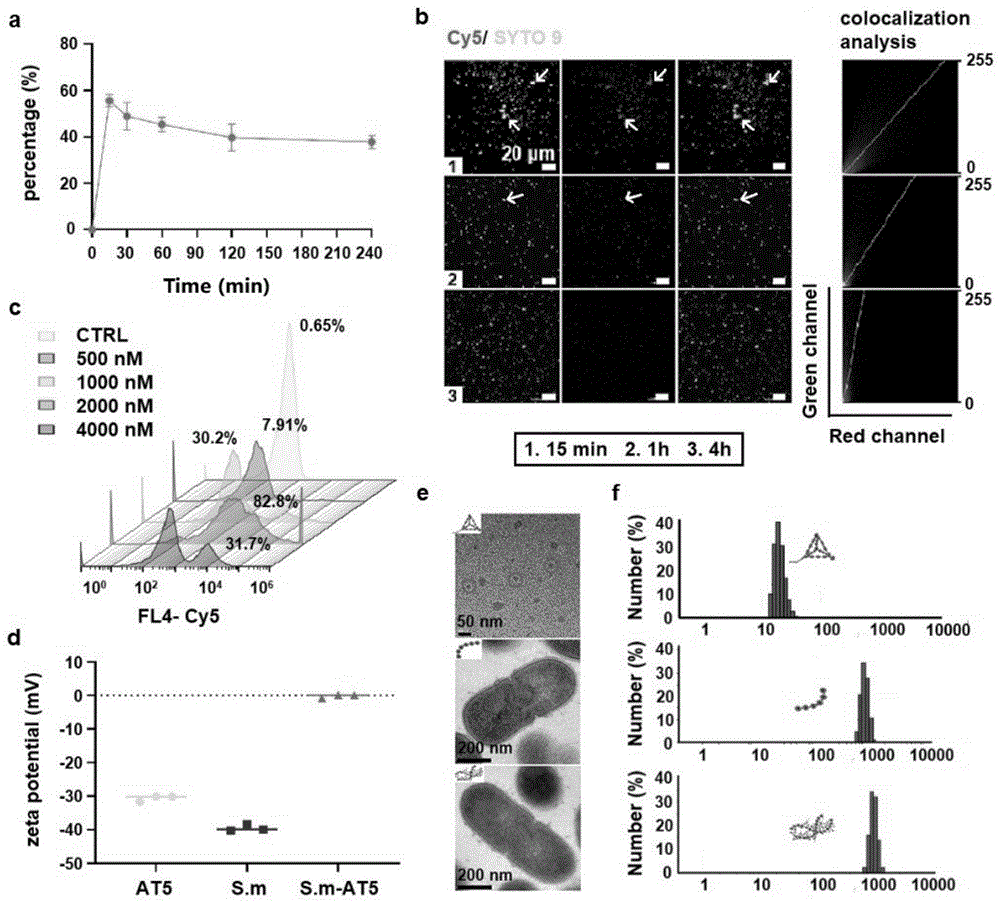
图1为变异链球菌细胞膜携载的DNA纳米药物的鉴定结果:a为荧光定量法选择最佳反应时间的结果;b为免疫荧光染色观察变异链球菌与DNA纳米药物的共定位情况结果;c为流式细胞术选择AT5的工作浓度结果;d为AT5、单纯细菌(S.m)及S.m-AT5的Zeta电位结果;e为透射电镜及免疫电镜对材料形态的表征结果;f为动态光散射对材料大小的表征结果。
图2为变异链球菌细胞膜携载的DNA纳米药物的有效性和安全性结果:a为小动物活体成像检测不同材料在小鼠体内的代谢时间结果;b为菌落培养观察材料在体内的分布情况;c为菌落培养观察材料在体内的分布情况统计图;d为溶血实验检测材料的溶血性结果;e为溶血性结果统计图。
图3为体外实验证明本发明药物在肿瘤细胞中的摄取结果:a为免疫荧光检测S.m-AT5的肿瘤生物膜趋化性及AT5的释放结果;b为用于体外研究的Transwell模型;c为免疫荧光观察人口腔鳞癌细胞(SCC25)对S.m-AT5的摄入情况。
图4为变异链球菌细胞膜携载的DNA纳米药物的细胞毒性检测结果:a为用于体外研究的Transwell模型;b为CCK-8实验检测结果;c为流式细胞术检测细胞周期的统计结果;d为流式细胞术检测细胞凋亡的统计结果;e为免疫印迹法检测细胞的蛋白表达结果;f,g为免疫印迹法检测细胞的蛋白表达结果统计柱状图;h,i为免疫荧光染色检测细胞的蛋白表达水平。
图5为流式细胞术检测结果:a为流式细胞术检测细胞周期结果;b为流式细胞术检测细胞凋亡结果。
图6为本发明药物的动物实验结果:a为荷瘤动物治疗模型示意图;b为免疫荧光观察药物的肿瘤浸润性结果;c为实体瘤拍照测量结果;d为肿瘤体积计算结果;e为小鼠生存率结果;f为H&E染色结果;g为TUNEL染色结果。
图7为本发明药物的肿瘤微环境研究结果:a为流式细胞术分选成熟树突状细胞结果;b为流式细胞术分选成熟树突状细胞统计柱状图;c为免疫荧光染色观察CD11c表达结果;d为流式细胞术分选具有抗原呈递能力的成熟树突状细胞;e为流式细胞术分选具有抗原呈递能力的成熟树突状细胞统计图;f为流式细胞术分选肿瘤浸润的CD3和CD8细胞;g为流式细胞术分选肿瘤浸润的CD3和CD8细胞统计图;h为免疫荧光染色观察肿瘤浸润的CD4及CD8表达结果;i为免疫荧光染色观察肿瘤浸润的淋巴结中CD4及CD8表达结果;j为流式细胞术分选小鼠外周血中效应记忆T细胞(Tem)及中央记忆T细胞(Tcm)的比例;k为流式细胞术分选小鼠外周血中效应记忆T细胞(Tem)及中央记忆T细胞(Tcm)的比例统计图;l为免疫荧光染色观察肿瘤中中性粒细胞的浸润情况。
具体实施方式
本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
实施例1、本发明细菌细胞膜/DNA四面体复合物的制备
1、5-氟尿嘧啶和AS1411修饰的DNA四面体的制备
按照公告号为CN109663134B的专利记载的方法制备,方法如下:
制备DNA四面体的四条单链分别为S1、S2、S3和S4-AS1411;其中,S3链的5’端连接5-氟尿嘧啶(5-FU);S4-AS1411为S4链的5’端连接AS1411而得。单链S1、S2、S3、S4、S4-AS1411和AS1411的序列如表1所示,表中序列小写部分为AS1411序列。
表1.序列表
/>
将四条浓度为1M的单链S1、S2、S3和S4-AS1411各1微升,加入到96微升含MgCl
将S1链5’端连接Cy5,标记为S1-Cy5,按照上述方法将S1替换为S1-Cy5,可制备得到Cy5标记的DNA四面体药物。
2、变异链球菌膜/DNA四面体复合物的合成
将处于对数生长期的变异链球菌收集起来,并将浓度调整至10
3、鉴定
(1)按照上述方法将AT5与变异链球菌孵育,改变孵育时间。采用荧光定量法选择DNA纳米药物与变异链球菌孵育的最佳时间。通过计算不同时间点反应体系中上清的DNA浓度,与最初DNA的2000nM比较,经计算得到不同反应时间下DNA药物的结合率。
结果如图1a所示:15min时,可得到最多约57.5%的AT5结合于变异链球菌细胞膜上,因此将15min作为最佳结合时间。
(2)采用免疫荧光染色观察变异链球菌与DNA纳米药物的共定位情况:用Cy5对AT5进行标记(Cy5对S1链进行标记,然后按照上述方法制备Cy5标记的AT5),同时SYTO 9对变异链球菌进行活菌染色,按照上述方法将AT5和变异链球菌进行孵育,观察二者孵育15min、1h及4h时,细菌与药物的结合情况。
结果如图1b所示:15min时,可观测到的AT5与变异链球菌的共定位最多,与图1a结果相符。
(3)流式细胞术选择AT5的工作浓度:将Cy5标记的AT5制备成500,1000,2000,4000nM的浓度梯度,按照上述方法制备复合物,分别检测其与变异链球菌细胞膜的结合比率。
结果如图1c所示:当AT5浓缩至2000nM时,它与细菌的结合率高达82.8%,因此选择2000nM作为工作浓度。
(4)检测AT5、单纯变异链球菌(S.m)及S.m-AT5的zeta电位。
结果如图1d所示:AT5作为DNA材料,表现出负电位,变异链球菌作为细菌也表现为负电,而S.m-AT5则为弱负电,代表了二者的结合。
(5)透射电镜及免疫电镜对材料形态进行表征
结果如图1e所示:AT5的形状在透射电镜下呈近似三角形形状,粒径大小在20nm范围内,细菌(S.m)及S.m-AT5形态相似,粒径大小均在1000nm左右。
(6)动态光散射对材料大小进行表征
结果如图1f所示:与透射电镜结果一致,AT5粒径大小为19.15nm,而细菌(S.m)及S.m-AT5粒径分别为1125.09nm and 1132.18nm。
4、有效性和安全性
(1)利用小动物活体成像检测不同材料(Cy5标记的AT5以及Cy5标记的S.m-AT5)在小鼠体内的代谢时间:将Cy5标记的药物局部注射之后(balb/c雄性荷瘤小鼠,以500nM浓度局部注射于小鼠口角颊粘膜下),将小鼠放入小动物活体成像仪。
结果如图2a所示:AT5在局部注射4小时内被迅速代谢至肝脏,12小时后排出体外;而S.m-AT5在局部注射12小时后,部分代谢至肝脏,仍有部分存留于肿瘤内。
(2)菌落培养观察材料在体内的分布情况:使用balb/c雄性荷瘤小鼠,以500nM浓度局部注射于小鼠口角颊粘膜下,完成药物注射5次后(其中CTRL组注射生理盐水),在疗程的第17天,收集小鼠心肝脾肺肾及肿瘤并制备成匀浆,与细菌固体培养基混合,于细菌琼脂平板上培养细菌24h,计数细菌菌落数量并进行统计。
结果如图2b和2c所示:局部注射导致材料大部分聚集于肿瘤组织内,其次更多位于肾脏内,其他脏器较少,预示了药物对其他脏器的生物安全性。
(3)溶血实验检测材料的溶血性:采用定量比色法测定血液接触纳米粒子(Cy5标记的AT5以及Cy5标记的S.m-AT5)后,全血中血红蛋白(total blood hemoglobin,TBH)和释放到血浆中的自由血红蛋白((plasma free hemoglobin,PFH)的含量。血红蛋白及其诱导剂,除硫血红蛋白外,血红蛋白在强碱中会被铁氰化物氧化为高铁血红蛋白。高铁血红蛋白再与氰化物(Drabkin’s溶液)继续反应会生成氰化正铁血红蛋白。分光光度计在540nm处可检测到氰化正铁血红蛋白。用血红蛋白标准品建立标准曲线,浓度范围从0.025至0.80mg/mL,并制备低(0.0625mg/mL)、中(0.125mg/mL)、高(0.625mg/mL)三个浓度的质量控制样品来监测实验。实验结果表示为溶血百分比,可以用来评估纳米粒子的体外急性溶血性质。
结果如图2d和2e所示:与阳性对照(PC)对比,AT5和S.m-AT5都基本未表现溶血性。
以下通过具体试验例证明本发明的有益效果。
试验例1、体外实验证明本发明复合物在肿瘤细胞中的摄取
本试验例中使用的AT5和S.m-AT5的制备方法同实施例1。
(1)免疫荧光检测S.m-AT5的肿瘤生物膜趋化性及AT5的释放:使用Alexa Fluor647标记生物膜胞外多糖,AMCA标记AT5,SYTO 9标记细菌。将AMCA及SYTO 9共同标记的S.m-AT5加入生物膜中,在共聚焦显微镜下层扫,观察从2h,6h至12h,24h,S.m-AT5趋化至生物膜及AT5的逐步释放。
结果如图3a所示:可见代表S.m-AT5的绿色荧光聚集至肿瘤生物膜表面,代表AT5的蓝色荧光逐渐增多,意味着AT5的逐步释放,证明2h至24h释放量逐步增多。
(2)图3b为用于体外研究的Transwell模型。
(3)免疫荧光观察人口腔鳞癌细胞(SCC25)对S.m-AT5的摄入:将肿瘤生物膜培养于Transwell的上层小室,细胞种于Transwell下层孔板,24h后,将Cy5标记的S.m-AT5加入上层生物膜,共聚焦显微镜下观察下层孔板中的细胞摄入药物情况,得出6h,18h及30h后SCC25细胞对S.m-AT5的摄入情况。
结果如图3c所示:可见由6h至30h,红色荧光数量增多证明细胞对S.m-AT5摄取逐渐增多,30h时最多。
上述实验结果表明本发明复合物具有能够趋化至肿瘤周围细菌生物膜,并逐步释放药物,进而增长肿瘤细胞对药物的摄入的特性。
试验例2、体外本发明复合物的细胞试验
本试验例中使用的AT5和S.m-AT5的制备方法同实施例1。
(1)CCK-8实验检测不同时间点药物对肿瘤细胞的毒性作用:同样通过Transwell模型,上层小室为肿瘤生物膜及后加入的药物,下层为肿瘤细胞(SCC25)。分别将细胞用药物处理24h、48h和72h,之后向下层细胞中加入CCK-8检测液孵育1-4h,酶标仪测量各孔在波长450nm下的吸光度。
结果如图4b所示:经统计,SCC25细胞在72h时,S.m-AT5的药物处理效果最显著。
(2)流式细胞术检测细胞周期:细胞经药物处理72h之后,收集下层小室中的细胞,预冷的乙醇于-20℃固定1h,接着使用100μl RNase A重悬,37℃孵育20min,离心清洗后,400μl PI 4℃避光孵育20min,流式细胞仪检测波长为488nm下的细胞周期。
结果如图4c和5a所示:上机检测后,得出图5a,经统计得图4c,可见经S.m-AT5处理后,代表细胞增殖状态的S期的细胞明显减少,说明了S.m-AT5的细胞毒性。
(3)流式细胞术检测细胞凋亡:细胞经药物处理72h之后,收集细胞,将5μlAnnexin V和PI与binding buffer混合,避光染色15min后,上机检测。
结果如图4d和5b所示:根据上机检测后得到的图5b,统计而得图4d,可见代表细胞早期凋亡与晚期凋亡的两个象限(LR+UR),在S.m-AT5组占比最多,再次证明了S.m-AT5对细胞凋亡的促进作用
(4)免疫印迹法检测细胞的蛋白表达:细胞经药物处理48h之后,收集细胞,提取全蛋白,15% SDS-PAGE电泳分离蛋白,转膜封闭后,分别使用β-actin,annti-caspase-3(ab32351)和anti-cleaved caspase-3(#9661S)孵育过夜,次日二抗孵育一小时,TBST清洗后曝光。
结果如图4e、4f和4g所示:从条带分析结果,可见S.m-AT5组代表凋亡通路的caspase-3表达最低,而对应的cleaved caspase-3表达最高,证明了S.m-AT5的促细胞凋亡作用。
(5)免疫荧光染色检测细胞的蛋白表达水平:细胞经药物处理48h之后,弃去培养液,多聚甲醛固定25min,0.5% Triton X-100打孔,羊血清封闭,一抗孵育4℃过夜;次日复温一小时后二抗孵育,DAPI染细胞核,甘油封片后使用激光共聚焦机器观察采图。
结果如图4h和4i所示:可见S.m-AT5组代表凋亡通路的caspase-3荧光最弱,而对应的cleaved caspase-3荧光最强,证明了S.m-AT5的促细胞凋亡作用。
上述实验结果表明本发明复合物具有对肿瘤细胞较强的细胞毒性作用。
试验例3、本发明复合物的动物试验
本试验例中使用的AT5和S.m-AT5的制备方法同实施例1。
(1)荷瘤动物治疗模型示意图:将小鼠口腔鳞癌细胞(SCC7)种植于小鼠口角颊粘膜下,待肿瘤体积增至1cm
(2)免疫荧光观察药物的肿瘤浸润性:分别用syto 9染色的S.m,Cy5标记的AT5,及syto 9、Cy5共标记的S.m-AT5瘤周局部注射24h后,收集离体肿瘤、切片、DAPI染色,全程避光。
结果如图6b所示:红色荧光聚集于肿瘤边缘,代表AT5浸润肿瘤的范围很浅,肿瘤内部积累少。绿色荧光在瘤体表面大量沉积,代表单纯细菌内部浸润较少,而S.m-AT5组,红绿荧光均在瘤内出现,说明AT5的内部浸润情况更好。
(3)实体瘤拍照测量
结果如图6c所示:经过对比可以发现,S.m-AT5药物处理组肿瘤大小明显小于其他药物处理组,AT5次之。
(4)肿瘤体积计算:据上一步测量的肿瘤的长和宽,计算得出肿瘤体积=长x宽
结果如图6d所示:随着处理时间的增长,S.m-AT5处理组的肿瘤体积出现轻微增长。AT5处理组肿瘤增长比较明显,其他处理组的肿瘤体积均表现出明显增长。
(5)小鼠生存率:记录各组小鼠的死亡时间,直至剩下最后一只存活小鼠。
结果如图6e所示:至第75天,S.m-AT5组小鼠仍有半数生存,而AT5组在第75天生存率达28.6%,其他处理组小鼠在第18-30天内,仅剩半数生存。
(6)H&E染色:将肿瘤且切片固定、包埋、切片后,进行苏木精&伊红染色,在光镜下观察采图。
结果如图6f所示:在生理盐水、单纯四面体及5-氟尿嘧啶处理组均可以观察到明显的鳞癌角化珠,单纯细菌组可以观察到明显的核异型性,及AT5组异型性减少,而S.m-AT5组则是明显的组织坏死及淋巴细胞浸润。
(7)TUNEL染色:将石蜡切片脱蜡、脱水、蛋白酶K处理后,加入TUNEL检测液后荧光显微镜下观察。
结果如图6g所示:代表DNA断裂的FITC在AT5和S.m-AT5处理组中显现,且S.m-AT5中绿色荧光更多。
上述实验结果表明本发明复合物应用于小鼠体内,能够大且深入的浸润肿瘤组织,对肿瘤生长发挥抑制作用,同时本发明复合物使用时安全性好。
试验例4、本发明复合物的肿瘤微环境研究
本试验例中使用的AT5和S.m-AT5的制备方法同实施例1。按照试验例3所述方法处理小鼠后,进行如下研究。
(1)流式细胞术分选成熟树突状细胞:收集各处理组小鼠肿瘤浸润的淋巴结,研磨过筛后,使用CD45,CD11c,CD86,MHC II流式抗体对分离出来的淋巴细胞进行染色。
结果如图7a和7b所示:上机可得图7a,据统计可见代表成熟树突状细胞的CD45+/CD11c+比例,在S.m-AT5处理组中最高,说明S.m-AT5对肿瘤浸润树突状细胞的激活。
(2)免疫荧光染色观察CD11c表达:取各处理组小鼠肿瘤浸润的淋巴结,固定、包埋、切片染色。
结果如图7c所示:可见CD11c在S.m-AT5处理组中比例最高,结论同上。
(3)流式细胞术分选具有抗原呈递能力的成熟树突状细胞
结果如图7d和7e所示:上机检测后得图7d,统计可得代表成熟树突状细胞抗原呈递能力得CD86+/MHC II在S.m-AT5处理组中比例最高,进一步说明S.m-AT5对肿瘤浸润树突状细胞的激活。
(4)流式细胞术分选肿瘤浸润的CD3和CD8细胞:收集各处理组小鼠肿瘤,消化研磨差速离心,提取其中浸润的淋巴细胞,使用CD3,CD8流式抗体对分离出来的淋巴细胞进行染色。
结果如图7f和7g所示:CD3+T细胞代表了肿瘤浸润的全部免疫细胞,在单纯细菌及S.m-AT5组中明显增多,说明细菌的存在对肿瘤组织中的免疫细胞起到了免疫激活作用。CD8+T细胞代表了细胞毒性T细胞,也就是发挥肿瘤细胞杀伤性的T细胞,其比例S.m-AT5组中最高,说明S.m-AT5的免疫杀伤作用。
(5)免疫荧光染色观察肿瘤浸润的CD4及CD8表达:收集各处理组小鼠肿瘤,切片后使用CD4,CD8抗体对切片进行染色。
结果如图7h所示:代表了记忆T和细胞毒性T细胞的CD4及CD8在S.m-AT5处理组中表达量最高,证明S.m-AT5药物处理后,肿瘤自身的免疫激活作用。
(6)免疫荧光染色观察肿瘤浸润的淋巴结中CD4及CD8表达:收集各处理组小鼠肿瘤浸润的淋巴结,切片后使用CD4,CD8抗体对切片进行染色,
结果如图7i所示:CD4及CD8在S.m-AT5处理组中表达量最高,证明S.m-AT5药物处理后,肿瘤自身的免疫激活作用。
(7)流式细胞术分选小鼠外周血中效应记忆T细胞(Tem)及中央记忆T细胞(Tcm)的比例:眼球取血法取小鼠体内外周血,红细胞裂解后,使用使用CD3,CD8,CD44,CD62L流式抗体对分离出来的淋巴细胞进行染色。
结果如图7j和7k所示:位于外周血中的Tem(CD44+,CD62L-),在刺激后迅速分泌毒力因子发挥毒性作用,而Tcm(CD44+,CD62L+)转化为Tem发挥毒性作用。上机检测后可见,S.m-AT5处理后,Tem明显增多,而相对应的Tcm则减少,说明S.m-AT5对外周血中免疫细胞的激活作用。
(8)免疫荧光染色观察肿瘤中中性粒细胞的浸润情况:收集各处理组小鼠肿瘤,切片后使用CD11b,Ly6G抗体对切片进行染色。
结果如图7l所示:当细菌入侵时,中性粒细胞作为第一道防线迅速发挥吞噬作用。在单纯细菌及S.m-AT5处理组中,代表了中性粒细胞的的蛋白(CD11b和Ly6G)表达明显更多,说明S.m-AT5对中性粒细胞的激活作用。
上述实验结果表明本发明复合物对肿瘤浸润及肿瘤微环境中的免疫起到激活作用。
综上,本发明基于DNA四面体纳米药物,将细菌细胞膜作为药物载体,利用细菌细胞膜对细菌肿瘤生物膜的天然趋化性,将DNA四面体纳米药物运送至特异性聚集于肿瘤周围的细菌生物膜上,同时释放药物,使其能够精准应用于肿瘤细胞。本发明细菌细胞膜优选变异链球菌细胞膜。本发明不仅拥有良好的肿瘤生物膜趋化性,大大增强了药物对实体瘤的浸润性,并且细菌载体能够影响肿瘤微环境的免疫细胞,起到免疫增强作用,最终增强了药物对肿瘤生长的抑制作用。
