一种CAR-NK细胞制剂的制备方法
文献发布时间:2024-04-18 19:58:21
技术领域
本申请涉及智能化制备领域,且更为具体地,涉及一种CAR-NK细胞制剂的制备方法。
背景技术
CAR-NK细胞是一种具有广泛应用前景的免疫细胞疗法。通过将嵌合抗原受体(Chimeric Antigen Receptor,CAR)导入到自然杀伤细胞(Natural Killer cells,NK)中,CAR-NK细胞能够识别和杀伤肿瘤细胞,具有较高的抗肿瘤活性和选择性。
CAR-NK细胞是CAR-T细胞疗法的一种变种,相比于CAR-T细胞,CAR-NK细胞在效率、安全性和耐受性方面表现出一些优势。CAR-NK细胞的杀伤机制可以通过激活受体介导的信号通路来针对异质性恶性肿瘤,这有利于消除那些失去或下调了CAR靶向抗原表达的细胞,从而降低复发或耐药的风险。
在CAR-NK细胞的制备过程中,为了能够评估CAR-NK细胞的功能和特性,以确保CAR-NK细胞在治疗过程中的有效性和安全性,细胞的活性检测是至关重要的。通过进行CAR-NK细胞的活性评估,能够帮助筛选出具有理想抗肿瘤活性的CAR-NK细胞,从而优化对CAR-NK细胞的评估结果。然而,传统的细胞活性检测方法包括细胞增殖、细胞毒性和细胞分泌等功能性测定,但这些方法通常需要较长的时间和复杂的实验操作。
因此,期望一种优化的CAR-NK细胞制剂的制备方案。
发明内容
为了解决上述技术问题,提出了本申请。本申请的实施例提供了一种CAR-NK细胞制剂的制备方法。其可以快速、可靠的评估细胞活性,以优化CAR-NK细胞制剂的制备效率和质量。
根据本申请的一个方面,提供了一种CAR-NK细胞制剂的制备方法,其包括:
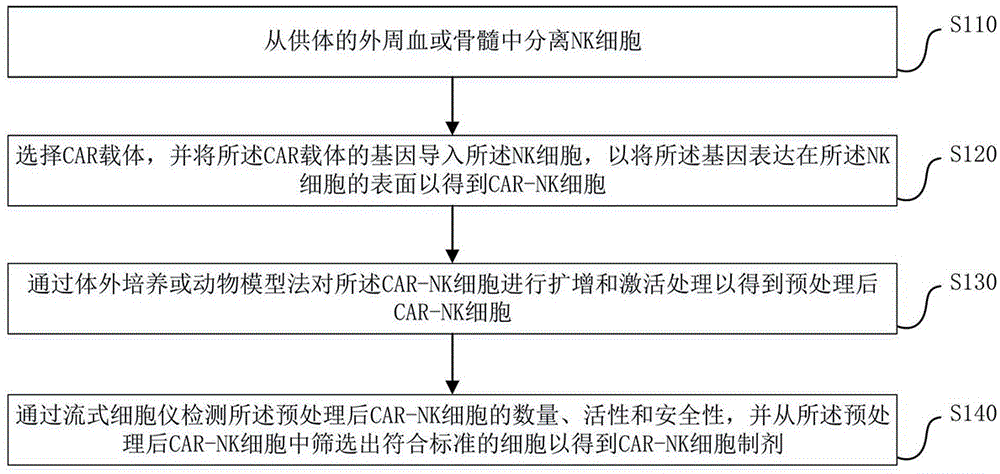
从供体的外周血或骨髓中分离NK细胞;
选择CAR载体,并将所述CAR载体的基因导入所述NK细胞,以将所述基因表达在所述NK细胞的表面以得到CAR-NK细胞;
通过体外培养或动物模型法对所述CAR-NK细胞进行扩增和激活处理以得到预处理后CAR-NK细胞;
以及通过流式细胞仪检测所述预处理后CAR-NK细胞的数量、活性和安全性,并从所述预处理后CAR-NK细胞中筛选出符合标准的细胞以得到CAR-NK细胞制剂。
与现有技术相比,本申请提供的CAR-NK细胞制剂的制备方法,其首先从供体的外周血或骨髓中分离NK细胞,接着,选择CAR载体,并将所述CAR载体的基因导入所述NK细胞,以将所述基因表达在所述NK细胞的表面以得到CAR-NK细胞,然后,通过体外培养或动物模型法对所述CAR-NK细胞进行扩增和激活处理以得到预处理后CAR-NK细胞,最后,通过流式细胞仪检测所述预处理后CAR-NK细胞的数量、活性和安全性,并从所述预处理后CAR-NK细胞中筛选出符合标准的细胞以得到CAR-NK细胞制剂。这样,可以快速、可靠的评估细胞活性,以优化CAR-NK细胞制剂的制备效率和质量。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,以下附图并未刻意按实际尺寸等比例缩放绘制,重点在于示出本申请的主旨。
图1为根据本申请实施例的CAR-NK细胞制剂的制备方法的流程图。
图2为根据本申请实施例的CAR-NK细胞制剂的制备方法的子步骤S140的流程图。
图3为根据本申请实施例的CAR-NK细胞制剂的制备方法的子步骤S140的架构示意图。
图4为根据本申请实施例的CAR-NK细胞制剂的制备方法的子步骤S142的流程图。
图5为根据本申请实施例的CAR-NK细胞制剂的制备方法的子步骤S143的流程图。
图6为根据本申请实施例的CAR-NK细胞制剂的制备系统的框图。
图7为根据本申请实施例的CAR-NK细胞制剂的制备方法的应用场景图。
图8为第一代、第二代和第三代CARs示意图。
图9为CAR结构设计的示意图。
图10为向NK细胞递送CAR结构的病毒和非病毒途径。
具体实施方式
下面将结合附图对本申请实施例中的技术方案进行清楚、完整地描述,显而易见地,所描述的实施例仅仅是本申请的部分实施例,而不是全部的实施例。基于本申请实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,也属于本申请保护的范围。
如本申请和权利要求书中所示,除非上下文明确提示例外情形,“一”、“一个”、“一种”和/或“该”等词并非特指单数,也可包括复数。一般说来,术语“包括”与“包含”仅提示包括已明确标识的步骤和元素,而这些步骤和元素不构成一个排它性的罗列,方法或者设备也可能包含其他的步骤或元素。
虽然本申请对根据本申请的实施例的系统中的某些模块做出了各种引用,然而,任何数量的不同模块可以被使用并运行在用户终端和/或服务器上。所述模块仅是说明性的,并且所述系统和方法的不同方面可以使用不同模块。
本申请中使用了流程图用来说明根据本申请的实施例的系统所执行的操作。应当理解的是,前面或下面操作不一定按照顺序来精确地执行。相反,根据需要,可以按照倒序或同时处理各种步骤。同时,也可以将其他操作添加到这些过程中,或从这些过程移除某一步或数步操作。
下面,将参考附图详细地描述根据本申请的示例实施例。显然,所描述的实施例仅仅是本申请的一部分实施例,而不是本申请的全部实施例,应理解,本申请不受这里描述的示例实施例的限制。
具体地,在本申请的技术方案中,提出了一种CAR-NK细胞制剂的制备方法,图1为根据本申请实施例的CAR-NK细胞制剂的制备方法的流程图。如图1所示,根据本申请实施例的CAR-NK细胞制剂的制备方法,包括步骤:S110,从供体的外周血或骨髓中分离NK细胞;S120,选择CAR载体,并将所述CAR载体的基因导入所述NK细胞,以将所述基因表达在所述NK细胞的表面以得到CAR-NK细胞;S130,通过体外培养或动物模型法对所述CAR-NK细胞进行扩增和激活处理以得到预处理后CAR-NK细胞;以及,S140,通过流式细胞仪检测所述预处理后CAR-NK细胞的数量、活性和安全性,并从所述预处理后CAR-NK细胞中筛选出符合标准的细胞以得到CAR-NK细胞制剂。
相应地,考虑到在实际进行CAR-NK细胞制剂的制备过程中,在进行CAR-NK细胞的活性检测时,利用所述流式细胞仪可以采集细胞表面标记物的荧光信号,这些信号可以提供关于细胞状态和功能的信息,有利于对于细胞活性进行判断检测。
基于此,本申请的技术构思为通过流式细胞仪采集检测标记物的荧光信号,并在后端引入图像的处理和分析算法来进行荧光信号的波形图分析,从而实现对CAR-NK细胞活性的自动准确评估,为CAR-NK细胞制备过程提供快速、可靠的细胞活性评估手段,以优化CAR-NK细胞制剂的制备效率和质量。
具体地,图2为根据本申请实施例的CAR-NK细胞制剂的制备方法的子步骤S140的流程图。图3为根据本申请实施例的CAR-NK细胞制剂的制备方法的子步骤S140的架构示意图。如图2和图3所示,根据本申请实施例的CAR-NK细胞制剂的制备方法,通过流式细胞仪检测所述预处理后CAR-NK细胞的数量、活性和安全性,并从所述预处理后CAR-NK细胞中筛选出符合标准的细胞以得到CAR-NK细胞制剂,包括:S141,获取由所述流式细胞仪采集的检测标记物的荧光信号;S142,对所述荧光信号进行信号特征分析以得到荧光信号特征;以及,S143,基于所述荧光信号特征,确定CAR-NK细胞的细胞活性是否符合预定标准。
相应地,在本申请的技术方案中,首先,获取由流式细胞仪采集的检测标记物的荧光信号。接着,对所述荧光信号进行图像特征分析以得到多个荧光信号特征,这样能够提供更多的信息和细节,从而有利于更全面地评估细胞的活性水平。也就是说,通过提取荧光信号图像的特征,例如荧光强度、荧光分布、荧光区域的大小和形状等,可以获得关于细胞活性的定量信息。具体来说,可以通过分析荧光信号的强度和分布情况来评估细胞的整体活性水平,同时还可以考虑荧光信号的空间分布和形态特征,以了解细胞内部的异质性和功能状态,从而有利于后续对于CAR-NK细胞的细胞活性检测。
然后,使用在图像的隐含特征提取方面具有优异表现的基于卷积神经网络模型的图像编码器来进行所述荧光信号波形图的特征提取,以此来挖掘出图像中关于荧光信号的波形特征分布信息。同时,还考虑到由于所述多个荧光信号特征也反映了细胞的活性水平。因此,为了能够提高对于CAR-NK细胞的细胞活性检测的精准度,在本申请的技术方案中,进一步将所述多个荧光信号特征和所述荧光信号通过包含序列编码器和图像编码器的跨模态联合编码器以得到多模态荧光信号特征矩阵。特别地,这里,所述图像编码器使用卷积神经网络模型来进行所述荧光信号波形图的特征挖掘,以提取出所述荧光信号中关于CAR-NK细胞的隐含特征分布信息。所述序列编码器能够提取出所述多个荧光信号特征之间的隐含关联特征信息。然后,再通过所述跨模态联合编码器的联合编码模块来进行所述荧光信号波形特征和所述多个荧光信号特征之间的关联特征的关联融合,以通过所述多个荧光信号特征之间的关联性特征分布信息来对所述荧光信号波形特征进行联合编码优化,从而进行所述荧光信号波形特征的优化表达,以提高对于所述CAR-NK细胞的活性检测精准度。
相应地,如图4所示,对所述荧光信号进行信号特征分析以得到荧光信号特征,包括:S1421,对所述荧光信号进行图像特征分析以得到多个荧光信号特征;以及,S1422,对所述多个荧光信号特征和所述荧光信号进行跨模态联合编码以得到多模态荧光信号特征矩阵作为所述荧光信号特征。
更具体地,在步骤S1422中,对所述多个荧光信号特征和所述荧光信号进行跨模态联合编码以得到多模态荧光信号特征矩阵作为所述荧光信号特征,包括:将所述多个荧光信号特征和所述荧光信号通过包含序列编码器和图像编码器的跨模态联合编码器以得到所述多模态荧光信号特征矩阵。
进一步地,将所述多个荧光信号特征和所述荧光信号通过包含序列编码器和图像编码器的跨模态联合编码器以得到所述多模态荧光信号特征矩阵,包括:将所述多个荧光信号特征通过所述跨模态联合编码器的所述序列编码器以得到荧光信号特征关联特征向量;将所述荧光信号通过所述跨模态联合编码器的所述图像编码器以得到荧光信号图像特征向量;以及,将所述荧光信号特征关联特征向量和所述荧光信号图像特征向量进行逐位置关联编码以得到所述多模态荧光信号特征矩阵。
值得一提的是,序列编码器(Sequence Encoder)是一种用于将序列数据转换为固定长度的向量表示的模型或组件。序列编码器的目标是将输入序列中的每个元素映射到一个连续的向量表示,以捕捉元素之间的语义和上下文关系。常见的序列编码器包括循环神经网络(Recurrent Neural Networks,RNN)和其变种(如长短期记忆网络(Long Short-Term Memory,LSTM)和门控循环单元(Gated Recurrent Unit,GRU)),以及基于自注意力机制的模型(如Transformer)。在序列编码器中,输入序列的每个元素都会经过编码器的处理,生成对应的向量表示。这些向量表示可以包含元素的语义信息、上下文信息以及序列中的其他重要特征。序列编码器可以通过逐步处理序列中的每个元素,并保持对整个序列的记忆来捕捉序列的长期依赖关系。序列编码器的输出可以用于后续的任务,如分类、生成、聚类等。在某些情况下,序列编码器的输出向量还可以作为输入序列的表示,进一步用于其他模型或组件的处理。换言之,序列编码器是一种将输入序列转换为固定长度向量表示的模型或组件,用于捕捉序列中的语义和上下文信息,常用于自然语言处理和序列建模任务中。
以及,图像编码器(Image Encoder)是一种将图像数据转换为固定长度的向量表示的模型或组件。图像编码器的目标是将输入图像转换为一个紧凑的向量表示,以捕捉图像中的视觉特征和语义信息。这个向量表示通常被称为图像的特征向量或嵌入向量。常见的图像编码器模型包括卷积神经网络(Convolutional Neural Networks,CNNs),如VGG、ResNet、Inception等。这些模型通过多个卷积层和池化层来提取图像的局部和全局特征,并将其映射到一个固定长度的向量表示。这个向量表示可以作为后续任务的输入,如图像分类器、目标检测器等。图像编码器能够将高维的图像数据转换为低维的向量表示,方便后续的处理和分析。
继而,再将所述多模态荧光信号特征矩阵通过分类器以得到分类结果,所述分类结果用于表示CAR-NK细胞的细胞活性是否符合预定标准。也就是说,利用优化表达后的所述荧光信号的波形特征分布信息来进行分类处理,从而实现对CAR-NK细胞活性的自动准确评估,为CAR-NK细胞制备过程提供快速、可靠的细胞活性评估手段。
相应地,如图5所示,基于所述荧光信号特征,确定CAR-NK细胞的细胞活性是否符合预定标准,包括:S1431,对所述多模态荧光信号特征矩阵进行特征分布优化以得到优化多模态荧光信号特征矩阵;以及,S1432,将所述多模态荧光信号特征矩阵通过分类器以得到分类结果,所述分类结果用于表示CAR-NK细胞的细胞活性是否符合预定标准。
更具体地,在步骤S1431中,对所述多模态荧光信号特征矩阵进行特征分布优化以得到优化多模态荧光信号特征矩阵,包括:基于所述多模态荧光信号特征矩阵的展开特征向量,分别计算所述荧光信号特征关联特征向量所述荧光信号图像特征向量的可转移特征的量化的可转移性感知因数以得到第一可转移性感知因数和第二可转移性感知因数;以所述第一可转移性感知因数和所述第二可转移性感知因数作为加权系数对所述荧光信号特征关联特征向量所述荧光信号图像特征向量进行加权优化以得到加权后荧光信号特征关联特征向量加权后荧光信号图像特征向量;以及,对所述加权后荧光信号特征关联特征向量和所述加权后荧光信号图像特征向量进行逐位置关联响应编码以得到所述优化多模态荧光信号特征矩阵。
特别地,在本申请的技术方案中,在将所述多个荧光信号特征和所述荧光信号通过包含序列编码器和图像编码器的跨模态联合编码器以得到多模态荧光信号特征矩阵时,是对所述序列编码器得到的荧光信号特征关联特征向量和所述图像编码器得到的荧光信号图像特征向量进行逐位置关联编码以得到所述多模态荧光信号特征矩阵。这里,所述荧光信号特征关联特征向量和所述荧光信号图像特征向量分别表示荧光信号特征的局部关联语义特征和所述荧光信号图像语义特征,考虑到所述荧光信号特征是序列离散数据而所述荧光信号是图像数据,即所述荧光信号特征和所述荧光信号是不同模态的数据,且源数据的差异会经序列编码和二维卷积编码的局部关联特征提取而放大,也就是说,所述荧光信号特征关联特征向量和所述荧光信号图像特征向量会有比较显著的特征分布差异。这样,在使用所述包含序列编码器和图像编码器的跨模态联合编码器对所述荧光信号特征关联特征向量和所述荧光信号图像特征向量进行跨模态编码时,所述荧光信号特征关联特征向量和所述荧光信号图像特征向量也会具有到所述多模态荧光信号特征矩阵的跨语义分布差异的特征分布域转移差异,从而影响跨模态编码的融合效果,也就影响了所述多模态荧光信号特征矩阵的表达效果。
基于此,本申请的申请人对于所述荧光信号特征关联特征向量,例如记为
相应地,在一个具体示例中,基于所述多模态荧光信号特征矩阵的展开特征向量,分别计算所述荧光信号特征关联特征向量所述荧光信号图像特征向量的可转移特征的量化的可转移性感知因数以得到第一可转移性感知因数和第二可转移性感知因数,包括:基于所述多模态荧光信号特征矩阵的展开特征向量,以如下优化公式分别计算所述荧光信号特征关联特征向量所述荧光信号图像特征向量的可转移特征的量化的可转移性感知因数以得到所述第一可转移性感知因数和所述第二可转移性感知因数;其中,所述优化公式为:
其中,
这里,所述可转移特征的量化的可转移性感知因数通过域转移下的不确定性度量来分别估计特征空间域到分类目标域的域不确定性,且由于该域不确定性估计可以用于标识已经在域间转移的特征表示,因此通过以该因数来作为权重分别对所述荧光信号特征关联特征向量和所述荧光信号图像特征向量进行加权后再对所述加权后荧光信号特征关联特征向量和所述加权后荧光信号图像特征向量进行逐位置关联响应编码,就可以通过特征空间域到分类目标域的跨域对齐来鉴别特征映射是否在域间有效转移,从而量化地感知所述荧光信号特征关联特征向量和所述荧光信号图像特征向量中的可转移特征的可转移性,以实现域间自适应的特征交互式融合,从而提升了所述多模态荧光信号特征矩阵的展开特征向量的表达效果。这样,能够基于检测标记物的荧光特征来实现对CAR-NK细胞活性的自动准确评估,从而为CAR-NK细胞制备过程提供快速、可靠的细胞活性评估手段,以优化CAR-NK细胞制剂的制备效率和质量。
更具体地,在步骤S1432中,将所述多模态荧光信号特征矩阵通过分类器以得到分类结果,所述分类结果用于表示CAR-NK细胞的细胞活性是否符合预定标准,包括:将所述多模态荧光信号特征矩阵按照行向量或者列向量展开为分类特征向量;使用所述分类器的全连接层对所述分类特征向量进行全连接编码以得到编码分类特征向量;以及,将所述编码分类特征向量输入所述分类器的Softmax分类函数以得到所述分类结果。
也就是,在本公开的技术方案中,所述分类器的标签包括CAR-NK细胞的细胞活性符合预定标准(第一标签),以及,CAR-NK细胞的细胞活性不符合预定标准(第二标签),其中,所述分类器通过软最大值函数来确定所述多模态荧光信号特征矩阵属于哪个分类标签。值得注意的是,这里的所述第一标签p1和所述第二标签p2并不包含人为设定的概念,实际上在训练过程当中,计算机模型并没有“CAR-NK细胞的细胞活性是否符合预定标准”这种概念,其只是有两种分类标签且输出特征在这两个分类标签下的概率,即p1和p2之和为一。因此,CAR-NK细胞的细胞活性是否符合预定标准的分类结果实际上是通过分类标签转化为符合自然规律的二分类的类概率分布,实质上用到的是标签的自然概率分布的物理意义,而不是“CAR-NK细胞的细胞活性是否符合预定标准”的语言文本意义。
应可以理解,分类器的作用是利用给定的类别、已知的训练数据来学习分类规则和分类器,然后对未知数据进行分类(或预测)。逻辑回归(logistics)、SVM等常用于解决二分类问题,对于多分类问题(multi-class classification),同样也可以用逻辑回归或SVM,只是需要多个二分类来组成多分类,但这样容易出错且效率不高,常用的多分类方法有Softmax分类函数。
综上,基于本申请实施例的CAR-NK细胞制剂的制备方法被阐明,其可以快速、可靠的评估细胞活性,以优化CAR-NK细胞制剂的制备效率和质量。
图6为根据本申请实施例的CAR-NK细胞制剂的制备系统100的框图。如图6所示,根据本申请实施例的CAR-NK细胞制剂的制备系统100,包括:NK细胞分离模块110,用于从供体的外周血或骨髓中分离NK细胞;基因导入模块120,用于选择CAR载体,并将所述CAR载体的基因导入所述NK细胞,以将所述基因表达在所述NK细胞的表面以得到CAR-NK细胞;扩增激活模块130,用于通过体外培养或动物模型法对所述CAR-NK细胞进行扩增和激活处理以得到预处理后CAR-NK细胞;以及,筛选模块140,用于通过流式细胞仪检测所述预处理后CAR-NK细胞的数量、活性和安全性,并从所述预处理后CAR-NK细胞中筛选出符合标准的细胞以得到CAR-NK细胞制剂。
在一个示例中,在上述CAR-NK细胞制剂的制备系统100中,所述筛选模块140,包括:荧光信号获取单元,用于获取由所述流式细胞仪采集的检测标记物的荧光信号;信号特征分析单元,用于对所述荧光信号进行信号特征分析以得到荧光信号特征;以及,细胞活性判断单元,用于基于所述荧光信号特征,确定CAR-NK细胞的细胞活性是否符合预定标准。
这里,本领域技术人员可以理解,上述CAR-NK细胞制剂的制备系统100中的各个模块的具体功能和操作已经在上面参考图1到图5的CAR-NK细胞制剂的制备方法的描述中得到了详细介绍,并因此,将省略其重复描述。
如上所述,根据本申请实施例的CAR-NK细胞制剂的制备系统100可以实现在各种无线终端中,例如具有CAR-NK细胞制剂的制备算法的服务器等。在一个示例中,根据本申请实施例的CAR-NK细胞制剂的制备系统100可以作为一个软件模块和/或硬件模块而集成到无线终端中。例如,该CAR-NK细胞制剂的制备系统100可以是该无线终端的操作系统中的一个软件模块,或者可以是针对于该无线终端所开发的一个应用程序;当然,该CAR-NK细胞制剂的制备系统100同样可以是该无线终端的众多硬件模块之一。
替换地,在另一示例中,该CAR-NK细胞制剂的制备系统100与该无线终端也可以是分立的设备,并且该CAR-NK细胞制剂的制备系统100可以通过有线和/或无线网络连接到该无线终端,并且按照约定的数据格式来传输交互信息。
图7为根据本申请实施例的CAR-NK细胞制剂的制备方法的应用场景图。如图7所示,在该应用场景中,首先,获取由所述流式细胞仪采集的检测标记物的荧光信号(例如,图7中所示意的D),然后,将所述荧光信号输入至部署有CAR-NK细胞制剂的制备算法的服务器中(例如,图7中所示意的S),其中,所述服务器能够使用所述CAR-NK细胞制剂的制备算法对所述荧光信号进行处理以得到用于表示CAR-NK细胞的细胞活性是否符合预定标准的分类结果。
进一步地,更具体地对CAR-NK细胞制剂的制备方法进行说明。
基于CAR的免疫疗法的成功在很大程度上取决于基因工程的效应细胞群的生物学特征。在不同类型的免疫细胞中,鉴于NK细胞固有的对不同恶性肿瘤的非主要组织相容性复合体(MHC)限制的细胞毒性潜力,其在免疫治疗领域的地位步步高升。图8示出了第一代、第二代和第三代CARs示意图,包括使用CARs进行基因改造的NK细胞来源,以及基于CAR-NK细胞的免疫疗法(PB:外周血;UCB:脐带血;hESC:人类胚胎干细胞;hiPSC:人类诱导多能干细胞)。
与CAR-T相比,CAR-NK在效率、安全性和耐受性方面表现出一些优势。CAR-NK细胞的杀伤机制可以通过激活受体介导的信号通路来针对异质性恶性肿瘤,这有利于消除那些失去或下调了CAR靶向抗原表达的细胞,从而降低复发或耐药的风险。尽管CAR-T细胞在其扩增的高峰期有很大的治疗潜力,但它也能引起严重的炎症反应,包括由目标外肿瘤效应导致的CRS和ICANS,这些副作用在某些情况下可能会危及生命,对治疗后管理是一大挑战。相比之下,CAR-NK细胞产生的促炎症细胞因子数量较少,如IL-1、IL-6、TNF-α,因此发生CRS和ICANS的风险较低。CAR-T细胞的长期存活导致其在体内长期存在,会产生负面影响。尽管CD19 CAR-T细胞的长期持续存在对于实现持久的抗肿瘤免疫以防止肿瘤复发非常重要,但由于恶性和非恶性T细胞上有共同的抗原表达,这些细胞会引起严重的B细胞增生,增加感染性并发症,以及细胞自相残杀。因此,增强的CAR-T细胞扩增和持久性可能像一把双刃剑。此外,异体现货型CAR-T细胞产品可以间接诱导或引发GVHD,可致死。然而,异体NK细胞表现出更好的安全性,允许使用普遍的健康捐赠者的NK细胞。NK细胞的寿命较短,可以减少自身免疫和长期副作用。不仅如此,廉价的扩增使自体和异体NK细胞成为大规模生产工程CAR细胞的理想现货候选细胞。目前,多种来源的NK细胞,如外周血、脐带血、人类胚胎干细胞、诱导多能干细胞和NK细胞"同类"系(即NK-92),都在CAR工程的背景下进行测试。尽管成熟NK细胞的体外扩增率相对较低(2-4倍),需要通过抽血来获得足够的CAR-NK细胞数量(每次输液的CAR-NK细胞总数从1×107到2×109/kg体重不等),但在UCBs、iPSCs和hESCs的情况下,基于供体细胞或无供体的扩增方案能够实现超过2000倍的扩展能力。如果是NK细胞系如NK-92,则可实现无限制扩增。
结合图9,NK细胞上表达的功能性CAR分子由三部分组成:胞外结构域、跨膜区以及胞内的信号结构域。胞外结构域由一个信号肽和识别抗原的单链抗体片段(scFv)组成,一段铰链区将这个结构连接到跨膜区,它也在细胞内连接到包含激活信号的胞内结构域。
载体骨架和启动子载体骨架包含了CAR表达所需的所有元素,如启动子、多聚腺苷信号和转录调节片段。由于启动子启动了CAR的转录,所以选择某种启动子对转基因的表达水平有直接影响。启动子的大小对病毒转导效率和随后的GFP表达有负相关的影响,较短的EFS、PGK、SV40和CMV启动子是很好的启动子,可以维持GFP表达17天。在原代T细胞中,一项研究显示与其他常用的启动子,如CMV、UbiC和PGK相比,EF1α启动子能诱导更高的CAR表达水平。另一项研究显示,MSCV在表达水平和CAR表达稳定性方面优于EF1α和PGK。对于给定的构建体和病毒载体,确定最佳启动子是很重要的。在初级CAR-NK和CAR-NK细胞系中,病毒性启动子(CMV、MPSV、MMLV、SFFV等)比组成型活性启动子,如EF1α、CMV和PGK更经常用于产生CAR-NK。信号肽CAR序列以一个短的信号肽(SP)开始。这些短肽位于蛋白质的N端,携带蛋白质在内质网(ER)和高尔基细胞器中翻译后组装和在膜上表达的信息。NK细胞上的最终CAR蛋白将是一个I型跨膜蛋白固定在细胞膜上。CAR和许多其他蛋白一样,也是由免疫细胞通过共翻译转位途径分泌的。在真核细胞中,当蛋白质仍在核糖体中翻译时,位于新生蛋白质N端的SP被信号识别颗粒(SRP)识别。新生蛋白质穿过ER膜后,信号肽被信号肽肽酶(SPP)裂解掉,然后开始蛋白质的组装和折叠。信号肽存在巨大的异质性,这直接转化为不同程度的蛋白质分泌效率。目前,CD8a SP是初级NK使用最多的肽序列,NK细胞系使用免疫球蛋白重链或轻链SP。
单链片段变体(scFv)单链片段变体(scFv)是一种抗体重链和轻链可变区的融合蛋白,是CAR的肿瘤抗原结合域。不同的scFv可以与同一蛋白的不同表位结合,因此,这个结构域将决定CAR-NK细胞的特异性和功能。scFv不是一种自然存在的抗体形式,它的重链和轻链的顺序是人为决定的。到目前为止,大多数在CAR-NK设计中倾向于VH-VL方向而不是VL-VH方向。H和L链的顺序并不影响抗KDR CAR在T细胞上的表达水平。另外,scFv在CAR中的抗原特异性和结合常数方面的表现有时被发现比其原始抗体低,主要是由于VL和VH结构域的连接性改变。这也可能对两个链的动态和相对方向产生影响。计算辅助设计scFv可能有助于通过分析VH和VL的CDR区域的氨基酸序列来开发功能性scFv,并预测scFv与其目标的相互作用。有趣的是,来自针对同一表位的不同抗体的VH和VL链也可以混合,有时会导致CAR亲和力的增加。还有,细胞可以配备多个单链抗体,从而扩大CAR效应细胞的抗原识别能力。在这里有多种选择:CAR可以用双元件的载体转导,诱导两个CAR结构的表达;或者将两个单链抗体融合在一个结构中,产生串联单链抗体的“单柄”CAR。虽然这些技术已用于生产CAR-T细胞,但CAR-NK细胞仍未知。目前大多数临床CAR-T细胞试验都利用了来自小鼠抗体的scFv,从而增加了抗小鼠IgG细胞宿主对移植物疾病的风险,导致毒性或缩短CAR承载细胞的持久性。这个问题可以通过人源化小鼠scFv或从全人类抗体中衍生出scFv来减弱。由于这些CAR受体的嵌合特性,即使是人源化scFv构建体仍可能诱发宿主的抗异型免疫反应。链接子重链和轻链之间的连接物有助于scFv的构象,部分决定了CAR对目标表位的识别程度。过短的连接体会诱发多聚体的形成,因为它们会阻止VH和VL结构域的结合。另一方面,过长的结构域可能会诱发蛋白分解或VH和VL结构域之间的弱关联。对于CAR-NK细胞来说,五肽GGGGS(甘氨酸-丝氨酸)的多聚体应用最广,通常为15聚体(G4S)3。另一种提高蛋白质溶解稳定性的连接子是Whitlow"218"连接子:GSTGSGSKPGSGEGSTKG。这种连接子增强了scFv的亲和力,可能也改变了CAR-NK细胞的功能。总的来说,目前还没有足够的数据对CAR的最佳连接子下定论。铰链区铰链区,也被称为间隔区,是CAR的细胞外结构区,连接scFv单元和跨膜结构域。这些间隔区通常能保持CAR在效应细胞中有力表达和活性所需的稳定性。铰链区还提供了灵活性,使其容易接触到目标抗原。大多数CAR-NK构建体使用CD8α或CD28细胞外结构域的衍生物或基于免疫球蛋白G(IgG)的铰链。
间隔物的类型和长度对CAR的功能活性有重要影响。由于目前没有CAR-NK细胞的具体数据,这部分信息全部来自于CAR-T领域,这是否可以直接转化为CAR-NK的设计还有待证明。在对CD28和CD8α铰链结构的直接比较中,发现CD28铰链结构更容易促进CAR分子的二聚化。因此从带有CD28铰链的CARs中得到的激活刺激更强,但这也可能诱发细胞因子释放综合征。基于IgG的铰链也被广泛用于CAR构建体中。基于IgG的铰链区的一个主要优势是构建体的灵活性,通常由IgG1或IgG4和IgG Fc的CH2/CH3结构域组成。后面的结构域的使用是可选的,因此可以调节间隔物的长度。虽然广泛的间隔物长度可以适应抗原识别,但研究发现,较短的间隔物与细胞因子的产生、CAR-T细胞的增殖以及体内的持久性和抗肿瘤效果更好有关。跨膜结构域跨膜(TM)结构域将CAR的外域与细胞内的激活信号域连接起来,并将受体与NK细胞膜对接。CAR-NK最常用的TM部分是由CD3ζ、CD8和CD28改编的,但其他的(如NKG2D、2B4、DNAM1)也被探讨过。
TM结构域的选择被证明会影响CAR构建体在细胞激活程度上的功能。CD28、CD16、NKp44、NKp46、NKG2D、DNAM-1和2B4的TM结构域已经被用来用NK-92细胞系来筛选CAR功能。来自通常在NK细胞上表达的分子的TM,如DNAM-1、2B4和NKG2D会导致更多的CD107a脱颗粒和更高的细胞毒性。因此,TM的具体来源将决定CAR-NK的活性。TM结构域的一个重要方面是,最佳的TM区域应该遵循蛋白质从T细胞或NK细胞上的跨膜蛋白的自然取向(N-到C-末端的顺序)。NKG2D是NK细胞的强大激活剂,因此是CAR-NK的合适骨架。然而,天然的NKG2D的跨膜区在C-到N-端顺序有一个短的细胞质尾巴。这些CAR-NK研究强调,考虑TM区作为细胞内激活信号的连接物的功能是很重要的,因为TM的类型可能影响信号转导和CAR二聚体化。在CAR-T细胞中,CD28衍生的TM域被证明可以促进激活诱导的细胞死亡(AICD)和细胞因子的产生,而具有CD8α衍生的TM的CAR则协助CAR与内源性TCR的二聚化介导T细胞的首次激活信号。CAR-NK激活信号目前大多数CAR结构依赖于CD3ζ链信号域,强烈的激活信号对于诱导有效的抗肿瘤反应很重要,但也可能导致效应细胞的快速衰竭。因此,共刺激域的组合可用于校准所需的免疫细胞反应。与基于4-1BB的CAR相比,基于CD28的CAR表现出更快的效应器特征,诱导更高水平的IFN-γ、颗粒酶B、TNF-α。然而,这种强烈的共刺激信号也会导致活化诱导的细胞死亡。在CAR-NK细胞系和原代CAR-NK细胞的研究中,CD3ζ几乎被普遍用作主要的激活域,其中约有一半携带一个额外的域,通常添加4-1BB或CD28。至于第三代构建体,最常使用的是CD28/4-1BB/CD3ζ的组合。
基于2B4-CD3ζ的CAR-NK构建体显示出最强的CD107a脱颗粒性和抗原特异性细胞毒性。此外,NKG2D-2B4-CD3ζ构建体的跨膜中Arg-Ala或ITAM/ITSM中Tyr-Phe的点突变,减少了下游激活分子如pSyk、pPLC-γ2和pERK1/2的磷酸盐招募。这将减少CAR-NK细胞的脱颗粒、细胞因子释放和抗原特异性裂解能力。这表明,跨膜和细胞内结构域也是决定CAR-NK细胞功能的关键部分。此外,在首次发表的CAR-NK细胞的临床试验中,CD28-CD3ζ的组合也被证明可以提供强大的激活信号,并且能够支持CAR-NK细胞在体内存活一年。一般来说,CD3ζ结构域是最常用的,至于哪种结构域的组合最好,以何种顺序,在何种情况下,仍有待于确定。
目前,CAR-NK疗法绝大部分使用为T细胞设计的CAR构建体。它们的共同点是CAR结构的主要分子(包括scFv、跨膜膜和信号域),差异主要体现在针对不同肿瘤抗原的scFv亲和力或发展不同代数的共刺激结构域。
由于目前大多数CAR-NK研究还在临床前,所以对效率和疗效对CAR结构的依赖性的洞察有限。然而仍然需要在亲和力和特异性方面优化CAR的结构,以利于TA的检测和减少并发症的发生。
在实体瘤中,CAR靶点的选择因物理/化学障碍而进一步复杂化,这些障碍阻碍了CARs在肿瘤微环境中到达其抗原。为了追求高效率和恢复免疫活性,目前正在考虑采用各种方式来释放细胞活性或减少效率障碍,其中包括有细胞因子联合疗法、治疗性检查点抑制剂、化学治疗剂、溶瘤病毒等。因此,抗原选择在CAR工程中至关重要,以支持治疗效率和安全性。
合格的CAR-NK细胞的诞生有赖于基因编辑和传递系统,以实现CAR稳定和有针对性地整合到基因组中。
图10示出了向NK细胞递送CAR结构的病毒和非病毒途径。逆转录病毒已被用于NK细胞的CAR转导,且已证明只有单剂量的逆转录病毒载体才能在人类预刺激的的NK细胞中达到所需的CAR转导效率。在临床上,已有报告表明逆转录病毒的CAR修饰的NK细胞可长期存在,在不同逆转录病毒中,α-逆转录病毒载体显示出比γ-逆转录病毒载体更优越的性能,在NK细胞系中的转导效率为90%,在受刺激的原代NK细胞中的转导效率大于60%。然而,逆转录病毒独特的复制能力允许转基因稳定地整合到目标基因组并长期表达CAR,但只能在分裂的NK细胞中表达。此外,逆转录病毒载体的突变率很高,在受体中的免疫反应不受控制,这是因为它们随机插入基因组导致不必要的高滴度和病毒载体的持续存在。重要的是,在应用CAR-T细胞治疗时,这些潜在的缺点在临床上并没有显示出其不利性,已获批的CAR-T产品中不乏采用了逆转录病毒载体的。慢病毒是逆转录病毒家族的一个亚类,由于各种编码的调节蛋白和附属蛋白,其基因比大多数逆转录病毒更复杂。虽然逆转录病毒介导的基因递送很常见,但值得注意的是,慢病毒CAR转导的细胞的临床繁荣程度越来越高。慢病毒对细胞周期的进展没有依赖性,可以成功转导到循环和非循环的NK细胞中。然而,原代培养的NK细胞通常需要病毒载体进行多轮转导才能达到足够的转导效率。慢病毒载体的半随机整合仍有插入突变和失调的风险,但程度比逆转录病毒载体要小,因此可能提供一个更安全的选择。这种差异被归因于慢病毒和逆转录病毒载体的程度和整合位点选择的不同。由于整合位点的分布会影响慢病毒转导的CAR-T细胞的治疗效果,所以可以采用有针对性的敲入转基因的方法来提高效率。由于病毒载体在向初级NK或T细胞传递基因方面的潜力有限,使用病毒载体面临许多挑战,因此克服这些障碍的科学尝试非常重要。在这方面,有几种可能的优化方法,如用饲养细胞刺激NK细胞,使用细胞因子鸡尾酒来加速病毒载体的吸收,或操纵NK细胞的先天抗病毒反应。这些方法的根本目的是解决使用常规方法转染或感染的阻力。此外,病毒载体的细胞滋养性和宿主范围可以通过用异质蛋白(最常见的是水泡性口炎病毒(VSV-G)的G糖蛋白)替代原生包膜蛋白来改变,这个过程称为假分型。基于VSV-G的病毒载体为T细胞中稳定的CAR转导提供了很大的潜力,但由于诱导的基因毒性,在初级NK细胞中不太成功。最近有报道称,由VSV触发的低密度脂蛋白受体(LDLR)表达的上调可以促进VSV-G慢病毒转导到原代NK细胞。作为一种选择,狒狒包膜糖蛋白(BaEV-gp)+细胞因子处理诱导慢病毒载体对NK细胞的更高亲和力;同样,用猫科内源性逆转录病毒包膜蛋白(RD114)进行假分型已被证明可以提高病毒载体在NK细胞中的感染性水平,而细胞活力没有明显变化。考虑到病毒在靶细胞上的扩散与随后的感染之间的正相关关系,阳离子聚合物如溴化六甲嘧胺(polybrene)或硫酸丙胺可以中和一些包膜病毒载体的负电荷,从而促进其膜融合。此外,转导增强剂如retronectin或vectofusion-1能促进假型病毒载体粘附到宿主细胞表面,这反过来又增加了细胞内化。更高的转导效率导致了NK细胞更强的抗白血病能力。在retronectin的存在下,用RD114-TR伪型的逆转录病毒载体在PB衍生的NK细胞中实现了高达90%的CD19 CAR转导。与T细胞相比,NK细胞在其模式识别受体信号的引导下对病毒转导更有抵抗力。因此,抑制细胞内的抗病毒防御机制可以增强VSV-G假型慢病毒载体进入NK细胞。非病毒途径CRISPR-Cas9基于这种技术,一个可编程的单向导RNA(sgRNA)将Cas9核酸酶带到基因组的特定部位,以诱导双链断裂,然后通过内源性DNA修复机制、同源重组(HR)或非同源端接(NHEJ)整合所需基因盒。CRISPR-Cas9的生产率取决于CRISPR-Cas9元件的应用格式、转染方法和细胞类型。CRISPR-Cas9元件可以以多种形式引入细胞,如DNA、RNA和核糖核酸蛋白(RNPs)。相应地,传递模式也根据CRISPR-Cas9元件的选择而不同。到目前为止,NK细胞对转染方法表现出抵抗力,这凸显了基于基因编辑的CRISPR-Cas9免疫疗法的关键问题。有针对性的CAR整合到T或NK细胞基因组中,可以防止异常病毒的非特异性和半随机性的基因整合。CD19 CAR敲入T细胞受体α常数(TRAC)基因座,确保了比传统的CAR-T细胞对急性淋巴细胞白血病模型有更好的表现,这是有效内化和CAR更均匀表达的结果。然而,这个结果受到CRISPR-Cas9成分以及相关基因的传递效果的影响。通过CRISPR-Cas9介导的对主要抑制性基因如PD-1的编辑,可以提高CAR工程免疫细胞的疗效。鉴于肿瘤细胞上表达的PD-L1对癌症治疗有负面作用,可以抑制CAR-T细胞的功能,通过Cas9核感染阻断PD-1受体,并伴随慢病毒CAR转导来提高T细胞的抗肿瘤活性。相比较而言,通过Cas9靶向细胞因子检查点加速了CAR-NK细胞的治疗作用。经CD19 CAR和IL-15转导的第四代CAR-NK细胞已被证明可以促进体内持久性和随后对淋巴瘤的疗效,这在CISH(细胞因子诱导的Src同源2域)基因敲除后得到加强。总而言之,已有证据显示Cas9基因编辑可能会在未来扩大CAR细胞工程的范围。转座子系统的应用满足了高效率、永久的转基因表达以及低免疫原性和无基因毒性的要求。值得注意的是,基于质粒的载体的生产具有时间和成本效益。基于这些优点,大基因(超过100kb)的转染潜力使该系统成为一种潜力方法。转座子系统通常由移动质粒(转座子),两侧是携带酶基因和插入序列的两个末端倒置重复(TIRs)。转座酶介导着宿主基因组中所需元素的切割和粘贴。
为了获得对转座子介导的基因工程的精确控制和令人满意的安全性和效率,传统的DNA质粒已被编码转座酶的短寿命mRNA和小圈DNA货物的组合所取代。mRNA编码的转座酶可以应用于系统中转座事件的超可控性。含有编码CD19 CAR的转座子的迷你圈DNA和转座酶的共电转染可以导致有利的插入情况,产生具有高治疗潜力的CAR-T细胞。此外,CAR到NK的非病毒法还包括mRNA电穿孔法,基于微流控技术的细胞挤压法,纳米载体介导等。
此外,本领域技术人员可以理解,本申请的各方面可以通过若干具有可专利性的种类或情况进行说明和描述,包括任何新的和有用的工序、机器、产品或物质的组合,或对他们的任何新的和有用的改进。相应地,本申请的各个方面可以完全由硬件执行、可以完全由软件(包括固件、常驻软件、微码等)执行、也可以由硬件和软件组合执行。以上硬件或软件均可被称为“数据块”、“模块”、“引擎”、“单元”、“组件”或“系统”。此外,本申请的各方面可能表现为位于一个或多个计算机可读介质中的计算机产品,该产品包括计算机可读程序编码。
除非另有定义,这里使用的所有术语(包括技术和科学术语)具有与本发明所属领域的普通技术人员共同理解的相同含义。还应当理解,诸如在通常字典里定义的那些术语应当被解释为具有与它们在相关技术的上下文中的含义相一致的含义,而不应用理想化或极度形式化的意义来解释,除非这里明确地这样定义。
上面是对本发明的说明,而不应被认为是对其的限制。尽管描述了本发明的若干示例性实施例,但本领域技术人员将容易地理解,在不背离本发明的新颖教学和优点的前提下可以对示例性实施例进行许多修改。因此,所有这些修改都意图包含在权利要求书所限定的本发明范围内。应当理解,上面是对本发明的说明,而不应被认为是限于所公开的特定实施例,并且对所公开的实施例以及其他实施例的修改意图包含在所附权利要求书的范围内。本发明由权利要求书及其等效物限定。
- 一种塑料安瓿的输液制剂的制备方法及制备系统
- 一种用于制备内胚层细胞系的培养体系以及制备内胚层细胞系的方法
- 一种萌芽抑制剂及其制备方法和使用方法
- 一种用于百合种球消毒的制剂及其制备方法和使用方法
- 联合制备CAR-NK细胞和CAR-NKT细胞的方法
- 一种CAR-NK细胞保存液及其制备方法、保存方法
