一种具有润肠通便功效的纳豆及其制备方法与应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明涉及保健食品技术领域,尤其涉及一种具有润肠通便功效的纳豆及其制备方法与应用。
背景技术
便秘是一种临床常见的功能性胃肠道疾病,主要症状包括粪便干涩、排便费力、排便次数减少等。便秘经常诱发肠道感染或引起炎症发生,导致肠道分泌功能和运动功能异常,进而影响机体健康。严重时,便秘还可以引起胃肠神经功能紊乱,诱发癌症及心血管等疾病的发生。近年来,我国便秘发病率呈现逐年增加趋势,这与现代生活节奏加快、饮食习惯改变和生活工作压力上升等有关。研究发现,胃肠激素可影响和改变肠道动力,其中,胃动素(Motilin,MTL)、血管活性肠肽(Vasoactive intestinal peptide,VIP)、P物质(Substance P,SP)是中枢神经系统和肠神经系统信息传递中重要的胃肠活性肽,影响胃肠蠕动和胃肠液分泌,在胃肠道功能的调节中起重要作用。目前便秘的治疗手段主要是通过药物干预,但多数药物存在副作用以及容易产生药物依赖性等问题,因此,研究人员尝试开发天然源的产品去治疗或缓解便秘。
纳豆是蒸煮后的大豆接种枯草芽孢杆菌发酵制成的一种功能性食品。纳豆初为豆豉,起源于我国的秦汉时期,唐朝时由鉴真和尚传至日本的寺庙,由于日本的寺庙又称作“纳所”,故日本人将大豆发酵物起名纳豆。纳豆既保留了黄豆的营养价值,又提高了大豆蛋白质的消化吸收率,同时在发酵过程中还产生了异黄酮、纳豆激酶、超氧化物歧化酶等多种生理活性物质。纳豆具有溶解血栓、降低血脂、抗氧化、抗癌、防治骨质疏松、预防和缓解更年期综合征等多种生理保健功能。另外,纳豆中富含的膳食纤维可促进肠道蠕动,加速毒素的排除,预防便秘;纳豆还可抑制肠道有害菌的繁殖,维持大肠内的正常环境和肠道菌群平衡,预防便秘发生。
虽然目前国内外对纳豆及其生物活性物质的应用非常广泛,但是,目前的纳豆产品需要与具有润肠功效的众多中药组合使用,才能达到较好的缓解便秘的效果,单纯使用纳豆产品需要较高的剂量才能达到较好的缓解便秘的功效,因此,成本较高。研发一种可以在低剂量使用且具有较好的缓解便秘功效的纳豆或纳豆衍生产品对于扩大纳豆的应用范围具有十分重要的意义。
发明内容
针对现有纳豆产品需要与较多中药材组合使用,或者需要较高的剂量才能达到较好的缓解便秘功效,成本较高的问题,本发明提供一种具有润肠通便功效的纳豆及其制备方法与应用。
为解决上述技术问题,本发明提供的技术方案是:
第一方面,本发明提供了冀黑豆1号在制备具有润肠通便作用的保健食品中的应用。
第二方面,本发明还提供了一种具有润肠通便作用的保健食品,其原料包括冀黑豆1号。
第三方面,本发明提供一种具有润肠通便作用的纳豆,由冀黑豆1号经枯草芽孢杆菌发酵得到。
相对于现有技术,本发明所提供的纳豆以冀黑豆1号为原料,经枯草芽孢杆菌发酵制成,其在低浓度下也可显著提高小鼠的排便速度及排便粒数,并能有效提高小鼠血清中P物质、5-羟基色胺(5-HT)等兴奋性神经递质的水平,降低生长抑素这一抑制性神经肽的水平,缓解由便秘引起的炎症反应,保护肠粘膜屏障的完整性。本发明提供的纳豆能够在低剂量使用时发挥较好的缓解便秘的作用,在制备缓解便秘保健食品领域具有较高的应用前景,且可有效降低使用成本,无毒副作用,安全性高,具有较高的市场前景和应用价值。
所述冀黑豆1号是河北省农林科学院粮油作物研究所2018年育成的抗倒伏、成熟时落叶性好、不裂荚的夏大豆新品种。2016年自行开展黑豆组区域试验,平均亩产156.0公斤;2017年同组区域试验,平均亩产168.0公斤。2018年通过河北省农作物品种审定委员会审定(审定编号:冀审豆20189001),适宜在河北省中南部夏播种植,品种来源:丹农黑×冀豆9号。农业农村部谷物品质监督检验测试中心测定,粗蛋白(干基)42.70%,粗脂肪(干基)19.16%。
进一步地,所述枯草芽孢杆菌为保藏编号CGMCC NO.24151的枯草芽孢杆菌(Bacillus subtilis)HAU-SDZ6。该菌株已在CN114292790B,专利名称一种枯草芽孢杆菌、用其制备纳豆的方法及制备出的纳豆与应用中公开。
所述枯草芽孢杆菌HAU-SDZ6是从自制发酵酸豆汁中分离得到,已于2021年12月20日保藏于中国微生物菌种保藏管理委员会普通微生物中心,简称CGMCC,菌种保藏号为CGMCC No.24151,保藏地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
本发明中所述枯草芽孢杆菌HAU-SDZ6的分类学特征为:
革兰氏阳性,菌落圆形边缘不整齐,在LB固体培养基上呈白色,菌落直径2.5mm~4.5mm,在LB液体培养基中,菌体为杆状,有单个芽孢,芽孢端生。
在糖发酵方面,能发酵利用葡萄糖、蔗糖、木糖、果糖和麦芽糖,不能发酵利用乳糖、山梨醇、阿拉伯糖、甘露糖和纤维二糖。另外,该菌株过氧化氢酶阳性、V.P.试验阳性,明胶液化阳性,酪蛋白水解酶阳性,硝酸盐还原试验阳性;产吲哚能力阴性、淀粉水解酶阴性、M.R.阴性、亚硝酸盐还原试验阴性、H
本发明还提供了上述具有润肠通便功效的纳豆的制备方法,包括如下步骤:将培养至对数生长期的枯草芽孢杆菌HAU-SDZ6的菌液接种至蒸熟冀黑豆1号中,39℃~44℃发酵18h~22h,得纳豆。
本发明中上述对数生长期的枯草芽孢杆菌HAU-SDZ6的菌液的OD值为4.0以上。
示例性的,本发明中还可将枯草芽孢杆菌HAU-SDZ6的菌液制成冻干菌粉后用于发酵制备纳豆,冻干菌粉的加入量为冀黑豆1号质量的0.5%~1.0%。
优选的,所述枯草芽孢杆菌HAU-SDZ6的菌液的接种量与蒸熟冀黑豆1号的体积质量比为(8~12)mL:100g。
优选的,所述蒸熟冀黑豆1号是由冀黑豆1号与水按照重量体积比为1:2.5~1:3.5在18℃~20℃浸泡12h~14h,然后于115℃~125℃蒸制30min~35min得到的;其中,重量的单位是克,体积的单位是毫升。
优选的,所述枯草芽孢杆菌HAU-SDZ6的菌液的制备方法包括如下步骤:将所述枯草芽孢杆菌HAU-SDZ6的活化菌液按1%~2%(v/v)的接种量接种至LB液体培养基中,37℃~40℃培养12h~15h,得所述枯草芽孢杆菌HAU-SDZ6的培养液;将所述培养液离心所得菌泥重悬在灭菌后的蒸馏水中,得所述枯草芽孢杆菌HAU-SDZ6的菌液。
本发明中上述对数生长期的枯草芽孢杆菌HAU-SDZ6的培养液的OD值为4.0以上。
优选的,所述枯草芽孢杆菌HAU-SDZ6的活化菌液是将枯草芽孢杆菌HAU-SDZ6的甘油管冷冻保藏菌种融化,并按1%~2%(v/v)接种量接种到LB液体培养基中,37℃~40℃下培养24h~36h得到的。
本发明还提供了上述纳豆在制备具有润肠通便功效的保健食品中的应用。
本发明提供的纳豆,在较低使用量时就能有效缓解便秘,通过日常摄入可有效预防便秘发生和复发,还具有调节胃肠道功能的作用,无任何毒副作用,在制备具有缓解便秘功效的保健食品或功能食品中具有广阔的应用前景。
附图说明
图1为本发明实施例6中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)的第17天各组小鼠的粪便性状对比图;
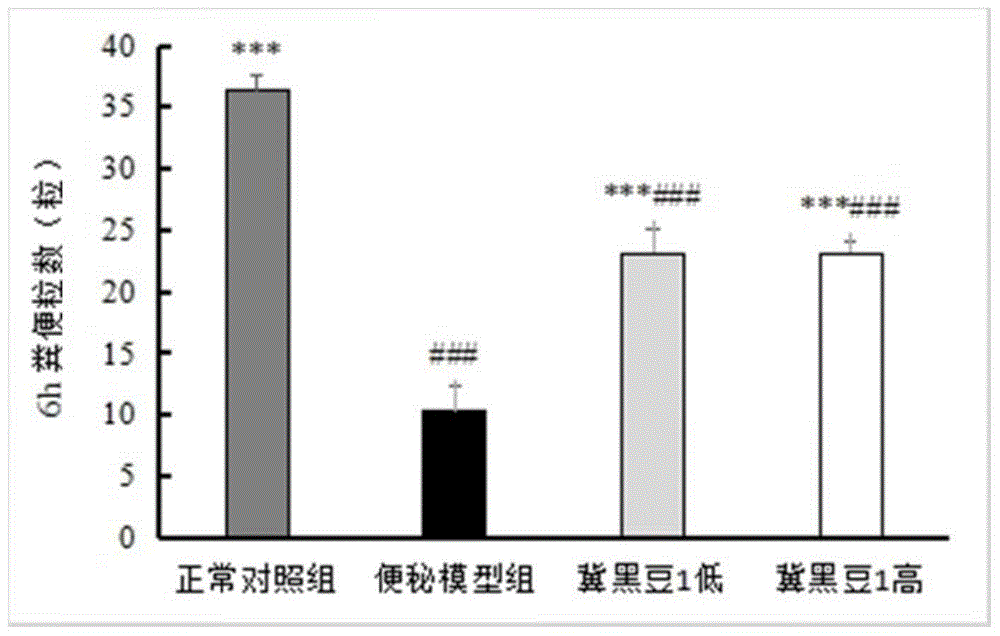
图2为本发明实施例6中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)的6h粪便粒数对比图,其中,###:与正常对照组相比有极显著差异p<0.001;***:与便秘模型组相比有极显著差异p<0.001;
图3为本发明实施例6中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)的首粒排便时间对比图,其中,###:与正常对照组相比有极显著差异p<0.001;***:与便秘模型组相比有极显著差异p<0.001;
图4为本发明实施例6中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)的小鼠粪便含水率的对比图,其中,###:与正常对照组相比有极显著差异p<0.001;##:与正常对照组相比有极显著差异p<0.01;***:与便秘模型组相比有极显著差异p<0.001;
图5为本发明实施例6中洋红在不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小鼠肠道内移动距离的对比图;
图6为本发明实施例6中洋红在不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小肠推进率的对比图,其中,###:与正常对照组相比有极显著差异p<0.001;***:与便秘模型组相比有极显著差异p<0.001;
图7为本发明实施例7中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小鼠血清中胃动素含量对比图,其中,##:与正常对照组相比有极显著差异p<0.01;###:与正常对照组相比有极显著差异p<0.001;***:与便秘模型组相比有极显著差异p<0.001;
图8为本发明实施例7中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小鼠血清中胃泌素含量对比图,其中,###:与正常对照组相比有极显著差异p<0.001;***:与便秘模型组相比有极显著差异p<0.001;
图9为本发明实施例7中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小鼠血清中生长抑素含量对比图,其中,##:与正常对照组相比有极显著差异p<0.01;**:与便秘模型组相比有极显著差异p<0.01,无“*”或“#”号标注代表差异不显著;
图10为本发明实施例8中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小鼠血清中5-羟色胺含量对比图,其中,###:与正常对照组相比有极显著差异p<0.001;***:与便秘模型组相比有极显著差异p<0.001;
图11为本发明实施例8中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小鼠血清中血管活性肠肽含量对比图,其中,#:与空白对照组相比有显著差异p<0.05;*:与便秘模型组相比有显著差异p<0.05;**:与便秘模型组相比有极显著差异p<0.01;无“*”或“#”号标注代表差异不显著;
图12为本发明实施例8中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小鼠血清中P物质含量对比图,其中,##:与空白对照组相比有极显著差异p<0.01;*:与便秘模型组相比有显著差异p<0.05;**:与便秘模型组相比有极显著差异p<0.01;无“*”或“#”号标注代表差异不显著;
图13为本发明实施例9中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小鼠血清中肿瘤坏死因子(TNF-α)含量对比图,其中,#:与空白对照组相比有显著差异p<0.05;###:与空白对照组相比有极显著差异p<0.001;***:与便秘模型组相比有极显著差异p<0.001;
图14为本发明实施例10中不同试验组(正常对照组、便秘模型组、冀黑豆1低和冀黑豆1高)小鼠结肠组织切片图;
图15为本发明实施例11中不同试验组(正常对照组、便秘模型组、冀黑豆1低)小鼠肠道微生物的门水平多样性对比图;
图16为本发明实施例11中不同试验组(正常对照组、便秘模型组、冀黑豆1低)小鼠肠道微生物的属水平多样性对比图;
图17为本发明实施例11中小鼠肠道属水平多样性与便秘指标相关性热图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
枯草芽孢杆菌HAU-SDZ6发酵大豆制备纳豆的方法:
将枯草芽孢杆菌HAU-SDZ6的甘油管冷冻保藏菌种融化,并按1%(v/v)接种量接种到LB液体培养基中,37℃下培养48h,得活化菌液;将上述活化菌液按1%(v/v)的接种量接种至LB液体培养基中,放入摇床180r/min、37℃培养12h,得所述枯草芽孢杆菌HAU-SDZ6的培养液;将所述培养液于8000r/min离心,去除上清液,所得菌泥重悬在灭菌后的蒸馏水中,得所述枯草芽孢杆菌HAU-SDZ6的菌液(OD值4.0以上)。
挑选颗粒饱满、无明显虫蛀损坏的冀黑豆1号,清洗干净,将冀黑豆1号置于纳豆机中,加入冀黑豆1号体积3倍量的水,于20℃浸泡12h,将浸泡好的冀黑豆1号放入高压蒸汽灭菌锅内121℃蒸煮30min,冷却至50℃以下,按照每100g蒸熟冀黑豆1号接种10mL上述生长至对数生长期的枯草芽孢杆菌HAU-SDZ6菌液的比例进行接种,在恒温恒湿培养箱内39℃发酵18h,得纳豆。
实施例2
冻干菌粉的制备:
保护剂溶液的配制:蔗糖7.5%,脱脂奶粉10%,余量去离子水,115℃高压蒸汽灭菌锅中灭菌15min;麦芽糊精12.5%,余量去离子水,121℃高压蒸汽灭菌锅中灭菌15min,混匀使用。
取处于稳定期的枯草芽孢杆菌HAU-SDZ6培养液(OD值7.0以上)放置在4℃低温离心机中,8000r/min离心10min,弃去上清液,收集菌泥,向菌泥中加入等体积保护剂溶液,混合均匀,放入-80℃冰箱预冻2h,提前打开真空冷冻干燥机预冷30min,将预冻好的菌泥与保护剂溶液的混合溶液放入冷冻干燥机中冷冻干燥24h,得冻干菌粉。
冻干菌粉发酵纳豆的方法:
挑选颗粒饱满、无明显虫蛀损坏的冀黑豆1号,清洗干净,将冀黑豆1号置于纳豆机中,加入冀黑豆1号体积3倍量的水,于20℃浸泡12h,将浸泡好的冀黑豆1号放入高压蒸汽灭菌锅内121℃蒸煮30min,冷却至50℃以下。
将冻干菌粉加入适量无菌水混匀,按照每200g蒸熟的冀黑豆1号加入1g冻干菌粉的比例进行接种,搅拌均匀,搅拌时用力需轻,避免戳破豆子,将接种后的大豆于39℃发酵18h,得纳豆。
实施例3
纳豆冻干粉的制作:
将发酵好的纳豆室温冷却后,放入-80℃冰箱预冻2h,提前打开真空冷冻干燥机预冷30min,将预冻好的纳豆放入真空冷冻干燥机中冻干24h,取出用粉碎机磨粉后转入真空袋抽真空,得纳豆冻干粉。
实施例4
挑选12种在河北省有较大种植面积、且已通过河北省审定或性状优良的优质高产大豆品种,其中,选择产自邯郸的3种(邯豆11、邯豆15和邯豆18),产自石家庄的3种(冀黑豆1号、石茶豆和石黑豆),产自沧州的3种(沧豆13、沧黑豆2和沧黑豆3),产自张家口地区的3种当地农户一直种植的当地优良大豆品种(绿仁黑豆、黄仁大黑豆、小扁黑豆)。以枯草芽孢杆菌HAU-SDZ6为菌源,按照实施例1的方法制备纳豆,并按照实施例3的方法将纳豆制备成纳豆冻干粉,将制备好的纳豆冻干粉装袋抽真空,在4℃冰箱保存备用。
为了方便,以下将正常对照组记为CK,便秘模型组记为CM,不同产地的大豆品种简称如下:其中产自邯郸的邯豆11、邯豆15和邯豆18分别简称HD11、HD15和HD18;产自石家庄的冀黑豆1号、石茶豆和石黑豆分别简称为JHD1、SChD、SHD;产自沧州的沧豆13、沧黑豆2和沧黑豆3分别简称CD13、CHD2和CHD3;产自张家口的绿仁黑豆、黄仁大黑豆、小扁黑豆分别简称为ZJK-3、ZJK-4和ZJK-5。
购买5周龄雄性ICR小鼠,适应性饲养两周后,将小鼠随机分成14组,每组6只小鼠。其中包括正常对照组(CK)、便秘模型组(CM)以及第一轮筛选用的12个大豆品种的纳豆处理组:邯豆11(HD11)、邯豆15(HD15)、邯豆18(HD18)、冀黑豆1号(JHD1)、石茶豆(SChD)、石黑豆(SHD)、沧豆13(CD13)、沧黑豆2(CHD2)、沧黑豆3(CHD3)、绿仁大黑豆(ZJK-3)、黄仁大黑豆(ZJK-4)、小扁黑豆(ZJK-5)。
根据小鼠体重,按照4g/kg(纳豆冻干粉(g)/小鼠体重(kg))的灌胃剂量计算各组小鼠所需纳豆冻干粉的量。每天早上根据计算量大致称取制备的纳豆冻干粉,并按照200mg/mL(即纳豆冻干粉(mg)/蒸馏水体积(mL))的浓度计算溶解所需的蒸馏水的体积,再将称取的纳豆冻干粉溶于蒸馏水中,充分振荡混匀,得到纳豆冻干粉溶液。每天早上九点开始灌胃,整个实验周期为17天。第1天~第14天,按照表1进行灌胃给药;在第7天、第14天早上灌胃时对小鼠进行称重,按照小鼠体重更新灌胃体积;第14天,各组小鼠禁食不禁水16h。其中,于第15天~第17天进行便秘造模,便秘模型组和纳豆处理组以30mg/kg(复方地芬诺酯(mg)/小鼠体重(kg))剂量进行灌胃复方地芬诺酯混悬液,纳豆处理组以相同剂量灌胃复方地芬诺酯混悬液后,再以4g/kg灌胃剂量灌胃纳豆冻干粉溶液,正常对照组灌胃与便秘模型组灌胃的复方地芬诺酯混悬液等体积的蒸馏水。于第17天,也即便秘模型组造模的最后一天,除按照上述第15天和第16天的灌胃方法灌胃各组小鼠外,在灌胃完成30min后,正常对照组、便秘模型组和纳豆处理组小鼠均灌胃2%的洋红溶液,灌胃体积根据小鼠体重计算,以每10g小鼠体重灌胃100μL计算每只小鼠灌胃洋红溶液的灌胃体积。从灌胃洋红溶液开始,记录每只动物首粒排红色粪便的时间、6h内排便粒数及重量,各组小鼠的6h内排便粒数和首粒排便时间结果如表2和表3所示。
洋红溶液的配制方法为:称取1g洋红染料,加入49mL蒸馏水,配成2%洋红溶液。
表1动物实验分组情况
表2灌胃剂量4g/kg下各组小鼠6h内排便粒数
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
表3灌胃剂量4g/kg下各组小鼠首粒排便时间
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
由表2可以看出,便秘模型组6h粪便粒数显著低于正常对照组,证明便秘模型小鼠造模成功。在纳豆处理组的小鼠中发现,用HD11、HD15、HD18、JHD1、CD13、CHD2、CHD3、ZJK-5制作的纳豆冻干粉灌胃时,小鼠6h内粪便粒数显著高于便秘模型组(p<0.05),表明用上述大豆品种制作的纳豆在4g/kg剂量下能显著促进便秘小鼠的排便,明显表现出了润肠通便作用。另外还发现,用SChD、SHD、ZJK-3、ZJK-4制作的纳豆冻干粉灌胃时,小鼠6h粪便粒数与便秘模型组相比均无显著差异(p>0.05),表明这四种大豆制作的纳豆在4g/kg剂量下对便秘小鼠不具有润肠通便作用。
从表3中的首粒排便时间看,便秘模型组极显著高于正常对照组。在纳豆处理组的小鼠中,灌胃用HD11、HD15、HD18、JHD1、CD13、CHD2、CHD3、ZJK-5制备的纳豆冻干粉时,小鼠首粒排便时间显著低于便秘模型组(p<0.05),表明用上述大豆制作的纳豆对小鼠通便有促进作用。当灌胃用SChD、SHD、ZJK-3、ZJK-4制作的纳豆冻干粉时,小鼠首粒排便时间与便秘模型组相比无显著差异(p>0.05),表明用这四种大豆制作的纳豆对便秘小鼠未表现出促排便作用。
综合以上结果,在第一轮筛选的12种大豆品种中,有8个大豆品种(HD11、HD15、HD18、JHD1、CD13、CHD2、CHD3、ZJK-5)制作的纳豆冻干粉表现出显著的促排便作用,有四个大豆品种(SChD、SHD、ZJK-3、ZJK-4)制作的纳豆在4g/kg剂量下对便秘模型小鼠未表现出促排便作用。
接下来,对第一轮筛选出的8种大豆品种(即HD11、HD15、HD18、JHD1、CD13、CHD2、CHD3、ZJK-5)重新进行第二轮筛选,动物实验分组及试验过程同第一轮筛选,不同的仅是将纳豆冻干粉的剂量由第一轮的4g/kg降至2g/kg。各组小鼠6小时粪便粒数和首粒排便时间结果分别如表4和表5所示。
表4灌胃剂量2g/kg下各组小鼠6h内排便粒数
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
表5灌胃剂量2g/kg下各组小鼠首粒排便时间
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
由表4可以看出,便秘模型组6h粪便粒数极显著低于正常对照组,证明便秘模型组小鼠造模成功。在纳豆处理组的小鼠中发现,用HD15、HD18、JHD1、CD13、CHD2制作的纳豆冻干粉灌胃时,小鼠6h内粪便粒数显著高于便秘模型组(p<0.05),表明用上述大豆品种制作的纳豆在2g/kg剂量下能显著促进便秘小鼠的排便,表现出显著的润肠通便作用。另外还发现,用HD11、CHD3、ZJK-5制作的纳豆冻干粉灌胃时,小鼠6h粪便粒数与便秘模型组相比均无显著差异(p>0.05),表明这三种大豆制作的纳豆在2g/kg剂量下对便秘小鼠不具有润肠通便作用。
从表5中的首粒排便时间看,便秘模型组显著高于正常对照组。在纳豆处理组的小鼠中,灌胃用HD15、HD18、JHD1、CD13、CHD2制备的纳豆冻干粉时,小鼠首粒排便时间显著低于便秘模型组(p<0.05),表明用上述大豆制作的纳豆对小鼠通便具有促进作用;当灌胃用HD11、CHD3、ZJK-5制备的纳豆冻干粉时,小鼠首粒排便时间与便秘模型组相比无显著差异(p>0.05),表明用这三种大豆制作的纳豆对便秘小鼠未表现出促排便作用。
综合以上结果,在第二轮筛选中,有5种大豆(HD15、HD18、JHD1、CD13、CHD2)制作的纳豆冻干粉能显著促进便秘小鼠的排便,表明上述5种大豆制作的纳豆在2g/kg剂量下具有显著的润肠通便作用。
接下来,对第二轮筛选出的5种大豆品种(即HD15、HD18、JHD1、CD13、CHD2)进行第三轮筛选,动物实验分组及试验过程同第一轮筛选,不同的仅是将纳豆冻干粉的剂量由第二轮的2g/kg降至1g/kg。各组小鼠6小时粪便粒数和首粒排便时间结果分别如表6和表7所示。
表6灌胃剂量1g/kg下各组小鼠6h内排便粒数
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
表7灌胃剂量1g/kg下各组小鼠首粒排便时间
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
由表6可以看出,便秘模型组6h粪便粒数极显著低于正常对照组,证明便秘模型组小鼠造模成功。在纳豆处理组的小鼠中发现,用JHD1制备纳豆时,小鼠6h内粪便粒数显著高于便秘模型组(p<0.05),表明用JHD1制作的纳豆在1g/kg剂量下能促进便秘小鼠的排便,具有抗便秘作用;用HD15、HD18、CD13、CHD2制作的纳豆冻干粉灌胃时发现,小鼠6h粪便粒数与便秘模型组相比均无显著差异(p>0.05),表明这四种大豆制作的纳豆在1g/kg剂量下对便秘小鼠不具有促排便作用。
从表7中的首粒排便时间看,便秘模型组极显著高于正常对照组。在纳豆处理组的小鼠中,灌胃用JHD1纳豆冻干粉时,小鼠首粒排便时间显著低于便秘模型组(p<0.05),表明用JHD1制作的纳豆对小鼠通便具有促进作用;当灌胃用HD15、HD18、CD13、CHD2制作的纳豆冻干粉时,小鼠首粒排便时间与便秘模型组相比无显著差异(p>0.05),表明用这四种大豆制作的纳豆对便秘小鼠未表现出促排便作用。
综合以上结果,在第三轮筛选中,在待筛选的5种大豆品种中,仅JHD1制作的纳豆冻干粉在1g/kg剂量下表现出明显的促排便作用。
实施例5
为了研究JHD1纳豆冻干粉对小鼠体征、进食量和组织器官的影响,在完成上述不同大豆品种的三轮筛选试验后,分别以高剂量(2g/kg)的JHD1纳豆冻干粉(简称冀黑豆1高)和低剂量(1g/kg)的JHD1纳豆冻干粉((简称冀黑豆1低)重新进行小鼠试验。试验分为四组:正常对照组(CK)、便秘模型组(CM)、高剂量JHD1纳豆冻干粉组和低剂量JHD1纳豆冻干粉组,每组小鼠6只。试验过程与第一轮筛选时的灌胃试验过程完全相同。试验开始后,跟踪观察并记录各组小鼠毛色、小鼠进食量、活跃程度等情况。试验期间小鼠食物和饮用水保证充足,小鼠自由进食饮水,于每日早上灌胃后统一给小鼠补充饲料,饮用水一般3-4天周期补充一次。
在试验第17天灌胃洋红溶液后测定6h内粪便粒数和首粒排便时间,所有小鼠禁食不禁水12h,于第18天对小鼠进行麻醉后,采用眼球取血,取血后脱颈处死小鼠,对小鼠进行解剖,观察小鼠内脏并取小鼠的心脏、肝脏、肾脏、脾脏和胸腺进行称重记录,计算脏器指数,脏器指数=脏器重量/小鼠体重。结果如表8~表9所示。
表8小鼠不同生长期的进食量(g)
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
表9灌胃JHD1纳豆对小鼠脏器指数的影响
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
试验结果证明,在整个灌胃周期中,各组小鼠皮毛都光滑润泽,色白,眼球粉红色,未见任何不良反应,表明本发明提供的纳豆冻干粉对小鼠安全无害。
小鼠在第0d、14d、17d的平均进食量结果如表8所示。结果表明,从试验开始前,到灌胃冀黑豆1号纳豆冻干粉小鼠预防期,直至便秘模型小鼠造模结束,小鼠平均进食量均无显著差异,表明灌胃JHD1纳豆冻干粉和复方地酚诺酯对小鼠进食量无显著影响。
动物脏器重量及相关系数变化是反映动物内脏器官功能是否正常的关键指标,各组小鼠的各脏器指数如表9所示。从表9可以看出,与正常对照组相比,各组小鼠脏器指数均无显著差异(p>0.05),表明灌胃复方地芬诺酯和JHD1纳豆冻干粉均未造成小鼠脏器异常或损伤。
实施例6
JHD1纳豆冻干粉对便秘模型小鼠粪便性状及排便是否顺畅的影响试验研究:
(1)小鼠粪便性状的研究
小鼠粪便性状是评价便秘模型构建成功与否的重要指标。按照实施例5相同的方法进行实验,取第17天各组小鼠的粪便进行观察,如图1所示,发现便秘模型组的小鼠粪便颗粒变小、表面干燥,喂食低剂量和高剂量JHD1纳豆冻干粉的小鼠粪便表面有光泽、湿润、形状为椭球形。
正常对照组小鼠粪便多呈黄褐色椭球状,粪便表面有光泽;与正常对照组相比,复方地酚诺酯处理3d后,小鼠粪便均出现干硬无光泽状态,黑色椭球形,粪便颗粒较小。与便秘模型组小鼠的粪便相比,JHD1纳豆冻干粉低剂量组(简称冀黑豆1低)小鼠粪便多为深褐色椭球形,粪便表面有光泽、湿润;JHD1纳豆冻干粉高剂量组(简称冀黑豆1高)小鼠粪便多为深褐色椭球形,色稍发黑,粪便表面有光泽、湿润。且与便秘模型组小鼠的粪便颗粒相比,灌胃JHD1低剂量组和高剂量组的小鼠的粪便颗粒明显变大,粪便明显湿润有光泽。该结果表明,灌胃JHD1纳豆冻干粉对便秘模型小鼠有较好的润肠作用。
(2)对小鼠6h内粪便粒数的影响
记录各组小鼠第17d的6h粪便粒数,对比分析灌胃低剂量和高剂量JHD1纳豆冻干粉对小鼠排便粒数的影响,结果如图2和表10所示。
表10各组小鼠6h内排便粒数
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果可知,与正常对照组相比,便秘模型组小鼠6h粪便粒数极显著下降,证明便秘模型组小鼠造模成功。与便秘模型组小鼠相比,灌胃JHD1低剂量纳豆冻干粉组(冀黑豆1低)和灌胃JHD1高剂量纳豆冻干粉组(冀黑豆1高)小鼠的6h粪便粒数均极显著增加(p<0.001),表明JHD1纳豆冻干粉对便秘小鼠有促排便作用。
(3)对小鼠首粒排便时间的影响
统计各组小鼠在第17天的首粒排便时间,结果如图3和表11所示。
表11各组小鼠首粒排便时间
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果可知,灌胃复方地酚诺酯导致小鼠排便时间延长。与正常对照组小鼠相比,便秘模型组小鼠的首粒排便时间极显著延长(p<0.001),JHD1低剂量纳豆冻干粉组(冀黑豆1低)、JHD1高剂量纳豆冻干粉组(冀黑豆1高)与便秘模型组相比,首粒排便时间极显著缩短(p<0.001)。该结果表明,JHD1纳豆冻干粉以低剂量灌胃便秘小鼠时,即能达到明显缩短排便时间的效果。
(4)对小鼠粪便含水率的影响
粪便中水分含量的多少是便秘症状的代表性指标之一。测定不同组小鼠在第17d时的粪便含水率,结果如图4和表12所示。
表12各组小鼠粪便的含水率
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果可知,与正常对照组相比,便秘模型组的粪便含水率极显著降低(p<0.001),灌胃低剂量(冀黑豆1低)和高剂量(冀黑豆1高)JHD1纳豆冻干粉均能够极显著提高小鼠粪便中的水分含量(p<0.001)。
(5)对小鼠肠道推进率的影响
用直尺记录幽门至回盲部总长度和洋红溶液在各组小鼠的肠道中推进的距离,结果如图5~图6和表13所示。
小肠推进率=洋红溶液推进距离(cm)/幽门至回盲部总长度(cm)×100%
表13各组小鼠的小肠推进率
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果显示,便秘模型组小鼠的小肠推进率极显著低于正常对照组;JHD1纳豆冻干粉低剂量组(冀黑豆1低)和JHD1纳豆冻干粉高剂量组(冀黑豆1高)小鼠小肠推进率极显著高于便秘模型组(p<0.001),并且与正常对照组相比无显著差异(p>0.05),该结果表明喂食JHD1纳豆冻干粉能够有效促进肠道蠕动,有助于小鼠排便。
实施例7
JHD1纳豆冻干粉对胃肠道激素的影响:
按照实施例5相同的方法进行实验,第17天试验结束后,小鼠禁食不禁水12h,于第18天对小鼠进行麻醉后,采用眼球取血,得小鼠血液,于4℃,3000rpm/min离心20min,取血清进行测试。
(1)对小鼠胃动素和胃泌素的影响
胃动素(Motilin,MTL)和胃泌素(Gastrin,Gas)属胃肠激素,主要通过作用于胃肠道平滑肌系统,加快胃肠蠕动,促进排便。测定各组小鼠血清中胃肠激素胃动素和胃泌素的含量,结果如图7~图8和表14所示。
表14各组小鼠血清中胃动素和胃泌素含量
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果表明,胃动素和胃泌素表现出了相似的变化规律,即与正常对照组小鼠相比,复方地酚诺酯诱导的便秘模型组小鼠血清中胃动素和胃泌素含量均极显著降低(p<0.001)。与便秘模型组组相比,灌胃低剂量JHD1纳豆冻干粉(冀黑豆1低)的小鼠极显著逆转了胃动素和胃泌素的降低(p<0.001),且均与正常对照组无显著差异。类似地,灌胃高剂量JHD1纳豆冻干粉(冀黑豆1高)的小鼠极显著逆转了胃动素和胃泌素的降低(p<0.001),其中胃泌素与正常对照无显著差异,但胃动素极显著高于正常对照组(p<0.01)。该研究结果表明,JHD1纳豆冻干粉可通过加快便秘模型组小鼠的胃肠蠕动,加快排便,防止便秘发生。
(2)对小鼠生长抑素的影响
生长抑素(somatostatin,SS)属抑制性胃肠激素,可使胃肠道平滑肌松弛,蠕动减少,延长胃肠道传输时间。测定各组小鼠血清中生长抑素的含量,结果如图9和表15所示。
表15各组小鼠血清中生长抑素含量
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果表明,与正常对照组小鼠相比,复方地酚诺酯诱导的便秘模型组小鼠血清中生长抑素含量极显著升高(p<0.01)。与便秘模型组相比,灌胃高剂量JHD1纳豆冻干粉(冀黑豆1高)的小鼠(JHD1-H)极显著逆转了生长抑素的升高(p<0.01),且与正常对照组无显著差异;但灌胃低剂量JHD1纳豆冻干粉(冀黑豆1低)的小鼠却未能显著逆转生长抑素的降低。
实施例8
JHD1纳豆冻干粉对神经递质的影响:
按照实施例5相同的方法进行实验,第17天试验结束后,小鼠禁食不禁水12h,于第18天对小鼠进行麻醉后,采用眼球取血,得小鼠血液,于4℃,3000rpm/min离心20min,取血清进行测试。
(1)对小鼠5-羟色胺的影响
5-羟色胺(5-hydroxytryptamine,5-HT)可以刺激胃肠粘液的分泌、血管的扩张以及平滑肌的收缩,可触发胃肠蠕动和分泌反射,并在正常自主排便和内脏感觉方面起重要作用,能有效促进排便。对不同组小鼠血清中5-羟色胺的含量进行测定,结果如图10和表16所示。
表16各组小鼠血清中5-羟色胺含量
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果发现,与正常对照组小鼠组相比,便秘模型组小鼠的5-羟色胺含量极显著降低(p<0.001);灌胃JHD1低剂量纳豆冻干粉(冀黑豆1低)和高剂量(冀黑豆1高)纳豆均能极显著逆转5-羟色胺的下降(p<0.001),且逆转后的5-羟色胺与正常对照组小鼠均无显著差异。表明,灌胃JHD1纳豆冻干粉有利于神经递质5-羟色胺的合成与释放,极显著提高了小鼠血清中5-羟色胺含量。
(2)对小鼠血管活性肠肽的影响
血管活性肠肽(Vasoactive intestinal peptide,VIP)是一个由28个氨基酸组成的多肽,在胃肠VIP主要以神经递质的方式发挥局部作用。VIP可使平滑肌松弛和血管舒张,促进肠道水和电解质的分泌。对不同组小鼠血清中VIP的含量进行测定,结果如图11和表17所示。
表17各组小鼠血清中血管活性肠肽的含量
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果发现,与正常对照组相比,便秘模型组小鼠血清中血管活性肠肽(VIP)含量显著降低(p<0.05);灌胃高剂量JHD1纳豆冻干粉的小鼠(冀黑豆1高)极显著逆转了VIP的降低(p<0.01),且与正常对照组无显著差异,但灌胃低剂量JHD1纳豆冻干粉的小鼠(冀黑豆1低)却未能显著逆转VIP的降低。
(3)对小鼠P物质的影响
P物质(Substance P,SP)是分布在肠道肌间神经丛的兴奋性运动神经递质,在肠道平滑肌收缩、环纵平滑肌协调性收缩中有重要作用,对肠道蠕动有正调控作用。对不同组小鼠血清中血管P物质的含量进行测定,结果如图12和表18所示。
表18各组小鼠血清中血管P物质含量
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果表明,与正常对照组相比,便秘模型组小鼠血清中P物质含量极显著降低(p<0.01);灌胃高剂量JHD1纳豆冻干粉的(冀黑豆1高)小鼠显著逆转了P物质的降低(p<0.05),且与正常对照组无显著差异,但灌胃低剂量JHD1纳豆冻干粉(冀黑豆1低)的小鼠却未能显著逆转P物质的降低。
实施例9
JHD1纳豆冻干粉对炎症因子TNF-α的影响:
按照实施例5相同的方法进行实验,第17天试验结束后,小鼠禁食不禁水12h,于第18天对小鼠进行麻醉后,采用眼球取血,得小鼠血液,于4℃,3000rpm/min离心20min,取血清进行测试。
肿瘤坏死因子(TNF-α)是调节免疫细胞趋化作用的重要促炎性细胞因子,对各组小鼠血清中TNF-α含量进行测定,结果如图13和表19所示。
表19各组小鼠血清中TNF-α含量
注:同列数据后字母不同表示差异显著或极显著,字母相同表示无显著性差异。
结果表明,与正常对照组相比,便秘模型组TNF-α含量极显著升高(p<0.001);灌胃低剂量JHD1纳豆冻干粉(冀黑豆1低)和高剂量(冀黑豆1高)的均能极显著逆转TNF-α的升高(p<0.001),且冀黑豆1高小鼠组逆转后的TNF-α与正常对照组小鼠无显著差异,冀黑豆1低小鼠组虽能极显著逆转TNF-α的升高,但逆转后的TNF-α仍显著高于(p<0.05)正常对照组小鼠。该结果表明,灌胃JHD1纳豆冻干粉可通过降低小鼠炎症因子表达发挥其抗便秘功能。
实施例10
JHD1纳豆冻干粉对小鼠结肠组织病理切片的影响:
按照实施例5相同的方法进行实验,第17天试验结束后,小鼠禁食不禁水12h,于第18天对小鼠进行麻醉后脱颈处死,对小鼠进行解剖,取各组小鼠结肠放入加满组织固定液的10mL试管保存,采用HE染色法制作组织切片,200倍成像倍数下的结果如图14所示。
由图14可以看出,正常对照组小鼠的结肠组织各层结构清晰,黏膜层上皮完整、细胞形态正常,肠腺数量丰富、排列紧密,未见明显的炎性改变;便秘模型组黏膜层偶见淋巴细胞呈灶性浸润(黑色箭头);JHD1纳豆冻干粉低剂量组(冀黑豆1低)、JHD1纳豆冻干粉高剂量组(冀黑豆1高)与正常对照组相比未见明显差异。
实施例11
JHD1纳豆冻干粉对小鼠肠道微生物多样性的影响:
按照实施例5相同的方法进行实验,第17天造模试验结束后,将收集到的正常对照组、便秘模型组、JHD1纳豆冻干粉低剂量组(冀黑豆1低)以每组6只,共18只小鼠粪便进行16S rDNA扩增子测序。扩增区域为16S V34;引物序列分别为CCTAYGGGRBGCASCAG和GGACTACNNGGGTATCTAAT。反应体系:15μL
(1)对门水平多样性的影响
为分析比较各组间的菌群丰度,根据OTUs序列的物种注释结果,选取门水平上相对丰度前10的物种绘制物种相对丰度柱形图,结果如图15所示。
从图15可以看出,在门水平上,各组的优势菌门均为拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)。为更加清楚了解不同组在门水平多样性上的差异,列出每组小鼠位于前10的门及所占百分比。正常对照组:拟杆菌门(Bacteroidota)73.89%、厚壁菌门(Firmicutes)19.13%、变形菌门(Proteobacteria)1.85%未分类细菌(unidentified_Bacteria)1.20%、疣微菌门(Verrucomicrobiota)1.12%、弯曲菌门(Campylobacterota)0.692%、蓝菌门(Cyanobacteria)0.196%、梭杆菌门(Fusobacteriota)0.078%、脱铁杆菌门(Deferribacteres)0.066%、放线菌门(Actinobacteria)0.062%。便秘模型组:拟杆菌门(Bacteroidota)69.65%、厚壁菌门(Firmicutes)23.17%、疣微菌门(Verrucomicrobiota)1.89%、未分类细菌(unidentified_Bacteria)1.74%、弯曲菌门(Campylobacterota)0.626%、变形菌门(Proteobacteria)0.617%、放线菌门(Actinobacteria)0.205%、蓝菌门(Cyanobacteria)0.135%、脱铁杆菌门(Deferribacteres)0.057%、梭杆菌门(Fusobacteriota)0.0025%。JHD1纳豆冻干粉低剂量灌胃组:拟杆菌门(Bacteroidota)62.79%、厚壁菌门(Firmicutes)26.10%、未分类细菌(unidentified_Bacteria)3.14%、变形菌门(Proteobacteria)3.01%、弯曲菌门(Campylobacterota)1.21%、疣微菌门(Verrucomicrobiota)0.630%、脱铁杆菌门(Deferribacteres)0.217%、梭杆菌门(Fusobacteriota)0.112%、蓝菌门(Cyanobacteria)0.072%、放线菌门(Actinobacteria)0.058%。
与正常对照组(CK)相比,便秘模型组(CM)的拟杆菌门、变形菌门丰度下降,厚壁菌门、疣微菌门和放线菌门丰度增加。与CM组相比,灌胃低剂量纳豆冻干粉(冀黑豆1低)的厚壁菌门、变形菌门、弧形菌门、脱铁杆菌门增加,疣微菌门、放线菌门、蓝菌门丰度降低。该结果表明,在门水平上,灌胃JHD1-L可有效逆转由便秘引起的变形菌门的降低和疣微菌门的升高。
(2)对属水平多样性的影响
除门水平外,还对小鼠肠道菌群属水平差异进行分析,以了解JHD1低剂量纳豆冻干粉(冀黑豆1低)对便秘小鼠肠道菌群某些特定属的丰度调节,结果如图16所示。
为更加清楚了解不同组在属水平多样性上的差异,列出每组小鼠位于前10的属及所占百分比。正常对照组:拟杆菌属(Bacteroides)15.30%、另枝菌属(Alistipes)4.68%、拟普雷沃菌属(Alloprevotella)2.99%、副杆菌属(Parabacteroides)2.00%、毛螺菌科_NK4A136_群(Lachnospiraceae_NK4A136_group)1.71%、阿克曼氏菌属(Akkermansia)1.12%、联合乳杆菌属(Ligilactobacillus)0.946%、粘液乳杆菌属(Limosilactobacillus)0.750%、臭气杆菌属(Odoribacter)0.652%、苏黎世杆菌属(Turicibacter)0.406%。便秘模型组:拟杆菌属(Bacteroides)15.65%、另枝菌属(Alistipes)4.07%、拟普雷沃菌属(Alloprevotella)3.51%、副杆菌属(Parabacteroides)3.39%、阿克曼氏菌属(Akkermansia)1.88%、苏黎世杆菌属(Turicibacter)1.55%、毛螺菌科_NK4A136_群(Lachnospiraceae_NK4A136_group)1.44%、粘液乳杆菌属(Limosilactobacillus)1.02%、臭气杆菌属(Odoribacter)0.909%、联合乳杆菌属(Ligilactobacillus)0.712%。JHD1纳豆冻干粉低剂量灌胃组:拟杆菌属(Bacteroides)15.65%、另枝菌属(Alistipes)4.88%、毛螺菌科_NK4A136_群(Lachnospiraceae_NK4A136_group)2.69%、拟普雷沃菌属(Alloprevotella)2.54%、副杆菌属(Parabacteroides)2.40%、粘液乳杆菌属(Limosilactobacillus)1.65%、联合乳杆菌属(Ligilactobacillus)1.54%、臭气杆菌属(Odoribacter)1.36%、阿克曼氏菌属(Akkermansia)0.629%、苏黎世杆菌属(Turicibacter)0.024%。
与正常对照组(CK)组相比,便秘模型组(CM)的拟普雷沃氏菌属、苏黎世杆菌属、阿克曼氏菌属、副拟杆菌属丰度增加,另枝菌属、联合乳杆菌属、毛螺菌科NK4A136群丰度降低。与CM组相比,灌胃JHD1-L的小鼠其肠道微生物中的另枝菌属、联合乳杆菌属、臭气杆菌属、粘液乳杆菌属、毛螺菌科NK4A136群丰度增加,而拟普雷沃氏菌属、苏黎世杆菌属、副拟杆菌属、阿克曼氏菌丰度降低。该结果表明,灌胃JHD1的低剂量纳豆冻干粉(冀黑豆1低)可有效逆转便秘小鼠肠道微生物菌群中拟普雷沃氏菌属、苏黎世杆菌属、副拟杆菌属和阿克曼氏菌丰度的升高,同时有效逆转便秘小鼠肠道微生物菌群中另枝菌属、联合乳杆菌属和毛螺菌科NK4A136群的下调。
(3)肠道菌群与便秘指标相关分析
为探究肠道微生物和便秘指标之间的关联性,对丰度位于前20的属水平上的物种与便秘指标作Spearman相关分析,结果如图17所示。
从图17可以看出,通过相关性分析发现所列出的属中有9属与小鼠便秘指标呈现相关性,具体包括:红育菌属(Rhodoferax)、杜氏杆菌属(Dubosiella)、螺杆菌属(Helicobacter)、文肯菌科Rc9肠道类群(Rikenellaceae_Rc9_gut_gut_group)、毛螺菌科NK4A136类群(Lachnospiraceae_NK4A136_group)、副拟杆菌属(Parabacteroides)、阿克曼氏菌属(Akkermansia)、苏黎世杆菌属(Turicibacter)、拟杆菌属(Bacteroides)。通过与不同组的小鼠肠道菌群门水平和属水平上差异进行联合分析,发现本研究中既与小鼠便秘指标相关且灌胃JHD1低剂量纳豆冻干粉后又能有效逆转的包括四个属,即副拟杆菌属(parabacteroides)、毛螺菌科NK4A136群(Lachnospiraceae_NK4A136_group)、阿克曼氏菌属(Akkermansia)和苏黎世杆菌属(Turicibacter)。前面通过肠道微生物多样性在属水平上的变化分析发现,JHD1低剂量纳豆冻干粉能有效逆转便秘引起的副拟杆菌属、阿克曼氏菌属和苏黎世杆菌属丰度的升高,同时还能有效逆转便秘引起的毛螺菌科NK4A136群丰富的下降。
由图17可以看出,副拟杆菌属与五项便秘指标呈显著相关性:与6h粪便粒数(FN)呈显著负相关(p<0.05)、与首粒排便时间(FDT)呈极显著正相关(p<0.01)、与粪便含水率(FWC)呈显著负相关(p<0.05)、与小肠推进率(GIT)呈显著负相关(p<0.05),与肿瘤坏死因子(TNF-α)呈极显著正相关(p<0.01)。该结果提示副拟杆菌属与便秘的发生发展密切相关,副拟杆菌属丰度的升高可能会导致小鼠排便困难,引发炎症,加剧便秘。在上述有关便秘引起的小鼠肠道菌群属水平多样性变化分析中已发现,与正常对照组相比,便秘模型组小鼠肠道中的副拟杆菌属的丰度是明显升高的,这表明致便秘药物复方地芬诺酯可引起小鼠肠道菌群中副拟杆菌属丰度的升高,引起小鼠排便困难,进而导致便秘发生,而低剂量JHD1纳豆冻干粉(冀黑豆1低)恰好可通过有效逆转副拟杆菌属丰度的升高来缓解便秘。
除副拟杆菌属外,在相关性分析中还发现毛螺菌科NK4A136群与三项便秘指标呈显著相关性:与小肠推进率(GIT)呈显著正相关(p<0.05)、与胃动素(MTL)呈显著正相关(p<0.05);与血管活性肠肽(VIP)呈显著正相关(p<0.05)。该结果表明,小鼠肠道菌群中毛螺菌科NK4A136群丰度升高有利于促进小鼠正常排便。在上述有关便秘引起的小鼠肠道菌群属水平多样性变化分析中已发现,与正常对照组相比,便秘模型组小鼠肠道菌群中的毛螺菌科NK4A136的丰度明显下降,而灌胃JHD1低剂量纳豆冻干粉(冀黑豆1低)可有效逆转由便秘引起的毛螺菌科NK4A136的丰度下调。这表明灌胃JHD1低剂量纳豆冻干粉可通过逆转由致便秘药物复方地芬诺酯引起的毛螺菌科NK4A136的丰度下降来预防或缓解便秘。
另外,从图17可以看出,阿克曼氏菌属与胃动素(MTL)呈显著负相关(p<0.05)。前面有关胃肠激素检测结果已证实,致便秘药物复方地芬诺酯可显著抑制MTL的分泌。上述有关便秘引起的小鼠肠道微生物属水平多样性变化分析中已发现,与正常对照组相比,便秘模型组小鼠肠道阿克曼氏菌属丰度显著升高。阿克曼氏菌属是疣微菌门的代表,在上述有关便秘引起的小鼠肠道菌群门水平多样性变化分析中已发现,与正常对照组相比,便秘模型组小鼠肠道疣微菌门丰度显著升高,这恰与属水平多样性分析中便秘模型组小鼠阿克曼氏菌属丰度升高相一致,而灌胃JHD1纳豆冻干粉能有效逆转由便秘引起的疣微菌门和阿克曼氏菌属丰度的升高。因此,JHD1纳豆冻干粉可能通过降低阿克曼氏菌属的丰度来增加MTL的分泌,进而对小鼠起到促排便作用。
从图17还可以看出,苏黎世杆菌属与胃泌素(Gas)呈极显著负相关(p<0.01)。前面有关胃肠激素检测结果已证实,致便秘药物复方地芬诺酯可显著抑制Gas的分泌。在上述有关便秘引起的小鼠肠道菌群门水平多样性变化分析中已发现,与正常对照组相比,便秘模型组小鼠肠道苏黎世杆菌属丰度升高,而灌胃低剂量JHD1纳豆冻干粉(JHD1-L)可明显降低苏黎世杆菌属的丰度,表明低剂量JHD1纳豆冻干粉可能通过降低苏黎世杆菌属丰度来促进Gas的分泌,进而促进小鼠排便。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
