用于预防脂肪肝病、预防脂肪肝病进展和治疗脂肪肝病的地那铵盐
文献发布时间:2024-04-18 20:01:23
相关申请的交叉引用
本申请要求2021年2月1日提交的美国临时专利申请号63/144,386的优先权权益。
技术领域
本公开文本提供了一种用于预防脂肪肝病、预防其进展和对其进行治疗的方法,所述方法包括施用有效量的药物组合物,所述药物组合物包含苦味受体激动剂,所述苦味受体激动剂包含地那铵盐,其中所述地那铵盐选自乙酸地那铵(DA)、柠檬酸地那铵、马来酸地那铵、糖地那铵和酒石酸地那铵;并且其中用于预防脂肪肝病或预防其进展的地那铵盐的每日剂量是约0.1mg/kg/天至约8mg/kg/天并且用于治疗现有脂肪肝病的地那铵盐的每日剂量是约1mg/kg/天至约8mg/kg/天,各自以QD、BID或TID施用。
背景技术
脂肪肝病是描述一组肝脏疾病的术语,所述肝脏疾病包括非酒精性脂肪性肝炎(NASH)、酒精性脂肪性肝炎(ASH)、非酒精性脂肪肝病(NAFLD)和HIV相关脂肪性肝炎,伴有或不伴有肝纤维化。具体地,非酒精性脂肪性肝炎(NASH)是一种与发病率和死亡率的增加相关的常见肝病。但是,尽管许多化合物正在所谓的NASH治疗模型中进行测试,但没有FDA批准的治疗选项。非酒精性脂肪肝病(NAFLD)是一种在美国影响多达每3-5名成年人中有1人以及每10名儿童中有1人的障碍。在这些情况下,很少饮酒或不饮酒的人的肝脏中存在多余脂肪的积聚。NAFLD最常见的形式是一种称为肝脂肪变性(脂肪肝)的非严重病症,其中脂肪积聚在肝细胞中:尽管这不正常,但其本身可能不会损害肝脏。NAFLD最常出现在具有一系列称为代谢综合征的风险因素的个体中,其特征为空腹血浆葡萄糖(FPG)升高,伴有或不伴有对餐后葡萄糖的不耐受、超重或肥胖、高血脂诸如胆固醇和甘油三酯(TG)以及低高密度脂蛋白胆固醇(HDL-C)水平以及高血压;但并非所有患者都具有代谢综合征的所有表现。肥胖症被认为是NAFLD最常见的原因;并且一些专家估计,约三分之二的肥胖成人和一半的肥胖儿童可能患有脂肪肝。大多数患有NAFLD的个体没有症状并且体检正常(尽管肝脏可能略有增大);儿童可能展现出诸如腹痛和疲劳的症状并且可能显示出斑片状深色皮肤变色(黑棘皮病)。NAFLD的诊断通常首先怀疑在超重或肥胖的人中,这些人在常规测试中被发现在他们的肝脏血液测试中有轻度升高,尽管NAFLD可能在正常的肝脏血液测试中出现或者在成像检查诸如腹部超声或CT扫描中偶然被检测到。成像研究证实了这一点,最常见的是肝脏超声或磁共振成像(MRI),并且排除了其他原因。
一些患有NAFLD的患者可能会发展成更严重的病症,称为非酒精性脂肪性肝炎(NASH):约2%-5%的美国成年人和高达20%的肥胖者可能患有NASH。在NASH中,肝脏中的脂肪积聚与炎症和不同程度的疤痕相关。NASH是一种潜在的严重病症,其具有进展为终末期肝病、肝硬化和肝细胞癌的巨大风险。一些发展肝硬化的患者有肝衰竭的风险并且最终可能需要肝移植。因此,减轻体重是预防NASH或减缓NASH进展的推荐方式。然而,一旦发生肝纤维化损伤,减轻体重没有显示可治疗NASH。
NAFLD可以通过NAFLD活动得分(NAS)与NASH进行区分,NAFLD活动得分是脂肪变性(0-3)、小叶炎症(0-2)和肝细胞气球样变(0-2)的肝脏活检的组织病理学得分的总和。<3的NAS对应于NAFLD,3-4对应于临界NASH,并且≥5对应于NASH。活检也对纤维化进行评分(0至4)。
NASH是导致终末期肝病的主要原因。
NAFLD和NASH的治疗
目前没有药物被批准用于预防或治疗NAFLD或NASH。已经在NAFLD/NASH中尝试了许多药理学干预,但总体益处有限。抗氧化剂可以阻止脂质过氧化,并且细胞保护剂稳定磷脂膜,但迄今为止尝试失败或收益甚微的药剂包括熊去氧胆酸、维生素E(α-生育酚)和C以及己酮可可碱。与仅使用饮食和锻炼来实现体重减轻(“单独的体重减轻”)相比,减轻体重剂(诸如奥利司他)没有显著益处。NAFLD/NASH的许多减轻体重研究是持续时间短和成功率有限的试点研究,报告称坏死性炎症或纤维化仅得到适度改善。一项针对吡格列酮(一种噻唑烷二酮过氧化物酶体增殖物激活受体-γ(PPARγ)激动剂和胰岛素增敏剂)的单独减轻体重的随机、双盲、安慰剂对照的6个月试验(Belfort,“Aplacebo-controlled trial ofpioglitazone in subjects with nonalcoholic steatohepatitis”,N.Engl.J.Med.,355,2297-2307(2006))未能证明单独减轻体重有任何改善,但吡格列酮治疗改善了患有NASH和IGT或T2DM的患者的血糖控制、胰岛素敏感性、全身炎症指标(包括hsCRP、肿瘤坏死因子-α和转化生长因子-β)和肝脏组织学。用吡格列酮的治疗还改善了脂肪、肝脏和肌肉IR,并且与坏死性炎症减少大约50%(p<0.002)和纤维化减少37%(p=0.08)相关。另一项为期12个月的吡格列酮对照试验中报告了肝细胞损伤和纤维化的改善。相比之下,尽管罗格列酮(另一种被批准用于糖尿病治疗的噻唑烷二酮)在NASH中的第一项随机临床研究证明IR、血浆丙氨酸转氨酶(ALT)水平和脂肪变性降低,但罗格列酮治疗对坏死、炎症或纤维化没有显著作用。重要的是注意,这些结果表明,即使ALT、胰岛素抵抗和其他糖尿病指标降低,也不能减少肝纤维化,肝纤维化是NASH的关键指标。因此,控制糖尿病不足以治疗NASH或甚至预防NASH。此外,吡格列酮和罗格列酮都存在严重的安全性限制。该试验的2年开放标签随访的初步报告也令人失望,其中罗格列酮治疗没有显著益处。吡格列酮是一种对NASH有一定功效的药物药剂。不幸的是,吡格列酮还与女性和男性两者的体重增加、水肿、充血性心力衰竭和骨质疏松性骨折的风险显著增加相关。
一项涉及NASH患者的2期试验显示,与安慰剂相比,每天皮下施用索马鲁肽(GLP-1激动剂)的治疗导致NASH消退的患者的比例更高。然而,试验没有显示出纤维化阶段改善的患者的百分比在组间存在显著差异(Newsome等人,N.Engl.J.Med.“APlacebo-ControlledTrial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis”2020年11月13日)。不幸的是,“实现NASH消退且没有纤维化恶化的患者的百分比在0.1mg组中是40%、在0.2mg组中是36%、在0.4mg组中是59%以及在安慰剂组中是17%(P=0.48)。0.4mg组中的平均体重减轻百分比为13%,并且安慰剂组中为1%。0.4mg组中恶心、便秘和呕吐的发生率高于安慰剂组(恶心,42%比11%;便秘,22%比12%;并且呕吐,15%比2%)。3名接受索马鲁肽的患者(1%)报告了恶性肿瘤,而接受安慰剂的患者没有报告恶性肿瘤。总的来说,索马鲁肽组中15%的患者和安慰剂组中8%的患者报告了肿瘤(良性、恶性或未指明);没有在特定器官中观察到发生模式”。因此,即使是GLP-1激动剂诸如索马鲁肽,也不是预防或治疗NASH的良性治疗方法,以保证治疗、预防或减缓NASH进展所需的长期施用的风险。
对所获得的临床数据的总结表明,NASH的治疗似乎与通过任何减轻体重技术作为治疗手段进行的减轻体重脱钩。但减轻体重可能是预防NASH或可能显示出NASH进展的有效手段。因此,需要更好接受的转化模型来预测包括NASH在内的脂肪肝病的预防、预防其进展和治疗。因此,需要有效且更安全的NASH治疗选项,特别是如果治疗可以口服而不是通过注射递送的话。还需要安全的药剂来预防完全NASH肝病和损伤的发展以及显示NASH的进展。
发明内容
本公开文本提供了一种用于预防脂肪肝病、预防其进展和/或对其进行治疗的方法,所述方法包括施用有效量的药物组合物,所述药物组合物包含苦味受体激动剂,所述苦味受体激动剂包含地那铵盐,其中所述地那铵盐选自乙酸地那铵(DA)、柠檬酸地那铵、马来酸地那铵、糖地那铵和酒石酸地那铵;并且其中用于脂肪肝病的预防或预防进展的地那铵盐的每日剂量是约0.1mg/kg/天至约8mg/kg/天并且用于治疗现有脂肪肝病的地那铵盐的每日剂量是约1mg/kg/天至约8mg/kg/天,各自以QD、BID或TID施用。
更具体地,本公开文本提供了一种预防伴有或不伴有肝纤维化的脂肪肝病和预防其进展的方法,所述脂肪肝病选自非酒精性脂肪性肝炎(NASH)、酒精性脂肪性肝炎(ASH)、非酒精性脂肪肝病(NAFLD)和HIV相关脂肪性肝炎,所述方法包括施用有效量的药物组合物,所述药物组合物包含地那铵盐,其中所述地那铵盐选自乙酸地那铵(DA)、柠檬酸地那铵、马来酸地那铵、糖地那铵和酒石酸地那铵,并且其中用于预防脂肪肝病或预防其进展的地那铵盐的每日剂量是约0.1mg/kg/天至约8mg/kg/天QD、BID或TID。优选地,所述药物组合物进一步包含约0.5g至约5g乙酸。更优选地,对于成年人的乙酸剂量/天是约1.5g至约3g。
本公开文本提供了一种治疗伴有或不伴有肝纤维化的肝病的方法,所述肝病选自非酒精性脂肪性肝炎(NASH)、酒精性脂肪性肝炎(ASH)、非酒精性脂肪肝病(NAFLD)和HIV相关脂肪性肝炎,所述方法包括施用有效量的药物组合物,所述药物组合物包含地那铵盐,其中所述地那铵盐选自乙酸地那铵(DA)、柠檬酸地那铵、马来酸地那铵、糖地那铵和酒石酸地那铵,并且其中用于治疗现有脂肪肝病的地那铵盐的每日剂量是QD、BID或TID施用约1.0mg/kg/天至约8mg/kg/天。优选地,所述药物组合物进一步包含约0.5g至约5g乙酸。更优选地,对于成年人的乙酸剂量/天是约1.5g至约3g。
附图说明
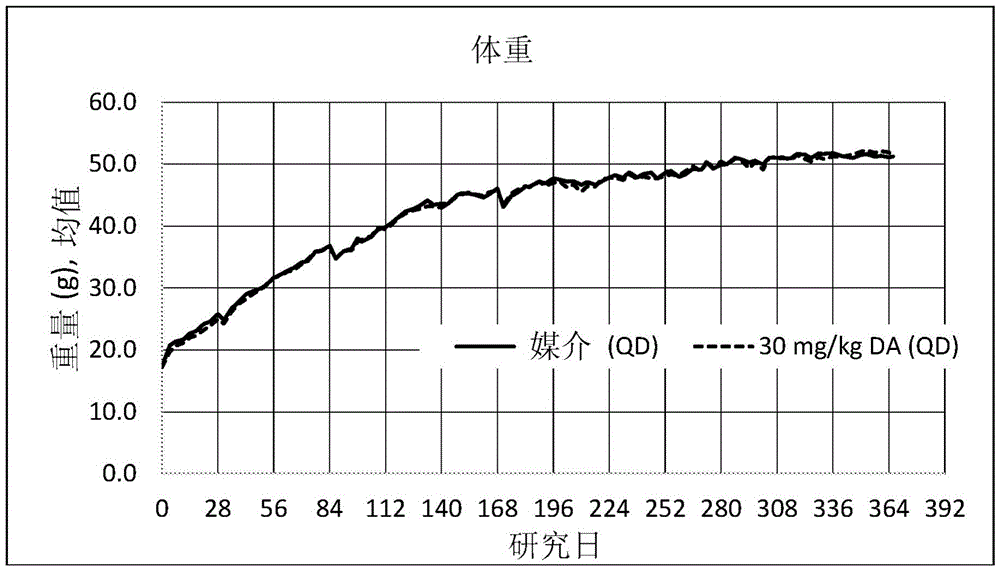
图1A-图1B示出了在每天用媒介物或30mg/kg DA治疗一年期间AMLN饮食喂养的小鼠的组平均绝对(图1A)和相对(%基线;图1B)体重。
图2示出了仅在第24周时,DA治疗的小鼠的空腹血液葡萄糖水平显著低于媒介物治疗的小鼠的空腹血液葡萄糖水平。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。NS,不显著。
图3示出了在第4周和第12周,DA治疗的小鼠的胰岛素水平显著升高(与媒介物治疗的小鼠的胰岛素水平相比),但随后不是如此。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。**p<0.01。NS,不显著。
图4示出了在第12周和第48周,DA治疗的小鼠的HbA1c水平显著减低(与媒介物治疗的小鼠的HbA1c水平相比),但在第24周不是如此。(未在给药前或第4周测定HbA1c水平。)通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。**p<0.01。***p<0.001。NS,不显著。未在给药前或第4周测定HbA1c。
图5A示出了仅在第24周,DA治疗的小鼠的GLP-1水平显著减低(与媒介物治疗的小鼠的GLP-1水平相比)。虽然差异的大小与其他时间点的差异相似(缺乏统计学显著性),但第24周的方差低于其他周,表明这种影响的统计学显著性没有意义。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。***p<0.001。NS,不显著。图5B示出了GLP-2水平。注意,仅在第48周测定GLP-2。在第48周,DA治疗的小鼠的GLP-2水平与媒介物治疗的小鼠的GLP-2水平没有显著差异,这周是评估该参数的唯一时间点。
图6示出了在第24周和第48周,DA治疗的小鼠的血清ALT活性水平显著减低(与媒介物治疗的小鼠的血清ALT活性水平相比),但在更早时不是如此。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。**p<0.01。***p<0.001。NS,不显著。
图7示出了仅在第24周,DA治疗的小鼠的血清AST活性水平显著减低(与媒介物治疗的小鼠的血清AST活性水平相比)。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。**p<0.01。NS,不显著。
图8示出了在任何评估时间点,DA治疗的小鼠的血清ALB水平与媒介物治疗的小鼠的血清ALB水平没有显著差异。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。NS,不显著。
图9示出了仅在第24周,DA治疗的小鼠的血清BA水平显著减低(与媒介物治疗的小鼠的血清BA水平相比)。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。NS,不显著。
图10示出了在AMLN饮食喂养的小鼠中,在每天用媒介物或30mg/kg DA治疗一年期间,对于IL-6(图10A)、IL-9(图10B)IL-13(图10C)IP-10(图10D)KC(图10E)MCP-1(图10F)MIP-1a(图10G)MIP-1B(图10H)MIG(图10I)和TNFα-6(图10J)而言,细胞因子(n=10)的血液水平显示出统计学显著的差异。细胞因子名称/图标题中的括号内的整数对应于用作多重测定的一部分的测定编号。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。**p<0.01。NS,不显著。
图11A(绝对)和图11B(相对)(体重归一化)示出了每天用媒介物或30mg/kg DA治疗一年后的尸检肝脏重量。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。NS,不显著。
图12示出了每天用媒介物或30mg/kg DA治疗一年后的血清HDL、LDL和TGA水平。在每天给药一年后,DA治疗的小鼠(与给药媒介物的动物相比)的血清TGA水平显著减低,但HDL或LDL的血清TGA水平不是如此。DA,乙酸地那铵。HDL,高密度脂蛋白。LDL,低密度脂蛋白。TGA,甘油三酯。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。NS,不显著。
图13示出了每天用媒介物或30mg/kg DA治疗一年后的肝脏TGA(图13A)、TC(图13B)和FFA(图13C)。在每天给药一年后,DA治疗的小鼠(与给药媒介物的小鼠相比)的肝脏TGA水平显著减低,但TC或FFA水平不是如此。
图14示出了基于设盲组织病理学检查,用DA(ARD-101)的治疗显著改善了NAFLD活动得分。
图15A和图15B示出了用ARD-101(DA)的治疗对AMLN饮食诱导的NASH小鼠的体重(15A)和体重变化(15B)显示出显著影响。数据以平均值呈现。用单尾t检验进行统计学分析。与媒介物相比,***P<0.001;与组合相比,
图16A和图16B示出了肝脏重量(图16A)和肝脏/体重比(图16B),其显示与媒介物相比,DA(ARD-101)显著降低了肝脏重量和肝脏/体重比。
图17A示出了ALT水平,并且图17B示出了AST水平。在研究结束时,与媒介物对照相比,DA(ARD-101)显著降低了ALT和AST水平。
图18A(甘油三酯(TG))、图18B(LDL)和图18C(HDL)示出了在实施例2的研究结束时,DA(ARD-101)分别显著降低了甘油三酯(TG)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)。
图19示出了所指示治疗组在实施例2研究结束时葡萄糖水平的变化。
图20示出了在实施例2研究结束时所指示治疗组的HbA1c水平。基线HbA1c水平是5.0%。
图21示出了在实施例2研究结束时所指示治疗组的胰岛素水平。基线胰岛素水平是1.5ng/ml。
图22示出了与媒介物对照相比,两种治疗对胆汁酸水平没有显著影响。基线胆汁酸水平是30μmol/L。
图23A(CK-18)示出了与媒介物对照相比,DA(ARD-101)显著降低了CK-18水平。图23B示出了所指示治疗组的TGF-β1水平。
图24A和图24B示出了在实施例2研究结束时,与媒介物相比,两种治疗对IL-6和TNF-α水平没有显著影响。
具体实施方式
本公开文本基于侧重于脂肪肝病预防的第一体内研究(呈现在实施例1中)并且然后是侧重于脂肪肝病治疗的第二体内研究(呈现在实施例2中)。总之,来自这两项研究的这些数据提供了令人惊讶的证据,即以不同的给药频率和剂量范围用地那铵盐治疗既可以提供在易感个体(诸如发展NASH的风险高得多的2型糖尿病)中的脂肪肝病保护作用也可以以较低的每天一次的地那铵盐口服给药提供预防疾病进展作用。并且这需要更高且每天两次剂量的地那铵盐来治疗体内模型的NASH,其效果与GLP-1激动剂相似,但没有索马鲁肽(一种原型市场销售GLP-1激动药)的已知(在人类中)严重副作用。
定义:
“脂肪肝病”意指一组以肝脏中不希望的脂肪积累为特征的疾病中的任一种,所述疾病包括非酒精性脂肪性肝炎(NASH)、酒精性脂肪性肝炎(ASH)、非酒精性脂肪肝病(NAFLD)和HIV相关脂肪性肝炎,伴有或不伴有肝纤维化。
地那铵盐的“治疗有效量”意指当施用于人类用于治疗脂肪肝病(诸如NAFLD或NASH)时足以实现治疗脂肪肝病的量。人类NAFLD或NASH的“治疗(treating)”或“治疗(treatment)”包括以下一种或多种:
(1)预防或降低发展NAFLD或NASH的风险,即,使可能易患NAFLD或NASH但尚未经历或显示NAFLD或NASH症状的受试者不发展NAFLD或NASH的临床症状(即,预防);
(2)抑制NAFLD或NASH,即阻止或减少NAFLD或NASH或其临床症状的发展;以及
(3)缓解NAFLD或NASH,即引起NAFLD或NASH的消退、逆转或改善或减少其临床症状的数量、频率、持续时间或严重程度。针对特定受试者的治疗有效量根据待治疗受试者的健康和身体状况、NAFLD或NASH的程度、医学状况的评估和其他相关因素而变化。预期治疗有效量将落入可通过常规试验确定的相对宽的范围内。
除非上下文另有要求,否则“或”以包含的含义使用(等同于“和/或”)。
如本文所用,范围和数量可以表示为“约”特定值或范围。约也包括确切量。因此,“约5mg”意指“约5mg”并且还意指“5mg”。通常,术语“约”包括预期在实验误差范围内的量,例如像在15%、10%或5%内。
章节标题仅为了方便读者而提供并且不限制本公开文本。
剂量
实施例1和实施例2中的两项体内鼠研究的结果以及第一项人1期临床安全性研究的结果为本公开文本的地那铵盐提供了安全有效的剂量范围。基于从小鼠到人的转换公式,等效于小鼠中50mg/kg BID(实施例2中用于体内治疗研究的剂量)的人剂量是4mg/kgBID(或8mg/kg/天)。考虑到成人平均体重为60kg,相应剂量为240mg,BID(或480mg/天)。在首次人体临床试验中,240mg BID(480mg/天)耐受性良好。因此,出于治疗目的,每日剂量上限(成人)600mg-1000mg/天是安全且耐受的,并且较低的每日剂量在本文提供的临床前鼠模型中显示出功效。
具体地,为了治疗脂肪肝病,地那铵盐的成人每日剂量为约10mg至约600mg或约0.2mg/kg至约10mg/kg体重/天。最优选地,用于成人的地那铵盐是约40mg至约400mg或约1mg/kg至约8mg/kg体重/天。将地那铵盐的每日剂量每天一次、每天两次或每天三次施用。最优选地,将地那铵盐的每日剂量每天两次施用。
具体地,为了预防脂肪肝病,地那铵盐的成人每日剂量为约5mg至约400mg或约0.1mg/kg至约8mg/kg体重/天。最优选地,用于成人的地那铵盐是约20mg至约200mg或约0.5mg/kg至约4mg/kg体重/天。将地那铵盐的每日剂量每天一次、每天两次或每天三次施用。最优选地,将地那铵盐的每日剂量每天一次施用。
在通过引用并入的任何材料与本公开文本的明确内容不一致的情况下,以明确内容为准。
无水乙酸地那铵或DA是一种无水盐,使得对于每100mg DA,存在83mg地那铵阳离子、17mg乙酸根阴离子。
本方案A描述了乙酸地那铵(DA)的合成。
步骤1:从利多卡因合成地那铵氢氧化物
向回流设备中添加25g利多卡因、60ml水和17.5g苄基氯,伴随在70℃-90℃下搅拌和加热。需要将溶液加热并且在给定值前搅拌24h,需要将溶液冷却至30℃。将未反应的试剂用3×10mL甲苯去除。在搅拌下将65g氢氧化钠溶解到65mL冷水中,并且经3小时的历程在搅拌下将其添加到水溶液中。将混合物过滤,用一些水洗涤,并且在露天中干燥。
在热氯仿或热乙醇中重结晶。
步骤2:从地那铵氢氧化物制备无水乙酸地那铵。
向回流设备中添加10g地那铵氢氧化物(MW:342.475g/mol,0.029mol)、20mL丙酮和溶解于15mL丙酮中的2g冰乙酸(0.033mol),将混合物搅拌并且加热至35℃保持3h。然后蒸发至干,并且在热丙酮中重结晶。
DA片剂的配制
这提供了作为游离碱的乙酸地那铵(DA)的立即释放型50mg颗粒配制品,作为立即胃释放型口服药物配制品。
表1示出了DA的定性和定量的配制品组成。
IID,非活性成分数据库;API,活性药物成分;USP,美国药典;NF,美国国家处方集
*将溶剂诸如乙醇USP 190Proof(190Proof纯乙醇)和纯化水(USP)用于制备药物溶液和密封包衣分散体,但在制造过程期间去除。
详细制造步骤如下所述。
1.药物分层过程-药物分层丸粒
药物分层过程是在配备有转子插入物(转子造粒机)的流体床造粒机中进行的。通过在乙醇中溶解聚维酮K30(Kollidon 30)和乙酸地那铵来制备药物溶液。将药物溶液切向喷到在转子造粒机中以圆周运动移动的糖球(35/45目)的床上。然后将最终的载药丸粒在转子造粒机中干燥十(10)分钟,并且通过#20目过筛。
2.密封包衣过程-密封包衣丸粒
密封包衣分散体是通过将羟丙甲纤维素E5单独地溶解在乙醇和纯化水的混合物(1:1)中直到获得澄清溶液制备的。然后将剩余量的乙醇添加到上述溶液中,然后添加滑石粉。将分散体混合20分钟以允许滑石粉的均匀分散。将密封包衣分散体切向喷在载药丸粒上,以实现5%的重量增加。然后将密封包衣丸粒在转子造粒机中干燥五(5)分钟,取出并且在55℃下在托盘干燥机/烘箱中进一步干燥2小时。然后将密封包衣丸粒通过#20目过筛。
3.最终共混-地那铵立即释放型(IR)丸粒
将密封包衣丸粒与通过#60目过筛的滑石粉使用V-Blender共混十(10)分钟并且取出。将共混的密封包衣珠即地那铵IR丸粒用于胶囊化。
4.胶囊化-地那铵胶囊,50mg
将50mg地那铵IR丸粒使用自动胶囊填充机填充到1号大小的白色不透明硬明胶胶囊中。然后,使胶囊通过在线胶囊抛光机和金属探测器。在胶囊化过程期间进行胶囊重量和外观的过程中控制。在胶囊化过程期间,通过对复合样品的质量保证(QA)进行接收质量限(AQL)抽样。将完成的产物复合样品收集并且根据释放测试的规范进行分析。
5.包装-胶囊,50mg-30个计数
将50mg胶囊以30个计数包装到具有33mm白色CRC盖的50/60cc白色HDPE圆形S-line瓶中。将瓶使用感应密封机进行扭转并且密封。
表2来自多项研究的NASH数据的汇总比较:
/>
/>
/>
表2示出了在非常不同的NASH体内模型中的宽范围的不同结果。这使得很难对数据进行直接比较。对应于第一行的研究(称为Aardvark Therapeutics)提供在下面的实施例1和本公开文本提供的附图中。应注意,与许多现有技术的NASH模型不同,本公开文本进行了长得多达48周的每日给药,因为估计需要至少30周的AMLN饮食时间在小鼠模型中诱导完全纤维化NASH。许多其他研究的持续时间较短。因此,实施例1的研究更能预测预防NASH和以肝纤维化为特征的类似肝病或减缓其进展的方法的效果。
强调减轻体重作为NASH治疗模型的研究似乎更针对的是治疗现有NASH病症。因此,本公开文本进一步通过引用将2020年12月23日提交的美国专利申请序列号17/132,580并入。特别地,实施例9和附图呈现了用较高剂量DA(23.1mg/kg BID,对应于46.2mg/kg/天的DA或37.4mg/kg/天的干地那铵)的减轻体重研究的结果,显示出体重增加的显著降低。与用大约两倍每日剂量DA的DIO较短期减轻体重研究相反,用较低剂量DA的本NASH预防研究在48周内与媒介物对照相比显示体重增加没有差异(本文图1)。因此,这种比较意味着治疗与预防相比需要更高的每日DA剂量,或者治疗需要更高的给药频率,或者治疗需要这两方面。但是实施例1中的研究清楚地表明,类似的剂量但仅每天一次(不是两次)足以预防NASH和减缓NASH的进展,但对于减轻体重不是如此,减轻体重更可能是NASH治疗的标志。因此,用于治疗NASH和相关肝病的方法的地那铵盐剂量范围是约1.0mg/kg/天至约12mg/kg/天;优选约2mg/kg/天至约8mg/kg/天;并且最优选约3mg/kg/天至约6mg/kg/天。因此,用于预防NASH和相关肝病的方法和用于减缓NASH和相关肝病进展的方法的地那铵盐剂量范围是约0.1mg/kg/天至约6mg/kg/天;优选约0.25mg/kg/天至约4mg/kg/天;并且最优选约0.5mg/kg/天至约3mg/kg/天。
实施方案
在第一方面,本公开文本提供了一种用于预防伴有或不伴有肝纤维化的脂肪肝病(例如,非酒精性脂肪性肝炎(NASH)、酒精性脂肪性肝炎(ASH)、非酒精性脂肪肝病(NAFLD)和HIV相关脂肪性肝炎)或预防其进展的方法(方法1),所述方法包括施用有效量的药物组合物,所述药物组合物包含地那铵盐,其中所述地那铵盐选自乙酸地那铵(DA)、柠檬酸地那铵、马来酸地那铵、糖地那铵和酒石酸地那铵,并且其中用于预防脂肪肝病或预防其进展的地那铵盐的每日剂量是约0.1mg/kg/天至约8mg/kg/天QD、BID或TID。优选地,所述药物组合物进一步包含约0.5g至约5g乙酸。更优选地,对于成年人的乙酸剂量/天是约1.5g至约3g。
本公开文本进一步提供了用于预防脂肪肝病或预防其进展的方法的以下实施方案:
1.1方法1,其中所述脂肪肝病是NASH。
1.2方法1或1.1,其中所述脂肪肝病是NASH或NAFLD或ASH。
1.3前述方法中的任一项,其中所述地那铵盐是乙酸地那铵。
1.4前述方法中的任一项,其中所述地那铵盐是柠檬酸地那铵。
1.5前述方法中的任一项,其中所述地那铵盐是马来酸地那铵。
1.6前述方法中的任一项,其中所述地那铵盐的每日剂量是0.2mg/kg/天QD。
1.7前述方法中的任一项,其中所述地那铵盐的每日剂量是1.0mg/kg/天QD。
1.8前述方法中的任一项,其中所述地那铵盐的每日剂量是4.0mg/kg/天QD。
在第二方面,本公开文本提供了一种用于治疗伴有或不伴有肝纤维化的脂肪肝病(例如,非酒精性脂肪性肝炎(NASH)、酒精性脂肪性肝炎(ASH)、非酒精性脂肪肝病(NAFLD)和HIV相关脂肪性肝炎)的方法(方法2),所述方法包括施用有效量的药物组合物,所述药物组合物包含地那铵盐,其中所述地那铵盐选自乙酸地那铵(DA)、柠檬酸地那铵、马来酸地那铵、糖地那铵和酒石酸地那铵,并且其中用于治疗现有脂肪肝病的地那铵盐的每日剂量是QD、BID或TID施用约1.0mg/kg/天至约10mg/kg/天。优选地,所述药物组合物进一步包含约0.5g至约5g乙酸。更优选地,对于成年人的乙酸剂量/天是约1.5g至约3g。
本公开文本进一步提供了用于治疗脂肪肝病的方法的以下实施方案:
2.1方法2,其中所述脂肪肝病是NASH。
2.2方法2或2.1,其中所述脂肪肝病是NASH或NAFLD或ASH。
2.3前述方法中的任一项,其中所述地那铵盐是乙酸地那铵。
2.4前述方法中的任一项,其中所述地那铵盐是柠檬酸地那铵。
2.5前述方法中的任一项,其中所述地那铵盐是马来酸地那铵。
2.6前述方法中的任一项,其中所述地那铵盐的每日剂量是2.5mg/kg/天BID。
2.7前述方法中的任一项,其中所述地那铵盐的每日剂量是5mg/kg/天BID。
2.8前述方法中的任一项,其中所述地那铵盐的每日剂量是7.5mg/kg/天BID。
治疗NASH的临床试验的FDA指南
在2021年1月29日,食品药品监督管理局(FDA)举办了一场关于伴有纤维化的NASH的治疗药物候选物如何能在动物模型和临床试验中显示出功效的简短研讨会。FDA证实NASH(伴有纤维化,下文称为NASH)是一种严重病症并且临床使用替代终点可以预测临床益处。尽管在动物研究中(诸如本文实施例1中所提供的),组织病理学检查是疾病的治疗、预防和进展益处的更好证明(取决于动物研究的长度)。因此,在临床试验中,FDA将接受替代终点和肝脏活检,作为显示临床益处(或缺乏益处)的手段。FDA认识到,NASH药物开发的挑战是由于肝脏中慢性炎症变化的逐渐和缓慢进展,并且任何用于预防完全NASH(晚期肝纤维化)或治疗或减缓进展的NASH药物都是潜在的终身治疗。至于替代终点,FDA提出组织病理学“合理地可能性预测临床益处”。FDA指出,NASH晚期肝“纤维化期,但没有脂肪性肝炎的其他组织学特征,与死亡率、移植和肝脏相关事件的增加独立相关”。(引用Angulo等人Gastroenterology,149:389-397,2015)。
在进行临床试验时,FDA提出早期试验使用非侵入性疾病特异性生物标记物(例如,转氨酶)、总胆红素和放射照相方式(诸如弹性成像、MRI-PDFF)来评估肝脏硬度。对于批准,FDA将接受肝脏组织学的改善。“肝脏活检是一种基于研究的替代方法,所述研究证明了组织学的改善可能预示着NASH患者临床结局的改善。”肝纤维化分级为0期(无)、1期、2期、3期和4期(肝硬化)。NASH推荐终点是(1)脂肪性肝炎消退和肝纤维化无恶化;或(2)肝纤维化改善和脂肪性肝炎无恶化;或(3)脂肪性肝炎消退和纤维化改善两者。
实施例1
本实施例提供了在通过饮食诱导NASH病症的小鼠中较低剂量DA(通过管饲,30mg/kg/天QD))的52周研究的结果。如此长持续时间(48-52周)的动物诱导的NASH的数据可以被解释为支持预防包括NASH在内的脂肪肝病的方法以及减缓包括NASH在内的脂肪肝病进展的方法。雄性C57BL/6小鼠(研究开始时4周龄)在到达后维持高脂肪“西方饮食”(AMLN饮食)(DIO-NASH)(D09100301,Research Diet,美国)(40%脂肪(18%反式脂肪)、40%碳水化合物(20%果糖)和2%胆固醇、40kcal%脂肪、20kcal%果糖和2%胆固醇),从而诱导非酒精性脂肪性肝炎(NASH)。适应后,将组1和组2(各n=22)通过灌胃口服管饲(PO)(分别)用媒介物(蒸馏水)或乙酸地那铵(DA)30mg/kg给药。剂量每天一次(QD)施用,给药量为1mL/kg,持续一整年(至第366天)。在整个研究过程中监测体重和临床观察结果。在基线(第-1天)时和在研究期间定期(第4、12、24和48周)从空腹动物收集血液,加工成血清或血浆,并且评价代谢参数[葡萄糖、胰岛素、血红蛋白A1c(HbA1c)和胰高血糖素样肽1和2(GLP-1和GLP-2)]、选定的血清化学参数[Ala转氨酶(ALT)、Asp转氨酶(AST)、白蛋白(ALB)和总胆汁酸(BA)]以及多种细胞因子(共32种)。在QD给药52周后,将空腹动物放血并且实施安乐死,并且收集肝脏并且称重。评估终末血清样品的低密度胆固醇和高密度胆固醇(分别为LDL和HDL)和甘油三酯(TGA);评估肝脏的总胆固醇(TC)、TGA和游离脂肪酸(FFA)。
在研究过程中发现三只动物死亡,包括一只给药媒介物的小鼠(第51周)和两只给药DA的小鼠(第12周和第49周各一只)。这三只动物在被发现死亡之前都没有展现出临床体征,尽管一只给药DA的死亡动物从第44周开始显示体重降低,并且另一只给药DA的死亡动物值得注意地比研究开始时的其他动物重。不清楚组2(给药DA的)的死亡是否与供试品有关。在研究间隔期间注意到没有其他临床观察结果。
在长达一年的研究中,两个组的体重都展现出与基线相比大约200%的平均增加(即,三倍体重)。值得注意的是,在研究期间,两组之间的体重(无论是以绝对值还是相对值表示)没有统计学显著的差异,唯一的例外是在给药开始后第一个时间点(第4天)的相对体重(其中组2的给药DA的小鼠的相对体重较低)。
对于活体血液样品,给药DA的小鼠(与媒介物相比)显示出如下显著差异:
·代谢参数:在第24周空腹葡萄糖和GLP-1水平减低,并且在第12周和第48周HbA1c减低;并且在第4周和第12周胰岛素水平升高。未看到GLP-2水平的显著差异(仅在第48周评估)。
·血清化学:在第24周和第48周ALT减低并且在第24周AST和BA减低。未看到血清ALB水平的显著差异。
·细胞因子:在第4周IP-10和MIP-1B减低;在第12周IL-13减低;在第24周MIP-1a减低;在第48周IL-6、IL-9和KC减低;并且在第4周和第48周MIG减低。任何其他(n=24)评估的细胞因子水平均未看到显著的治疗相关差异。
在QD给药一年后的尸检中,给药DA的小鼠(与给药媒介物的动物相比)的相对(体重归一化)而非绝对肝脏重量减低。
终末血液样品揭示了在每天给药一年后,DA治疗的小鼠(与给药媒介物的动物相比)的血清TGA水平显著减低。在尸检肝脏样品中,DA治疗的小鼠(与给药媒介物的动物相比)的TGA水平显著减低,但TC或FFA水平不是如此。
因此,AMLN饮食诱导的NASH小鼠的DA给药一年(30mg/kg,PO,QD)显现对存活率、体重或临床体征没有不良影响。与媒介物相比,DA导致许多代谢参数(空腹葡萄糖、GLP-1、HbA1c和胰岛素)、血清化学(ALT、AST和BA)和细胞因子子集(IL-6、IL-9、IL-13、IP-10、KC、MIG、MIP-1a和MIP-1B)在选定的生命时间点发生显著变化。QD给药一年后,给药DA的小鼠展现出(与媒介物相比)血清和肝脏两者中相对肝脏重量和TGA水平的减低。
雄性C57BL/6小鼠(n=44)购自Taconic Biosciences,Inc.(伦斯勒,纽约州),为4周龄动物。到达后,使用电子天平(Ohaus
将DA在DW中配制成30mg/mL。将固体DA称重并且添加到适当体积的DW中;将溶液充分混合并且目视检查,以确保没有沉淀并且验证供试品完全溶解。每周新鲜制备DA给药溶液,并且在每日剂量施用中的使用之间冷藏保存在4℃。
在第-1天(即,开始给药前一天);并且在第4、12、24和48周(即,给药1、3、6和12个月后),从空腹动物中收集血液样品和粪便样品。
·直接从每个笼的地板上收集粪便样品(每笼3-4只小鼠,4粒小球),分成两等份,并且储存在-80℃,用于将来的微生物群和微生物组分析。这些分析的结果不包括在本报告中。
·通过颌下途径从每只动物收集血液(100μL/只动物)。评估所有血液样品的血液葡萄糖水平,并且然后加工成血清和血浆两者。根据时间点和测定,对每组样品(即,10或11个)的全部或一半进行以下参数评估:
o血清:选定的血清化学参数[Ala转氨酶(ALT)、Asp转氨酶(AST)、白蛋白(ALB)和总胆汁酸(BA)]、胰岛素和胰高血糖素样肽1和2(GLP-1和GLP-2)
o血浆:血红蛋白A1c(HbA1c)和细胞因子。
在第366天(第52周),将空腹小鼠称重,经受终末心脏穿刺并且实施安乐死。将血液加工成血清。切除肝脏,称重,快速冷冻,并且储存在-80℃;丢弃剩余的组织。评估血清的低密度胆固醇和高密度胆固醇(分别为LDL和HDL)以及甘油三酯(TGA)。评估肝脏的总胆固醇(TC)、TGA和游离脂肪酸(FFA)。
使用表3中所指示的试剂盒和设备测量血液和肝脏参数。
表3:血清参数试剂盒和设备
ALB,白蛋白。ALT,Ala转氨酶。AST,Asp转氨酶。BA,胆汁酸。FFA,游离脂肪酸。GLP-1/2,胰高血糖素样肽-1/2。HDL,高密度脂肽。LDL,低密度脂肽。No.,编号。TC,总胆固醇,TGA,甘油三酯。
结果:
在长达一年的研究中,两组的体重都展现出与基线相比大约200%的平均增加(即,三倍体重),其中这种增加的大部分(约150%)发生在前5个月内。值得注意的是,在研究期间,两组之间的体重(无论是以绝对值还是相对值表示)没有统计学显著的差异,唯一的例外是在给药开始后第一个时间点(第4天)的相对体重(其中组2的给药DA的小鼠的相对体重较低)。
图1示出了在每天用媒介物或30mg/kg DA治疗一年期间AMLN饮食喂养的小鼠的组平均绝对(图1A)和相对(%基线;图1B)体重。
图2示出了仅在第24周时,DA治疗的小鼠的空腹血液葡萄糖水平显著低于媒介物治疗的小鼠的空腹血液葡萄糖水平。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。NS,不显著。
图3示出了在第4周和第12周,DA治疗的小鼠的胰岛素水平显著升高(与媒介物治疗的小鼠的胰岛素水平相比),但随后不是如此。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。**p<0.01。NS,不显著。
图4示出了在第12周和第48周,DA治疗的小鼠的HbA1c水平显著减低(与媒介物治疗的小鼠的HbA1c水平相比),但在第24周不是如此。(未在给药前或第4周测定HbA1c水平。)通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。**p<0.01。***p<0.001。NS,不显著。未在给药前或第4周测定HbA1c。
图5A-图5B示出了仅在第24周,DA治疗的小鼠的GLP-1水平显著减低(与媒介物治疗的小鼠的GLP-1水平相比)。虽然差异的大小与其他时间点的差异相似(缺乏统计学显著性),但第24周的方差低于其他周,表明这种影响的统计学显著性没有意义。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。***p<0.001。NS,不显著。注意,仅在第48周测定GLP-2。在第48周,DA治疗的小鼠的GLP-2水平与媒介物治疗的小鼠的GLP-2水平没有显著差异,这周是评估该参数的唯一时间点。
血清化学:
图6示出了在第24周和第48周,DA治疗的小鼠的血清ALT活性水平显著减低(与媒介物治疗的小鼠的血清ALT活性水平相比),但在更早时不是如此。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。**p<0.01。***p<0.001。NS,不显著。
图7示出了仅在第24周,DA治疗的小鼠的血清AST活性水平显著减低(与媒介物治疗的小鼠的血清AST活性水平相比)。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。**p<0.01。NS,不显著。
图8示出了在任何评估时间点,DA治疗的小鼠的血清ALB水平与媒介物治疗的小鼠的血清ALB水平没有显著差异。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。NS,不显著。
图9示出了仅在第24周,DA治疗的小鼠的血清BA水平显著减低(与媒介物治疗的小鼠的血清BA水平相比)。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。NS,不显著。
血液细胞因子水平
图10中绘制了细胞因子的平均值,其中组(n=10)之间具有统计学显著差异。在这10种细胞因子中,8种在开始给药后显示出显著的组间差异。其他两种细胞因子[MCP-1(单核细胞趋化蛋白-1,又名CCL2)和TNFα(肿瘤坏死因子α)]仅在给药前时间点展现出显著的组间差异,这种效应显然与治疗无关。如下观察到DA治疗的小鼠(与媒介物治疗的小鼠相比)中细胞因子水平的统计学显著减低:
仅第4周:IP-10(干扰素γ诱导的蛋白10,又名CXCL10);MIP-1B(巨噬细胞炎症蛋白1β,又名CCL4)。
仅第12周:IL-13(白介素13)。
仅第24周:MIP-1a(巨噬细胞炎症蛋白1α)。
仅第48周:IL-6(白介素6);IL-9(白介素9);KC(角质细胞衍生趋化因子,又名CXCL1或CINC-1)。
仅第4周和第48周:MIG(γ-干扰素诱导的单核因子,又名CXCL9)。
图10示出了在AMLN饮食喂养的小鼠中,在每天用媒介物或30mg/kg DA治疗一年期间,对于IL-6(图10A)、IL-9(图10B)IL-13(图10C)IP-10(图10D)KC(图10E)MCP-1(图10F)MIP-1a(图10G)MIP-1B(图10H)MIG(图10I)和TNFα-6(图10J)而言,细胞因子(n=10)的血液水平显示出统计学显著的差异。细胞因子名称/图标题中的括号内的整数对应于用作多重测定的一部分的测定编号。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。**p<0.01。NS,不显著。
终末肝脏参数
图11A(绝对)和图11B(相对)(体重归一化)示出了每天用媒介物或30mg/kg DA治疗一年后的尸检肝脏重量。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。NS,不显著。
图12示出了每天用媒介物或30mg/kg DA治疗一年后的血清HDL、LDL和TGA水平。在每天给药一年后,DA治疗的小鼠(与给药媒介物的动物相比)的血清TGA水平显著减低,但HDL或LDL的血清TGA水平不是如此。DA,乙酸地那铵。HDL,高密度脂蛋白。LDL。低密度脂蛋白。TGA,甘油三酯。通过双尾非配对t检验与相应日期的媒介物值进行比较。p<0.05的差异被认为是统计学显著的。*p<0.05。NS,不显著。
图13A-图13C示出了每天用媒介物或30mg/kg DA治疗一年后的肝脏TGA(图13A)、TC(图13B)和FFA(图13C)。在每天给药一年后,DA治疗的小鼠(与给药媒介物的小鼠相比)的肝脏TGA水平显著减低,但TC或FFA水平不是如此。
本研究的结论是,AMLN饮食诱导的NASH小鼠的DA给药一年(30mg/kg,PO,QD)显现对存活率、体重或临床体征没有不良影响。与媒介物相比,DA导致少数代谢参数(空腹葡萄糖、GLP-1、HbA1c和胰岛素)、血清化学(ALT、AST和BA)和细胞因子子集(IL-6、IL-9、IL-13、IP-10、KC、MIG、MIP-1a和MIP-1B)在选定的生命时间点发生显著变化。QD给药一年后,给药DA的小鼠展现出(与媒介物相比)血清和肝脏两者中相对肝脏重量和TGA水平的减低。
总之,图12-图14中的这项一年NASH研究组织病理学数据显示,基于设盲组织病理学审查,用DA的治疗显著改善了脂肪变性并且改善/消除了纤维化(作为一个例子,总纤维化得分为1.52比0.58,p值<0.0001)。基于新FDA NASH/纤维化标准,在许多其他NASH动物研究(通常是持续时间短得多的,参见本文表2)中没有看到的组织病理学数据支持这样的结论,即,用于预防脂肪肝病或预防其进展的方法可以通过施用一定口服剂量的地那铵盐来完成,所述脂肪肝病选自非酒精性脂肪性肝炎(NASH)、酒精性脂肪性肝炎(ASH)、非酒精性脂肪肝病(NAFLD)和HIV相关脂肪性肝炎,伴有或不伴有肝纤维化,所述地那铵盐选自乙酸地那铵(DA)、柠檬酸地那铵、马来酸地那铵、糖地那铵和酒石酸地那铵。
实施例2
本实施例提供了从脂肪肝疾病治疗的第二体内小鼠模型获得的结果,以研究与阳性对照索马鲁肽(一种市场销售用于降低HbA1c的GLP-1激动剂药物)相比,DA对NASH治疗的治疗效果。与实施例1中的预防性模型相比,本研究中的差异在于使用比30mg/kg更高剂量的DA(75mg/kg),每天两次给药(BID,而实施例1研究中为QD),使用阳性对照索马鲁肽,使用不同的小鼠品系(B6小鼠),并且当研究开始时动物已成年(实施例2中为23周龄,而实施例1中为4周龄),因为在研究开始之前动物已喂食AMLN饮食17周。研究剂量从75mg/kg BID开始。然而,在给药两周后,发现该DA剂量不被很好地耐受,因此在剩余的10周给药(总共12周)内将其降低至50mg/kg BID。
研究包括3个组,每组10只小鼠,(A)通过管饲BID用蒸馏水的媒介物对照,(B)通过管饲BID的DA,以及(C)索马鲁肽10mmol/kg sc QD。每周测量3次体重和变化。在给药开始(基线)和研究结束时测量血清代谢标记物(血液葡萄糖、血液胰岛素、HbA1c、HDL、LDL、甘油三酯和胆汁酸)。在研究结束时,评价肝脏样品的组织病理学和炎症生物标记物(IL-6、TNFα、CK-18和TGF-β)的血清水平。用根据表4的NAFLD活动得分和纤维化得分的评分量表,设盲地进行组织病理学检查。
表4.用于组织病理学评估的非酒精性脂肪肝病活动性得分和纤维化得分
图14示出了基于设盲组织病理学检查,用DA(ARD-101)的治疗显著改善了NAFLD活动得分。图15A-图15B示出了用ARD-101(DA)的治疗对AMLN饮食诱导的NASH小鼠的体重和体重变化(图16A-图16B)显示出显著影响。
图16A和图16B示出了肝脏重量(图16A)和肝脏/体重比(图16B),其显示与媒介物相比,DA(ARD-101)显著降低了肝脏重量和肝脏/体重比。
图17A示出了ALT水平,并且图17B示出了AST水平。在研究结束时,与媒介物对照相比,DA(ARD-101)显著降低了ALT和AST水平。
图18A(甘油三酯)、图18B(LDL)和图18C(HDL)示出了在研究结束时,DA(ARD-101)分别显著降低甘油三酯(TG)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)。
图19示出了在研究结束时的空腹葡萄糖水平。图20示出了在研究结束时的HbA1c水平。基线HbA1c水平是5.0%。图21示出了在研究结束时的胰岛素水平。基线胰岛素水平是1.5ng/ml。图22示出了与媒介物对照相比,两种治疗对胆汁酸水平没有显著影响。基线胆汁酸水平是30μmol/L。
图23A(CK-18)和图23B(TGF-β)示出了与媒介物对照相比,DA(ARD-101)显著降低了CK-18水平(图24A)。
图24A和图24B示出了在研究结束时,与媒介物相比,两种治疗对IL-6和TNF-α水平没有显著影响。
- 用于运行内燃机的方法以及用于内燃机的电子控制装置
- 用于内燃机的汽缸盖油分离器(流动受控的油分离器)
- 用于内燃机的汽缸盖油分离器(流动受控的油分离器)
