用于对哺乳动物中的细胞或组织进行采样的活检/细胞学装置
文献发布时间:2024-01-17 01:23:59
技术领域
本公开总体涉及一种用于使细胞在受试者的腔中脱离的装置以及一种从受试者的腔中对细胞或组织进行采样的液体活检/细胞学方法。该活检/细胞学方法包括经由中空的导管或针引入并操纵所述装置,以便能够获得细胞样本。
背景技术
胰腺癌目前在西方为癌症相关死亡的第四大主要原因,并且预计到2030年,其发病率据估是所有癌症中的第二高。预后仍然很差,5年存活率仅为2%至9%,是所有癌症当中最低的,因为在诊断时就处于晚期。胰腺囊性病变是大多数胰腺癌的前兆,并且在高达40%的普通人群中存在。因此,非常需要根据胰腺囊肿的良性或恶性潜在性对其进行正确诊断。
内窥镜超声(EUS)引导的囊性病变的细针抽吸(FNA),然后进行液体细胞分析,已被用作用于区分良性、潜在恶性以及恶性胰腺囊肿的诊断工具。尽管实体性病变的EUS-FNA结果令人鼓舞,但囊性病变的结果却令人沮丧,因为囊性液体中的细胞含量稀少。这种细胞稀少的原因是EUS-FNA去除了囊肿的液体成分,而不是其通常被细胞覆盖的囊肿膜或壁。该方法的灵敏度的范围在65%至95%之间,并且特异性在50%至100%之间。平均准确率为85%,这导致了20%的病例中出现不确定或模棱两可的情况。这种信息的缺乏造成了细胞病理学家无法进行诊断的情况。解决这一问题的尝试是开发有“穿透针”的细胞学刷(回声刷;库克内窥镜,Winston-Salem NC),以用于通过19G针进行操作,这在85.1%的病例中提供了诊断材料。然而,出血风险的增加导致这些装置停产。
WO 2018/053402A1公开了一种胰腺囊肿装置,该装置可通过22号内窥镜超声(EUS)针部署到囊肿中。该装置为柔性轴,该柔性轴具有近端和“螺旋Q”形的远端,该远端被设计成符合囊肿的形状以使接触面积最大化,并且该近端可以连接到手柄,以允许操作者在胰腺囊肿内使装置旋转,以将细胞从囊性膜中取出。
然而,前面提到的装置仍然有损伤囊性膜的风险,并且螺旋形的远端可能在操作和缩回到外轴中期间断裂。此外,柔性轴的整个长度由镍钛诺制成,并且因此其制造成本昂贵。
因此,需要改进已知的装置及方法,以克服上述缺点。
发明内容
因此,本发明的目的是旨在实现一种微创活检/细胞学装置及方法,该装置及方法减少了取样部位处的组织损伤,同时增加从受试者的腔中采集的细胞或组织的数量。
该目的是在本公开的第一方面中实现的,在本公开的所述第一方面中,提供了一种用于使细胞或组织从受试者的腔中脱离的装置,该装置包括:细长构件,所述细长构件被布置成在针或导管的管腔内移动;以及至少一个柔性构件,所述至少一个柔性构件被布置在所述细长构件的远端处,其中,所述柔性构件被配置成处于在所述针或导管的所述管腔内的第一约束配置与在所述管腔外的第二展开配置之间,其中,所述柔性构件在所述第二展开配置中被配置成符合所述装置所插入的腔的内部几何形状。
通过提供一种具有细长构件和布置在其远端处的柔性构件的装置,所述柔性构件被配置成采用符合所述装置所插入的腔的内部几何形状的形状,这可以在采样手术中增加采集的细胞的数量,同时降低损伤采样部位处的组织的风险。
在一个实施方式中,所述柔性构件为超弹性金属丝,优选地,所述柔性构件由形状记忆合金制成。超弹性(特别是诸如镍钛的形状记忆合金)允许所述柔性构件在所述装置插入腔(例如囊肿)中时采用所述腔的内部几何形状的期望形状。
在一个实施方式中,所述柔性构件被布置成在所述展开配置中形成至少一个环。该环形允许所述柔性构件以简单的方式符合所述腔的内部几何形状的期望形状。此外,所述环形减少了在所述柔性构件达到其完全部署的展开配置之前使所述细长构件前进所需的距离。
在一个实施方式中,所述柔性构件的至少一部分具有大致螺旋形状,在该大致螺旋形状中,螺旋的轴线大致平行于所述柔性构件的大体延伸方向。所述螺旋形状提供了粗糙的边缘,以便于从所述腔的内膜/壁刮除细胞。
在一个实施方式中,所述柔性构件的至少一部分具有锯齿状结构,例如展现出多个齿。优选地,所述锯齿状结构是通过被机加工或被布置在所述柔性构件的表面上的微结构来实现的。所述锯齿状结构提供了粗糙的边缘,以增加耐磨性并有助于从所述腔的内膜/壁刮除细胞,从而增加所述细胞产量。
在一个实施方式中,所述细长构件和所述柔性构件被一体形成为单体结构,其中,所述柔性构件的直径比所述细长构件的直径小。所述柔性构件的较小直径允许其在约束配置中折叠,从而减少了在所述柔性构件达到其完全部署的展开配置之前使所述细长构件前进所需的距离。
在一个实施方式中,所述细长构件在其远端处包括安装接口,并且所述至少一个柔性构件借助所述安装接口附接到所述细长构件。该配置允许所述柔性构件与所述细长构件分开制造,例如以不同的材料中或使用不同的工艺。
在一个实施方式中,所述安装接口包括:至少一个孔,所述至少一个孔用于将所述至少一个柔性构件紧固到所述细长构件;在所述细长构件与所述至少一个柔性构件之间的焊缝、胶合缝或机械互锁机构或它们的组合。根据所述装置的期望特性和/或预期操作条件,可以选择不同的紧固替代方案。优选地,所述安装接口覆盖有热收缩管。所述热收缩管保护所述安装接口,以防止所述柔性构件从所述细长构件断裂或脱离。
在一个实施方式中,所述装置还包括管状护套,所述管状护套被布置在所述细长构件之外并被配置成在所述针或导管的所述管腔内沿着所述细长构件移动。所述管状护套保护所述柔性构件在相对于例如所述装置所插入的中空的针的前进、操作以及缩回期间不断裂。优选地,所述管状护套由诸如聚醚、聚酰胺、聚酰亚胺或聚四氟乙烯即PTFE的聚合物或者诸如镍钛或不锈钢的金属制成。
在一个实施方式中,所述细长构件和/或所述柔性构件被表面处理或涂覆,以降低摩擦系数。
在本公开的第二方面中,提供了一种用于进行细针抽吸即FNA或细针活检即FNB的装置,该装置包括:中空的针;根据所述第一方面的装置,该装置以可移动的方式布置在所述针的管腔内。
在本公开的第三方面中,提供了一种用于进行细针抽吸即FNA或细针活检即FNB以从受试者的腔对细胞或组织进行采样的方法,该方法包括:
提供中空的针以及装置,所述装置包括细长构件和至少一个柔性构件,所述细长构件被布置成在所述针的管腔内移动,所述至少一个柔性构件被布置在所述细长构件的远端处,其中,所述柔性构件被配置成处于在所述针的所述管腔内的第一约束配置与在所述管腔外的第二展开配置之间,其中,所述柔性构件在所述第二展开配置中被配置成符合所述装置所插入的腔的内部几何形状;
将所述针引入到所述受试者的所述腔中;
使所述细长构件前进穿过所述针的所述管腔,使得所述柔性构件从所述针的远端突出,并在所述腔内呈所述第二展开配置并与所述腔的内壁接触;
使所述细长构件旋转,使得展开的柔性构件刮擦所述腔的内壁;
将所述细长构件缩回到所述针的所述管腔中,使得所述柔性构件处于所述第一约束配置,并重新进入所述针的远端;
通过所述针的所述管腔而从所述腔抽吸液体;以及
将所述针从所述腔缩回。
在一个实施方式中,所述装置包括管状护套,所述管状护套被布置在所述细长构件的外部,并且被配置成在所述针或导管的所述管腔内沿着所述细长构件移动,并且所述方法还包括:
在使所述细长构件旋转的步骤之前,使所述管状护套前进穿过所述针,使得所述管状护套的远端离开所述针的远端并接触展开的所述柔性构件;和
在将所述细长构件缩回的步骤之后,将所述管状护套缩回到所述针中。
在一个实施方式中,将所述针引入到所述受试者的腔中的步骤是通过内窥镜超声即EUS引导来执行的。因此,采样可以以微创方式作为EUS-FNA/FNB手术来执行,例如用于获取受试者的胃区域中的样本。
附图说明
现参照附图,以示例的方式描述本发明,其中:
图1示出了由根据本公开的一个实施方式的装置使用的朝向胰腺中的囊肿的内窥镜超声引导的细针抽吸(EUS-FNA)路径、在人体外操作该装置以及结合EUS-FNA的装置的不同步骤;
图2示出了根据本公开的一个实施方式的装置离开22G针的照片,以及在放置热收缩管之前和之后以结的形式的安装界面的扫描电子显微镜(SEM)图像;
图3示出了如下视图,即:根据本公开的一个实施方式的装置在囊肿幻影的腔中操作的剖面图;在装置插入的情况下的囊肿幻影的侧视图照片;以及使用该装置刷洗之前和刷洗之后的囊肿幻影的前部和后部的轴向视图;以及它们之间的差异;
图4示出了根据本公开的一个实施方式的装置在猪小肠模型中的离体测试的示意图;
图5a和图5b示出了如图4中所示的来自所进行的测试的绝对细胞浓度和刷效率;
图6示出了根据本公开的一个实施方式的装置在牛卵泡囊肿中的离体测试的示意图,以及在不刷洗和刷洗的情况下的细胞计数器图像;
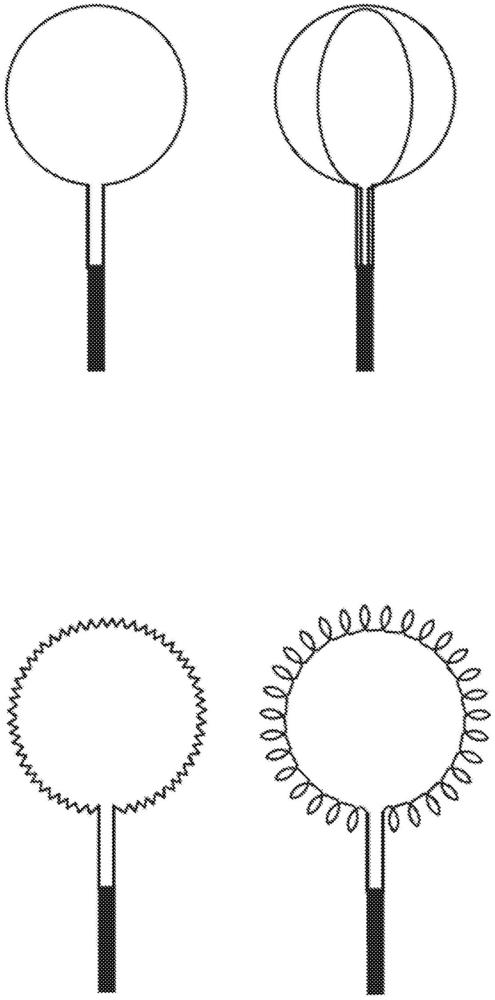
图7示出了根据本公开柔性构件的被布置在细长构件的远端处的四个实施方式;
图8示出了根据本公开的不同实施方式的柔性构件的特写视图;
图9示出了操作根据本公开的另一个实施方式的装置的不同步骤。
具体实施方式
在下文中,呈现了根据本公开的装置的详细描述。在附图中,相同的附图标记表示贯穿多个附图的相同或对应的元件。应将理解,这些附图仅是用于例示的,而不以任何方式限制本发明的范围。
在本公开的上下文中,应当理解,术语“远端的”和“远端地”是指在使用根据本公开的装置时离操作者(最远)的位置或方向。相应地,术语“近端的”和“近端地”是指在使用根据本公开的装置时最接近于或朝向操作者的位置或方向。
现参照图1,在图a)中,示出了根据当前实践的内窥镜超声引导的细针抽吸/活检(EUS-FNA/FNB)手术的示意图。内窥镜穿过患者的口腔、食道、胃、小肠(十二指肠)来插入,以到达胰腺,并且当由超声换能器定位囊肿时,操作者将22G针插入到囊肿中。然而,可以将其它感兴趣的器官或区域作为目标,并且内窥镜可以穿过结肠、肛门或直肠来插入。根据手术的不同,还可以预见针的其它计量器。
在图1的b)图中,示出了用于提高细胞产量的手术的步骤。最初位于22G针内的呈环刷形式的柔性构件被推入到囊肿中,在该囊肿中,其符合内腔。使细长构件旋转导致环刷旋转,并从囊壁刮擦细胞,以导致其释放到囊液中。接下来,将柔性构件从针的管腔缩回,并且通过针抽吸囊液,并收集囊液用于下游细胞学/病理学或生物化学、分子或遗传学分析。
为了验证该装置的机械坚固性,进行了应力测试,结果表明,当通过针将具有1200mm长的细长构件的环刷引入、旋转和移除多达100次时,对环刷的移动没有限制。图1的照片c)示出了内窥镜的远端,该内窥镜的远端包括针和环刷。
柔性构件的拉伸测试表明,机械失效发生在断裂极限力大于3N时,其数量级与直的50m镍钛诺金属丝(SI5)的数量级相似。体内操作期间的机械应力水平保持在低于该极限强度几个数量级的水平。
现参照图2,示出了一种根据本公开的一个实施方式的装置。图2的照片a)例示了该装置的远端,其中,柔性构件以环的形式被布置在细长构件(此处称为导丝)的远端处。柔性构件由50μm细的镍钛诺金属丝构成,该金属丝成形为直径为1cm的环。如图2的扫描电子显微镜(SEM)照片b)中所示,该环通过反手结被固定至280μm粗的镍钛诺细长构件。镍钛诺金属丝穿过其中的孔与导丝打结。该孔可以具有大于0.025mm且小于5mm的直径,通常小于0.50mm。该孔可以被定位成距离细长构件的远端1mm或最多10mm。
如图2的SEM照片c)中所示,打结后,热收缩管被插入在结上方,并允许通过施加热量而使其收缩,从而将结包裹。热收缩管可以具有大于0.1mm且小于12mm的直径,通常大于0.2mm。
在本公开的范围内可以预见用于将柔性构件安装到细长构件的其它手段,这些手段包括胶合、焊接、机械互锁。安装接口可以与热收缩管结合,以用于包裹,或可以不与热缩管结合。在一个实施方式中,细长构件和柔性构件被一体形成为单体结构,即,单件。
现参照图3,研究了环刷在体外囊肿幻影中的球形腔内的操作方式,如图3的图a)中所示。柔性构件穿过22G针的管腔而被引入到腔中,然后旋转。如图3的照片b)中所示。据观察,环刷符合幻影的内壁,并且示出柔性构件的从腔的硬内壁将细胞大小的滑石粉颗粒去除的能力,从而显露出刷洗内部3D曲面的能力,如图3的照片c)中所示。
目前,还不存在与人类囊肿大小相似并模拟组织中细胞附着的胰腺囊肿的动物模型,这对于环刷功能的验证是至关重要的。此外,胰腺囊肿含有不同粘度的液体,粘度越高,表明恶性程度越高。因此,用盐水或甘油作为液体介质来构建离体猪小肠模型。参照图4,证明了柔性构件在刷洗后增加细胞数量的能力。使用了六根肠(指示为A至F),并且将每根肠切均成六个测试段(表示为1至6)。图4的图a)示出了截面切割位置的示意图。图4中的图b)示出了在以下手术中从模型采集细胞的剖面示意图:i)阴性对照测试,即,随后在不刷洗的情况下添加液体和抽吸;ii)阳性对照测试,即,随后在第一肠段上添加液体,并用齿间刷刷洗并抽吸液体,以及;iii)样本测试,即,随后在第2至第6个肠段上添加液体,并用环刷刷洗并抽吸液体。
将环刷洗、阴性对照(不刷洗)以及阳性对照(用齿间刷刷洗)之间去除液体之后的细胞含量进行比较。结果如图5a中所示,即:图5a例示了绝对细胞浓度,而图5b例示了刷效率η。来自肠的样本(表示为A至C)充满盐水,而来自肠的样本(表示D至F)充满甘油。水平虚线表示细胞计数器的检测极限(LOD)。LOD以下的细胞计数被紧接在LOD线的下方呈现。误差条表示SD.*P<0.05。进行阴性对照和环刷的所有15次重复秩和配对测试,发现了两种培养基的P<0.0001。
刷效率η被限定为环刷样本与阴性对照样本的细胞浓度比。在阴性对照样本包含的细胞少于细胞计数器的检测极限(LOD)的情况下,使用LOD值而不是阴性对照值。所有测试均显示η>1。在盐水模型中,η的平均值=11(n=15);在甘油含量的模型中,η的平均值为65(n=15)。这些结果显示,环刷可以将细胞从3D软组织表面去除,之后可以通过抽吸将其采集。在环刷洗之后,盐水和甘油填充样本的细胞浓度具有相似的数量级,这表明环刷洗改善了不同粘度的囊液中的细胞采集。在盐水与甘油填充模型之间的阴性对照测量中观察到细胞含量具有差异。这种差异归因于液体粘度的差异,这导致用于盐水模型的更多紊流填充条件以及用于甘油的更多层流条件。即,用盐水填充模型将已经释放的细胞混合在液体中,而甘油填充则将这些细胞保持为靠近于肠壁。
进一步验证了,在一般操作手术中,由柔性构件施加在组织上的力大约在0.1mN至0.7mN的范围内(SI7)。环刷的使用也在模拟胃肠系统的曲线的囊肿内窥镜路径的模型中得以验证。在没有观察到不利情况的情况下,使环刷抵靠猪小肠模型的管腔以60rpm旋转1小时。
现参照图6,测试了刷洗离体牛卵泡囊肿模型之后增加细胞数量的能力。如图6的图a)中所示,实验手术开始于不刷洗的情况下液体取样(阴性对照),然后是环刷洗,接着是第二次液体取样。图6的照片b)示出了带有以及不带有卵泡囊肿的奶牛卵巢。图6的照片c)和照片d)示出了用于阴性对照样本(c)和环刷样本(d)的彩色增强细胞计数器图像及其相应的细胞计数。
与阴性对照相比,环刷洗使细胞浓度增加了至少10倍。刷洗之后细胞簇的存在不容易对样本中的所有细胞进行计数,这导致了该效率估计是保守的。这些结果显示:柔性构件可以通过22G针的管腔在囊肿内被成功操作,并且能够在囊肿的液体环境中刷洗和分散细胞。柔性构件在一种以上类型的组织中轻轻摩擦和分散细胞的能力表明其在胰腺癌诊断手术中成功操作的潜力。
目前结果证明了柔性构件在胃肠道模型中的功能、机械稳健性、简单的操作手术以及柔性构件对组织的低作用力,并显示了其与目前EUS-FNA手术的兼容性。未来的研究应旨在评估该手术的安全性,特别是关于对周围组织的潜在损伤,以及在具有隔膜的囊肿中刷洗,即,将囊腔分隔成两个或更多个隔间的壁结构。
现参照图7,示出了根据本公开的环形柔性构件的四个实施方式。柔性构件被布置在细长构件的远端处。细长构件可以具有大于0.1mm且小于12mm的直径,通常大于0.2mm。细长构件可以长达2米且短至1cm,通常大于3cm。在操作中,细长构件可以被用于引导柔性构件。例如,当细长构件在针管腔中分别前进、旋转并且缩回时,柔性构件可以被引入到腔中、在腔内旋转以及从腔移除。细长构件可以借助手或借助机械/机器人装置来操纵。该操纵可以在现场进行,也可以远程进行。
柔性构件可以具有大于0.025mm且小于4mm的直径,通常小于0.5mm,更优选地小于0.21mm。环的直径可以大于1mm,通常大于2mm,且小于8cm,通常小于3cm。
在第一实施方式中,柔性构件包括单个环,当在针或导管的管腔中不受约束时,该单个环在展开配置中是大致圆形的。示例性针可以具有大于0.1mm且小于6mm的内径,通常小于5.5mm。示例性导管可以具有大于0.33mm且小于12mm的内径,通常小于9mm。在第二实施方式中,柔性构件包括一个以上的环,例如如此处所示的两个环。在第三实施方式中,柔性构件包括至少一个锯齿状部分,以产生呈Z形图案的多个齿或点。环的锯齿状边缘增加了柔性构件抵靠囊肿或其它腔的壁的摩擦作用,从而增加了细胞产量。锯齿状边缘可以由柔性构件的宏观结构形成,例如,柔性构件形成有锯齿状结构。在第四实施方式中,柔性构件被卷绕成螺旋形状,并且随后形成为环,使得螺旋的轴线大致平行于柔性构件的大体延伸方向,即,环形状的轮廓。
现参照图8,示出了根据本公开的不同实施方式的柔性构件的表面的特写视图。在一个实施方式中,柔性构件的表面可以是大致光滑的,如图7的左上实施方式所示。在另一个实施方式中,柔性构件的表面可以包括微结构,以增加耐磨性,从而提高细胞产量,这类似于图7的左下实施方式。如图8的中间视图中所示,微观结构可以通过柔性构件表面中的凹口或凹槽来实现。在一个实施方式中,微结构是借助一个或多个圆柱形结构来实现的,该圆柱形结构在其上具有多个突起,例如螺柱,并被插入到柔性构件上。圆柱形结构可以是刚性的,这局部地限制了柔性构件的柔性。柔性构件可以在圆柱形结构之间的部分中弯曲,从而改善柔性构件相对于腔的组织壁的保形性能。
现参照图9,示出了用于操作根据本公开的一个实施方式的装置的手术的步骤。在步骤a)中,将包括装置(该装置包括细长构件和柔性构件,所述柔性构件在所述针的管腔内处于受限配置)的针引入到受试者的腔中,例如囊肿。在步骤b)中,细长构件在远端方向上前进穿过针的管腔,使得柔性构件离开针的管腔并过渡到展开配置,在展开配置中,柔性构件大致符合囊肿的内部几何形状以接触内壁。在步骤c)中,管状护套在针的管腔内在细长构件上前进,直到管状护套的远端接触展开的柔性构件。管状护套可以由诸如聚醚、聚酰胺、聚酰亚胺或聚四氟乙烯即PTFE的聚合物或者诸如镍钛或不锈钢的金属制成,并且保护柔性构件免受针的尖锐刻面的影响。在步骤d)中,细长构件在针的管腔内旋转,这使柔性构件在囊肿内旋转并从内壁刮擦细胞。在步骤e)中,将细长构件在近端方向上缩回,使得柔性构件重新进入针并过渡到约束配置。在该阶段,管状护套在超过针尖的位置中被保持就位,使得柔性构件在缩回期间不接触针。在步骤f)中,将管状护套沿近端方向缩回到针管腔中。最后,在步骤g)中,将囊肿中的液体与通过柔性构件的摩擦作用而脱落的细胞一起抽吸。腔中的液体含量可以由生物体自然排泄,例如排尿。液体含量可以通过导管插入术来去除。
在一个实施方式中,可以通过使细长构件和柔性构件沿远端方向前进而将抽吸的液体含量推出针管腔。在一个实施方式中,可以通过在针内向前推动金属丝(例如探针)而将液体含量推出针管腔。在一个实施方式中,可以通过使用空气或液体穿过注射器而将液体含量推出针管腔。柔性构件可以在去除液体之后被切割,并且随后被用于细胞学、病理学、生物学或化学分析。液体含量随后可以被用于细胞学、病理学、生物学或化学分析。所述细胞学分析是例如用于细胞形态分析的。所述病理学分析是例如用于组织形态分析的。所述化学分析是例如蛋白质、糖蛋白、酶、DNA、癌症标记物、免疫分析的。
在一个实施方式中,细长构件、柔性构件和/或管状护套的表面可以进行处理或涂覆,以降低摩擦系数,从而有助于前进、缩回和旋转。
环刷制造
环刷在一个实施方式中由三个主要部件构成:280μm镍钛诺细长构件(从美国波士顿科学公司,ExpectTM Slimline EUS-FNA装置M00555510获得的探针金属丝),打结以形成环的50μm镍钛诺金属丝(NiTi#1金属丝0.002″±0.0001″直退火轻氧化物,爱尔兰韦恩堡金属公司)和具有收缩前内径为460μm的PET医用热收缩管(103-0510,美国诺德森医疗公司),以用于保护打结区域。
为了制造环刷,穿过细长构件的远端钻出150μm的孔。不覆盖孔的情况下,将细长构件插入穿过热收缩管的2cm截面。然后,将50μm镍钛诺金属丝的同一端穿过该孔两次,以形成环。将环缠绕在直径为1cm的冰圆柱体上,并使用50μm镍钛诺金属丝的两端制作反手结。这确保了该结相对于细长构件的位置以及1cm的环直径。然后,将冰圆柱体置于室温下融化20分钟,并切割用于方便打结的多余金属丝末端,以留下约1cm的金属丝末端。最后,手动向前推动收缩管,以覆盖镍钛诺金属丝末端和结,并在70℃下加热30s,以使管收缩。收缩管具有两个功能:通过防止结在环刷移动过程中解开来保护结,以及塑造环形式的形状,由于环金属丝的一部分在收缩管内保持笔直,因此在管外部时形成环的形状。
体外囊肿幻影及刷洗测试
通过铣削2×2×2cm
通过将
通过使两个部分相互碰撞20次,使腔彼此面对,而去除多余的滑石粉。刷洗前,在立方体的每个部分均被固定在位置保持器中并且腔面向显微镜的情况下,用Leica M205 C显微镜使内腔成像。然后,将这两个部分用两个对准销组装,并用夹具固定。将环刷插入到22G皮下注射针(4710007040,Henke-Sass-Wolf,德国)中,该针在幻影入口的前部保持就位。为了便于测试,环刷细长构件由针外的金属丝保持器来固定。将金属丝保持器焊接到Robotzone 101rpm@12V DC电机(638194,ServoCity,瑞士)的轴。
刷洗腔通过在60rpm下启动电机1分钟来执行。刷洗之后,将球体的两个部分分离并再次成像。在所有图像采集过程中,保持相机设置不变。
为了测量刷洗之前和刷洗之后的差异,使用Python代码(SI4)将刷洗之后的图像与其相应的刷洗之前的图像对准。在图像对准之后,将所有图像转换为16位灰度图,并且对于每个球体部均获得了表示刷洗之前与刷洗之后之间的图像差异的图像。这是通过使用ImageJ(版本1.52a,美国国家卫生研究所)中的差异功能来进行的。
猪肠囊肿模型
猪小肠在死后立即通过
对于每个实验,使用手术刀切割小肠,以将其分离成六根8cm长的段,并从距离幽门约3cm处开始。这些段随后被轴向切割开,以完全暴露肠的管腔侧。用自来水冲洗所有暴露的片段1分钟,并且同时,手动轻轻擦洗以去除残留的残渣。将每个肠片段放置在装有自来水的容器中,其中,在20分钟内保持组织直到测试。
对于刷洗测试,使用半径为2.5cm的半球形模具来保持肠片段。该模具有五个直径为1mm的钻孔,该钻孔连接到真空管线,以在管腔侧面向外(图4b)的情况下,保持肠片段就位。
无刷洗情况下的测试(阴性对照)是固定在模具中之后通过将300μL的0.9%盐水(786-561,G-Biosciences,瑞典)或甘油(G9012,Sigma-Aldrich,瑞典)放置在组织上来进行的。将液体静置1分钟,然后使用移液管仔细抽吸100μL液体,在此期间注意不要接触肠壁。该方法先于每次环刷洗和阳性对照实验,并揭示了通过样本切割、清洁、处理和/或将培养基放置在样本上而自然脱落到培养基中的细胞数量。因此,在对同一肠段进行环刷洗测试之前,对每个肠段进行阴性对照测试。对六个肠段中的五个进行了环刷洗。然后,阴性对照测试之后,通过在组织切片上额外添加100μL液体来开始环刷洗,从而在整个测试过程中保持了液体体积。在阴性对照测试之后,对剩余的组织切片进行阳性对照刷洗,同时开始在组织切片上额外添加100μL液体。使用齿间刷(Dentalux,瑞典)作为阳性对照刷。该刷在持续1分钟不旋转的情况下,轻轻压靠肠管腔,然后在肠片段的中心处的0.5cm
牛卵泡囊肿模型
牛的生殖系统在死后立即通过
使用手术刀从牛生殖系统切除一个没有卵泡囊肿的卵巢和一个含有卵泡囊肿的卵巢,并将其固定在皮式培养皿中(图5b)。实验设计如图5a)中所例示,并按如下方式进行。首先,将卵泡囊肿刺破,并使用22G皮下注射针和注射器抽吸1.5mL液体。其次,再次刺破卵泡囊肿,使用具有预先安装的环刷的22G皮下注射针,然后引入环刷,以大约60rpm的速度手动旋转1分钟,并移除刷。最后,使用注射器通过针来抽吸1.5mL囊性液体。均化后,取出1.5mL样本中的100μL的份,以用于进一步的细胞分析。
液体样本处理
将抽吸的液体样本转移到试管(0030120086,Eppendorf,瑞典)中,并且随后与500μL StemProTM AccutaseTM(A1110501,瑞典赛默飞世尔科技公司)混合,并用移液管以2s为一周期抽吸和分配液体达30s,使其轻轻均质,并在37℃下静置5分钟。接着,使用70μm细胞过滤器(431751,CorningQR,荷兰)来过滤样本(牛除外),并使用Micro-Star 17R离心机(VWR,瑞典)以11000rpm离心4分钟。将上清液去除,并将浓度为0.05%v/v的含双苯亚甲胺33342(H3570,瑞典赛默飞世尔科技公司)的盐水的荧光团溶液添加到每个样本中。将阳性对照品与100μL溶液混合,并将阴性对照品和环刷洗样本与50μL溶液进行混合,以适应容纳的颗粒尺寸。最后,用铝箔缠绕样本20分钟,然后再次展开,为细胞计数做准备。
细胞计数器分析
细胞计数是用Countess II FL自动细胞计数器(瑞典赛默飞世尔科学公司)与EVOSTM光立方体DAPI(AMEP4650,瑞典赛默飞世尔科学公司)联接进行的。用移液管轻轻匀化所有样本,并将10μL样本放置于CountessTM细胞计数室载玻片(C10228,瑞典赛默飞世尔科学公司)上。使用DAPI光立方体进行肠样本细胞计数,设定如下:尺寸在4μm至14μm之间,亮度在0a.u.至255a.u.之间,环度为0.67,并使用自动对焦。卵泡囊肿样本细胞计数也使用DAPI光立方体来进行,设定如下:尺寸在6μm至29μm之间,亮度在0a.u.至255a.u.之间,环度为0.78,并自动聚焦。最后,对肠和卵泡囊肿样本进行稀释计算,最终体积为50μL。
统计分析
将肠细胞计数结果应用于单侧秩和检验配对符号秩检验,并具有显著性水平为5%,以检验使用或不使用环刷之间的统计学显著性差异。这是使用GraphPad Prism 8软件(GraphPad,CA,USA)来完成的。
结论
一种被设计成从与EUS-FNA结合的胰腺囊肿和中空腔的内壁获取细胞的环刷得以成功测试。当通过22G针引入、旋转以及从囊肿中移除环刷时,没有发现任何不利因素。将用环刷刷洗之前和之后从离体囊肿模型中提取的液体中的细胞含量进行比较。在软组织软状腔中使用低粘度水作为液体时,细胞含量增加了54倍;当使用高粘度甘油时,细胞含量增加高达174倍,并且;在奶牛卵巢囊肿中,细胞含量增加至少10倍。环刷证明是一种强大、微创以及全方位的工具,其能够与EUS-FNA结合操作,并能够在软质和硬质状囊肿模型中以及浆液或粘稠状液体中刷洗囊肿细胞。
使用连接到DC电机的刷进行环刷实验,类似于体外囊肿幻影测试。将刷子的远端轻轻压靠肠管腔,并在肠片段的中心处0.5cm
已经描述了一种根据本公开的用于从受试者的腔中使细胞或组织分脱离的装置的优选实施方式。然而,本领域技术人员意识到,在不脱离本发明思想的情况下,可以在所附权利要求的范围内进行变化。
在不脱离本发明思想的情况下,只要组合不矛盾,上述所有替代实施方式或实施方式的部分都可以自由组合。
