一种TNF-α纳米抗体的制备方法及其应用
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及生物技术领域,具体涉及一种TNF-α纳米抗体的制备方法及其应用。
背景技术
溃疡性结肠炎(ulcerative colitis,UC)是一种易复发的自身免疫性疾病,属于炎症性肠病(Inflammatory bowel disease,IBD)的一种。溃疡性结肠炎在临床上的典型症状表现为血性腹泻、夜间排便、急症和里急后重,在最初的隐匿期后,它表现出粘膜炎症反复发作和缓解的特征。IBD的致病机制尚不明确,遗传、免疫和环境因素,如饮食、压力、吸烟和自由基等,都参与了其发展。
在世界范围内,UC的发病率呈现出逐年上升的趋势。随着UC患病率的上升,整体医疗成本也会上升。因此,开发新型的高效低毒的治疗药物成为需求。
anti-TNF-α抗体药物在20世纪90年代后期开发,在治疗自身免疫性疾病如炎症性肠病,强直性脊柱炎,牛皮癣和类风湿性关节炎方面取得了巨大成功。目前常见的TNF-α抗体药物包括英夫利昔单抗、阿达木单抗、戈利木单抗、赛妥珠单抗和依那西普。
由于市售的TNF-α抗体由于分子量大、结构复杂,只能由哺乳动物细胞表达,因此,TNF-α抗体药物价格昂贵,一直高居全球各类药物销售的榜首。研发高活性、低成本的TNF-α抗体药物、使之成为“老百姓用得起的药物”一直成为全球制药行业的努力目标。
目前,缺乏一种成本低廉的、适于在大肠杆菌中制备高活性的TNF-α纳米抗体的制备方法及其应用。
发明内容
本发明的目的在于为了解决现有技术中的问题,而提出的一种具有高活性、适于在大肠杆菌中表达和纯化高活性的TNF-α纳米抗体的制备方法及其应用。
为了实现上述目的,本发明提供了如下技术方案:
本发明的所述的TNF-α纳米抗体的制备方法,在大肠杆菌中进行表达和分离纯化,具体包括如下步骤:
(1)通过酶切和酶联反应将TNF-α纳米抗体基因导入pET28a载体,构建表达质粒;
(2)将目的质粒转入BL21(DE3)感受态细胞,转化后取适量菌液涂布在含有卡那霉素的LB平板上37℃过夜培养;
(3)挑取阳性克隆在含卡那霉素的LB培养基中进行扩大培养,在15℃条件下加入5mM的IPTG诱导20h;通过离心收取细胞沉淀,向体系中加入蛋白缓冲液,使用匀浆机破碎细胞,离心后收取上清液;通过柱层析进行分离纯化,制得TNF-α纳米抗体。
在步骤(1)中,所述的TNF-α纳米抗体为具有如下氨基酸序列:
(1)由SEQ ID No.1或2或3所示的氨基酸序列组成的蛋白质;或
(2)与序列SEQ ID No.1或2或3限定的氨基酸序列同源性在80%至100%编码相同功能蛋白质的氨基酸序列;或
(3)SEQ ID No.1或2或3所示的氨基酸序列经增加、缺失或替换一个或多个氨基酸具有同等活性的由(1)衍生的蛋白。
在步骤(1)中,所述的TNF-α纳米抗体为TNF-α纳米抗体V19或TNF-α纳米抗体V7或TNF-α纳米抗体V1,所述的TNF-α纳米抗体V19为SEQ ID No.1所示的氨基酸序列组成的蛋白质,所述的TNF-α纳米抗体V7为SEQ ID No.2所示的氨基酸序列组成的蛋白质,所述的TNF-α纳米抗体V1为SEQ ID No.3所示的氨基酸序列组成的蛋白质。
进一步地,在步骤(1)中,通过酶切酶联反应将如SEQ ID No.1或SEQ IDNo.2或SEQID No.3所述的TNF-α纳米抗体基因导入pET28a载体,构建质粒;
(2)将目的质粒转入BL21(DE3)感受态细胞轻轻混匀后冰浴30min,42℃热激45s,冰上静置2min后加入600μl无抗生素LB培养基后37℃震荡1h,离心后弃上清,留下少许培养基重悬菌液;转化后取适量菌液涂布在含有卡那霉素的LB平板上37℃过夜培养;
(3)挑取阳性克隆在含卡那霉素的LB培养基中进行扩大培养,在15℃条件下加入5mM的IPTG诱导20h;表达的TNF-α纳米抗体蛋白中包含His标签;
通过离心收取细胞沉淀,向体系中加入蛋白缓冲液,使用匀浆机破碎细胞,离心后收取上清液,表达的TNF-α纳米抗体以可溶性形式存在于上清液中;
使用蛋白缓冲液平衡含有Ni-NTA树脂的柱子后,使上清液缓慢通过Ni-NTA从而将目的TNF-α纳米抗体结合在Ni-NTA上,之后使用蛋白洗脱液进行洗脱;蛋白缓冲液由如下组分组成:300mM NaCl,50mM Tris-HCl,0.5mMβ-巯基乙醇,pH 7.8;蛋白洗脱液由如下组分组成:80mM imidazole,300mM NaCl,50mM Tris-HCl,0.5mMβ-巯基乙醇,pH 7.8;
(4)在4℃条件下使用HRV3C酶剪切TNF-α纳米抗体上的His标签12h;将溶液重新通过Ni-NTA以得到不含His标签的TNF-α纳米抗体,使用PBS缓冲液过夜透析后浓缩并保存;制得TNF-α纳米抗体;用12% SDS-PAGE验证TNF-α纳米抗体的分子量和纯度。
进一步地,在步骤(3)中,所述的第一次离心的速率为2500rpm,离心的时间为5min;在步骤(3)中,所述的第二次离心的速率为4000rpm,离心的时间为20min,离心的温度为4℃;所述的第三次离心的速率为12000rpm,离心的时间为30min,离心的温度为4℃。
更进一步地,在步骤(3)中,所述的蛋白缓冲液由300mM NaCl,50mM Tris-HCl,0.5mMβ-巯基乙醇组成,所述的蛋白缓冲液的pH为7.8。
进一步地,在步骤(3)中,所述的蛋白洗脱液由80mM imidazole,300mM NaCl,50mMTris-HCl和0.5mMβ-巯基乙醇组成,所述的蛋白洗脱液的pH为7.8;在步骤(4)中,用12%SDS-PAGE验证TNF-α纳米抗体的分子量和纯度。
本发明所述的TNF-α纳米抗体在制备炎症药物中的应用。
本发明所述的TNF-α纳米抗体在制备溃疡性结肠炎药物中的应用。
有益效果:本发明建立了适于在大肠杆菌中表达和制备高活性的TNF-α纳米抗体的制备方法,纳米抗体亲和力可以高达6.5pM(V19)、146nM(V7)远好于目前上市的TNF-α抗体药物的亲和力。具有高活性的TNF-α纳米抗体能够在大肠杆菌中进行表达和分离纯化,成功避免了大肠杆菌表达系统难以可溶性表达抗体类蛋白质;即使能够表达,也因为蛋白质折叠不安全的原因、其活性较低的难题。
与现有技术相比,本发明具备以下优点:
(1)本发明制备的TNF-α纳米抗体与现有的哺乳动物系统表达的TNF-α抗体药物相比,不仅具有优越的亲和力,而且展现出显著的治疗效果(以溃疡性结肠炎为例)。
(2)本发明表达和制备的TNF-α纳米抗体还能够在大肠杆菌中以可溶性形式表达,存在于细胞裂解上清液中,具有生物活性高的特点。
(3)本发明表达和制备的TNF-α纳米抗体能够在大肠杆菌中可溶性形式表达和分离纯化,避免了复杂和昂贵的哺乳动物细胞表达及其繁琐、高成本的分离制备;明显降低了生产成本。
附图说明
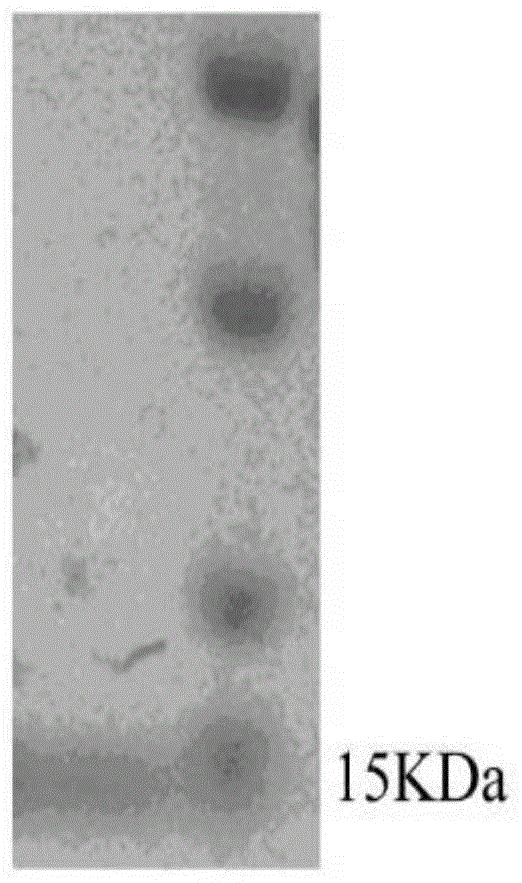
图1为本发明的TNF-α纳米抗体的纯化与表征;A:通过亲和层析表达和纯化TNF-α纳米抗体;B:通过MST检测TNF-α纳米抗体与鼠源s-TNF-α的亲和力。
图2为本发明的不同剂量TNF-α纳米抗体对DSS小鼠体重及结肠长度的影响。A:TNF-α纳米抗体治疗DSS诱导的结肠炎期间的一系列体重变化;B:第8天各组的代表性结肠的长度比较。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
所述的TNF-α纳米抗体为TNF-α纳米抗体V19或TNF-α纳米抗体V7或TNF-α纳米抗体V1,所述的TNF-α纳米抗体V19为SEQ ID No.1所示的氨基酸序列组成的蛋白质,所述的TNF-α纳米抗体V7为SEQ ID No.2所示的氨基酸序列组成的蛋白质,所述的TNF-α纳米抗体V1为SEQ ID No.3所示的氨基酸序列组成的蛋白质。
由于TNF-α作为炎症因子,在炎症性疾病中发挥核心作用,因此,TNF-α抗体被广泛用于治疗炎症性肠病,强直性脊柱炎,牛皮癣和类风湿性关节炎等自身免疫性疾病。本发明中仅以炎症性肠病作为TNF-α纳米抗体的疾病治疗模型,所述的TNF-α纳米抗体在治疗其他自身免疫性疾病,例如,强直性脊柱炎、过敏性鼻炎等模型中也均表现出优异的治疗效果。同时,TNF-α纳米抗体能够像目前临床使用的TNF-α抗体药物一样与其他治疗药物获治疗方法联合使用。
本发明所述的TNF-α纳米抗体制备方法所制备的TNF-α纳米抗体在制备炎症药物中的应用。
本发明所述的TNF-α纳米抗体制备方法所制备的TNF-α纳米抗体在制备溃疡性结肠炎药物中的应用。
本发明三种TNF-α纳米抗体均可在大肠杆菌中可溶性表达和分离纯化,因此,本发明中仅以其中的TNF-α纳米抗体V7为例。
实施例1
如图1至图2所示,本发明首先在大肠杆菌中原核表达TNF-α纳米抗体V7,具体步骤为:通过酶切和酶联反应将如SEQ ID No.2所示的TNF-α纳米抗体V7基因导入pET28a载体,构建表达质粒。
将目的质粒转入BL21(DE3)感受态细胞轻轻混匀后冰浴30min,42℃热激45s,冰上静置2min后加入600μl无抗LB培养基后37℃震荡1h,离心(2500rpm,5min)后弃上清,留下少许培养基重悬菌液。
转化后取适量菌液涂布在含有卡那霉素的LB平板上37℃过夜培养。
挑取阳性克隆在含卡那霉素的LB培养基中进行扩大培养,在15℃条件下加入5mM的IPTG诱导20h。表达的TNF-α纳米抗体V7蛋白中包含His标签。
通过离心(4000rpm,20min,4℃)收取细胞沉淀,向体系中加入蛋白缓冲液,使用匀浆机破碎细胞,离心(12000rpm,30min,4℃)后收取上清液,表达的TNF-α纳米抗体以可溶性形式存在于上清液中。
蛋白缓冲液配方:①300mM NaCl,②50mM Tris-HCl,③0.5mMβ-巯基乙醇。④pH7.8。
使用蛋白缓冲液平衡含有Ni-NTA树脂的柱子后,使上清液缓慢通过Ni-NTA从而将目的TNF-α纳米抗体V7结合在Ni-NTA上,之后使用洗脱液进行洗脱。
蛋白洗脱液配方:①80mM imidazole,②300mM NaCl,③50mM Tris-HCl,④0.5mMβ-巯基乙醇,⑤pH 7.8。
在4℃条件下使用HRV3C酶剪切TNF-α纳米抗体V7蛋白上的His标签12h。
将溶液重新通过Ni-NTA以得到不含His标签的TNF-α纳米抗体V7,使用PBS缓冲液过夜透析后浓缩并保存(-80℃)。
用12% SDS-PAGE验证TNF-α纳米抗体V7的分子量和纯度。
如图1A所示,孔道中为纯化后切除His标签后的TNF-α纳米抗体V7的蛋白,约为15kDa。
实施例2
本发明通过MST实验检测了纯化的TNF-α纳米抗体V7对可溶性TNF-α(s-TNF-α)的亲和力,具体步骤为:
使用MST缓冲液(50mM HEPES,100mM KCl,0.05% Tween-20)配制100nM的TNF-α纳米抗体V7溶液。
使用PBST缓冲液制备10μM的人源或鼠源的TNF-α溶液。
TNF-α溶液的最高配体浓度为5μM,并按照16步梯度稀释法进行稀释,每个稀释系列样品的最终体积为10μl。
将10μl 100nM的TNF-α纳米抗体V7与各浓度梯度TNF-α样品混合并摇匀,室温孵育5min后将样品吸到毛细管中,并将毛细管放置于Monolith NT.115仪器中进行检测。
如图1B所示,TNF-α纳米抗体V7及TNF-α纳米抗体V7和鼠源s-TNF-α的解离常数达到146nM,说明本发明在大肠杆菌中制备的TNF-α纳米抗体具有高生物活性,即具有完整、正确的空间折叠的蛋白质结构。TNF-α纳米抗体V19纳米抗体亲和力可以高达6.5pM。
实施例3
本发明证明了TNF-α纳米抗体V7在10mg/kg的剂量下对3%葡聚糖硫酸钠(DSS)诱导的急性结肠炎小鼠具有明显的治疗效果,具体步骤如下:
选用7-9周C57BL/6雌性小鼠(体重18~20g)进行模型诱导。空白对照组小鼠每日喂养正常饮用水,DSS造模组和各给药治疗组小鼠自由饮用含有3%DSS的饮用水,共诱导8天。
从造模第二天开始,小鼠腹腔注射1mg/kg,5mg/kg,10mg/kg TNF-α纳米抗体V7,给药周期为三天一次。
每天记录小鼠的体重和粪便隐血的情况。
如图2A所示,10mg/kg(18.40g±0.9959g,P=0.0304)和5mg/kg(18.15g±0.5949g,P=0.014)组的小鼠体重显著高于DSS组(17.03g±2.443g),而1mg/kg(18.01g±1.674g,P=0.3397)组的小鼠体重无显著变化。如图2B所示,治疗后,与DSS组相比,10mg/kg和5mg/kg组的结肠损伤更少。这表明在10mg/kg的剂量下,TNF-α纳米抗体V7对DSS小鼠有良好的治疗效果,为TNF-α纳米抗体V7的最佳治疗剂量。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
