一种甜味蛋白的制备方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明创造涉及生物技术领域,具体地说,涉及一种甜味蛋白的制备方法。
背景技术
甜味蛋白是食品添加剂中常用的一种蛋白类甜味剂,与糖类甜味剂相比,其具有甜度高和热量低的特点,能够预防龋齿且安全性已经得到广泛认可,其经胃蛋白酶消化后成为必需氨基酸,还具有一定的营养价值。迄今为止,已报道的甜味蛋白有6种,包括索马甜(Thaumatin),马宾灵(Mabinlin)、库克灵(Curculin)、巴西甜蛋白/布拉齐因(Brazzein)、莫乃灵(Monellin)、神秘果素/奇果蛋白(Miraculin),基本特征如下:
表1 不同甜味蛋白特征对比
由于提取植物原产地的区域限制,以及提取成本过高,传统的以植物为原料提取制备甜味蛋白的方法无法得到推广应用,生产规模严重受限。在早期甜味蛋白生产中,人们尝试通过转基因作为来提高甜味蛋白的产量,及扩大生产经营范围,已报道的转基因作物包括马铃薯、黄瓜、番茄、梨和草莓等。但是利用转基因作物进行甜味蛋白生产,其年产量与转基因作物品种有关,同时还受到植物生长情况的影响,面临着严峻的气候威胁。随着生物技术的发展,尤其是利用基因工程技术将甜味蛋白基因克隆到微生物细胞中,构建产甜味蛋白的基因工程菌,为商品化生产甜味蛋白开辟了一条快速而有效的新途径。
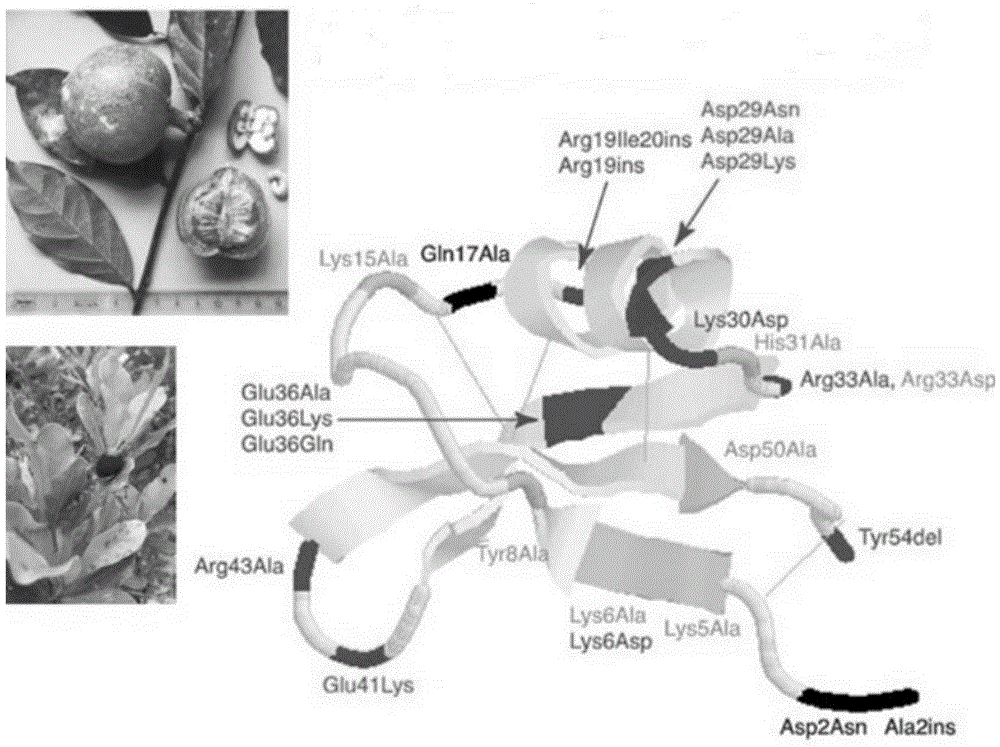
相较于其他5种甜味蛋白,巴西甜蛋白有着明显的特点:巴西甜蛋白的甜味为蔗糖的2000倍,分子质量较小,只有6.4kDa,由54个氨基酸残基组成(如图1所示),稳定性较好,在80 ℃下加热4h也不会丧失甜味,但是只有L-型具有甜味,D-型则不具有甜味。
由于其分子量小,用于生产的表达系统相对于其他甜味蛋白,在理论上应当具有更高的外泌效率,这使得巴西甜蛋白也拥有着极大的市场开发潜力。近年来已经被广泛研究,例如针对其甜度低于索马甜和莫乃灵,有报道通过基因工程改造后的巴西甜蛋白甜度比野生型提高近50%,能够达到索马甜和莫乃灵的相当甜度
但作为食品添加剂,安全性是甜味蛋白能够进入市场的重要评价指标,尽管上述6种甜味蛋白的安全性已经得到充分认可,但是经过基因工程改造后的甜味蛋白中通常含有氨基酸残基突变,对于突变后的甜味蛋白是否仍然满足安全性的要求,目前缺乏明确的评价标准。并且,甜味蛋白的稳定性和甜度等商品化必要特性是否能够得以保留,也是基因改造过程中面临的技术难题。同时,巴西甜蛋白由于分子量小,其表现外泌优势的同时,也带来纯化难度大的技术问题。
发明内容
本发明的目的在于,提供一种野生型甜味蛋白的制备方法,为了避免甜味蛋白在食品应用中存在的安全性问题,提供一种在不改变甜味蛋白的天然氨基酸序列的情况下,高效生产高甜度甜味蛋白的方法,该方法在甜味蛋白表达基因上游添加引导蛋白,构建融合蛋白表达系统,用于生产甜味蛋白,显著提高甜味蛋白的表达量。
本发明的另一个目的在于,提供利用上述酵母表达系统高效生产甜味蛋白,得到含有甜味蛋白片段的融合蛋白,该融合蛋白经过蛋白酶的剪切,能够得到具有活性的甜味蛋白。
为了解决上述技术问题,实现上述目的,本发明提供了以下技术方案:
第一方面,本发明提供了在酵母中高表达的蛋白作为引导蛋白在甜味蛋白表达系统构建中的应用。其中,所述酵母包括马克斯克鲁维酵母、乳酸克鲁维酵母或毕赤酵母。所述引导蛋白包括融合标签蛋白、β-乳球蛋白或其他酵母中高表达的蛋白,优选为β-乳球蛋白。
在可选的实施方式中,所述甜味蛋白包括巴西甜蛋白、索马甜、莫乃灵、马宾灵、库克灵或神秘果素,优选为巴西甜蛋白。
在可选的实施方式中,所述β-乳球蛋白的氨基酸序列如SEQ ID No:1所示或与其同源性在80%以上的衍生序列;所述巴西甜蛋白的氨基酸序列如SEQ ID No:2所示或与其同源性在80%以上的衍生序列。
第二方面,本发明提供了一种融合蛋白,所述融合蛋白包括来源于β-乳球蛋白的片段和来源于甜味蛋白的片段。
在可选的实施方式中,所述来源于β-乳球蛋白的片段和来源于甜味蛋白的片段之间通过linker连接。
在可选的实施方式中,所述linker为肠激酶酶切位点。
在可选的实施方式中,所述甜味蛋白为巴西甜蛋白。
在可选的实施方式中,所述β-乳球蛋白的氨基酸序列如SEQ ID No:1所示或与其同源性在80%以上的衍生序列;所述巴西甜蛋白的氨基酸序列如SEQ ID No:2所示或与其同源性在80%以上的衍生序列;所述肠激酶酶切位点的氨基酸序列如SEQ ID No:3所示。
第三方面,以下(a)~(e)中任一种生物材料:
(a)编码前述实施方式任一项所述融合蛋白的核酸分子,或其经密码子优化后的衍生核酸分子;
(b)装载有(a)所述核酸分子的表达载体,所述表达载体为质粒表达载体,所述质粒表达载体的原始质粒选自pKLAC1或pKLAC2;
(c)马克斯克鲁维酵母表达系统,含有(a)所述核酸分子或(b)所述表达载体;
(d)乳酸克鲁维酵母表达系统,含有(a)所述核酸分子或(b)所述表达载体的乳酸克鲁维酵母;
(e)毕赤酵母表达系统,含有(a)所述核酸分子或(b)所述表达载体的毕赤酵母。
在可选的实施方式中,所述马克斯克鲁维酵母选自以下任一保藏编号的马克斯克鲁维酵母菌株:CCTCC No:M20211265、CCTCC No:M20211601、CCTCC No:M20211602、CCTCCNo:M20211603、CCTCC No:M20211604、CCTCC No:M20211605、CCTCC No:M20211606、CCTCCNo:M20211607、CCTCC No:M20211608、CCTCC No:M20211609或CCTCC No:M20211610;
第四方面,本发明提供了前述实施方式任一项所述融合蛋白的制备方法,所述制备方法为,发酵培养前述实施方式任一项所述的马克斯克鲁维酵母表达系统、乳酸克鲁维酵母表达系统或毕赤酵母表达系统,从发酵液中分离回收融合蛋白。
在可选的实施方式中,所述发酵培养包括菌体富集阶段和诱导表达阶段,通过向培养基中添加半乳糖实现融合蛋白的诱导表达。
第五方面,本发明提供了前述实施方式任一项所述融合蛋白或采用前述实施方式任一项所述制备方法制备得到的融合蛋白在制备甜味蛋白中的应用。
第六方面,本发明提供了甜味蛋白的制备方法,所述制备方法包括,使用蛋白酶将前述实施方式任一项所述融合蛋白或采用前述实施方式任一项所述制备方法制备得到的融合蛋白截断,得到甜味蛋白。
在可选的实施方式中,所述β-乳球蛋白片段和甜味蛋白片段之间通过linker连接,所述蛋白酶截断后的甜味蛋白中不含有来源于linker的氨基酸残基。
在可选的实施方式中,所述linker为肠激酶酶切位点,所述蛋白酶为肠激酶。
本发明中,发明人首次尝试将β-乳球蛋白作为引导蛋白应用于甜味蛋白表达系统的构建,依赖表达系统能够高产β-乳球蛋白的特性,同时实现甜味蛋白的高产。同时提供了β-乳球蛋白作为引导蛋白与甜味蛋白组成的融合蛋白,以及利用该融合蛋白进行甜味蛋白生产的方法。经验证,本发明成功制备了具有天然氨基酸序列的表现甜度活性的甜味蛋白,其产量在10g/L以上,从而在保证安全性的前提下,实现了具有甜度活性的甜味蛋白的高产和简易纯化。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为巴西甜蛋白结构示意图;
图2为pKLAC1质粒图谱;
图3为不同实施例和对比例发酵液样品的SDS-PAGE的电泳结果;
图4为实施例5中分离得到的重组蛋白的酶切前后蛋白的电泳结果对比。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。
术语“表达系统”,即“蛋白表达系统”,是指由宿主、外源基因和载体组成的体系。通过这个体系可以实现外源基因在宿主中表达的目的。表达系统一般由以下几个部分组成:
(1)宿主细胞:表达蛋白的生物体,可以为细菌、酵母、植物细胞、动物细胞等。由于各种生物的特性不同,适合表达蛋白的种类也不相同。
本发明适合选用的酵母包括任何下述各属酵母或其衍生、杂交后的变种:假丝酵母属(Candida)(例如,白色假丝酵母(Candida albicans)、埃切假丝酵母(Candidaetchellsii)、季也蒙假丝酵母(Candida guilliermondii)、扁平云假丝酵母(Candidahumilis)、解脂假丝酵母(Candida lipolytica)、拟平滑假丝酵母(Candidaorthopsilosis)、棕榈油假丝酵母(Candida palmioleophila)、假热带假丝酵母(Candidapseudotropicalis)、假丝酵母属物种、产朊假丝酵母(Candida utilis)、多变假丝酵母(Candida versatilis))、枝孢属(Cladosporium)、隐球酵母属(Cryptococcus)(例如,地生隐球酵母(Cryptococcus terricolus)、弯曲隐球酵母(Cryptococcuscurvatus))、德巴利酵母属(Debaryomyces)(例如,汉逊德巴利酵母(Debaryomyceshansenii))、内孢霉属(Endomyces)(例如,产脂内孢霉(Endomyces vernalis))、拟内孢霉属(Endomycopsis)(例如,产脂拟内孢霉(Endomycopsis vernalis))、假囊酵母属(Eremothecium)(例如,阿氏假囊酵母(Eremothecium ashbyii))、汉逊酵母属(Hansenula)(例如,汉逊酵母属物种、多形汉逊酵母(Hansenula polymorpha))、克鲁维酵母属(Kluyveromyces)(例如,克鲁维酵母属物种、乳酸克鲁维酵母(Kluyveromyces lactis)、马克斯克鲁维酵母乳酸变种(Kluyveromyces marxianus var.lactis)、马克斯克鲁维酵母(Kluyveromycesmarxianus)、耐热克鲁维酵母(Kluyveromyces thermotolerans))、油脂酵母属(Lipomyces)(例如,斯达氏油脂酵母(Lipomyces starkeyi)、产油油脂酵母(Lipomyecslipofer))、绪方酵母属(Ogataea)(例如,微小绪方酵母(Ogataea minuta))、毕赤酵母属(Pichia)(例如,毕赤酵母属物种、巴斯德毕赤酵母(Pichia pastoris)、芬兰毕赤酵母(Pichia finlandica)、喜海藻糖毕赤酵母(Pichia trehalophila)、科克拉马毕赤酵母(Pichia koclamae)、膜醭毕赤酵母(Pichia membranaefaciens)、微小毕赤酵母(Pichiaminuta)、林氏毕赤酵母(Pichia lindneri)、仙人掌毕赤酵母(Pichia opuntiae)、耐热毕赤酵母(Pichia thermotolerans)、柳毕赤酵母(Pichia salictaria)、松栎毕赤酵母(Pichia guercuum)、皮氏毕赤酵母(Pichia pijperi)、树干毕赤酵母(Pichiastiptis)、甲醇毕赤酵母(Pichia methanolica))、红冬孢酵母属(Rhodosporidium)(例如,圆红冬孢酵母(Rhodosporidium toruloides))、红酵母属(Rhodotorula)(例如,红酵母属物种、瘦弱红酵母(Rhodotorula gracilis)、粘红酵母(Rhodotorula glutinis)、禾本红酵母(Rhodotorula graminis))、酵母属(Saccharomyces)(例如,酵母属物种、贝酵母(Saccharomyces bayanus)、啤酒酵母(Saccharomyces beticus)、酿酒酵母(Saccharomyces cerevisiae)、薛瓦酵母(Saccharomyces chevalieri)、糖化酵母(Saccharomyces diastaticus)、葡萄酒酵母(Saccharomyces ellipsoideus)、少孢酵母(Saccharomyces exiguus)、弗罗棱糖酵母(Saccharomyces florentinus)、脆壁酵母(Saccharomyces fragilis)、巴斯德酵母(Saccharomyces pastorianus)、粟酒酵母(Saccharomyces pombe)、清酒酵母(Saccharomyces sake)、葡萄汁酵母(Saccharomycesuvarum))、掷孢酵母属(Sporobolomyces)(例如,粉红掷孢酵母(Sporobolomycesroseus))、锁掷酵母属(Sporidiobolus)(例如,约翰逊锁掷酵母(Sporidiobolusjohnsonii)、鲑色锁掷酵母(Sporidiobolus salmonicolor))、丝孢酵母属(Trichosporon)(例如,解可可脂丝孢酵母(Trichosporon cacaoliposimilis)、油脂丝孢酵母新种(Trichosporon oleaginosus sp.nov.)、解可可脂丝孢酵母新种(Trichosporoncacaoliposimilis sp.nov.)、纤弱丝孢酵母(Trichosporon gracile)、卫矛丝孢酵母(Trichosporon dulcitum)、吉氏丝孢酵母(Trichosporon jirovecii)、昆虫丝孢酵母(Trichosporon insectorum))、叶黄素酵母(Xanthophyllomyces(例如,树状叶黄素酵母(Xanthophyllomyces dendrorhous))、耶氏酵母属(Yarrowia(例如,解脂耶氏酵母(Yarrowia lipolytica))、和接合酵母(Zygosaccharomyces)(例如,鲁氏接合酵母(Zygosaccharomyces rouxii)。
其中常用的酵母表达系统为酿酒酵母(Saccharomycescerevisiae)表达系统和甲醇营养型酵母表达系统:
①酿酒酵母表达系统:酿酒酵母在酿酒业和面包业的使用已有数千年的历史,被认为是GRAS(generally recognized as safe)生物,不产生毒素,已被美国FDA确认为安全性生物,但酿酒酵母难于高密度培养,分泌效率低,几乎不分泌分子量大于30 kD的外源蛋白质,也不能使所表达的外源蛋白质正确糖基化,而且表达蛋白质的C端往往被截短。因此,一般不用酿酒酵母做重组蛋白质表达的宿主菌。
②甲醇营养型酵母表达系统:甲醇酵母表达系统是应用最广泛的酵母表达系统。甲醇酵母主要有汉森酵母属(Hansenula),毕赤酵母属(Pichia),球拟酵母属(Torulopsis)等,并以毕赤酵母属应用居多。甲醇酵母的表达载体为整合型质粒,载体中含有与酵母染色体中同源的序列,因而比较容易整合入酵母染色体中,大部分甲醇酵母的表达载体中都含有甲醇酵母醇氧化酶基因—1(AOX1),在该基因的启动子(PAOX1)作用下,外源基因得以表达。甲醇酵母一般先在含甘油的培养基中生长,培养至高浓度,再以甲醇为碳源,诱导表达外源蛋白,这样可以大大提高表达产量。利用甲醇酵母表达外源性蛋白质其产量往往可达克级,与酿酒酵母相比其翻译后的加工更接近哺乳动物细胞,不会发生超糖基化。
载体:是可复制的核酸,当载体转化入适当的宿主细胞时,可以从该载体表达一种或多种异源蛋白。其种类与宿主细胞相匹配。根据宿主不同,分为原核(细菌)表达载体、酵母表达载体、植物表达载体、哺乳动物表达载体、昆虫表达载体等。载体中含有外源基因片段。通过载体介导,外源基因可以在宿主中表达。本发明中使用的表达载体优选为pKLAC1,其图谱如图2所示。pKLAC1载体是一种既能在大肠杆菌中复制又能稳定整合到酵母Kluyveromyces lactis基因组中的表达载体,经验证该载体也能够成功整合到马克斯克鲁维酵母菌基因组中,实现外源蛋白的表达。
在某些表达系统构建过程中,还需要用到辅助成分,例如协助载体进入宿主的辅助成分,比如昆虫-杆状病毒表达体系中的杆状病毒,对此,本领域技术人员在选用具体表达系统时,能够根据实际需求,按照公知技术常识,对所需用的辅助成分进行常规选择,含有由此种选择而出的辅助成分的表达系统不能构成与本发明的实质性区别,应当理解为在本发明的保护范围内。
术语“引导蛋白”,功能类似于大分子“融合标签”,是指在外源表达过程中自身能够形成空间结构,进而通过与目的外源蛋白形成融合蛋白的形式,增加目的外源蛋白的溶解性,并配合信号肽,引导目的外源蛋白外泌,从而提高目的外源蛋白的表达量。本发明中适合使用的引导蛋白包括β-乳球蛋白、融合标签蛋白或其他在酵母中高表达的蛋白。
其中所述融合标签蛋白包括纯化标签蛋白和/或报告标签蛋白,所述纯化标签蛋白包括His标签(组氨酸标签)、GST标签(谷胱甘肽巯基转移酶标签)、MBP标签(麦芽糖结合蛋白标签)、FLAG标签(DYKDDDDKSEQ ID No:4)、Avi标签(具有一个单生物素化赖氨酸位点的短肽)、SUMO标签(小分子泛素样修饰蛋白)、Halo标签(脱卤素酶的遗传修饰衍生物)或SNAP标签(来源于O6-甲基鸟嘌呤-DNA甲基转移反应)。所述报告标签蛋白包括c-Myc标签(EQKLISEEDLSEQ ID No:5)、HA标签(YPYDVPDYASEQ ID No:6)或荧光素酶或荧光标签蛋白。
可行的引导蛋白和宿主细胞的选择组合包括:β-乳球蛋白和一种或多种马克斯克鲁维酵母菌,β-乳球蛋白和一种或多种乳酸克鲁维酵母菌,β-乳球蛋白和一种或多种毕赤酵母菌;His标签和一种或多种马克斯克鲁维酵母菌,His标签和一种或多种乳酸克鲁维酵母菌,His标签和一种或多种毕赤酵母菌;GST标签和一种或多种马克斯克鲁维酵母菌,GST标签和一种或多种乳酸克鲁维酵母菌,GST标签和一种或多种毕赤酵母菌;MBP标签和一种或多种马克斯克鲁维酵母菌,MBP标签和一种或多种乳酸克鲁维酵母菌,MBP标签和一种或多种毕赤酵母菌;FLAG标签和一种或多种马克斯克鲁维酵母菌,FLAG标签和一种或多种乳酸克鲁维酵母菌,FLAG标签和一种或多种毕赤酵母菌;Avi标签和一种或多种马克斯克鲁维酵母菌,Avi标签和一种或多种乳酸克鲁维酵母菌,Avi标签和一种或多种毕赤酵母菌;SUMO标签和一种或多种马克斯克鲁维酵母菌,SUMO标签和一种或多种乳酸克鲁维酵母菌,SUMO标签和一种或多种毕赤酵母菌;Halo标签和一种或多种马克斯克鲁维酵母菌,Halo标签和一种或多种乳酸克鲁维酵母菌,Halo标签和一种或多种毕赤酵母菌;SNAP标签和一种或多种马克斯克鲁维酵母菌,SNAP标签和一种或多种乳酸克鲁维酵母菌,SNAP标签和一种或多种毕赤酵母菌;c-Myc标签和一种或多种马克斯克鲁维酵母菌,c-Myc标签和一种或多种乳酸克鲁维酵母菌,c-Myc标签和一种或多种毕赤酵母菌;HA标签和一种或多种马克斯克鲁维酵母菌,HA标签和一种或多种乳酸克鲁维酵母菌,HA标签和一种或多种毕赤酵母菌;荧光素酶和一种或多种马克斯克鲁维酵母菌,荧光素酶和一种或多种乳酸克鲁维酵母菌,荧光素酶和一种或多种毕赤酵母菌;荧光标签蛋白和一种或多种马克斯克鲁维酵母菌,荧光标签蛋白和一种或多种乳酸克鲁维酵母菌,荧光标签蛋白和一种或多种毕赤酵母菌。
在可选地实施方式中,宿主细胞可以为马克斯克鲁维酵母菌,引导蛋白为β-乳球蛋白。经发明人尝试,申请人自行保藏的马克斯克鲁维酵母菌均能够满足本发明的需求,用于构建以β-乳球蛋白为引导蛋白的甜味蛋白表达系统,实现融合蛋白的表达,并且不需要甘油培养基富集和甲醇诱导表达,培养及放大规模难度低。
术语序列“同源性”具有本领域公认的含义,并且可以利用公开的技术计算两个核酸或多肽或区域之间序列相同性的百分比。可以沿着多核苷酸或多肽的全长或者沿着该分子的区域测量序列相同性。
术语“密码子优化”是指用于转化各种宿主的核酸分子的基因或编码区,是指核酸分子的基因或编码区中反映宿主生物的典型密码子使用而不改变DNA编码的多肽的密码子改变。此类优化包括用该生物基因中使用频率更高的一个或多个密码子来替代至少一个或多于一个或大量密码子。通过利用关于每种生物中密码子使用或密码子偏好的知识,本领域的普通技术人员可以将这些频率适用于任何给定的多肽序列,并产生编码该多肽,但是使用给定物种的最佳密码子的密码子优化编码区的核酸片段。密码子优化编码区可以通过本领域技术人员已知的各种方法来设计。
术语“表达”指通过多核苷酸的转录和翻译产生多肽的过程。多肽的表达水平可以利用本领域已知的任何方法来评价,包括例如测定从宿主细胞产生的多肽的量的方法。这类方法可以包括但不限于通过ELISA定量细胞裂解物中的多肽,凝胶电泳之后考马斯蓝染色,Lowry蛋白测定以及Bradford蛋白测定。
在具体实施方式中,第一方面,本发明提供了β-乳球蛋白作为引导蛋白在甜味蛋白表达系统构建中的应用。
在可选的实施方式中,所述表达系统的原始菌株为马克斯克鲁维酵母。
在可选的实施方式中,所述表达系统的原始菌株选自以下任一保藏编号的马克斯克鲁维酵母菌株:CCTCC No:M20211265、CCTCC No:M20211601、CCTCC No:M20211602、CCTCCNo:M20211603、CCTCC No:M20211604、CCTCC No:M20211605、CCTCC No:M20211606、CCTCCNo:M20211607、CCTCC No:M20211608、CCTCC No:M20211609或CCTCC No:M20211610。
在可选的实施方式中,所述甜味蛋白为巴西甜蛋白。
所述巴西甜蛋白相比于其他甜味蛋白分子量小很多,本发明将β-乳球蛋白片段和巴西甜蛋白以融合蛋白的形式外泌表达,增大了发酵产物的分子量,除了提高巴西甜蛋白表达量,还进一步有利于发酵产物的分离纯化。
在可选的实施方式中,所述β-乳球蛋白的氨基酸序列如SEQ ID No:1所示或与其同源性在80%以上的衍生序列,同源性比例包括但不限于80%、85%、90%、95%或100%;所述巴西甜蛋白的氨基酸序列如SEQ ID No:2所示或与其同源性在80%以上的衍生序列,同源性比例包括但不限于80%、85%、90%、95%或100%。需要说明的是,本发明所述的满足同源性比例的衍生序列对应的β-乳球蛋白和巴西甜蛋白仍然保持着SEQ ID No:1和SEQ ID No:2所对应的β-乳球蛋白和巴西甜蛋白相当的活性。
所述SEQ ID No:1的氨基酸序列为LIVTQTMKGLDIQKVAGTWYSLAMAASDISLLDAQS APLREEVEELKPTPEGDLEILLQKWENGECAQKKIIAEKTKIPAVFKIDALNENKVLVLDTDYKKYLLFCMENSAEPEQSLACQCLVRTPEVDDEALEKFDKALKAPVMHIRLSFNPTQLEEQCHI。
所述SEQ ID No:2的氨基酸序列为MDKCKKVYENYPVSKCQLANQCNYDCKLDKHARSGECFYDEKRNLQCICDYCEY。
第二方面,本发明提供了一种融合蛋白,所述融合蛋白包括β-乳球蛋白片段和甜味蛋白片段。
在可选的实施方式中,所述β-乳球蛋白片段和甜味蛋白片段之间通过linker连接。
在可选的实施方式中,所述linker为肠激酶酶切位点。
作为融合蛋白重组不可或缺的组成部分,Linker在构建稳定、具有生物活性的融合蛋白中发挥着重要的作用。Linker为两个融合蛋白间起连接作用的氨基酸链,具有一定的柔性以允许两侧的蛋白完成各自独立的功能。蛋白Linker通常分为3种,分别为FlexibleLinker(柔性Linker)、Rigid Linker(刚性Linker)和Cleavable Linker(可剪切Linker)。本领域技术人员有能力根据实际需求进行常规选择可剪切linker,用于本发明连接β-乳球蛋白片段和甜味蛋白。但是需要说明的是,由于甜味蛋白食用安全性的考虑,本发明中使用的linker在后续截断制备甜味蛋白的过程中,需要全部去除。最理想的状态是,在后续使用蛋白酶对融合蛋白进行截断时,能恰好将linker和甜味蛋白分开,而实际操作过程中,很难保证精确切除,因此,考虑到甜味蛋白食用安全性的问题,在本发明中应当选择在后续蛋白酶截断步骤中,蛋白酶能够精准识别切割,或者总是以倾向于向下游过多切割的方式来截断linker和甜味蛋白,从而保证得到的甜味蛋白中不会引入linker的末端氨基酸残基。
在可选的实施方式中,所述甜味蛋白为巴西甜蛋白。
在可选的实施方式中,所述β-乳球蛋白的氨基酸序列如SEQ ID No:1所示或与其同源性在80%以上的衍生序列,同源性比例包括但不限于80%、85%、90%、95%或100%;所述巴西甜蛋白的氨基酸序列如SEQ ID No:2所示或与其同源性在80%以上的衍生序列,同源性比例包括但不限于80%、85%、90%、95%或100%。所述肠激酶酶切位点的氨基酸序列如SEQ IDNo:3所示。需要说明的是,本发明所述的满足同源性比例的衍生序列对应的β-乳球蛋白和巴西甜蛋白仍然保持着SEQ ID No:1和SEQ ID No:2所对应的β-乳球蛋白和巴西甜蛋白相当的活性。
第三方面,以下(a)~(c)中任一种生物材料:
(a)编码前述实施方式任一项所述融合蛋白的核酸分子,或其经密码子优化后的衍生序列;
(b)装载有(a)所述核酸分子的表达载体,所述表达载体为质粒表达载体,所述质粒表达载体的原始质粒选自pKLAC1或pKLAC2;
(c)马克斯克鲁维酵母表达系统,含有(a)所述核酸分子或(b)所述表达载体。
在可选的实施方式中,所述马克斯克鲁维酵母选自以下任一保藏编号的马克斯克鲁维酵母菌株:CCTCC No:M20211265、CCTCC No:M20211601、CCTCC No:M20211602、CCTCCNo:M20211603、CCTCC No:M20211604、CCTCC No:M20211605、CCTCC No:M20211606、CCTCCNo:M20211607、CCTCC No:M20211608、CCTCC No:M20211609或CCTCC No:M20211610。
第四方面,本发明提供了前述实施方式任一项所述融合蛋白的制备方法,所述制备方法为,发酵培养前述实施方式任一项所述的马克斯克鲁维酵母表达系统,从发酵液中分离回收融合蛋白。
在可选的实施方式中,所述发酵培养包括菌体富集阶段和诱导表达阶段,通过向培养基中添加半乳糖实现融合蛋白的诱导表达。
第五方面,本发明提供了前述实施方式任一项所述融合蛋白或采用前述实施方式任一项所述制备方法制备得到的融合蛋白在制备甜味蛋白中的应用。
第六方面,本发明提供了甜味蛋白的制备方法,所述制备方法包括,使用蛋白酶将前述实施方式任一项所述融合蛋白或采用前述实施方式任一项所述制备方法制备得到的融合蛋白截断,得到甜味蛋白。
在可选的实施方式中,所述β-乳球蛋白片段和甜味蛋白片段之间通过linker连接,所述蛋白酶截断后的甜味蛋白中不含有来源于linker的氨基酸残基。
在可选的实施方式中,所述β-乳球蛋白片段和甜味蛋白片段之间通过肠激酶酶切位点连接,所述蛋白酶为肠激酶,所述肠激酶酶切位点例如为DDDDK(SEQ ID No:3)。
下面结合附图,对本发明的一些实施方式作详细说明。在不冲突的情况下,下述的实施例及实施例中的特征可以相互组合。
本申请使用的菌株包括:
(1)马克斯克鲁维酵母(K. marxianus)CJA0001,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211601,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianusCJA0001。
(2)马克斯克鲁维酵母(K. marxianus)CJA0002,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211602,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJA0002。
(3)马克斯克鲁维酵母(K. marxianus)CJA0003,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211603,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJA0003。
(4)马克斯克鲁维酵母(K. marxianus)CJA0004,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211604,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJA0004。
(5)马克斯克鲁维酵母(K. marxianus)CJA0005,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211605,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJA0005。
(6)马克斯克鲁维酵母(K. marxianus)CJA0006,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211606,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJA0006。
(7)马克斯克鲁维酵母(K. marxianus)CJA0007,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211607,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJA0007。
(8)马克斯克鲁维酵母(K. marxianus)CJA0008,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211608,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJA0008。
(9)马克斯克鲁维酵母(K. marxianus)CJA0009,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211609,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJA0009。
(10)马克斯克鲁维酵母(K. marxianus)CJA0010,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211610,保藏日期为2021年12月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJA0010。
(11)马克斯克鲁维酵母(K. marxianus)CJ3113,保藏于中国典型培养物保藏中心,保藏编号为CCTCC No:M20211265,保藏日期为2021年10月13日,保藏地址为中国武汉市武汉大学,分类命名为Kluyveromyces marxianus CJ3113。
实施例1 K. marxianus整合表达巴西甜蛋白
本实施例采用马克斯克鲁维酵母(K. marxianus)CJ3113(中国典型培养物保藏中心,CCTCC No:M20211265)表达甜味蛋白步骤如下:
1:在金斯瑞合成了巴西甜蛋白基因片段,命名为bra。以bra为模板,通过PCR扩增(上游引物F11:5'-GAAAAGAGAGGCTGAAGCTGACAAGTGTAAGAAGGTCTACG-3'(SEQ ID No:7),下游引物R11:5'-ACGGTACCCCTAGGAGATCTCAGTATTCACAGTAGTCACAGATAC -3'(SEQ ID No:8)获得目标基因bra;通过PCR引物(上游引物F12:5'-GATCTCCTAGGGGTACCG-3'SEQ ID No:9,R12:5'-AGCTTCAGCCTCTCTTTTCTC-3'SEQ ID No:10)扩增商业化载体pKLAC1。将目标基因通过无缝组装的方式与商品化pKLAC1载体连接获得表达载体pKLAC1-bra。
2:使用快速内切酶Sac Ⅱ(纽英伦生物技术(北京)有限公司,货号#R0157L)酶切质粒pKLAC1-bra,获得线性化pKLAC1-bra的同源重组片段,纯化后得到的片段浓度>1 μg,采用电转(0.1 cm电转杯,1.5~2.5 kV电压,时间选择为~5 ms)方法将线性化pKLAC1-bra转化马克斯克鲁维酵母CJ3113(保藏号CCTCC No:M20211265)构建K. marxianus::pKLAC1-bra表达菌株,同时构建对照菌株K. marxianus::pKLAC1。在含碳源、氮源及盐类的培养基(4.5%葡萄糖、0.2%糖蜜、0.2%玉米浆干粉、0.05%硫酸镁、0.5%硫酸铵、0.8%酵母提取物、0.6%磷酸二氢钾、10 ppm硫酸铜,5 ppm硫酸亚铁,15 ppm硫酸锰,7 ppm氯化钴,2 ppm硫酸锌、3 ppm蛋氨酸、1 ppm丙氨酸、6 ppm半胱氨酸、3 ppm甘氨酸)中分别培养上述表达菌株和对照菌株;调控培养基pH为5.5~6.5,经30℃发酵72 h,过程流加半乳糖诱导蛋白表达,分别于0h、12h、24h、36h、48h和60h取发酵液。
3:12000 g分别离心各发酵液,收集上清,根据目的蛋白大小,选择15%的分离胶浓度,使用SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒(C631100)进行配制(生工生物工程(上海)股份有限公司),详细的配方见附页的说明书。取10 μL上清样品于离心管中,加入2μL 5×蛋白上样缓冲液,混匀后沸水加热10 min,使蛋白样品变性。每个胶孔加样品10 μL,Maker 5 μL,电泳电压为恒压110 V,时间80~90 min。电泳结束后,对蛋白胶染色和脱色,SDS-PAGE胶如图3所示,其中M泳道为marker,WT泳道为原始质粒pKLAC1,BA泳道为插入β-乳球蛋白基因的重组质粒,BA-SW(+肠激酶位点)为插入β-乳球蛋白-肠激酶酶切位点-巴西甜蛋白融合蛋白基因的重组质粒,BA-LF(+肠激酶位点)为插入β-乳球蛋白-肠激酶酶切位点-乳铁蛋白肽融合蛋白基因的重组质粒,BA-SW为插入β-乳球蛋白-巴西甜蛋白融合蛋白基因的重组质粒,BA-LF为插入β-乳球蛋白-乳铁蛋白肽融合蛋白基因的重组质粒,SW为插入巴西甜蛋白基因的重组质粒。由图3的SW泳道可以看出,直接插入巴西甜蛋白基因构建重组质粒,而后转入马克斯克鲁维酵母进行发酵培养,结果未明显见到甜味蛋白的表达。
实施例2:β-Lg作为融合标签表达巴西甜蛋白
1:以β-乳球蛋白基因片段(Gene ID: 113901792)为模板,通过PCR扩增(上游引物F21:5'-GAAAAGAGAGGCTGAAGCTTTGATCGTTACCCAAACTATGAAG-3'SEQ ID No:11,下游引物R21:5'-AATGTGACATTGTTCTTCCAATTG -3'SEQ ID No:12)获得目标基因β-Lg。以bra为模板,通过PCR扩增(上游引物F22:5'-GGAAGAACAATGTCACATTGACAAGTGTAAGAAGGTCTACG-3'SEQ IDNo:13,下游引物R22:5'-ACGGTACCCCTAGGAGATCTCAGTATTCACAGTAGTCACAGATAC-3'SEQ IDNo:8)获得目标基因bra;通过PCR引物(上游引物F23:5'-GATCTCCTAGGGGTACCG-3'SEQ IDNo:9,R23:5'- AGCTTCAGCCTCTCTTTTCTC-3'SEQ ID No:10)扩增商业化载体pKLAC1。将目标基因β-Lg,bra通过无缝组装的方式与商品化pKLAC1载体连接获得表达载体pKLAC1-Lg-bra1。
2:使用快速内切酶Sac Ⅱ(纽英伦生物技术(北京)有限公司,货号#R0157L)酶切质粒pKLAC1-Lg-bra1,获得线性化pKLAC1-Lg-bra1的同源重组片段,纯化后得到的片段浓度>1 μg,采用电转(0.1 cm电转杯,1.5~2.5 kV电压,时间选择为~5 ms)方法将线性化pKLAC1-bra1转化马克斯克鲁维酵母CJ3113(保藏号CCTCC No:M20211265)构建K.marxianus:: pKLAC1-Lg-bra1表达菌株,同时构建对照菌株K. marxianus::pKLAC1。在含碳源、氮源及盐类的培养基(4.5%葡萄糖、0.2%糖蜜、0.2%玉米浆干粉、0.05%硫酸镁、0.5%硫酸铵、0.8%酵母提取物、0.6%磷酸二氢钾、10 ppm硫酸铜,5 ppm硫酸亚铁,15 ppm硫酸锰,7 ppm氯化钴,2 ppm硫酸锌、3 ppm蛋氨酸、1 ppm丙氨酸、6 ppm半胱氨酸、3 ppm甘氨酸)中分别培养上述表达菌株和对照菌株;调控培养基pH为5.5~6.5,经30℃发酵72h,过程流加半乳糖诱导蛋白表达。分别于0h、12h、24h、36h、48h和60h取发酵液。
3:12000 g分别离心各发酵液,收集上清,根据目的蛋白大小,选择15%的分离胶浓度,使用SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒(C631100)进行配制(生工生物工程(上海)股份有限公司),详细的配方见附页的说明书。取10 μL上清样品于离心管中,加入2μL 5×蛋白上样缓冲液,混匀后沸水加热10 min,使蛋白样品变性。每个胶孔加样品10 μL,Maker 5 μL,电泳电压为恒压110 V,时间80~90 min。电泳结束后,对蛋白胶染色和脱色。SDS-PAGE胶如图3中的BA-SW泳道所示,可以看出,将β-乳球蛋白与巴西甜蛋白融合后,实现了融合蛋白的表达。
实施例3:β-Lg作为融合标签表达巴西甜蛋白,加linker
1:以β-乳球蛋白基因片段(Gene ID: 113901792)为模板,通过PCR扩增(上游引物F31:5'-GAAAAGAGAGGCTGAAGCTTTGATCGTTACCCAAACTATGAAG-3'SEQ ID No:11,下游引物R31:5'-AATGTGACATTGTTCTTCCAATTGAG-3'SEQ ID No:14)获得目标基因β-Lg。以P2A肽为模板,通过PCR扩增(上游引物F32:5'-GGAAGAACAATGTCACATTGGATCCGGAGCCACGAAC-3'SEQ IDNo:15,下游引物R32:5'-GACCTTCTTACACTTGTCAGGACCGGGGTTTTCTTCC-3'SEQ ID No:16)扩增P2A肽基因序列。以bra为模板,通过PCR扩增(上游引物F33:5'-GACAAGTGTAAGAAGGTCTACG-3'SEQ ID No:17,下游引物R33:5'-ACGGTACCCCTAGGAGATCTCAGTATTCACAGTAGTCACAGATAC-3'SEQ ID No:8)扩增bra序列。通过PCR引物(上游引物F34:5'-GATCTCCTAGGGGTACCG-3'SEQ ID No:9,R34:5'-AGCTTCAGCCTCTCTTTTCTC-3'SEQ ID No:10)扩增商业化载体pKLAC1。将β-Lg基因序列、P2A肽基因序列和bra基因序列通过无缝组装的方式与商品化pKLAC1载体连接获得表达载体pKLAC1-Lg-P2A-bra2。
2:使用快速内切酶Sac Ⅱ(纽英伦生物技术(北京)有限公司,货号#R0157L)酶切质粒pKLAC1-Lg-P2A-bra2,获得线性化pKLAC1-Lg-P2A-bra2的同源重组片段,纯化后得到的片段浓度>1 μg,采用电转(0.1 cm电转杯,1.5~2.5 kV电压,时间选择为~5 ms)方法将线性化pKLAC1-Lg-P2A-bra转化马克斯克鲁维酵母CJ3113(保藏号CCTCC No:M20211265)构建K. marxianus:: pKLAC1-Lg-P2A-bra2表达菌株,同时构建对照菌株K. marxianus::pKLAC1。在含碳源、氮源及盐类的培养基(4.5%葡萄糖、0.2%糖蜜、0.2%玉米浆干粉、0.05%硫酸镁、0.5%硫酸铵、0.8%酵母提取物、0.6%磷酸二氢钾、10 ppm硫酸铜,5 ppm硫酸亚铁,15 ppm硫酸锰,7 ppm氯化钴,2 ppm硫酸锌、3 ppm蛋氨酸、1 ppm丙氨酸、6 ppm半胱氨酸、3 ppm甘氨酸)中分别培养上述表达菌株和对照菌株;调控培养基pH为5.5~6.5,经30℃发酵72 h,过程流加半乳糖诱导蛋白表达。分别于0h、12h、24h、36h、48h和60h取发酵液。
3:12000 g分别离心各发酵液,收集上清,根据目的蛋白大小,选择15%的分离胶浓度,使用SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒(C631100)进行配制(生工生物工程(上海)股份有限公司),详细的配方见附页的说明书。取10 μL上清样品于离心管中,加入2μL 5×蛋白上样缓冲液,混匀后沸水加热10 min,使蛋白样品变性。每个胶孔加样品10 μL,Maker 5 μL,电泳电压为恒压110 V,时间80~90 min。分离出β-乳球蛋白片段和巴西甜蛋白片段,但是得到的巴西甜蛋白经过味觉评价验证,并没有甜味。
实施例4:β-Lg作为融合标签表达巴西甜蛋白,加肠激酶位点
1:以β-乳球蛋白基因片段(Gene ID: 113901792)为模板,通过PCR扩增(上游引物F41:5'- GAAAAGAGAGGCTGAAGCTTTGATCGTTACCCAAACTATGAAG -3'SEQ ID No:11,下游引物R41:5'- TTTATCGTCATCATCAATGTGACATTGTTCTTCCAATTG-3'SEQ ID No:18)获得目标基因β-Lg,肠激酶序列在引物同源臂中添加,以bra为模板,通过PCR扩增(上游引物F42:5'- ATTGATGATGACGATAAAGACAAGTGTAAGAAGGTCTAC -3'SEQ ID No:19,下游引物R42:5'-ACGGTACCCCTAGGAGATCTCAGTATTCACAGTAGTCACAGATAC -3'SEQ ID No:8)扩增bra序列;通过PCR引物(上游引物F43:5'-GATCTCCTAGGGGTACCG-3'SEQ ID No:9,R43:5'-AGCTTCAGCCTCTCTTTTCTC-3'SEQ ID No:10)扩增商业化载体pKLAC1。将目标基因β-Lg,bra通过无缝组装的方式与商品化pKLAC1载体连接获得表达载体pKLAC1-Lg-肠激酶酶切位点-bra3。
2:使用快速内切酶Sac Ⅱ(纽英伦生物技术(北京)有限公司,货号#R0157L)酶切质粒pKLAC1-Lg-肠激酶酶切位点-bra3,获得线性化pKLAC1-Lg-bra3的同源重组片段,纯化后得到的片段浓度>1 μg,采用电转(0.1 cm电转杯,1.5~2.5 kV电压,时间选择为~5 ms)方法将线性化pKLAC1-Lg-肠激酶酶切位点-bra转化马克斯克鲁维酵母CJ3113(保藏号CCTCC No:M20211265)构建K. marxianus:: pKLAC1-Lg-Lg-肠激酶酶切位点-bra1表达菌株,同时构建对照菌株K. marxianus::pKLAC1。在含碳源、氮源及盐类的培养基(4.5%葡萄糖、0.2%糖蜜、0.2%玉米浆干粉、0.05%硫酸镁、0.5%硫酸铵、0.8%酵母提取物、0.6%磷酸二氢钾、10 ppm硫酸铜,5 ppm硫酸亚铁,15 ppm硫酸锰,7 ppm氯化钴,2 ppm硫酸锌、3ppm蛋氨酸、1 ppm丙氨酸、6 ppm半胱氨酸、3 ppm甘氨酸)中分别培养上述表达菌株和对照菌株;调控培养基pH为5.5~6.5,经30℃发酵72 h,过程流加半乳糖诱导蛋白表达。分别于0h、12h、24h、36h、48h和60h取发酵液。
3:12000 g分别离心各发酵液,收集上清,根据目的蛋白大小,选择15%的分离胶浓度,使用SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒(C631100)进行配制(生工生物工程(上海)股份有限公司),详细的配方见附页的说明书。取10 μL上清样品于离心管中,加入2μL 5×蛋白上样缓冲液,混匀后沸水加热10 min,使蛋白样品变性。每个胶孔加样品10 μL,Maker 5 μL,电泳电压为恒压110 V,时间80~90 min。电泳结束后,对蛋白胶染色和脱色。SDS-PAGE胶如图3的BA-SW(+肠激酶位点)泳道所示,可以看出,β-乳球蛋白融合甜味蛋白加入肠激酶位点与单纯β-乳球蛋白融合甜味蛋白表达效果相当。
实施例5:K. marxianus表达的巴西甜蛋白,经85℃,30min处理后,甜味稳定
1:以β-乳球蛋白基因片段(Gene ID: 113901792)为模板,通过PCR扩增(上游引物F51:5'- GAAAAGAGAGGCTGAAGCTTTGATCGTTACCCAAACTATGAAG-3'SEQ ID No:11,下游引物R51:5'-TTTATCGTCATCATCAATGTGACATTGTTCTTCCAATTG-3'SEQ ID No:18)获得目标基因β-Lg,肠激酶序列在引物同源臂中添加,以bra为模板,通过PCR扩增(上游引物F52:5'-ATTGATGATGACGATAAAGACAAGTGTAAGAAGGTCTAC-3'SEQ ID No:19,下游引物R52:5'-ACGGTACCCCTAGGAGATCTCAGTATTCACAGTAGTCACAGATAC-3'SEQ ID No:8)扩增bra序列;通过PCR引物(上游引物F53:5'-GATCTCCTAGGGGTACCG-3'SEQ ID No:9,R53:5'-AGCTTCAGCCTCTCTTTTCTC-3'SEQ ID No:10)扩增商业化载体pKLAC1。将目标基因β-Lg,bra通过无缝组装的方式与商品化pKLAC1载体连接获得表达载体pKLAC1-Lg-bra3。
2:使用快速内切酶Sac Ⅱ(纽英伦生物技术(北京)有限公司,货号#R0157L)酶切质粒pKLAC1-Lg-bra3,获得线性化pKLAC1-Lg-bra3的同源重组片段,纯化后得到的片段浓度>1 μg,采用电转(0.1 cm电转杯,1.5~2.5 kV电压,时间选择为~5 ms)方法将线性化pKLAC1-bra转化马克斯克鲁维酵母CJ3113(保藏号CCTCC No:M20211265)构建K.marxianus:: pKLAC1-Lg-bra3表达菌株,同时构建对照菌株K. marxianus::pKLAC1。在含碳源、氮源及盐类的培养基(4.5%葡萄糖、0.2%糖蜜、0.2%玉米浆干粉、0.05%硫酸镁、0.5%硫酸铵、0.8%酵母提取物、0.6%磷酸二氢钾、10 ppm硫酸铜,5 ppm硫酸亚铁,15 ppm硫酸锰,7 ppm氯化钴,2 ppm硫酸锌、3 ppm蛋氨酸、1 ppm丙氨酸、6 ppm半胱氨酸、3 ppm甘氨酸)中分别培养上述表达菌株和对照菌株;调控培养基pH为5.5~6.5,经30℃发酵72 h,过程流加半乳糖诱导蛋白表达。分别于0h、12h、24h、36h、48h和60h取发酵液。
3:12000 g分别离心各发酵液,收集上清,根据目的蛋白大小,选择15%的分离胶浓度,使用SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒(C631100)进行配制(生工生物工程(上海)股份有限公司),详细的配方见附页的说明书。取10 μL上清样品于离心管中,加入2μL 5×蛋白上样缓冲液,混匀后沸水加热10 min,使蛋白样品变性。每个胶孔加样品10 μL,Maker 5 μL,电泳电压为恒压110 V,时间80~90 min。电泳结束后,对蛋白胶染色和脱色。
4:将发酵液上清通过AKTA脱盐柱进行初步纯化,纯化步骤如下。a:Hitrap CaptoQ阴离子交换层析分离纯化重组巴西甜蛋白。
取发酵液上清10 mL,12000 rpm/min离心5 min,取上清液,用NaOH调节pH至7.5/8.5,用0.45 μm无菌针式过滤器过滤。
AKTA Pure 150上机检测,用超纯水冲洗整个流路5个柱体积,流速为5 mL/min;用缓冲液A平衡5个柱体积,流速为5 mL/min;上样前用缓冲液A清洗loop环,上样流速为3 mL/min;用分别含100、200、300、400、500 mM NaCl的缓冲液进行阶段洗脱,流速为5 mL/min,收集各阶段洗脱峰,用SDS-PAGE检测融合蛋白的分子量大小和纯度;用超纯水流洗5个柱体积,再用20%的乙醇流洗5个柱体积,流速为5 mL/min。优化后使用Hitrap Capto Q 5 mL强阴离子交换层析柱纯化重组蛋白的上样量为2 mL,用分别含100~600 mM NaCl的缓冲液进行洗脱,其中,300 mM NaCl洗脱得到重组巴西甜蛋白。
5:肠激酶酶切与鉴定
使用从碧云天购买的肠激酶,对纯化后的融合蛋白进行酶切,重组肠激酶的氨基酸序列如下:IVGGSDSREGAWPWVVALYFDDQQVCGASLVSRDWLVSA AHCVYGRNMEPSKWKAVLGLHMASNLTSPQIETRLIDQIVINPHYNKRRKNNDIAMMHLEMKVNYTDYIQPICLPEENQVFPPGRICSIAGWGALIYQGSTADVLQEADVPLLSNEKCQQQMPEYNITENMVCAGYEAGGVDSCQGDSGGPLMCQENNRWLLAGVTSFGYQCALPNRPGVYARVPRFTEWIQSFLH(SEQ ID No:20)。
酶切体系为25mM Tris-HCl (pH8.0)体系中,融合蛋白浓度0.1~1mg/ml (蛋白总量50~100µg),重组EK 0.1~0.2U。25℃酶切过夜或16~24h,4℃条件下也可对底物进行有效酶切,但需要将酶切时间延长至48~64h,或增加2~3倍酶量。
根据实际情况优化:将约5 g/L的纯化样品取1 ml 稀释10倍于25mM Tris-HCl后,加入2μl(约20U)肠激酶进行酶切,酶切温度选择4℃,防止非特异性酶切出现,抑制微生物生长。
酶切20 h后,取适量进行SDS-PAGE检测其酶切效果,结果如图4所示,其中P为100mg/L乳球蛋白标品,由于酶切体系中样品稀释了10倍,因此将酶切前样品也稀释10倍,上样量与酶切后样品一致。由于酶切体系稀释了10倍,本发明将纯化后的初始样品稀释10倍后,以相同的上样量与酶切后样品进行对比。
结果显示,大部分融合蛋白都被酶切(重组肠激酶大小与融合蛋白大小接近不易区分,但浓度极低,约1mg /L基本检测不到,不需要考虑),考虑到后续还有透析步骤也会继续酶切融合蛋白,并且SDS-PAGE检测的时间肠激酶仍会继续切割(后续检测巴西甜的热稳定性后,可将样品热处理使肠激酶失活停止切割防止非特异性切割),因此本发明直接用此样品进行后续透析处理。
6:透析与后处理
针对巴西甜蛋白的分子量(约6.4 kDa),本发明选择3.5~5 kDa的透析袋,用纯水在冰水浴中,对样品进行透析除去样品中的Tris-HCl和其他可能存在的杂质。
透析换水3次以上,全程在冰水浴中进行防止肠激酶的非特异性酶切,透析完成后,初步品尝,发现纯化后的样品有甜味,并且本发明将未酶切的原液稀释到相同倍数后品尝,无甜味。
结果表明,经过酶切的融合蛋白具有甜味。
分别取部分酶切透析后的溶液,置于4℃、-20℃和-80℃过夜后,其甜度没有显著差异,将其混合后冻干,以等体积纯净水复溶,过0.45μm过滤器除菌后,梯度稀释2、4、8、16、32、64倍,将原液和稀释后的溶液以稀释倍数2n的n分别编号为0、1、2、3、4、5、6。取部分原液85℃水浴30 min,作为加热处理的样品,检测巴西甜蛋白的热稳定性。
7:甜味及热稳定性的感官评价及分析
将梯度稀释的样品0~6和加热处理后的样品,参考文献报道(甜味蛋白Monellin基因的合成[D]、功能分析及对桑树的遗传转化研究,金筱耘,西南大学,博士,2012)的感官评价方法,以1%蔗糖溶液作为对照,以用于溶解和稀释的纯净水作为空白对照,找7人(3男4女)进行感官评价。
其中,是否感受到甜味表示在与等体积纯净水比较时是否能主管感受到甜味;是否较对照更甜表示在与等体积1%蔗糖溶液对照时是否更甜;处理和0号对照用于验证相同样品在热处理前后甜度是否有显著差异,用于验证巴西甜蛋白的热稳定性,感官评价的结果统计见下表。
表2 甜味感官评价结果
以上结果表明,本发明在马克斯克鲁维酵母中表达的β-乳球蛋白乳球-肠激酶酶切位点-巴西甜融合蛋白经过肠激酶酶切后,具有甜味,且具有较好的热稳定性,85℃30min未减少其甜味。其甜味阈值约为5 mg/L(蔗糖为10g/L),甜度约为相同质量蔗糖的528倍以上,约为相同摩尔数蔗糖的10000倍以上。
实施例6 乳酸克鲁维酵母表达巴西甜蛋白
采用与实施例4相同的表达系统方法,将马克斯克鲁维酵母CJ3113(保藏号CCTCCNo:M20211265)替换为乳酸克鲁维酵母构建巴西甜蛋白表达菌株,采用与实施例4相同的发酵方法得到重组巴西甜蛋白,而后采用实施例5中的步骤5:肠激酶酶切并透析后,得到具有甜味的巴西甜蛋白,产量与马克斯克鲁维发酵产量相当。
实施例7 毕赤酵母发酵表达巴西甜蛋白
采用与实施例4相同的表达系统方法,将马克斯克鲁维酵母CJ3113(保藏号CCTCCNo:M20211265)替换为毕赤酵母GS115构建巴西甜蛋白表达菌株,采用与实施例4相同的发酵方法得到重组巴西甜蛋白,而后采用实施例5中的步骤5:肠激酶酶切并透析后,得到具有甜味的巴西甜蛋白,产量与马克斯克鲁维发酵产量相当。
对比例1β-Lg作为融合标签表达乳铁蛋白肽
参考上述实施例2和实施例4的方法,分别构建用以表达乳铁蛋白肽的pKLAC1-Lg-LF重组质粒和pKLAC1-Lg-肠激酶酶切位点-LF重组质粒,所述乳铁蛋白肽的氨基酸序列为FKCRR WQWRMKKLGA PSITCVRRAF(SEQ ID No:21),实验结果如图3所示,添加肠激酶酶切位点前后均未见到明显的乳铁蛋白肽,证明在马克斯克鲁维表达系统中,将β-乳球蛋白作为引导蛋白用于提高蛋白表达量的方法对于目的蛋白具有一定的选择性。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 美容仪及其制冷功率控制电路
- 功率控制方法、控制电路和射频美容仪
