新颖化合物及包含其的有机发光器件
文献发布时间:2023-06-19 10:10:17
本申请是申请日为2015年12月29日、申请号为“201580071738.X”、发明名称为“新颖化合物及包含其的有机发光器件”的中国专利申请的分案申请,原申请是国际申请PCT/KR2015/014444的中国国家阶段申请。
技术领域
本发明涉及新颖化合物及包含其的有机发光器件。并且,本发明涉及将上述新颖化合物和咔唑衍生物作为主体一起使用,从而可适当地调节激基复合物波长,且极大化效率及寿命的有机发光器件。
背景技术
最近,能够以自发光型进行低电压驱动的有机发光器件与作为平板显示器件的主流的液晶显示器(LCD,liquid crystal display)相比,视角、对照比等优秀,且不需要背光源,从而可实现轻量化及薄型化,在耗电方面上也有利,且色彩再现范围广,从而作为下一代显示器件备受瞩目。
在有机发光器件中,用作有机物层的材料,按照功能,大体上可分为发光材料、空穴注入材料、空穴传输材料、电子传输材料、电子注入材料等。
上述发光材料按照分子量可分为高分子和低分子,按照发光机制可分为来源于电子的单重态激发态的荧光材料和来源于电子的三重态激发态的磷光材料,发光材料按照发光颜色,可分为蓝色、绿色、红色发光材料和为了呈现更好的天然色而所需的黄色及橙色发光材料。并且,为了增加色纯度,并通过能量转移来增加发光效率,可将主体/掺杂剂类用作发光物质。其原理在于,若将与主要构成发光层的主体相比能带隙小且发光效率优秀的少量掺杂剂混合于发光层,则主体中产生的激子向掺杂剂传输,从而发出效率高的光。此时,主体的波长向掺杂剂的波长范围移动,因而根据所利用的掺杂剂和主体的种类可获得所需波长的光。
至今,众所周知,这种有机发光器件中使用的物质有多种化合物,但在利用至今众所周知的物质的有机发光器件的情况下,由于高的驱动电压、低的效率及短寿命,很难进行实用化。
因此,利用具有优秀的特性的物质,持续地努力开发具有低电压驱动、高亮度及长寿命的有机发光器件。
发明内容
技术问题
为了解决如上所述问题,本发明的目的在于,提供可用作有机发光器件的发光主体或电子注入材料、电子传输材料或空穴阻挡材料,适用于有机发光器件时可确保长寿命、高效率、低电压、高Tg、薄膜稳定性,尤其是通过激基复合物形成及向掺杂剂的能量转移而极大化有机发光器件的效率及寿命的化合物。
并且,本发明的目的在于,提供包含上述化合物并具有长寿命、高效率、低电压、高Tg、薄膜稳定性,尤其是通过激基复合物形成及向掺杂剂的能量转移而极大化效率及寿命的有机发光器件。
解决问题的方案
为了实现上述目的,本发明提供由以下化学式1表示的化合物:
化学式1
在上述化学式1中,X分别独立地表示N或CR
Y为O或S,
R
m、n分别独立地表示0或2的整数。
并且,本发明提供包含由上述化学式1表示的化合物的有机发光器件。
发明的效果
本发明的化合物和适用上述化合物的有机发光器件具有如下特征。
1.导入化合物内的三亚苯结构,针对电子及空穴的耐久性优秀,由此确保有机发光器件的长寿命。
2.通过维持适合作为绿色磷光的三重态能量,确保有机发光器件的高效率。
3.在化合物内导入杂芳基,容易进行电子注入及传输,由此确保有机发光器件的低电压驱动及高效率。
4.通过化合物内的稠环(Fused ring)可形成高Tg,驱动有机发光器件时提高薄膜稳定性。
5.适用于有机发光器件时,利用本发明的新颖化合物(发光主体1)和咔唑衍生物(发光主体2),容易进行电子注入及传输,并可实现低电压驱动、高效率。
6.适用于有机发光器件时,通过使用本发明的新颖化合物(发光主体1)和咔唑衍生物(发光主体2),形成激基复合物,并向掺杂剂转移能量来极大化效率,由此可实现高效率长寿命。
附图说明
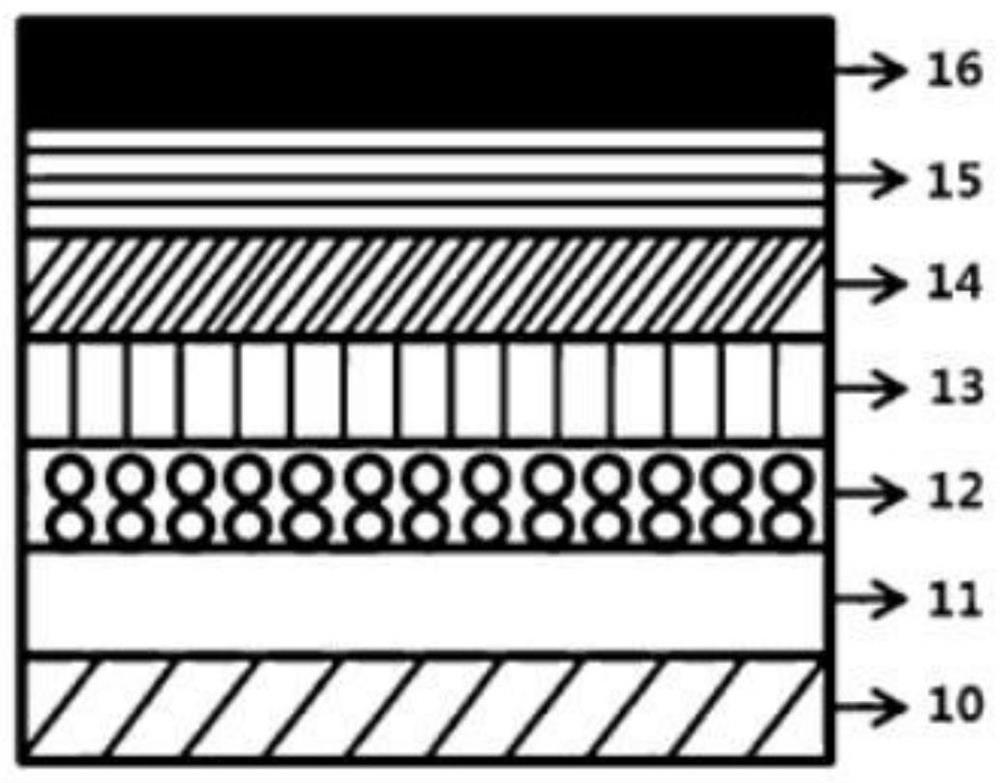
图1简要示出本发明一实施例的有机发光二极管(OLED)的截面。
附图标记的说明
10:基板 11:阳极
12:空穴注入层 13:空穴传输层
14:发光层 15:电子传输层
16:阴极
具体实施方式
本发明的化合物,由以下化学式1表示。
化学式1
在上述化学式1中,X分别独立地表示N或CR
Y为O或S,
R
Y为O或S,
R
m、n分别独立地表示0或2的整数,具体地,m及n为1。
在本发明中,由上述化学式1表示的化合物可以是由以下化学式1-1至1-6表示的化合物中的一个。
化学式1-1
化学式1-2
化学式1-3
化学式1-4
化学式1-5
化学式1-6
在上述化学式中,X、Y如化学式1所定义。
在本发明中,由上述化学式1表示的化合物的具体例为如下:
本发明的化学式1的化合物,空穴及电子传输特性优秀,发光效率优秀,并具有高色纯度、高效率及长寿命,适用于有机发光器件时,可呈现优秀的器件特性。并且,化学式1的化合物,具有电子注入容易的LUMO能级,电子传输特性优秀,适用于有机发光器件的电子注入层或者电子传输层时,可具有优秀的低电压、高效率、基于高Tg的稳定性及长寿命。
并且,本发明的化合物可通过由以下反应式1至3中的一种表示的反应式制备而得:
反应式1
反应式2
反应式3
在上述反应式中,X及Y如化学式1所定义。
并且,本发明提供将由上述化学式1表示的化合物包含在有机物层的有机发光器件。此时,本发明的化合物具体地单独使用为发光主体、电子注入材料、电子传输材料或者空穴阻挡物质,或者可与公知的化合物一起使用。更具体地,将本发明的化合物用作发光主体,此时,将由以下化学式2表示的发光化合物(发光主体2)与由本发明的化学式1表示的化合物(发光主体1)一起用作发光主体为好。
化学式2
在上述化学式2中,r
Ar为由重氢、卤素、氨基、腈基、硝基、C
m为1至4的整数,
当m为2至4时,Ar及r
具体地,上述化学式2的化合物为由以下化学式2-1至2-7表示的化合物中的一种为好。
化学式2-1
化学式2-2
化学式2-3
化学式2-4
化学式2-5
化学式2-6
化学式2-7
在上述式中,Ar
R
a、b分别独立地表示0至3的整数。
更具体地,上述化学式2的化合物优选为由上述化学式2-3表示的化合物,这种情况下,化学式中包含的咔唑苯基部之间包括被取代的结构,由此最高占据分子轨道会更大,空穴注入更容易,可降低驱动电压。
当本发明的有机发光器件将上述化学式2的化合物用作发光主体时,化学式1及化学式2的混合比率为重量比率9:1至2:8为好。当在于上述范围内时,有机发光器件的驱动电压低,并可具有高效率及长寿命,但超过上述范围而由化学式2表示的化合物过多时,空穴注入及传输过度,由此会减少效率及寿命。
化学式2的具体化合物为如下。
在本发明中,通过上述发光主体1及2形成的激基复合物发光波长可形成为400-650nm,通过选择发光主体1及2来形成450-500nm的激基复合物波长,可使用于绿色有机发光器件,通过形成500-630nm的激基复合物波长,可使用于红色有机发光器件。
具体地,通过上述发光主体的组合形成的激基复合物波长形成在比发光层的客分子掺杂剂的发光波长更短的波长为好。这样磷光掺杂剂吸收基于发光主体组合的激基复合物而发光的过程中,有效地进行能量转移,由此可极大化效率,并可具有高效率长寿命。
并且,本发明的有机发光器件除了包括包含由上述化学式1表示的化合物的1层以上的有机物层之外,可使用公知的有机发光器件的制备方法来制备有机发光器件,作为一例说明有机发光器件的制备方法为如下。
上述有机发光器件在阳极(anode)与正极(cathod)之间可包括1个以上的空穴注入层(HIL)、空穴传输层(HTL)、发光层(EML)、电子传输层(ETL)、电子注入层(EIL)等有机物层。
首先,在基板上部蒸镀具有高功函数的阳极电极用物质来形成阳极。此时,上述基板可使用在常规的有机发光器件中使用的基板,尤其是,使用机械强度、热稳定性、透明性、表面平滑性、处理容易性及防水性优秀的玻璃基板或者透明塑料基板为好。并且,作为阳极电极用物质可使用透明而导电性优秀的氧化铟锡(ITO)、氧化铟锌(IZO)、氧化锡(SnO
其次,可通过真空蒸镀法、旋涂法、浇铸法、LB(Langmuir-Blodgett)法之类的方法,将空穴注入层形成在上述阳极电极上部。上述空穴注入层物质可使用公知的空穴注入层物质,作为一例,可将美国专利第4356429号中揭示的铜酞菁等酞菁化合物或者星爆型胺衍生物类TCTA(4,4',4"-三(N-咔唑基)三苯胺)、m-MTDATA(4,4',4"-三(3-甲苯氨基)三苯胺)、m-MTDAPB(4,4',4"-三(3-甲苯氨基)苯氧基苯)、HI-406(N1,N1'-(联苯-4,4'-二基)双(N1-(萘-1-基)-N4,N4-二苯基苯-1,4-二胺)等用作空穴注入层物质。
接着,可通过真空蒸镀法、旋涂法、浇铸法、LB法等之类的方法,将空穴传输层物质形成在上述空穴注入层上部。
上述空穴传输层物质可混合公知的空穴传输层物质来使用。具体地,作为上述公知的空穴传输层物质,可使用N-苯基咔唑、聚乙烯基咔唑等咔唑衍生物、N,N'-双(3-甲基苯基)-N,N'-双苯基-[1,1-联苯]-4,4'-二胺(TPD)、N.N'-双(萘-1-基)-N,N'-双苯基联苯胺(α-NPD)等的具有芳香族稠环的常规的胺衍生物等。
之后,通过真空蒸镀法、旋涂法、浇铸法、LB法等之类的方法,可将发光层物质形成在上述空穴传输层上部。借助上述真空蒸镀法来形成发光层时,其蒸镀条件随着所使用的化合物不同,通常在与空穴注入层的形成几乎相同的条件范围内选择为好。
并且,上述发光层材料可使用公知的主体或者掺杂剂,使用由本发明的化学式1表示的化合物用作主体为好,具体地,同时使用由本发明的化学式1表示的化合物(发光主体1)和由化学式2表示的化合物(发光主体2)为好,更具体地,同时使用由本发明的化学式1表示的化合物(发光主体1)和由化学式2-3表示的化合物(发光主体2)为好。作为上述发光主体,以由本发明的化学式1表示的化合物(发光主体1)和由化学式2表示的化合物(发光主体2)组合而成的激基复合物波长可形成在比发光层的掺杂剂的发光波长更短的波长的方式,选择掺杂剂物质来使用为好。
可使用的荧光掺杂剂可使用可从日本出光公司(Idemitsu公司)购买的IDE102或者IDE105,或者BD142(N
并且,在上述空穴传输层与发光层之间还可包括发光补助层,作为发光补助层材料可使用公知的物质。
并且,为了防止三重态激子或者空穴扩散到电子传输层,通过真空蒸镀法或者旋涂法,还可将空穴阻挡材料(HBL)层叠在发光层。此时可使用的空穴阻挡物质不受特别限制,但可选择任何用作空穴阻挡材料的公知的物质来利用。公知的材料例如可列举恶二唑衍生物或三唑衍生物、邻菲咯啉衍生物或日本特开平11-329734(A1)中记载的的空穴阻挡材料等,可使用代表性的Balq(双(8-羟基-2-甲基喹啉)-铝双酚盐)、邻菲咯啉(phenanthrolines)类化合物(例:UDC公司BCP(浴铜灵))等。
在如上所述形成的发光层上部形成电子传输层,此时上述电子传输层可通过真空蒸镀法、旋涂法、浇铸法等方法形成。
上述电子传输层材料可使用由上述化学式1表示的化合物或者公知的材料,作为公知的材料的例子,可使用喹啉衍生物,尤其可使用三(8-喹啉)铝(Alq
并且,在电子传输层上部可层叠作为具有从阴极容易注入电子的功能的物质的电子注入层(EIL),作为电子注入层物质可利用由上述化学式1表示的化合物或者LiF、NaCl、CsF、Li
最后,可通过真空蒸镀法或溅射等方法,在电子传输层或者电子注入层上部形成阴极形成用金属,并用作阴极。其中,作为阴极形成用金属可使用具有低功函数的金属、合金、导电性化合物及它们的混合物。作为具体例子,有锂(Li)、镁(Mg)、铝(Al)、铝-锂(A l-Li)、钙(Ca)、镁-铟(Mg-In)、镁-银(Mg-Ag)等。并且,为了获得顶部发光器件,还可使用利用ITO、IZO的透过型阴极。
本发明的有机发光器件,不仅可实现阳极、空穴注入层、空穴传输层、发光层、电子传输层、电子注入层、阴极结构的有机发光器件,而且还可以实现多种结构的有机发光器件的结构,根据需要,还可形成1层或者2层的中间层。
如上所述,根据本发明形成的各个有机物层的厚度可根据所需的程度进行调节,具体为10至1000nm,更具体地,20至150nm为好。
并且,在本发明中,包含由上述化学式1表示的化合物的有机物层,由于可按分子单位调节有机物层的厚度,因此具有表面均匀且形态稳定性突出的优点。
本发明的有机发光器件,针对电子及空穴的耐久性优秀,可确保有机发光器件的长寿命、低电压驱动及高效率,薄膜稳定性优秀,利用本发明的新颖化合物(发光主体1)和咔唑衍生物(发光主体2),电子注入及传输容易,可实现低电压驱动、高效率,通过激基复合物形成及向掺杂剂转移能量来极大化效率,并可实现高效率长寿命。
以下,为了有助于理解本发明,提出具体的实施例,但以下实施例仅是用来例示本发明,而本发明的范围并不局限于以下实施例。
化学式1的合成
中间体I1的合成
I1-1的合成
在圆底烧瓶中,将三苯烯-2-基-2-硼酸(triphenylen-2-ylboronic acid)8.4g、2,8-二溴二苯并[b,d]呋喃(2,8-dibromodibenzo[b,d]furan)10.0g溶解于甲苯280ml中,并加入K
I1的合成
将上述中间体I1-1 8.1g、双(频哪醇合)二硼(bis(pinacolato)diboron)5.6g、Pd(dppf)Cl
中间体I2的合成
通过与上述中间体I1-1及I1合成相同的方法,利用4,6-二溴二苯并[b,d]呋喃(4,6-dibromodibenzo[b,d]furan)来代替2,8-二溴二苯并[b,d]呋喃(2,8-dibromodibenzo[b,d]furan),合成中间体I2。(收率50%)
中间体I3的合成
I3-1的合成
在圆底烧瓶中,将2-溴三亚苯(2-bromotriphenylene)15.0g、二苯并[b,d]呋喃-4-基硼酸(dibenzo[b,d]furan-4-ylboronic acid)10.5g溶解于甲苯380ml,并加入K
I3-2的合成
将上述中间体I3-1 15.0g溶解于二甲基甲酰胺(DMF)150ml之后,在DMF 70ml中慢慢滴加溶解了N-溴代琥珀酰亚胺(N-Bromos uccinimide)7.5g的溶液,并搅拌16小时。用TLC确认反应,用蒸馏水析出并并进行重结晶,获得13.5g(收率75%)的中间体I3-2。
I3的合成
将上述中间体I1-1 13.5g、双(频哪醇合)二硼(bis(pinacolat o)diboron)9.4g、Pd(dppf)Cl
中间体I4的合成
通过与上述中间体I3-1及I3合成相同的方法,利用2-氯-4,6-二苯基-1,3,5-三嗪(2-chloro-4,6-diphenyl-1,3,5-triazine)来代替2-溴三亚苯(2-bromotriphenylene),合成中间体I4。(收率47%)
中间体I5的合成
通过与上述中间体I1-1及I1合成相同的方法,利用2,8-二溴二苯并[b,d]噻吩(2,8-dibromodibenzo[b,d]thiophene)来代替2,8-二溴二苯并[b,d]呋喃(2,8-dibromodibenzo[b,d]furan),合成中间体I5。(收率53%)
中间体I6的合成
通过与上述中间体I1-1及I1合成相同的方法,利用(4,6-二溴二苯并[b,d]噻吩)(4,6-dibromodibenzo[b,d]thiophene)来代替2,8-二溴二苯并[b,d]呋喃(2,8-dibromodibenzo[b,d]furan),合成中间体I6。(收率48%)
中间体I7的合成
通过与上述中间体I3-1及I3合成相同的方法,利用二苯并[b,d]噻吩-4-基硼酸(dibenzo[b,d]thiophen-4-ylboronic acid)来代替二苯并[b,d]呋喃-4-基硼酸(dibenzo[b,d]furan-4-ylboronic acid),合成中间体I7。(收率51%)
中间体I8的合成
通过与上述中间体I3-1及I3合成相同的方法,利用2-氯-4,6-二苯基-1,3,5-三嗪(2-chloro-4,6-diphenyl-1,3,5-triazine)及二苯并[b,d]噻吩-4-基硼酸(dibenzo[b,d]thiophen-4-ylboronic acid)来代替2-溴三亚苯(2-bromotriphenylene)及二苯并[b,d]呋喃-4-基硼酸(dibenzo[b,d]furan-4-ylboronic acid),合成中间体I8。(收率45%)
化学式1的合成
化合物1-1
在圆底烧瓶中,将中间体I1 5.0g、2-(3-溴苯基)-4,6-二苯基-1,3,5-三嗪(2-(3-bromophenyl)-4,6-diphenyl-1,3,5-triazine)2.8g溶解于甲苯120ml,并加入K
m/z:625.22(100.0%)、626.22(49.0%)、627.22(12.3%)、628.23(1.8%)、626.21(1.1%)
化合物1-2
通过与上述化合物1-1相同的方法,利用4-chloro-2,6-diphenylpyrimidine来代替2-chloro-4,6-diphenyl-1,3,5-triazine,合成化合物1-2。
(收率62%)
m/z:624.22(100.0%)、625.22(50.5%)、626.23(12.3%)、627.23(2.1%)
化合物1-3
通过与上述化合物1-1相同的方法,利用2-chloro-4,6-diphenylpy rimidine来代替2-chloro-4,6-diphenyl-1,3,5-triazine,合成化合物1-3。
(收率65%)
m/z:624.22(100.0%)、625.22(50.5%)、626.23(12.3%)、627.23(2.1%)
化合物1-4
通过与上述化合物1-1相同的方法,使用中间体I2来代替中间体I1,合成化合物1-4。(收率59%)
m/z:625.22(100.0%)、626.22(49.0%)、627.22(12.3%)、628.23(1.8%)、626.21(1.1%)
化合物1-5
通过与上述化合物1-1相同的方法,利用中间体I2及4-chloro-2,6-diphenylpyrimidine来代替中间体I1及2-chloro-4,6-diphenyl-1,3,5-triazine,合成化合物1-5。(收率63%)
m/z:624.22(100.0%)、625.22(50.5%)、626.23(12.3%)、627.23(2.1%)
化合物1-6的合成
通过与上述化合物1-1相同的方法,利用中间体I2及2-chloro-4,6-diphenylpyrimidine来代替中间体I1及2-chloro-4,6-diphenyl-1,3,5-triazine,合成化合物1-6。(收率60%)
m/z:624.22(100.0%)、625.22(50.5%)、626.23(12.3%)、627.23(2.1%)
化合物1-7
通过与上述化合物1-1相同的方法,利用中间体I3来代替中间体I1,合成化合物1-7。(收率64%)
m/z:625.22(100.0%)、626.22(49.0%)、627.22(12.3%)、628.23(1.8%)、626.21(1.1%)
化合物1-8
通过与上述化合物1-1相同的方法,利用中间体I4及2-chloro-4,6-diphenyl-1,3,5-triazine来代替中间体I1及2-bromotriphenylene,合成化合物1-8。(收率60%)
m/z:625.22(100.0%)、626.22(49.0%)、627.22(12.3%)、628.23(1.8%)、626.21(1.1%)
化合物1-9
通过与上述化合物1-1相同的方法,利用中间体I5来代替中间体I1,合成化合物1-9。(收率60%)
m/z:641.19(100.0%)、642.20(49.0%)、643.20(12.1%)、643.19(5.1%)、644.19(2.3%)、644.20(2.0%)、642.19(1.9%)
化合物1-10
通过与上述化合物1-1相同的方法,利用中间体I5及4-chloro-2,6-diphenylpyrimidine来代替中间体I1及2-chloro-4,6-diphenyl-1,3,5-triazine,合成化合物1-10。(收率65%)
m/z:640.20(100.0%)、641.20(50.9%)、642.20(12.9%)、642.19(4.5%)、643.20(2.5%)、643.21(2.0%)
化合物1-11
通过与上述化合物1-1相同的方法,利用中间体I5及2-chloro-4,6-diphenylpyrimidine来代替中间体I1及2-chloro-4,6-diphenyl-1,3,5-triazine,合成化合物1-11。(收率62%)
m/z:640.20(100.0%)、641.20(50.9%)、642.20(12.9%)、642.19(4.5%)、643.20(2.5%)、643.21(2.0%)
化合物1-12
通过与上述化合物1-1相同的方法,利用中间体I6来代替中间体I1,合成化合物1-12。(收率65%)
m/z:641.19(100.0%)、642.20(49.0%)、643.20(12.1%)、643.19(5.1%)、644.19(2.3%)、644.20(2.0%)、642.19(1.9%)
化合物1-13
通过与上述化合物1-1相同的方法,利用中间体I6及4-chloro-2,6-diphenylpyrimidine来代替中间体I1及2-chloro-4,6-diphenyl-1,3,5-triazine,合成化合物1-13。(收率60%)
m/z:640.20(100.0%)、641.20(50.9%)、642.20(12.9%)、642.19(4.5%)、643.20(2.5%)、643.21(2.0%)
化合物1-14
通过与上述化合物1-1相同的方法,利用中间体I6及2-chloro-4,6-diphenylpyrimidine来代替中间体I1及2-chloro-4,6-diphenyl-1,3,5-triazine,合成化合物1-14。(收率62%)
m/z:640.20(100.0%)、641.20(50.9%)、642.20(12.9%)、642.19(4.5%)、643.20(2.5%)、643.21(2.0%)
化合物1-15
通过与上述化合物1-1相同的方法,利用中间体I7来代替中间体I1,合成化合物1-15。(收率65%)
2,4-二苯基-6-(6-(三亚苯-2-基)二苯并[b,d]噻吩-2-基)-1,3,5-三嗪(2,4-diphenyl-6-(6-(triphenylen-2-yl)dibenzo[b,d]thiophen-2-yl)-1,3,5-triazine)
化合物1-16
通过与上述化合物1-1相同的方法,利用中间体I8及2-chloro-4,6-diphenyl-1,3,5-triazine来代替中间体I1及2-bromotriphenylene,合成化合物1-16。(收率66%)
m/z:641.19(100.0%)、642.20(49.0%)、643.20(12.1%)、643.19(5.1%)、644.19(2.3%)、644.20(2.0%)、642.19(1.9%)
化学式2的合成
化合物2-1
在圆底烧瓶中,将3-苯基-9H-咔唑(3-phenyl-9H-carbazole)5.0g、3,3'-二溴-1,1'-联苯(3,3'-dibromo-1,1'-biphenyl)3.21g、t-BuONa2.96g、Pd
m/z:636.26(100.0%)、637.26(52.3%)、638.26(13.6%)、639.27(2.2%)
化合物2-2
在圆底烧瓶中,将9-([1,1':3',1”-三联苯]-5'-基)-3-溴-9H-咔唑(9-([1,1':3',1”-terphenyl]-5'-yl)-3-bromo-9H-carbazole)8.0g、(4-(9H-咔唑-9-基)苯基)硼酸((4-(9H-carbazol-9-yl)phenyl)boronicacid)4.85g溶解于甲苯200ml,并加入K
m/z:636.26(100.0%)、637.26(52.3%)、638.26(13.6%)、639.27(2.2%)
化合物2-3
在圆底烧瓶中,将9H,9'H-3,3'-联咔唑(9H,9'H-3,3'-bicarbazole)10.0g、3-溴-1,1'-联苯(3-bromo-1,1'-biphenyl)14.1g、t-BuONa 4.4g、Pd
m/z:636.26(100.0%)、637.26(52.3%)、638.26(13.6%)、639.27(2.2%)
化合物2-4
在圆底烧瓶中,将9-苯基-9H,9'H-3,3'-联咔唑(9-phenyl-9H,9'H-3,3'-bicarbazole)5.0g、3-溴-1,1'-联苯(3-bromo-1,1'-biphenyl)4.0g、t-BuONa 1.8g、Pd
m/z:649.25(100.0%)、650.26(52.3%)、651.26(13.4%)、652.26(2.4%)、650.25(1.1%)
化合物2-5
在圆底烧瓶中,将9-([1,1'-联苯]-3-基)-3,6-二溴-9H-咔唑(9-([1,1'-biphenyl]-3-yl)-3,6-dibromo-9H-carbazole)5.0g、9H-咔唑(9H-carbazole)3.7g、t-BuONa 1.5g、Pd
m/z:649.25(100.0%)、650.26(52.3%)、651.26(13.4%)、652.26(2.4%)、650.25(1.1%)
有机发光器件的制备
按照图1所示的结构制备了有机发光器件。有机发光器件至下而上依次层叠阳极(空穴注入电极11)/空穴注入层12/空穴传输层13/发光层14/电子传输层15/阴极(电子注入电极16)。
实施例及比较例的空穴注入层12、空穴传输层13、发光层14、电子传输层15使用了如下的物质。
制作有机发光器件之前,为了察看借助激基复合物形成的能量有效地转移至磷光掺杂剂的主体1及主体2的组合,在玻璃基板蒸镀主体1/主体2(1:1),测定激基复合物波长,将其结果表示在以下表1。
表1
如上述表1所示,组合比较例1至组合比较例3未观测到基于激基复合物的波长,就组合比较例4而言,在510nm以上观测到波长。由此可知,考虑绿色区域的磷光掺杂剂的吸收波长(最右侧450nm-500nm区域)时,能量转移不能有效地发生。
有机发光器件的制备
实施例1
用蒸馏水超声波清洗以
实施例2
除了作为上述实施例1的发光层主体使用化合物1-2来代替化合物1-1之外,通过相同的方法制作绿色有机发光器件。
实施例3
除了作为上述实施例1的发光层主体使用化合物1-4来代替化合物1-1之外,通过相同的方法制作绿色有机发光器件。
实施例4
除了作为上述实施例1的发光层主体使用化合物1-8来代替化合物1-1之外,通过相同的方法制作绿色有机发光器件。
实施例5
除了作为上述实施例1的发光层主体使用化合物1-11来代替化合物1-1之外,通过相同的方法制作绿色有机发光器件。
实施例6
用蒸馏水超声波清洗以
实施例7至实施例21
通过与实施例6相同的方法,制作了作为发光层主体使用化合物1-2至1-16:化合物2-3(6:4w%)混合物来代替化合物1-1:化合物2-3而制膜的绿色有机发光器件。
比较例1
除了作为上述实施例1的发光层主体使用CBP之外,通过相同的方法制作了绿色有机发光器件。
比较例2
除了作为上述实施例1的发光层主体使用比较化合物(Ref.)1之外,通过相同的方法制作了绿色有机发光器件。
比较例3
除了作为上述实施例1的发光层主体使用比较化合物(Ref.)2之外,通过相同的方法制作了绿色有机发光器件。
比较例4
除了作为上述实施例1的发光层主体使用比较化合物(Ref.)3之外,通过相同的方法制作了绿色有机发光器件。
有机发光器件的性能评价
使用吉时利2400源测量单元(Kiethley 2400source measureme nt unit)施加电压,注入电子及空穴,利用柯尼卡美能达(Konica Minolta)分光辐射度计(CS-2000),测定发光时的亮度,在大气压条件下测定实施例及比较例的有机发光器件的性能和有关施加电压的电流密度及亮度来进行评价,将其结果表示于表2。
表2
如上述表1所示,可确认本发明的实施例与比较例1~4相比,驱动电压低而具有高效率及长寿命,由此可知在所有方面上物性优秀。本发明的实施例与比较例2及比较例4相比,在三亚苯基具有作为连接基的二苯并呋喃及二苯并噻吩,还具有杂原子基,容易进行电子注入及传输,由此可知驱动电压低而效率及寿命上升。其中,一起使用空穴注入及传输容易的主体2化合物,可确认驱动电压更低而高电流密度下耐久性优秀,由此具有长寿命。这在电子注入及传输容易的主体1化合物中使用空穴注入及传输容易的主体2化合物,由此可知,降低驱动电压,在发光层内有效地聚集激子,来增加效率,在高电流密度下抑制滚降现象,耐久性好,具有长寿命。
实施例22
通过与实施例6相同的方法,制作了作为发光层主体使用化合物1-1:化合物2-3(7:3w%)而制膜的绿色有机发光器件。
实施例23
通过与实施例6相同的方法,制作了作为发光层主体使用化合物1-1:化合物2-3(8:2w%)而制膜的绿色有机发光器件。
实施例24
通过与实施例6相同的方法,制作了作为发光层主体使用化合物1-1:化合物2-3(4:6w%)而制膜的绿色有机发光器件。
实施例25
[352]
通过与实施例6相同的方法,制作了作为发光层主体使用化合物1-1:化合物2-3(2:8w%)而制膜的绿色有机发光器件。
参考例1
通过与实施例6相同的方法,制作了作为发光层主体使用化合物1-1:化合物2-3(1:9w%)而制膜的绿色有机发光器件。
针对上述实施例22至25及参考例1,使用吉时利2400源测量单元(Kiethley2400source measurement unit)施加电压,注入电子及空穴,利用柯尼卡美能达(KonicaMinolta)分光辐射度计(CS-2000),测定发光时的亮度,在大气压条件下测定实施例及比较例的有机发光器件的性能和有关施加电压的电流密度及亮度来进行评价,将其结果表示于表3。
表3
在上述表1中确认到基于化学式1及化学式2的组合比率的器件特性。最终,化学式1及化学式2的比率为1:9时,获得效率及寿命减少的结果,这与比较例1相比,可被视为因化学式2而导致空穴注入及传输过度的结果。具体地,化学式1及化学式2的比率在9:1至2:8,可确认到基于发光主体组合的有利的特性。
产业上可利用性
本发明的化合物和适用上述化合物的有机发光器件具有如下特征。
1.导入化合物内的三亚苯结构,针对电子及空穴的耐久性优秀,由此确保有机发光器件的长寿命。
2.通过维持适合作为绿色磷光的三重态能量,确保有机发光器件的高效率。
3.在化合物内导入杂芳基,容易进行电子注入及传输,由此确保有机发光器件的低电压驱动及高效率。
4.通过化合物内的稠环(Fused ring)可形成高Tg,驱动有机发光器件时提高薄膜稳定性。
5.适用于有机发光器件时,利用本发明的新颖化合物(发光主体1)和咔唑衍生物(发光主体2),容易进行电子注入及传输,并可实现低电压驱动、高效率。
6.适用于有机发光器件时,通过使用本发明的新颖化合物(发光主体1)和咔唑衍生物(发光主体2),形成激基复合物,并向掺杂剂转移能量来极大化效率,由此可实现高效率长寿命。
- 新颖的有机电致发光化合物和包含该化合物的有机电致发光器件
- 基质化合物和掺杂剂化合物的新颖组合及包含该组合的有机电致发光器件
