一种光热声敏产活性氧的纳米囊泡及其制备和应用
文献发布时间:2023-06-19 19:14:59
技术领域
本发明涉及一种光热声敏产活性氧的纳米囊泡及其制备和应用,属于分子材料和化学催化剂领域。
背景技术
随着纳米技术的快速发展,纳米制剂与肿瘤治疗的结合越来越受到关注。其中,为了更好地发挥纳米粒的治疗效果,纳米粒(NPs)与细胞的相互作用是疾病治疗的一个关键过程,而纳米粒成功进入实体瘤细胞是这一关键过程的主要问题。纳米粒进入肿瘤细胞的一个公认机制是EPR效应,然而实体瘤致密的细胞外基质限制了纳米粒进入细胞。因此,研究人员探索了另一种方法来实现这一目标,这就是膜渗透。这种方法利用物理力量将"纳米弹丸"射入细胞。例如,采用液滴声致气化的透皮贴片来突破障碍,实现药物的局部输送。光触发的"纳米弹",其动力是由光来汽化水,从而产生物理力穿透细胞膜。
此外,超声与特殊纳米粒相结合的另一种方法也被认为是一种有前途的癌症治疗方式,这就是声动力疗法(SDT)。SDT是在低频、低强度超声作用下,声敏剂将能量转移到氧分子上,产生
光热疗法(PTT)作为一种不依赖O
发明内容
本发明提供了一种光热声敏产活性氧的纳米囊泡(“纳米炸弹”),是在脂质体囊泡上负载贵金属纳米团簇即可,所述脂质体囊泡是以全氟戊烷PFP为核,以磷脂为壳形成的囊泡;所得负载金属团簇的纳米囊泡在超声波和近红外光的双重照射下,作为“纳米炸弹”核心的低沸点PFP迅速形成气泡,随后气泡快速膨胀、塌陷产生的物理力将贵金属(如Pt/Pd)纳米簇推进到周围肿瘤细胞;而具有仿过氧化氢酶活性的纳米簇(如Pt/Pd)消耗肿瘤细胞内过量过氧化氢(H
本发明的技术方案:
本发明要解决的第一个技术问题是提供一种光热声敏产活性氧的纳米囊泡,所述纳米囊泡是在脂质体囊泡上负载贵金属纳米团簇;其中,所述脂质体囊泡是以全氟戊烷或全氟己烷为核,以磷脂为壳形成的囊泡。
进一步,所述贵金属选自Pt、Pd、Au、Ru、Rh、Os或Ir中的至少一种;优选为Pt或/和Pd;更优选为Pt和Pd。
进一步,所述负载金属纳米团簇的囊泡的粒径为300~800nm。
本发明要解决的第二个技术问题是提供上述光热声敏产活性氧的纳米囊泡的制备方法,所述制备方法为:在脂质体囊泡表面均匀负载贵金属即可。
进一步,所述光热声敏产活性氧的纳米囊泡的制备方法为:先以全氟戊烷为核,磷脂为外壳,通过薄膜水化法形成具有核壳结构的脂质体囊泡;再在脂质体囊泡表面负载金属纳米团簇形成所述光热声敏产活性氧的纳米囊泡(负载金属纳米团簇的囊泡)。
具体的,所述脂质体囊泡的制备方法为:先将二棕榈酸磷脂酰胆碱(DPPC)和二棕榈酰磷脂酰乙醇胺-甲氧基聚乙二醇2000(DPPE-MPEG2000)溶解于有机溶剂中,随后蒸发有机溶剂得到脂质薄膜,重悬得到溶液A;然后在溶液A中加入全氟戊烷或全氟己烷,再经超声处理、离心洗涤得到溶液B;最后将金属盐溶液加入溶液B中,0~8℃搅拌5~10min后缓慢加入稀释的催化剂,避光于0~8℃搅拌反应4~5h;最后离心、重悬得所述光热声敏产活性氧的纳米囊泡。
进一步,所述缓慢加入稀释的催化剂的方法为:将1~4mg的催化剂以磷酸盐缓冲液稀释至30~50mL,将其在4~5小时内缓慢加完。
进一步,所述催化剂为硼氢化钠、柠檬酸钠、抗坏血酸或其他还原性物质。
进一步,所述金属盐包括:六氯钯酸钾、氯铂酸或氯金酸中的至少一种。
进一步,上述制备方法中,金属盐的引入量占溶液B用量的1~4mg/mL。
优选的,所述金属盐中Pt与Pd的摩尔比为Pt:Pd=1~9:9~1。
进一步,上述制备方法中,DPPC与DPPE-MPEG2000的质量比为6~9:2~4。
进一步,所述有机溶剂为醇类或三氯甲烷等有机溶剂;优选为无水乙醇。
进一步,所述离心采用去离子水离心洗涤至少三次,离心转速为2500~3500g(优选为3000g),每次离心时间为3~10分钟。
本发明要解决的第三个技术问题是指出上述光热声敏产活性氧的纳米囊泡用于医学、成像、催化或递送领域。
进一步,所述光热声敏产活性氧的纳米囊泡用作抗肿瘤催化剂或抗菌抗炎药物。
进一步,所述光热声敏产活性氧的纳米囊泡用作抗肿瘤催化剂或抗菌抗炎药物的使用方法为:对上述制得的光热声敏产活性氧的纳米囊泡实施超声波和近红外光照射,由于全氟戊烷或全氟己烷沸点低,在超声波和近红外光的双重照射下,所述纳米囊泡迅速形成气泡,并快速膨胀、塌陷产生物理力,进而将其表面负载的贵金属纳米团簇推进到周围肿瘤细胞或其他病灶。
本发明的有益效果:
本发明在以全氟戊烷(PFP)或全氟己烷为核以磷脂为壳形成的脂质体囊泡上负载贵金属纳米簇,形成一种新型的光热声敏产活性氧的纳米囊泡(纳米炸弹);由于其核心全氟戊烷具有低沸点的特性,在超声波和近红外光的双重照射下,该纳米囊泡能够迅速形成气泡,并快速膨胀、塌陷产生的物理力将其表面负载的贵金属(如Pt/Pd)纳米簇推进到周围肿瘤细胞;由于贵金属纳米簇可作为光热/声敏剂,能够同时实现PTT和SDT,因此所得“纳米炸弹”具有光热、声动力协同抗肿瘤的效果;该发明为多功能纳米炸弹平台的构建开拓了道路。
附图说明
图1a、图1b分别为实施例1中的ND
图2a、图2b分别为实施例1中的ND
图3为实施例1中的ND
图4a、图4b分别为实施例1中的ND
图5为实施例1中的ND
图6为实施例1中的ND
图7为实施例1中的ND
图8a、图8b分别为近红外激光照射下的纳米颗粒的热成像图和温度升高曲线图。
图9为不同浓度的实施例1中的ND
图10为实施例1中的ND
图11为实施例1中的ND
图12a、图12b分别为不同纳米溶液催化H
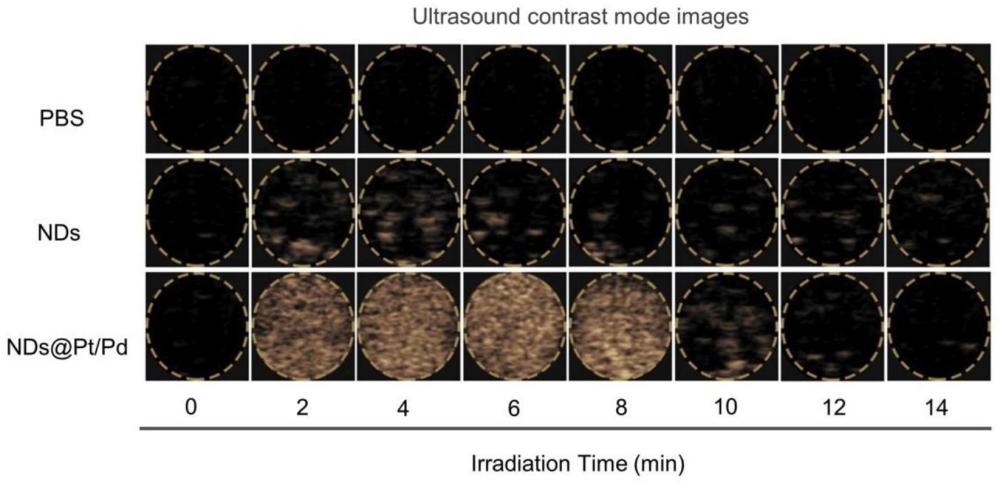
图13为PBS、ND
图14a、图14b分别为含有HE或SOSG的不同溶液在US照射下的荧光光谱图。
图15为不同处理后的Hepa1-6细胞的DCFH-DA染色结果图。
图16为不同处理后的calcein-AM/PI染色Hepa1-6细胞荧光图。
图17为不同浓度ND
图18为不同治疗方式的体内抗肿瘤效果图:a)注射PBS或ND
具体实施方式
本发明首次将含全氟戊烷或全氟己烷的脂质体囊泡和具有声动力、光热效果的贵金属结合起来制成一种新型的纳米炸弹,一方面利用贵金属仿酶制剂负载于囊泡上,实现了光热和声动力的协同效果;另一方面,近红外照射下的升温和超声的声致气化联合使用,可以使全氟戊烷或全氟己烷更快地由液体变成气体。
实施例1
ND
ND
试验例1形貌表征:
测试方法:
实施例中所得ND
测试结果:
通过透射电子显微镜(TEM)可观察到,ND
试验例2光热性能测试:
测试方法:
将不同浓度的纳米粒子加入离心管中,其混合PBS溶液的最终体积为200μL。用热像仪成像设备记录近红外照射(2.8W/cm
测试结果:
在近红外(NIR)激光照射下,含有100μg/mL(100μg/mL具体指1mL溶液中引入的金属盐溶液的总质量是100ug。取100uL上述实施例中制备出的负载金属纳米团簇的溶液,定容至1mL,即得到100μg/mL的溶液)的ND
试验例3类过氧化物酶及类过氧化氢酶活性测试:
测试方法:
类过氧化物酶活性测试:将稀释的纳米颗加入含有H
类过氧化氢酶活性测试:将20μL ND
测试结果:
在H
试验例4单线态氧的检测和超氧阴离子的检测:
测试方法:
单线态氧的检测:将含有10μL纳米粒子(1mg/mL)、20μLH
超氧阴离子的检测:100μL纳米颗粒(100μg/mL)与10μL H
测试结果:
为了说明ND
试验例5超声及近红外触发的相变检测:
测试方法:
将200μL纳米颗粒放入凝胶中,用近红外和超声照射14分钟,并使用超声造影系统获得成像。
测试结果:
为了验证超声和激光能够诱导PFP产生气泡并破裂,本发明利用超声造影模式来观察这些气泡在不同照射时间的变化。从造影模式的图像(图13)可以看出,在辐照前,三组溶液都没有回声,在2分钟时ND
试验例6细胞实验:
测试方法:
细胞的培养:Hepa1-6和人脐带内皮细胞(HUVECs)在含有10%胎牛血清(FBS)和1%青霉素-链霉素的DMEM中培养,在37℃、5%CO
细胞内ROS评估:将Hepa1-6细胞2×10
纳米粒对肿瘤细胞的杀伤作用:将Hepa1-6细胞放入48孔板中生长24小时,根据分组用US和NIR照射后再孵育20小时,随后用Calcein-AM/PI染色细胞,并用荧光显微镜评估抗肿瘤效果。
纳米粒对人脐静脉内皮细胞的毒性作用:将1×10
测试结果:
为了评估本发明在Hepa1-6细胞上产生的ROS,应用2,7-二氯荧光素二乙酸盐(DCFH-DA)作为荧光探针观察了细胞内ROS的产生。如图15所示,施加/未施加NIR+US的Control组几乎没有绿色荧光,而ND
本发明用活/死染色来评估其对Hepa1-6肿瘤细胞的杀伤能力(图16)。与Control组相比,与ND
同时,为了确定ND
试验例7动物实验:
测试方法:
肿瘤模型的建立和治疗:5周龄大的Balb/c Nude小鼠适应环境一周后,皮下注射含有3×10
测试结果:
本发明进一步探讨了不同处理下的ND
此外,用苏木精和伊红染色(H&E)、免疫组织化学染色(CD-31)和免疫荧光染色(TUNEL和Ki-67)评估了不同组的治疗效果(图18c)。H&E染色图像显示,ND
综上可知,本发明提供了一种US/NIR双响应的“纳米炸弹”(ND
