抗纤维化组合物
文献发布时间:2023-06-19 10:35:20
发明领域
本发明涉及治疗异常纤维化状况,诸如肺、皮肤、胃肠系统、泌尿生殖系统、心脏、腹膜、肾、肝和粘膜的状况的方法。特别地,本发明涉及肺损伤,其特征可以在于肺血管通透性增加。合适地,本发明涉及治疗肺实质的方法,以限制在肺泡-毛细血管膜水平开始并且其对肺的气体交换表面的功能完整性的影响达到肺水肿发展和表面活性物质功能受损的程度的远端肺损伤或事件的有害进展。
发明背景
虽然急性肺损伤(ALI)的临床综合征和急性呼吸窘迫综合征(ARDS)例示了这样的远端肺损伤,并且可由范围从肺炎到脓毒症和创伤的一系列直接和间接伤害(insult)引起,但是另一种公认的能够以这种方式使肺泡-毛细血管膜受损的伤害是暴露于电离辐射。这样的损伤引起的损害通常会消退。然而,在一定比例的个体中,可能反而会进一步进展到肺泡-毛细血管膜因胶原沉积(肺泡纤维化)和组织重塑而变为长期受损的程度。在肺泡-毛细血管膜水平开始的远端肺损伤或事件的有害进展可导致进行性肺泡纤维化和呼吸功能受损,这会显著影响生活质量并导致呼吸衰竭。认为在鉴定为初始影响肺泡-毛细血管膜的状况(例如ALI/ARDS、放射性肺损伤(Radiation-Induced Lung Injury;RILI))中,表面活性物质减少和/或受损。在体内生理上产生的表面活性物质被认为在细胞膜上提供单层结构,但表面活性物质不能够穿过细胞膜进入肺泡和/或间质(interstitium)。
发明概述
ARDS可由许多原因引起,例如由于胃内容物吸入导致的直接肺损伤或例如由于严重创伤导致的间接肺损伤。就ARDS而言,其促成了炎症级联反应,涉及强效炎性细胞诸如嗜中性粒细胞的募集以及促炎性细胞因子和趋化因子的分泌。该状况的初始和功能限制性病理发生于间质和肺泡细胞中。虽然生理上提供的表面活性物质可以提供对肺的保护作用,但它不能够在间质或肺泡细胞中起作用,并且因此不能够在初始病理位置处和进一步地在组织(orchestrate)进一步病理的位置处起作用。
因此,在穿过肺泡-毛细血管膜时,炎性细胞和流体充满肺泡。这些会干扰表面活性物质功能,其继而降低肺泡通畅性(alveolar patency)并使呼吸功能受损。表面活性物质保护肺的能力进一步受到疾病过程期间产生表面活性物质的II型肺细胞的初始破坏的挑战。
本发明人确定了与纤维化状况的后治疗不同,使用本文讨论的板层小体组合物的预治疗(pre-treatment)或围治疗(peri treatment)(预防性)可以在纤维化病理建立和对细胞造成不可逆损伤之前起到阻止纤维化病理的作用。
放射治疗(RT)在接受癌症治疗的超过50%的患者中被采用。潜在的严重并发症是RILI,它影响辐射场内的正常的肺。特别地,在对胸部结构、胸壁和下颈部进行治疗后,RT可引起肺炎和肺纤维化,这是因为肺是被RT靶向的组织的一部分,或者是因为肺靠近肿瘤靶。由于意外暴露或由于用电离辐射的治疗性治疗,可发生RILI。据估计,有症状的放射性肺炎(肺部炎症)影响所有接受胸部RT的患者中的约7%,而超过40%的患者可能显示出指示肺损伤的放射学变化。
RILI与约2戈瑞(Gy)以上的辐射剂量特别相关。在动物实验中,在被提供了这样的辐射的细胞中在辐照1小时内观察到电子显微术变化,具有对于维持肺泡通畅性必不可少的表面活性物质的早期释放和消耗。到24小时,细胞内含有表面活性物质的板层小体被耗尽。在易受影响的个体中,这些早期变化在一个疗程的RT后约4-12周变得临床上明显。典型的症状包括呼吸短促、咳嗽和胸部不适、对肺部感染的易感性增加。虽然这种急性放射性肺炎通过治疗通常会消退,但一定比例的患者随后会经历与慢性疾病进展相关的症状,包括明显的肺纤维化,这可使肺功能严重受损,达到威胁生命的程度。
通常通过减少向受试者提供的剂量来使RT风险最小化。然而,需要减轻RILI特别是纤维化的新方法,以改善癌症存活者的结果。减轻RILI的方法在处理有意或意外的核事件或放射事件方面也是有用的。
本发明人确定了在暴露于可导致肺泡-毛细血管膜受损的情况的受试者中,在可导致这样的肺泡-毛细血管膜受损的伤害/损伤之前、与可导致这样的肺泡-毛细血管膜受损的伤害/损伤一起或在可导致这样的肺泡-毛细血管膜受损的伤害/损伤之后提供合成的板层小体组合物可以限制初始损伤向肺泡纤维化的有害进展。与含表面活性物质脂质的组合物形成对比,本发明人确定了可在间质和肺泡细胞中起作用的合成的板层小体脂质组合物。
特别地,本发明人显示,用本发明的合成的板层小体治疗减少了纤维化,如通过ASMA和胶原的减少显示的。用本发明的板层小体的治疗合适地构成了异常纤维化状况的新疗法,所述异常纤维化状况包括肺、皮肤、GI、GU、心脏、腹膜、肾、肝中的异常纤维化状况和其他经受纤维化的粘膜状况。与涉及治疗已确定状况的后治疗不同,这种治疗可以是涉及已确定状况的风险的预治疗或围治疗(例如,在观察到纤维化状况的病理之前提供的治疗)。利用绵羊放射性肺损伤模型,本发明人考虑了减少纤维化和肌成纤维细胞的治疗,如通过ASMA测量的。
肌成纤维细胞(MFB)存在于一系列粘膜组织例如皮肤、胃肠道(GI)和泌尿生殖(GU)系统的上皮下区域中。在创伤愈合和组织修复中,肌成纤维细胞再生且数量增加,并且在成功完成后,它们通过凋亡被去除。然而,在若干纤维化疾病中,例如在肝、心脏、肺、腹膜和肾中的纤维化疾病中,再生过程的失败引起持续性的肌成纤维细胞,并促进细胞外(间质)细胞基质(ECM)重塑和生长。这样的重塑和生长是纤维化疾病的标志。当这种重塑发生时,发生可能是不可逆的慢性纤维化状况。慢性纤维化状况通常需要恢复性治疗,而不是预防性治疗。
肌成纤维细胞可以由许多祖细胞产生,所述祖细胞包括内皮和上皮两者来源的细胞。特征上,肌成纤维细胞的标志是α平滑肌肌动蛋白(ASMA或αSMA)的存在。在肺的情况下,肌成纤维细胞也可以直接从间充质干细胞“从头产生”。
此外,使用肺中纤维化的模型系统,本发明人显示,DC-LAMP阳性细胞的密度随着用本发明的板层小体的治疗而降低,降低了组织损伤中的促纤维化反应。
已显示,树突状细胞的存在与一系列状况例如肾移植排斥、间质性肺病和寻常型银屑病中的间质纤维化相关。此外,在急性排斥反应期间髓系树突状细胞的密度可以是慢性变化的长期发展和移植物功能丧失的重要风险因素。树突状细胞溶酶体相关膜糖蛋白(DC-LAMP)是成熟髓系树突状细胞密度的标志物。它被认为在非特异性间质性肺炎中升高。DC-LAMP在寻常型银屑病皮肤中的表达也增加。
相应地,本发明的第一方面提供了一种治疗纤维化或降低促纤维化反应的方法,该方法包括向有相应需要的受试者提供本发明的板层小体的步骤。合适地,促纤维化反应可以在肺、皮肤、GI、GU、心脏、腹膜、肾、肝或其他粘膜中提供。合适地,引起纤维化的状况可以在肺、皮肤、GI、GU、心脏、腹膜、肾、肝和其他粘膜中提供。合适地,提供了哺乳动物受试者中由受损的肺泡-毛细血管膜引起的损伤(损伤风险)的预防性治疗,包括在可导致受损的肺泡-毛细血管膜的损伤之前、与可导致受损的肺泡-毛细血管膜的损伤一起或在可导致受损的肺泡-毛细血管膜的损伤之后向受试者施用治疗有效量的板层小体组合物。
不希望被理论所束缚,本发明人认为所提供的板层小体可以通过降低表面张力有助于肺泡开放,并且还可以有益地调节病理生理学过程的性质和程度,所述病理生理学过程是远端肺中急性炎性和/或进行性纤维化反应的基础。
合适地,在施用板层小体组合物后,由纤维化或促纤维化引起的对受试者的潜在损害的减轻可以通过测量DC-LAMP表达或ASMA来确定。认为这样的减轻不仅仅是板层小体仅仅起替代被消耗的表面活性物质水平的作用。这得到本文讨论的板层小体在辐射损害之前并因此在表面活性物质耗尽之前的预防作用的支持。不希望被理论所束缚,认为本发明的板层小体的作用是通过其穿过细胞膜的能力来提供的(不同于表面活性物质)。合适地,在施用板层小体组合物后,由受损的肺泡-毛细血管膜引起的对受试者的潜在损害的减轻可以通过测量受试者中由此而产生的细胞和基质反应来确定。在本研究中,指示人类对辐射诱导的直接肺损伤的反应的绵羊模型证明,板层小体组合物的提供消除了辐射诱导的肺泡纤维化,并增加了远端肺中表达产生表面活性物质的II型肺细胞的标志物的细胞数量。还认为,纤维化状况的这样的减轻允许本发明的板层小体组合物用于治疗诸如急性肺损伤和急性呼吸窘迫综合征(ARDS)的状况。
根据本发明的第二方面,提供了用于在治疗纤维化或促纤维化反应中使用的板层小体。治疗可以针对风险被预应用或围应用(预防性治疗),而不是基于由纤维化引起的已确定状况的后治疗或基于观察到的由纤维化引起的损害而被应用。合适地,纤维化或促纤维化反应可以在肺、皮肤、GI、GU、心脏、腹膜、肾、肝或其他粘膜中提供。合适地,纤维化或促纤维化反应可以在肺中,并且是由哺乳动物受试者中与受损的肺泡-毛细血管膜相关的损伤引起。合适地,板层小体组合物可以在与受损的肺泡-毛细血管膜相关的伤害/损伤之前、和与受损的肺泡-毛细血管膜相关的伤害/损伤一起或在与受损的肺泡-毛细血管膜相关的伤害/损伤之后提供。如以上讨论的,与表面活性物质的脂质组合物形成对比,认为本发明的合成的板层小体组合物可以穿过肺泡细胞壁,并影响发生在肺泡间质(肺泡壁内结缔组织的薄区)和肺泡细胞内的状况的初始和功能限制性病理。
根据本发明的第三方面,提供了一种板层小体组合物,该板层小体组合物被配制用于通过气道施用至下气道上皮,以预防和治疗由于受损的肺泡-毛细血管膜引起的远端肺损伤,例如由对肺的直接或间接伤害(包括但不限于对下颈部、胸部结构或胸壁的辐照)引起的远端肺损伤。如将理解的,合适地,可以提供组合物以允许治疗皮肤、GI、GU、心脏、腹膜、肾、肝或其他粘膜。
根据本发明的第四方面,提供了一种组合物,所述组合物用于制备用于治疗促纤维化状况或纤维化状况,特别是肺、皮肤、GI、GU、心脏、腹膜、肾、肝或其他粘膜的状况的药物。组合物是合成的板层小体组合物,所述板层小体组合物具有选自磷脂酰胆碱(PC)和胆固醇(Chol)以及至少一种选自磷脂酰甘油(PG)、磷脂酰丝氨酸(PS)或磷脂酰肌醇(PI)的另外的磷脂的至少三种脂质,以提供带负电荷的磷脂。合适地,带负电荷的板层小体具有约-30mv或更大的负电荷。合适地,板层小体被设置尺寸使得其小于或等于250nm、小于或等于200nm、小于或等于150nm、小于或等于125nm,其中测量值与板层小体的直径相关—板层小体被认为基本上是球形的。
合适地,组合物用于制备用于预防和治疗由于受损的肺泡-毛细血管膜引起的远端肺损伤,例如由对肺的直接或间接伤害(包括但不限于对下颈部、胸部结构或胸壁的辐照)引起的远端肺损伤的药物。
远端肺损伤可以由直接肺损伤诸如创伤、脓毒性休克或由辐照引起。后者可以由选择性放射治疗提供,或者可选地辐照可由于意外暴露于辐射引起。胸部辐照可以通过放射治疗引起。胸部放射治疗最通常在乳腺癌和肺癌以及霍奇金病的情况中提供。
例如,合适地,受辐照的肺损伤可在胸膜表面显示出明显的深红色充血,并且触诊显示坚实(firmness)。合适地,受辐照的肺可显示出一致的组织病理学特征,诸如胸膜下、小动脉周(periarteriolar)和支气管周的肺泡内水肿、肺泡纤维化、间质性肺炎和II型肺细胞增生(pneumocyte type II hyperplasia)。
合适地,用板层小体组合物治疗可以使肺泡纤维化最小化或阻止肺泡纤维化的增加。合适地,用板层小体组合物治疗可以使暴露于辐射的受试者中α-平滑肌肌动蛋白(ASMA)表达最小化或阻止暴露于辐射的受试者中α-平滑肌肌动蛋白(ASMA)表达的增加。特别地,用板层小体组合物治疗可以消除损伤诱导的肺泡纤维化并减少ASMA的表达。
合适地,用板层小体组合物治疗可与遍及肺的树突状细胞-溶酶体相关膜蛋白(DC-LAMP)阳性(+ve)细胞数量的增加相关。
不希望受到理论的束缚,本发明人还考虑了当例如通过雾化提供至肺时,板层小体可以作用于导致纤维化状况的病理级联反应,并提供另外的脂质膜来减轻诸如RILI中的纤维化损害。有利地,减轻RILI的方法将允许开发更有效的放射治疗方案。
关于RILI,将肺保护剂诸如表面活性物质以气溶胶方式递送至肺被认为是有利的,因为它提供了更小剂量的肺保护剂的使用,更快速地靶向组织,并且从而使可能发生的副作用最小化。以气溶胶方式递送,例如通过使板层小体组合物雾化,也被认为允许板层小体组合物向肺组织提供的容易性和速度,以预防或治疗RILI。合适地,板层小体组合物可以由非医务人员提供。
基于本发明人所进行的研究,确定了板层小体提供被抑制的纤维化反应的关键结构和功能要求。有利地,本发明的板层小体可以包括以下特征中的至少一个,并且合适地包括以下特征的组合:
ο为阴离子性的,而不是阳离子性的;
ο提供细胞内和/或间质渗透,这有利地通过提供能够进入细胞和/或间质的合适尺寸、基本上球形的板层小体结构,而不是简单的非球形单层表面活性剂/PC来进行;
ο板层小体的磷脂在它们在细胞膜上的分布方面不受限制。
与先前表明磷脂(例如PC)和/或表面活性物可以对纤维化组织提供恢复作用(即提供缓解作用)而不减轻损害的原因或逆转损害的研究形成对比,本发明人确定了通过用板层小体预处理受试者的细胞,板层小体可以提供预防性作用。这是重要的,因为这样的预防性使用可以使促纤维化反应引起的损害最小化,而不是仅仅提供这种损害的影响的减少。
术语“哺乳动物受试者”优选地为人类。在实施方案中,人类可以是经历过肺损伤的受试者或正在经历用于癌症治疗,特别是用于肺癌治疗或主要与吸烟相关的癌症的治疗的辐射的受试者。在实施方案中,受试者是处于纤维化状况的风险或具有促纤维化例如硬化、心房纤维化、心内膜纤维化、关节纤维化、纵膈纤维化、肾源性系统性纤维化(nephrogenic systemic fibrosis)、腹膜后纤维化或硬皮病/系统性硬化的人类。在可选的实施方案中,本发明提供了非人类动物的兽医治疗。
在实施方案中,肺损伤可以由例如创伤或电离辐射损伤例如急性电离辐射损伤引起,例如由在少于1天或2天或更多的若干天的时间内对电离辐射的急性暴露引起。
在实施方案中,辐射暴露可以与任何临床上明显的不利影响不相关。在实施方案中,施用步骤可以在引起纤维化的损害之前或之后进行,合适地在引起纤维化的损害之前或之后的1天、2天、3天或更多天内进行。在实施方案中,施用步骤可以在肺损伤之前或之后(例如电离肺损伤或辐射暴露之前或之后)的1天、2天、3天或更多天内进行。暴露可以是选择的,即用于肿瘤的放射治疗;或是意外的,即工业或军事方面的。
合适地,在暴露于RT,特别是肺部放射治疗之前提供对受试者的预治疗。治疗可以通过雾化的板层小体组合物进行。
合适地,肺损伤(例如由于辐射引起的肺损伤)的治疗可以通过吸入板层小体组合物或板层小体组合物的雾化溶液或者通过任何其他直接施用至下气道的方式而将板层小体组合物直接施用至下气道上皮进行。
合适地,组合物可以被施用至肺泡。合适地,组合物可以被提供至细支气管。
有利地,板层小体组合物可以被直接递送至期望进行治疗或防护辐射的组织。有利地,板层小体组合物可以在每剂量放射治疗之前立即施用或与每剂量放射治疗一起施用(例如在向胸部提供放射治疗的情况下),以及在放射治疗的疗程期间和之后的各种其他时间施用。
本发明还适用于由于电离辐射事件(诸如攻击或事故)而导致的即将发生或最近的辐射暴露,以及在这样的事件之后对背景辐射更长时间的暴露,或适用于在患者处于例如脓毒症或胃内容物吸入的风险的事件之前使用。因此,板层小体组合物可以作为保护性治疗提供。
在实施方案中,板层小体组合物可以包含选自磷脂酰胆碱(PC)和胆固醇(Chol)以及至少一种选自磷脂酰甘油(PG)、磷脂酰丝氨酸(PS)和磷脂酰肌醇(PI)的另外的磷脂的至少三种脂质。在实施方案中,板层小体组合物可以包含选自磷脂酰胆碱(PC)和胆固醇(Chol)以及至少一种选自磷脂酰甘油(PG)、磷脂酰丝氨酸(PS)和磷脂酰肌醇(PI)的另外的磷脂的三种脂质。
有利地,第三组分可以以根据PS优于PG优于PI来选择。
在实施方案中,板层小体组合物可以包含选自磷脂酰胆碱(PC)和胆固醇(Chol)以及至少两种选自磷脂酰甘油(PG)、鞘磷脂(ESM)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)和磷脂酰肌醇(PI)的磷脂的至少四种脂质(组分)。板层小体应被提供使得其具有负电荷。
基于本发明人进行的研究,认为PS、PI和PG中的至少一种应该以三种或更多种(例如四种或五种)脂质(合适地包括PC和Chol以及阴离子性脂质)的组合提供,以促进板层小体制剂/组合物的细胞进入。
合适地,可以用于本发明的磷脂的组合可以包括:
本发明人确定了一种组合物
该组合物没有缩小尺寸以提供平均尺寸小于250nm、优选地小于200nm、优选地小于150nm的具有窄尺寸分布的板层小体,例如,其保持为在板层小体的制备中形成的平均更大的多分散微囊泡(microvesicle),不能有效地进入间质和/或细胞内,并且不能使进入的细胞的促纤维化反应最小化。
为了阐明细胞相互作用,用一种亲脂性非可交换性荧光脂质标记物1,1’-双十八烷基-3,3,3’,3’-四甲基吲哚羰花青高氯酸盐(DiI)对制备的板层小体制剂的制备制剂进行标记。使用细胞外荧光猝灭剂台盼蓝,通过流式细胞术测量细胞相互作用,以区分细胞结合和囊泡内化。这是一种先前描述的标准技术(Sahlin等人,1983;Feldmann等人,2017)。所有变化形式都在HeLa细胞中进行了测试,并且一些变化形式也在A549细胞中进行了测试。所选细胞系作为模型细胞系被采用,以说明板层小体组合物被细胞摄取,即穿过细胞壁,这允许它们在预防纤维化状况中发挥作用。
通过用含有带负电荷脂质的六种、五种、四种或三种脂质(包括胆固醇)制备的组合物/制剂,观察到板层小体组合物/制剂的细胞进入。制剂中的磷脂包括酯化的饱和及不饱和脂肪酸。该实例说明,板层小体制剂通常适于被细胞摄取,即穿过细胞壁。
在实施方案中,组合物可以包含至少五种选自胆固醇、磷脂酰胆碱、磷脂酰甘油、鞘磷脂、磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇的脂质,并且所提供的板层小体组合物具有负电荷。合适地,板层小体包含磷脂酰胆碱和胆固醇。合适地,负电荷可以为至少-30mV。合适地,板层小体的尺寸可以小于250nm,优选地小于200nm,优选地小于150nm,合适地为约125nm。
使用标准加工技术,诸如挤压、双重离心和微流化,使板层小体制剂尺寸缩小。
合适地,本发明的板层小体在电荷方面为阴离子性的,如通过任何测量磷脂囊泡的δ电位的方法确定的。
本领域中将理解哪些脂质带负电荷,并且哪些脂质是中性的,以及哪些是两性离子(在pH 7是中性的)。由板层小体提供的总电荷被认为是由个体脂质的净电荷提供的电荷所提供的。通常,脂质组合物中提供的PS、PI和/或PG越多,由脂质组合物形成的囊泡可能带有的负电荷越多。
合适地,提供带负电荷的磷脂以提供负的程度比-30mV(约10%PS)更大的负电荷,因为这有利地提供了改善的细胞进入,并且板层小体应更稳定。
合适地,磷脂酰胆碱和/或磷脂酰甘油可以构成板层小体组合物的至少约25%、至少约35%、至少约40%至约70%。合适地,磷脂酰乙醇胺、磷脂酰丝氨酸、磷脂酰肌醇和胆固醇可以各自独立地以组合物的至多约15%,合适地以组合物的至多约10%提供。合适地,胆固醇可以以组合物的至少约5%提供。
合适地,磷脂酰丝氨酸可以以组合物的至少10%、15%、20%、25%或至少30%或更高提供。
合适地,板层小体组合物包含最低限度的磷脂酰胆碱和胆固醇以及带阴离子电荷的脂质,其中磷脂酰丝氨酸被确定为特别有利。特别地,板层小体组合物包含约44%-70%的磷脂酰胆碱和/或磷脂酰甘油的组合,按重量计约4%-12%的胆固醇、以及任选地约15%-23%的鞘磷脂、约6%-10%的磷脂酰乙醇胺、约2%-6%的磷脂酰丝氨酸、约2%-4%的磷脂酰肌醇。合适地,板层小体组合物可以包含25%-70%的磷脂酰胆碱和/或磷脂酰甘油的组合、按重量计约4%-12%的胆固醇、任选地约15%-23%的鞘磷脂、至少10%的磷脂酰丝氨酸和任选地约6%-10%的磷脂酰乙醇胺、约2%-4%的磷脂酰肌醇,%wt总计为100%。如将理解的是,虽然约10%的磷脂酰丝氨酸提供合适的负电荷,但其他脂质组合也可以与PS组合使用,或者作为PS的替代物使用以提供负电荷。
不希望受到理论的束缚,认为大部分板层小体可以被提供为具有磷脂酰胆碱—这是板层小体的相对经济的组分。胆固醇为板层小体提供刚性和耐久性。鞘磷脂起支持胆固醇的功能的作用。令人惊讶地确定了带负电荷的磷脂允许板层小体进入细胞并允许板层小体发挥抗纤维化作用。因此,基于对板层小体的组分的这种理解,可以使用合适的脂质组合来实现板层小体是阴离子性而不是阳离子性的功能效果,并提供细胞内和/或间质渗透,有利地,这样的渗透可以通过提供合适尺寸、基本上球形的板层小体结构来提供,这不同于简单的非球形单层表面活性物质/PC,所述合适尺寸、基本上球形的板层小体结构可以进入细胞和/或间质。如所讨论的,电荷和板层小体进入细胞和/或间质的能力可以使用本文的方法来确定。
合适地,板层小体组合物可以包含按重量计约44%-70%的磷脂酰胆碱、约15%-23%的鞘磷脂、约6%-10%的磷脂酰乙醇胺、约2%-6%的磷脂酰丝氨酸、约2%-4%的磷脂酰肌醇和约4%-12%的胆固醇,并且还包含按重量计约0-3%的溶血磷脂酰胆碱。
合适地,板层小体组合物可以包含按重量计约54%的磷脂酰胆碱、约19%的鞘磷脂、约8%的磷脂酰乙醇胺、约4%的磷脂酰丝氨酸、约3%的磷脂酰肌醇和约10%的胆固醇。合适地,板层小体组合物可以还包含按重量计约2%的溶血磷脂酰胆碱。
合适地,板层小体组合物可以被雾化。如本领域将理解的,由雾化器提供的“液滴”的尺寸将决定它们在肺中沉积的位置。合适地,如果液滴大而板层小体小,则每个“液滴”可以包含多个板层小体。对于肺泡沉积(alveolar deposition),即肺的最远端部分,液滴尺寸通常平均为约1.5微米。对于中心沉积(central deposition),即击中气道,通常平均液滴尺寸应该为约3.5微米。合适地,如果板层小体没有被设置尺寸,则可以提供多分散组合物,其中液滴尺寸为约5微米。合适地,板层小体可以在平均尺寸为约100nm的液滴中提供(如将理解的,如果板层小体被认为是球形的,则这样的尺寸是横截面或直径)。合适地,可以提供液滴尺寸,以将板层小体引导至肺中的特定位置,该特定位置合适地与肿瘤或肺伤害的位置相关。可选地,可以提供一系列的液滴尺寸,合适地,所述液滴尺寸在需要时具有较大剂量,以使整个肺暴露于所提供的板层小体。
合适地,滴注和/或雾化可以用作板层小体肺泡递送的合适施用途径。
为了使肺泡递送最大化,具有板层小体的液滴本身可以被提供为具有约1.5微米的平均尺寸。合适地,板层小体可以具有约4微米的质量中值空气动力学直径(MMAD)。合适地,MMAD可以在下一代撞击器中确定。
目前,氨磷汀是美国食品和药物管理局批准的唯一用于防护辐射的药物。作为一种无活性的前药施用,它在正常内皮中被碱性磷酸酶去磷酸化,形成一种清除自由基、诱导细胞缺氧和保护DNA的活性硫醇。虽然几项非随机临床试验显示氨磷汀可以降低放射治疗后肺损伤的严重程度,但由于其有时有严重的副作用,氨磷汀的使用通常限于头颈部癌症患者。
合适地,板层小体组合物可以与另一种纤维化治疗组合提供,其中第二种治疗与板层小体分别提供。合适地,可以提供选自以下的治疗:氨磷汀、褪黑激素或抗氧化剂类似物或代谢物,例如抗氧化剂诸如维生素E、辅酶Q10、α-硫辛酸或维生素C作为活性物质或任何合适的氧自由基清除剂。可以将这样的治疗组合预防性地提供至细胞,以使纤维化的影响最小化。
向气道的施用可以通过吸入或通过气管内、支气管内或支气管肺泡施用进行。
气管内、支气管内或支气管肺泡施用的方法包括但不限于喷雾、灌洗、吸入、鼻吹入(nasal insufflation)、冲洗或滴注,使用药物组合物已经溶解在其中的生理上可接受的组合物作为流体。当在本文中使用时,术语“气管内、支气管或肺泡施用”包括所有形式的这样的施用,由此将组合物应用到气管、支气管或肺泡中,无论是通过组合物的溶液的滴注、通过应用粉末形式的组合物,还是通过吸入作为气溶胶化或雾化的溶液或悬浮液或吸入粉末的组合物(具有或没有添加的稳定剂或其他赋形剂)而使组合物到达气道的相关部分。
支气管或肺泡施用的方法还包括根据本领域技术人员熟知的方法进行支气管肺泡灌洗(BAL),其使用组合物已经溶解在其中的生理上可接受的组合物作为灌洗液,或者通过在支气管镜检查过程中直接应用呈溶液或悬浮液或粉末形式的组合物。气管内施用的方法包括用溶解的组合物的类似溶液或用组合物的悬浮液进行盲探气管冲洗,或含有溶解的组合物或组合物悬浮液的雾化的流体液滴的吸入,所述雾化的流体液滴通过使用任何适于此目的的雾化装置获得。
在保护肺的情况下,肺部递送潜在地允许使用比全身递送更快速地靶向的较小剂量的活性剂,并从而避免全身副作用。此外,剂量问题、靶向问题和副作用问题,通过气溶胶施用肺保护提供了许多与通过相同途径进行大规模疫苗接种情况中提到的相同的优势—即由非医务人员应用的容易性和速度;非侵入性,所述非侵入性导致更高的社会接受度;降低血液传播的感染原(infectious agent)交叉污染的风险;减少医疗废弃物;以及潜在的更低成本。
本发明主要涉及人类受试者的治疗,但是本发明也可以对动物受试者实施以用于兽医目的,所述动物受试者特别是哺乳动物受试者,诸如狗、猫、家畜和马。受试者可以是男性/雄性或女性/雌性,并且可以是任何年龄,包括新生儿、婴儿、少年(juvenile)、青少年(adolescent)、成年或老年受试者。
如本文使用的“电离辐射”包括电磁辐射(诸如X射线辐射和γ辐射)和粒子辐射(包括α、β、中子和质子辐射)两者。电离辐射的特征在于携带足够的能量以使原子和分子电离:以从电中性的原子和分子产生正粒子或负粒子。当穿过物质,例如细胞、组织或生物体时,电离辐射释放能量。当能量足够高时,这可导致对细胞、组织或生物体的急性或慢性损伤。
如本文使用的“治疗”是指给予患者益处的任何类型的治疗,包括延迟紊乱的发作和/或降低紊乱的至少一种症状的严重程度(例如,减少细胞死亡,和/或治疗白细胞减少症、嗜中性粒细胞减少症、单核细胞减少症、淋巴细胞减少症、疲劳等中的一种或更多种)。
如本文使用的术语“一(a)”和“一(an)”是指列举的组分中的“一种或更多种”。本领域普通技术人员将会清楚,单数的使用包括复数,除非另有具体说明。
如本文使用的,术语“有效量”意指将引发肺部组织的或正在寻求的动物的生物学或医学响应的药物或药剂的量。
药物制剂
合适地,板层小体组合物可以根据已知技术配制,用于在药物载体中施用。参见例如,Remington,The Science And Practice of Pharmacy(第9版1995)。在根据本发明的药物制剂的制备中,通常将板层小体组合物与尤其是可接受的载体混合。当然,从与制剂中的任何其他成分相容的意义上说,载体必须是可接受的,并且载体对患者必须是无害的。
适于施用的本发明的制剂可以包含板层小体组合物的无菌水性溶液和非水性溶液。
为实施本发明而制备的板层小体组合物的固体或液体颗粒形式应包括可吸入尺寸的颗粒:即,尺寸足够小以在吸入时通过口和喉并进入肺的支气管和肺泡的颗粒。一般来说,尺寸范围为约1微米至10微米的颗粒在可吸入范围内。包含在气溶胶中的非可吸入尺寸的颗粒倾向于沉积在咽喉中并被吞咽,而气溶胶中非可吸入颗粒的量优选地被最小化。
包含板层小体组合物的液体颗粒的气溶胶可以通过任何合适的手段产生,诸如用压力驱动的气溶胶雾化器或超声雾化器产生。参见例如美国专利第4,501,729号。雾化器是商购可得的装置,其通过使压缩的气体(通常地空气或氧气)加速通过窄的文托利孔口或通过超声搅拌而将活性成分的溶液或悬浮液转化成治疗性气溶胶雾。用于雾化器的合适制剂由在液体载体中的活性成分组成,活性成分占制剂的最多40%w/w,但优选地小于20%w/w。载体通常是水或生理盐水(normal saline)或磷酸盐缓冲盐水(PBS)(并且最优选无菌、无热原的水或生理盐水或PBS)或稀释的水醇溶液(aqueous alcoholic solution),优选地通过添加例如氯化钠制成与体液等渗的,但可以是高渗的。任选的添加剂包括防腐剂(如果制剂不是被制备成无菌的)例如甲基羟苯酸酯(methyl hydroxybenzoate)、抗氧化剂、调味剂、挥发性油、缓冲剂以及表面活性剂。
可通过本发明的方法治疗的受试者是那些经历过直接或间接肺损伤、已经或可能暴露于任何水平的潜在破坏性电离辐射的受试者。例如,受试者可以是已经或可能暴露于50拉德或100拉德、0.5戈瑞或1戈瑞或500毫西弗至100毫西弗的电离辐射或更高的电离辐射的那些受试者。一般认为,辐射损伤的特征在于暴露于损伤性辐射后症状的延迟发作,因此将理解的是,治疗可以在损伤处于早期或潜伏期时以及在显现疾病期间施用。
除非上下文另有要求,否则本发明的每一个方面的优选特征和实施方案加以必要的修改被用于每一个其他方面。
本文本中引用的每一个文件、参考文献、专利申请或专利通过引用以其整体明确地并入本文,这意味着其应该被读者阅读并视为本文的一部分。仅仅是出于简洁的原因,本文中引用的文件、参考文献、专利申请或专利在本文中没有被重复。
提及本文中引用的材料或被包含在本文中的信息不应被理解为承认该材料或信息是公知常识的一部分或在任何国家是已知的。
如本文使用的,冠词“一(a)”和“一(an)”是指一个或多于一个(例如至少一个)该冠词的语法对象。
“约”通常应意指鉴于测量的性质或精度,所测量的量的可接受的误差程度。
贯穿本说明书,除非上下文另有要求,否则术语‘包含/包括(comprise)’或‘包括/包含(include)’或变化形式诸如‘包含/包括(comprises)’或‘包含/包括(comprising)’、‘包括/包含(includes)’或‘包括/包含(including)’应被理解为暗示包括所提到的整数或整数的组,但不排除任何其他整数或整数的组。
现在将参考附图来描述本发明的实施方案,在附图中:
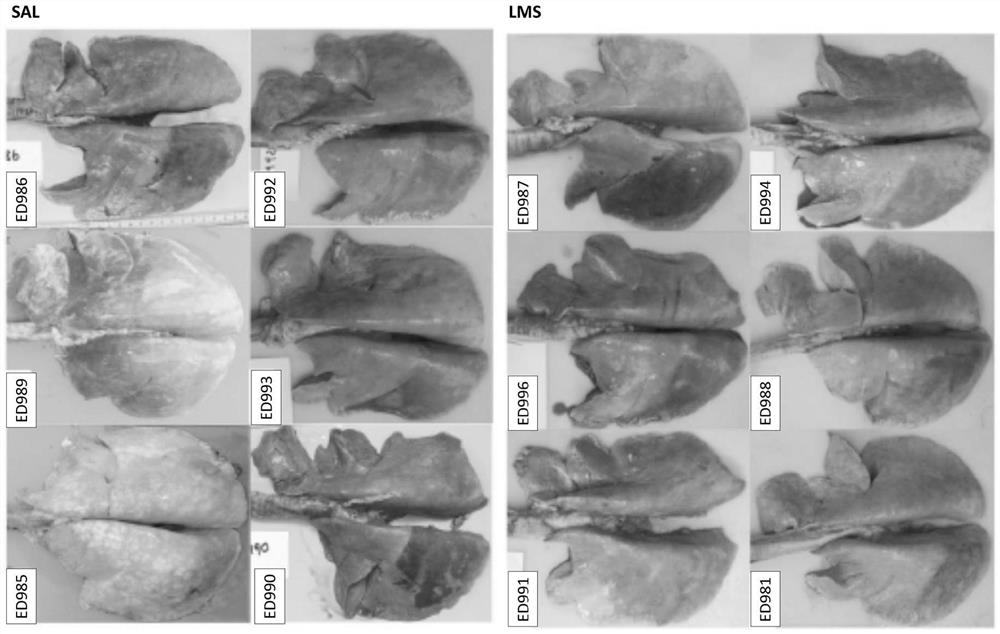
图1:说明了与肺损伤相关的宏观病理学特征,本例中为绵羊中的RILI—提供了从绵羊取出的肺的照片,所述绵羊在以3-4天的间隔向左侧尾侧膈叶递送5次6Gy辐射中的每一次之前,用雾化的盐水(SAL)或板层小体(LMS)处理。反映了计划靶体积(PTV)的边缘的深红色胸膜变色区域在所有肺中清楚明显。虽然每一组的肺的宏观外观没有实质性差异,但是在辐射引起的变色的性质和程度方面,一些绵羊之间有明显变化。
图2:说明了与肺损伤相关的组织病理学特征,本例中为绵羊中的RILI—图(a-c):提供了H&E染色切片的显微照片,说明了绵羊肺由于辐射暴露引起的水肿。水肿可以宏观识别(a),并且常见于胸膜下区域(比例尺5mm)。水肿区域和充气的肺区域之间的边界通常被清晰地划分(b)(比例尺1mm)。还识别出血管周水肿(c)(比例尺100μm)。图(d-f):天狼猩红(picrosirius red)染色切片的显微照片,突显了胶原沉积。图(e)和(f)是来自辐射暴露的肺(比例尺分别为100μm和50μm)的切片图像,且(d)是来自对侧的对照肺(比例尺为100μm)。辐射暴露与胶原区域百分比的增加相关。图(g-i):突显了辐射暴露的肺(h&i,比例尺分别为250μm和50μm)和对侧的对照肺(g)(比例尺250μm)中ASMA表达的显微照片。非辐射暴露的肺中ASMA表达稀少,并且发现在隔尖(septal tip)处和肺泡壁中与肺泡管结合。辐射暴露导致这些区域中ASMA表达增加。
图3:说明了组织病理学定量,其中提供了绵羊肺中与辐射暴露相关的主要组织病理学特征的不知情半定量分析结果的热图表示。上图报告了与左肺相关的发现,而下图报告了与右肺相关的发现。在每个肺中,评估区域进一步细分为后部和前部,反映提交用于评估的组织块(block)的来源。源自左肺后部体积的组织块位于PTV内,并直接暴露于辐射,而源自前部体积的组织块位于PTV颅缘近端,并且应当未直接暴露于辐射。同等地,来自右肺的组织块被鉴定为左肺样品的对侧对照。根据治疗(板层小体(LMS)或盐水(SAL))将图进一步细分,每个单元格的颜色代表组织病理学特征的半定量评分,列在热图中每行的左侧。
图4:说明了天狼猩红染色的定量,其中(a)箱线图描绘了与天狼猩红染色的肺实质切片中存在的胶原的区域的百分比相关的数据,所述肺实质切片源自先前暴露于辐射的绵羊的肺。切片源自左侧尾侧膈肺(diaphragmatic lung)(LL_Post;代表PTV的等中心)、其对侧对照(RL_Post)、来源于PTV的颅缘前部的肺内对照(LL_Ant)以及来自右对侧对照肺的其对应的组织块(RL_Ant)。根据绵羊在辐射暴露前接受的治疗(SAL或LMS),箱线图被进一步分类。(b)箱线图描绘了源自左肺的切片中胶原区域百分比相对于动物体内配对的右肺对侧对照切片的变化倍数(LL/RL)。LMS_CON和SAL_CON是LL_Ant和RL_Ant之间的变化倍数,且LMS_Rx和SAL_Rx是LL_Post和RL_Post之间的变化倍数。只有经盐水预处理的绵羊显示出左侧(辐射暴露的)肺相对于右对侧对照肺的变化倍数的显著增加。
图5:说明了ASMA染色的定量—箱线图描绘了与肺实质切片中存在的ASMA的区域的百分比相关的数据,所述肺实质切片源自先前暴露于辐射的绵羊的肺。切片的来源如图4的图例中以及材料和方法中描述的。
图6:说明了绵羊中与RILI相关的DC-LAMP和抗原Ki-67(Ki-67-一种细胞增殖的标志物)的表达,其中图(a)和(b)是免疫染色切片的显微照片,描绘了来自辐射暴露的(b)和非辐射暴露的(a)对侧对照肺的DC-LAMP表达(比例尺100μm)。在对照肺中,DC-LAMP由肺泡角中的圆形细胞表达,该细胞被认为是II型肺细胞。这些细胞遍及远端肺实质中均匀间隔排列。在辐射暴露的肺中,可以清楚地鉴定出在肺泡壁衬里的表达DC-LAMP的细胞簇,伴随着肺泡区域中表达的减少(未示出)。在可以鉴定出表达DC-LAMP的细胞簇的位置(c),我们通过对相邻连续切片(d)进行免疫染色以描绘Ki67表达来评估这些细胞是否在增殖(比例尺100μm)。在许多情况下,DC-LAMP表达的簇与明显的细胞增殖不相关。事实上,描绘DC-LAMP表达的图(e)(比例尺100μm)和描绘Ki67表达的(f)(比例尺100μm)的连续切片的显微照片说明,DC-LAMP和Ki67表达之间有时是一致的(*),以及DC-LAMP表达可以在Ki67表达不存在的情况下发生的事实(o),并且反之亦然(#)。
图7:说明了DC-LAMP染色的定量,其中提供了描绘与以下相关的数据的箱线图:(a)DC-LAMP表达的区域的百分比,(b)表达DC-LAMP的颗粒的计数(DC-LAMP计数),(c)表达DC-LAMP的颗粒的平均尺寸(DC-LAMP尺寸),以及(d)应用于实质切片中存在的表达DC-LAMP的细胞的最近邻距离(NND)中值,所述实质切片源自先前暴露于辐射的绵羊肺。切片的来源如图4的图例中以及材料和方法中描述的。
图8:说明了通过箱线图提供的Ki67染色的定量,该箱线图描绘了与来源于先前暴露于辐射的绵羊的肺实质切片的图像视野中存在的表达Ki67的细胞的平均数量(Ki67计数)相关的数据。切片的来源如图4的图例中以及材料和方法中描述的。
图9:说明了孵育2小时后A549细胞(A)和HeLa细胞(B)中板层小体制剂的总细胞结合和内化。将DiI荧光的中值针对DOPC/Chol处理的细胞的DiI的中值归一化。红色条(每种组合物的左侧条)代表总的DiI荧光(即总的结合的囊泡相关的(内化的和吸附到细胞表面的),蓝色条(每种组合物的右侧条)代表台盼蓝猝灭后的荧光减少(即被细胞内化的)。结果显示为具有SD的平均值(n=2),例外是LMS-611的n=3。
详述
在本说明书中,描述了三种模型系统:
-放射性肺损伤(RILI)模型;
-TGF-β1模型系统,其用于研究促纤维化介质和筛选对抗这样的促纤维化介质的候选物的方法。如下文进一步讨论的,发现TGF-β1的表达与辐射暴露后6个月的肺纤维化相关。因此,TGF-β1表达被认为是候选物介导和减少纤维化或促纤维化介质的功效的指示性量度。
-细胞进入模型。
选择RILI模型作为人类肺间质针对损害的纤维化反应的经验证的模型(validated model)。如本领域已知的,该模型允许评价与放射性肺损伤相关的分子机制和候选对策的功效筛选。
此外,该模型允许研究纤维化的发展,并进一步认识引起肺泡毛细血管膜有效破坏的间质性肺病的状况,例如轻度肺炎或胸腔积液。
RILI模型
为了提供肺损伤的模型,十二只商业来源的成年Shetland绵羊(体重:38.5kg[33.0-43.0]中值[范围];6只雌性和6只去势的雄性)被纳入所描述的研究。通过耳标识别动物。在研究期间,将动物圈养,并在其他方面按照农场动物畜牧学的正常标准进行维持。在研究开始前,对这些绵羊进行驱虫处理。将绵羊随机分配到两个性别匹配的处理组之一。
为了确认没有预先存在的肺部疾病,并收集基线样品以针对其判断动物中的变化,进行了初步基线检查(BBr1),包括气体麻醉下的支气管镜可视化、支气管肺泡灌洗和支气管刷活检。在支气管肺泡灌洗液细胞学检查未能符合正常界限并指示寄生物感染(嗜酸性粒细胞%>7.5%)的情况下,在任何进一步参与实验方案之前,对绵羊再次进行驱虫处理,并确认结果在正常范围之内。此后,以每两周一次的间隔进行另外两次基线检查(BBr2和BBr3),包括支气管刷活检取样。在这些时间点还进行体重和直肠温度的测量。在最后一次基线评估(BBr3)后至少两周,对绵羊进行再次麻醉,并将其置于胸骨卧位,以便于采集胸部计算机断层扫描图像,用于后续的辐射处理计划。在最后一次辐射处理(t0)后,密切监测绵羊的不良反应的任何迹象。在t0+11d和t0+21d,将绵羊再次麻醉,并以与初步基线评价期间相同的方式进行支气管刷活检。在t0+23d,通过过量麻醉剂杀死绵羊,并进行尸检检查。
在辐射处理期间,以分次方案递送总剂量30Gy。这包括在两周的时间段内(间隔3-4天)在五个单独的时机中的每一个时机向左侧尾侧膈肺叶的定义的计划靶体积(PTV)递送6Gy。
支气管肺泡灌洗液收集
将支气管镜(FG-15W型;Pentax UK Ltd.)楔入右顶叶的节段支气管中。使用两份20ml等份试样的PBS从该肺段收集支气管肺泡灌洗液(BALF)。将BALF样品放置在无菌管中,并保持在冰上,直到随后的分析。取出5毫升BALF,并以400g离心7分钟以分离出细胞级分。将所得的沉淀物重新悬浮在无菌磷酸盐缓冲盐水(PBS)中,并对总细胞数进行计数,然后进行随后的用于鉴别细胞学的离心涂片的制备。使用Neubauer血细胞计数器对细胞进行计数,并且数值以每毫升BALF表示。制备细胞离心载玻片,并使用利什曼染色法来染色,以对500个细胞进行鉴别计数。根据标准形态学标准将细胞分类为嗜中性粒细胞、巨噬细胞、嗜酸性粒细胞、淋巴细胞或肥大细胞。
支气管刷活检
在基线评估的每一个时机中,从肺的三个独立区域的每一个获得三个支气管刷活检样品(总计n=9)。样品源自左侧尾侧膈肺叶(LCD)、右侧尾侧膈肺叶(RCD)内的支气管,并且还源自右前肺区域内的支气管。每一个时机都非常小心(通过手动绘图和参考视频记录),以避免对先前已进行过支气管刷活检的支气管上皮的任何区域取样。在t0+11d和t0+21d,将绵羊以与初步基线评价期间相同的方式进行支气管刷活检。
尸检
通过静脉内注射巴比妥酸盐进行安乐死后,按照标准尸检方案小心地从尸体取出心脏和肺。通过肺动脉用2-3升的PBS灌注肺循环,然后解剖出心脏。然后对肺部进行拍照,然后进行进一步处理。
膨胀固定(inflation fixation)
将肺组织通过气道滴注10%中性缓冲福尔马林固定。将气管与一个固定剂贮库相连,并且允许固定剂流动,直到建立肺的“自然轮廓”。然后使肺漂浮在相同固定剂的罐中,并在3.0kPa的恒定压力进行膨胀固定持续7天。
宏观组织取样
固定后,从每个膈叶的尾极开始,沿着横向平面小心地将每个肺切成15个1cm厚的组织切片。然后将这些切片以连续的顺序排列以进行拍摄,然后从每个连续切片中选择代表性组织块并从周围肺组织中仔细解剖出。捕获切片及其被选组织块原位的另外的照片图像,以记录每个组织块的空间来源。该后一步骤是通过参考先前从同一动物收集的CT图像来记录每个组织块相对于辐射场的位置的必要前提。然后将组织块提交用于标准组织学处理和石蜡包埋。
组织块选择
鉴定并选择代表计划靶体积的等中心的来自左侧尾侧膈肺的福尔马林固定石蜡包埋(FFPE)组织块,以及来自右对侧对照肺的对应组织块。此后,这些组织块分别标记为LL_Post和RL_Post(“LL”和“RL”分别代表左肺和右肺,并且“Post”代表后部)。另外的FFPE组织块来源于PTV的颅缘前部(14.5mm[9.7-23.0])(LL_Ant)以及来自右对侧对照肺的其对应组织块(RL_Ant)。
组织化学染色和免疫组织化学染色
用苏木精-伊红(H&E)和天狼猩红对从上述组织块切下的切片进行染色,以及用对以下抗原特异性的抗体进行免疫染色:ASMA、DC-LAMP和Ki67蛋白。使用标准免疫组织化学方法对所有载玻片进行染色,其中使用甲醇中的3%H
用PBS+0.5%吐温80中的10%正常山羊血清(Sigma G9023)阻断ASMA非特异性结合。将一抗单克隆ASMA(Sigma A2547)和正常小鼠IgG同种型对照(Sigma M5284)在封闭缓冲液中稀释至1μg/ml,并在室温孵育30分钟。使用生物素化的山羊抗小鼠IgG(Vector BA-2001)和链霉亲和素过氧化物酶聚合物(Sigma S-2438),然后用DAB底物(Vector SK-4100)和苏木精复染进行检测。
用PBS+0.05%吐温20中的3%BSA(Sigma A3733)阻断Ki67非特异性结合。一抗单克隆抗Ki67克隆MIB-1(Dako M7240)和正常小鼠IgG同种型对照(Sigma M5284)稀释至1μg/ml,在室温孵育45分钟。使用生物素化的山羊抗小鼠IgG(Vector BA2001)和链霉亲和素过氧化物酶聚合物(Sigma S-2438),然后用DAB底物(Vector SK-4100)和苏木精复染进行检测。
用PBS+0.2%吐温80中的4%正常兔血清(Sigma R9133)阻断DC-LAMP非特异性结合。将一抗DC-LAMP/CD208(2BScientific DDX0191P-50)和正常大鼠IgG同种型对照(Serotec MCA1125R)在封闭缓冲液中稀释至2.5μg/ml,并在4℃孵育过夜。使用生物素化的山羊抗大鼠IgG(Vector BA4001)和链霉亲和素过氧化物酶聚合物(Sigma S-2438),然后用DAB底物(Vector SK-4100)和苏木精复染进行检测。
支气管刷细胞因子表达
支气管刷活检样品使用细胞学刷(Conmed Endoscopic Technologies152R)收集,通过200μl宽孔吸管端(Star Lab E1011-8000)搅动到1ml冷无菌PBS(Sigma D8537)中,并以10,000g离心5分钟。将沉淀物重悬于含有1%β巯基乙醇的RLT缓冲液(Qiagen 74106)中,并在-80℃储存直至提取。将所有样品运行通过Qiashredder柱(Qiagen 79656),并且RNA提取使用RNeasy微型试剂盒(Qiagen 74106)进行,其中DNA酶处理使用无RNA酶的DNA酶套装(Qiagen 79254)进行。在Nanodrop上对RNA进行定量,并且在Agilent Tapestation上通过RNA screentape(Agilent 5067-5576)进行质量检查。使用随机六聚体引物,用Transcriptor第一链cDNA合成试剂盒(Roche 04 896 866 001)从400ng RNA制备cDNA。定量实时PCR使用Lightcycler 480用LightCycler 480Sybr Green I Master(Roche 04 887352001)中的2.5μl cDNA和特异性引物进行。进阶相对定量(advanced relativequantification)使用Lightcycler 480SW1.5程序来计算。每种基因的标准曲线从汇集的绵羊(ovine)肺泡巨噬细胞cDNA产生。解链曲线分析显示所有样品均为单一峰。PCR效率在1.8至2.1的范围中。qPCR条件和参考引物组(12-15)在表1_**qPCR条件**和表2_**qPCR引物组**中规定。
半定量组织病理学评价
一名病理学家(SHS)检查了减化的子集(仅用盐水处理),以获得初步的组织病理学结果,以为进一步的分析提供信息,而另一名病理学家(JDP)对初步分析的结果和载玻片的来源不知情。所有H&E染色切片在全载玻片扫描仪(Nanozoomer,Hamamatsu,Japan)上扫描,以获得放大倍数为×40的全载玻片图像(WSI)。然后,这些切片由对切片的具体身份不知情的兽医病理学家(Dr del-Pozo)进行详细检查。在其中鉴定了主要病理学特征的初步评估后,开发了半定量评分系统,以获取每种特征在不同切片中的发生率和程度。简而言之,为了对病变的严重程度进行评分,每个切片被分配范围从0(不存在)、1(轻度)、2(中度)到3(严重)的评分。通过分配估计的所涉及表面%对纤维化进行评分(注意,该评分没有考虑严重程度,在所有情况中,受影响区域中的严重程度均为轻度)。对三个变量,即肺细胞II型细胞增生和异型性以及上皮异型性进行了定性评分,即存在或不存在。
定量组织学分析
使用Hamamatsu NDP.view2查看器软件,可以在马松三色染色切片中清楚地鉴定和注释肺泡水肿区域。通过使用徒手画的区域工具(freehand region tool),描画每个组织切片的区域的轮廓,被大的(软骨)气道和相关血管所占据的区域一样地处理。最后,还对每一个切片的被肺泡水肿占据的区域进行注释。将测量的注释保存至文件,并计算被水肿占据的‘实质’的百分比(水肿区域
在ImageJ中,使用NDPITools自定义提取为TIFF/mosaic插件将每个ndpi图像文件提取为多张TIFF图像。来自H&E染色切片的WSI以分辨率x20提取,并且其余的WSI以分辨率x40提取。然后从这些提取文件的随机选择中手动选择包含实质(包括不大于呼吸性细支气管的气道)的图像视野。然后使用ImageJ递归TiffConvert宏结合(engage)生物格式导出器功能,将这些文件转换成OME-TIFF。
将分形分析应用于H&E染色切片,以评估远端肺的形态学。在可得的情况下,从每个切片(LL_Ant、LL_Post、RL_Ant和RL_Post)随机选择100张H&E染色图像。在可得图像少于100张的五个情况中,选择了92张、78张、49张、90张和56张图像。然后使用递归TiffConvert宏结合生物格式导出器功能,将实质图像转换成OME-TIFF。然后以类似于Andersen等人(2012)所描述的方式,使用imageJ功能将这些经转换的文件处理成二值图像,并使用计算分形盒维数(D
使用宏批量处理实质的x40 OME-TIFF文件,所述宏使用颜色去卷积(devolution)插件来检测天狼猩红染色切片中红色染色的胶原区域、ASMA和DC-LAMP免疫染色切片中二氨基联苯胺(DAB)染色的区域、以及Ki67免疫染色切片中DAB染色颗粒(>200像素
统计分析
使用Kolmogorov-Smirnoff检验对数据的正态分布进行初始评估。在必要的情况下,应用数据转换来使分布正态化,并且在这样的转换失败的情况下,应用秩序转换(arank-order transformation),然后进行评估。对于重复测量数据,拟合了一般线性模型,在该一般线性模型中,针对时间和实验处理(板层小体组合物(LMS)、SAL),评价了辐射暴露的肺段和对侧对照肺段中的反应。嵌套在处理中的绵羊身份被认为是设计中的随机因素。
为了分析组织病理学和免疫组织化学数据,对两个独立变量(肺、处理)对所讨论的变量的影响进行了一般线性模型双因素方差分析。肺包括四个水平(LL_Ant、LL_Post、RL_Ant、RL_Post),并且处理包括两个水平(板层小体组合物、SAL)。
结果
没有记录到由于气溶胶递送或与暴露于辐射相关的不良影响。在每个时间点,对绵羊称重并记录直肠温度。
将体重数据进行秩转换,并通过具有一个因素重复测量的双因素ANOVA进行分析。处理(LMS、SAL)在0.05显著性水平是统计学显著的。处理的主效应产生的F比值为F(1,82)=6.32,p=0.031。时间的主效应产生的F比值为F(9,82)=1.58,p=0.136,表明对体重没有显著影响。处理*时间交互作用是显著的,F(9,82)=25.10,p=0.001,突出了从Rx1开始仅LMS处理的绵羊的体重增加。
将温度数据类似地进行秩转换,并通过具有一个因素重复测量的双因素ANOVA进行分析。处理(LMS、SAL)和时间在0.05显著性水平都不是统计学显著的。处理的主效应产生的F比值为F(1,82)=2.09,p=0.178,且时间的主效应产生的F比值为F(9,82)=1.19,p=0.313—两者都表明对体温没有显著影响。处理*时间交互作用是显著的,F(9,82)=3.31,p=0.002,突出了从基线2和3起仅盐水处理的绵羊的体温增加。
虽然在实验方案期间的所有时间体温都保持在正常限值内,但在基线2和3观察到了小的但是显著的增加。因为这可能指示亚临床现象,所以这些时间点的数据被弃用。替代地使用在第一基线评价时获得的数据作为所选基线时间点。
根据支气管刷活检细胞因子表达,将IL1β、TGFβ和IL8相对于ATP酶的基因表达水平分别进行log
处理和时间对源自RCD或LCD的样品中Log10 IL1β或秩转换的TGFβ表达水平均无显著影响,并且这些项目之间无显著交互作用。类似地,对于源自RCD的样品,处理和时间对Log10 IL8表达水平均无显著影响,并且这些项目之间无显著交互作用。然而,对于源自LCD的样品,虽然处理没有显著影响,但时间对Log10 IL8表达水平确实具有显著影响(p=0.030)—反映了在时间点4的表达降低。这些项目之间没有显著交互作用。
尸检时,由于深红色变色,覆盖计划靶体积的胸膜表面可容易地识别(图1)。触诊时,下方肺物质(lung substance)感觉更坚硬,并且在一个实例中研究时,当连接至大体积校准注射器时,受影响的肺体积未能适当地膨胀。
根据组织病理学评价,在所有辐射处理的肺中注意到的主要实质异常为胸膜下、小动脉周和支气管周肺泡内水肿(图2),特征在于小动脉周和肺泡内均质、蛋白质物质的积聚,偶尔具有纤维状物质(纤维蛋白),和嗜酸性污迹物质(纤维蛋白)的聚集。这种变化与肺泡内巨噬细胞数量的增加相关,在这些区域中,肺泡内巨噬细胞的特征为泡沫状细胞质。此外,存在肺泡纤维化的证据,特征在于肺泡壁由于苍白的嗜酸性纤维状物质沉积的轻度增厚,间质性肺炎包括肺泡壁通过少量淋巴细胞和浆细胞的浸润,分散的II型肺细胞增生和偶尔的异型性,核:质比增加,顶端起泡,轻度多形性,并且核具有细点状染色质和小的核仁。
与气道相关的辐射引起的异常包括淋巴细胞和浆细胞的轻度粘膜下浸润,以及支气管和细支气管上皮异型性,类似于对肺细胞II型细胞所描述的。在少数切片中注意到的其他组织病理学异常涉及寄生物肉芽肿,所述寄生物肉芽肿被解释为与处理不相关。
组织病理学评估的结果在图3中描绘。组织病理学评估的半定量和定性方面的统计分析包括对有序数据进行排序,并对排序后的数据(根据组(LMS、SAL)、肺(LL、RL)和节段(Ant、Post)进行分类)进行单因素ANOVA。Tukey成对比较表明,对于用盐水处理的绵羊,辐射暴露的肺相对于同一绵羊的未暴露的对照肺显著增加的特征包括肺泡内巨噬细胞的数量、肺泡水肿的程度、间质性肺炎和II型肺细胞增生的程度、以及支气管周炎症和动脉周炎症的程度。用本发明的板层小体组合物进行预处理显著减轻了辐射引起的间质性肺炎的程度。
定量组织化学和免疫组织化学结果
包括远端肺实质水肿的组织病理学异常的证据提出了局部肺顺应性和因此肺泡区域形态计量学受到影响的可能性。在这一情况中应用分形分析。如Porzionato A,Guidolin D,Macchi V,Sarasin G,Grisafi D,Tortorella C,等人Fractal analysis ofalveolarization in hyperoxia-induced rat models of bronchopulmonarydysplasia.Am J Physiol Lung Cell Mol Physiol.2016;310(7):L680-8.中表明的,测量结构细节随着放大倍数、比例或分辨率的增加的增加率的分形维数,可以用于表征肺泡壁形成的空间模式。
将H&E染色的载玻片扫描成数字图像,并使用NDPITools自定义提取为TIFF/mosaic插件将每个.ndpi图像文件提取为多张x20 TIFF图像。手动删除非实质图像,并对这些文件进行随机选择。在可得的情况下,随机选择100张图像—如果可得图像少于100张,则选择所有图像。然后使用递归TiffConvert宏结合生物格式导出器功能,将实质图像转换成OME-TIFF。然后,使用imageJ功能将这些经转换的文件处理成二值图像。最后,使用计算分形盒维数(D
对于每只绵羊,确定每个肺段的平均值。对两个独立变量(肺、处理)对平均D
认为这些结果表明,直接暴露于辐射与D
计算每个马松三色染色切片中被肺泡水肿占据实质的百分比(水肿区域%)。对两个独立变量(肺、处理)对水肿区域%秩数据的影响进行双因素方差分析。肺在0.05显著性水平是统计学显著的。肺的主效应产生的F比值为F(3,40)=39.76,p=0.000,表明LL_Ant(M=21.96,SE=1.82)、LL_Post(M=41.42,SE=1.82)、RL_Ant(M=18.13,SE=1.82)和RL_Post(M=16.50,SE=1.82)之间的显著差异。处理的主效应产生的F比值为F(1,40)=0.57,p=0.456,表明处理的影响不显著,LMS(M=25.19,SE=1.29)和SAL(M=23.81,SE=1.29)。交互作用效应不显著,F(3,40)=0.80,p=0.503。综合来看,认为这些结果表明,直接暴露于辐射与水肿区域%的显著增加相关。这些结果与使用不知情半定量评分方案获得的结果一致。
使用天狼猩红染色使得能够定量肺泡纤维化的程度。
先前未暴露于辐射的肺中的天狼猩红染色明显遍及肺泡隔(alveolar septa)(图4)。在肺泡壁中,最强的染色呈现为长度和厚度可变的波浪形丝状纤维延伸形式。隔嵴(septal crest)和毗邻肺泡管的肺泡壁通常特征为更加弥散的染色,其中个体纤维表现为被梳理开成亚单位原纤维(fibril)。在已经暴露于辐射的肺中,存在于增厚的肺泡隔中的纤维更常表现为被梳理开,提供一种染色更丰富的总体主观印象。在来自辐射暴露的肺的切片中,视野之间的染色程度方面通常存在大幅变化,一些区域表现为与来自对照肺切片的染色程度相同。
对考察源自左肺辐射暴露区域(LL_Post)、其对侧对照(RL_Post)、以及左肺非辐射暴露区域(LL_Ant)和其对侧对照(RL_Ant)的肺切片中被胶原(红色)占据的肺实质的区域%的数据进行了分析。最高值存在于用盐水预处理的绵羊的辐射暴露的肺中。对两个独立变量(肺、处理)对胶原(天狼猩红)区域%秩的影响进行双因素方差分析。肺在0.05显著性水平是统计学显著的。肺的主效应产生的F比值为F(3,40)=5.72,p=0.002,表明LL_Ant(M=3.685,SE=0.750)、LL_Post(M=7.787,SE=0.750)、RL_Ant(M=5.562,SE=0.750)和RL_Post(M=6.751,SE=0.750)之间的显著差异。处理的主效应产生的F比值为F(1,40)=1.51,p=0.227,表明处理的影响不显著,LMS(M=5.509,SE=0.530)和SAL(M=6.429,SE=0.530)。交互作用效应(无序的)是显著的,F(3,40)=4.53,p=0.008,表明肺的影响取决于处理。检查对于用盐水(SAL_Rx)或LMS(LMS_Rx)预处理的绵羊,辐射暴露的肺中存在的胶原区域%相对于其对侧对照的变化倍数,以及对于用盐水(SAL_CON)或LMS(LMS_CON)预处理的绵羊,非辐射暴露的肺中存在的胶原区域%相对于其对侧对照的变化倍数确定,在SAL_Rx组中观察到最大的变化倍数。对变化倍数相对于组的单因素ANOVA表明,SAL_Rx组的变化倍数显著大于任何其他组的变化倍数(P=0.001)。其他组的变化倍数彼此之间没有显著差异。
在先前未暴露于辐射的肺中,ASMA表达在毗邻肺泡管的次隔嵴尖端以及与导管相似地相邻的肺泡壁内是明显的(图5)。对于辐射暴露的肺,相同的一般表达模式但区域增加,是明显的。
确定了每个切片中被ASMA阳性染色的细胞占据的显微镜视野的平均区域百分比。对两个独立变量(肺、处理)对Log10 ASMA区域%的影响进行双因素方差分析。肺在0.05显著性水平是统计学不显著的。肺的主效应产生的F比值为F(3,40)=1.26,p=0.303,表明LL_Ant(M=0.1805,SE=0.0717)、LL_Post(M=0.3261,SE=0.0717)、RL_Ant(M=0.3180,SE=0.0717)和RL_Post(M=0.3638,SE=0.0717)之间无显著差异。处理的主效应产生的F比值为F(1,40)=28.45,p=0.000,表明处理的影响显著,LMS(M=0.1060,SE=0.0507)和SAL(M=0.4882,SE=0.0507)。交互作用效应未达到显著性,F(3,40)=2.58,p=0.067。
探索了用SAL预处理的绵羊和用LMS预处理的绵羊的被胶原(天狼猩红)占据的区域%与被ASMA占据的区域%之间的关系。在拟合回归模型时,使用ASMA区域%作为反应变量,天狼猩红区域%作为连续预测因素,并且处理(LMS或SAL)作为类别预测因素,表明两条回归线之间的垂直距离的处理系数非常显著(p=0.000)。通过在模型中包括交互作用项目天狼猩红区域%*治疗,检查到两个组的关系的斜率显示出是相似的观察结果。这证实了交互作用不显著(p=0.833)。
在先前未暴露于辐射的肺中DC-LAMP表达在最常位于相邻肺泡壁交叉处的大的甚圆的细胞(large well-rounded cell)中是明显的(图6)。它们的外观和位置与其推测为II型肺细胞的身份一致。这些细胞遍及实质规则地排列。相比之下,在辐射暴露的肺中,表达DC-LAMP的细胞通常成簇排列。虽然簇之间的区域很大程度上缺乏在对照肺中观察到的规则的表达阵列,但是当在相邻肺泡壁的交叉处鉴定出细胞时,它们表现为比在对照肺切片中观察到的大得多。增生的簇包含在肺泡壁衬里的连续的、通常是圆形的但有时被拉长或扁平的细胞。虽然不是绝对的发现,但簇通常位于呼吸性细支气管和/或肺泡管附近。
ImageJ宏程序被设计为测量每个切片的被DAB染色占据的区域百分比(区域%)、给定尺寸(150像素
对两个独立变量(肺、处理)对秩转换的平均中值DC-LAMP NND的影响进行了双因素方差分析。肺在0.05显著性水平是统计学显著的。肺的主效应产生的F比值为F(3,40)=47.92,p=0.000,表明LL_Ant(M=17.83,SE=1.95)、LL_Post(M=8.67,SE=1.95)、RL_Ant(M=36.25,SE=1.95)和RL_Post(M=35.25,SE=1.95)之间的显著差异。处理的主效应产生的F比值为F(1,40)=0.36,p=0.554,表明处理的影响不显著,LMS(M=25.08,SE=1.38)和SAL(M=23.92,SE=1.38)。交互作用效应显著,F(3,40)=5.66,p=0.002,表明肺影响取决于绵羊接受了何种处理。综合来看,辐射暴露引起直接暴露的肺中DC-LAMP NND的降低,并且用LMS预处理也与非辐射暴露的左肺(LL-Ant)中的DC-LAMP NND降低相关。
表达Ki67的细胞在先前未暴露于辐射的肺中仅很少地观察到,并且不同地存在于间隔壁(septal wall)或肺泡空气空间中。增殖的细胞在先前暴露于辐射的肺中更通常地被鉴定出。偶尔这些细胞表现为与表达DC-LAMP的细胞共定位(图6)。表达Ki67的细胞也可以在血管周筋膜和间质中鉴定出。
双因素ANOVA(表1)指示了显著的(P=0.000)肺影响、不显著的处理影响(P=0.221)和显著的交互作用效应(P=0.034),表明肺影响取决于绵羊接受了何种处理。
表1:双因素ANOVA统计的总结,检查了肺(四个水平:LL_Ant、LL_Post、RL_Ant、RL_Post)、处理(两个水平:LMS、SAL)两个因素及其交互作用(肺*处理)(总自由度=40)对胶原区域%、ASMA区域%、DC-LAMP染色区域%、DC-LAMP阳性颗粒的数量和尺寸、DC-LAMP阳性颗粒之间的最近邻距离(NND)以及Ki67阳性颗粒的数量的影响。F比值和P值在因素栏中描述,并且每个因素水平的拟合平均值(SE平均值)在水平栏中给出。为清楚起见,后者仅在相关因素影响显著时示出。
对两个独立变量(肺、处理)对DC-LAMP阳性染色的区域百分比(区域%)、给定尺寸(150像素
双因素ANOVA(表1)指示了不同肺段之间的平均胶原百分比存在显著差异(P=0.002)。虽然处理的影响不显著(P=0.227),但交互作用效应显著(P=0.008),表明肺的影响取决于处理。检查对于用盐水(SAL_Rx)或LMS(LMS_Rx)预处理的绵羊,辐射暴露的肺中存在的胶原区域%相对于其对侧对照的变化倍数,以及对于用盐水(SAL_CON)或LMS(LMS_CON)预处理的绵羊,非辐射暴露的肺中存在的胶原区域%相对于其对侧对照的变化倍数确定,在SAL_Rx组(图4b)中观察到的变化倍数显著超过在任何其他组中观察到的变化倍数(P=0.001)。
ASMA表达:双因素ANOVA(表1)指示了不显著的肺影响(P=0.303)、非常显著的处理影响(P=0.000)和不显著的交互作用效应(P=0.067)。探索了被胶原(天狼猩红)占据的区域%和被ASMA占据的区域%之间的关系,并能够证明两个组的显著相关性(对于SAL,P=0.029,并且对于LMS,P=0.009)。
对两个独立变量(肺、处理)对Log10 Ki67计数%的影响进行双因素方差分析。肺在0.05显著性水平是统计学显著的。肺的主效应产生的F比值为F(3,40)=7.75,p=0.000,表明LL_Ant(M=1.1208,SE=0.0755)、LL_Post(M=1.3704,SE=0.0755)、RL_Ant(M=0.9011,SE=0.0755)和RL_Post(M=0.9589,SE=0.0755)之间的显著差异。处理的主效应产生的F比值为F(1,40)=1.55,p=0.221,表明处理的影响不显著,LMS(M=1.1347,SE=0.0534)和SAL(M=1.0409,SE=0.0534)。交互作用效应显著,F(3,40)=3.19,p=0.034,表明肺影响取决于绵羊接受了何种处理。
在本研究中使用了绵羊模型系统。提出了这一模型展示出与预期将在人类中观察到的类似的发现。在本研究中,与肺辐照相关的一致的组织病理学特征是肺泡内水肿、肺泡纤维化、间质性肺炎和II型肺细胞增生,这些特征在首次暴露于辐射后37天内(最后一次暴露后23天内)发展。虽然在回顾放射治疗后4-12周死于肺炎的人类的尸检研究中对辐射对人类肺部的最早影响的观察是不可得的Gross(Gross NJ.Pulmonary effects ofradiation therapy.Ann Intern Med.1977;86(1):81-92),但也发现肺泡隔增厚伴水肿、细胞浸润和结缔组织沉积(laying down of connective tissue),以及肺泡上皮细胞的异型性、增生和脱落以及透明膜的存在。肺泡隔纤维化的早期出现不是孤立的发现。事实上,Jennings&Arden(Jennings FL,Arden A.Development of radiation pneumonitis.Timeand dose factors.Arch Pathol.1962;74:351-60)发现,在一些情况下,辐射暴露后少于30天,可以观察到肺泡隔纤维化。Bennett等人(Bennett DE,Million RR,AckermanLV.Bilateral radiation pneumonitis,a complication of the radiotherapy ofbronchogenic carcinoma.(Report and analysis of seven cases with autopsy).Cancer.1969;23(5):1001-18),在分析7例尸检中(其中放射治疗后双侧放射性肺炎是首要或主要的促成死亡的原因)发现其中5例的肺泡隔纤维化是显著特征,这些患者在放射治疗完成后40天和95天之间死亡。
尽管与死于放射性肺炎的患者共有病理学方面,但本研究中的绵羊并未因辐射暴露而表现出临床上明显的不良反应。认为这是本研究中的分次剂量方案和靶向的体积的作用。事实上,先前已经显示,如果提供足够的剂量和靶向的肺体积,绵羊确实会发生在人类中观察到的典型的放射性肺炎(Ohkuda K,Abe Y,Ohnuki T,Koike K,Watanabe S,NittaS,等人Effects of irradiation on the pulmonary vascular fluid and proteinexchange.The Tohoku journal of experimental medicine.1982;138(3):309-12;Perkett EA,Brigham KL,Meyrick B.Increased vasoreactivity and chronicpulmonary hypertension following thoracic irradiation in sheep.J ApplPhysiol.1986;61(5):1875-81;Loyd JE,Bolds JM,Sheller JR,Duke SS,Gillette AW,Malcolm AW,等人.Acute effects of thoracic irradiation on lung function andstructure in awake sheep.J Appl Physiol.1987;62(1):208-18;Guerry-Force ML,Perkett EA,Brigham KL,Meyrick B.Early structural changes in sheep lungfollowing thoracic irradiation.Radiat Res.1988;114(1):138-53;以及Tillman BF,Loyd JE,Malcolm AW,Holm BA,Brigham KL.Unilateral radiation pneumonitis insheep:physiological changes and bronchoalveolar lavage.J Appl Physiol.1989;66(3):1273-9)。
对绵羊胸部进行单侧单次分次辐照(30Gy)在辐照后4周产生具有在人类中典型的综合征的放射性肺炎,且对绵羊进行全肺辐照(15Gy)导致暴露后3周发展呼吸困难,呼吸困难持续进展直至在4周时动物被杀死。本发明人认为,绵羊复制了人类对肺辐照的早期反应的许多方面,并且在经受放射治疗方案(30Gy/5F/2wk)的绵羊中发展了包括肺泡纤维化在内的实质性病理,该放射治疗方案与常规应用于患有转移性肺癌的患者和一些患有局部晚期疾病的患者的姑息治疗方案具有相似性。
虽然在受辐照的肺中相对频繁地鉴定出支气管周和细支气管周炎性细胞(主要包括浆细胞和淋巴细胞),但是本发明人没有发现辐射影响支气管上皮细胞因子表达的证据。先前评估肺癌放射治疗期间血浆细胞因子浓度变化的临床研究显示出增加的循环TGF-β1、IL-6和IL-10以及MCP-3、δMIP-1a和IP-10。这些细胞因子的具体细胞来源尚未被决定性地确定。
在该模型中,辐射被认为不影响支气管上皮细胞因子的表达,并且因此不太可能证明是在这种情况下指示辐射暴露的影响的有用指标。
本发明人确定辐射暴露的肺中受水肿影响的实质的百分比显著增加。在本发明人所使用的方法(手动注释马松三色染色切片的低功效全载玻片图像)中,仅足够灵敏地鉴定出肺区域,在肺区域中,存在充满吸收染料的水肿液的整个肺泡。因此,该方法很可能低估了水肿的真实程度,并且可能由于水肿液成分的变化而易受可变的染料吸收的影响。
在用盐水处理的绵羊的辐射暴露的肺中,本发明人展示了被天狼猩红染色的胶原占据的实质的区域百分比的中值变化倍数(相对于对侧对照肺)为1.68(范围:1.25-4.01)。
肺泡间质中的成纤维细胞群体负责产生原胶原(胶原纤维的分子组分)和填充间质空间中细胞和各种纤维之间的空间的基质(ground substance)。分化的成纤维细胞的特定群体包括肌成纤维细胞,肌成纤维细胞的特征在于它们表达ASMA,以及它们以平滑肌细胞样方式收缩的能力。肌成纤维细胞在肺泡发生(alveologenesis)中起着基础性作用。
在健康的肺切片中,在次隔嵴的尖端处识别出ASMA表达,次隔嵴代表了在肺泡管周围的肺泡之间运作的横截面嵴(ridge)。
由于辐射暴露,肺泡间质基质的结构显著受损。在协调基质组织重塑的生长因子中,主要因子是转化生长因子-β。这种生长因子由体内所有细胞和组织普遍表达,其通过刺激不同的胶原、弹性蛋白、纤连蛋白和蛋白聚糖基因产生ECM组分而促进细胞外基质(ECM)的沉积。在合成过程中,两种TGF-β前体蛋白形成二聚体,其然后被弗林蛋白酶裂解成两种产物,第一种是潜伏相关肽(latency-associated peptide;LAP),且另一种是成熟的TGF-β。此后,这些产物保持非共价缔合,形成被称为小潜伏复合物(small latent complex)的复合物,该复合物继而共价连接到潜伏TGF-β结合蛋白(LTBP)以形成大潜伏复合物,然后该大潜伏复合物被分泌并作为无活性分子掺入到细胞外基质中。除了诸如酸化或温度变化的物理影响外,TGF-β还可以通过蛋白酶、通过活性氧物质或通过与血小板反应蛋白或含αv的整合素(αvβ5、αvβ6和αvβ8)的相互作用激活。整合素αvβ5由肺中的气道上皮细胞、内皮细胞、成纤维细胞和单核细胞表达,整合素αvβ8由气道上皮基底细胞表达,并且αvβ6由气道上皮细胞表达。活化的TGF-β然后可以与其受体相互作用,导致转录因子Smad2和/或Smad3磷酸化,这些转录因子继而与Smad4缔合并形成复合物,然后转移至细胞核以影响靶基因的转录和ECM组分的产生。在大鼠放射性肺损伤模型中,整合素αvβ6、TGF-β1、TβRII、Smad3和p-Smad2/3的蛋白表达在正常肺泡上皮中是不可检测的,但在辐射暴露后6个月与肺纤维化相关地增加。
本研究结果表明,来自暴露于辐射的绵羊的肺切片中ASMA表达与胶原沉积之间存在显著的正相关。
本发明人对DC-LAMP表达的分析发现,辐射暴露与DC-LAMP阳性细胞的聚簇和尺寸增加相关。II型肺细胞被认为响应于损伤而增殖,并且用作用于替代在肺泡表面衬里的丢失或受损害的I型肺细胞的祖细胞。
II型细胞被公认是辐射效应的早期易受影响的靶,并且本发明人发现,II型细胞在肺泡角处II型细胞的正常小生境中存在的减少,与在这些部位存在的剩余细胞的尺寸增加相关。
在每次辐射暴露之前用本发明的经雾化的板层小体组合物预处理绵羊,消除了在用盐水预处理的绵羊的PTV中观察到的胶原增加。
相对于用盐水预处理的绵羊,板层小体组合物预处理显著增加了肺中DC-LAMP阳性细胞的数量,这有助于DC-LAMP区域百分比朝向增加的不显著趋势(P=0.067)。板层小体组合物影响II型细胞管理间质的能力,这被提出改变了在健康的该隔室中肌成纤维细胞的比例,这将解释处理对ASMA的显著影响。
用本文讨论的板层小体组合物预处理与非辐射暴露的左肺中DC-LAMP阳性细胞的聚簇和Ki67计数增加相关(引起显著的交互作用效应)。本发明人认为,前部组织块(anterior block)与PTV的颅缘的靠近可能是决定处理组之间的这种差异的一个因素。如下选择前部组织块:鉴定包含PTV的颅缘的组织块。向颅的方向前进,忽略它的直接邻居,并且选择顺沿的下一个组织块作为LL(或RL)_Ant。由于这一程序是一致的,因此假定所选组织块和PTV的颅缘之间的空间关系的任何变化将在SAL组和板层小体组之间随机分布。然而,当本发明人回顾性地检查这些距离时,本发明人确定各组之间在“Ant”切片距PTV的颅缘的距离方面存在显著差异—板层小体切片近了约7mm(数据未示出)。此外,当将LL_Ant与RL_Ant的DC-LAMP NND和Ki67细胞计数之间的关系分别表示为绝对差异(LL-RL)和变化倍数(1+((LL-RL)/RL),并与切片距PTV的颅缘的距离进行比较时,发现了显著的相关性,这表现出解释了用板层小体组合物预处理与非辐射暴露的左肺中DC-LAMP NND的降低和Ki67计数的增加相关的观察结果(数据未示出)。这表明了辐射的生物效应的斜降(rampeddecline)(至少在DC-LAMP细胞聚簇和细胞增殖方面)在这个模型中延伸超出了PTV的边缘。
TGF-β1模型
选择了使用源自健康供体的肺和特发性肺纤维化(IPF)患者的肺的原代成纤维细胞建立的体外肌成纤维细胞活化模型,来研究下表中概述的制备的板层小体组合物的抗纤维化作用。该模型包括96孔测定,其中用TGF-β1处理细胞以刺激成纤维细胞向肌成纤维细胞分化,允许使用来自多个供体的细胞进行抗纤维化化合物的高通量筛选。
为了本研究的目的,使用来自健康供体的第4代成纤维细胞。在第0天,将细胞接种在96孔板中,并在37℃孵育48小时。在第2天,更新细胞培养基。在第5天,用每种板层小体制剂的8点浓度曲线处理细胞。浓度曲线通过用0.9%盐水溶液对1.5mg/ml的最高总脂质浓度进行稀释的两倍系列稀释物产生。处理后1小时,用1.25ng/ml TGF-β1刺激细胞。将细胞孵育另外72小时。
为了证实该测定是有效的,1nM SB-525334被用作抗纤维化活性的阳性对照。SB525334是ALK5(TGF-β受体2)的抑制剂,并抑制TGF-β1信号传导。与板层小体处理平行地,用SB-525334处理细胞一小时。用0.1%DMSO或0.9%盐水(每孔最终体积的3%)处理的细胞分别用作SB-525334和板层小体制剂的媒介物对照。一种临床上批准用于治疗IPF的药物尼达尼布(Nintedanib),也被用作参考化合物,针对该参考化合物比较板层小体制剂的功效。使用8点浓度曲线,最高浓度为10μM。
在第8天,用TGF-β1刺激后72小时,用4%甲醛固定细胞。
对肌成纤维细胞响应于TGF-β1的分化的分析是通过α平滑肌肌动蛋白(αSMA)的荧光染色和细胞核的DAPI染色的共聚焦显微术成像来进行的。该方法测量αSMA染色的密度乘以面积(DxA)。DAPI染色阳性的细胞核数量用作可能的化合物细胞毒性的指标。
认为该测定适于分析LMS-611组合物和其他新型板层小体制剂的潜在抗纤维化作用。确定制剂(1、2和8)诱导了对TGF-β1诱导的αSMA的部分抑制,富含DOPS的制剂4在αSMA响应于TGF-β1刺激的上调中引起了完全的剂量依赖性抑制。
下表总结了所测试的制剂,以及它们是否能够在该FMT测定模型中表现出抗纤维化作用。
*基于来自2名人类供体的结果
**来自一名供体的结果显示出抑制作用,但是来自第二名供体的数据没有显示出抑制作用。
细胞进入模型
为了阐明细胞相互作用,用一种亲脂性非可交换性荧光脂质标记物1,1’-双十八烷基-3,3,3’,3’-四甲基吲哚羰花青高氯酸盐(DiI)对板层小体制剂的所有制备制剂进行标记。使用细胞外荧光猝灭剂台盼蓝,通过流式细胞术测量细胞相互作用,以区分细胞结合和囊泡内化。这是一种先前描述的标准技术(Sahlin等人,1983;Feldmann等人,2017)。所有变化形式都在HeLa细胞中进行了测试,并且一些变化形式也在A549细胞中进行了测试。所选细胞系作为模型细胞系被采用,以说明制剂被细胞摄取。
使用双重离心来使脂质/水混合物有效均质化,以形成囊泡型磷脂凝胶(vesicular phospholipid gel;VPG),并在随后稀释VPG后制备板层小体制剂。该工艺方法描述于(Massing,U.,Ingebrigtsen,S.G.,
通过在合适的有机溶剂或溶剂混合物中将溶解的脂质与相对于总脂质量为0.5mol%的DiI混合,然后通过在真空下干燥去除溶剂来制备脂质混合物。通过在250mM蔗糖和25mM氯化钠中使干燥的脂质膜水合来制备板层小体制剂的水性分散体,并在双重离心机(ZentriMix 380R,Andreas Hettich GmbH,Germany)中以1200rpm、15℃处理20min。将所得的囊泡型磷脂凝胶(VPG)用水性介质稀释,并在1200rpm、15℃再次处理5min。在小瓶中使用陶瓷珠作为混合辅助物。最后,将制剂进一步稀释至所需浓度。
挤压后的磷脂浓度使用Bartlett测定确定(Bartlett,1959Bartlett,G.R.,1959.Phosphorus assay in column chromatography.J.Biol.Chem.234,466-468.)。对于所有制剂,测量囊泡尺寸和尺寸范围。在下表中提供了所测试的板层小体制剂的组成、尺寸范围和δ电位(不同制剂的特征—注意:所有制剂都标记有0.7重量%的DiI。)。
不同制剂的特征-
对于细胞摄取实验,将6.5·10
如先前描述的,使用0.08%台盼蓝水溶液(DiI荧光的猝灭剂,不能渗透细胞)来区分板层小体的结合和摄取(Sahlin,S.,Hed,J.,Rundquist,I.,1983.Differentiationbetween attached and ingested immune complexes by a fluorescence quenchingcytofluorometric assay.J.Immunol.Methods 60,115-124.;Feldmann,D.P.,Xie,Y.,Jones,S.K.,Yu,D.,Moszczynska,A.,Merkel,O.M.,2017.The impact of microfluidicmixing of triblock micelleplexes on in vitro/in vivo gene silencing andintracellular trafficking.Nanotechnology 28,224001.https://doi.org/10.1088/1361-6528/aa6d15)。DiI和台盼蓝光谱重叠的校正用BD FACSDiva软件进行。
通过将测试制剂的DiI荧光强度针对中性对照脂质体(DOPC/Chol)的DiI荧光归一化来分析摄取实验。
板层小体囊泡制剂LMS-611能够进入两种细胞系。荧光强度与DOPC/Chol对照脂质体相比为其40倍高(A549和HeLa)。此外,在两种细胞系中,LMS-611板层小体制剂被高度内化(93%的荧光未被台盼蓝猝灭)。所有板层小体制剂都显示出比DOPC/Chol对照脂质体显著更大程度的细胞进入。
图9描绘了2小时孵育期后A549细胞(A)和HeLa细胞(B)中制剂的细胞结合(红条)和内化(蓝条)。将DiI荧光的变化倍数针对中性DOPC/Chol脂质体归一化。
用由含有带负电荷的脂质的六种、五种或四种或三种脂质制备的制剂观察到板层小体制剂的细胞进入。制剂中的磷脂包括酯化的饱和及不饱和脂肪酸。该实例说明,板层小体制剂通常适于被细胞摄取。因此,认为这些组合物可以在细胞内的病理部位起作用,以使纤维化状况最小化或预防性地治疗纤维化状况。
虽然已经参考特定实例具体地示出和描述了本发明,但本领域技术人员将理解的是,可以进行形式和细节上的各种改变而不背离本发明的范围。
- 抗纤维化组合物
- 一种中药组合物在制备抗纤维化药物中的应用
