经基因修饰的骨髓间充质干细胞来源的微囊泡在制备治疗肾损伤药物中的应用
文献发布时间:2023-06-19 12:18:04
技术领域
本发明涉及干细胞微泡技术领域,特别涉及经基因修饰的骨髓间充质干细胞来源的微囊泡在制备治疗肾损伤药物中的应用。
背景技术
慢性肾脏病(Chronic Kidney Disease,CKD)在我国的发病率高达11.8%,已成为继心脑血管疾病、肿瘤和糖尿病后威胁人类健康的又一大原因。肾小管间质炎症和纤维化是导致CKD进展的主要病理基础,其特征为正常肾单位进行性丧失及大量成纤维细胞增殖和细胞外基质的过度分泌,这一过程就类似于组织损伤后的斑痕修复而非正常组织修复。目前临床所采取的治疗措施仅能延缓这一斑痕修复过程的速度,从而延缓CKD进展的速度,但尚无阻断斑痕修复或使损伤肾单位进行正常修复,从而阻断或逆转CKD进展的方法。因此,迫切需要寻求肾损伤修复的新途径。
近年来研究发现骨髓间充质干细胞(mesenchymal stem cell,MSC)在肾损伤修复作用至关重要。MSC具有极强的可塑性,在适宜条件下可跨胚层分化为多种组织细胞,包括骨细胞、成骨细胞、脂肪细胞等;还可能具有向肾实质细胞(如上皮细胞、系膜细胞、足细胞等)分化的潜能,从而参与肾脏损伤的修复和再生。MSC移植是参与肾小管修复和肾功能恢复的主要细胞群体,能够明显改善肾脏功能。既往研究大部分认为骨髓间充质干细胞通过向受损部位归巢,并转分化为肾小管上皮细胞,从而修复肾脏的结构和功能。然而,研究发现MSC移植虽然促进了肾损伤修复,但并未检测到移植MSC分化为肾小管上皮细胞、系膜细胞或足细胞等肾脏固有细胞,提示MSC可能是通过旁分泌作用促进肾损伤修复,这成为MSC在肾损伤修复研究中的一个重要转折。
最新国内外研究表明MSC可能通过微囊泡(microvesicle,MV)释放各种因子,促进肾损伤修复。微泡是从骨髓间充质细胞表面脱落或细胞区室中释放的圆形膜片(直径100nm-1μm),其主要功能是将各种蛋白质、酶、miRNA和mRNA以微泡的形式运送至靶细胞,发挥相应生物学作用。几乎所有处于静息期和活动期的细胞均可分泌微泡,在应激状态下(如器官组织损伤、感染、肿瘤形成等),其数量会显著增加。申请者硕士研究期间通过体内外实验证实MSC来源的MV能够促进肾大部切除小鼠模型的肾脏损伤的修复(He Juan,etal.Nephrology.2012;17(5):493-500.)。国外研究也在急性肾缺血模型中发现MSC能够通过其分泌的MV进入受损肾脏细胞而发挥修复作用。无论是在维持肾功能,还是在促进形态学恢复、抑制细胞凋亡等方面,MV均可以发挥类似MSC的作用,而并非必须经过MSC细胞转化为肾小管上皮细胞等肾固有细胞进行肾修复。因此,阐明MSC促进肾损伤过程中MV所分泌的分子标志物及其机制有可能为肾损伤提供新的有效治疗方法。截止到2011年3月,美国FDA已批准应用骨髓间充质干细胞进行临床研究的试验方案共154项,其中已完成I期临床安全性试验109项,III期临床试验2项。我国政府每年投入该方面的科研经费已超过50亿。
国内外学者将MSC应用于急性心肌梗死、脑梗死、肝功能衰竭、大面积烧伤等组织创伤修复上,取得了良好的效果。在心血管领域,研究者通过将MSC移植到动物心梗模型,促使心梗面积缩小,梗死缺血边缘区毛细血管增多,心功能得到改善,动物死亡率下降,并已尝试用于临床治疗。除了将MSC作为细胞移植治疗心肌梗死之外,对其它心肌疾病,如糖尿病心肌病、扩张型心肌病的治疗也有报道。也有学者研究证实MSC能够在移植肝组织内定居存活,在肝移植等肝脏损伤的状况下,正常肝细胞增殖受到抑制,肝脏大量分泌促进肝细胞生长的细胞因子,为移植的MSC提供定居所需的微环境,增加干细胞存活几率,从而进一步发挥组织修复作用。
MSC修复损伤肾组织的研究起步相对较晚。有研究表明MSC具有极强的可塑性,在适宜条件下可跨胚层分化为多种组织细胞,不仅可分化为骨细胞、成骨细胞、脂肪细胞等;还具有向肾实质细胞分化的潜能,可分化为上皮细胞、系膜细胞、足细胞等多种肾脏细胞类型,从而参与肾脏损伤的修复和再生。Morigi等在针对骨髓来源的干细胞参与肾脏组织修复的研究中发现,间充质干细胞的移植能够明显改善肾脏功能,它是参与肾小管修复和肾功能恢复的主要细胞群体。继之,Togel等移植荧光标记的MSC至动物体内,发现仅在移植后1-2d内在肾脏的微血管部位检测到移植的MSC,在移植24h后,检测到炎症因子白细胞介素1β、肿瘤坏死因子α、γ-干扰素表达减少,抗炎因子白细胞介素10、碱性成纤维细胞生长因子、转化生长因子α、Bcl-2则表达增加,但并未检测到移植MSC分化为肾小管上皮细胞、系膜细胞或足细胞等肾脏固有细胞。
近年来,新近的研究表明MSC并未转化为肾脏固有细胞,而是通过旁分泌作用减轻肾损害。MSC分泌一系列生长因子、细胞因子和趋化因子,这些因子能够防止损伤组织细胞的凋亡,刺激血管生成,改善局部环境,促进肾损伤修复,阻断肾脏纤维化的过程。
微泡是从细胞表面脱落或细胞区室释放的小圆形膜片(直径100nm-1μm),微泡的生物学意义一直在很大程度上被忽视。新近的研究表明,微泡的分泌或脱落是由正常细胞而非凋亡细胞完成,它比凋亡小体的体积更小。微泡包含大量结构蛋白(如受体、粘附分子),也含有来源于细胞膜上的脂类。微泡在细胞膜起泡过程中吞噬一些细胞质,因而富含来源于原始细胞的蛋白质、酶、mRNA和miRNA,随后微泡将这些物质运送至靶细胞。在mRNA、miRNA、蛋白质等的转运过程中,微泡扮演着“自然工程脂质体”的角色。研究发现人干细胞来源的微泡可以在体内将人的mRNA转运到小鼠细胞中,并导致蛋白的翻译。除了mRNA,微泡还可将miRNA转运到靶细胞中;miRNA是天然的蛋白翻译调节因子,因此有可能通过微泡在邻近细胞间转运miRNA,从而实现干细胞调节基因的表达。新近,有学者通过对miRNA的分级聚类和相似性分析,证明在MSC来源的微泡穿梭运载miRNA的过程中,微泡对miRNA的分泌和区室化都是高度调控的过程。进一步的研究显示,MSC来源的微泡高表达miRNA,可能参与多种器官的发育、细胞的存活、分化以及免疫调节。已有证据表明微泡通过多种方式影响靶细胞的行为,如直接刺激靶细胞,或通过细胞间的受体传递,或向靶细胞传递某种受体蛋白,或横向传递遗传信息。但目前认为,微泡的主要作用是在靶细胞间传递信号和传送遗传信息。然而,现今尚未十分明确,微泡转运基因信息的功能是否在干细胞重塑和组织再生中发挥重要作用,它是否有助于干细胞通过旁分泌作用修复受损组织,这是非常有意义而值得深入探讨的问题。
进一步研究发现MSC来源的MV对缺血性肾损伤的修复作用是通过miRNA发挥的(HeJuan,et al.Nephrology.2015;20:591-600.)。骨髓间充质干细胞来源的微泡富含源细胞的miRNA,微泡将其转运到靶细胞中,而miRNA是天然的蛋白翻译的调节因子,因此有可能通过微泡在邻近细胞间转运miRNA,从而实现干细胞调节基因的表达。微泡对miRNA的分泌和区室化具有出高度调控的过程,可能参与受损细胞的存活、分化以及免疫调节。
利用miRCURY
发明内容
本发明的目的在于提供经基因修饰的骨髓间充质干细胞来源的微囊泡在制备治疗肾损伤药物中的应用,可以解决上述背景技术中提出的问题。
为实现上述目的,本发明提供如下技术方案:
经基因修饰的骨髓间充质干细胞来源的微囊泡在制备治疗肾损伤药物中的应用,包括骨髓间充质干细胞来源、并经基因修饰的miR-34a-MSC-MV,这一特定设计的微泡在制备治疗肾损伤药物中的应用。
进一步地,微泡按如下方法提取:
采用全骨髓发分离提取骨髓间充质干细胞,待干细胞贴壁,生长良好,经miR-34a慢病毒感染颗粒转染后,每次细胞换液前,收集培养液,随即将收集的培养液离心3000rpm,25min,吸取上清,保存于-80℃备用;待收集一定量的培养液上清后,集中进行高速冰冻离心,具体方法为:将收集来的无细胞碎片上清培养液经100000g,4℃,离心1h,弃去上清,用含HEPES的无血清培养基-199冲洗,再经相同条件离心后,弃去上清,加入含有HEPES的无血清培养基-199吹打均匀,即得到miR-34a-MV悬液。
进一步地,所述的骨髓间充质干细胞来源于C57雄性小鼠,由西北大学实验动物中心提供。
进一步地,对于骨髓间充质干细胞,通过以下方法进行MSC鉴定:①成骨诱导,茜素红染色观察细胞钙盐沉积,②成脂肪诱导,油红O染色鉴定脂肪细胞,③流式细胞术:MSC表达CD105、CD73和CD90,不表达CD45、CD34、CD14、CD11b、CD79a、CD19和HLA-DR表面分子。
进一步地,骨髓间充质干细胞(MSC)来源的微泡(MV)能传递多种遗传信息和生物活性物质。
进一步地,慢病毒感染:取出-80℃保存的病毒,放入4℃备用,使用前轻轻摇匀,病毒准备好之后,从培养箱中拿出细胞,首先观察细胞生长状态,如细胞状态较好则开始实验,使用移液器吸取准确体积的病毒液加入准备好的培养基中,吸去细胞中剩余培养基,在目的细胞和对照细胞中分别加入计算好的病毒液,混匀后放于37℃,5%CO2的培养箱内孵育过夜,感染48h后,一部分用于后续实验,一部分细胞继续培养,第16-19天Real-time PCR检测miR-34a-5p miRNA的表达,利用总RNA提取试剂盒提取样本总RNA,使用紫外分光光度计NANO 2000测定各样本中RNA的浓度。
进一步地,病毒数与细胞数比值为50:1。
进一步地,微泡的提取方法还包括反转录:将得到的RNA样本进行反转录,对上步实验所得的RNA样本进行反转录以得到对应的cDNA,由PCR仪完成,最后得到20μl cDNA样本,置于-20℃保存及后续实验。
与现有技术相比,本发明的有益效果是:本发明通过体内、外实验分别验证miR-34a-MV在肾脏纤维化过程中的修复作用。如期成功地分离、培养、鉴定MSCs,成功提取MSC来源的MV。经慢病毒载体介导miR-34a在MSCs中的过表达,miR-34a-MSC中,检测miR-34a水平。随后,在慢病毒miR-34a感染的MSCs的MVs中,检测miR-34a的分泌水平。通过模拟体内微环境,TGF-β1诱导HK-2细胞损伤,western blot和IF法检测间充质标记物α-SMA、纤连蛋白表达上调,TJP1和钙粘蛋白表达,进一步用western blot检测HK-2细胞Notch信号通路的改变可见,与MSC-MVs共培养,观察Notch1和Jagged-1参与TGF-β1诱发的EMT且在细胞中表达。通过MTT分析,观察TGF-β1诱导HK-2细胞损伤,以及改良的和未改良的MSC-MVs对细胞存活率的影响。在体外研究的基础上,观察了miR-34a修饰的MSC-MVs对单侧输尿管梗阻模型所致肾损伤模型的修复作用。由此可以推测miR-34a-MV的肾损伤修复作用,将为间充质干细胞治疗提供新的途径,充满前景。
附图说明
图1为本发明微泡提取mir-34a修饰的MSC照片;
图2为本发明miR-34a在MSCs中的过表达通过慢病毒载体介导;
图3为本发明miR-34a-修饰的MSC-MVs对TGF-β1刺激的HK-2细胞的修复作用示意图;
图4为本发明腺病毒转染后miR-34a-MV的修复作用示意图;
图5为本发明miR-34a-MVs对抑制由TGF-β1诱导的HK-2细胞凋亡作用示意图;
图6为本发明miR-34a-MVs在单侧输尿管梗阻(UUO)模型中的修复作用示意图;
图7为本发明锁核酸micor-RNA表达谱分析结果显示示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
一、体外实验:
1、人近端肾小管上皮细胞(HK2)培养:HK2购自美国ATCC公司。以含5%新生胎牛血清、青/链霉素(100μg/L)的M199培养液,置37℃孵箱(5%CO2)内培养,每2天换液一次。待细胞密度达80%-90%,用含0.25%胰酶(含1mmol/L EDTA)消化后l:2-3传代,记为P1。按上述方法继续传代培养,并按检测所需的细胞浓度接种,换无血清培养液,同步化24h后,换新鲜含血清培养液。按相应组别分别加入TGF-β1(6ng/ml)、MV(30μg/ml),MSC(1×10
2、分组:
(1)HK-2对照组
(2)HK-2+TGF-β1
(3)HK-2+TGF-β1+MSC-MV
(4)HK-2+TGF-β1+miR-34a-MV
3、观察内容:
(1)电镜下观察MSC胞吐MV的过程以及MV的形态;
(2)48h后,光镜下观察细胞形态;
(3)48h后,western blot和IF法检测EMT相关分子的表达水平;
(4)48h后,观察miR-34a-MVs对抑制由TGF-β1诱导的HK-2细胞凋亡作用。
二、体内实验:
1、动物模型建立:单侧输尿管梗阻模型(UUO):
C57小鼠吸入麻醉后,于小鼠左侧中腹部切开皮肤,打开腹腔,钝性游离左侧输尿管,于中上1/3处以4-0线双重结扎,分层缝合关闭腹腔,逐层缝合皮肤。
2、干细胞、微泡的提取:
(1)干细胞分离、培养和鉴定:
采用全骨髓法进行MSC分离培养。并通过以下方法进行MSC鉴定:①成骨诱导,茜素红染色观察细胞钙盐沉积。②成脂肪诱导,油红O染色鉴定脂肪细胞。③流式细胞术:MSC表达CD105、CD73和CD90,不表达CD45、CD34、CD14、CD11b、CD79a、CD19和HLA-DR表面分子。
(2)微泡提取:
待干细胞贴壁,生长良好,进行如下操作:(1)细胞慢病毒感染:取出-80℃保存的病毒,放入4℃备用,使用前轻轻摇匀。病毒准备好之后,从培养箱中拿出细胞,首先观察细胞生长状态,如细胞状态较好则开始实验。使用移液器吸取准确体积(病毒数与细胞数比值为50:1)的病毒液加入准备好的培养基中,吸去细胞中剩余培养基,在目的细胞和对照细胞中分别加入计算好的病毒液。混匀后放于37℃,5%CO2的培养箱内孵育过夜。感染48h后,一部分用于后续实验,一部分细胞继续培养。第16-19天Real-time PCR检测miR-34a-5pmiRNA的表达,利用总RNA提取试剂盒提取样本总RNA,使用紫外分光光度计NANO 2000测定各样本中RNA的浓度。(2)反转录:将得到的RNA样本进行反转录,对上步实验所得的RNA样本进行反转录以得到对应的cDNA,由PCR仪完成,最后得到20μl cDNA样本,置于-20℃保存及后续实验。(3)经慢病毒miR-34a转染后,每次细胞换液前,收集培养液,每次将收集的培养液离心3000rpm,25min,保存于-80℃备用。待收集一定量的培养液后,集中进行高速冰冻离心,具体方法为:将收集来的无细胞碎片上清培养液经100000g,4℃,离心1h,弃去上清,用含HEPES的无血清培养基-199冲洗,再经相同情况(100000g,4℃,1h)离心后,弃去上清,加入含有HEPES的无血清培养基-199冲洗吹打,即得到miR-34a-MV悬液,过程中注意无菌操作。间充质干细胞(MSC)来源的微泡(MV)能传递多种遗传信息和生物活性物质,可能在肾修复中起关键作用。MV治疗有望成为干细胞治疗的新方向,可能成为细胞治疗新的一族。研究探讨了经基因修饰的miR-34a-MV的肾修复作用,发现miR-34a-MV能够显著改善受损肾脏的功能和形态。在慢性肾脏纤维化的治疗方面有所突破,为慢性肾衰竭干细胞治疗提供了新途径。
3、实验分组:
(1)对照组:10只,第7、14天各处死5只;
(2)UUO组:10只,第7、14天各处死5只;
(3)UUO+MSC-MV组,10只,第7天、14天各处死5只;
(4)UUO+miR-34a-MVs组,10只,第7天、14天各处死5只;
4、观察内容:小鼠一般情况、肾脏病理改变。
三、实验结果:
图1所示,微泡提取mir-34a修饰的MSC照片:A.分离的MSCs表面标志物CD105阳性,CD11、CD45、CD34阴性,油红染色和茜素红染色图像证实了MSCs的体外成脂和成骨能力(图1B-C)。
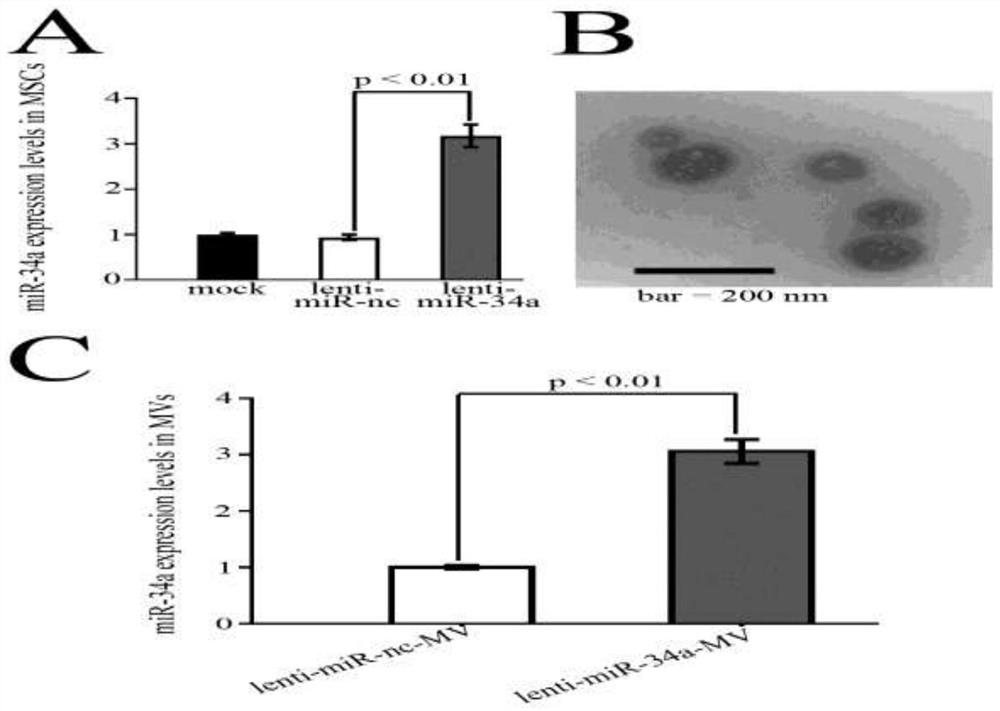
图2所示,miR-34a在MSCs中的过表达通过慢病毒载体介导:48小时后,real-timePCR检测未感染MSCs和感染慢病毒-miR-34a或慢病毒-mir-nc MSCs的miR-34a水平。数据显示,在慢-miR-34a感染的msc中,miR-34a水平升高了3倍(图2A)。利用电子显微镜,发现分离的MVs的直径小于200nm(图2B)。此外,如图2C所示,在慢病毒miR-34a感染的MSCs的MVs中,更多的miR-34a被分泌(图2C)。
图3所示,miR-34a-修饰的MSC-MVs对TGF-β1刺激的HK-2细胞的修复作用:模拟体内微环境,TGF-β1诱导HK-2细胞损伤。western blot和IF法检测EMT相关分子的表达水平。间充质标记物α-SMA、纤连蛋白表达上调,TJP1和钙粘蛋白表达下调,表明TGF-β1成功地诱导了EMT(图3A-B)。进一步用western blot检测HK-2细胞Notch信号通路的改变。如图3C-D,与MSC-MVs共培养,Notch1和Jagged-1参与TGF-β1诱发的EMT且在细胞中表达下调。在mir-34a-MSC-MVs实验组,二者的降低更为显著。
图4所示,腺病毒转染后miR-34a-MV的修复作用:倒置显微镜下观察各组细胞形态,A.对照组呈正常肾小管上皮细胞形态,细胞成多边形或卵圆形,排列规整,有典型的上皮细胞铺路石样的形态学特征。B.TGF-β1组加入TGF-β1 6ng/ml培养48小时,即可见融合的HK2细胞间失去连接,铺路石样形态消失,代之以肥大、长梭形的成纤维细胞样外观,细胞生长排列紊乱,漂浮细胞增多,细胞发生分化。C、D.在光镜下,加入MV、miR-34a-MV组可在一定程度上抑制由TGF-β1诱导的HK2细胞形态改变,大多数细胞形态正常,排列紧密,细胞纤维化程度和范围减轻。
图5所示,miR-34a-MVs对抑制由TGF-β1诱导的HK-2细胞凋亡作用:在不同的分组中,HK-2细胞与TGF-β1共培养48小时。通过MTT分析,TGF-β1诱导HK-2细胞活力降低了39%。改良的和未改良的MSC-MVs均可提高细胞存活率,但mir-34a修饰的MSC-MVs的保护作用不如未修饰的明显。凋亡分析的数据支持MTT结果。
图6所示,miR-34a-MVs在单侧输尿管梗阻(UUO)模型中的修复作用:HE染色可见:A组视野内可见的肾小球体积略有萎缩,部分肾小管有轻微肿胀,部分肾小管刷状缘减少或丢失;B组肾小囊腔明显扩大,肾小球萎缩或分瓣,较多肾小管刷状缘丢失并空腔化,肾小管上皮普遍肿胀,14天时病变更加明显;C组也可见肾小球皱缩,囊腔扩大,部分肾小管空腔化,部分肾小管黏连纤维化,肾小管间隙伴有较多散在分布的血细胞,但肾小管上皮细胞核固缩、碎裂和溶解等细胞坏死和变性征象有所减轻,小管轮廓尚清晰可见,基底膜较完整,间质红细胞数量减少;D组肾小管大部分肿胀,有少量空泡化,刷状缘缺失明显,肾小球皱缩减小,组织间隙有少量血细胞及炎性细胞分布,纤维较明显;E组肾小管普遍轻微肿胀,肾小球皱缩,基膜有增厚,少量肾小管刷状缘丢失,部分肾小管管腔内有粉染的黏液样物质分布。A.对照组,B.UUO组,C.UUO+MV,D.UUO+miR-34a-MV,E.UUO+miR-34a-inhibitor-MV。
Masson染色可见:A组组织染色清晰,蓝然纤维物质少或无,组织基本正常;B组在肾小管间质区及肾小球内部有明显的蓝色纤维丝染色,其他位置红色,且上述病变于14天时更加明显;C组染色情况与B组类似;D组整体蓝染有所减少,主要分布在肾小球、肾小管及肾小管间质区,部分萎缩的肾小管内部明显染色;E组整体结构可见少部分血管周围及肾小管间质区有蓝染,其他位置红染;A.对照组,B.UUO组,C.UUO+MV,D.UUO+miR-34a-MV,E.UUO+miR-34a-inhibitor-MV。
图7所示,锁核酸micor-RNA表达谱分析结果显示:MSC、MV中共检测到542种mi-RNA有荧光信号的表达,其中MSC为266种,MV为276种,进一步分析显示,MV中荧光表达强度超过MSC2倍的,共有81种。A、B:MSV、MV锁核酸micor-RNA基因芯片原始荧光信号图;C:MSV、MV锁核酸micor-RNA基因芯片表达谱;D:MSV、MV-micor-RNA表达差异分析。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 经基因修饰的骨髓间充质干细胞来源的微囊泡在制备治疗肾损伤药物中的应用
- 间充质干细胞来源的纳米微囊泡在制备治疗子痫前期的药物中的应用
