DUSP13在治疗心肌细胞凋亡相关的心血管疾病中的应用
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于生物医药技术领域,具体涉及DUSP13在治疗心肌细胞凋亡相关的心血管疾病中的应用。
背景技术
心血管疾病(cardiovascular disease,CVD)是目前人类健康的头号杀手,全球每年死于心血管疾病的人数多于其它任何原因。据世界卫生组织(WHO)统计,全球死亡人数中1/3死于心血管疾病,其中中国是心血管疾病死亡人数最多的国家。随着人民生活水平的提高和饮食结构的变化,心血管疾病的患病率和死亡率仍呈明显上升趋势。
心肌细胞凋亡参与多种心血管疾病病理生理过程,包括原发性高血压、缺血性心脏病和再灌注损伤、心肌炎、心肌病、心律失常、心脏衰竭、先天性心脏病等。心肌细胞凋亡机能异常是发生多种重症心血管病的重要机制。通过干预细胞凋亡程序的进行,抑制心肌细胞凋亡的发生,挽救心脏和心功能,已成为心血管疾病药物研究的重要方向之一。目前临床上抑制心肌细胞凋亡的药物有他汀类、β-受体阻断剂、血管紧张素转换酶抑制剂等,但存在不同程度的副作用。
氧化应激(oxidative stress,OS)指机体内活性氧(reactive oxygen species,ROS)产生过多,导致氧化和抗氧化系统失衡,引起细胞或组织氧化损伤的一种病理状态。在心血管疾病的发生发展中氧化应激扮演着重要角色,活性氧(ROS)产生的增加依次导致多种心脏致病效应,包括凋亡、自噬、衰老、肥厚、纤维化和心肌重塑,寻找有效的抗氧化措施,可为心血管疾病提供更有针对性的防治方案。目前研究氧化应激应用最广泛的体外模型是过氧化氢H2O2氧化损伤模型。
转录因子MYOG编码肌细胞生成素(Myogenin)蛋白,是生肌调节因子(MRFs)基因家族的成员之一。MRFs转录因子家族(包括Myod、Myf5、Mrf4和MYOG)在骨骼肌发生的各个阶段都起着关键作用。该家族所有成员共同含有一个保守的螺旋-环-螺旋(bHLH)基序,可以与下游基因的E盒结合,从而激活下游肌肉特异性基因的表达。研究表明,MYOG通过控制、启动成肌细胞的融合和肌纤维的形成,而在肌肉分化过程中起关键作用。在小鼠中的研究显示,MYOG基因缺失会导致严重的肌肉分化缺陷,从而造成围产期死亡。因此,MYOG是骨骼肌发育过程中必需的调控因子,并且是不可替代的。目前,已有研究证实,MYOG基因能抑制由血管紧张素Ⅱ诱导的心肌细胞凋亡,但对其抑制心肌细胞凋亡的具体机制仍不清楚,并对由活性氧诱导的心肌细胞凋亡是否具有抑制作用及作用机制尚未见报道。
DUSPs(双特异性磷酸酶)是一类异质蛋白磷酸酶,可催化磷酸化酪氨酸和磷酸化丝氨酸/苏氨酸残基上的蛋白质去磷酸化。DUSPs被认为在细胞信号转导、细胞生长、分化、转录和凋亡中起着重要的调节作用。目前已发现61种形态和结构不同的双特异性磷酸酶,可根据特定结构域的存在和序列相似性分为七类:slingshots,PRLs(phosphatases ofregenerating liver),Cdc14 phosphatases(Cdc is cell division cycle),PTENs(phosphatase and tensin homologues deleted on chromosome 10),myotubularins,MKPs(mitogen activated protein kinase phosphatases)and atypical DUSPs。
DUSP13是一种atypical DUSPs(非典型双特异性磷酸酶),其通过开放阅读框编码产生两个不同却密切相关的非典型DUSPs,DUSP13B(TMDP)和DUSP13A(MDSP)。有研究表明DUSP13B参与精子形成过程中睾丸生殖细胞的减数分裂和分化的调控,在保护精子免受外部压力方面发挥着重要作用,还具有脱磷并使应激激活的MAP激酶JNK和p38失活的作用。DUSP13A是一种肌肉限制性双特异性磷酸酶,仅在骨骼肌中表达,并能激活凋亡信号调节激酶(ASK1)活性。
发明内容
本发明发现MYOG基因通过调控DUSP13对ROS作用下心肌细胞提供抗凋亡保护的方法;本发明通过过氧化氢(H
附图说明
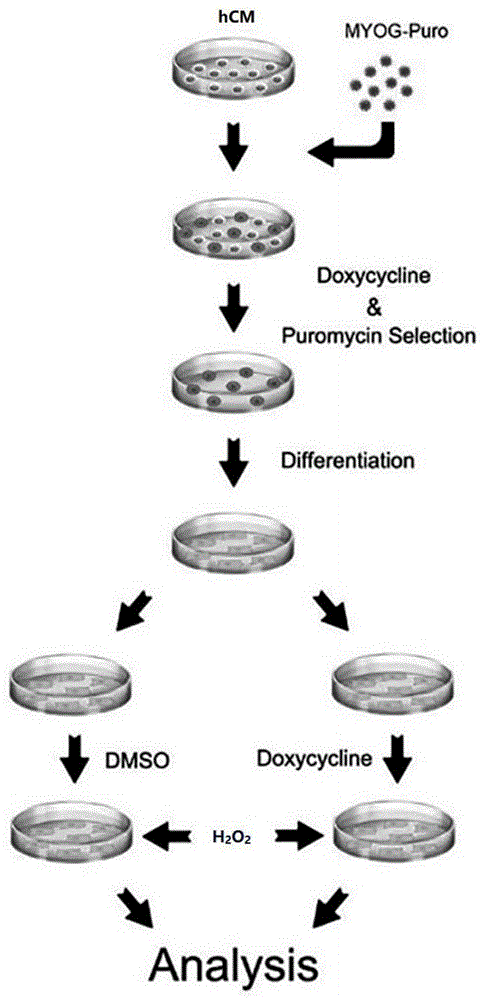
图1为本发明的技术流程图;
图2为实施例2中MYOG表达水平测定图;
图3为实施例2中MYOG免疫荧光染色图;
图4为实施例3中Annexin V法检测处理后的心肌细胞凋亡情况的结果图;
图5为实施例4中RNA测序与分析MYOG调控DUSP13表达的结果图;
图6为双荧光素酶实验的统计结果图;
图7为流式检测DUSP13表达对H
具体实施方式
为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合具体实施例进行详细描述。
如图1所示,本发明的技术流程如下:
1、构建pCW-EGFP-MYOG载体。
2、包装慢病毒。
3、转染人心肌细胞。
4、用盐酸多西环素(Dox)诱导hCM-MYOG细胞表达MYOG基因,Dox浓度为2μg/mL。
5、用过氧化氢诱导hCM、hCM-MYOG凋亡,过氧化氢浓度为1mM。
7、测定细胞凋亡,RNA-seq与分析,检测蛋白水平。
8、检测启动子区域,检测细胞凋亡。
实施例1:获得hCM-MYOG细胞株
1.1慢病毒表达载体构建:用常规分子克隆方法将MYOG cDNA和EGFP绿色荧光蛋白基因亚克隆到pCW-Cas9-Blast载体中(Addgene,83481),得到pCW-EGFP-MYOG。
1.2慢病毒包装
1.2.1接种HEK293T细胞到6孔板中,用D10培养液(DMEM培养液+10%胎牛血清+1%PS)进行培养,待细胞汇合度达到70%-80%时准备进行转染。
1.2.2在转染前1h,弃去原来培养液,加入2mL/孔预热的无血清DMEM培养液。
1.2.3按照说明书用EZ Trans细胞转染试剂(李记生物,AC04L091)进行转染。将pCW-EGFP-MYOG(20μg)、pVSVg(10μg)、psPAX2(15μg)共转染HEK293T细胞。
1.2.4 6h后,将培养液更换成D10培养液(DMEM培养液+10%胎牛血清+1%PS)。
1.2.5继续培养约60h后,取培养液于3000rpm、4℃离心10min,去除细胞残渣。
1.2.6用0.45μm低蛋白结合滤膜(Millipore Steriflip HV/PVDF)过滤上清液,去除细胞残渣。
1.2.7将含病毒的培养液按照体积比4:1与10%蔗糖缓冲液(50mM Tris-Hcl,pH7.4,100mM NaCl,0.5mM EDTA),10000g、4℃离心4h。小心弃去上清液,离心管在吸水纸上沥干3min,加入1×PBS重悬获得浓缩病毒液,-80℃保存。
1.3获得hCM-MYOG细胞
1.3.1hCM培养:将人心肌细胞(hCM)(青旗(上海)生物技术发展有限公司,BFN608007121)接种于明胶(sigma,V900863)包被的平板上,然后用D10培养液进行培养。D10培养基每两天更换一次。hCM每隔3天传代一次,或在细胞培养达到80-90%汇合度时传代。传代过程中用1×DPBS(Gibco,14040133)冲洗1次,然后在室温下用使用0.05%胰酶((Solarbio,T1320)消化不超过5min。传代比为1:2-1:3。
1.3.2转染:待hCM细胞汇合度达到70%-80%时进行转染。感染复数(MOI)约为0.3-0.5。转染24h后,将培养液更换成新鲜D10培养液(含终浓度为2μg/mL的盐酸多四环素(Dox))。诱导2天后,使用倒置荧光显微镜观察绿色荧光表达情况,并使用流式细胞仪(FACSAria IIU,BD Biosciences)分选带有绿色荧光的细胞。经过2~3天培养,即得hCM-MYOG细胞株。
实施例2:鉴定hCM-MYOG细胞株
2.1诱导表达:在D10培养液中加入终浓度为2μg/mL的盐酸多西环素(Dox)(Sigma,D9891)诱导MYOG表达,并以DMSO作为对照。对照组没有DOX只有DMSO,标注为C1,加入到D10培养液;试验组有DOX也有DMSO,DOX先加入到DMSO,标注为C2,再加入到D10培养液;DOX在D10培养液里的终浓度是2μg/mL;C1和C2的加入量相同;
2.2总RNA提取:用EZ-10总RNA小量提取试剂盒(Sangon Biotech,B618583-0050)提取细胞总RNA。(样品使用RNase-Free DNA清除试剂盒,Sangon Biotech,B618253-0050)清除残留基因组DNA);
2.3逆转录:用逆转录试剂盒
2.4qPCR检测MYOG mRNA表达水平:按照TB
MYOG-RT-F:GCCCAAGGTGGAGATCCT;
MYOG-RT-R:GGTCAGCCGTGAGCAGAT;
GAPDH-RT-F:TGGGTGTGAACCATGAGAAG;
GAPDH-RT-R:GTGTCGCTGTTGAAGTCAGA。
2.5免疫荧光检测MYOG蛋白表达:
2.5.1细胞用4%多聚甲醛在室温下固定20min,随后用1×PBS清洗3次。然后用含0.25%Triton X-100的PBS对细胞进行室温通透10min。
2.5.2使用封闭缓冲液(1×PBS+10%羊血清)37℃封闭1h后,用一抗(Myogenin,Rabbit,abcam,ab124800)4℃过夜染色。细胞用含0.1%Triton X-100的PBS清洗3次后,与二抗(Alexa Fluor 555goat anti-Rabbit)37℃孵育1h。
2.5.3细胞核用Hoechst 33342(beyotime,C1022,5μg/ml)染色5min,用倒置荧光显微镜成像,并用ImageJ分析图像。
结果分析:如图2所示,Dox诱导组中MYOG的表达水平高出DMSO对照组100余倍。如图3所示,在Dox诱导第2天,MYOG蛋白表达明显高于DMSO组。结果表明,已经成功构建出能够高表达MYOG基因的hCM-MYOG细胞株。
实施例3:MYOG抑制由过氧化氢诱导的hCM细胞凋亡
3.1过氧化氢诱导hCM-MYOG细胞凋亡:按MYOG不同表达时间将hCM-MYOG细胞分为7组(DMSO(+)48h&H
3.2细胞凋亡检测:流式细胞术实验:使用APC Annexin V检测试剂盒(Biolegend,640920)检测以上7组心肌细胞的凋亡情况。细胞按分组处理,消化后按试剂盒说明用凋亡早期标记物Annexin V标记后,用NovoCyte D2040R流式细胞分析仪(安捷伦)进行分析。结果如图4所示。
结果分析:其中4个分组使用流式细胞仪采集细胞凋亡结果如图4-a,重复采集3次后进行统计学分析。Dox(+)24h&H
实施例4:RNA-seq与分析MYOG调控DUSP13表达
4.1Dox诱导MYOG表达:纯化后的hCM-MYOG细胞,分6组(DMSO(+)48h,Dox(+)6h,Dox(+)12h,Dox(+)24h,Dox(+)48h,Dox(+)48h&H2O2(+))诱导MYOG表达,并以DMSO作为对照。Dox终浓度是2μg/mL,DMSO和Dox加入的量相等;H
4.2总RNA提取:用EZ-10总RNA 小量提取试剂盒(Sangon Biotech,B618583-0050)提取细胞总RNA。(样品使用RNase-Free DNA清除试剂盒(Sangon Biotech,B618253-0050)清除残留基因组DNA)。
4.3RNA-seq由Novogene公司完成,收集MYOG不同诱导表达时间(6h、12h、24h和48h),以及对照组(添加等量DMSO)。另外收集诱导48h后H
DUSP13-RT-F:CTTCCCCAACCGAGGCTT;
DUSP13-RT-R:CAGGGAGTAAGGACCAGCTC;
GAPDH-RT-F:TGGGTGTGAACCATGAGAAG;
GAPDH-RT-R:GTGTCGCTGTTGAAGTCAGA。
结果分析:筛选false discovery rate(FDR)<0.05和与对照相比log2(倍数变化)>1的蛋白编码基因,在此标准下,选择从诱导6小时到48小时表达持续增加的差异表达基因(DEGs)(图5-a),其中PHGR1、DUSP13和VWA5B2是诱导48小时后上调最多的3个基因。据报道,双特异性磷酸酶(DUSPs)家族成员DUSP13能使JNK1和p38α脱磷酸化,降低AP-1依赖性基因的表达。考虑到p38磷酸化是p38 MAPK介导的细胞凋亡的关键事件,MYOG可能通过直接启动DUSP13的表达来抑制p38 MAPK通路。Q-PCR结果也证实了DUSP13、ATOH8和FOXA3表达水平均有上调符合RNA-seq数据。免疫印迹结果也表明DUSP13在诱导MYOG表达下蛋白表达水平明显增加。
实施例5:MYOG识别并结合DUSP13的启动子区域
5.1使用JASPAR数据库预测DUSP13基因5’UTR上游2500bp的序列,预测MYOG的潜在结合位点(图6-a)。根据假设的结合位点分布,将DUSP13启动子区域(500bp、1000bp、1350bp、1500bp和2500bp)分为5个不同长度,分别命名为P500、P1000、P1350、P1500和P2500,突变序列Mut P1350由上海生工生物工程股份有限公司合成。通过PCR将这些序列克隆到Firefly荧光素酶报告载体PGL6-TA中(beyotime,D2105),MYOG cDNA亚克隆到表达载体pCW-N-Myc-Pur(Beyotime,D2791)。引物序列如下:
DUSP13-HindIII-R:GTAAGCTTGTCATTTCTCCTTCCCAG;
DUSP13-P500-XhoI-F:TATACTCGAGCCTGACCTCCGTAATTCAGAG;
DUSP13-P1000-XhoI-F:AACTCGAGCGTCTCCCCATTTGACAT;
DUSP3-P1350-XhoI-F:AACTCGAGCGACTTCAATGGTTCTGA;
DUSP13-P1500-XhoI-F:AACTCGAGCTGTATTTTCCTCACTCC;
DUSP13-P2500-XhoI-F:AACTCGAGAGTTCGACAACCTCCATTTG。
5.2双荧光素酶检测:
将这些Firefly荧光素酶报告载体,MYOG表达载体和Renilla荧光素酶报告载体PRL-TK共转染人293T细胞,通过Dual-Lumi
结果分析:双荧光素酶报告实验结果显示,与对照组(转染PGL6载体的细胞)相比,P1350组(转染P1350的细胞)荧光素酶的相对活性最强(40.5倍)。P500、P1000和P1500组的荧光素酶活性相对较低(分别为20.2倍、20.3倍和25.4倍)。因此-1244~-1233区域可能是MYOG的核心结合位点。通过合成DNA片段构建突变的P1350载体(Mut P1350,从CAGCTG到ACTGGC)。结果Mut P1350组相对荧光素酶活性(21.9倍)较P1350组降低46%(图6-b)。这些数据表明,MYOG可以直接结合DUSP13的启动子区域,并上调其表达。
实施例6:DUSP13抑制过氧化氢诱导的心肌细胞凋亡
6.1构建载体pcDNA3.1-DUSP13A、pcDNA3.1-DUSP13B
6.1.1载体pcDNA3.1+由HonorGene公司提供。从NCBI网站查询DUSP13A和DUSP13B的编码区,根据编码区序列设计引物,并引入酶切位点,引物序列如下所示(其中F表示正向引物,R表示反向引物,大写表示酶切位点)。
DUSP13A-NheI-F:tataGCTAGCaccatggctgagacctctctcc;
DUSP13A-BamhI-R:tataGGATCCtcagctctggccggcac;
DUSP13B-NheI-F:taGCTAGCaccatggactcactgcagaagcag;
DUSP13B-BamhI-R:tataGGATCCtcagaaccgccccgtctcc。
6.1.2以人心肌细胞cDNA为模板,利用各基因引物进行PCR扩增,具体如下:
反应体系(50μl)为:2×Hight Fidelity PCR Master Mix 25μl,上下游引物(5μM)各1μl,模板1μl,ddH2O 22μl。
基因PCR扩增程序为:95℃5min;95℃30sec,56℃1min,72℃1min,循环30次;72℃10min。
6.2瞬时转染hCM:
hCM细胞分4组:pcDNA3.1&H
结果分析:各个分组使用流式细胞仪采集细胞凋亡结果如图7-a~e,重复采集3次后进行统计学分析。与对照组(转染空载体)相比,表达DUSP13A和DUSP13B显著降低了H
由此可知:
(1)本发明成功构建了hCM-MYOG细胞株,经验证,Dox可诱导hCM-MYOG细胞高表达MYOG基因。
(2)高表达MYOG基因可以抑制由ROS诱导的心肌细胞凋亡。
(3)MYOG通过直接调控DUSP13的表达抑制ROS诱导的心肌细胞凋亡。
(4)MYOG识别并直接结合DUSP13的启动子区域,上调其表达。
(5)过表达DUSP13能抑制氧化应激(ROS)诱导的心肌细胞凋亡。
本发明首次发现了MYOG通过上调DUSP13抑制氧化应激(ROS)诱导的心肌细胞凋亡的机制,为心肌细胞凋亡相关的心血管疾病药物的研发和临床治疗提供了一个新思路。
- MYOG基因作为靶点在制备治疗心肌细胞凋亡相关的心血管疾病的药物中的应用
- MYOG基因作为靶点在制备治疗心肌细胞凋亡相关的心血管疾病的药物中的应用
