一种药物涂层球囊导管及其制备方法
文献发布时间:2024-01-17 01:13:28
技术领域
本发明涉及医疗器械技术领域,具体涉及一种药物涂层球囊导管及其制备方法。
背景技术
动脉粥样硬化是心脑血管病患者最常见的血管病变,是冠心病、脑梗死及外周血管病的主要原因。动脉粥样硬化会导致动脉壁增厚变硬、血管管腔狭窄甚至闭塞,从而引起动脉内血流减少或中断。
目前针对动脉粥样硬化性狭窄,主要是通过药物治疗、单纯球囊扩张、血管支架的方法来治疗的。在临床上,治疗脑血管ICAS(全称为颅内动脉粥样硬化性狭窄)是通过长期口服抗血小板药物,以及控制高血脂、高血压、糖尿病和吸烟等危险因素为主。虽然这对降低脑血管ICAS患者的卒中发生率具有一定作用,但临床的实际效果并不能令人完全满意,特别是存在不稳定斑块和血流动力学性脑缺血事件的患者。对于颅内主要动脉狭窄程度较高(狭窄程度较高是指狭窄率为70%~99%)的ICAS患者,即便能够接受合适的药物进行治疗,但其卒中复发率仍然居高不下,而且长期药物治疗所带来的肝肾功能损伤等药物副作用不容忽视。至于采用单纯球囊扩张治疗颅内主要动脉狭窄容易存在再狭窄等问题。而血管支架属于血管内植入物,植入血管支架的患者需要长期服用双抗药物,这就存在炎症、血栓形成、再狭窄等问题。
针对动脉粥样硬化性狭窄,采用单纯球囊成形术会出现较高的再狭窄率,因此,药物支架和药物球囊应运而生。但是药物支架属于血管内植入物,患者需长期服用双抗药物,同时会带来炎症、血栓形成、再狭窄等远期问题。药物球囊虽然避免了异物植入的问题,但存在输送损失高、组织吸收差的问题,此外,目前药物球囊大多存在基质和/或载体,从而导致潜在风险增加。
近些年来,药物涂层球囊导管(DCB)作为一种新的介入治疗技术在欧洲逐渐广泛应用于冠状动脉及外周介入领域。一方面,药物涂层球囊导管作为介入器械,避免了血管支架作为永久植入物在血管内可能造成的因药物持续接触血管内壁导致的内皮化障碍、晚期血栓及炎症等风险。另一方面,药物涂层球囊导管还提供了短期存在并可控的药物来抑制血管的内皮增生。
目前国内市场也有药物涂层球囊导管的投入,且有多个已经投入临床使用或即将投入临床使用。现有药物涂层球囊导管需要采用基质及聚合物等成分将紫杉醇、紫杉醇衍生物、雷帕霉素及雷帕霉素衍生物作为活性药物涂层。含有基质及聚合物成分的药物涂层球囊导管存在潜在风险。此外,根据相关研究,目前用于血管成形术(主要是外周和冠脉)的药物涂层球囊导管,其药物涂层均为紫杉醇。但紫杉醇具有细胞毒性,安全剂量范围较窄,并且其在抑制再狭窄方面的作用弱于雷帕霉素,这些缺点已经在冠脉药物支架中得到证实。而采用雷帕霉素作为药物涂层,由于雷帕霉素的亲脂性差会导致靶病变部位的吸收慢。
发明内容
本发明提供了一种药物涂层球囊导管及其制备方法,以解决现有采用雷帕霉素作为药物涂层的药物涂层球囊导管由于亲脂性差导致的靶病变部位的吸收慢,药物转载率及利用率低的技术问题。
申请人现有一件公开号为CN115624656B的中国发明专利能够解决背景技术中的技术问题,但在解决上述技术问题的同时,上述中国发明专利所制备的药物涂层球囊导管的药物涂层的药物颗粒的粒径仍不够细,而且在加热干燥药物颗粒时会产生静电,从而导致药物颗粒难以收集。
本发明公开一种药物涂层球囊导管的制备方法,药物涂层球囊导管包括依次连接的远端头端、球囊本体、导管及导管座,该药物涂层球囊导管的制备方法包括:
将雷帕霉素和/或雷帕霉素衍生物与第一良性溶剂进行混合;
之后依次进行第一涡旋混合处理、第一水浴超声处理及第一真空冻干处理,获得雷帕霉素和/或雷帕霉素衍生物的第一药物颗粒;
将第一药物颗粒与第二良性溶剂、不良溶剂混合,获得雷帕霉素和/或雷帕霉素衍生物浓度为5 mg/ml~40mg/ml的第一混合溶液;
之后依次进行第二涡旋混合处理、第二水浴超声处理及第二真空冻干处理,获得雷帕霉素和/或雷帕霉素衍生物的第二药物颗粒;
将第二药物颗粒与第二良性溶剂、不良溶剂混合,获得雷帕霉素和/或雷帕霉素衍生物浓度为5 mg/ml~40mg/ml的第二混合溶液;
采用第一混合溶液对球囊本体进行至少一次底层喷涂处理;
采用第二混合溶液对球囊本体进行至少一次药物层喷涂处理;
采用第一混合溶液对球囊本体进行至少一次表层喷涂处理;
将依次经过底层喷涂处理、药物层喷涂处理及表层喷涂处理的球囊导管进行避光干燥处理。
进一步的,将雷帕霉素和/或雷帕霉素衍生物与第一良性溶剂按照1:1~20的比例进行混合生成混合物。
进一步的,第一涡旋混合处理包括:将混合物以2500r/min进行涡旋混合,处理时长为1h~4h。
进一步的,第一水浴超声处理包括:将经过第一涡旋混合处理的混合物进行水浴处理,水浴的温度取值范围为20℃~40℃;同时,对进行水浴的混合物进行超声处理,超声的频率取值范围为10khz~80khz,处理时长为30min。
进一步的,第一真空冻干处理包括:将经过第一水浴超声处理的混合物与水按照2~10:1的比例进行混合,并进行真空冻干处理,处理时长至少24h,获得粒径的取值范围为0.01um~6um的雷帕霉素和/或雷帕霉素衍生物的第一药物颗粒。
进一步的,在第一药物颗粒与第二良性溶剂、不良溶剂进行混合时,第二良性溶剂与不良溶剂的比值范围为0.1~6,且获得雷帕霉素和/或雷帕霉素衍生物浓度为5 mg/ml~40mg/ml的第一混合溶液。
进一步的,第二涡旋混合处理包括:将混合物以2500r/min进行涡旋混合,处理时长为0.1h~2h。
进一步的,第二水浴超声处理包括:将经过第二涡旋混合处理的混合物进行水浴处理,水浴的温度取值范围为20℃~40℃;同时,对进行水浴的混合物进行超声处理,超声的频率取值范围为10khz~80khz,处理时长为30min。
进一步的,第二真空冻干处理包括:将经过第二水浴超声处理的混合物与水按照2~10:1的比例进行混合,并进行真空冻干处理,处理时长至少24h,获得粒径的取值范围为0.05um~15um的雷帕霉素和/或雷帕霉素衍生物的第二药物颗粒。
进一步的,在第二药物颗粒与第二良性溶剂、不良溶剂进行混合时,第二良性溶剂与不良溶剂的比值范围为0.1~6,且获得雷帕霉素和/或雷帕霉素衍生物浓度为5 mg/ml~40mg/ml的第二混合溶液。
进一步的,采用单通道喷涂机或双通道喷涂机将第一混合溶液及第二混合溶液喷涂到球囊本体上。
进一步的,单通道喷涂机或双通道喷涂机的喷涂参数包括:湿度的取值范围为60%~90%,流量的取值范围为0.02 ml/min~0.12ml/min,进给速度的取值范围为1 mm/s~10mm/s,旋转速度的取值范围为1圈/s ~10圈/s,功率的取值范围为0.1 W~3W。
本发明还公开一种药物涂层球囊导管,其由如上所述任一项的药物球囊导管的制备方法制得,药物球囊导管的球囊本体包括至少一层底层药物涂层至少一层中间药物层及至少一层表层药物涂层。
本发明提供的药物涂层球囊导管及其制备方法,可以实现以下技术效果:
1、采用上述方法制备的药物涂层球囊导管,其底层药物涂层、表层药物涂层均由粒径的取值范围为0.01um~6um的雷帕霉素和/或雷帕霉素衍生物的第一药物颗粒组成,这样小粒径的第一药物颗粒形成的底层药物涂层能够提高结合强度,而形成的表层药物涂层能够使其表层均匀致密以减少药物运输过程中的损失。而其中间药物层由粒径的取值范围为0.05um~15um的雷帕霉素和/或雷帕霉素衍生物的第二药物颗粒组成,中间药物层的第二药物颗粒的粒径较大,且排列疏松,能够促进有效转载。这样的第一药物颗粒及第二药物颗粒均属于纳米级的微晶体颗粒,具有更强的附着力,降低了药物颗粒在球囊本体的运输过程中的脱落及损失。
2、采用上述方法制备的药物涂层球囊导管通过采用不同粒径的药物颗粒晶体还弥补了雷帕霉素亲脂性差的缺点,从而提高了靶病变部位的吸收速度,具有较长的组织停留时间,提高了药物的转载率及利用率。
3、采用本发明的上述方法制备的药物涂层球囊导管,其底层药物涂层、中间药物层及表层药物涂层均为雷帕霉素和/或雷帕霉素衍生物的纯药物涂层,不含有聚合物、基质及载体,降低了潜在的风险。
4、采用本发明的上述方法制备的药物涂层球囊导管,能够有效抑制血管成形术后的再狭窄。
5、本发明采用采用真空冻干处理的方式不仅能够使药物颗粒晶体更加细小,还能够避免药物颗粒聚结成难以分散的团块。
6、采用真空冻干处理的方式制备药物颗粒还能够避免静电的产生,利于药物颗粒的收集。
以上的总体描述和下文中的描述仅是示例性和解释性的,不用于限制本发明。
附图说明
一个或一个以上实施例通过与之对应的附图进行示例性说明,这些示例性说明和附图并不构成对实施例的限定,附图中具有相同参考数字标号的元件视为类似的元件,并且其中:
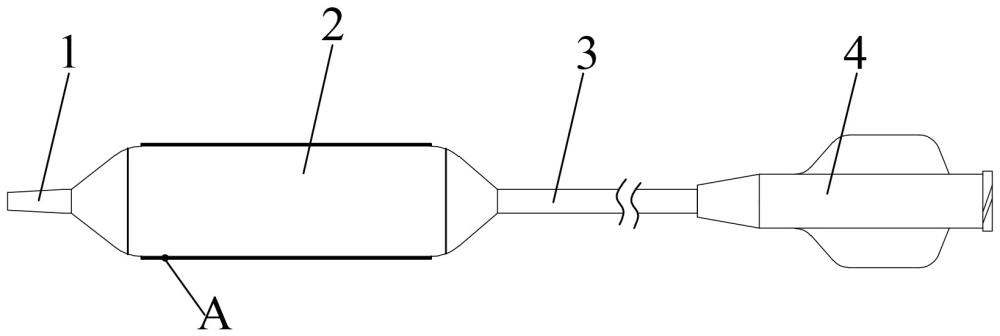
图1是本发明一种药物涂层球囊导管的一种实施例的示意图;
图2是图1的A部放大图。
附图标记:
1、远端头端;2、球囊本体;3、导管;4、导管座;5、底层药物涂层;6、中间药物层;7、表层药物涂层。
具体实施方式
为了能够更加详尽地了解本公开实施例的特点与技术内容,下面结合附图对本公开实施例的实现进行详细阐述,所附附图仅供参考说明之用,并非用来限定本公开实施例。在以下的技术描述中,为方便解释起见,通过多个细节以提供对所披露实施例的充分理解。然而,在没有这些细节的情况下,一个或多个实施例仍然可以实施。在其它情况下,为简化附图,熟知的结构和装置可以简化展示。
本公开实施例的说明书和权利要求书及上述附图中的术语“第一”、“第二”等是用于区别类似的对象,而不必用于描述特定的顺序或先后次序。应该理解这样使用的数据在适当情况下可以互换,以便这里描述的本公开实施例的实施例。此外,术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含。
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的药物涂层球囊导管及其制备方法进行具体说明。
在本发明中,药物涂层球囊导管的药物可以采用雷帕霉素,或采用雷帕霉素衍生物,还可以采用雷帕霉素及雷帕霉素衍生物。采用雷帕霉素及雷帕霉素衍生物作为药物涂层,相对于紫杉醇作为药物涂层的细胞毒性更低,安全剂量范围更广。雷帕霉素的不良溶剂包括正庚烷、乙醚,或与前述试剂化学性质相同或相似的化学试剂。雷帕霉素的第一良性溶剂及第二良性溶剂相同,均包含乙腈、甲醇、乙醇、丙酮、氯仿、四氢呋喃、乙酸乙酯,或与前述试剂化学性质相同或相似的化学试剂。在后续的介绍中,将以雷帕霉素、正庚烷作为雷帕霉素的不良溶剂及乙腈作为雷帕霉素的第一良性溶剂、第二良性溶剂为例进行介绍。
如图1所示,药物涂层球囊导管包括依次连接的远端头端1、球囊本体2、导管3及导管座4,本发明提供的药物涂层球囊导管的制备方法包括:
步骤A、混合物的制备:
在试管中加入雷帕霉素及乙腈进行混合生成混合物,雷帕霉素与乙腈按照1:1~20的比例进行混合。乙腈能够为雷帕霉素后续的真空冻干处理提供液态环境。
优选的,在试管中加入1份重量的雷帕霉素及1份重量的乙腈,此时,雷帕霉素与乙腈按照1:1的比例进行混合。优选的,在试管中加入1份重量的雷帕霉素及10份重量的乙腈,此时,雷帕霉素与乙腈按照1:10的比例进行混合。优选的,在试管中加入1份重量的雷帕霉素及15份重量的乙腈,此时,雷帕霉素与乙腈按照1:15的比例进行混合。优选的,在试管中加入1份重量的雷帕霉素及20份重量的乙腈,此时,雷帕霉素与乙腈按照1:20的比例进行混合。乙腈为雷帕霉素的良性溶剂,能够使雷帕霉素溶解于乙腈。但乙腈在混合物中占比越多,越不利于后期的真空冻干处理,故本发明所公开的比例能够使得乙腈在混合物中保持合适的占比,利于后期的真空冻干处理。
步骤B、第一药物颗粒的制备:
步骤b1、将试管放入涡旋混合仪器进行第一涡旋混合处理。将涡旋混合仪器的转速设置为2500r/min,试管内的混合物也以同样的转速进行涡旋混合处理。涡旋混合处理的时长为1h~4h,这样能够保障雷帕霉素被充分混合溶解,避免雷帕霉素的药物颗粒聚结成团块。
优选的,涡旋混合处理的时长为3h,既能够让雷帕霉素被充分溶解,还能够节约研磨时间。
步骤b2、将试管从涡旋混合仪器中取出,并将试管放入超声波清洗机中进行第一水浴超声处理。在超声波清洗机中,采用水浴的方式对试管内的混合物进行加热,而水浴的温度取值范围为20℃~40℃。同时,还采用超声波对试管内的混合物进行超声处理,超声波的频率取值范围为10khz~80khz。第一水浴超声处理的时长为30min。这样的设置能够让雷帕霉素在乙腈中产生高频振荡,从而进一步溶解,还能够使得雷帕霉素在乙腈均匀地分布,便于后续的真空冻干处理。
步骤b3、在经过第一水浴超声处理的混合物中加入水,以实现调整混合物的凝固点的目的,便于进行真空冻干处理。经过第一水浴超声处理的混合物与水按照2~10:1的比例进行混合,之后进行第一真空冻干处理获得雷帕霉素的第一药物颗粒。第一真空冻干处理的时长至少为24h,以保障混合物中的水及乙腈充分升华。经过上述处理的第一药物颗粒的粒径的取值范围为0.01um~6um。
步骤C、第一混合溶液的制备:
将雷帕霉素的第一药物颗粒与乙腈、正庚烷进行混合,在雷帕霉素的第一药物颗粒与乙腈、正庚烷进行混合时,乙腈与正庚烷的比值的取值范围为0.1~6,通过控制雷帕霉素的第二良性溶剂与雷帕霉素的不良溶剂的比值,从而获得雷帕霉素的第一混合溶液,在第一混合溶液中,雷帕霉素的浓度为5mg/ml~40mg/ml。这样的第一混合溶液更加利于底层药物涂层5及表层药物涂层7的形成,且其药物涂层均匀致密。
步骤D、第二药物颗粒的制备:
步骤d1、将试管放入涡旋混合仪器进行第二涡旋混合处理。将涡旋混合仪器的转速设置为2500r/min,试管内的混合物也以同样的转速进行涡旋混合处理。涡旋混合处理的时长为0.1h~2h,这样能够保障雷帕霉素被充分混合溶解,避免雷帕霉素产生团聚现象。
优选的,涡旋混合处理的时长为2h,既能够让雷帕霉素被充分溶解,还能够节约研磨时间。
步骤d2、将试管从涡旋混合仪器中取出,并将试管放入超声波清洗机中进行第二水浴超声处理。在超声波清洗机中,采用水浴的方式对试管内的混合物进行加热,而水浴的温度取值范围为20℃~40℃。同时,还采用超声波对试管内的混合物进行超声处理,超声波的频率取值范围为10khz~80khz。第二水浴超声处理的时长为30min。这样的设置能够让雷帕霉素在乙腈中产生高频振荡,从而进一步溶解,还能够使得雷帕霉素在乙腈均匀地分布,便于后续的真空冻干处理。
步骤d3、在经过第二水浴超声处理的混合物中加入水,以实现调整混合物的凝固点的目的,便于进行真空冻干处理。经过第二水浴超声处理的混合物与水按照2~10:1的比例进行混合,之后进行第二真空冻干处理获得雷帕霉素的第二药物颗粒。第二真空冻干处理的时长至少为24h,以保障混合物中的水及乙腈充分升华。经过上述处理的第二药物颗粒的粒径的取值范围为0.05um~15um。
步骤E、第二混合溶液的制备:
将雷帕霉素的第二药物颗粒与乙腈、正庚烷进行混合,在雷帕霉素的第二药物颗粒与乙腈、正庚烷进行混合时,乙腈与正庚烷的比值的取值范围为0.1~6,通过控制雷帕霉素的第二良性溶剂与雷帕霉素的不良溶剂的比值,从而获得雷帕霉素的第二混合溶液,在第二混合溶液中,雷帕霉素的浓度为5mg/ml~40mg/ml。这样的第二混合溶液更加利于中间药物层6的形成,且其药物涂层均匀致密。
可选地,步骤B可以比步骤D先一步进行制备。可选地,步骤D可以比步骤B先一步进行制备。可选地,步骤B可与步骤D同时进行制备。
可选地,步骤C可以比步骤E先一步进行制备。可选地,步骤E可以比步骤C先一步进行制备。可选地,步骤C可与步骤E同时进行制备。
步骤F、药物涂层球囊导管的药物涂层喷涂处理:
步骤f1、采用单通道喷涂机对药物涂层球囊导管的球囊本体2进行药物涂层的喷涂。单通道喷涂机的数量为至少一个。可选地,当单通道喷涂机的数量为一个时,先采用单通道喷涂机将第一混合溶液对球囊本体2进行一次底层喷涂处理,以便形成一层底层药物涂层5;之后,将单通道喷涂机清洗干净;再采用单通道喷涂机将第二混合溶液对球囊本体2进行一次药物层喷涂处理,以便形成一层中间药物层6;然后,将单通道喷涂机清洗干净;最后采用单通道喷涂机将第一混合溶液对球囊本体2进行表层喷涂处理,以便形成一层表层药物涂层7。可选地,当单通道喷涂机的数量为两个时,一个单通道喷涂机用来喷涂第一混合溶液,另一个单通道喷涂机用来喷涂第二混合溶液,这样的设置方式无需清洗单通道喷涂机。仅需采用两个单通道喷涂机依次交替喷涂,即可完成球囊本体2的底层喷涂处理、药物层喷涂处理、表层喷涂处理,并使得球囊本体2上依次形成一层底层药物涂层5、一层中间药物层6及一层表层药物涂层7。
步骤f2、采用双通道喷涂机对药物涂层球囊导管的球囊本体2进行药物涂层的喷涂。双通道喷涂机的一个通道用来喷涂第一混合溶液,另一个通道用来喷涂第二混合溶液,采用两个通道依次交替喷涂,即可完成球囊本体2的底层喷涂处理、药物层喷涂处理、表层喷涂处理,并使得球囊本体2上依次形成一层底层药物涂层5、一层中间药物层6及一层表层药物涂层7。双通道喷涂机的作用等同于两个单通道喷涂机,但双通道喷涂机的两个通道同属于一个产品,其整体性更强,喷涂效果优于两个单通道喷涂机的喷涂效果。
在药物涂层喷涂处理时,只能选择步骤f1或步骤f2。单通道喷涂机及双通道喷涂机在喷涂时,均采用超声波雾化喷涂。其中,超声波雾化喷涂的具体方式可参考现有技术,在此不做具体的赘述。在制备第一混合溶液及第二混合溶液时,添加正庚烷,此处的正庚烷用于降低雷帕霉素的药物颗粒的溶解度,更利于药物涂层的形成。
优选的,为了能够使药物涂层的喷涂效果更好,单通道喷涂机或双通道喷涂机的喷涂参数均可设置为如下参数:
湿度的取值范围为60%~90%,流量的取值范围为0.02ml/min~0.12ml/min,进给速度的取值范围为1mm/s~10mm/s,旋转速度的取值范围为1圈/s~10圈/s,功率的取值范围为0.1W~3W。
步骤f3、将依次经过底层喷涂处理、药物层喷涂处理及表层喷涂处理的球囊导管进行避光干燥处理。在本步骤中,避光干燥处理采用避光的自然干燥处理,其温度的取值范围为15℃~35℃,其湿度的取值范围为30%~80%,避光干燥处理的时长为0.5h~48h,以确保药物涂层彻底成型。这样的温度不会对雷帕霉素的药性产生损伤。
本发明提供的药物涂层球囊导管,其可以由上述药物涂层球囊导管的制备方法制得,也可以采用其他的现有方式进行制备,但无论采用什么方式制备,制备的药物涂层球囊导管的结构均需满足以下要求:
如图1、图2所示,本发明还提供一种药物涂层球囊导管,其由如上所述任一项可选实施例的药物球囊导管的制备方法制得。药物球囊导管的球囊本体2包括至少一层底层药物涂层5至少一层中间药物层6及至少一层表层药物涂层7。
优选的,当中间药物层6的层数与表层药物涂层7的层数均为多层时,中间药物层6与表层药物涂层7在球囊本体2的外表面依次交替设置。这种中间药物层6与表层药物涂层7交替设置的方式能够有效控制药物涂层的释放速度,同时使得药物颗粒的释放速度规律化。此处的多层为至少两层,例如,可以采用两层,或三层,或四层等。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 一种药物球囊导管和球囊装置
- 一种药物涂层球囊导管的制备方法、制备得到的药物涂层球囊导管及其应用
- 一种药物涂层球囊导管的制备方法、制备得到的药物涂层球囊导管及其应用
