移植材料以及肾移植试剂盒
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及移植材料以及肾移植试剂盒(肾移植套件)。
本申请基于2021年5月28日向日本申请的特愿2021-090066号要求优先权,在此将该申请的内容引用于本说明书中。
背景技术
从最初进行器官移植以来,作为避免供体不足的问题的手段,异种供体器官受到关注。尤其是,在猪发育工程技术方面取得进步并生产出对异种移植有用的已施加基因操作(基因操纵)的猪,正在进行使用了非人灵长类动物作为受体的临床前模型的验证(参照非专利文献1)。
近年来,基因改造猪也得到开发,已有通过利用非常强力的免疫抑制药进行控制来实现长期移植物存活的相关报告(参照非专利文献2~4)。
现有技术文献
非专利文献
非专利文献1:Qi S,Peng J,Xu D,Vu MD,Liu D,Chen H.Improved techniquesfor kidney transplantation in the monkey.Microsurgery.1999;19(7):335-7.
非专利文献2:Iwase H,Hara H,Ezzelarab M,et al.Immunologic andphysiologic observations in baboons with life-supporting geneticallyengineered pig kidney grafts.Xenotransplantation.2017;24(2):10.1111/xen.12293.
非专利文献3:Higginbotham L,Mathews D,Breeden CA,et al.Pre-transplantantibody screening and anti-CD154 costimulation blockade promote long-termxenograft survival in a pig-to-primate kidney transplantmodel.Xenotransplantation.2015;22(3):221-230.doi:10.1111/xen.12166
非专利文献4:Kim SC,Mathews DV,Breeden CP,et al.Long-term survival ofpig-to-rhesus macaque renal xenografts is dependent on CD4 T celldepletion.Am J Transplant.2019;19(8):2174-2185.doi:10.1111/ajt.15329
发明内容
发明要解决的问题
然而,在从猪向灵长类动物的肾异种移植中,仅用在临床上得到承认的免疫抑制药来控制免疫应答是非常困难的,需要进一步改善。
因此,本发明的目的在于提供一种在向灵长类动物的移植时能够抑制受体的排斥反应并且可实现长期移植物存活的移植材料以及肾移植试剂盒。
用于解决问题的手段
本发明包括如下技术方案。
[1]一种向灵长类动物的肾异种移植用的移植材料,其包含来源于猪胎儿的不带血管的附有膀胱的肾脏原基。
[2]如[1]所述的移植材料,其中,所述附有膀胱的肾脏原基来源于胎生4周~6周的猪胎儿。
[3]如[1]或[2]所述的移植材料,其中,所述附有膀胱的肾脏原基来源于野生型猪胎儿。
[4]如[1]至[3]中任一项所述的移植材料,其中,所述附有膀胱的肾脏原基还包含来源于人的肾单位祖细胞。
[5]如[1]至[4]中任一项所述的移植材料,其中,用于根据免疫抑制方案施用免疫抑制剂的患者。
[6]如[5]所述的移植材料,其中,所述免疫抑制方案包括:
(1)施用选自抗胸腺细胞球蛋白(thymoglobulin)及抗CD20抗体中的至少一种免疫抑制剂;以及
(2)施用选自CD28介导的共刺激信号抑制剂、钙调磷酸酶抑制剂、肌苷单磷酸脱氢酶抑制剂、类固醇、抗CD25抗体以及抗CD40抗体中的至少一种免疫抑制剂。
[7]如[6]所述的移植材料,其中,所述免疫抑制方案还包括:
(3)施用选自抗IL-6受体抗体及TNF-α抑制剂中的至少一种抗炎剂和/或
(4)施用选自血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂及抗病毒剂中的至少一种佐剂。
[8]如[5]至[7]中任一项所述的移植材料,其中,所述免疫抑制方案包括:
(1)在移植2~3天前,独立地施用抗胸腺细胞球蛋白以及抗CD20抗体;
(2)在移植后每7天或者刚移植后及每7天施用CD28介导的共刺激信号抑制剂;
(3)从移植9天前开始持续地施用钙调磷酸酶抑制剂;
(4)从移植5天前开始持续地施用肌苷单磷酸脱氢酶抑制剂;
(5)从移植当天开始持续地施用类固醇;
(6)在移植前一天以及移植后约每7天施用1~3次抗IL-6受体抗体;
(7)从刚移植后开始每3~4天施用TNF-α抑制剂;以及
(8)施用选自血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂及抗病毒剂中的至少一种药剂作为佐剂。
[9]如[5]至[7]中任一项所述的移植材料,其中,所述免疫抑制方案包括:
(1)在移植约2~3周前施用抗CD20抗体;
(2)从移植前约2周前开始持续地施用肌苷单磷酸脱氢酶抑制剂;
(3)在移植当天以及第4天施用抗CD25抗体;
(4)从移植前约1周前开始持续地施用钙调磷酸酶抑制剂以及类固醇;以及
(5)施用选自血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂及抗病毒剂中的至少一种药剂作为佐剂。
[10]一种肾移植试剂盒,其包括上述[1]至[4]中任一项所述的移植材料、以及基于免疫抑制方案使用的药剂的组合物。
[11]如[10]所述的肾移植试剂盒,其中,所述免疫抑制方案包括:
(1)施用选自抗胸腺细胞球蛋白及抗CD20抗体中的至少一种免疫抑制剂;以及
(2)施用选自CD28介导的共刺激信号抑制剂、钙调磷酸酶抑制剂、肌苷单磷酸脱氢酶抑制剂、类固醇、抗CD25抗体以及抗CD40抗体中的至少一种免疫抑制剂。
[12]如[11]所述的肾移植试剂盒,其中,所述免疫抑制方案还包括:
(3)施用选自抗IL-6受体抗体及TNF-α抑制剂中的至少一种抗炎剂和/或
(4)施用选自血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂及抗病毒剂中的至少一种佐剂。
[13]如[10]至[12]中任一项所述的肾移植试剂盒,其中,所述免疫抑制方案包括:
(1)在移植2~3天前独立地施用抗胸腺细胞球蛋白以及抗CD20抗体;
(2)在移植后每7天或者刚移植后及每7天施用CD28介导的共刺激信号抑制剂;
(3)从移植9天前开始持续地施用钙调磷酸酶抑制剂;
(4)从移植5天前开始持续地施用肌苷单磷酸脱氢酶抑制剂;
(5)从移植当天开始持续地施用类固醇;
(6)在移植前一天以及移植后约每7天施用1~3次抗IL-6受体抗体;
(7)从刚移植后开始每3~4天施用TNF-α抑制剂;以及
(8)施用血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂以及抗病毒剂作为佐剂。
[14]如[10]至[12]中任一项所述的肾移植试剂盒,所述免疫抑制方案包括:
(1)在移植约2~3周前施用抗CD20抗体;
(2)从移植前约2周前开始持续地施用肌苷单磷酸脱氢酶抑制剂;
(3)在移植当天以及第4天施用抗CD25抗体;
(4)从移植前约1周前开始持续地施用钙调磷酸酶抑制剂以及类固醇;以及
(5)施用选自血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂及抗病毒剂中的至少一种药剂作为佐剂。
发明效果
基于本发明,能够提供在向灵长类动物的移植时能够抑制受体的排斥反应、能够实现长期移植物存活的移植材料以及肾移植试剂盒。
附图说明
图1是实施例的各动物的血液检测数据。图1的(A):编号200(实验1)。图1的(B):编号335(实验1)。图1的(C):编号323(实验2)。图1的(D):编号219(实验2)。
图2是在实验1中被移植的新生仔的肾脏的照片。图2的(A)移植时。图2的(B)移植后13天。
图3是在实验1中被移植的胎儿泄殖腔的照片。图3的(A):移植后13天。图3的(B):移植后27天。
图4是对实验1的新生仔肾脏与胎儿泄殖腔的组织病理学的特征进行比较的代表性的照片。图4的(A)~(C):新生仔肾脏。图4的(D)~(F):胎儿泄殖腔(移植后13天)。图4的(G)~(I):胎儿泄殖腔(移植后27天)。图4的(A)(B)(D)(E)(G)(H):Masson三色染色像。图4的(C)(F)(I):CD3。
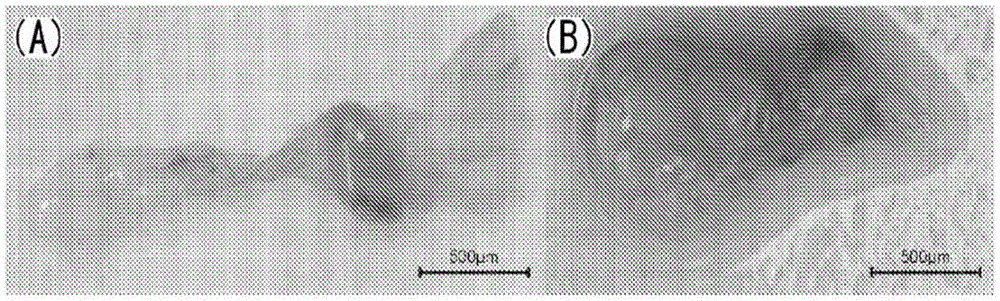
图5是在实验2中被移植的胎儿泄殖腔的照片。图5的(A):移植后33天。图5的(B):移植后50天。图5的(C):移植后79天。
图6是对实验2的胎儿泄殖腔的组织病理学的特征进行比较的代表性照片。图6的(A)~(C):移植后33天。图6的(D)~(F):移植后50天。图6的(G)~(I):移植后79天。图6的(A)(B)(D)(E)(G)(H):Masson三色染色像。图6的(C)(F)(I):CD3。
具体实施方式
<<移植材料>>
本发明在一实施方式中提供一种向灵长类动物的肾异种移植用的移植材料,其包含来源于猪胎儿的不带血管的附有膀胱的肾脏原基。
本实施方式的移植材料能够适当地用于改善肾功能降低了的灵长类动物的肾功能。
<<肾脏原基>>
肾脏原基指胎儿期的肾脏,对于哺乳类而言相当于后肾。在胎儿期的哺乳类中,形成膀胱-输尿管-后肾组织成为一体的组织,但是在本说明书中,将该组织称为附有膀胱的肾脏原基。发明人将该胎儿期的膀胱-输尿管-后肾组织取名为泄殖腔移植物。即,在本说明书中,附有膀胱的肾脏原基也称为泄殖腔移植物。如果将肾脏原基移植到动物的腹腔内,则血管从受体进入泄殖腔并持续发育、产生尿。
在实施例中,如后面所述地,当分别将带血管的猪新生仔肾脏以及不带血管的来源于猪胎儿的附有膀胱的肾脏原基移植到作为受体的食蟹猴时,猪-猴肾异种移植的胎儿肾脏原基(来源于猪胎儿的附有膀胱的肾脏原基)的免疫原性低于新生仔肾脏的免疫原性。
对于伴随血管吻合的新生仔肾脏移植物,在数周后观察到急性排斥反应。另一方面,尽管施用了相同的免疫抑制方案,但是猪的胎儿肾脏原基(来源于猪胎儿的附有膀胱的肾脏原基)却避免了排斥反应,持续了长期间具体而言至少约80天的生长。
即,判明了:移植后的发育中(也称为成长中)的肾脏的流入血管是受体的血管,通过使用不带血管的来源于猪胎儿的附有膀胱的肾脏原基,能够避免异种排斥反应的最初目标——即作为超急性排斥反应之一的血管内皮功能障碍。
附有膀胱的肾脏原基优选为来源于胎生4周~6周(28天~42天)的猪胎儿,更优选为来源于胎生28天~30天的猪胎儿。通过使用涉及的胎生期的肾脏,不会分化为其它组织,容易成熟为产生尿的肾组织。
另外,异种受体的血管在移植过程流入胎儿的肾脏,供体抗原的表达在肾脏的发育阶段容易减少。
作为一种方式,附有膀胱的肾脏原基优选为来源于野生型的猪胎儿。即,在以往的来源于猪的肾脏组织向灵长类动物的移植中,为了避免受体的强烈的排斥反应,必须进行猪的基因改造,但是在实施例中如后述那样确认到:在本发明中,通过使用来源于未伴随基因改造的野生型的猪胎儿的附有膀胱的肾脏原基作为移植材料,能够抑制急性排斥反应。
作为一种实施方式,附有膀胱的肾脏原基优选为未实施用于避免异种移植的排斥反应的基因改造。作为该基因改造,可以举出本领域技术人员公知的方法(例如,Xiao-HuaYu et al.,Clinica Chimica Acta 514(2021)15-23,或者Lu et al.,Frontiers inImmunology,January 2020,Volume 10,Article3060),具体而言,可以举出:α1,3-半乳糖基转移酶(GalT)敲除、CMP-N-乙酰神经氨酸羟化酶(CMAH)敲除、β-1,4N-乙酰氨基半乳糖转移酶e(β4GalNT2)敲除、人CD39(hCD39)基因导入、人CD46(hCD46)基因导入、人CD47(hCD47)基因导入、人CD55(hCD55)基因导入、人CD59(hCD59)基因导入、人CD200(hCD200)基因导入、人CD274(hCD274)基因导入、人凝血调节蛋白(hTBM)基因导入、人组织因子途径抑制物(hTFPI)基因导入、人内皮细胞蛋白C受体(hEPCR)基因导入、人肿瘤坏死因子α诱导蛋白-3(hA20)基因导入、人血红素加氧酶1(hHO1)基因导入、细胞毒性T淋巴细胞相关蛋白-4-免疫球蛋白(CTLA4-Ig)基因导入、MHC II类反式激活蛋白显性阴性(MHC class IItransactivator dominant negative(CIITA-DN))基因导入。
本实施方式的移植材料被异种移植的受体是灵长类动物,可以举出人、猴、大猩猩、黑猩猩等;作为猴可举出恒河猴(macaca mulatta)、食蟹猴等。作为灵长类动物的一种方式,可以举出食蟹猴等旧世界猴或人。作为灵长类动物的一种方式,可以举出不表达半乳糖-α.1,3-半乳糖的灵长类动物。
从尿的排泄系统确立的观点出发,本实施方式的移植材料优选为用于以附有膀胱的肾脏原基的膀胱与受体的输尿管连接的方式移植。
附有膀胱的肾脏原基可以还包含来源于人的肾单位祖细胞。作为肾单位祖细胞,例如可以举出从iPS细胞、ES细胞等多能干细胞分化诱导的细胞等。肾单位祖细胞可以是来源于患者的细胞,也可以是抑制了排斥反应的异体的细胞(参照Fujimoto T,Yamanaka S,Tajiri S,et al.Generation of人Renal Vesicles in Mouse Organ Niche UsingNephron Progenitor Cell Replacement System.Cell Rep.2020;32(11):108130.doi:10.1016/j.celrep.2020.Article No.108130)。
将来源于人的肾单位祖细胞注入猪胎儿的肾脏原基。通过使用还包含来源于人的肾单位祖细胞的附有膀胱的肾脏原基,在受体中的嵌合胎儿肾脏会成长。
移植材料的器官的大小优选为与受体本来具有的器官相同。因此,例如为了在人中形成能够发挥充分的功能的肾脏,优选为供体是具有与人的器官近似的大小的哺乳动物。但是,无需具有完全相同的大小,若是肾脏则在具有整体功能的十分之一的情况下就能够进行充分的透析,能够充分地维持生命。根据该理由,在本实施方式的移植材料中,使用的供体是猪,判断为用小型猪的器官的大小就足够。
接着,将如上述制备的附有膀胱的肾脏原基移植到受体的腹腔内。作为移植部位,只要是腹腔内就没有限定,可以举出大网膜、腹主动脉旁等。大网膜是从胃的下侧向下方围裙样的垂下的腹膜。
肾脏原基向包括人的灵长类动物的大网膜、腹主动脉旁等的移植能够通过通常的外科处理方法等进行。例如可以举出如下方法等:用锐利的镊子夹住移植的肾脏原基,用镊子的前端在大网膜的脂肪组织的表面制作一点切口,将组织埋入其中。另外,利用内窥镜也能够移植到大网膜、腹主动脉旁等。
<<肾移植试剂盒>>
本发明在一实施方式中提供基于免疫抑制方案使用上述移植材料的移植方法亦即基于免疫抑制方案使用的上述移植材料。
另外,本发明在一实施方式中提供包括上述移植材料以及基于免疫抑制方案使用的药剂的组合物的肾移植试剂盒。
作为基于免疫抑制方案使用的药剂的组合物,可以举出免疫抑制剂与抗炎剂和/或佐剂的组合物。
在本说明书中,免疫抑制剂的意思指抑制免疫细胞的生成、活化或增殖的药剂。作为免疫细胞,具体而言可以举出B细胞或T细胞等淋巴细胞。作为免疫抑制剂,可以举出损害T细胞的药剂、阻碍T细胞的合成的药剂或者抑制T细胞的活化的药剂或者抑制T细胞的分化(合成)·增殖或者B细胞的活化·增殖的药剂等。另外,间接地抑制免疫细胞的生成、活化或增殖的药剂或者抑制基于免疫细胞的作用的细胞因子分泌、活性的抗炎剂等药剂也是免疫抑制剂的范畴。
作为损害T细胞或B细胞的药剂,具体而言,可以举出损害T细胞的抗胸腺细胞球蛋白、损害B细胞的抗CD20抗体(例如利妥昔单抗、奥比妥珠单抗)等。
作为抑制T细胞的分化·活化或增殖的药剂,具体而言,可以举出阻碍CD28共刺激信号的物质(例如,包含与CD80/CD86结合的CTLA4胞外域的阿巴西普)、钙调磷酸酶抑制剂(例如他克莫司、环孢霉素)、肌苷单磷酸脱氢酶抑制剂(例如霉酚酸、作为其酯的霉酚酸酯[MMF]、硫唑嘌呤、咪唑立宾)、类固醇(例如作为糖皮质激素类类固醇的甲泼尼龙)、抗CD25抗体(例如巴利昔单抗)或者抗CD40抗体(例如伊卡利单抗(iscalimab)(CFZ533))等。
作为抗炎剂,可以举出IL-6抑制剂(例如作为抗IL-6受体抗体的托珠单抗或沙利鲁单抗(sarilumab))、TNFα抑制剂(例如作为可溶性TNFα受体的依那西普或者作为抗TNFα单克隆抗体的阿达木单抗(adalimumab)、戈利木单抗(golimumab)或者赛妥珠单抗)等。
作为佐剂,可以举出血小板凝集抑制剂(乙酰水杨酸(阿司匹林)等)、胃酸分泌抑制剂(法莫替丁等)、抗凝剂(低分子量肝素或萘莫司他等)、抗菌剂(例如青霉素类抗生物质、头孢菌素类抗生物质或磺胺药等)、造血剂(促红细胞生成素或罗沙司他等)、抗病毒剂(缬更昔洛韦或更昔洛韦等)等。
对于这些药剂的给药方法没有特别的限定,可以根据免疫抑制方案来适当确定。例如施以口服给药片剂、包衣片、丸剂、粉剂、颗粒剂、胶囊剂、液剂、悬浮剂或者乳剂等。另外,注射剂可以单独方式或者与葡萄糖、氨基酸等常规补液混合进行静脉内给药,此外也可以根据需要而进行动脉内、肌肉内、皮内、皮下或腹腔内给药。栓剂可施以直肠内给药。皮肤外用剂可施以对患部涂布、粘贴或喷雾。
这些药剂的给药量因患者的症状、体重、年龄、性别等而不同,不能一概而论,但是在口服给药的情况下,例如可以每一天施用1μg~10g、例如每一天给药0.01mg~2000mg的有效成分。另外,在注射剂的情况下,例如可以每一天给药0.1μg~1g,例如每一天给药0.001mg~200mg的有效成分。另外,在栓剂的情况下,例如可以每一天给药1μg~10g,例如每一天给药0.01mg~2000mg的有效成分。
本说明书的免疫抑制方案即免疫抑制剂的组合以及给药时机没有特别的限定,但是作为一例,包括:
(1)在免疫抑制的导入时期(Induction),施用比较强的免疫抑制剂,例如施用损害免疫细胞的药剂;以及
(2)在免疫抑制的持续时期(Maintenance),施用一定期间以上的长期间的施用导致的安全性的担心少的免疫抑制剂、抑制免疫细胞的分化(合成)、活化或增殖的药剂和/或抗炎剂。
在所述导入时期,例如可以在从移植的约2周前开始到移植后数天(例如移植当天~第4天)期间的任意时期,施用单次或多次。
在所述持续时期,例如可以在从移植的约2周前开始到移植后的一定期间之间持续地施用(例如1天1次或2天1次等)。
作为本实施方式的免疫抑制方案,可以举出包括(1)及(2)的情形:
(1)施用选自抗胸腺细胞球蛋白及抗CD20抗体中至少一种免疫抑制剂;
(2)施用选自CD28介导的共刺激信号抑制剂(例如阿巴西普)、钙调磷酸酶抑制剂(例如他克莫司、雷帕霉素)、肌苷单磷酸脱氢酶抑制剂(例如霉酚酸酯(MMF))、类固醇(例如甲泼尼龙)、抗CD25抗体以及抗CD40抗体中的至少一种免疫抑制剂。
作为一种实施方式,在上述(2)中,优选施用选自CD28介导的共刺激信号抑制剂(例如阿巴西普)、钙调磷酸酶抑制剂(例如他克莫司或雷帕霉素)、肌苷单磷酸脱氢酶抑制剂(例如霉酚酸酯(MMF))、类固醇(例如甲泼尼龙)、以及抗CD25抗体中的至少一种免疫抑制剂。
上述方案可以还包括:
(3)施用选自抗IL-6受体抗体及TNF-α抑制剂中的至少一种抗炎剂和/或
(4)施用选自血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂以及抗病毒剂中的至少一种佐剂。
作为免疫抑制方案的一种实施方式,可以举出包括:
(1)在移植2~3天前,独立地施用抗胸腺细胞球蛋白以及抗CD20抗体;
(2)在移植后每7天或者刚移植后及移植后每7天施用CD28介导的共刺激信号抑制剂;
(3)从移植9天前开始持续地施用钙调磷酸酶抑制剂;
(4)从移植5天前开始持续地施用肌苷单磷酸脱氢酶抑制剂;
(5)从移植当天开始持续地施用类固醇;
(6)在移植前一天以及移植后约每7天施用1~3次抗IL-6受体抗体,具体而言在第7天、第14天施用抗IL-6受体抗体;
(7)从刚移植后开始每3~4天施用TNFα抑制剂(例如依那西普);以及
(8)施用血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂以及抗病毒剂作为佐剂。
作为具体的方案,可以举出包括:
(1)在移植2~3天前,独立地施用抗胸腺细胞球蛋白以及利妥昔单抗;
(2)在移植后每7天或者刚移植后及移植后每7天施用阿巴西普;
(3)从移植9天前开始持续地施用他克莫司;
(4)从移植5天前开始持续地施用MMF;
(5)从移植当天开始持续地施用甲泼尼龙;
(6)在移植前一天、以及移植后第7天、第14天施用托珠单抗;
(7)从刚移植后开始每3~4天施用依那西普;以及
(8)施用选自阿司匹林、低分子量肝素、抗菌剂、促红细胞生成素以及缬更昔洛韦中的至少一种药剂作为佐剂。
另外,作为免疫抑制方案的一种实施方式,可以举出包括:
(1)在移植约2~3周前施用抗CD20抗体;
(2)从移植前约2周前开始持续地施用肌苷单磷酸脱氢酶抑制剂;
(3)在移植当天以及第4天施用抗CD25抗体;
(4)从移植前约1周前开始持续地施用钙调磷酸酶抑制剂以及类固醇;以及
(5)施用血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂以及抗病毒剂作为佐剂。
另外,作为具体的方案,可以举出包括:
(1)在移植约2~3周前施用利妥昔单抗;
(2)从移植前约2周前开始持续地施用MMF;
(3)在移植当天以及第4天施用巴利昔单抗;
(4)从移植前约1周前开始持续地施用他克莫司以及甲泼尼龙;以及
(5)施用选自血小板凝集抑制剂、抗凝剂、抗菌剂、造血剂、胃酸分泌抑制剂及抗病毒剂中的至少一种药剂作为佐剂。
<<移植方法>>
在一实施方式中,本发明提供一种肾脏的移植方法,其包括:将包含来源于猪胎儿的不带血管的附有膀胱的肾脏原基的移植材料移植到患者的体内的步骤(a);以及在从移植开始的规定期间后,将所述来源于猪胎儿的膀胱与患者的输尿管连接的步骤(b)。
本实施方式的方法也可以说是肾疾病的治疗方法。作为移植材料,可以使用上述的移植材料。
通过将在上述步骤(a)中移植后的移植材料放置规定期间,移植材料成长,开始产生尿。规定期间只要是移植材料充分地成长且到发生肾积水前的期间即可。规定期间可以根据患者的症状等适当地调整,例如可以是1~10周。
接着,在从移植开始的规定期间后实施步骤(b)。在步骤(b)中,切开移植材料的膀胱,将该膀胱与患者的输尿管连接。作为连接方法,可以举出端端吻合、端侧吻合、侧侧吻合、侧端吻合,优选为端侧吻合。
将移植材料的膀胱与患者的膀胱通过患者的输尿管连接,从而能够使移植材料产生的尿向患者的膀胱排泄。更详细而言,移植材料的肾脏产生的尿排泄到移植材料的膀胱,接着从移植材料的膀胱通过患者的输尿管排泄到患者的膀胱。
即,作为本发明的一实施方式,可以举出用于上述肾脏的移植方法、肾疾病的治疗方法的包含猪胎儿的附有膀胱的肾脏原基的移植材料。
另外,作为本发明的一实施方式,可以举出在上述肾脏的移植方法、肾疾病的治疗方法中使用的猪胎儿的附有膀胱的肾脏原基在制造移植材料中的用途。
上述移植方法优选为与上述免疫抑制方案的实施一起进行。该免疫抑制方案可以是所述[6]~[9]、[11]~[14]等在本说明书中记载的免疫抑制方案中的任意一种。
在一实施方式中,本发明可以举出:用于与免疫抑制方案的实施一起进行的上述肾脏的移植方法或肾疾病的治疗方法的、包含猪胎儿的附有膀胱的肾脏原基的移植材料,以及包括该移植材料与基于免疫抑制方案使用的药剂的组合物的肾移植试剂盒。
另外,作为本发明的一实施方式,可以举出:用于与免疫抑制方案的实施一起进行的上述肾脏的移植方法、疾病的治疗方法的包含猪胎儿的附有膀胱的肾脏原基的移植材料,以及用于包括该移植材料与基于免疫抑制方案使用的药剂的组合物在制造肾移植试剂盒中的用途。以抑制针对移植材料的受体(患者)的排斥反应为目的,在实施受体的血浆交换之后,能够进行上述移植方法。
在一实施方式中,本发明提供一种肾脏的移植方法或肾疾病的治疗方法,其中包括:实施受体(患者)的血浆交换的步骤(a1),将包含来源于猪胎儿的不带血管的附有膀胱的肾脏原基的移植材料移植到患者的体内的步骤(b1),以及在从移植开始的规定期间后将所述来源于猪胎儿的膀胱与患者的输尿管连接的步骤(b2)。
即,作为本发明的一实施方式,可以举出该肾脏的移植方法、肾疾病的治疗方法中使用的包含猪胎儿的附有膀胱的肾脏原基的移植材料。
另外,作为本发明的一实施方式,可以举出该肾脏的移植方法、肾疾病的治疗方法中使用的猪胎儿的附有膀胱的肾脏原基在制造移植材料中的用途。
作为血浆交换的方法,已知有双重过滤血浆分类交换(DFPP)、单纯血浆交换(PE)、血浆吸附(PA)、免疫吸附(IAPP)等。优选为一起进行移植前的血浆交换与上述免疫抑制方案的实施。
实施例
下面,通过实施例对本发明进行说明,但本发明不局限于下述实施例。
[缩写]
TAC:他克莫司(Tacrolimus)
MMF:霉酚酸酯(Micophenolate mofetil)
[实验1]
将野生的猪作为供体使用,将冷冻保存的胎生28~30天的泄殖腔解冻,作为胎儿的肾脏使用。另外,也将体重5.0~6.12kg的20~28日龄的新生仔猪肾脏作为供体肾脏使用。实验按照用于动物实验的适当的操作指南实施。
[新生仔猪肾脏与胎儿泄殖腔的移植]
伴随血管吻合的新生仔猪肾脏的移植按照由非专利文献2记载的方法实施。新生仔猪肾脏供体的肾血流在腹部正中切开后被阻断。
接着,用465mL的Euro-Collins溶液、35mL的50%葡萄糖溶液、以及包含1000单位的肝素的保存溶液进行了回流后,将肾脏与血管以及输尿管一起去除,运输到受体设施以准备移植(总保管时间:3小时)。
全部的受体猴从前一天的傍晚开始到手术为止进行了绝食。维持麻醉在手术当天导入了阿托品(0.1mg/kg i.m.)和氯胺酮(10mg/kg i.m.)后使用异氟醚(0.5%~2%)吸入来给药。
另外,作为镇痛剂,使用了布托啡诺(0.1mg/kg i.m.),作为手术前后的抗菌药使用了苄基青霉素钾47500单位/1个体。
在全身麻醉下通过腹部正中切开,对经过了上述预处理的受体猴进行了开腹手术。将左肾动脉/静脉与左输尿管结扎后,摘出左肾脏,将新生仔猪肾脏配置在相同部位,将血管和输尿管吻合。
接着,将主动脉以及左肾脏附近的后腹膜缓慢地剥离形成囊袋,使用刮勺(spatula)将2个胎儿泄殖腔[泄殖腔移植物(附有膀胱的肾脏原基)]移植到各动物的囊袋。在移植后,用LIGACLIP(注册商标)封闭了囊袋。同样地,将2个胎儿泄殖腔移植到大网膜,用LIGACLIP(注册商标)封闭了囊袋。由此,由于用大网膜组织覆盖,所以防止了泄殖腔脱落。将泄殖腔移植到主动脉周围以及大网膜后,封闭腹部以及伤口,完成了手术。
[移植组织的恢复]
在移植的13天后,通过腹部正中切开,再次打开腹部。开腹后,使大网膜露出,将用LIGACLIP(注册商标)夹住的部分作为引导,特定了移植后的来源于胎儿泄殖腔的肾脏。为了避免损伤,与周围的大网膜组织一起解剖了移植后的来源于胎儿泄殖腔的肾脏的一部分,回收了组织。
接着,用手动方式移动肠,使移植后的来源于新生仔猪的肾脏露出。将左肾动脉/静脉以及左输尿管的周围剥离,使腹部主动脉以及下大静脉露出。将左肾静脉以及左输尿管结扎,在猪肾动静脉侧切开移植后的来源于新生仔猪的肾脏,一起摘出。最后封闭了腹部以及伤口,完成了手术。一边观察饮食的摄取状况一边在手术后也持续进行免疫抑制剂的给药。
此外,移植到大网膜的剩余的来源于胎儿泄殖腔的肾脏在移植的27天后也使用相同的方法,再次确定并且回收了移植后的组织。
[实验2]
[胎儿肾移植]
与实验例1大致同样地进行了受体猴的术前及术后的制备。用聚乙烯吡咯酮碘(isodine)对腹部整体进行消毒,切开中央部,在施以麻醉后开腹。用手动方式移动大网膜及肠,在开腹后使后腹膜露出。缓慢地剥离主动脉以及左肾脏附近的后腹膜,形成囊袋,使用刮勺将2个胎儿泄殖腔移植到各动物的囊袋。其后,在移植后,用LIGACLIP(注册商标)封闭囊袋。接着,将3个胎儿泄殖腔同样地移植到大网膜,用LIGACLIP(注册商标)封闭了囊袋。由此,用大网膜组织覆盖,使得胎儿泄殖腔不脱落。在将胎儿泄殖腔移植到主动脉周围以及大网膜后,封闭腹部以及伤口并完成了手术。
[大网膜胎儿肾脏/主动脉周围胎儿膀胱的恢复以及尿路的吻合]
在移植的33天后,使用腹部正中切开,再次打开腹部。开腹后,使大网膜露出,使用以LIGACLIP(注册商标)夹住的部分作为引导,特定了移植后的来源于胎儿泄殖腔的肾脏整体。接着,对来源于胎儿泄殖腔的肾脏与周围的大网膜组织一起进行解剖并避免损伤,回收了组织。
同样地,也在确定移植到腹主动脉旁部分的来源于胎儿泄殖腔的肾脏后,剥离左肾动脉/静脉以及左输尿管的周围的区域,使附近的腹部主动脉以及下大静脉露出。将左肾动脉后、左肾静脉以及左输尿管结扎,摘出了左肾。去除后,通过利用降落伞式缝合的受体猴的一个胎儿膀胱以及左输尿管的端端吻合来进行尿的再建。最后,在尿的再建后封闭腹部以及伤口,完成了手术。
[输尿管形成后的腹主动脉旁胎儿肾脏的恢复]
在移植后50天或79天,通过腹部正中切开,再次打开腹部。在开腹后,用手动移动大网膜以及肠,确定了主动脉周围部的移植组织。此外,在确定后,将右肾动脉结扎,进行了呋塞米(20mg)以及靛胭脂(20mg)的静脉内注射,并且从静脉内系统施用了约100mL的细胞外液(常规生理盐水、葡萄糖以及VITAMEDIN(注册商标))。观察15分钟以上,确认了来自移植组织的尿的产生。其后,对移植组织与周围的组织一起进行解剖、评价,结束了实验。
[免疫抑制、抗炎症以及支持疗法]
表1中示出免疫抑制疗法的详细内容。另外,在开始日,将移植日设为零(0),用负(-)表示其之前的时间。具体而言,与此伴随了他克莫司(0.02mg/kg im×2/天,开始日第﹣9天)、阿巴西普(50mg/kg iv×1/周,开始日第7天)、以及霉酚酸酯(40mg/kg po×2/天,开始日第﹣5天)。也从开始日第0天开始给药甲泼尼龙(10mg/kg iv),从第2天开始改换为口服给药(5mg/kg)。每5天将给药量逐渐减为4、3、2、1、0.5、0.25mg/kg后,将0.25mg/kg的给药持续到剖检时。此外,施用了抗胸腺细胞球蛋白(在第3天10mg/kg iv)、利妥昔单抗(在第2天10mg/kg iv)、托珠单抗(在第﹣1天、第7天以及第14天10mg/kg sc)、以及依那西普(在第0天、第3天、第6天以及第10天0.5mg/kg sc)。每周测定2次血中的他克莫司及霉酚酸酯的浓度,将目标谷浓度作为标准,适当地调整了给药量(TAC谷值为:第﹣9天至第2天为15ng/mL~20ng/mL,第3天以后为9ng/mL~12ng/mL。MMF谷值为4ng/mL~6μg/mL)。
[表1]
[受体猴的监测]
确认了受体猴的每天的饮食状态以及活动,根据需要通过补充来进行支援。此外,通过每周2次的体重测量、体温、SpO2测量以及采血,评价了猴们的全身状态。除了TAC以及MMF以外,还通过血液检查测量了RBC、Hb、Ht(MCV、MCH及MCHC)、RET、WBC(中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞)、Plt、PT、APTT、Fbg、TP、Alb、T-Bil、LDH、AST、ALT、ALP、γGTP、CK、BUN、Cr、Na、K、Cl、Ca、P、Glu、T-Cho、TG以及CRP。
[组织学评价以及免疫组织化学评价]
用4%多聚甲醛将回收的标本固定,进行了石蜡包埋。接着,将它们分离成4μm的厚度的切片,用苏木精及曙红(HE)、过碘酸希夫以及Masson三色染色进行了染色。
对于免疫组织化学,对来自福尔马林固定标本的厚度4μm的连续切片进行脱石蜡,使用阶段性浓度的相对于去离子水的乙醇进行了水合。
将用于CD3染色的组织切片在0.01M柠檬酸钠缓冲液中使用压力锅处理了10秒钟(将缓冲液预热30秒钟),进行了抗原回收。将抗原回收后,用PBS将全部的切片温和地洗净。用3%过氧化氢对内源性过氧化物酶进行了20分钟的阻断(封闭)。用PBS洗净后,用5%脱脂奶对全部的切片进行30分钟的阻断。接着,将全部的切片与抗CD3抗体(MA5-12577,英杰(Invitrogen)公司,美国加利福尼亚州卡尔斯巴德)一起在4℃下进行培养过夜。用PBS洗净后,将切片在Histofine Simple Stain(注册商标)(424151,株式会社日冷,日本)中培养了30分钟。使用二氨基联苯胺作为色原,使用苏木精作为对比染色。
[实验1:针对异种排斥反应的胎儿肾脏的免疫学优点]
基于全身状态以及血液生化学检查的结果,对免疫抑制药的给药量进行了增减。图1的(A)及(B)中示出了得到的药物动态(图1的(C)及(D)中也示出了实验2的结果)。另外,免疫抑制剂施用开始后,在任意情况下都确认了肝酶的暂时上升,确认了MMF的吸收,也观察到术后贫血。
由于在术后第7天突然症状恶化,所以移植了新生仔猪肾脏以及胎儿泄殖腔的1例(相当于图1的(B))失效。移植了新生仔猪肾脏以及胎儿泄殖腔的其它例子比较稳定,但由于状态恶化以及血小板(plt)转移,在移植后第13天再次打开腹部,同时摘出了血管新生后的猪的肾脏以及移植后的泄殖腔,进行了泄殖腔的活检。摘出的移植肾与移植时比较,显著膨胀(重量21~124g、最大直径5.2~10cm),颜色也变化成暗红色;另一方面,泄殖腔在视觉上被保存(参照图2以及图3)。对于所述移植肾,通过病理学评价,组织基本上被破坏,观察到大量用HE染色被深部染色的多核细胞以及CD3阳性细胞(参照图4的(A)~(C))。
另一方面,与所述移植肾同时回收的胎儿肾脏(泄殖腔)的肾小球、肾小管等基本全部保持了组织结构。此外,不存在核异型及CD3阳性细胞的浸润(参照图4的(D)~(F))。再次封闭腹部后,对相同的猴持续地给药免疫抑制剂。去除了移植的猪的肾脏后该猴进行恢复,到移植的27天后的死亡那天为止比较稳定。图2中示出了回收的2个胎儿肾脏。在移植后13天保存了组织结构,但在一部分观察到CD3阳性细胞的浸润(参照图4的(G)~(I))。
[实验2:基于FDA承认的免疫抑制药施用的胎儿泄殖腔的生长]
在约4周的组织移植后第33天实施了从移植后的胎儿泄殖腔生长的膀胱与受体的尿路吻合。最初预定在尿路吻合的6周后作为标准评价移植组织。但是,在吻合后有1例状态逐渐恶化,因此在移植后50天在去除了移植组织后将该1例安乐死。其它例子比较稳定,因此按预定在吻合的46天后(移植后79天)回收了组织。
在移植33天后从大网膜回收的最大的胎儿肾脏的长径为约800μm(参照图5的(A))。肾小球和肾小管等的组织结构与实验1同样地基本保存了,未观察到细胞浸润。基于目视检查,鲍曼囊(也称为肾小囊)的空间稍微扩大,产生了尿,承认了肾脏在发挥功能。
在移植50天后从腹主动脉旁区域回收的最大的胎儿肾脏的长径约1.5mm。此外,在移植后79天从腹主动脉旁区域回收的最大的胎儿肾脏的长径约2mm(参照图5的(B)、(C))。在组织病理学评价中,在移植后33、50、79天在胎儿肾脏未观察到细胞浸润的程度的较大的变化(参照图6)。
本实施例是对未进行基因改造的猪与猴之间的异种移植的新生仔肾脏与胎儿肾脏的免疫原性进行直接比较、在胎儿肾脏(泄殖腔)的尿路吻合后的长期生长成功、观察了其经过的最初的实验结果。这些实验结果确认了:在异种移植中胎儿的肾脏比新生仔的肾脏更有利地发挥功能,胎儿的肾脏的长期移植物存活是可能的。
在将成熟的猪的肾脏移植到猴的情况下,即使是仅施用了FDA承认的免疫抑制药的基因改造猪,长期移植物存活也是困难的。在本发明中,猪的新生儿的肾脏的移植使1只受体猴的状态恶化。针对移植后的肾脏的强烈排斥反应与以前的报告结果一致。但是,在同时期的胎儿肾脏(泄殖腔的肾原基)几乎未观察到在新生仔猪肾脏的排斥反应中发生的特征性的炎症性细胞浸润以及组织破坏。
在猪胎儿肾脏的情况下确立了若选择4周等适当期间则胎儿肾脏会成熟为产生尿的肾组织而不会分化为其它组织。此外,异种受体的血管在移植过程中注入胎儿的肾脏,供体抗原的表达在肾脏的发育阶段本身减少。这揭示出了泄殖腔的排斥反应在异种移植中发生的可能性低。但是,在将新生仔肾脏与胎儿肾脏同时移植的实验1中,与实验2相比,尽管经过短,但是在胎儿肾脏中确认到炎症性细胞浸润。
因此,在存在新生仔的肾脏等强烈地诱发炎症反应的因素的情况下,即使在认为免疫原性低的胎儿的肾脏也存在炎症扩展的可能性。此外,存在抗猪IgE/A抗体等天然抗体参与受体猴的免疫应答的可能性,但是认为这些对胎儿的肾脏的生长不产生较大的影响。
如实验2中所确认到的那样,在仅胎儿肾脏(泄殖腔)的移植中,通过减少免疫抑制药的种类以及给药量,能够期待长期的移植物存活。为了使胎儿的肾脏生长成受体的更成熟的肾脏,不仅需要控制排斥反应,也需要确立尿的排泄系统,通过本实施例能够得到实现。
作为结论,在本实施例中,在不使用基因改造动物而使用了猪-猴临床前模型得到的胎儿肾脏的移植以及长期移植物存活方面取得了成功。该结果在以实现人化肾脏为目的而开发注入了来源于人的肾祖细胞得到的嵌合胎儿肾脏方面是重要的发现。
工业实用性
基于本发明能够提供一种在向灵长类动物的移植时能够抑制受体的排斥反应、能够实现长期移植物存活的移植材料以及肾移植试剂盒。
