丝氨酸蛋白酶抑制剂Kazal(SPIK)组合物和方法
文献发布时间:2023-06-19 09:41:38
相关申请的交叉引用
本申请要求2018年3月6日提交的美国临时申请序列第62/639,345号以及2018年3月7日提交的美国临时申请序列第62/639,850号的优先权,上述申请的公开内容通过引用整体并入本文。
政府权利
本发明是在政府支持下、在由美国国立卫生研究院(NIH)在小型企业创新研究(SBIR)计划下授予的授权号2R44CA165314-02A1和FAIN号R44CA165314下进行的。政府拥有本发明中的某些权利。
技术领域
公开了抗AS-SPIK抗体以及制备此类抗体的方法、包含此类抗体的组合物(包括药物组合物)及其在诊断以AS-SPIK表达为特征的疾病(例如,肝癌)中的用途。还公开了包含所述抗AS-SPIK抗体的诊断方法和试剂盒。
背景技术
肝脏是体内最大的器官之一。肝脏具有多种功能,包括产生食物消化所需的酶和胆汁、调节糖原储存、合成血浆蛋白、产生激素和各种代谢物的解毒。肝脏疾病包括肝癌(如肝细胞癌(HCC)和肝内胆管癌(ICC))、病毒性感染、肝硬化和其他肝脏炎症性疾病,其对全球数百万人造成影响。例如,美国有超过500万人,且全球有超过4.5亿人患有乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染,其中超过30%的感染者有发展为肝癌的高风险。Kew等人,Pathologie-biologie 2010;58(4):273-277;Saraswat等人,J Viral Hepat.2015;22Suppl 1:6-25;E1-Serag等人,Hepatology 2014;60(5):1767-1775;Kanwal等人,Clinical gastroenterology and hepatology 2015;13(4):805-807。尽管诊断和治疗取得了进展,但肝癌仍然是发病率和死亡率的重要原因。E1-Serag,The New England journalof medicine 2011;365(12):1118-1127。原发性肝癌,或源于肝脏的癌症,具有低于10%的五年生存率。然而,如果肝癌在早期和最可治疗的阶段被发现,则生存率几乎提高到40%。El-Serag等人,Therapeutic advances in gastroenterology 2011;4(1):5-10。早期肝癌患者可能具有很少的症状或没有症状。由于灵敏度低和可能的操作者错误,目前的检测方法,如血清学方法、超声、计算机断层扫描(CT)、磁共振成像(MRI)和血管造影,可能并不可靠。成本较高的成像技术对于较小的早期肿瘤的检测可能不太准确。Yu等人,Clinical gastroenterology and hepatology 2011;9(2):161-167;Bruix等人,Hepatology 2011;53(3):1020-1022。肝活检,仍被认为是区分良性肿瘤和恶性肿瘤最可靠的方法,具有创伤性且需要手术。Lok等人,Gastroenterology 2001;122(7):2092-2093。人们仍然需要诊断和治疗肝癌的新方法,特别是对于那些受肝硬化、病毒性感染和肝脏炎症性疾病影响的患者。
发明内容
本发明的方面包括分离的抗AS-SPIK抗体或其抗原结合片段,其与AS-SPIK特异性结合但不与NS-SPIK特异性结合,包含:(a)重链可变结构域,其包含:(i)CDRH1序列,其在SEQ ID NO:15-18的任何氨基酸序列中具有两个或更少取代;和/或(ii)CDRH2序列,其在SEQ ID NO:19-22的任何氨基酸序列中具有两个或更少的取代;和/或(iii)CDRH3序列,其在SEQ ID NO:23-26的任何氨基酸序列中具有两个或更少的取代;和(b)轻链可变结构域,其包含:(i)CDRL1序列,其在SEQ ID NO:27-30的任何氨基酸序列中具有两个或更少的取代;和/或(ii)CDRL2序列,其在SEQ ID NO:31-34的任何氨基酸序列中具有两个或更少的取代;和/或(iii)CDRL3序列,其在SEQ ID NO:35-38的任何氨基酸序列中具有两个或更少的取代。在一些实施例中,CDRH1、CDRH2、CDRH3、CDRL1、CDRL2和CDRL3序列存在于框架序列中。在一些实施例中,至少一部分框架序列包含人类共识框架序列。
在一些实施例中,抗体或抗原结合片段包含:(a)CDRH1序列,其选自由SEQ ID NO:15-18组成的组;和/或(b)CDRH2序列,其选自由SEQ ID NO:19-22组成的组;和/或(c)CDRH3序列,其选自由SEQ ID NO:23-26组成的组;和/或(d)CDRL1序列,其选自由SEQ ID NO:27-30组成的组;和/或(e)CDRL2序列,其选自由SEQ ID NO:31-34组成的组;和/或(f)CDRL3序列,其选自由SEQ ID NO:35-38组成的组。
在一些实施例中,抗体或抗原结合片段包含:(a)CDRH1序列,其选自由SEQ ID NO:15-18组成的组;(b)CDRH2序列,其选自由SEQ ID NO:19-22组成的组;(c)CDRH3序列,其选自由SEQ ID NO:23-26组成的组;(d)CDRL1序列,其选自由SEQ ID NO:27-30组成的组;(e)CDRL2序列,其选自由SEQ ID NO:31-34组成的组;和(f)CDRL3序列,其选自由SEQ ID NO:35-38组成的组。
在一些实施例中,抗体或抗原结合片段包含:(a)SEQ ID NO:15的CDRH1序列,SEQID NO:19的CDRH2序列,SEQ ID NO:23的CDRH3序列,SEQ ID NO:27的CDRL1序列,SEQ IDNO:31的CDRL2序列,和SEQ ID NO:35的CDRL3序列;或(b)SEQ ID NO:16的CDRH1序列,SEQID NO:20的CDRH2序列,SEQ ID NO:24的CDRH3序列,SEQ ID NO:28的CDRL1序列,SEQ IDNO:32的CDRL2序列,和SEQ ID NO:36的CDRL3序列;或(c)SEQ ID NO:17的CDRH1序列,SEQID NO:21的CDRH2序列,SEQ ID NO:25的CDRH3序列,SEQ ID NO:29的CDRL1序列,SEQ IDNO:33的CDRL2序列,和SEQ ID NO:37的CDRL3序列;或(d)SEQ ID NO:18的CDRH1序列,SEQID NO:22的CDRH2序列,SEQ ID NO:26的CDRH3序列,SEQ ID NO:30的CDRL1序列,SEQ IDNO:34的CDRL2序列,和SEQ ID NO:38的CDRL3序列。
在一些实施例中,抗体或抗原结合片段包含:与SEQ ID NO:7-10中的任何一个序列具有至少95%序列同一性的重链可变区和/或与SEQ ID NO:11-14中的任何一个序列具有至少95%序列同一性的轻链可变区。在一些实施例中,抗体或抗原结合片段包含选自由SEQ ID NO:7-10组成的组的重链可变区序列和/或选自由SEQ ID NO:11-14组成的组的轻链可变区序列。
在一些实施例中,抗体或抗原结合片段包含:(a)SEQ ID NO:7的重链可变区序列和SEQ ID NO:11的轻链可变区序列;或(b)SEQ ID NO:8的重链可变区序列和SEQ ID NO:12的轻链可变区序列;或(c)SEQ ID NO:9的重链可变区序列和SEQ ID NO:13的轻链可变区序列;或(d)SEQ ID NO:10的重链可变区序列和SEQ ID NO:14的轻链可变区序列。
本发明的方面包括分离的抗AS-SPIK抗体,其与AS-SPIK特异性结合但不与NS-SPIK特异性结合,包含:(a)在人类VH框架中包含CDRH1、CDRH2和CDRH3序列的重链可变区,其中CDRH序列是在选自由SEQ ID NO:15-26组成的组的CDR序列中具有两个或更少取代的序列;(b)在人类VL框架中包含CDRL1、CDRL2和CDRL3序列的轻链可变区,其中CDLH序列是在选自由SEQ ID NO:27-38组成的组的CDR序列中具有两个或更少取代的序列。
在一些实施例中,抗体包含:(a)在人类VH框架中包含CDRH1、CDRH2和CDRH3序列的重链可变区,其中CDRH序列选自由SEQ ID NO:15-26组成的组;和(b)在人类VL框架中包含CDRL1、CDRL2和CDRL3序列的轻链可变区,其中CDRL序列选自由SEQ ID NO:27-38组成的组。
本发明的方面包括分离的抗AS-SPIK抗体,其与AS-SPIK特异性结合但不与NS-SPIK特异性结合,包含:(a)在人类VH框架中,SEQ ID NO:15的CDRH1序列,SEQ ID NO:19的CDRH2序列,和SEQ ID NO:23的CDRH3序列,和在人类VL框架中,SEQ ID NO:27的CDRL1序列,SEQ ID NO:31的CDRL2序列,和SEQ ID NO:35的CDRL3序列;或(b)在人类VH框架中,SEQ IDNO:16的CDRH1序列,SEQ ID NO:20的CDRH2序列,和SEQ ID NO:24的CDRH3序列,和在人类VL框架中,SEQ ID NO:28的CDRL1序列,SEQ ID NO:32的CDRL2序列,和SEQ ID NO:36的CDRL3序列;或(c)在人类VH框架中,SEQ ID NO:17的CDRH1序列,SEQ ID NO:21的CDRH2序列,和SEQ ID NO:25的CDRH3序列,和在人类VL框架中,SEQ ID NO:29的CDRL1序列,SEQ ID NO:33的CDRL2序列,和SEQ ID NO:37的CDRL3序列;或(d)在人类VH框架中,SEQ ID NO:18的CDRH1序列,SEQ ID NO:22的CDRH2序列,和SEQ ID NO:26的CDRH3序列,和在人类VL框架中,SEQID NO:30的CDRL1序列,SEQ ID NO:34的CDRL2序列,和SEQ ID NO:38的CDRL3序列。
在一些实施例中,抗体或抗原结合片段是多特异性的。在一些实施例中,抗体或抗原结合片段是双特异性的。在一些实施例中,抗体或抗原结合片段与效应细胞具有结合亲和力。在一些实施例中,抗体或抗原结合片段与T细胞抗原具有结合亲和力。在一些实施例中,抗体或抗原结合片段与CD3具有结合亲和力。在一些实施例中,抗体或抗原结合片段是单克隆抗体。在一些实施例中,抗体或抗原结合片段是CAR-T形式。
本发明的方面包括包含如本文所述抗体或抗原结合片段的药物组合物。
本发明的方面包括用于治疗以AS-SPIK表达为特征的疾病的方法,其包含向患有所述疾病的受试者给予本文所述的抗体或抗原结合片段,或本文所述的药物组合物。
本发明的方面包括本文所述抗体或抗原结合片段在制备用于治疗以AS-SPIK表达为特征的疾病的药剂中的用途。
本发明的方面包括用于治疗以AS-SPIK表达为特征的疾病的本文所述的抗体或抗原结合片段。
在一些实施例中,该疾病是肝脏疾病。在一些实施例中,该肝脏疾病是肝细胞癌。在一些实施例中,该肝脏疾病是肝内胆管癌。在一些实施例中,该肝脏疾病是病毒性感染。在一些实施例中,该肝脏疾病是炎症性肝脏疾病。在一些实施例中,该炎症性肝脏疾病是肝硬化。
本发明的方面包括编码如本文所述抗体或抗原结合片段的多核苷酸。本发明的方面包括包含本文所述多核苷酸的载体。本发明的方面包括包含本文所述载体的宿主细胞。
本发明的方面包括产生本文所述抗体或抗原结合片段的方法,其包含在允许表达抗体或抗原结合片段的条件下培养宿主细胞,和从该细胞中分离该抗体或抗原结合片段。
本发明的方面包括用于确定受试者是否患有以AS-SPIK表达为特征的疾病或有发生以AS-SPIK表达为特征的疾病的风险的诊断方法,该方法包含:(a)将该受试者的生物供试样品与本文所述的AS-SPIK抗体或抗原结合片段接触,以生成AS-SPIK抗体复合物;(b)检测该生物供试样品中的AS-SPIK抗体复合物的浓度;和(c)将该AS-SPIK抗体复合物的浓度与参考值进行比较,以确定该受试者是否患有以该疾病或有发生该疾病的风险。
本发明的方面包括用于确定受试者是否患有以AS-SPIK表达为特征的疾病或有发生以AS-SPIK表达为特征的疾病的风险的诊断方法,该方法包含:(a)将该受试者的生物供试样品与特异性结合SPIK的第一抗体或抗原结合片段接触,以形成SPIK抗体复合物;(b)将该SPIK抗体复合物与本文所述的AS-SPIK抗体或抗原结合片段接触,以产生AS-SPIK抗体复合物;(c)检测该生物供试样品中的AS-SPIK抗体复合物的浓度;和(d)将该AS-SPIK抗体复合物的浓度与参考值进行比较,以确定该受试者是否患有该疾病或有发生该疾病的风险。
在一些实施例中,抗体或抗原结合片段包含可检测的标记物。
在一些实施例中,该疾病是肝脏疾病。在一些实施例中,该肝脏疾病选自由以下组成的组:肝细胞癌、肝内胆管癌、肝脏病毒性感染、肝脏炎症性疾病和肝硬化。
本发明的方面包括包含本文所述抗体或抗原结合片段的试剂盒。在一些实施例中,该试剂盒进一步包含与SPIK特异性结合的抗体或抗原结合片段。
附图说明
图1是显示NS-SPIK和AS-SPIK大小的SDS PAGE。
图2描述了AS-SPIK的Edman N端分析结果。
图3是比较AS-SPIK和NS-SPIK结构的示意图。
图4是描述单克隆抗体IM-BA1结合位点在NS-SPIK中位置的示意图。
图5是描述分析IM-BA1结合活性的实验的结果图。
图6是用于免疫以产生与AS-SPIK特异性结合或优先结合的抗体的重组蛋白的序列。“共同区域”表示在AS-SPIK和NS-SPIK中均发现的氨基酸。
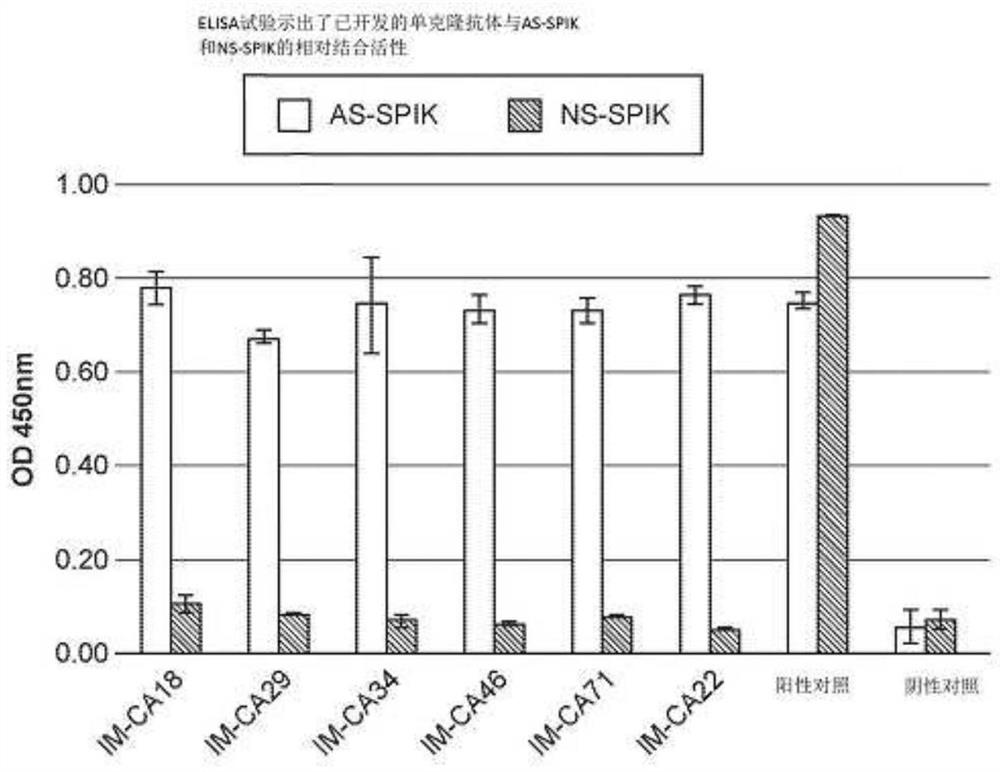
图7示出了ELISA的结果,其显示各种单克隆抗体与AS-SPIK和NS-SPIK的相对结合活性。
图8是显示与MA86相比,单克隆抗体IM-CA22与AS-SPIK的结合特异性的免疫印迹,MA86为同时结合AS-SPIK和NS-SPIK的对照抗体。
图9示出了免疫沉淀实验的结果,该实验分析了由单克隆抗体IM-CA22和AS-SPIK组成的复合物的形成。
图10是描述了用于检测AS-SPIK复合物的ELISA结果图。
图11是描述了AS-SPIK复合物形成的定量分析结果的图。
图12是描述使用IM-CA22单克隆抗体的AS-SPIK免疫测定法的灵敏度分析结果的图。
图13是描述了分析抗AS-SPIK抗体对SPIK活性影响的实验的结果图。
图14是描述肝细胞癌(HCC)患者血清中AS-SPIK水平分析的结果的图。
图15是描述HCC患者中LC-SPIK的ROC分析的结果的图。
图16是描述早期HCC患者血清中AS-SPIK水平分析的结果的图。
图17(表1)示出了单克隆抗体的序列同源性与结合至AS-SPIK的能力之间的关系。
图18(表2)示出了AS-SPIK血清水平与ICC存在之间的关系。
图19提供了四种抗体(CA18、CA22、CA46和CB77)的CDR(VL和VH)对齐。本文提供的抗体可以通过其包括字母“IM”的长名称来调用,如IM-CA18、IM-CA22等,或者可以通过去掉“IM”的缩写形式来引用,如CA18或CA22等。提供了与抗体CA22相比的同源性百分比。图17中的表1也提供了同源性百分比的信息。还提供了抗体BA1、S14和抗维生素D受体抗体(抗VD受体抗体)的VH和VL区域的CDR序列。
图20提供了本发明的四种抗体(CA18、CA22、CA46和CB77)的VH区域的对齐。提供了与抗体CA22相比的同源性百分比。图17中的表1也提供了同源性百分比的信息。CDR用下划线标出。第一区域为CDR1,第二区域为CDR2,第三区域为CDR3。
图21提供了四种抗体(CA18、CA22、CA46和CB77)的VH区域的对齐。还提供了抗体BA1、S14和抗VD受体抗体的VH区域的序列。CDR用下划线标出。第一区域为CDR1,第二区域为CDR2,第三区域为CDR3。
图22提供了四种抗体(CA18、CA22、CA46和CB77)的VL区域的对齐。提供了与抗体CA22相比的同源性百分比。图16中的表1也提供了同源性百分比的信息。CDR用下划线标出。第一区域为CDR1,第二区域为CDR2,第三区域为CDR3。
图23提供了四种抗体(CA18、CA22、CA46和CB77)的VL区域的对齐。还提供了抗体BA1、S14和抗VD受体抗体VL区域的序列。CDR用下划线标出。第一区域为CDR1,第二区域为CDR2,第三区域为CDR3。
图24是根据本发明的实施例说明各种多核苷酸和多肽的序列的表。
具体实施方式
除非另有说明,本发明的实践将采用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术,这些技术在本领域的技能范围内。此类技术在文献中得到了充分的解释,如,“Molecular Cloning:A Laboratory Manual”,第二版(Sambrook等人,1989);“Oligonucleotide Synthesis”(M.J.Gait编辑,1984);“Animal CellCulture”(R.I.Freshney编辑,1987);“Methods in Enzymology”(Academic Press,Inc.);“Current Protocols in Molecular Biology”(F.M.Ausubel等人编辑,1987,并且定期更新);“PCR:The Polymerase Chain Reaction”,(Mullis等人编辑,1994);“A PracticalGuide to Molecular Cloning”(Perbal Bernard V.,1988);“Phage Display:ALaboratory Manual”(Barbas等人,2001);Harlow,Lane和Harlow,Using Antibodies:ALaboratory Manual:Portable Protocol No.I,Cold Spring Harbor Laboratory(1998);以及Harlow和Lane,Antibodies:A Laboratory Manual,Cold Spring HarborLaboratory;(1988)。
如果提供了一系列值,除非上下文另有明确规定,否则应理解为在该范围的上限和下限之间的每个中间值(至下限的十分之一单位)以及该范围内的任何其他声明值或中间值包含在本发明中。这些较小范围的上限和下限可以独立地包括在较小范围内,也包含在本发明中,受制于所述范围内任何特定排除的限制。在所述范围包括一个或两个限值的情况下,则排除其中一个或两个限值的范围也包含在本发明中。
除非另有说明,否则本文中的抗体残基根据Kabat编号系统进行编号(例如,Kabat等人,Sequences of Immunological Interest.第5版.Public Health Service,NationalInstitutes of Health,Bethesda,Md.(1991))。
在以下描述中,阐述了多种具体细节,以更彻底地了解本发明。然而,对于本领域的技术人员来说显而易见的是,可以在没有这些具体细节中的一个或多个的情况下实施本发明。在其他情况下,对于本领域技术人员来说公知的已知特征和程序将不再描述,以避免模糊本发明。
在整个公开内容中引用的所有参考文献,包括专利申请和出版物,均通过引用整体并入本文。
为了解释本说明书,将应用以下定义,并且在适当情况下,以单数使用的术语也将包括复数,反之亦然。如果提出的任何定义与通过引用并入本文的任何文件相冲突,则应以下述定义为准。
“表位”是抗原分子表面上与单个抗体分子结合的位点。通常,抗原具有几种或多种不同的表位,并与多种不同的抗体反应。该术语具体包括线性表位和构象表位。该术语包括能够与抗体特异性结合的任何分子决定簇。在某些实施例中,表位决定簇包括分子(如氨基酸、糖侧链、磷酰基或磺酰基)的化学活性表面基团,并且在某些实施例中,其可以具有特定的三维结构特征和/或特定的电荷特征。表位是抗原中与抗体结合的区域。“结合区域”是结合靶标上与结合分子结合的区域。
“表位作图”是识别抗体在其靶抗原上的结合位点或表位的过程。抗体表位可以是线性表位或构象表位。线性表位是由蛋白质中氨基酸的连续序列所形成的。构象表位是由蛋白质序列中不连续的氨基酸所形成的,但在蛋白质折叠成其三维结构时将其聚集在一起。
本文所定义的“表位聚类(Epitope binning)”是根据抗体识别的表位对抗体进行分组的过程。更具体地,表位聚类包含用于区分不同抗体的表位识别特性的方法和系统,其结合了基于其表位识别特性的对抗体进行聚类和识别具有不同结合特异性的抗体的计算过程。
当两种抗体识别相同或空间重叠的表位时,抗体与参照抗体结合“基本相同的表位”。确定两个表位是否与相同或空间重叠表位结合的最广泛使用和快速的方法是竞争测定,其可以使用标记抗原或标记抗体以任何数量的不同格式进行配置。通常,将抗原固定在96孔板上,并利用放射性或酶标记来测定未标记抗体阻断标记抗体结合的能力。
如本文中所用,氨基酸残基/位置的“修饰”是指与起始氨基酸序列相比,初级氨基酸序列的变化,其中该变化是由涉及上述氨基酸残基/位置的序列变化引起的。例如,典型的修饰包括用另一个氨基酸取代残基(或在所述位置)(例如保守或非保守取代)、在所述残基/位置附近插入一个或多个(通常少于5或3个)氨基酸以及删除所述残基/位置。“氨基酸取代”或其变体是指用不同的氨基酸残基替换预定(起始)氨基酸序列中的现有氨基酸残基。通常并优选地,与包含起始(或“野生型”)氨基酸序列的多肽相比,修饰导致变体多肽的至少一种物理或生化活性的改变。例如,对于抗体,改变的物理或生化活性可以是对靶分子的结合亲和力、结合能力和/或结合效应。
术语“抗体”包括单克隆抗体(包括具有免疫球蛋白Fc区的全长抗体)、单链分子以及抗体片段(例如,Fab、F(ab′)2和Fv)。在本文中,术语“免疫球蛋白”(Ig)与“抗体”可以互换使用。基本的4链抗体单元是由两条相同的轻(L)链和两条相同的重(H)链组成的异四聚体糖蛋白。除非另有说明,否则术语“抗体”在本文中以其最广义的含义使用,并具体包括抗体的所有同种型、亚类和形式,包括IgG、IgM、IgA、IgD和IgE抗体及其片段,优选抗原结合片段。
除非另有说明,否则术语“抗体”具体包括天然人类和非人类IgGl、IgG2(IgG2a、IgG2b)、IgG3、IgG4、IgE、IgA、IgD和IgM抗体,包括天然变体。
如本文中所用,术语“单克隆抗体”是指从基本上同种的抗体群体(即,除可能以少量存在的天然突变外,包含该群体的单个抗体是相同的)中获得的抗体。单克隆抗体具有高度特异性,可直接作用于单个抗原位点。此外,与传统(多克隆)抗体制剂(通常包括针对不同决定簇(表位)的不同抗体)相比,每种单克隆抗体均针对抗原上的单个决定簇。修饰语“单克隆”表示从基本上同种的抗体群体获得的抗体特征,并不应解释为需要通过任何特定方法产生抗体。例如,根据本发明使用的单克隆抗体可以通过由Kohler等人(1975)Nature256:495中第一次描述的杂交瘤方法制备,或可以通过重组DNA方法制备(例如,参见美国专利第4,816,567号)。“单克隆抗体”也可以使用,例如Clackson等人(1991)Nature352:624-628和Marks等人(1991)J.Mol.Biol.222:581-597中描述的技术从噬菌体抗体库中分离。
本文中的单克隆抗体具体包括“嵌合”抗体(免疫球蛋白),其中重链和/或轻链的一部分与来自特定种属的抗体中的相应序列相同或同源,而链的其余部分与来自另一个种属的抗体中的相应序列以及此类抗体的片段相同或同源,只要其表现出所需的生物活性(美国专利第4,816,567号;和Morrison等人(1984)Proc.Natl.Acad.Sci.USA 81:6851-6855)。
非人源(例如,鼠)抗体的“人源化”形式是含有源于非人免疫球蛋白的最小序列的抗体。在大多数情况下,人源化抗体是人免疫球蛋白(受体抗体),其中该受体高变区的残基被非人类种属(供体抗体)(如具有所需的特异性、亲和力和能力的小鼠、大鼠、兔或非人灵长类动物)高变区的残基取代。在一些情况下,人免疫球蛋白的Fv框架区域(FR)残基也被相应的非人类残基取代。此外,人源化抗体可以包含受体抗体或供体抗体中未发现的残基。这些修饰是为了进一步完善抗体性能。通常,人源化抗体将包含至少一个,通常是两个,可变结构域的基本上全部,其中所有或基本上所有高变环对应于非人免疫球蛋白,并且所有或基本上所有FR区域是人免疫球蛋白序列的FR区域。人源化抗体任选地也可以包含免疫球蛋白恒定区(Fc)的至少一部分,通常是人免疫球蛋白的一部分。更多详细细节请参见Jones等人(1986)Nature 321:522-525;Riechmann等人(1988)Nature 332:323-329;和Presta(1992)Curr.Op.Struct.Biol.2:593-596。
相对于参照多肽序列的“氨基酸序列同一性百分比(%)”定义为在对齐该序列并引入缺口(如必要)以达到最大序列同一性百分比后,候选序列中与参照多肽序列中氨基酸残基相同的氨基酸残基的百分比,并且不考虑任何保守取代作为序列同一性的一部分。用于确定氨基酸序列同一性百分比的对齐可以以本领域技能范围内的各种方式实现,例如,使用公开的计算机软件,如BLAST、BLAST-2、ALIGN或Megalign(DNASTAR)软件。本领域的技术人员可以确定用于对齐序列的适当参数,包括在比较的序列全长上实现最大对齐所需的任何算法。然而,出于本文目的,使用序列比较计算机程序ALIGN-2,生成了氨基酸序列同一性%值。
如本文中所用,术语“序列同源性百分比”是指任何给定查询序列与目标序列之间的同源性程度。例如,天然存在的AS-SPIK多肽或NS-SPIK多肽可以是查询序列,而AS-SPIK多肽或NS-SPIK多肽的片段可以是目标序列。同样,AS-SPIK多肽或NS-SPIK多肽的片段可以是查询序列,其生物活性变体可以是目标序列。
本文中的“分离”抗体是指已经在重组宿主细胞中从其自然环境的组分中识别、分离和/或回收的抗体。其自然环境中的污染组分是可以干扰抗体诊断或治疗用途并可以包括酶、激素和其他蛋白或非蛋白溶质以及生产中不希望副产物的材料。在优选实施例中,本文中分离的抗体将:(1)通过SDS-PAGE或SEC-HPLC方法测定,被纯化为大于95重量%或大于98重量%或大于99重量%,(2)使用氨基酸测序仪纯化为足以获得至少15个N-末端或内部氨基酸序列残基的程度,或(3)在还原或非还原条件下通过SDS-PAGE的同种性使用考马斯蓝或优选银染法进行纯化。通常,分离的抗体将通过至少一个纯化步骤来制备。
对于IgG,4链单位一般约为150000道尔顿。每个L链通过一个共价二硫键与H链连接,而两个H链通过一个或多个二硫键彼此连接,这取决于H链的同种型。每个H链和L链还具有规则间隔的链内二硫键。每个H链在N末端有一个可变结构域(VH),随后是每个α和γ链的三个恒定结构域(CH),以及μ和ε同种型的四个CH结构域。每个L链在N端有一个可变结构域(VL),另一端有一个恒定结构域。VL与VH对齐,CL与重链的第一恒定结构域(CH1)对齐。认为特定氨基酸残基在轻链和重链可变结构域之间形成了界面。VH和VL的配对共同形成单个抗原结合位点。
术语“多肽”在本文中以其广义含义使用,并且包括肽序列。术语“肽”通常描述氨基酸的线性分子链,其含有通过肽键共价连接的多达约60个氨基酸,优选多达约30个氨基酸。
术语“特异性结合”或“特异性结合至”或“对......具有特异性”是指抗体与靶抗原(例如,特定多肽、肽或其他靶标(例如糖蛋白靶标)上的表位)的结合,并且是指与非特异性相互作用明显不同的结合(例如,非特异性相互作用可以与牛血清白蛋白或酪蛋白结合)。特异性结合可以例如通过确定与对照分子的结合相比的抗体与靶分子的结合来测量。例如,特异性结合可以通过与和靶标(例如,过量的非标记靶标)相似的对照分子竞争来确定。在这种情况下,如果标记靶标与探针的结合被过量的未标记靶标竞争性抑制,则表明特异性结合。如本文中所用,术语“特异性结合”或“特异性结合至”特定多肽或特定多肽靶标上的表位,或“对其具有特异性”可以,例如,通过对靶标具有至少约200nM、或者至少约150nM、或者至少约100nM、或者至少约60nM、或者至少约50nM、或者至少约40nM、或者至少约30nM、或者至少约20nM、或者至少约10nM、或者至少约8nM、或者至少约6nM、或者至少约4nM、或者至少约2nM、或者至少约1nM或更高的Kd的分子进行表示。在某些情况下,术语“特异性结合”是指分子与特定多肽或特定多肽上的表位结合,而基本上不与任何其他多肽或多肽表位结合。
“结合亲和力”是指分子(例如抗体)的单个结合位点与其结合伴侣(例如抗原)之间的非共价相互作用总和的强度。除非另有说明,否则如本文中所用,“结合亲和力”是指反映结合对成员(例如抗体和抗原)之间1∶1相互作用的固有结合亲和力。分子X对其伴侣Y的亲和力通常可以用解离常数(Kd)来表示。例如,Kd可以为约200nM、150nM、100nM、60nM、50nM、40nM、30nM、20nM、10nM、8nM、6nM、4nM、2nM、1nM或更强。亲和力可以通过本领域已知的常用方法测量,包括本文中所描述的那些方法。低亲和力抗体通常较慢地结合抗原并容易解离,而高亲和力抗体通常较快结合抗原并趋向于维持更长时间的结合。本领域已知有多种测定结合亲和力的方法。
如本文中所用,“Kd”或“Kd值”是指通过适用于抗体和靶标对的技术测量的解离常数,例如,使用表面等离子体共振测定法,例如,使用BIAcore
如本文中所用,术语“价”表示抗体中存在规定数量的结合位点。因此,术语“二价”表示存在两个结合位点。
“多表位特异性”是指与相同或不同靶标上的两个或更多个不同表位特异性结合的能力。“单特异性”是指仅结合一个表位的能力。在一些实施例中,抗体以至少10
术语“靶标”或“结合靶标”以其广义含义使用,并且具体包括但不限于多肽、核酸、碳水化合物、脂质、细胞和自然界中存在的具有或不具有生物学功能的其他分子。
术语“抗原”是指可以与抗体结合或触发细胞免疫应答的实体或其片段。免疫原是指可以在生物体,特别是动物,更尤其是包括人类在内的哺乳动物中引起免疫应答的抗原。术语抗原包括如上所述的被称为抗原决定簇或表位的区域。
如本文中所用,术语“免疫原性的”是指引起抗体产生和/或激活T细胞和/或其他针对免疫原抗原的反应性免疫细胞的物质。
本发明抗体的“抗原结合位点”或“抗原结合区”通常含有6个高变区(HVR),其在不同程度上有助于结合位点对抗原的亲和力。术语“互补决定区”或“CDR”在本文中可以与术语“高变区”或“HVR”互换使用。存在3个重链可变结构域HVR(HVR-H1、HVR-H2和HVR-H3)和3个轻链可变结构域HVR(HVR-L1、HVR-L2和HVR-L3)。通过与编译的氨基酸序列数据库进行比较,确定HVR和框架区(FR)的范围,其中这些区是根据序列之间的变异性和/或抗体/抗原复合物的结构信息来进行定义。本发明范围还包括由较少HVR组成的功能性抗原结合位点(即,结合特异性由3、4或5个HVR决定)。少于整组6个HVR可以足以与一些结合靶标结合。因此,在一些情况下,单独VH或VL结构域的HVR就足够了。此外,某些抗体可以具有抗原的非HVR相关结合位点。此类结合位点具体包括在本定义中。
如本文中所用,术语“宿主细胞”是指可以根据本发明进行改造以产生抗体的任何类型的细胞体系。在一个实施例中,使用中国仓鼠卵巢(CHO)细胞作为宿主细胞。
如本文中所用,表达“细胞”、“细胞系”和“细胞培养物”可以互换使用,并且所有此类名称均包括子代。因此,术语“转化子”和“转化细胞”包括原代受试细胞和从中衍生的培养物而不考虑转移次数。还可以理解的是,由于故意或无意的突变,所有子代在DNA含量上可能并不完全相同。包括与原始转化细胞中筛选的功能或生物活性相同的变异子代。
当核酸与另一个核酸序列处于功能关系时,核酸是“可操作连接的”。例如,如果前序列或分泌前导序列的DNA被表达为参与多肽分泌的前蛋白,则其可操作地与多肽的DNA连接;如果启动子或增强子影响序列的转录,则其可操作地与编码序列连接;或者如果核糖体结合位点定位成便于翻译,则其可操作地与编码序列连接。通常,“可操作连接的”是指被连接的DNA序列是连续的,并且在分泌前导序列的情况下,是连续的和阅读框内的。然而,增强子不必是连续的。连接通过在方便的限制位点处连接来完成。如果不存在此类位点,则按照常规实践使用合成的寡核苷酸接头或连接肽。
术语“抗AS-SPIK抗体”、“AS-SPIK抗体”或“与AS-SPIK结合的抗体”均是指能够以足够的亲和力结合AS-SPIK的抗体,因此该抗体可以用作靶向AS-SPIK的诊断和/或治疗药物。
在一个实施例中,本文中所用的“AS-SPIK抗体”具体指抗AS-SPIK单克隆抗体,其(i)包含SEQ ID NO:7-10中任何一个提供的重链可变结构域序列和/或SEQ ID NO:11-14中任何一个提供的轻链可变结构域序列;或(ii)包含SEQ ID NO:15-38中提供的CDR中的一个、两个、三个、四个、五个或六个。
术语“可变”是指可变结构域的某些片段在抗体之间的序列差异很大。“可变”或“V”结构域介导抗原结合,并定义特定抗体对其特定抗原的特异性。然而,该变异性在该可变结构域的110个氨基酸跨度中分布不均匀。相反,V区由称为15-30个氨基酸框架区(FR)的相对不变延伸组成,其由称为“高变区”的极端变异性较短区域分隔,每个区域为9-12个氨基酸长。天然重链和轻链的可变结构域各包括4个FR,主要采用β折叠构型,由形成环连接的3个高变区连接,在一些情况下形成β折叠结构的一部分。每条链中的高变区通过FR紧密地结合在一起,并且与来自另一条链的高变区结合一起,有助于形成抗体的抗原结合位点(参见Kabat等人,Sequences of Proteins of Immunological Interest,第五版.PublicHealth Service,National Institutes of Health,Bethesda,MD.(1991))。
“完整”抗体是包含抗原结合位点以及特定抗体类别的轻链恒定结构域(CL)和至少重链恒定结构域的抗体。例如,完整的IgG抗体包含抗原结合位点、轻链恒定结构域CL和至少重链恒定结构域CH1(Cγ1)、CH2(Cγ2)和CH3(Cγ3)。完整的IgM抗体包含抗原结合位点、轻链恒定结构域CL和至少重链恒定结构域CM1(Cμ1)、CM2(Cμ2)、CM3(Cμ3)和CM4(Cμ4)。完整的IgA抗体包含抗原结合位点、轻链恒定结构域CL和至少重链恒定结构域CA1(Cα1)、CA2(Cα2)和CA3(Cα3)。完整的IgD抗体包含抗原结合位点、轻链恒定结构域CL和至少重链恒定结构域CD1(Cδ1)、CD2(Cδ2)和CD3(Cδ3)。完整的IgE抗体包含抗原结合位点、轻链恒定结构域CL和至少重链恒定结构域CE1(Cε1)、CE2(Cε2)、CE3(Cε3)和CE4(Cε4)。恒定结构域可以是天然序列恒定结构域(例如,人类天然序列恒定结构域)或其氨基酸序列变体。优选地,完整抗体具有一种或多种效应功能。
抗体的“抗体片段”或“抗原结合片段”包含完整抗体的一部分,优选完整抗体的抗原结合或可变区。抗体片段的非限制性示例包括Fab、Fab′、F(ab′)2和Fv片段;双体抗体;线性抗体(参见,美国专利第5,641,870号,实例2;Zapata等人,Protein Eng.8(10):1057-1062(1995));单链抗体分子;和抗体片段形成的多特异性抗体。在一个实施例中,抗体片段包括完整抗体的抗原结合位点,并因此保留了结合抗原的能力。本领域的普通技术人员应理解的是,通过将抗体的至少抗原结合部分与其轻链和重链的其余部分分离以产生抗原结合片段,可以从任何完整的抗体中产生抗体片段,例如从IgG、IgM、IgA、IgD或IgE抗体中产生。在某些实施例中,抗体片段可以包含抗体的抗原结合区,以及抗体的轻链和/或重链的一个或多个额外结构域。例如,在一些实施例中,抗体片段可以包含抗原结合区域,包括VH和VL结构域、轻链恒定结构域CL和一个或多个重链恒定结构域,例如CH1(Cγ1)结构域、CM1(Cμl)结构域、CA1(Cα1)结构域、CD1(Cδ1)结构域或CE1(Cε1)结构域。
对于IgG抗体片段,木瓜蛋白酶消化产生两个相同的抗原结合片段,称为“Fab”片段,和残留的“Fc”片段,该名称反映了易于结晶的能力。Fab片段由整个L链以及H链的可变区结构域(VH)和一条重链的第一恒定结构域(CH1)组成。每个Fab片段在抗原结合方面是单价的,即具有单个抗原结合位点。IgG抗的胃蛋白酶处理可以产生单个较大的F(ab′)2片段,其大致对应于具有二价抗原结合活性且仍能交联抗原的两个二硫键连接Fab片段。Fab′片段与Fab片段的不同之处在于在CH1结构域的羧基端有额外的几个残基,包括抗体铰链区的一个或多个半胱氨酸。Fab′-SH是本文中Fab′的名称,其中该恒定结构域的半胱氨酸残基具有游离巯基。F(ab′)2抗体片段最初是作为Fab′片段对产生的,这些片段之间有铰链半胱氨酸。抗体片段的其他化学偶联也是已知的。
IgG抗体的Fc片段包含通过二硫键结合在一起的两条H链的羧基末端部分。抗体的效应功能由Fc区中的序列决定,该区域也是在某些类型细胞上发现的由Fc受体(FcR)识别的部分。
“Fv”是含有完整抗原识别和结合位点的最小抗体片段。该片段由紧密且非共价结合的一个重链和一个轻链可变区结构域的二聚体组成。在单链Fv(scFv)种属中,一个重链和一个轻链可变结构域可以通过柔性连接肽共价连接,使得轻链和重链可以结合成类似于双链Fv种属中的“二聚体”结构。通过这两个结构域的折叠产生6个高变环(H链和L链各3个环),其为抗原结合提供氨基酸残基,并赋予抗体抗原结合特异性。然而,即使是单个可变结构域(或仅包含抗原特异性的3个HVR的半数Fv)也具有识别和结合抗原的能力,尽管与整个结合位点相比亲和力更低。
“单链Fv”,也简称为“sFv”或“scFv”,是抗体片段,其包含连接到单个多肽链中的VH和VL抗体结构域。优选地,sFv多肽进一步包含VH和VL结构域之间的连接多肽,其使sFv能够形成抗原结合所需的结构。对于sFv的综述,参见Pluckthun in The Pharmacology ofMonoclonal Antibodies,第113卷,Rosenburg和Moore编辑,Springer-Verlag,New York,pp.269-315(1994);Borrebaeck 1995,infra。
术语“嵌合抗原受体”或“CAR”在本文中以其广义含义使用,是指工程化受体,其将所需的结合特异性(例如,单克隆抗体或其他配体的抗原结合区域)移植到跨膜和细胞内信号传导结构域。通常,该受体用于将单克隆抗体的特异性移植到T细胞上,以产生嵌合抗原受体(CAR)(Dai等人,JNatl Cancer Inst,2016;108(7):djv439;和Jackson等人,NatureReviews Clinical Oncology,2016;13:370-383.)。
如本文中所用,术语“效应细胞”是指与免疫应答的认知和活化阶段相反,参与免疫应答的效应阶段的免疫细胞。一些效应细胞表达特异性Fc受体并执行特异性免疫功能。在一些实施例中,效应细胞(如自然杀伤细胞)能够诱导抗体依赖性细胞毒性(ADCC)。例如,表达FcR的单核细胞和巨噬细胞参与靶细胞的特异性杀伤并将抗原递呈给免疫系统的其他组分,或与递呈抗原的细胞结合。在一些实施例中,效应细胞可以吞噬靶抗原或靶细胞。
“人类效应细胞”是表达如T细胞受体或FcR等受体并执行效应功能的白细胞。优选地,该细胞至少表达FcγRIII并执行ADCC效应功能。介导ADCC的人类白细胞的示例包括自然杀伤(NK)细胞、单核细胞、细胞毒性T细胞和中性粒细胞;优选NK细胞。该效应细胞可以从其天然来源中分离,例如从本文所述的血液或PBMC中分离。
术语“免疫细胞”在本文中以其广义含义使用,包括但不限于髓系或淋巴系的细胞,例如淋巴细胞(如B细胞和T细胞,包括细胞溶解性T细胞(CTL))、杀伤细胞、自然杀伤(NK)细胞、巨噬细胞、单核细胞、嗜酸性粒细胞、多形核细胞,如中性粒细胞、粒细胞、肥大细胞和嗜碱性粒细胞。
抗体“效应功能”是指归因于抗体的Fc区(天然序列Fc区或氨基酸序列变体Fc区)的生物活性。抗体效应功能的示例包括C1q结合;补体依赖性细胞毒性;Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体(例如B细胞受体;BCR)下调等。
“抗体依赖性细胞介导的细胞毒性”和“ADCC”是指表达Fc受体(FcR)的非特异性细胞毒性细胞(例如,自然杀伤(NK)细胞、中性粒细胞和巨噬细胞)识别靶细胞上的结合抗体,随后引起靶细胞溶解的细胞介导反应。介导ADCC的原代细胞NK细胞仅表达FcγRIII,而单核细胞表达FcγRI、FcγRII和FcγRIII。造血细胞上的FcR表达在Ravetch和Kinet,Annu.Rev.Immunol 9:457-92(1991)的第464页的表3中概述。为了评估目标分子的ADCC活性,可以进行如美国专利第5,500,362号或第5,821,337号中所述的体外ADCC测定。可用于此类测定的效应细胞包括外周血单核细胞(PBMC)和自然杀伤(NK)细胞。可选地或另外地,可以在体内评估目标分子的ADCC活性,例如在如Clynes等人PNAS(USA)95:652-656(1998)中所公开的动物模型中。
“补体依赖性细胞毒性”或“CDC”是指存在补体时分子裂解靶标的能力。补体活化途径是由补体系统的第一成分(C1q)与同源抗原复合的分子(例如抗体)结合启动的。为评估补体活化,可以进行如Gazzano-Santoro等人,J.Immunol.Methods 202:163(1996)中所述的CDC测定。
“阻断”抗体或“拮抗剂”或“拮抗”抗体可以是抑制或降低与其结合的抗原的生物活性的抗体。优选的阻断抗体或拮抗剂抗体能够显著或完全抑制抗原的生物活性。
“结合”目标抗原的抗体,例如AS-SPIK或NS-SPIK多肽,是以足够的亲和力结合抗原的抗体,使该抗体可以用作靶向表达该抗原的细胞或组织的治疗药物,并且不会与其他蛋白质发生显著的交叉反应。关于抗体与靶分子的结合,术语“特异性结合”或“特异性结合至”特定多肽或特定多肽靶标上的表位,或“对其具有特异性”,是指可测量的不同于非特异性相互作用的结合。特异性结合可以例如通过确定与对照分子的结合相比的分子的结合来测量,对照分子通常是具有相似结构但不具有结合活性的分子。例如,特异性结合可以通过与和靶标(例如,过量的非标记靶标)相似的对照分子竞争来确定。在这种情况下,如果标记靶标与探针的结合被过量的未标记靶标竞争性抑制,则表明特异性结合。在一个实施例中,术语“特异性结合”是指分子与特定多肽或特定多肽上的表位结合,而基本上不与任何其他多肽或多肽表位结合。
术语“癌症”和“癌症的”是指或描述哺乳动物的生理状况,通常表现为不受控的细胞生长。“肿瘤”包含一个或多个癌细胞。癌症的示例包括但不限于恶性上皮肿瘤、淋巴瘤、母细胞瘤、肉瘤和白血病或淋巴恶性肿瘤。此类癌症的更具体示例包括鳞状细胞癌(例如,上皮鳞状细胞癌)、皮肤癌、黑色素瘤、肺癌(包括小细胞肺癌、非小细胞肺癌(“NSCLC”)、肺腺癌和肺鳞癌)、腹膜癌、胃癌(包括胃肠道癌)、胰腺癌(例如,胰腺导管腺癌)、胶质母细胞瘤、宫颈癌、卵巢癌(例如,高级浆液性卵巢癌)、肝癌(例如,肝细胞癌(HCC)、肝内胆管癌(ICC))、膀胱癌(例如,尿路上皮膀胱癌)、睾丸(生殖细胞肿瘤)癌、肝癌、乳腺癌、脑癌(例如,星形细胞瘤)、结肠癌、直肠癌、结直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌或肾脏癌(如肾细胞癌、肾母细胞瘤或维耳姆斯瘤)、前列腺癌、外阴癌、甲状腺癌、肝癌、肛门癌、阴茎癌以及头颈癌。癌症的其他示例包括但不限于视网膜母细胞瘤、卵泡膜细胞瘤(thecomas)、卵巢睾丸母细胞瘤(arrhenoblastomas)、肝细胞瘤、血液恶性肿瘤(包括非霍奇金淋巴瘤(NHL))、多发性骨髓瘤和急性血液恶性肿瘤、子宫内膜癌或子宫癌、子宫内膜异位症、纤维肉瘤、绒毛膜癌、涎腺癌、外阴癌、甲状腺癌、食管癌、肝癌、肛门癌、阴茎癌、鼻咽癌、喉癌、卡波西肉瘤、黑色素瘤、皮肤癌、神经鞘瘤、少突胶质细胞瘤、神经母细胞瘤、横纹肌肉瘤、成骨肉瘤、平滑肌肉瘤和泌尿道癌。
术语“转移性癌症”是指起源组织的癌细胞通过血管或淋巴管从原始部位传播到身体其他部位的一个或多个部位,以在起源组织以外的一个或多个器官中形成一个或多个继发性肿瘤的癌症状态。
如本文所用,“以AS-SPIK表达为特征的疾病”的“AS-SPIK相关疾病”是一种与AS-SPIK基因或基因产物(AS-SPIK多肽)的表达或过表达相关的疾病,其可以是以相对于合适的对照细胞表达正常或升高的AS-SPIK水平的细胞为特征的任何疾病。合适的对照细胞可以是未受AS-SPIK表达或过表达癌症影响的个体细胞,也可以是来自有需要的受试者的非癌细胞,或者可能是来自受AS-SPIK表达或过表达癌症影响的另一个个体的非癌细胞。AS-SPIK相关疾病的一个突出示例是肝癌。
术语“细胞增殖性疾病”和“增殖性疾病”是指与一定程度的异常细胞增殖相关的疾病。在一个实施例中,该细胞增殖性疾病是癌症。
如本文中所用,“肿瘤”是指所有赘生性细胞生长和增殖,无论是恶性还是良性,以及所有癌前和癌性细胞和组织。
如本文中所用,术语“预测性”和“预后性”也可以互换使用,意思是用于预测或预后的方法允许实践该方法的人员选择被认为(通常在治疗前,但不是必须的)更可能对抗癌药物(包括抗AS-SPIK抗体)治疗有反应的患者。
如本文中所用,术语“治疗(treat、treatment或treating)”是指治疗性治疗和预防性预防措施,其中该目的是预防或减缓(减轻)目标病理状况或疾病。需要治疗的受试者包括已具有特定状况或含有特定疾病的受试者,以及易于患有该疾病或需要预防该疾病的受试者。
本发明至少部分基于发现某些疾病以独特形式或丝氨酸蛋白酶抑制剂Kazal(SPIK)的表达为特征。一个突出的示例是肝癌,包括但不限于肝细胞癌(HCC)和肝内胆管癌(ICC)。更具体地,本发明者已经发现,某些癌症,如肝癌,表达的SPIK的形式为在分泌的SPIK多肽的N端包括另外23个氨基酸。在正常细胞(如胰腺细胞)分泌的SPIK多肽中未发现该23个氨基酸片段(SEQ ID NO:6)。这与我们以前的报道一致,即这23个氨基酸片段中的前9个氨基酸可以存在于肝癌细胞系分泌的未经处理的SPIK中。Lu等人,Immunology 2011;134(4):398-408。我们可以将SPIK的较长形式称为AS-SPIK或异常分泌SPIK。我们也可以将肝癌细胞产生的AS-SPIK称为LC-SPIK或肝癌分泌SPIK。在本文中术语AS-SPIK和LC-SPIK可以互换使用。示例性的AS-SPIK多肽可以具有SEQ ID NO:2的氨基酸序列。我们可以将正常细胞(如胰腺细胞)分泌的SPIK的形式称为NS-SPIK或正常分泌SPIK。示例性的NS-SPIK多肽可以具有SEQ ID NO:4的氨基酸序列。我们还发现AS-SPIK的构象(如3D结构)不同于NS-SPIK。
因此,本发明的方面包括与AS-SPIK特异性或优先结合但不与NS-SPIK结合的组合物,如抗体。还提供了AS-SPIK复合物。根据本发明实施例的AS-SPIK复合物包含与AS-SPIK特异性或优先结合的抗体,和AS-SPIK多肽或其片段。本发明的方面还包括使用受试抗体检测以AS-SPIK表达为特征的疾病(例如肝脏疾病,如肝癌,例如HCC或ICC)的方法。
虽然我们相信我们理解了在AS-SPIK表达过程中发生的某些事件,但本发明的组合物和方法并不局限于通过影响任何特定细胞机制发挥作用的组合物和方法。不受理论的束缚,本发明人假设由于SPIK是蛋白酶抑制剂,因此SPIK在癌细胞中的过表达会抑制信号肽肽酶(一种蛋白酶)的活性,从而导致癌细胞分泌出未减毒的全长蛋白质。
本文所提供的组合物包括与AS-SPIK特异性或优先结合但不与NS-SPIK结合的抗体。
丝氨酸蛋白酶抑制剂Kazal(SPIK),又称为SPINK1、PSTI、TATI,是一种小分子蛋白质,并已被证明可以广泛调节多种细胞蛋白酶的活性,如胰蛋白酶样蛋白酶和糜蛋白酶样蛋白酶。Greene,LJ,J Surg Oncol.1975;7(2):151-154;Horii等人,Biochemical andbiophysical research communications 1987;149(2):635-641;Stenman,UH,ClinChem.2002;48(8):1206-1209。SPIK也可以在抑制细胞凋亡中发挥作用。Lu等人,Immunology 2011;134(4):398-408。示例性的人类SPIK氨基酸序列包括基因库登录号:M11949,GI编号:190687;基因库登录号:NM003122,GI:657940887;和基因库登录号:BC025790,GI:19343607。
本文提供的抗体可以包括特异性或优先结合SEQ ID NO:2的氨基酸1-23内表位的抗体,或该区域内含有至少一个氨基酸的表位。该表位可以是构象表位(构象特异性表位)或线性表位。在一些实施例中,抗体特异性或优先结合至SEQ ID NO:6中所示的AS-SPIK蛋白序列中的表位。在一些实施例中,抗体特异性或优先结合至包含SEQ ID NO:6的至少一个氨基酸的构象特异性表位。
根据本发明实施例的抗体可以是多克隆或单克隆抗体,特别是单克隆抗体,并且可以由人类、鼠、兔、绵羊或山羊细胞或者由源于这些细胞的杂交瘤细胞产生。在一些实施例中,抗体可以是人源化的,或嵌合的。
根据本发明实施例的抗体可以假设各种构型,并包含由基本上由免疫球蛋白基因编码的一种或多种多肽组成的蛋白质。可以使用各种抗体结构中的任何一种,包括完整的抗体、抗体多聚体或其抗体片段或其他变体,该变体包括该抗体的功能性抗原结合区域。术语“免疫球蛋白”可以与“抗体”同义使用。该抗体的来源可以是单克隆或多克隆的。无论抗体的来源如何,合适的抗体都包括完整的抗体,例如具有两条重(H)链和两条轻(L)链的IgG四聚体、单链抗体、嵌合抗体、人源化抗体、互补决定区(CDR)接枝的抗体以及抗体片段,例如Fab、Fab′、F(ab′)2、scFv、Fv和从此类片段衍生的重组抗体,例如骆驼体、微抗体、双体和双特异性抗体。
完整抗体是包含抗原结合可变区(V
抗AS-SPIK抗体可以来自任何类型的免疫球蛋白,例如,IgA、IgG、IgE、IgD、IgM(以及其亚型(例如IgG
术语免疫球蛋白或抗体的“抗原结合部分”通常是指免疫球蛋白中与靶标特异性或优先结合的部分,在这一情况下,包含AS-SPIK(SEQ ID NO:6)而不是NS-SPIK上的氨基酸残基的表位。因此,免疫球蛋白的抗原结合部分是其中一个或多个免疫球蛋白链为非全长,但特异性或优先与细胞靶标结合的分子。抗原结合部分或片段的示例包括:(i)Fab片段,由VLC、VHC、CL和CH1结构域组成的单价片段;(ii)F(ab′)
“Fv”片段是包含完整抗原识别和结合位点的最小抗体片段。该区域由重链和轻链可变结构域以紧密共价联接形成的二聚体组成。正是在这种构型中,每个可变结构域的三个高变区相互作用,以确定V
只要抗体片段保留了全长抗体所需的特异性和/或足够的特异性来结合AS-SPIK而不是NS-SPIK,则其适用于提供的方法。
本文中所描述的抗体的抗原结合结构域可以用于生产T细胞衔接器分子(例如双特异性T细胞衔接器,又名BiTE分子)以及CAR-T结构。例如,T细胞衔接器分子在Huehls等人,Bispecific T cell engagers for cancer immunotherapy,Immunol Cell Biol.2015Mar;93(3):290-296中描述。例如,包含作为结合(靶向)结构域的单结构域抗体的CAR-T结构在Iri-Sofla等人,2011,Experimental Cell Research 317:2630-2641和Jamnani等人,2014,Biochim Biophys Acta,1840:378-386中描述。
制备抗体片段的方法包括生化方法(例如完整抗体的蛋白水解消化,其之后可以进行化学交联)和基于重组DNA的方法,其中免疫球蛋白序列通过基因工程化来指导所需片段的合成。抗体片段可以通过非特异性硫代蛋白酶、木瓜蛋白酶对整个免疫球蛋白进行蛋白水解获得。木瓜蛋白酶消化产生两个相同的抗原结合片段,称为“Fab片段”,每个片段具有单个抗原结合位点和残留的“Fc片段”。可以通过琼脂糖蛋白A或离子交换色谱法分离各种馏分。从兔和人源IgG制备F(ab′)
在本发明范围内还有制备抗AS-SPIK抗体的方法。例如,可以使用PCR诱变方法构建可变区,以改变编码免疫球蛋白链的DNA序列(例如,使用用于生成人源化免疫球蛋白的方法)。
单克隆抗体是由抗体产生细胞的单个克隆产生的抗原特异性相同的同种抗体,而多克隆抗体一般识别同一抗原上的不同表位,并由一个以上的抗体产生细胞克隆产生。每个单克隆抗体针对抗原上的单个决定簇。修饰语单克隆表示抗体的特性是从实质上同种的抗体群中获得的,而不应解释为需要通过任何特定方法生产抗体。
本文中的单克隆抗体可以包括嵌合抗体,即,通常具有与来源于特定种属或属于特定抗体类别或亚类的抗体中的相应序列相同或同源的重链和/或轻链部分的抗体,而链的其余部分与来源于另一种属或属于另一抗体类别或亚类的抗体中的相应序列以及此类抗体的片段相同或同源,只要它们表现出所需的生物活性。目标嵌合抗体包括灵长类抗体,其包含来源于非人灵长类动物(例如猿猴、旧大陆猴、新大陆猴、原猿)的可变结构域抗原结合序列和人类恒定区序列。
小鼠和大鼠单克隆抗体通过用专门设计的重组蛋白免疫小鼠或大鼠而产生,该重组蛋白具有在AS-SPIK中发现的而未在NS-SPIK中发现的额外23个氨基酸序列(SEQ ID NO6),除共同区域(SEQ ID NO:4)(在NS-SPIK和AS-SPIK中均发现的氨基酸序列)以外。在一些实施例中,该重组蛋白可以不需要具有整个23个氨基酸序列(SEQ ID NO:6)来产生仅有效结合AS-SPIK但不有效结合NS-SPIK的抗体。筛选和选择与AS-SPIK特异性或优先结合的抗体的方法在实例4中描述。
在图7中,提供了单克隆抗体的试验结果,其表明本发明的抗体能够特异性或优先识别AS-SPIK而不是NS-SPIK;这些包括但不限于IM-CA18、IM-CA22、IM-CA29、IM-CA34、IM-CA46和IM-CA71。试验描述参见实例4。
测定了单克隆抗体轻链(VL)和重链(VH)可变区的序列,其特异性或优先与AS-SPIK(而非NS-SPIK)结合(SEQ ID NO 7-14)。还测定了这些抗体的所有CDR(SEQ ID NO15-38)。图19-23提供了这些区域的对齐。下表提供了本发明的四种示例性抗体的各个VH和VL区的SEQ ID NO:。
例如,CA-18抗体具有SEQ ID NO:7中所示的VH区和SEQ ID NO:11中所示的VL区。该VH区具有3个CDR,分别为SEQ ID NO:15、19和23。该VL区具有3个CDR,分别为SEQ ID NO:27、31和35。
CA22抗体具有SEQ ID NO:8中所示的VH区和SEQ ID NO:12中所示的VL区。该VH区具有3个CDR,分别为SEQ ID NO:16、20和24。该VL区具有3个CDR,分别为SEQ ID NO:28、32和36。
CA-46抗体具有SEQ ID NO:9中所示的VH区和SEQ ID NO:13中所示的VL区。该VH区具有3个CDR,分别为SEQ ID NO:17、21和25。该VL区具有3个CDR,分别为SEQ ID NO:29、33和37。
CB77抗体具有SEQ ID NO:10中所示的VH区和SEQ ID NO:14中所示的VL区。该VH区具有3个CDR,分别为SEQ ID NO:18、22和26。该VL区具有3个CDR,分别为SEQ ID NO:30、34和38。
表A
表B
表C
此外,根据本发明实施例的抗体可以是与AS-SPIK特异性结合或优先结合但不与NS-SPIK结合的任何非天然(人造)抗体。
在一些实施例中,该抗体包含VH区,其具有SEQ ID NO:7、8、9或10中提供的序列,或者具有VH区,该VH区与SEQ ID NO:8至少约50%、65%、68%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源(或具有所述的百分比同一性),只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。VH区可以与SEQ ID NO:8至少50-68%、50-95%、65-95%或78%-95%同源(或具有所述的百分比同一性),只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。本发明的抗体可以包含本文该段中不再使用的任何VH区,并且可以包含任何VL区,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。
在一些实施例中,该抗体包含VL区,其具有SEQ ID NO:11、12、13或14中提供的序列,或者具有与SEQ ID NO:12至少69%同源(或具有至少69%同一性)的VL区,只要抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。该VL区可以与SEQ ID NO:12至少69%-95%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源(或具有所述的百分比同一性),只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。本发明的抗体可以包含本文描述的任何VL区,并且可以包含本文描述的任何VH区,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。
在一些实施例中,该抗体具有VH CDR1区,其具有SEQ ID NO:15、16、17或18中提供的序列,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。该VH CDR1区可以与SEQID NO:15、16、17或18至少40%、50%、60%、40-95%、50-95%、60-95%、40-60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。
在一些实施例中,该抗体包含VH CDR2区,其具有SEQ ID NO:19、20、21或22中提供的序列,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。该VH CDR2区可以与SEQID NO:19、20、21或22至少44%、50%、44-50%、44-95%、50-95%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。
在一些实施例中,该抗体包含VH CDR3区,其具有SEQ ID NO:23、24、25或26中提供的序列,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。该VH CDR3区可以与SEQID NO:23、24、25或26至少95%、96%、97%、98%、99%或95-99%同源,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。
在一些实施例中,该抗体包含VL CDR1区,其具有SEQ ID NO:27、28、29或30中提供的序列,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。该VL CDR1区可以与SEQID NO:27、28、29或30至少95%、96%、97%、98%、99%或95-99%同源,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。
在一些实施例中,该抗体包含VL CDR2区域,其具有SEQ ID NO:31、32、33或34中提供的序列,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。该VL CDR2区可以与SEQ ID NO:31、32、33或34至少43%、57%、43-57%、43-95%、57-95%或95-99%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。
在一些实施例中,该抗体包含VL CDR3区域,其具有SEQ ID NO:35、36、37或38中提供的序列,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。该VL CDR3区可以与SEQ ID NO:35、36、37或38至少44%、44-95%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源,只要该抗体特异性或优先结合AS-SPIK且不结合NS-SPIK。
根据本发明实施例的抗体可以包括本文描述的任何VH、VL、VH CDR1、VH CDR2或VHCDR3,或VL CDR1、VL CDR2或VL CDR3区,或这些区域的任何组合,其包括具有上述的同源性或同一性百分比的序列,只要该抗体结合AS-SPIK但不结合NS-SPIK。
使用由北卡罗来纳州立大学开发的软件程序“BioEdi”测定这些抗体的序列同源性。
还研究了抗体的同源性和与AS-SPIK的结合活性。结果在实例6和7中描述。
单克隆抗体的生产方法可以包括纯化步骤。例如,该抗体通常可以进一步纯化,例如,使用过滤、离心和各种色谱方法,如HPLC或亲和层析,所有这些都是本领域普通技术人员之一所熟知的技术。这些纯化技术均涉及分馏,以将所需抗体与混合物的其他组分分离。特别适用于抗体制备的分析方法包括,例如,琼脂糖蛋白A和/或琼脂糖蛋白G色谱法。
本发明的抗AS-SPIK抗体可以包括人源或非人源的CDR。“人源化”抗体通常是来自小鼠、大鼠、仓鼠、兔或其他种属的嵌合或突变单克隆抗体,其携带人类恒定和/或可变区结构域或特异性变化。免疫球蛋白的框架可以是人类的、人源化的或非人类的(例如,修饰以降低在人类中的抗原性的鼠框架),或合成框架(例如,共有序列)。人源化免疫球蛋白是其中框架残基对应于人类种系序列的免疫球蛋白,CDR由V(D)J重组和体细胞突变产生。然而,人源化免疫球蛋白也可以包括人类种系免疫球蛋白核酸序列中未编码的氨基酸残基(例如,通过随机或位点特异性诱变离体引入的突变)。例如,由体内体细胞突变过程引入的基于种系序列但具有框架突变的抗体可变结构域基因被称为“人类的”。
人源化抗体可以通过本领域已知的各种方法进行工程化改造,包括,例如:(1)将非人类互补决定区(CDR)移植到人类框架和恒定区(本领域称为人源化的过程),或者(2)移植整个非人类可变结构域,但通过替换表面残留物为其提供类人类表面(本领域称为表面改构(veneering)的过程)。人源化抗体可以包括人源化和表面改构抗体。同样,可以通过将人免疫球蛋白位点引入转基因动物(例如,其中内源性免疫球蛋白基因已部分或完全失活的小鼠)中来制备人类抗体。攻击(challenge)时,观察到人类抗体产生,其在所有方面均与人类中观察到的非常相似,包括基因重排、组装和抗体库。
除嵌合和人源化抗体外,全人源抗体可以来源于具有人免疫球蛋白基因的转基因小鼠。在一些实施例中,抗体可以通过scFv-噬菌体展示文库产生和鉴定。
可以对抗AS-SPIK抗体进行修饰,以调节其抗原结合亲和力、效应功能或药代动力学。特别地,可以在CDR和筛选的产物中进行随机突变,以识别具有更高亲和力和/或更高特异性的抗体。通常,CDR可以在1或2个氨基酸上存在差异。
例如,CDR改组和植入技术可以与本文提供的抗体一起使用。CDR改组将CDR序列插入到特定的框架区。CDR植入技术允许将CDR序列随机组合到单个主框架中。使用此类技术,可以例如诱变抗AS-SPIK抗体的CDR序列,以产生多种不同的序列,其可以整合到支架序列中,并针对所需的特征,例如更高的亲和力筛选所得的抗体变体。
我们对SPIK功能的研究表明,SPIK可以结合颗粒酶A(GzmA),并抑制其诱导细胞凋亡。Lu等人,Immunology 2011;134(4):398-408。GzmA是一种细胞毒性丝氨酸蛋白酶,其由活化的CTL和NK细胞分泌以在免疫监视过程中杀死靶细胞。已经证实了GzmA诱导的细胞凋亡在清除恶性肿瘤细胞,如肿瘤前体/肿瘤生殖细胞中的作用。Pardo等人,EurJImmunol.2002;32(10):2881-2887。因此,AS-SPIK在肝癌细胞中的过度表达可能会引起细胞在免疫清除过程中抵抗由GzmA诱导的细胞凋亡。这导致这些癌细胞逃避免疫途径的杀伤。Lu等人,Immunology 2011;134(4):398-408。基于这一假说,在不受理论束缚的情况下,我们得出结论,抑制AS-SPIK的过度表达,或抑制过度表达的AS-SPIK的活性,可以恢复GzmA在人体免疫清除过程中诱导的癌细胞的免疫杀伤。
在实例11中证明了抗AS-SPIK抗体可以抑制AS-SPIK的活性。因此,可以使用抗AS-SPIK抗体阻断AS-SPIK与GzmA结合、释放GzmA,并通过免疫清除恢复这些癌细胞的凋亡杀伤。出于此目的,抗SPIK抗体可以用于治疗由过表达AS-SPIK引起的疾病,包括但不限于癌症、病毒性感染和炎症。
抗体的一种治疗用途是通过人源化。人源化单克隆抗体治疗是一个正在迅速发展的领域,其特异性和效力得到了很好的研究。Rothernberg,ME,Cell 2016;165(3):509。受试抗AS-SPIK单克隆抗体,包括但不限于IM-CA18、IM-CA22、IM-CA46和IM-CB77,以及本发明的其他能够抑制SPIK活性的抗体,也可以人源化并用于疾病治疗。
使用重组技术,例如噬菌粒技术,可以从编码一系列抗体的重组基因中制备具有所需特异性的抗体。某些重组技术涉及通过对由从免疫动物脾脏分离的RNA制备的组合免疫球蛋白噬菌体表达文库进行免疫筛选来分离抗体基因。对于此类方法,可以由从免疫动物脾脏中分离的RNA制备组合免疫球蛋白噬菌粒文库,并可以利用表达抗原的细胞和对照细胞,通过淘选筛选出表达适当抗体的噬菌粒。
除了上述公开的组合免疫球蛋白噬菌体表达文库外,一种分子克隆方法是由含有人类抗体文库的转基因小鼠制备抗体。此类转基因动物可以用于产生单一同种型的人类抗体,更具体地,是B细胞成熟所必需的同种型,如IgM和可能的IgD。
抗AS-SPIK免疫球蛋白可以进行修饰以减少或消除糖基化。缺乏糖基化的免疫球蛋白可以是完全没有糖基化的免疫球蛋白;没有完全糖基化的免疫球蛋白;或者是非典型糖基化的免疫球蛋白(即突变体的糖基化模式不同于相应野生型免疫球蛋白的糖基化模式)。IgG多肽包括一个或多个(例如1、2或3或更多)减弱糖基化的突变,即导致缺乏糖基化的IgG CH2结构域、或未完全糖基化或非典型糖基化的突变。还可以对寡糖结构进行修饰,例如,通过去除N-连接聚糖中的岩藻糖部分。
还可以通过与非蛋白质聚合物(如聚乙二醇)偶联来修饰抗体,以增加其在体内的稳定性和/或溶解度。只要抗AS-SPIK抗体保留选择性结合AS-SPIK但不结合NS-SPIK的能力,任何peg化方法都可以使用。
只要产生的多肽包括对靶标,即AS-SPIK具有特异性的至少一个结合区域,就可以使用各种各样的抗体/免疫球蛋白框架或支架。此类框架或支架包括人免疫球蛋白的5种主要独特型或其片段(如本文其他地方公开的),并包括其他动物种属的免疫球蛋白,优选具有人源化的方面。在这方面,单链重链抗体(如在骆驼中识别的抗体)特别令人感兴趣。
本发明的抗AS-SPIK抗体特异性或优先与AS-SPIK上的表位结合,但不与NS-SPIK上的表位结合。表位是指靶标上与互补位特异性结合的抗原决定簇,即抗体的结合位点。表位决定簇通常由如氨基酸或糖侧链等分子的化学活性表面基团组成,通常具有特定的三维结构特征,以及特定的电荷特征。表位通常具有约4至约10个,优选4至8个连续氨基酸(线性或连续表位),或者可选地可以是限定特定结构的一组非连续氨基酸(例如,构象表位)。因此,表位可以由至少4、至少6、至少8、至少10和至少12个此类氨基酸组成。确定氨基酸空间构象的方法是本领域已知的,包括,例如,x射线晶体学和二维核磁共振。
预测可以结合抗体的其他潜在表位的方法包括但不限于Kyte-Doolittle分析(Kyte和Dolittle,J.Mol.Biol.157:105-132(1982)),Hopp和Woods分析(Hopp和Woods,Proc.Natl.Acad.Sci.USA 78:3824-3828(1981);Hopp和Woods,Mol.Immunol.20:483-489(1983);Hopp,J.Immunol.Methods 88:1-18(1986)),Jameson-Wolf分析(Jameson和WolfComput.Appl.Biosci.4:181-186(1988)),和Emini分析(Emini等人,Virology 140:13-20(1985)),Chou和Fasman分析(Ponomarenko&Regenmortel,StructuralBioinformatics,2009),Karplus和Schulz分析(Kolaskar和TongaonkarAnalysisKolaskar&Tongaonkar,FEBS Letters,172-174(1990)),和Parker分析。在一些实施例中,通过与其他研究中已知抗原位点的相关性确定潜在表位,这些预测技术可以与结构数据结合,如X射线晶体学数据。表位预测还可以包括同时预测连续和不连续表位的技术。预测不连续表位的方法包括但不限于以下:DiscoTope、BEpro、ElliPro、SEPPA、EPITOPIA、EPCES、Bpredictor和EPMeta(Yao等人,PLOS ONE,(2013))。在一些实施例中,通过确定理论胞外结构域来识别潜在的表位。分析算法,如TMpred(参见Hofmann和Stoffel,Biol.Chem.374:166(1993))或TMHMM(Krogh等人,J.Mol.Biol.,305(3):567-580(2001))可以用于进行此类预测。其他算法,如SignalP3.0(Bednsten等人,J.Mol.Biol.340(4):783-795(2004))可以用于预测信号肽的存在,并预测这些肽将从全长蛋白中裂解的位置。该细胞外的蛋白质部分可以作为抗体相互作用的靶标。
本发明的组合物包括本文描述的抗体,其:(1)表现出结合活性的阈值水平;(2)与已知的相关多肽分子无显著交叉反应;(3)与AS-SPIK结合,和(4)不与NS-SPIK结合。抗体的结合亲和力可以很容易地由本领域的普通技术人员确定,例如,通过Scatchard分析(Scatchard.Ann.NYAcad,Sci.51:660-672(1949))。
在一些实施例中,对于靶标AS-SPIK,与预测与AS-SPIK具有一定同源性的其他蛋白,例如NS-SPIK相比,该抗AS-SPIK抗体可以以至少1.5倍、2倍、5倍、10倍、100倍、10
在一些实施例中,该抗AS-SPIK抗体以10
本发明的抗体可以以10
在一些实施例中,该抗体不与已知的相关多肽分子结合;例如,它们与AS-SPIK结合,但不与已知的相关多肽结合,例如,NS-SPIK。可以针对已知的相关多肽筛选抗体,以分离特异性或优先结合AS-SPIK的抗体群体。例如,在适当的缓冲液条件下,对AS-SPIK具有特异性的抗体将流经包含粘附在不溶性基质上的NS-SPIK的色谱柱。此类筛选允许分离与密切相关的多肽无交叉反应的多克隆和单克隆抗体。筛选和分离特异性抗体的其他方法包括但不限于,例如,并行免疫电泳、放射免疫测定(RIA)、放射免疫沉淀、酶联免疫吸附测定(ELISA)、斑点印迹或免疫印迹测定、抑制或竞争测定和夹心测定。
根据本发明实施例的抗体可以包括可检测的标记物,其也可以被称为报告物(例如,可检测的报告物)。在一些实施例中,可检测的标记物可以是与抗体(例如抗AS-SPIK抗体)或其生物活性片段共价连接的任何分子,其允许定性和/或定量评估标记肽的表达或活性。该活性可以包括生物活性、理化活性或其组合。只要标记抗体保留生物活性,可检测的标记物的形式和位置均可以变化。可以使用多种不同的标记物,并且特定标记物的选择将取决于所需的应用。标记的抗AS-SPIK抗体可以用于,例如,评估生物样品(例如,尿液、唾液、脑脊液、血液或活检样品)中的AS-SPIK水平。
可检测的标记物可以包括酶、光亲和配体、放射性同位素和荧光或化学发光化合物。示例性酶标记物可以包括辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶和脲酶。抗AS-SPIK抗体与酶的共价连接可以通过不同的方法进行,例如通过游离氨基与戊二醛偶联。或者,抗AS-SPIK抗体可以通过糖残基与酶偶联。其他含有碳水化合物的酶也可以以这种方式与抗体偶联。酶偶联也可以通过使用异双功能连接肽(如6-(N-马来酰亚胺基)己酸琥珀酰亚胺酯),将抗体的氨基与酶的游离巯基(如β-半乳糖苷酶)交联来执行。辣根过氧化物酶检测系统可以,例如,与显色底物四甲基联苯胺(TMB)一起使用,其在存在过氧化氢的情况下产生可在450nm处检测到的可溶性产物。例如,碱性磷酸酶检测系统可以与显色底物对硝基苯磷酸盐一起使用,其产生可在405nm处易于检测到的可溶性产物。同样,β-半乳糖苷酶检测系统可以与显色底物邻硝基苯基-P-D-吡喃半乳糖氧化物(ONPG)一起使用,其产生可在410nm处检测到的可溶性产物。脲酶检测系统可以与底物(如尿素-溴甲酚紫)一起使用。
可检测的标记物可以是荧光标记物,包括但不限于异硫氰酸荧光素、罗丹明、藻红蛋白、藻蓝蛋白、别藻蓝蛋白、邻苯二甲醛和荧光胺;选自由鲁米诺、异鲁米诺、芳香族吖啶酯、咪唑、吖啶盐和草酸酯组成的组的化学发光化合物;脂质体或葡聚糖;或生物发光化合物,如荧光素、荧光素酶和水母发光蛋白。可选地或另外地,可检测的标记物包括但不限于不透射线或造影剂,如钡、泛影酸盐、乙碘油、枸橼酸镓、碘卡酸、碘西他酸、碘酰胺、碘肥胺、碘沙酸、碘古酰胺、碘海醇、碘帕醇、碘番酸、碘普西酸、碘西法酸、碘丝酸、碘砜葡胺、碘塞酸(iosemetic acid)、碘酞硫、碘替酸、碘他拉酸、碘曲西酸、碘克沙酸、羟泛影酸、碘泊酸盐、葡甲胺、甲泛葡胺、甲泛影酸盐、丙碘酮和氯化亚铊。
可以在合成期间或合成后添加标记物。重组抗AS-SPIK抗体或其生物活性变体也可通过向其中生长有转化细胞的培养基中加入标记的前体(如放射性标记的氨基酸)进行标记。在一些实施例中,可以使用肽的类似物或变体,以便于加入可检测的标志物。例如,任何N-末端苯丙氨酸残基都可以用密切相关的芳香族氨基酸取代,如酪氨酸,其可以很容易地用
在一些实施例中,本发明的组合物可以包括SPIK多肽,例如由上述任何核酸序列编码的AS-SPIK多肽。术语“肽”、“多肽”和“蛋白质”在本文中可以互换使用,但通常指不同大小的肽序列。我们可以将本发明的基于氨基酸的组合物称为“多肽”,以传达它们是氨基酸残基的线性聚合物,并帮助将它们与全长蛋白区分开来。根据本发明实施例的多肽可以“构成”或“包括”AS-SPIK多肽或NS-SPIK多肽的片段,并且本发明包括构成或包括AS-SPIK多肽或NS-SPIK多肽的生物活性变体的多肽。因此,应当理解的是多肽可以仅包括AS-SPIK多肽或NS-SPIK多肽(或其生物活性变体)的片段,但也可以包括额外的残基。生物活性变体将保留足够的活性来抑制蛋白酶。
氨基酸残基之间的键可以是常规的肽键或另一种共价键(如酯键或醚键),并且多肽可以通过酰胺化、磷酸化或糖基化进行修饰。修饰可以影响多肽骨架和/或一个或多个侧链。化学修饰可以是在编码多肽的mRNA的翻译后在体内进行的天然修饰(例如,细菌宿主中的糖基化)或在体外进行的合成修饰。AS-SPIK多肽或NS-SPIK多肽的生物活性变体可以包括由天然存在(即,在体内自然产生)和合成修饰(即,在体外自然产生或非天然存在的修饰)的任何组合引起的一种或多种结构修饰。修饰的示例包括但不限于:酰胺化(例如,C末端的游离羧基被氨基取代);生物素化(例如,赖氨酸或其他活性氨基酸残基与生物素分子的酰化);糖基化(例如,在天冬酰胺、羟赖氨酸、丝氨酸或苏氨酸残基上添加糖基,以生成糖蛋白或糖肽);乙酰化(例如,添加乙酰基团,通常在多肽的N末端);烷基化(例如,添加烷基基团);异戊二烯化(例如,添加类异戊二烯基团);脂化(例如,硫辛酸部分的附着);磷酸化(例如,在丝氨酸、酪氨酸、苏氨酸或组氨酸上添加磷酸基团)。
生物活性变体中的一个或多个氨基酸残基可以是非天然存在的氨基酸残基。天然存在的氨基酸残基包括由遗传密码自然编码的氨基酸以及非标准氨基酸(例如,具有D-构型而不是L-构型的氨基酸)。目前的肽还可以包括氨基酸残基,它们是标准残基的修饰版本(例如,可以使用吡咯赖氨酸代替赖氨酸,可以使用硒代半胱氨酸代替半胱氨酸)。非天然存在的氨基酸残基是自然界中未发现的氨基酸残基,但符合氨基酸的基本分子式,并可以并入肽中。这些包括D-别异亮氨酸(2R,3S)-2-氨基-3-甲基戊酸和L-环戊基甘氨酸(S)-2-氨基-2-环戊基乙酸。对于其他示例,人们可以查阅教科书或环球网(该网站目前由加州理工学院维护,并显示已成功并入功能性蛋白质中的非天然氨基酸的结构)。
可选地或另外地,生物活性变体中的一个或多个氨基酸残基可以是天然存在的残基,其与在野生型序列中相应位置处发现的天然存在的残基不同。换句话说,生物活性变体可以包括一个或多个,特别是一个或两个氨基酸取代。我们可以将氨基酸残基的取代、添加或缺失称为野生型序列的突变。如上所述,取代可以用非天然存在的残基或仅用不同的天然存在的残基替代天然存在的氨基酸残基。此外,取代可以构成保守或非保守取代。保守的氨基酸取代通常包括以下基团的取代:甘氨酸和丙氨酸;缬氨酸、异亮氨酸和亮氨酸;天冬氨酸和谷氨酸;天冬酰胺、谷氨酰胺、丝氨酸和苏氨酸;赖氨酸、组氨酸和精氨酸;以及苯丙氨酸和酪氨酸。
作为AS-SPIK生物活性变体的多肽可以根据其序列与相应野生型多肽相似或同源的程度进行表征。例如,生物活性变体的序列可以与野生型多肽中相应的残基至少或约80%同源(或相同)。例如,AS-SPIK多肽或NS-SPIK多肽的生物活性变体可以具有与AS-SPIK多肽(SEQ ID NO:2、4或6)或其同源物或直系同源物具有至少或约80%的序列同源性(例如,至少或约85%、90%、95%、96%、97%、98%或99%的序列同源性)(或所述的百分比同一性)的氨基酸序列。
AS-SPIK多肽或NS-SPIK多肽的生物活性变体将保留足够的生物活性以用于本发明的方法。生物活性变体将保留足够的活性,以作为蛋白酶活性的抑制剂。可以采用本领域普通技术人员已知的方法评估生物活性,包括但不限于体外裂解测定或功能测定。
多肽可以通过多种方法产生,例如,包括重组技术或化学合成。一旦产生,多肽可以被分离和纯化到任何所需的程度。例如,可以使用以下的冻干法,例如反相(优选)或正相HPLC,或在多糖凝胶介质(如SephadexG-25)上进行尺寸排阻或分配色谱法。通过标准方法、氨基酸测序或FAB-MS技术降解肽后,可以通过氨基酸分析确认最终多肽的组合物。可以使用本领域已知的方法制备盐,包括酸盐、酯、酰胺和多肽氨基的N-酰基衍生物,并且此类肽在本发明的背景下是有用的。
还提供了AS-SPIK复合物。根据本发明实施例的AS-SPIK复合物包括如本文所述的本发明的抗体,其与AS-SPIK和AS-SPIK多肽或其片段特异性或优先结合。该片段特别具有至少23个氨基酸(SEQ ID NO:6)的长度,优选至少10个氨基酸,更优选SEQ ID NO:6的至少第7至(并包括)第23个氨基酸,甚至更优选SEQ ID NO:6的至少第8至(并包括)第17个氨基酸。抗体可以是上述任何一种抗AS-SPIK抗体。AS-SPIK多肽或其片段可以是上述AS-SPIK多肽或其片段。在一些实施例中,抗体是抗AS-SPIK单克隆抗体、IMCA18、IM-CA22、IM-CA46或IMCB-77(序列数据中列出的VL和VH序列)。在一些实施例中,AS-SPIK多肽是氨基酸序列与SEQ ID NO:2或SEQ ID NO:6的氨基酸序列具有至少98%同源(或同一性)的多肽。在一些实施例中,AS-SPIK多肽是氨基酸序列为SEQ ID NO:2的多肽。
抗AS-SPIK抗体(如IM-CA18、IM-CA22、IM-CA46或IM-CB77)的特异性结合在一定条件下可以与AS-SPIK或AS-SPIK肽形成免疫复合物。可以从溶液中沉淀复合物以用于进一步分析,例如,使用夹心ELISA试验。使用以第二抗AS-SPIK抗体固定的96孔板作为载体,可以通过板捕获免疫复合物。如果该复合物中的抗体用辣根过氧化物酶(HPR)等报告物进行标记,则可以测定形成的AS-SPIK免疫复合物的量。图10提供了用于测定供试溶液中抗AS-SPIK抗体/AS-SPIK复合物含量的ELISA的结果。AS-SPIK免疫复合物也可以通过与第二抗AS-SPIK抗体连接的琼脂糖珠捕获,以用于蛋白免疫印迹分析;图9示出了AS-SPIK复合物的蛋白免疫印迹分析的结果。
术语“核酸”和“多核苷酸”在本文中可以互换使用,是指RNA和DNA,包括cDNA、基因组DNA、合成DNA和含有核酸类似物的DNA(或RNA),其中任何一种都可以编码本发明的多肽,并且本发明包含所有这些多肽。多核苷酸基本上可以有任何三维结构。核酸可以是双链或单链(即有义链或反义链)。多核苷酸的非限制性示例包括基因、基因片段、外显子、内含子、信使RNA(mRNA)及其部分、转移RNA、核糖体RNA、siRNA、微小RNA、核酶、cDNA、重组多核苷酸、分支多核苷酸、质粒、载体、任何序列的分离DNA、任何序列的分离RNA、核酸探针和引物以及核酸类似物。在本发明的背景下,核酸可以编码天然存在的AS-SPIK多肽或NS-SPIK多肽的片段或其生物活性变体。核酸的非限制性示例分别包括SEQ ID NO:1或其生物活性片段,以及SEQ ID NO:3或SEQ ID NO:5或其生物活性片段。该片段可以具有至少66个核苷酸的长度,优选至少54个核苷酸的长度,更优选具有SEQ ID NO:3的第28个核苷酸至(并包括)第105个核苷酸的长度,甚至更优选具有SEQ ID NO:3的第49个核苷酸至(并包括)第105个核苷酸的长度。Lu等人,Immunology 2011;134(4):398-408。
“分离”的核酸可以是,例如,天然存在的DNA分子或其片段,前提是通常在天然存在的基因组中的DNA分子侧翼发现的至少一个核酸序列被移除或缺失。因此,分离的核酸包括但不限于作为独立分子存在的DNA分子,与其他序列无关(例如,化学合成的核酸,或由聚合酶链反应(PCR)或限制性内切酶处理产生的cDNA或基因组DNA片段)。分离的核酸也是指加入载体、自主复制质粒、病毒或原核生物或真核生物的基因组DNA中的DNA分子。此外,分离的核酸可以包括作为杂交或融合核酸的一部分的工程化核酸,如DNA分子。例如,cDNA文库或基因组文库,或含有基因组DNA限制酶切消化的凝胶切片中存在于多个(例如,几十个或数百至数百万个)其他核酸中的核酸不是分离的核酸。
例如,可以通过聚合酶链反应(PCR)技术产生分离的核酸分子,其可以用于获得含有本文所述核苷酸序列的分离核酸,包括本文中所描述的编码多肽的核苷酸序列。PCR可以用于扩增DNA以及RNA的特定序列,其包括来自总基因组DNA或总细胞RNA的序列。通常,使用目标区域末端或以外的序列信息设计寡核苷酸引物,其序列与待扩增模板的相反链相同或相似。还提供了各种PCR策略,通过这些策略可以将位点特异性核苷酸序列修饰引入模板核酸中。
分离的核酸也可以化学合成,或作为单个核酸分子(例如,使用亚磷酰胺技术在3’到5’方向上自动合成DNA)或作为一系列寡核苷酸。例如,可以合成含有所需序列的一对或多对长寡核苷酸(例如,>50-100个核苷酸),每对均含有短段互补(例如,约15个核苷酸),使得在寡核苷酸被退火时形成双链体。DNA聚合酶用于延伸寡核苷酸,导致每个寡核苷酸对产生单个双链核酸分子,然后可以连接到载体上。本发明的分离核酸也可以通过,例如,编码AS-SPIK或NS-SPIK的DNA的天然存在部分(例如,根据上述公式)的诱变获得。
两个核酸或它们编码的多肽可以被描述为彼此具有一定程度的同源性或同一性。例如,AS-SPIK多肽或NS-SPIK多肽及其生物活性变体可以被描述为表现出一定程度的同源性或同一性。对齐可以通过将短AS-SPIK多肽或NS-SPIK多肽序列定位在蛋白质信息研究(PIR)位点(http://pir.georgetown.edu),然后使用NCBI网站(http://www.ncbi.nlm.nih.gov/blast)上的“几乎相同的短序列”基本局部对齐搜索工具(BLAST)算法进行分析。
为了确定序列同源性或同一性,可以使用计算机程序,如,例如BioEdit(版本4.8.5,北卡罗来纳州立大学),将查询的核酸或氨基酸序列分别与一个或多个受试者的核酸或氨基酸序列进行对齐,该程序允许横跨整个长度对核酸或蛋白质序列执行对齐(全局对齐)或ALIGN-2,如上所述。
BioEdit计算查询与一个或多个目标序列之间的最佳匹配,并对其进行对齐,以便确定同一性、相似性和差异。一个或多个残基的缺口可以插入到查询序列、目标序列或两者中,以使序列对齐最大化。对于核酸序列的快速成对对齐,使用以下默认参数:字号:2;窗口大小:4;评分方法:百分比;顶部对角线数量:4;和间隙惩罚:5。对于核酸序列的多重对齐,使用以下参数:间隙开放惩罚:10.0;间隙扩展惩罚:5.0;权重转换:是。对于蛋白质序列的快速成对对齐,采用以下参数:字号:1;窗口大小:5;评分方法:百分比;顶部对角线数量:5;间隙惩罚:3。对于蛋白序列的多重对齐,采用以下参数:权重矩阵:blosum;间隙开放惩罚:10.0;间隙扩展惩罚:0.05;亲水性间隙:开;亲水性残基:Gly、Pro、Ser、Asn、Asp、Gln、Glu、Arg和Lys;残基特异性间隙惩罚:开。输出是反映序列之间关系的序列对齐。
为了确定查询序列和目标序列之间的同源性百分比,BioEdit将最佳对齐中的同一性数量除以对比的残基数量(排除间隙位置),并将结果乘以100。输出是目标序列相对于查询序列的同源性百分比。值得注意的是,同源性百分比值可以四舍五入至最接近的十分之一。例如,78.11、78.12、78.13和78.14四舍五入至78.1,而78.15、78.16、78.17、78.18和78.19四舍五入至78.2。
本文所述的核酸和多肽可以称为“外源性”。术语“外源性”表示核酸或多肽是重组核酸构建体的一部分或由重组核酸构建体编码,或不在其自然环境中。例如,外源性核酸可以是从一个种属引入另一个种属的序列,即异源核酸。通常,此类外源核酸通过重组核酸构建体引入其他种属。外源性核酸也可以是生物体天然的序列,并已重新引入该生物体的细胞中。包括天然序列的外源核酸通常可以通过与外源核酸连接的非天然序列的存在与天然存在的序列进行区分,例如,在重组核酸构建体中,非天然调控序列侧接天然序列。此外,稳定转化的外源核酸通常整合在发现天然序列的位置以外的位置。
本文还提供了重组构建体,可以用于转化细胞以表达AS-SPIK。重组核酸构建体包括一个编码AS-SPIK或NS-SPIK序列的核酸,该序列可操作地连接至适合于在特定细胞中表达AS-SPIK或NS-SPIK的调控区。应当理解的是,多种核酸可以编码具有特定氨基酸序列的多肽。遗传密码的简并性在本领域中是众所周知的。对于多种氨基酸,存在一个以上的核苷酸三联体作为氨基酸的密码子。例如,使用该生物体的适当密码子偏好表,可以修改AS-SPIK或NS-SPIK编码序列中的密码子,以便获得在特定生物体中的最佳表达。
还提供了含有核酸(如本文中所描述的那些核酸)的载体。“载体”是复制子,如质粒、噬菌体或粘粒,其中可以插入另一个DNA片段从而带来插入片段的复制。通常,当与适当的对照元素相关联时,载体能够复制。合适的载体骨架包括,例如,本领域常规使用的载体骨架,如质粒、病毒、人工染色体、BAC、YAC或PAC。术语“载体”包括克隆和表达载体,以及病毒载体和整合载体。“表达载体”是包含调控区的载体。可以使用多种宿主/表达载体组合来表达本文所述的核酸序列。合适的表达载体包括但不限于来源于例如噬菌体、杆状病毒和逆转录病毒等的质粒和病毒载体。
本文提供的载体还可以包括,例如,复制起点、支架附着区(SAR)和/或标志物。标志物基因可以赋予宿主细胞可以选择的表型。例如,标志物可以赋予杀生物剂抗性,如对抗生素(例如,卡那霉素、G418、博来霉素或潮霉素)的抗性。如上所述,表达载体可以包括标签序列,其旨在促进表达多肽的操作或检测(例如,纯化或定位)。标签序列,如绿色荧光蛋白(GFP)、谷胱甘肽S-转移酶(GST)、多组氨酸、c-myc、血凝素或Flag
其他表达载体还可以包括,例如,染色体、非染色体和合成DNA序列的片段。合适的载体包括SV40的衍生物和已知的细菌质粒,例如,大肠杆菌质粒col E1、pCR1、pBR322、pMal-C2、pET、pGEX、pMB9及其衍生物,质粒如RP4;噬菌体DNA,例如噬菌体1的多种衍生物,例如NM989,和其他噬菌体DNA,例如M13和丝状单链噬菌体DNA;酵母质粒,如2μ质粒或其衍生物,在真核细胞中有用的载体,如在昆虫或哺乳动物细胞中有用的载体;来源于质粒和噬菌体DNA组合的载体,如已被修饰用于使用噬菌体DNA或其他表达对照序列的质粒。
载体还可以包括一个调控区。术语“调控区”是指影响转录或翻译起始和速率以及转录或翻译产物的稳定性和/或迁移率的核苷酸序列。调控区包括但不限于启动子序列、增强子序列、反应元件、蛋白质识别位点、可诱导元件、蛋白质结合序列、5′和3′非翻译区(UTR)、转录起始位点、终止序列、多聚腺苷酸化序列、核定位信号和内含子。
如本文中所使用,术语“可操作地连接”是指调控区和在核酸中待转录的序列的定位,从而影响此类序列的转录或翻译。例如,为了在启动子的控制下带来编码序列,多肽翻译阅读框架的翻译起始位点通常位于启动子下游1至约50个核苷酸之间。然而,启动子可以位于翻译起始位点上游约5000个核苷酸或转录起始位点上游约2000个核苷酸处。启动子通常包括至少一个核心(基础)启动子。启动子还可以包括至少一个控制元件,如增强子序列、上游元件或上游激活区(UAR)。待包括在内的启动子的选择取决于几个因素,包括但不限于效率、选择性、可诱导性、所需的表达水平和细胞或组织优先表达。通过适当地选择和定位启动子和相对于编码序列的其他调控区来调节编码序列的表达是本领域技术人员之一的常规问题。
包含AS-SPIK或NS-SPIK核酸序列的载体可以被配制成促进细胞,即原核或真核细胞,例如哺乳动物细胞的摄取。有用的载体系统和配方如上所述。在一些实施例中,载体可以将组合物递送至特定的细胞类型。然而,本发明并不限于此,还考虑了其他DNA递送方法,例如化学转染,使用,例如磷酸钙、DEAE葡聚糖、脂质体、阳性脂质体、表面活性剂和全氟化学液体,以及物理递送方法,例如电穿孔、微量注射、弹道颗粒和“基因枪”系统。在一些实施例中,本发明的多核苷酸也可以与微递送载体一起使用,例如阳离子脂质体、其他含脂质的复合物和其他能够介导多核苷酸递送至宿主细胞的大分子复合物。另一种递送方法是使用单链DNA产生载体,其可以在细胞内产生表达产物。
本文公开的组合物通常且在各种方面用于诊断和/或治疗以AS-SPIK表达为特征的疾病。此类疾病包括但不限于癌症、病毒性感染和炎症性疾病。一个突出的示例是肝癌。其他非限制性示例包括本文中描述的与术语“癌症”定义相关的癌症。相应地,本发明的方面涉及在患有所述癌症或存在发生所述癌症风险的受试者中诊断和/或治疗癌症(例如肝癌)的方法。术语“受试者”、“患者”和“个体”在本文中可以互换使用。
在一些实施例中,该方法涉及将受试者的生物供试样品与AS-SPIK抗体或抗原结合片段接触,以生成AS-SPIK-抗体复合物;检测生物供试样品中AS-SPIK-抗体复合物的浓度;并将AS-SPIK-抗体复合物的浓度与参考值进行比较,以确定受试者是否患有该疾病或有发生该疾病的风险。在某些实施例中,该方法包含将生物供试样品与结合SPIK的第一抗体或抗原结合片段接触,以生成SPIK抗体复合物;将SPIK抗体复合物与AS-SPIK抗体或抗原结合片段接触,以在生物供试样品中生成AS-SPIK抗体复合物;并将AS-SPIK抗体复合物的浓度与参考值进行比较,以确定受试者是否患有该疾病或有发生该疾病的风险。本文描述了可以用于此类方法的抗体的几种非限制性示例。
以AS-SPIK表达为特征的疾病的一个突出示例是肝癌。肝癌包括导致肝损伤或肝功能受损的多种疾病。例如,肝癌可以由感染物、疾病、创伤或遗传疾病或感染物、疾病、创伤和遗传疾病的组合导致。
肝癌可以包括涉及细胞生长异常的疾病,如原发性肝癌,例如,肝细胞癌、胆管癌、血管肉瘤和肝母细胞瘤。此类癌症可以包括处于疾病进展任何阶段的癌症,如HCC的极早期阶段(巴塞罗那临床肝癌系统(BCLC)的0期且肿瘤大小<2cm)、早期阶段(BCLC的A期,肿瘤大小在2cm至5cm之间)、中期阶段(BCLC的B期,中间肿瘤大小>5cm)、晚期阶段(BCLC的C期和D期,晚期)或转移阶段(Pons等人,HPB 2005;7(1):35-41和ICC的ICC早期阶段(I期、II期和IIIa期,肿瘤大小<2cm)、中期阶段(IIIb期和IIIc期,肿瘤大小≥2cm)和晚期阶段(IV期)(Farges等人,Cancer 2011;117(10):2170-2177)。
由病毒引起的传染性疾病也可以诱发肝癌,如乙型肝炎、丙型肝炎、丁型肝炎等,无论具体的肝炎病毒如何,此类感染既可以是急性的,也可以是慢性的。
肝癌也可以由肝损伤引起,例如肝硬化。肝硬化是肝脏瘢痕化或纤维化的晚期阶段,可以由多种形式的肝病和疾病引起。肝硬化可以由遗传疾病引起,例如血色沉着病、囊性纤维化、肝豆状核变性和自身免疫性疾病。肝硬化也可以由肝炎病毒性感染和饮酒引起。
肝癌也可以由其他疾病引起,包括但不限于酒精性肝病、与肝脏脂肪含量异常相关的疾病,如脂肪肝、非酒精性脂肪肝、非酒精性脂肪变性和肝纤维化。
“生物样品”、“供试样品”或“样品”是指从患者获得或衍生的样品。样品可以是,例如,体液样品。示例性的体液样品包括血液、血清、血浆、尿液、唾液、精液、粪便、痰液、脑脊液、泪液、粘液、羊水或其任何组合。在一些实施例中,生物样品可以是组织样品。示例性的组织样品包括活检标本,如肝活检标本,或由患者细胞制备的原代细胞培养标本,或原代培养物的上清液。
本发明的方面包括诊断测定方法,例如,诊断免疫测定,其可以用于检测供试样品中是否存在AS-SPIK。可以以多种方式配置用于检测AS-SPIK的免疫测定形式。免疫测定可以包括均相和异质分析、竞争性和非竞争性分析、直接和间接测定以及“夹心”测定。有用的形式包括但不限于酶免疫测定,例如,酶联免疫吸附测定(ELISA)、化学发光免疫测定(CLIA)、电化学发光测定、放射免疫测定、免疫荧光、荧光各向异性、免疫沉淀、平衡透析、免疫扩散、免疫印迹、凝集、发光接近测定和散射比浊法。
无论何种形式,生物样品均与本发明的抗AS-SPIK抗体接触。在一些实施例中,生物样品可以固定在固体载体上。在一些实施例中,生物样品与固定在固体载体上的本发明的抗SPIK抗体接触。固体载体可以是,例如,塑料表面、玻璃表面、纸或纤维表面或颗粒表面。更具体地,载体可以包括微孔板、微珠、聚偏二氟乙烯(PVDF)膜、硝酸纤维素膜、尼龙膜、多孔膜、无孔膜。底物的组合物可以改变。例如,底物或载体可以包括玻璃、纤维素基材料、热塑性聚合物(如聚乙烯、聚丙烯或聚酯)、由颗粒材料(例如,玻璃或各种热塑性聚合物)组成的烧结结构或由硝酸纤维素、尼龙或聚砜组成的铸膜。在一般实施例中,底物可以是抗体或多肽可以固定在其上的任何表面或载体,包括一个或多个固体载体(例如玻璃,如载玻片或包被板、二氧化硅、塑料或衍生塑料、顺磁性或非磁性金属)、半固体载体(例如,聚合材料、凝胶、琼脂糖或其他基质)和/或多孔载体(例如,过滤器、尼龙或硝酸纤维素膜或其他膜)。在一些实施例中,合成聚合物可用作底物,包括例如聚苯乙烯、聚丙烯、聚甲基丙烯酸缩水甘油酯、胺化或羧基化聚苯乙烯、聚丙烯酰胺、聚酰胺和聚氯乙烯。
在一些实施例中,免疫测定形式可以是双抗体“夹心”测定。生物样品与固定在固体载体(例如,微量滴定板)上的本发明的抗SPIK抗体接触。在有利于SPIK抗体复合物的特异性结合和形成的条件下孵育样品和第一抗体。在接触步骤后,去除生物样品的未结合成分。然后,将复合物与第二抗SPIK抗体接触。第二抗体结合至与第一抗体所结合的表位不同的SPIK表位。因此,第一和第二抗体在与SPIK的结合上不会竞争性地相互抑制。在一些实施例中,第一抗体可以识别同时存在于AS-SPIK和NS-SPIK上的表位,即抗原决定簇。我们可以将此类抗体称为“泛SPIK”抗体。或者,第一抗体可以识别仅存在于AS-SPIK上的表位。在一些实施例中,第二抗体可以识别同时存在于AS-SPIK和NS-SPIK上的表位,即抗原决定簇。或者,第二抗体可以识别仅存在于AS-SPIK或NS-SPIK上的表位。因此,夹心法可以被配置成使第一抗体为泛SPIK抗体,第二抗体与AS-SPIK特异性或优先结合但不与NS-SPIK特异性结合。或者,夹心法可以被配置成使第一和第二抗体与AS-SPIK特异性结合或优先结合但不与NS-SPIK特异性结合。
抗体结合可以通过多种方式进行测量。可以使用光学扫描仪或其他图像采集设备和允许测量信号的软件(例如,与复合物形成相关的荧光信号、发光信号或磷光信号或放射性信号),对由可检测的标记物产生的信号进行分析和定量(如适用)。测量可检测信号的示例性仪器包括但不限于酶标仪、荧光计、分光光度计和γ计数器。
可以将生物样品中的AS-SPIK水平与参考样品中的AS-SPIK水平进行比较。标准参考水平通常代表来源于个体群体的平均AS-SPIK水平。参考人群可以包括与所讨论个体相似的年龄、体型、种族背景或一般健康状况的个体。因此,可以将患者样品中的AS-SPIK水平与来源于以下的值进行比较:1)已知患有肝癌并表达AS-SPIK且体液中含有AS-SPIK的个体;2)无肝癌且体液中含有低水平AS-SPIK的个体。
通常,升高的AS-SPIK水平可以是比在对照样品中发现的AS-SPIK水平更高,优选地高至少1、2、3、4或5%,更优选地高至少5%,或比在无肝癌的正常健康个体群体样品中发现的AS-SPIK平均水平(参考值)更高的任何AS-SPIK水平。降低的AS-SPIK水平可以是比在对照样品中发现的AS-SPIK水平更低或比在患有肝癌的个体群体样品中发现的AS-SPIK平均水平更低的任何AS-SPIK水平。任何大小的群体均可以用于确定在来自正常健康个体群体样品中发现的AS-SPIK平均水平。例如,2至250之间(例如2、3、4、5、10、15、20、25、30、40、50、100、150、200、250或更多的个体)的群体可以用于测定正常健康个体群体样品中的AS-SPIK平均水平,更大样品群体的测量准确度更高。
在一些实施例中,可以使用参考图表确定样品中特定水平的AS-SPIK是否相对于对照样品或更大群体得到了升高。例如,参考图表可以包含在与所讨论个体相同年龄、种族背景或一般健康的健康个体中发现的AS-SPIK的正常范围。使用这一参考图表,相对于对照样品或相对于来源于较大群体的平均值,样品中测量的任何水平的AS-SPIK均可以分类为低、正常或升高。术语“升高的水平”被定义为高于参考水平,优选高至少2%,更优选高至少5%的水平。
可选地或另外地,生物样品中的AS-SPIK水平可以根据一个或多个额外生物标志物的水平进行“标准化”,例如,表达与AS-SPIK表达无关的另一个标志物。也就是说,可以在同一时间或不同情况下,与AS-SPIK的水平平行评价额外标志物的水平。额外标志物可以用作样品制备、处理和储存以及日间测定变异性的内部对照。AS-SPIK水平和额外标记物的值可以表示为比值,并可以将该比值与参照样品或群体获得的相似比值进行比较。有用的第二标志物可以是甲胎蛋白。
在一些实施例中,该方法可以包括使用标准参考集。该参考集可以包括一个或多个纯化SPIK多肽或其片段的样品。当使用多个样品时,这些样品可以具有不同的浓度。在一个实施例中,该参考集可以包括浓度为50ng/ml、30ng/ml、8ng/ml、3ng/ml、1ng/ml和0ng/ml的重组AS-SPIK的6个样品。该重组AS-SPIK可以使用抗AS-SPIK抗体(如IM-CA22)或抗标签抗体通过亲和层析(HPLC)进行纯化。血液或其他体液中的参考值可以变化。然而,本领域技术人员能够测定相应人群的不同体液中的平均AS-SPIK水平并确定相应的参考值,从而确保待测肝癌患者的AS-SPIK水平远高于参考值,而未患肝癌的患者或健康个体的水平远低于相应的参考值。在优选的实施例中,参考值比在正常健康个体群体样品中发现的AS-SPIK平均水平高约5%,更优选高约7%,甚至更优选高约10%。值得注意的是,生物样品和对照样品中的AS-SPIK水平将通过相同的方法测定,因此具有可比性。如上文所述,可以使用上述重组AS-SPIK通过校准曲线来测定AS-SPIK水平的绝对值。
在一些实施例中,阳性对照可以包括由真核细胞或细胞系产生的AS-SPIK样品。例如,有用的对照可以是含有100ng/ml的来自稳定细胞系S2-3的AS-SPIK的培养基。这是由本发明人通过将AS-SPIK的DNA序列插入到HCC细胞的染色体中,在过表达AS-SPIK的人工启动子的控制下产生的。
本文公开的方法可以用于检测疑似患有肝癌或有肝癌风险患者的肝癌。这些方法还可以用于分析接受过肝癌(例如肝细胞癌)治疗的患者的样品,以确定患者是否存在肝细胞癌缓解的风险。这些方法还可以用于监测治疗过程,例如,采用治疗药物(例如:小分子药物或治疗性抗体)、化疗、放射治疗或手术进行治疗,以确定治疗的疗效,并允许管理临床医生以在需要时改变治疗。这些方法还可以用于检测、监测或分析患有或有任何与调节相关疾病风险的患者,例如,从患者获得的生物样品(例如血液或血清样品)中AS-SPIK水平的增加。
本文公开的方法可以与其他标准诊断方法结合使用,例如肝酶或甲胎蛋白的血清学分析、超声(超声检查)、计算机断层扫描(CT扫描)、磁共振成像(MRI)、血管造影、腹腔镜检查或活检。
本文所述的组合物可以包装在标记的适当容器中,例如,用于检测、识别和定量生物样品中的AS-SPIK。制品(也称为“试剂盒”)可以包括本发明的抗体、培养基、用作阳性对照的抗原纯化样品或其任何组合。试剂盒中包含的容器可以包括包含本发明抗体的组合物,其与AS-SPIK特异性或优先结合但不与NS-SPIK结合。试剂盒还可以包括同时与AS-SPIK和NS-SPIK结合的抗体。还可以提供用于稀释或重建供试样品和抗体的适当缓冲液。一些组分可以以干燥形式提供并可能需要重建。抗SPIK抗体可以预结合到测定设备上,例如微孔板。因此,在一个实施例中,用于检测、识别和定量AS-SPIK的试剂盒包括抗AS-SPIK抗体和泛SPIK抗体。该试剂盒可以任选地包含可检测的标记物。
因此,包装产品(例如,含有本文中所描述的一种或多种组合物并以浓缩或即用型浓度包装用于储存、运输或销售的无菌容器)和试剂盒,包括本发明的至少一种组合物,例如抗AS-SPIK抗体,也在本发明的范围内。产品可以包括含有本发明的一种或多种组合物的容器(例如,小瓶、罐、瓶、袋或类似容器)。此外,制品可以进一步包括,例如,包装材料、使用说明书、注射器、递送装置、缓冲液或用于治疗或监测需要诊断或治疗的状况的其他对照试剂。
用于特定类型测定的试剂也可以包含在在本发明的试剂盒中。因此,试剂盒可以包括一组微珠(例如,适用于凝集测定或侧流测定)或板(例如,适用于ELISA测定的板)。在其他实施例中,试剂盒包含设备,如侧流免疫测定设备、分析转子或电化学、光学或光电传感器。一组微珠、微孔板和设备可以用于进行免疫测定。例如,它们可以用于检测第一试剂-分析物-第二试剂复合物的形成。
此外,试剂盒还可以包括各种稀释液和缓冲液、标记的结合物或其他用于检测特异性结合抗原或抗体的试剂,以及其他信号生成试剂,如酶底物、辅因子和色原体。试剂盒可以包括一个或多个不同浓度的参照样品,例如,纯化的重组AS-SPIK。试剂盒还可以包括阳性对照,例如,过表达AS-SPIK的细胞系的细胞上清液。试剂盒的其他组分可以包括包被试剂、对待测抗原或分析物具有特异性的多克隆或单克隆捕获抗体,或两种或更多种抗体的混合物、这些抗原的纯化或半纯化提取物(作为标准品)、单克隆抗体检测抗体、抗小鼠、抗犬、抗鸡或抗人类抗体以及与其结合的指示分子、用于比色比较的指示图、一次性手套、去污说明、敷药棒或容器、样品制备杯等。在一个实施例中,试剂盒包含缓冲液或其他适用于构成反应介质的试剂,以允许形成肽-抗体复合物。
此类试剂盒为临床医生提供了一种方便、有效的方法来确定受试者是否有肝癌风险。因此,在某些实施例中,试剂盒进一步包括使用说明。该产品还可以包括图例(例如,打印标签或插页或描述产品使用的其他媒介(例如,录音带或录像带))。该图例可以与容器相关联(例如,贴在容器上),并且可以描述应进行测定的方式、指示和其他用途。
以下实例仅出于说明的目的提供,并不旨在以任何方式限制本发明的范围。虽然在本公开中提供了几个实施例,但应当理解的是,在不偏离本公开的精神或范围的情况下,公开的组合物和方法可以以多种其他特定形式体现。本实例将被视为说明性的,而不是限制性的,其目的不限于本文给出的详细信息。变化、替换和变更的各种实例可以由本领域的技术人员确定,并且可以在不偏离本文公开的精神和范围的情况下进行。
实例1:AS-SPIK和NS-SPIK之间的结构差异
使用HPLC,从S2-3细胞的培养基中纯化AS-SPIK,并从胰腺细胞的培养基中纯化NS-SPIK。在5-15%梯度的SDS-PAGE凝胶(英杰公司(Invitrogen),卡尔斯巴德,加利福尼亚州)上运行1μg的各蛋白质。转移到PVDF膜后,通过考马斯亮蓝染色观察蛋白质。图1显示了胰腺细胞产生的NS-SPIK大小约为6.5KD,这与已发表的序列数据一致,表明在分泌过程中去除NS-SPIK中的前23个氨基酸(图2,下划线的序列)。Horii等人,Biochemical andbiophysical research communications1987;149(2):635-641;Bartelt等人ArchBiochem Biophys.1977;179(1):189-199。相反,AS-SPIK的大小比NS-SPIK大约10-15KD。
为确定AS-SPIK的序列,将AS-SPIK条带从膜上切下。Alphalyse公司(帕洛阿尔托,加利福尼亚州)进行了Edman的N-末端分析。通过Edman降解预测的S2-3细胞分泌型SPIK的N末端的序列用下划线标出。Edman降解数据表明,AS-SPIK的N-末端与SPIK的残基2-6的序列相匹配(不包括起始密码子的第一个蛋氨酸)(参见图2),表明分泌后在AS-SPIK中保留了SPIK的N-末端的23个氨基酸,其以(M)K(赖氨酸)开始。图3比较了AS-SPIK和NS-SPIK的结构。
实例2:AS-SPIK和NS-SPIK之间的构象差异
NS-SPIK和AS-SPIK享有公用序列(残基24-79)(参见图3)。我们分析了AS-SPIK中额外的氨基酸是否对蛋白质构象有影响。我们测定了AS-SPIK和NS-SPIK与抗体IM-BA1的结合活性。IM-BA1是本发明人开发的单克隆抗体,并且与在AS-SPIK和NS-SPIK中发现的C1-C2区域结合(图3和4)。96孔板分别用从S2-3和胰腺细胞培养基中部分纯化的AS-SPIK和NS-SPIK包被,然后用单克隆抗体IM-BA1孵育。在37℃下孵育1小时后,用清洗缓冲液(PBS,磷酸盐缓冲盐水,pH7.4,含0.5%的吐温20)清洗板3次,然后与用辣根过氧化物酶(HRP)标记的抗小鼠抗体孵育。用TMB(赛默科技(Thermo Scientific),罗克福德,伊利诺伊州)孵育后显色,并在OD
实例3:生成仅识别AS-SPIK而不识别NS-SPIK的抗体的重组蛋白的设计
AS-SPIK与NS-SPIK的不同之处在于AS-SPIK的N末端有23个额外的氨基酸(图3)。因此,抗AS-SPIK抗体应该特异性或优先识别该区域。为了产生此类抗体,我们设计了一系列含有该区域的不同亚群的重组蛋白,并将其用于免疫小鼠。该重组蛋白包括1)标签,如GST和His,2)连接肽,如氨基酸序列VPRGSPGIHRA,其包括凝血酶裂解位点(氨基酸VPRGS),以及至多22个氨基酸的可变长度的序列(SEQ ID NO:6的子集,和3)AS-SPIK和NS-SPIK(SEQID NO:4)的共同区域(参见图6)。研究表明,AS-SPIK的额外的23个AA片段中的一些氨基酸在产生仅识别AS-SPIK的抗体中是至关重要的。
实例4:对AS-SPIK具有特异性的单克隆抗体的生产
采用众所周知的标准方法制备单克隆抗体。简言之,用上述重组蛋白免疫小鼠。在3次或4次贮存后,通过ELISA检测血液。使用96孔板捕获从S2-3细胞部分纯化的AS-SPIK和从胰腺细胞部分纯化的NS-SPIK。将血液与板反应,并用HRP标记的抗小鼠抗体孵育板来显色,与底物TMB反应后测定光密度。将产生仅与AS-SPIK结合(但不与NS-SPIK结合)的抗体的小鼠。然后将脾脏与骨髓瘤细胞融合。融合后,筛选克隆,并如前所述用ELISA评价和筛选产生与AS-SPIK结合的抗体的阳性克隆。最后,挑取与AS-SPIK具有高亲和力的最佳杂交瘤。利用这一技术我们已经选择了超过22种单克隆抗体。图7示出了6个克隆,分别命名为IM-C18、IM-CA22、IM-CA29、IM-CA34、IMCA46和IM-CA71,它们与AS-SPIK显示出高结合活性,而与NS-SPIK的结合活性刚好处于阴性对照的背景水平(图7,阴性对照)。相反,阳性对照,单克隆抗SPIK抗体MA86,可以与AS-SPIK和NS-SPIK的共同区域结合,显示出与两种SPIK的高结合活性(图7,阳性对照)。
免疫印迹法进一步证明了IM-CA系列单克隆抗体仅识别AS-SPIK的能力。这里和后面提供的数据来自IM-CA22。简言之,在5-15%梯度的SDS-PAGE凝胶(英杰公司,卡尔斯巴德,加利福尼亚州)上运行来自分泌AS-SPIK的S2-3细胞和分泌NS-SPIK的胰腺细胞的15μl/孔的培养基。然后将蛋白质转移到PVDF膜上。然后用单克隆抗SPIK抗体IM-CA22或MA86孵育复制膜。在37℃下孵育1小时后,用抗小鼠-HRP二抗对膜染色。使用ECLAdvance试剂盒可视化图像。图8示出了IM-CA22与S2-3细胞分泌的AS-SPIK结合,但不与胰腺细胞分泌的NS-SPIK结合(图8,IM-CA22)。相反,识别AS-SPIK和NA-SPIK共同区域的抗体MA86与AS-SPIK和NS-SPIK均结合(图8,M86)。这些数据表明,单克隆抗体IM-CA22特异性结合AS-SPIK但不结合NS-SPIK。
实例5:抗AS-SPIK抗体的序列及其同源性
测定了对AS-SPIK具有特异性的单克隆抗体的轻链(VL)和重链(VH)可变区序列,如IM-CA系列抗体(SEQ ID 7-14),以及与AS-SPIK和NS-SPIK共同区域结合的其他抗体,如IM-BA1、IM-S14。此外,还测定了抗体序列,其与AS-SPIK的结合亲和力较弱,但与NS-SPIK的结合亲和力不弱,如CB77。同时对上述抗体的所有CDR进行测序。使用北卡罗来纳州立大学开发的软件程序“BioEdif”比较所有上述抗体的序列。如果序列至少50%同源,则认为它们具有显著的相似性。由于IM-CA46、IM-CA29、IM-CA34和IM-CA71具有相同的序列(许多可以来自相同的亲本克隆),我们仅选择使用IM-CA46进行进一步研究。
可变区的CDR大多数确定了抗体的特异性,并且因此,研究了工作抗体的CDR的同源性。结果表明,那些仅结合AS-SPIK的抗体,在VH或VL中至少有一个CDR具有显著的相似性。由于我们的数据主要由CA22生成,我们使用CA22作为比较的参考。结果表明,CA18与CA22的具有57%的CDRL2同源性,69%的VL框架同源性;CA46具有两个CDR(CDRH1和CDRH2),与CA22的同源性分别为60%和50%,VH框架同源性为68%。CB77也与AS-SPIK结合,但比CA22弱得多,具有两个CDR(CDRH1和CDRH2),与CA22的同源性为50%和44%,VH框架同源性为65%(参见图17,表1)。不结合AS-SPIK的抗体在CDR或可变区均与CA22无显著相似性,无论其是否与SPIK的共同区域结合,如BA1和S14,或与SPIK完全无关,如抗VD受体(表1)。BA1、S14与AS-SPIK和NS-SPIK的共同区域结合。抗VD受体抗体不与AS-SPIK或NS-SPIK结合,并用作阴性对照。
实例6:抗AS-SPIK抗体的同源性与结合活性的关系
由于可变区的CDR决定了抗体的特异性,因此研究了工作抗体的CDR与AS-SPIK结合活性之间的关系。我们发现CA18,其与CDRL2具有57%的同源性且与CA22的VL框架具有69%的同源性,与LS-SPIK的结合亲和力几乎相同;CA46,其具有两个CDR(CDRH1和CDRH2),与CA22具有显著的相似性(同源性分别为60%和50%)且与CA22的VH框架具有68%的同源性,与AS-SPIK具有显著的结合亲和力(CA22的70%)。如果CDR和可变链的同源性较低,则结合AS-SPIK的亲和力变弱。与CA18和CA46相比,CB77对AS-SPIK仅有CA22的20%的亲和力。更重要的是,在CDR或可变区与CA22均无任何显著相似性的抗体根本不与AS-SPIK结合,无论其是否与SPIK的共同区域(如BA1和S14)结合,或是否与SPIK(如抗VD受体)完全无关(表1)。这些结果表明,CDR的同源性,可能是抗体的可变区,与抗体与AS-SPIK的结合活性高度相关。
实例7:AS-SPIK的免疫沉淀
免疫沉淀测定表明,IM-CA22以及其他抗AS-SPIK抗体可以与AS-SPIK特异性形成免疫复合物。IM-CA22共价连接到琼脂糖珠上,并然后将该珠与来自S2-3细胞的培养基的AS-SPIK共同孵育。洗涤除去非特异性蛋白质后,再离心收集琼脂糖珠。通过pH 2.5缓冲液处理从该珠中释放与该珠结合的蛋白质,并在SDS PAGE中分离。将沉淀的蛋白质转移到PVDF膜上,并用抗SPIK结合物对膜进行染色。如图8所示,在同时存在抗AS-SPIK抗体IM-CA22和AS-SPIK的情况下,AS-SPIK发生沉淀(参见图9,3和4,二份)。在省略了AS-SPIK或IM-CA22的对照样品中,未检测到AS-SPIK(参见图9,1和2)。这些数据表明IM-CA22可以与AS-SPIK形成复合物,其可以从溶液中沉淀出来。
实例8:检测AS-SPIK复合物的免疫测定法
我们建立了特异性检测AS-SPIK的ELISA测定方法。用100μl/孔(1μl/ml)多克隆抗SPIK抗体包被96孔板。用1%牛血清白蛋白(BSA)阻断非特异性结合。然后将该板与100μl/孔的S2-3细胞或胰腺细胞的培养基在37℃下反应2小时,以确保捕获AS-SPIK或NS-SPIK。洗涤后,将板与HRP标记的单克隆抗AS-SPIK抗体IM-CA22在37℃下孵育1小时,以使抗体-抗原复合物(AS-SPIK复合物)形成。清洗以去除未结合的IM-CA22后,加入底物TMB和光密度(OD
实例9:AS-SPIK复合物的定量检测
使用实例8中所述的免疫测定法定量测定AS-SPIK复合物的浓度。简言之,用多克隆抗SPIK抗体包被96孔板。用1%的BSA阻断非特异性结合。在PMV启动子对照下由编码整个SPIK基因的载体产生并通过亲和柱纯化的一系列重组AS-SPIK多肽以1ng/ml至100ng/m的浓度加入到板中。通过加入HRP标记的IM-CA22抗体形成AS-SPIK复合物,并通过加入底物TMB显色。用酶标仪测定光密度。如图11所示,形成的AS-SPIK复合物的浓度与AS-SPIK的浓度成正比。在高达60ng/ml的AS-SPIK浓度下,这一线性关系得以维持。图的线性部分中最佳拟合线的R值为0.94,表明AS-SPIK和AS-SPIK复合物形成之间存在相关性。
实例10:AS-SPIK复合物定量检测的灵敏度和特异性
我们开发了一种检测AS-SPIK复合物的测定。该测定包括:1)用HPR标记的IM-CA22抗体(本发明的任何AS-SPIK抗体均可以用于代替IM-CA22或作为IM-CA22的补充;该测定可以包括本发明的AS-SPIK抗体混合物);2)用多克隆或单克隆抗SPIK抗体固定的96孔板,作为与IM-CA22配对的一部分(结合到不同区域,且不干扰IM-CA22结合);3)由6种不同浓度的纯化重组AS-SPIK组成的标准参考集;和4)100μl的S2-3细胞培养基作为阳性对照,和100μl的胰腺细胞培养基作为阴性对照。为了确定测定的敏感性,纯化的重组AS-SPIK与含有固定的多克隆抗SPIK抗体的板以一系列浓度孵育,范围从1ng/ml到100ng/ml,然后与IM-CA22结合物反应形成AS-SPIK复合物。加入TMB后,测定光密度。结果表明,使用该测定估计的AS-SPIK复合物的最小可检测浓度为1.0ng/ml。通过回归分析生成线性曲线(图12)。该检测的线性范围约为1ng/mL至50ng/mL,这通过6次独立检测证实并在图12中示出。使用IBM软件SPSS 22(IBM,阿蒙克,纽约州)分析可靠性,检验Cronbach的α值为0.998,表明一致性极佳。标准参考曲线的方程式为:AS-SPIK复合物(ng/ml)=31.5X OD450nm-6.80,R=0.95。
实例11:抗AS-SPIK抗体对SPIK活性的影响
我们使用胰蛋白酶底物BML(Boc-Gln-Ala-Arg-AMC,恩佐生命科学(EnzoLifeSciences),法明代尔,纽约州)测定了本发明的AS-SPIK抗体对SPIK活性的影响。合成底物的胰蛋白酶消化产生荧光染料(AMC),其可以通过荧光光谱仪检测。荧光强度与胰蛋白酶活性水平直接相关,并且可以进行定量测定。在BML的胰蛋白酶消化中加入AS-SPIK可以阻断胰蛋白酶活性,并降低产生的荧光。如图13所示,向2ng/mL胰蛋白酶(西格玛(Sigma),圣路易斯,密苏里州)中加入从S2-3细胞的培养基中纯化的3nM的AS-SPIK,60分钟后抑制1μM的BML胰蛋白酶消化的70%(图13单独胰蛋白酶和AS-SPIK)。为了评估抗AS-SPIK抗体恢复胰蛋白酶活性的能力,3nM的AS-SPIK首先与1μg/ml的IM-CA22孵育20分钟,然后与2ng/ml的人类胰蛋白酶在室温下孵育30分钟。然后加入1μM的BML,0、20、40、60、80和100分钟后通过荧光光谱仪测定荧光,其中激发波长为380nm,发射波长为440nm。当胰蛋白酶消化达到最大值时,使用以下公式计算60分钟时AS-SPIK活性的抑制:AS-SPIK活性抑制%=(ΔD-ΔS)/(ΔG-ΔS)X100。这里ΔG代表在0分钟和60分钟时单独胰蛋白酶治疗之间的吸光度差异;ΔS代表在0分钟和60分钟时加入AS-SPIK之间的吸光度差异;ΔD代表在0分钟和60分钟时首先用抗AS-SPIK孵育然后用胰蛋白酶孵育的AS-SPIK之间的吸光度差异。图13示出了IM-CA22能够恢复60%以上的胰蛋白酶活性。这一结果表明抗AS-SPIK抗体可以抑制AS-SPIK活性。
实例12:HCC患者中的AS-SPIK分析
使用实例9中所述的测定系统,对来自HCC患者的共计58份血清标本和来自健康个体、乙型肝炎/丙型肝炎患者、肝硬化患者和胰腺炎患者的共计88份血清标本进行检测,用稀释缓冲液将20μl的每份血清标本稀释至100μl并用于分析。每份样品重复检测三次。计算每个样品的OD450nm值的平均值和标准差(SD),通过与由标准参考集生成的标准曲线比较,确定AS-SPIK复合物的水平。使用IBM软件SPSS22进行统计分析。为了确定HCC患者的AS-SPIK水平与对照受试者相比是否存在显著差异,使用单因素ANOVA,并进行多重成对比较。HCC患者的血清中的AS-SPIK的平均浓度为43ng/ml,而对照组仅为2-11ng/ml。更具体地,HCC患者中的AS-SPIK平均水平(43ng/ml)显著高于(P<0.001)肝炎、肝硬化、胰腺炎患者和健康受试者中的AS-SPIK平均水平(分别为11ng/ml、10ng/ml、2.3ng/ml和3.2ng/ml)。使用22ng/ml的临界值,HCC测定的灵敏度和特异性分别为79%和94%(图15)。患者年龄、性别和诸如ALT的肝功能的亚组间AS-SPIK水平差异无统计学意义(所有P>0.05)。这些结果表明,AS-SPIK是诊断HCC的一个有用的生物标志物。胰腺炎患者的血清中NS-SPIK的存在并没有破坏AS-SPIK检测。胰腺炎患者和健康受试者的血清中的AS-SPIK复合物水平无显著差异(P>0.05)(图14,胰腺炎和健康)这一观察结果支持了上述观点,尽管在胰腺炎患者中观察到高水平的NS-SPIK(平均值为37ng/ml,95%CI:28.8至44.2,t检验),但在健康受试者中并未观察到。
实例13:极早期HCC患者中的AS-SPIK分析
我们分析了我们的系统是否可以在其最早期阶段(BCLC 0期;大小<2cm)检测到肝细胞癌。来自极早期HCC患者的15份血清标本使用实例9中所述的方法,并与对照组进行比较。使用与实例9中所述的相同的ANOVA方法分析结果。如图16所示,极早期HCC患者的血清中的AS-SPIK水平的平均值为36ng/ml(95%CI:23.49至48.37)。这一水平显著高于对照组水平(P<0.001)。这些结果表明,AS-SPIK是诊断极早期HCC的有用生物标志物。
实例14:ICC患者中的AS-SPIK分析
由于HCC和ICC均为肝癌类型,并且在HCC和ICC中均证实了SPIK mRNA的过表达(Lee等人,The America Journal of Gastroenterology 2008;103(7):1716-1720),我们开始研究我们的系统是否可以检测ICC患者的血清中AS-SPIK的增加。表2显示,定量分析表明所有5名不同阶段的ICC患者的血液中的AS-SPIK水平均有明显升高。如果使用22ng/ml作为HCC检测中的临界值(实例9),则所有5名患者均有阳性结果。受试患者的AS-SPIK平均值为64ng/ml(95%CI,24.8至104.1),与所有对照组有显著差异:乙肝/丙肝为11ng/ml(95%CI:2.14至19.98)(p<0.001),肝硬化为10ng/ml(95%CI:4.15至16.19)(p<0.001),健康受试者为3.2ng/ml(95%CI:1.22至5.23)(p<0.001)。
