组织识别装置、组织识别系统和方法、检查方法、内窥镜系统、组织识别程序及记录介质
文献发布时间:2023-06-19 09:54:18
技术领域
本发明涉及识别生物体组织的装置、组织识别系统、生物体组织识别方法、以及内窥镜系统。
背景技术
已知存在一种通过吸光度的分析来判定生物体组织的种类或状态、特别是癌等的肿瘤的有无的技术。例如,在专利文献1~3中记载了如下技术:利用FTIR(FourierTransform Infrared Spectroscopy:傅里叶变换红外光谱)法对包括近红外光的较广的红外区域的吸收光谱进行测量,并且根据该吸收光谱判断癌组织的有无。
通过使用这样的光学上的手段,能够以非侵入的方式进行生物体组织的识别。此外,通过利用规定的算法分析获得的吸收光谱,能够获得不依赖于检查者的主观的客观的识别结果。
现有技术文献
专利文献
专利文献1:国际公开WO2011/151825号公报
专利文献2:国际公开WO97/18566号公报
专利文献3:国际公开WO2013/139348号公报
发明内容
发明要解决的问题
然而,在利用FTIR法的专利文献1~3中记载的技术中,由于取得较广的波长范围的吸收光谱,并对得到的光谱的整体形状进行分析,因此识别所需的处理量增多。因此,存在生物体组织的识别所需的时间变长的问题。
本发明的一个方式的目的在于,实现以较少的处理量得到生物体组织的识别结果的生物体组织识别装置等。
解决问题的方案
为了解决上述课题,本发明的一个实施方式的组织识别装置构成为,具有:计算部和识别信息生成部,在所述计算部中,将第1检查光透过生物体组织后得到的光或者反射到所述生物体组织后得到的光所表示的透射率、反射率或者吸光度作为第1测量值,将第2检查光透过所述生物体组织后得到的光或者反射到所述生物体组织后得到的光所表示的透射率、反射率或者吸光度作为第2测量值,所述第1检查光和所述第2检查光在2μm以上且20μm以下范围内具有彼此不同的峰值波长,并且,所述计算部取得所述第1测量值和所述第2测量值,计算所述第1测量值与所述第2测量值的比值或者所述比值的倒数,所述识别信息生成部通过判定由所述计算部计算出的比值或该比值的倒数属于预先设定的多个数值范围中的哪一个数值范围,从而生成表示所述生物体组织的种类或者状态的识别信息。
本发明的一个实施方式的组织识别方法是如下方法:其包括:照射步骤,在该照射步骤中,向生物体组织照射在2μm以上且20μm以下范围内具有彼此不同的峰值波长的第1检查光和第2检查光;取得步骤,在该取得步骤中,取得第1测量值和第2测量值,该第1测量值表示第1检查光透过生物体组织后得到的光或者反射到所述生物体组织后得到的光所表示的透射率、反射率或者吸光度,该第2测量值表示第2检查光透过所述生物体组织后得到的光或者反射到所述生物体组织后得到的光所表示的透射率、反射率或者吸光度;计算步骤,在该计算步骤中,计算所述第1测量值与所述第2测量值的比值或者所述比值的倒数;以及输出步骤,在该输出步骤中,通过判定所述比值或所述比值的倒数属于预先设定的多个数值范围中的哪一个数值范围,从而生成表示所述生物体组织的种类或者状态的识别信息,并且将该识别信息输出到输出装置。
本发明的一个实施方式的内窥镜系统构成为,具有:第1光源,其射出在2μm以上且20μm以下的范围内具有峰值波长的检查光;第2光源,其射出可视光;第1光纤,其对从所述第1光源射出的所述检查光进行引导;第2光纤,其对从所述第2光源射出的所述可视光进行引导;第1光接收部,其接收透过生物体组织的所述检查光或者反射到所述生物体组织的所述检查光;以及第2光接收部,其接收透过所述生物体组织的所述可视光或者反射到所述生物体组织的所述可视光,其中,所述第1光纤和所述第2光纤是同轴配置的。
本发明的一个实施方式的检查方法是如下方法:包括:照射步骤,在该照射步骤中,向生物体组织照射在2μm以上且20μm以下的范围内具有彼此不同的峰值波长的检查光,以及光接收步骤,在该光接收步骤中,通过光检测器接收透过所述生物体组织的所述检查光或者反射到所述生物体组织的所述检查光,其中,所述检查光包括主脉冲和子脉冲,在所述光接收步骤中,对所述光检测器可接收光的时间进行限制,以使由所述子脉冲产生的光的至少一部分不被接收。
发明效果
根据本发明的一个方式,能够以较少的处理量得到生物体组织的识别结果。
附图说明
图1是示出通过对肺组织照射中红外光而得到的吸收光谱的一例的图。
图2是示出实施方式1的生物体组织识别系统的结构的图。
图3是示意性地示出光学参量振荡器的结构的图。
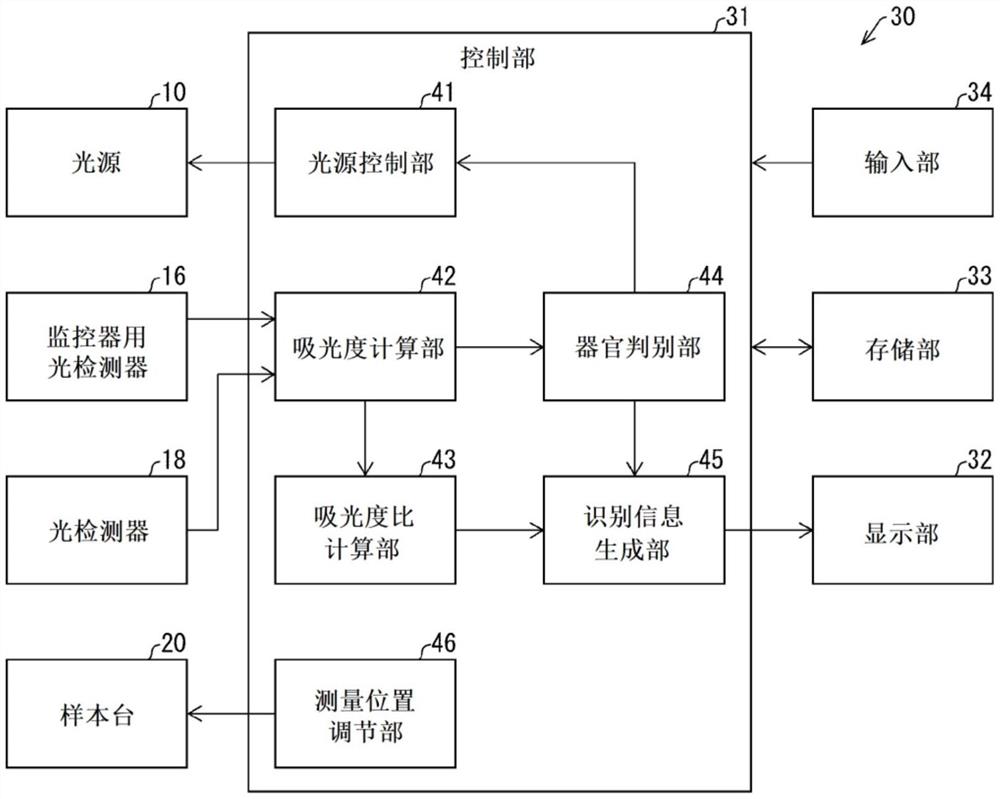
图4是示出控制部的结构的功能框图。
图5是示出生物体组织识别系统中的处理的流程的一例的流程图。
图6是示出乳腺组织中的吸收光谱的图。
图7是示出用于判定生物体组织源自哪个器官的模板的一例的图。
图8的(a)是示出样品的图像的一例的图,图8的(b)是示出在显示部显示识别信息的情况下的图像的一例的图。
图9是示出肝脏组织中的正常组织和癌组织(组织球肉瘤)的吸收光谱的图。
图10是示出肝脏的癌组织(肝细胞癌)和淋巴细胞的吸收光谱的图。
图11是示出肌肉的正常组织、骨骼的正常组织以及癌组织(骨肉瘤)的吸收光谱的图。
图12是示出小脑中的正常组织和癌组织(髓母细胞瘤)的吸收光谱的图。
图13是示出肝脏中的正常组织和癌组织(恶性淋巴瘤)的吸收光谱的图。
图14是示出肌肉的正常组织和癌组织(横纹肌肉瘤)的吸收光谱的图。
图15是示出脾脏中的正常组织和癌组织(组织球肉瘤)的吸收光谱的图。
图16是示出实施方式2的生物体组织识别系统的结构的图。
图17的(a)是示出内窥镜系统的结构的剖视图,图17的(b)是示出管的侧面的图。
图18的(a)是示出作为生物体组织的识别信息显示在显示部中的图像的图,图18的(b)是示出作为识别对象的肝脏组织的图像的图,图18的(c)是在所述肝脏组织的图像上重叠了作为识别信息的图像的图,图18的(d)是对图18的(c)中的框线部对应的肝脏组织的图像的一部分进行放大后的图。
图19是示出振荡出激光时的脉冲的波形的图。
图20是示出实施方式4的生物体组织识别系统具有的控制部的结构的功能框图。
图21是示出肝脏组织中的正常肝和恶性淋巴瘤浸润部的吸收光谱的图,图21的(a)示出使用实施方式1的生物体组织识别系统时的所述吸收光谱,图21的(b)示出使用实施方式4的生物体组织识别系统时的所述吸收光谱。
图22是示出多种正常组织和癌组织的吸收光谱的图。
图23是示出肝脏组织中的正常组织、癌组织以及淋巴细胞的吸收光谱的图。
图24是示出肺组织中的正常组织、原发性肺癌组织以及肝癌的肺转移灶的吸收光谱的图。
图25是示出心脏组织中的正常组织和心肌梗塞病灶的吸收光谱的图。
图26是示出肝脏组织中的正常组织和脂肪肝的组织的吸收光谱的图。
图27是示出肝脏组织中的正常组织和肝硬化的组织的吸收光谱的图。
图28是示出小脑组织中的正常组织、放射性诱发癌组织、以及自然发生的癌组织的吸收光谱的图。
图29是示出肾脏组织中的正常肾小管和淀粉样蛋白沉积的肾小球的吸收光谱的图。
具体实施方式
[实施方式1]
以下,对本发明的一个实施方式进行详细说明。首先,对本发明的技术思想进行说明。本发明的发明人们分析了对生物体组织照射各种波长的光而得到的吸收光谱。其结果是,本发明的发明人们发现,通过将在2μm以上且20μm以下的范围内具有彼此不同的峰值波长的至少2个波长的中红外光照射到生物体组织并计算作为结果获得的吸光度的比,可以识别该生物体组织。
图1是示出通过对肺组织照射中红外光而得到的吸收光谱的一例的图。图1所示的多个吸收光谱中,标号81表示的吸收光谱是正常组织的吸收光谱,标号82表示的吸收光谱是癌组织的吸收光谱。另外,吸收光谱是对各组织进行多次测量得到的。另外,对于以下所示的吸收光谱而言,也同样是对各组织进行多次测量得到的。对这样的2种吸收光谱进行分析后,其结果是,本发明人发现了以下见解。
·存在吸光度根据生物体组织的种类或者状态难以发生变化的波长(称为基准波长)的范围。该基准波长的范围是相当于吸收光谱的峰值的狭窄范围。在图1所示的例子中,通过将“相当于峰值”的波长用作基准波长,能够正确地进行评价。另一方面,例如在图12(小脑组织)所示的例子中,由于“相当于峰值”的波长的吸光度在正常组织和癌组织中有很大不同,因此难以进行正确的评价。在这种情况下,通过将各组织的基准波长下的吸光度的平均值用作基准波长的吸光度,能够进行正确的评价。但是,被设定成基准波长的波长可以是与吸收光谱的波谷对应的波长,也可以是与吸收光谱的平坦部分对应的波长,只要是吸光度难以根据生物体组织的种类或者状态发生变化的波长即可。
·存在吸光度根据生物体组织的种类或者状态容易发生变化的波长(称为判别波长)的范围。判别波长的范围在图1所示的例子中为箭头83A所示的范围(8.06μm~8.70μm)和箭头83B所示的范围(8.75μm~10.05μm)。
·将基准波长的光(称为基准检查光(第2检查光))照射到生物体组织,并且将透过生物体组织的基准检查光或者反射到生物体组织的基准检查光所表示的吸光度作为基准吸光度(第2测量值)。将判别波长的光(称为判别检查光(第1检查光))照射到生物体组织,并且将透过生物体组织的判别检查光或反射到生物体组织的判别检查光所表示的吸光度作为判别吸光度(第1测量值)。此时,判别吸光度与基准吸光度的比值(判别吸光度/基准吸光度)或该比值的倒数(基准吸光度/判别吸光度)根据生物体组织的种类或者状态的不同而不同。
·从其他观点说明的话,通过将判别检查光照射在生物体组织上而得到的判别吸光度根据作为照射对象的生物体组织的种类或者状态发生变化的程度比通过将基准检查光照射在所述生物体组织上而得到的基准吸光度根据所述生物体组织的种类或者状态发生变化的程度大。
·如果按照生物体组织的每个种类或者每个状态预先设定判别吸光度与基准吸光度之间的比值(称为吸光度比)(或该比值的倒数)可取的值的范围,则通过判定吸光度比(或该比值的倒数)的实测值包含在预先设定的多个数值范围中的哪一个数值范围内,能够识别作为检查对象的生物体组织的种类或者状态。
不使用判别吸光度的绝对值,而使用吸光度比是为了提高识别精度。在对生物体组织照射激光来测量吸光度的情况下,吸光度的实测值也会根据光的入射角等、光的照射条件、样品S的厚度等发生变动。因此,为了恰当地识别判别波长区域的吸光光谱的不同,优选的是,不使用判别吸光度的绝对值,而使用与在同一照射条件下测量出的基准吸光度的比。
另外,在下文中,对不使用判别吸光度与基准吸光度的比值的倒数,而使用该比值本身的情况的实施方式进行说明。在使用比值的倒数(基准吸光度/判别吸光度)的情况下,按照与该倒数的可取值的范围对应的方式设定上述多个数值范围即可。
图1中示出了基准波长A(8.74μm)、基准波长B(9.73μm)、判别波长A(8.28μm)以及判别波长B(9.26μm)。为了进行生物体组织的识别,只要使用至少1个基准波长的吸光度(基准吸光度)和与该基准波长相邻的波长范围内包括的至少1个判别波长的吸光度(判别吸光度)即可。
例如,分别对正常组织的吸收光谱和癌组织的吸收光谱计算判别波长A的吸光度与基准波长A的吸光度之间的比值(吸光度比)。在图1所示的例子中,关于正常组织的吸光度比大于关于癌组织的吸光度比。因此,如果预先调查并设定这些吸光度比可取的值的范围,则通过对由实测得到的吸光度比是包含在正常组织可取的数值范围内,还是包含在癌组织可取的数值范围内进行判定,能够判定作为检查对象的生物体组织中是否包含癌组织。另外,还存在正常组织的吸光度比小于癌组织的吸光度比的例子。
在图1所示例子中,对于使用基准波长A和判别波长A的情况和使用基准波长A和判别波长B的情况,可以将正常组织可取的数值范围与癌组织可取的数值范围之间的边界的值(阈值)规定为0.986。在这种情况下,当吸光度比小于0.986时,可以判定该生物体组织为癌组织。
在现有的技术中,通过将生物体组织的吸收光谱的波形与在数据库中登记的波形进行比较,从而判断该生物体组织中是否含有癌组织。与此相对,在本发明中,照射在2μm以上且20μm以下的范围内具有峰值波长的至少2个波长的中红外光,并且基于根据该结果得到的吸光度的比进行生物体组织的识别。因此,不需要在较广的波长范围内取得吸收光谱就能够缩短吸光度的测量时间。另外,由于能够根据吸光度比来识别生物体组织,因此识别所需的信息处理量较少即可,能够缩短运算时间。另外,由于根据吸光度比来识别生物体组织,因此能够不依赖于检查者的主观地进行客观的识别。预先设定的吸光度比的可取值的范围可以是2个,也可以是3个以上。例如,也可以是,根据癌的恶性程度设定3级以上的数值范围。
上述见解也适用于如下关系:(1)透过生物体组织的基准检查光的透射率与透过生物体组织的判别检查光的透射率之间的关系、以及(2)反射到生物体组织的基准检查光的反射率与反射到生物体组织的判别检查光的反射率之间的关系。这是因为,吸光度与透射率和反射率是可以相互换算的。在本实施方式中,仅提及使用吸光度的例子。
(生物体组织识别系统1的结构)
图2是示出本实施方式的生物体组织识别系统1的结构的图。生物体组织识别系统1是如下系统:将中红外光照射到被放置在样本台20上的样本S,测量透过样本S的光的吸光度,从而识别包含在样本S中的生物体组织。样本S中包含的生物体组织可以是从人身上采集的组织,也可以是从小鼠、大鼠等人以外的动物身上采集的组织。
在生物体组织识别系统1中使用的光源10是选择性地(以切换波长的方式)振荡出波长在2μm~20μm范围内的中红外光中的特定峰值波长的中红外光的激光光源。为了提高吸光度测量的精度和效率,优选的是使用振荡出高亮度的中红外激光的量子级联激光器或者具备OPO(光学参量振荡器)的光源作为光源10。
由于使用激光作为检查光,因此能够使用亮度较高的光束。由此,不需要进行信号的平均化等,能够得到较高的S/N比,能够在短时间内进行测量。另外,由于激光光源能够以窄线宽进行波长扫描,因此也能够实现较高的波长分辨率。并且,由于激光是相干光,能够将激光聚光到衍射极限,因此具有还能够得到较高的空间分辨率的优点。另外,在使用OPO或量子级联激光器的情况下,由于能够使光源10小型化,因此能够使装置整体小型化。
光源10通过利用OPO12将从激励光源11振荡出的脉冲状的、与中红外光相比短波长的激励光101转换为长波长,同时进行放大,从而产生激光100。关于光学参量振荡,例如在日本特开2010-281891号公报中有记载。
作为激励光源11,特别优选的是,使用能够振荡出脉冲状且与中红外光相比短波长的激励光101的Q开关Nd:YAG激光器(振荡波长1.064μm)、Q开关Yb:YAG激光器(振荡波长1.30μm)。这些激励光源能够使用过饱和吸收体自动地进行开关动作。因此,通过使用Q开关Nd:YAG激光器或Q开关Yb:YAG激光器作为激励光源11,可以实现激励光源11和用于控制激励光源11的结构的简化和小型化。在Q开关振荡中,例如能够以脉冲宽度约8ns且10Hz以上的重复来振荡出激励光101。
图3是示意性地示出OPO12的结构的图。在OPO12中,非线性光学晶体123被设置在入射侧半透镜121与出射侧半透镜122之间。透过了入射侧半透镜121的激励光101入射到非线性光学晶体123并且被转换为相比激励光101长波长的光,并且当光在入射侧半透镜121与出射侧半透镜122之间被反射而被封闭时光参量增大。增大后的光透过出射侧半透镜122成为激光100被输出。另外,在图2中,为了方便说明,示出了从OPO12振荡的激光100的方向与激励光101的方向不同,但该方向可以通过使用反射镜来适当调整。
作为非线性光学晶体123,在相位匹配的条件下使用适合于这样的波长转换的AgGaS
振荡出的激光100被分束器15分成两束,其中一束朝向被固定在样本台20上的样本S侧。另一束被用作监控器,并且由监控器用光检测器16进行检测。因此,即使在激光100本身的强度有变动的情况下,也能够根据监控用光检测器16的输出识别该变动。
朝向样本S的激光100通过聚光透镜17被调整,使得在样本S上的光束点的尺寸变小,并且能够照射样本S中的特定的部位。样本S上的光束点的尺寸例如优选的是缩小到直径10μm左右。如果是该大小的光束点,则能够以细胞单位照射激光。
样本台20具有能够供透过样本S的激光100即透射光100A透过的开口部。通过该开口部的透射光100A由光检测器18进行检测。另外,样本台20能够相对于激光100的光轴二维地移动,由此对样本S中的激光100的照射部位进行调整。
另外,从样本S观察时,用于拍摄样本S中的包括激光100的照射部位的区域的摄像部21被设置在光源10侧。另外,聚光透镜17只要能够减小激光100的光束点的尺寸即可,也可以使用针孔等来代替聚光透镜17。
计算机30用于控制整个生物体组织识别系统1。该计算机30具有控制部(组织识别装置)31(CPU)、显示部32以及存储部33。显示部32是显示各种信息和测量结果的显示器。存储部33是由存储各种数据的硬盘或半导体存储器构成的。另外,计算机30还具有受理用户的操作的触摸面板、键盘和/或鼠标等的输入部34。
图4是示出控制部31的结构的功能框图。如图4所示,控制部31具有:控制光源10的光源控制部41、计算判别吸光度和基准吸光度的吸光度计算部42、计算判别吸光度与基准吸光度之间的比的吸光度比计算部43。并且,控制部31具有器官判别部44、识别信息生成部45以及测量位置调节部46。
器官辨别部44将透过样本S的生物体组织的光所表示的吸收光谱与预先存储在存储部33中的、源自多种器官(脏器)的组织的吸收光谱进行比较,由此来判定样本S的生物体组织源自哪个器官(器官判定)。
识别信息生成部45通过判定吸光度比属于预先确定的多个数值范围中的哪一个数值范围,来识别作为检查对象的生物体组织的种类或者状态。识别信息生成部45生成表示该生物体组织的种类或者状态的识别信息,并将该识别信息输出到输出装置。所述输出装置例如是显示部32,但只要是用户能够确认识别结果的装置即可,也可以是扬声器或打印机等任意的装置。
识别信息生成部45识别的生物体组织的种类例如可以是指该生物体组织是正常组织、良性肿瘤、还是癌组织,也可以是指该生物体组织的癌化过程中的组织的形态(致癌过程中的阶段)。另外,所述生物体组织的种类不限于癌,也可以是发生异常的组织的形态(状态)。即,在本说明书中,判定识别对象的生物体组织中是否包含癌组织,可以作为判定该生物体组织是否发生异常的下位概念来理解。因此,可以说,识别信息生成部45通过判定所述吸光度比属于所述多个数值范围中的哪一个数值范围,来生成表示所述生物体组织是否发生异常的识别信息。
在识别对象的生物体组织是肿瘤的情况下,识别信息生成部45也可以识别该肿瘤的组织类型。另外,在识别对象的生物体组织是癌组织的情况下,识别信息生成部45也可以识别该癌组织是转移性的癌组织还是原发性的癌组织。另外,识别信息生成部45也可以对识别对象的生物体组织是源自哪个器官(脏器)的组织进行识别。进行这些识别包括在识别生物体组织的“种类”中。另外,所述生物体组织的状态例如是指在该生物体组织是癌组织的情况下,癌的恶性度。
这样,在本发明中,只要预先使生物体组织的种类或者状态与关于该生物体组织的吸光度比可取的值的范围相对应,就可以对任何种类或者状态进行识别。
测量位置调节部46对样本台20相对于激光100光轴的相对位置进行调节。通过该调节,能够调节样本S中的照射激光100的位置(即,测量位置)。
作为光检测器18和监控器用光检测器16,例如使用用液氮冷却的HgCdTe红外线检测器。HgCdTe红外线检测器能够接收上述波长范围的激光100或透射光100A,并将其强度作为电信号输出。此时,从激励光源11使激励光101以脉冲状振荡,并且提取与该脉冲同步的光检测器18和监控器用光检测器16的输出,由此能够以较高的S/N比对激光100进行检测。
另外,通过预先识别光透射率为100%时(没有样本S时)的监控器用光检测器16的检测强度与光检测器18的检测强度之间的关系,即使激光100的强度随时间发生变动,也能够根据监控器用光检测器16的检测强度和光检测器18的检测强度,适当地计算样本S的光透射率。另外,在激光100的时间变动较小,实际上能够只根据光检测器18的检测强度计算吸光度的情况下,不需要监控器用光检测器16。
另外,如上所述那样的生物体组织识别系统1可以作为显微镜系统实现。在这种情况下,可以将显微镜的载物台用作样本台20。在目视观察样本S情况下,可以利用显微镜的物镜和目镜。
(生物体组织识别系统1中处理的流程)
图5是示出生物体组织识别系统1中的处理的流程的一例的流程图。这里,对判定样本S的生物体组织中包含正常组织、腺瘤、纤维腺瘤以及癌组织中的哪一个组织的例子进行说明。
在判明了样本S的生物体组织源自哪个器官(脏器)的情况下(在S1中为“是”),控制部31经由输入部34从用户处接收用于确定该器官的器官信息(器官的名称、赋予给器官的编号等)(S2)。所述器官是具有特定的功能的组织的集合,例如肺、胃、肌肉、脑等。各种器官的器官信息与用于识别构成该器官的组织的基准波长和判别波长相对应地存储在存储部33中。
当接收到器官信息时,控制部31的光源控制部41从存储部33取得与该器官信息相对应的基准波长和判别波长(S3)。测量位置调节部46通过调节样本台20的位置,将照射基准波长和判别波长的位置设定为初始位置(S4)。另外,样本台20的位置(样本S中的激光100的照射位置)的调节可以是一边由用户在显示部32上确认由摄像部21拍摄的图像一边进行的。另外,由于不能目视出上述波长范围的激光100,因此优选的是,设置在位置调节时照射可视光的光源。
光源控制部41通过控制光源10来振荡具有与器官信息相对应的基准波长的基准检查光、以及具有与器官信息相对应的判别波长的判别检查光(S5:照射步骤)。在以下的说明中,将基准检查光和判别检查光总称为激光100。振荡出的激光100的一部分是由监控器用光检测器16检测的,剩余部分通过样本S后,由光检测器18进行检测。
吸光度计算部42通过识别来自监控器用光检测器16和光检测器18的输出信号,从而对激光100相对于样本S的吸光度(判别吸光度和基准吸光度)进行计算(S6:取得步骤)。
光源控制部41和吸光度计算部42反复进行S5和S6的动作,直到照射了全部应照射的波长的激光100为止(S7)。当所有激光100的照射和吸光度的测量结束时(在S7中为“是”),吸光度比计算部43计算判别吸光度与基准吸光度的比(S8:计算步骤)。
识别信息生成部45通过判定吸光度比计算部43计算出的吸光度比属于针对作为检查对象的器官预先确定的多个数值范围中的哪一个数值范围,来判定样本S的生物体组织中是否含有肿瘤(S9)。
图6是示出乳腺组织中的吸收光谱的图。图6示出了正常组织、腺瘤、纤维腺瘤以及癌组织的光谱。箭头83所示的区域(9.80μm~10.60μm)除此之外还有8.05μm~8.15μm、8.22μm~8.62μm、8.71μm~8.85μm、以及8.88μm~10.6μm的范围是判别波长可取得波长区域。在该波长区域中,吸光度根据是正常组织、腺瘤、纤维腺瘤还是癌组织而互不相同。因此,在上述器官是乳腺的情况下,例如可以使用9.75μm波长的光作为基准波长,使用10.05μm波长的光作为判别波长。
对于正常组织、腺瘤、纤维腺瘤以及癌组织而言,判别吸光度与基准吸光度之间的比(吸光度比)可取的值的范围是分别预先设定的,并且这4个数值范围被存储在存储部33中。
在由吸光度比计算部43计算出的吸光度比在与腺瘤、纤维腺瘤以及癌组织中的任意一个相对应的数值范围内的情况下,识别信息生成部45判定在该生物体组织中包括肿瘤(在图5的S9中为“是”)。并且,识别信息生成部45通过判定由吸光度比计算部43计算出的吸光度比属于与腺瘤、纤维腺瘤或癌组织相对应的数值范围中的哪一个数值范围,从而判定该肿瘤是恶性的(癌组织)还是良性的(S10)。识别信息生成部45还可以判定该肿瘤是腺瘤还是纤维腺瘤。
另外,识别信息生成部45也可以将S9和S10作为一个步骤进行,在一个阶段内判定该生物体组织是正常组织、腺瘤、纤维腺瘤以及癌组织中的哪一个。另外,也可以是,将正常组织、腺瘤以及纤维腺瘤作为不是癌组织的组织进行处理,识别信息生成部45仅判定在样本S中是否含有癌组织。另外,也可以是,将腺瘤、纤维腺瘤以及癌组织作为肿瘤组织进行处理,识别信息生成部45仅判定在样本S中是否含有肿瘤组织。
在初始设定的测量位置处的吸光度测量和判定结束后,测量位置调节部46使样本台20移动,变更测量位置(S11、S12)。
在所有的测量位置处的吸光度测量和判定结束时(S11中为“是”),识别信息生成部45生成表示该生物体组织的种类的识别信息,并将该识别信息输出到显示部32(S13:输出步骤)。
另一方面,在没有判明出样本S的生物体组织源自哪个器官(脏器)的情况下(S1中为“否”),进行从S21~S27的处理(器官判定步骤)。即,器官判别部44将样本S的生物体组织的吸收光谱与预先存储在存储部33中的多种器官的吸收光谱(模板)进行比较,由此来判定样本S的生物体组织源自于哪个器官。另外,也可以是,将从S21~S27的处理所涉及的发明理解为与从S2~S13的处理所涉及的发明是独立的发明。
图7是示出用于判定生物体组织源自哪个器官的模板的一例的图。在图7中示出了对(1)肺的正常组织、(2)肺的癌组织、(3)骨骼的正常组织、(4)肌肉的正常组织、(5)骨肉瘤的吸光度光谱进行了平滑化后的光谱。这些模板和表示各模板的波长范围的数据被预先存储在存储部33中。
在器官判定步骤中,首先,光源控制部41从存储部33取得与所有的模板对应的波长范围(在图7所示的例子中为8.05μm~10.05μm)进行识别(图5的S21)。之后,与S4相同,进行测量部位的设定(S22)。
光源控制部41控制光源10并将光源10的振荡波长设定为与第1模板对应的波长范围中的1个波长(S23)。
吸光度计算部42通过识别来自监控器用光检测器16和光检测器18的输出信号来计算吸光度(S24)。在S23中设定的波长是与各模板对应的波长范围内的多个波长,对这些多个波长分别进行吸光度的测量(S25)。由此,得到了与模板能够进行比较的吸收光谱。为了这样高效地获得广范围的吸收光谱,优选的是,使用具有能够在中红外区域内调整振荡波长的量子级联激光器或OPO(光学参量振荡器)12的光源作为光源10。
器官判别部44将如上述那样测量得到的吸收光谱与各模板进行比较,确定两者的差异最小的模板(S26)。关于进行实际测量的吸收光谱与模板的匹配的技术,可以使用公知的技术。接着,器官判别部44将表示与特定的模板相对应的器官的器官信息输出到光源控制部41和识别信息生成部45(S26)。之后的处理的流程与上述S5~S13中的处理的流程相同。
器官判别部44不一定需要输出唯一的判定结果,例如也可以输出表示上述差异在规定范围内的多个器官的候补的器官信息。
有时根据测量条件或样本S的条件(厚度等)吸光度的对比度会发生变动。因此,在进行上述匹配的情况下,也可以进行频谱形状的校正。例如,也可以是,校正实际测量的吸收光谱,使得实际测量的吸收光谱的最大值与最小值之间的差等于模板的最大值与最小值之间的差。
通过这样设置器官判别部44,即使对于未知的样本S,也能够进行在该样本S中包含的生物体组织的识别。另外,在第1组织中存在源自第2组织的癌组织的情况下,也能够适当地进行这些组织的识别。
另外,也可以是,器官判别部44将反射到样本S的生物体组织的光所表示的吸收光谱与预先存储在存储部33中的吸收光谱进行比较,从而进行器官判定。
另外,也可以是,器官判别部44代替上述吸收光谱而使用透过样本S的生物体组织的光所表示的透射率的光谱、或反射到样本S的生物体组织的光所表示的反射率的光谱,进行器官判定。在这种情况下,只要在存储单元33中存储具有对应的透射率或反射率的光谱的模板即可。
另外,器官判别部44可以对样本S的一个部位进行器官的判定,也可以对样本S的多个部位进行器官的判定。进一步而言,也可以是,使器官判别部44的判定部位与识别信息生成部45的判定部位一致。
另外,也可以是,器官判别部44通过将实际测量的吸收光谱与预先存储的、关于同一器官中的多种组织的吸收光谱进行比较,从而判别生物体组织的种类或者状态的候选。例如,如图7所示的例子那样,也可以是,器官判别部44暂时判别样本S的生物体组织是肺的正常组织还是肺的癌组织,识别信息生成部45使用吸光度比进行最终的识别。另外,如果是肠管,则器官判别部44也可以判别是上皮组织(粘膜)、结缔组织、肌组织等同一器官中的哪个组织的候选。即,器官判别部44对作为检查对象的生物体组织的种类或者状态的候选进行判别。在这些情况下,器官判别部44在图5的S27中,将表示上述候选的信息输出到光源控制部41和识别信息生成部45。该候选、基准波长、判别波长以及用于识别的所述多个数值范围被预先存储在存储部33中。
另外,在上述流程中,识别信息生成部45从用户或者器官判别部44取得表示样本S的生物体组织源自于哪个器官的器官信息,并且使用与该器官信息表示的器官有关的上述多个数值范围,进行上述判定。但是,也可以是,识别信息生成部45通过判定上述吸光度比属于预先设定的多个数值范围中的哪一个数值范围,来判定样本S的生物体组织源自于哪个器官。在这种情况下,不需要器官判别部44。
(识别信息的显示方法的一例)
图8的(a)是示出样品S的图像的一例的图。图8的(b)是示出在显示部32显示识别信息生成部45生成的识别信息的情况下的图像的一例的图。在图8的(a)所示的生物体组织的图像中拍摄有癌组织90。在图8的(b)所示的例子中,生物体组织识别系统1将该生物体组织分割为一边边长为500μm的分割区域91,并且对每个分割区域91测量其吸光度。在图5的S12中,测量位置调节部46使样本台20的位置移动,以对所有的分割区域91测量吸光度。
分割区域91的大小越小,组织识别的精度越高。因此,分割区域91的一边优选为10μm左右。
(使用多个参考波长和/或判别波长的情况)
在使用多个基准波长或判别波长中的任意一个的情况下,由吸光度计算部42计算出多个吸光度比,由识别信息生成部45判定各吸光度比被包含在规定的数值范围中的哪一个数值范围内。
在图1所示的例子中,在表1中示出了在使用基准波长A(8.74μm)、基准波长B(9.73μm)、判别波长A(8.28μm)以及判别波长B(9.26μm)的组合的情况下所使用的阈值的具体例。该阈值是表示正常组织的吸光度比的范围与癌组织的吸光度比的范围之间的边界的值。
[表1]
例如,在使用基准波长A和判别波长B的情况下,当吸光度比计算部43计算出的吸光度比小于0.9860时,识别信息生成部45判定该生物体组织为癌组织。
在使用各吸光度比的识别结果(例如,是正常组织还是癌组织)互不相同的情况下,如果所有的识别结果不是“正常组织”,则识别信息生成部45可以输出是“癌组织”的识别结果,也可以输出反映了是正常组织的识别结果的数量与是癌组织的识别结果的数量的比例的数值作为识别信息。
或者,识别信息生成部45也可以由识别信息生成部45计算表示使用了各吸光度比的识别结果的准确度的得分。作为该得分,例如可以使用表示实际测量出的吸光度比与数值范围的边界(阈值)偏离多少的数值。识别信息生成部45采用基于上述得分的较大一方的吸光度比的识别结果等被认为可靠性更高的一方的识别结果即可。
(吸收光谱具体例)
图9是示出肝脏组织中的正常组织和癌组织(组织球肉瘤)的吸收光谱的图。在图9所示的例子中,基准波长为9.75μm,判别波长的范围为9.33μm~9.64μm。图10是示出肝脏的癌组织(肝细胞癌)和淋巴细胞的吸收光谱的图。在图10所示例子中,基准波长为9.75μm,判别波长的范围为8.05μm~8.40μm和8.85μm~9.56μm。图11是示出肌肉的正常组织、骨骼的正常组织以及癌组织(骨肉瘤)的吸收光谱的图。在图11所示例子中,基准波长为9.77μm,判别波长的范围为8.05μm~10.5μm。图12是示出小脑中的正常组织和癌组织(髓母细胞瘤)的吸收光谱的图。在图12所示例子中,基准波长为9.71μm,判别波长的范围为8.05μm~10.5μm。图13是示出肝脏中的正常组织和癌组织(恶性淋巴瘤)的吸收光谱的图。在图13所示例子中,基准波长为9.75μm,判别波长的范围为9.07μm~9.77μm和9.82μm~10.8μm。图14是示出肌肉的正常组织和癌组织(横纹肌肉瘤)的吸收光谱的图。在图14所示例子中,基准波长为8.75μm,判别波长的范围为8.20μm~8.66μm和8.91μm~11.0μm。图15是示出脾脏中的正常组织和癌组织(组织球肉瘤)的吸收光谱的图。在图15所示例子中,基准波长为9.76μm,判别波长的范围为8.05μm~8.39μm、8.70μm~9.58μm、以及9.87μm~10.9μm。
由这些结果可知,在任意一个器官(脏器)中,在由箭头83所示的判别波长的范围内,吸收光谱明显地根据生物体组织的种类或者状态而非偶然地不同。只要根据器官的种类或者识别的目的设定基准波长、判别波长以及吸光度比可取的值的范围,就能够识别该生物体组织的种类或者状态。关于基准波长、判别波长以及吸光度比的范围,可以通过按照该生物体组织的种类取得作为识别对象的生物体组织的吸收光谱,并比较所取得的吸收光谱来设定。
[实施方式2]
以下,对本发明的其他实施方式进行说明。另外,为了便于说明,对于具有与上述实施方式中说明的部件相同功能的部件,标注相同的标号,不重复其说明。
图16是示出本实施方式的生物体组织识别系统2的结构的图。在生物体组织识别系统2中,吸光度计算部42计算反射到生物体组织的基准检查光所表示的吸光度、以及反射到生物体组织的判别检查光所表示的吸光度。组织识别的算法与生物体组织识别系统1的算法相同。也可以是,控制部31对反射到生物体组织的判别检查光所表示的反射率与反射到生物体组织的基准检查光所表示的反射率之比进行计算从而代替吸光度比。
在生物体组织识别系统2中,由分束器15分成2束激光束100中的一束被照射到在样本台20上固定的样本S,并且光检测器18检测反射到样本S的激光束100(反射光100B)。即使在使用这样的反射光的情况下,也能够适当地进行生物体组织的识别。
[实施方式3]
以下,对本发明的其他实施方式进行说明。图17的(a)是示出能够应用在生物体组织识别系统1或生物体组织识别系统2中的内窥镜系统的结构的剖视图。如图17的(a)所示,内窥镜系统3是向生物体组织照射基准检查光和判别检查光,并接收其反射光的系统。
内窥镜系统3具有接近生物体L使用的测量头50、光源(第1光源)10以及照明光源(第2光源)70。照明光源70是发出可视光(照明光200)的光源,该可视光是用于通过摄像部21对生物体L中作为测量对象的部位进行光学观察的可视光。
在作为测量头50主体的管60的内部,从其前端侧起配置有光检测器(第1光接收部)18、摄像部(第2光接收部)21、检查光纤(第1光纤)51以及照明光纤(第2光纤)54的前端部。检查光纤51是对从光源10发出的激光100进行引导的光纤。在检查光纤51中传播的激光100经由被配置在管60的侧壁面上的聚光透镜17照射到生物体L。照明光纤54是对从照明光源70射出的照明光200进行引导的光纤。照明光纤54与检查光纤51同轴配置,并且照明光纤54位于检查光纤51的外侧。在照明光纤54中传播的照明光200经由聚光透镜17照射在生物体L上。照明光200不需要是激光,照明光纤54不需要像检查光纤51那样传输特性较高。
摄像部21是由摄像元件211和被配置在管60的侧壁面上的物镜212构成的。摄像元件211经由物镜212接收被照射到生物体L中的测量对象部位的照明光的反射光,由此进行测量对象部位的拍摄。摄像元件211的输出信号被发送到显示部32,用户能够一边观察显示部32的画面一边进行测量头50的定位。
光检测器18接收来自激光100的生物体L的反射光(漫反射光)100B。反射光100B是透过生物体组织并在其中途由生物体组织反射而射出到生物体组织外的光。反射光100B经由被配置在管60的侧壁面上的物镜52和受光光纤53入射到光检测器18。物镜52的倍率与聚光透镜17的倍率不同。光检测器18的输出信号被发送到生物体组织识别系统1或生物体组织识别系统2所具有的控制部31。作为光检测器18,可以使用小型的光检测器,例如热释电型的红外线检测器。
图17的(b)是示出管60的侧面的图。如图17的(b)所示,从管60的前端侧起,与光检测器18对应的物镜52、摄像元件211的物镜212、以及被配置在检查光纤51(以及照明光纤54)的射出侧前端部的聚光透镜17依次设置在相互接近的位置处。通过进行这样的配置,能够对照射激光100的位置进行拍摄,并且能够接收激光100在生物体L中的反射光。
但是,管60的内部的光检测器18、摄像元件211、检查光纤51以及照明光纤54的配置不限于上述配置。例如,也可以使检查光纤51、照明光纤54以及光检测器18的位置关系颠倒。
(内窥镜系统3的效果)
通过使用具有测量头50的内窥镜系统3,能够将激光100照射到生物体L中的期望的部位,并利用其反射光以非侵入的方式进行生物体组织的识别。由于测量头50具有挠性,因此通过使测量头50小型化,能够将测量头50插入到生物体的各种器官的内部,从而能够识别该器官的组织。
另外,由于检查光纤51和照明光纤54同轴配置,因此能够可靠地向检查光照射的部位(即,作为测量对象的部位)照射照明光。因此,用户能够可靠地视觉辨认作为测量对象的部位。
[实施方式4]
以下,对本发明的其他实施方式进行说明。本实施方式的生物体组织识别系统1a具有未图示的物镜(也被称为反射型物镜)来代替生物体组织识别系统1中的聚光透镜17。该物镜在内部具有反射镜,通过由该反射镜反射激光100来进行聚光。通过使用这样物镜,能够缩小激光100的直径。
在生物体组织识别系统1a中,通过上述物镜进行聚光的激光100照射在样本S上(照射步骤),光检测器18接收透过样本S的激光100即透射光100A或反射到样本S上的激光100即反射光100B(光接收步骤)。
所述物镜例如是由金属涂层的反射面构成的Schwarzschild光学系统的物镜。物镜的NA值例如为0.3,焦距例如为13.3mm。
生物体组织识别系统1a通过具有上述物镜,与使用聚光透镜17的情况相比,能够进一步缩小光束点。由此,样本S中的激光100的照射范围变得更小,即分割区域91变小,因此能够增加每单位面积的分割区域91。例如,在使用生物体组织识别系统1情况下,分割区域91的一边为500μm,与之相对,在使用生物体组织识别系统1a的情况下,能够将分割区域91的一边设为约70μm。因此,通过使用生物体组织识别系统1a能够得到更详细(分辨率较高的)识别结果。
使用图18说明得到分辨率较高的识别结果的例子。在图18所示的例子中,使用肝脏组织作为样本S。图18的(a)是示出生物体组织识别系统1输出的识别信息的图,图18的(b)是示出作为识别对象的肝脏组织的图像的图。图18的(c)是在所述肝脏组织的图像上重叠了作为生物体组织识别系统1a的识别信息的图像的图。图18的(d)是对图18的(c)所示的肝脏组织的图像中的框线部的一部分进行放大后的图。
这里,图18的(a)示出了图18的(b)的框线部的识别结果,图18的(c示出了图18的(b)的虚线部的识别结果。另外,图18的(d)中的虚线部是通过病理诊断被认为是癌组织(恶性淋巴瘤浸润部)的部分。另外,图18的(a)和(c)所示的识别结果是使用同一样本得到的,图18的(b)和(d)所示的图像是通过对从上述样本的附近采集的样本进行染色而得到的。
如图18的(a)~(c)所示,在使用生物体组织识别系统1a的情况下,与使用生物体组织识别系统1的情况相比,分割区域91由于尺寸变小而增加,因此可以得到详细的识别结果。并且,当比较图18的(c)和图18的(d)时,由识别信息生成部45判定成是“癌组织”的可能性较高的部位的形状与根据病理组织图像鉴别成是癌组织的部分的形状大致一致。即,生物体组织识别系统1a与生物体组织识别系统1相比,分辨率提高,能够得到精度较高的识别结果。由此,即使癌组织微小,生物体组织识别系统1a也能够准确地识别该癌组织的位置和形状。
如图18的(c)所示,也可以是,识别信息生成部45通过以与各分割区域91中的组织的判定结果对应的颜色显示各分割区域91,将组织的判定结果作为图像输出给显示部32,以使组织的判定结果能够在视觉上识别成该组织的图像。
本实施方式的发明的目的还在于,提高对生物体组织进行照射的光的透射率、反射率或吸光度的测量精度。以下,对这一点进行说明。
图19是示出振荡出激光100时的脉冲的波形的图。生物体组织识别系统1a中的光源10振荡出脉冲状的激光100。发明人们使用光电检测器测量了光源10振荡出激光100时的脉冲的波形。具体而言,使用光电检测器,将光源10发出的激光100转换为电信号,并且利用示波器对该信号进行观测。
如图19所示,由光源10发射的激光100包括主脉冲300和子脉冲301。主脉冲300是激光100的主要的成分。子脉冲301是与主脉冲300相伴的脉冲,是不可避免地产生的脉冲。
在多次进行同样的测量时,可知子脉冲301的强度在每个波长或每个测量中发生变化。另外,在生物体组织识别系统1中计算吸光度时,在包含所有的主脉冲300和子脉冲301的基础上进行了时间积分。据此可以判明,子脉冲301可以作为噪声对吸光度(透射率或反射率)的测量结果产生影响。
因此,为了降低子脉冲301对测量结果的影响,并且改善测量精度,发明人们实现了如下方法:利用光检测器18检测来自主脉冲300的透射光100A(或反射光100B),并且利用光检测器18不检测来自主脉冲301的透射光100A(或反射光100B)。
具体而言,作为本实施方式的检查方法,发明人们设定了时间选通宽度304,该时间选通宽度为光检测器18仅能够检测透射光100A(或反射光100B)的时间,并且限制了光检测器18能够接收光的时间。时间选通宽度304被设定成主脉冲300的脉冲宽度302以上的时间。由此,在生物体组织识别系统1a中,通过仅对主脉冲300进行时间积分来计算吸光度。
为了可靠地测量主脉冲300整体,时间选通宽度304被设定成除了包括脉冲宽度302之外,还包括脉冲宽度302之前和之后的时间(图19中箭头303所示的时间)的时间。另外,箭头303所示的时间优选的是被设定成不包括产生子脉冲301的时间。具体而言,图19的箭头303所示的时间分别被设定为脉冲宽度302的0~10%左右即可,例如为3%。
另外,光源10振荡出激光100的定时与光检测器18检测出透射光100A的定时在严格意义上是不同的。因此,只要考虑到上述定时的差来设定光检测器18能够接收光的定时即可。
另外,本实施方式并非想要完全不检测子脉冲301,只要是对组织的识别不会产生影响的程度,也可以检测子脉冲301。即,在本实施方式中,只要按照光检测器18不检测子脉冲301的至少一部分的方式设定时间选通宽度304即可。
另外,在进行测量的全部波长中脉冲宽度302是相同的情况下,也可以是,通过固定进行测量的全部波长中的时间选通宽度304来进行测量。但是,在每个波长的脉宽302都不同的情况下,优选的是,对每个波长适当地变更时间选通宽度304。
图20是示出本实施方式的生物体组织识别系统1a具有的控制部31a的结构的功能框图。生物体组织识别系统1a的除控制部31a以外的结构与生物体组织识别系统1的结构相同。
如图20所示,计算机30具有的控制部31a控制光检测器18,使该光检测器18只检测上述的时间选通宽度304的时间间隔的透射光100A或反射光100B。由此,在生物体组织识别系统1a中,能够得到降低了作为噪声的子脉冲301的影响的识别结果。即,能够进一步提高组织识别的精度。
在本实施方式中,说明了在生物体组织识别系统1的结构中应用物镜和控制部31a的结构,但该结构也可以应用于实施方式2和3,在该情况下也起到同样的效果。
(生物体组织识别系统1a的效果)
使用体组织识别系统1和生物体组织识别系统1a,对肝脏组织中的正常肝和恶性淋巴瘤浸润部的吸收光谱进行测量。另外,在该测量中,在进行测量的所有波长中,将脉冲宽度302固定为557ns,将时间选通宽度304固定为590ns,该时间590ns是在脉冲宽度302的基础上前后加上脉冲宽度302的3%的时间后的时间。另外,对各个组织进行多次测量。图21是示出肝脏组织中的正常肝和恶性淋巴瘤浸润部的吸收光谱的图,图21的(a)示出使用生物体组织识别系统1获得的吸收光谱,图21的(b)示出使用生物体组织识别系统1a获得的吸收光谱。另外,图21的(a)和(b)所示的吸收光谱是使用相同的样本进行测量后得到的。
如图21的(b)所示,生物体组织识别系统1a的测量结果与图21的(a)所示的生物体组织识别系统1的测量结果相比,正常肝与恶性淋巴瘤浸润部的差异较为明确。即,在生物体组织识别系统1a中,由于就有物镜,从而提高了分辨率,通过设定时间选通宽度304从而降低了子脉冲301的影响,其结果是,确认了吸收光谱的测量精度提高。
特别是,如图21的(a)所示,在使用生物体组织识别系统1进行测量的情况下,例如在使用9.83μm波长的光进行测量时,正常组织间的吸光度在每次测量时变动较大,组织的识别结果不明确。另外,在使用9.07μm波长的光进行测量时,正常组织与恶性淋巴瘤浸润部之间的吸光度的差较小。与此相对,如图21的(b)所示,在使用生物体组织识别系统1a进行测量的情况下,在使用9.83μm波长的光进行测量时,正常组织中的每次测量的吸光度的变动降低。另外,在使用9.07μm波长的光进行测量时,可以明确地识别出正常肝与恶性淋巴瘤浸润部分之间的差异。
(吸收光谱的具体例)
使用图22~图29,对使用生物体组织识别系统1a进行测量的例子进行说明。另外,对各个组织进行多次测量。图22是示出多种正常组织和癌组织的吸收光谱的图。在图22所示的例子中,对骨髓、横纹肌肉瘤(癌组织)、肌肉以及骨骼进行了测量,基准波长为8.84μm,判别波长的范围为8.87μm~9.02μm。图23是示出肝脏组织中的正常组织、癌组织以及淋巴细胞的吸收光谱的图。在图23所示例子中,基准波长为9.75μm,判别波长的范围为9.10μm~9.55μm。图24是示出肺组织中的正常组织、原发性肺癌组织以及肝癌的肺转移灶的吸收光谱的图。在图24所示例子中,基准波长为9.70μm,判别波长的范围为9.75μm~10.00μm。
图25是示出心脏组织中的正常组织和心肌梗塞病灶的吸收光谱的图。在图25例子中,基准波长为8.76μm,判别波长的范围为9.18μm~9.71μm以及9.84μm~11.00μm。图26是示出肝脏组织中的正常组织和脂肪肝的组织的吸收光谱的图。在图26例子中,基准波长为9.75μm,判别波长的范围为8.05μm~9.18μm。图27是示出肝脏组织中的正常组织和肝硬化的组织的吸收光谱的图。在图27例子中,基准波长为9.75μm,判别波长的范围为8.61μm~9.00μm以及9.05μm~9.26μm。
图28是示出小脑组织(髓母细胞瘤)中的正常组织、放射性诱发癌组织、以及自然发生的癌组织的吸收光谱的图。在图28例子中,基准波长为9.71μm,判别波长的范围为8.80μm~9.34μm以及9.89μm~10.25μm。图29是示出肾脏组织中的正常肾小管和淀粉样蛋白沉积的肾小球的吸收光谱的图。在图29例子中,基准波长为9.73μm,判别波长的范围为8.88μm~9.14μm。
在图22~图29所示的任意一个结果中,在箭头83、83A、83B所示的判别波长的范围内,吸收光谱明显根据生物体组织的种类或者状态非偶然地不同。由图22所示的结果可知,能够识别多种组织中的癌组织。
另外,在图23所示的例子中,使用正常组织、癌组织以及淋巴细胞之间的边界在病理组织图像中不清晰的样本来测量吸收光谱。根据图23所示结果可知,即使在组织的边界不清晰的情况下,也能够在箭头83所示的判别波长的范围内识别各个组织。
另外,根据图24所示的结果可知,在箭头83所示的判别波长的范围内,在识别正常组织和癌组织的基础上,能够识别该癌组织源自哪个组织。例如,能够识别该癌组织是转移性的癌组织还是原发性的癌组织。
另外,根据图25所示结果,在箭头83A和83B所示的判别波长的范围内,能够识别正常组织和心肌梗死灶。特别是,在使用9.62μm波长的光进行测量的情况下,可知能够详细地识别心肌梗塞病灶。
另外,根据图26和图27所示的结果可知,能够在图26的箭头83所示的判别波长的范围内识别正常组织和脂肪肝的组织,另外,能够在图27的箭头83A和83B所示的判别波长的范围内识别正常组织和肝硬化的组织。另外,如上所述那样,在肝脏组织中,还可以识别正常组织和癌组织。
在肝脏组织中,当正常组织内发生油滴沉积时,形成脂肪肝,进而在胶原沉积且纤维化时,成为肝硬化。另外,有可能以肝硬化为母地发生肝癌。在本实施方式中,能够识别肝脏组织处于致癌过程中的哪个阶段。
另外,由图28所示结果可知,在箭头83A、83B所示的判别波长范围内,在识别出正常组织和癌组织的基础上,还可以识别该癌组织是自然发生的癌组织还是放射线诱发性的癌组织。迄今为止,在病理组织图像中难以区分放射性诱发癌组织和自然发生的癌组织,但在本实施方式中,能够识别这些癌组织。
另外,根据图29所示的结果可知,在箭头83所示的判别波长的范围内,能够识别正常的肾小管和淀粉样蛋白沉积的肾小球。淀粉样蛋白沉积的肾小球是导致蛋白尿和肾病综合征的原因,并且如果继续发展则有发生慢性肾衰竭的风险。因此,在本实施方式中,能够识别在发生慢性肾功能衰竭之前存在该危险的组织,换言之,能够识别发生了异常的组织。另外,在脑、心脏、消化道、肝脏、末梢神经、舌、甲状腺以及皮肤等的全身的脏器中,也同样能够识别病情发病前(早期)有无淀粉样蛋白沉积。
(基于软件的实现例)
控制部31的控制块(特别是吸光度比计算部43、器官判别部44以及识别信息生成部45)可以通过形成在集成电路(IC芯片)等中的逻辑电路(硬件)来实现,也可以通过软件来实现。
在后者的情况下,控制部31被实现成执行实现各功能的软件即组织识别程序的命令的计算机。控制部31例如具有1个以上的处理器,并且与存储了上述程序的计算机可读取的记录介质即存储部33可通信地连接。并且,在控制部31中,上述处理器从上述记录介质读取上述程序并执行,由此实现了本发明的目的。
作为上述处理器,例如可以使用CPU(Central Processing Unit:中央处理单元)。作为上述记录介质,除了可以使用“非暂时的有形介质”例如ROM(Read Only Memory:只读存储器)等之外,还可以使用磁带、盘、卡、半导体存储器、可编程逻辑电路等。另外,也可以是,还具有展开上述程序的RAM(Random Access Memory:随机存取存储器)等。另外,上述程序也可以经由能够传输该程序的任意的传输介质(通信网络或广播波等)被提供给上述计算机。另外,本发明的一个方式也可以是通过上述程序被电子传输而具体化的、嵌入到载波中的数据信号的形态来实现的。
本发明不限于上述的各实施方式,能够在权利要求所示的范围内进行各种变更,关于将不同的实施方式中分别公开的技术手段适当组合而得到的实施方式,也包含在本发明的技术范围内。
标号说明
1、1a:生物体组织识别系统(组织识别系统);
2:生物体组织识别系统(组织识别系统);
3:内窥镜系统;
10:光源(第1光源);
18:光检测器(第1光接收部);
21:摄像部(第2光接收部);
41:光源控制部;
43:吸光度比计算部(计算部);
44:器官判别部(判别部);
45:识别信息生成部;
51:检查光纤(第1光纤);
54:照明光光纤(第2光纤);
70:照明光源(第2光源);
100:激光(检查光);
200:照明光(可视光);
300:主脉冲;
301:子脉冲。
