结肠直肠癌的治疗性和预防性处理
文献发布时间:2024-01-17 01:20:32
相关申请
本申请要求2019年1月31日提交的美国临时专利申请62/799,162号的优先权,通过援引方式将其内容整体并入本文,用于所有目的。
发明背景
结肠直肠癌(CRC)在最常见癌症中排名第三,在全球癌症死亡主要原因中排名第四,估计每年新发病例为一百万,死亡数大于五十万人。根据香港医院管理局癌症登记处公布的数据,CRC占香港2012年所有新发癌症病例的16.4%和所有癌症死亡的14.3%。
数种内部因素(例如,年龄,男性性别,糖尿病,肥胖和炎性肠病)和外部因素(例如,吸烟,纤维摄入不足,高摄入酒精、红肉和高脂肪饮食)与CRC风险增加有关。CRC的流行病学特点由于风险因素的流行和分布的变化而处于动态变化中。在这方面,在过去二十年中,包括亚洲国家在内的许多发展中国家的CRC发病率增加了2至4倍,现在已经达到了警戒水平,饮食的西方化在这里起到关键作用。
已经证实,人类肠道中存在约100万亿细菌,并且由于它们与人体的共生和协作关系,它们与CRC密切相关。已经在不同群体中研究了CRC与改变的肠微生物群的关联性,鉴定了在肿瘤发生中可能重要的细菌,例如核梭杆菌(Fusobacterium nucleatum)和脆弱拟杆菌(Bacteroides fragilis)。对此,发现核梭杆菌改变了肿瘤免疫微环境,从而促进了结肠直肠癌的发生。脆弱拟杆菌还通过产生基因毒素以损害宿主细胞中的DNA而产生重要的致癌作用。据报道,普氏菌(Prevotella)在近端结肠癌症中富集并且与产生白介素(IL)-17的细胞有关。据报道,卟啉单胞菌(Porphyromonas)也与不同群体中的CRC有关。
已经开发了包括手术、化疗、放射治疗和靶向治疗(例如,西妥昔单抗和贝伐单抗)的几种处置方式来控制CRC。然而,患有转移性CRC的患者的预后仍然较差,突出了预防这种疾病的重要性。CRC从细胞转化到高度转移性病变的长期逐步进展已经使得能够通过天然化合物或药物来阻止或逆转该过程。具体而言,经济分析表明,当靶向息肉切除术后的中等风险人群时,化学预防可以是成本有效的干预措施。为此,已经证实非甾体抗炎药(NSAID)和环加氧酶-2(COX-2)抑制剂能在高危个体中减少CRC或其癌前病变的发生。然而,长期使用这些药剂与心血管事件的风险增加有关,这引起了推荐这些药剂用于CRC化学预防的高风险受益比的担心。还已经研究了包括叶酸、钙、维生素D和抗氧化剂在内的其它药剂的化学预防作用,但是它们的功效仍有待确定。益生菌是人类肠道中的共生微生物。本申请提供了用于CRC预防和治疗的特异性益生菌及其分泌的分子。
CRC从细胞转化到高度转移性病变的长期逐步进展已经使得能够通过天然化合物或药物来阻止或逆转该过程。然而,当靶向息肉切除后的中等风险群体时,化学预防可以是成本有效的干预措施。已证实微生物群与CRC密切相关。为此,使用CRC中特异性地减少的细菌的可能是阻止CRC发展的潜在的理想方法。本申请的发明人首次发现嗜热链球菌(S.thermophilus)及其分泌的分子可以在体外和体内抑制CRC的生长。因此,该发现为CRC的预防和治疗提供了重要的手段。
发明内容
本申请的发明人发现,嗜热链球菌及其分泌的化合物,例如β-半乳糖苷酶,以及其他能够分泌β-半乳糖苷酶的细菌,可以有效地抑制人结肠直肠癌(CRC)细胞的增殖和活力,因此可以在预防和治疗应用中用作预防和治疗CRC的治疗剂。
因此,在第一方面,本申请提供了抑制癌细胞增殖的方法。该方法包括使癌细胞与包含有效量的活的嗜热链球菌或嗜热链球菌培养物的提取物、β-半乳糖苷酶或其他分泌β-半乳糖苷酶的细菌或其培养物的组合物接触的步骤。在一些实施方案中,癌细胞是结肠癌细胞。在一些实施方案中,癌细胞,尤其是结肠癌细胞,在个体体内。在一些实施方案中,个体具有癌症(例如结肠癌)的家族史,但尚未被诊断患有癌症。在其它实施方案中,个体已经被诊断患有癌症,例如结肠癌。在一些实施方案中,请求保护的方法中使用的组合物是嗜热链球菌或其他分泌β-半乳糖苷酶的细菌的培养物;或者所述细菌(例如,嗜热链球菌)培养物的提取物,其中所述提取物基本上不含所述细菌(例如,嗜热链球菌);或者所述细菌(例如,嗜热链球菌)培养物的提取物,其中所述提取物基本上不含所述细菌(例如,嗜热链球菌)并且在具有100kDa的分子量截止值(MWCO)的膜过滤后被保留在膜上;或者所述细菌(例如,嗜热链球菌)培养物的提取物,其中所述提取物包含β-半乳糖苷酶;或者β-半乳糖苷酶,其可以是重组性质的或可以是从能够分泌β-半乳糖苷酶的任何细菌的培养物中分离的。在一些实施方案中,向个体口服施用包含有效量的β-半乳糖苷酶、或活的分泌β-半乳糖苷酶的细菌(例如嗜热链球菌)、或所述细菌(例如嗜热链球菌)的培养物的提取物的组合物。例如,该组合物可以是嗜热链球菌培养物;或者嗜热链球菌培养物的提取物,其中所述提取物基本上不含嗜热链球菌;或者嗜热链球菌培养物的提取物,其中所述提取物基本上不含嗜热链球菌并且在具有100kDa的分子量截止值(MWCO)的膜过滤后被保留在膜上;或者嗜热链球菌培养物的提取物,其中所述提取物包含β-半乳糖苷酶。在一些实施方案中,所述方法为体外方法,即,所述接触步骤在体外发生。
在第二方面,本申请提供了用于处理个体的癌症或降低个体癌症风险的套装产品。所述套装产品包括这些组分:(1)第一容器,其包含第一组合物,所述第一组合物包含有效量的β-半乳糖苷酶、或能够分泌β-半乳糖苷酶的细菌(例如嗜热链球菌)的活培养物、或所述细菌(例如嗜热链球菌)培养物的提取物;和(2)第二容器,其包含第二组合物,所述第二组合物包含有效量的抗癌治疗剂。在一些实施方案中,个体具有癌症,尤其是结肠癌的家族史,但尚未诊断患有癌症。在一些实施方案中,个体已经被诊断患有癌症,尤其是结肠癌。在一些实施方案中,第一组合物是分泌β-半乳糖苷酶的细菌(例如嗜热链球菌)的培养物,尤其是活培养物;或者分泌β-半乳糖苷酶的细菌(例如,嗜热链球菌)培养物的提取物,其中所述提取物基本上不含所述细菌(例如,嗜热链球菌);或者所述细菌(例如,嗜热链球菌)培养物的提取物,其中所述提取物基本上不含所述细菌(例如,嗜热链球菌)并且在具有100kDa的分子量截止值(MWCO)的膜过滤后被保留在膜上;或者所述细菌(例如,嗜热链球菌)培养物的提取物,其中所述提取物包含β-半乳糖苷酶;或者包含β-半乳糖苷酶的组合物,β-半乳糖苷酶可以是重组产生的或从天然存在的来源分离/纯化/浓缩的。在一些实施方案中,第一组合物被配制用于口服施用,例如,组合物可以作为食品、饮料、食品补充剂、片剂、胶囊、糊剂/霜剂、液体或半液体组合物提供。在一些实施方案中,所述组合物可配制用于直肠沉积或插入。任选地,所述套装产品还包括说明书手册。
在第三方面,本申请提供了用于处理癌症或降低癌症风险的组合物,其包含(1)有效量的β-半乳糖苷酶,或分泌β-半乳糖苷酶的细菌(例如嗜热链球菌)的活培养物,或所述细菌(例如嗜热链球菌)培养物的提取物;和(2)有效量的抗癌治疗剂;和(3)生理学上可接受的赋形剂。在一些实施方案中,癌症是结肠癌。在一些实施方案中,组合物可配制成直肠栓剂。在一些实施方案中,提取物是分泌β-半乳糖苷酶的细菌(例如,嗜热链球菌)培养物的提取物,其中所述提取物基本上不含所述细菌(例如,嗜热链球菌);或者所述细菌(例如,嗜热链球菌)培养物的提取物,其中所述提取物基本上不含所述细菌(例如,嗜热链球菌)并且在具有100kDa的分子量截止值(MWCO)的膜过滤后被保留在膜上;或者分泌β-半乳糖苷酶的细菌(例如,嗜热链球菌)培养物的提取物,其中所述提取物包含β-半乳糖苷酶。在一些实施方案中,组合物被配制用于口服施用,并且可以是食品、饮料、食品补充剂、片剂、胶囊、糊剂/霜剂、液体或半液体组合物。在一些实施方案中,组合物被配制用于直肠栓剂。
在相关方面,本申请提供了β-半乳糖苷酶、分泌β-半乳糖苷酶的细菌或所述细菌的活培养物或培养物的提取物(例如,如本文所述的活的嗜热链球菌、嗜热链球菌培养物、嗜热链球菌培养物的提取物)用于处理个体癌症或用于降低个体癌症风险,特别是结肠癌的用途,个体可以已经被诊断患有疾病或已知具有增加的疾病风险,但还未得到疾病的诊断。.
附图简要说明
图1显示嗜热链球菌对APC
图2显示嗜热链球菌对注射致癌物(AOM)的小鼠的肠道肿瘤发展的预防作用。
图3显示嗜热链球菌对癌性结肠上皮细胞(HCT116,HT29,Caco-2)和正常结肠上皮细胞(NCM460)的活力的抑制作用。
图4显示灭活的嗜热链球菌对CRC细胞系没有作用。
图5显示St.CM对CRC细胞系的时间依赖性和浓度依赖性抑制作用。
图6显示St.CM在癌性结肠上皮细胞(HCT116、HT29、Caco-2)中诱导凋亡性细胞死亡,而在正常结肠上皮细胞(NCM460)中无此作用。
图7显示来自St.CM的>100KDa组分的肿瘤抑制作用。
图8显示来自St.CM的>100KDa组分在CRC细胞系中的促凋亡作用。
图9显示CRC细胞系中来自St.CM的>100KDa组分的细胞周期阻滞效应。
图10显示来自St.CM的>100KDa组分对裸鼠中CRC异种移植物生长的抑制作用。
图11显示来自St.CM的>100KDa组分在热灭活或与蛋白酶K共孵育后丧失其对CRC细胞系的活力的抑制作用。
图12显示从St.CM分离的肿瘤抑制组分含有β-半乳糖苷酶。
图13显示嗜热链球菌的抗肿瘤作用由β-半乳糖苷酶的分泌介导。
定义
在本申请中,术语“结肠直肠癌(CRC)”和“结肠癌”具有相同的含义,并且是指大肠(结肠)(即人类消化系统的下部)的癌症,尽管直肠癌经常更具体地是指结肠的最后几英寸(直肠)的癌症。“结肠直肠癌细胞”是具有结肠癌特征的结肠上皮细胞,并且包括癌前细胞,癌前细胞处于转化成癌细胞的早期阶段或其有倾向转化成癌细胞。这种细胞可表现出癌细胞的一种或多种表型性状和特征。
在本申请中,在文中内容无另外明确规定的情况下,术语"或"通常以包括"和/或"的意义使用。
本文所用的"嗜热链球菌(Streptococcus thermophilus)培养物"是指一种组合物,其中嗜热链球菌能够在合适的条件下增殖,所述条件包括合适的温度,通气和水分等。通常,"嗜热链球菌培养物"是包含必需营养素以及嗜热链球菌的水性溶液,每种必需营养素的量足以维持嗜热链球菌的生长,并且"嗜热链球菌培养物"优选被置于适于嗜热链球菌增殖的条件下保持允许嗜热链球菌增殖的最短时间,例如,至少2、4、8、10和/或长达12小时,因此还含有由嗜热链球菌在其生命周期期间分泌的化合物。在本申请中,"嗜热链球菌培养物"的"提取物"是指除去了完整嗜热链球菌培养物的一种或多种成分的组合物或培养物的任何组分,例如,除去(例如,通过离心和/或通过例如0.22微米膜的膜过滤)或灭活(例如,通过加热、化学处理或辐射)所有细菌,尤其是嗜热链球菌的无细菌组分。当在组合物(例如嗜热链球菌培养物的提取物)中嗜热链球菌的存在产生与背景信号基本上相同的可检测信号时,组合物被称为"基本上不含嗜热链球菌"。其它可能的提取物或组分可包括以下情形:除去了一定分子量范围内的化合物,或仅保留一定分子量范围内的化合物(例如,通过经预定分子量截止值或MWCO的膜的过滤,并回收保留在膜上的部分或通过膜的部分),或蛋白质成分被消化或以其它方式灭活(例如,通过蛋白水解处理、化学处理或热处理)。
在本文中,“β-半乳糖苷酶”是指通过糖苷键的断裂催化β-半乳糖苷水解成单糖的糖苷水解酶。术语β-半乳糖苷酶包括源自不同细菌物种的变体和同系物,例如源自嗜热链球菌的β-半乳糖苷酶,β-半乳糖苷酶可基于氨基酸序列的相似性和酶活性的功能属性来鉴定。例如,本文所定义的“β-半乳糖苷酶”与源自嗜热链球菌的β-半乳糖苷酶存在至少90%、95%或更高的氨基酸序列同一性。“β-半乳糖苷酶”可以是天然存在的或重组产生的。
“分泌β-半乳糖苷酶的细菌”是指能够产生可检测水平的β-半乳糖苷酶的任何细菌种类,β-半乳糖苷酶从细菌中释放并存在于细菌培养物中,并且可通过例如至少一种免疫测定(如Western印迹)来检测。细菌可以是天然存在的细菌或可以是重组细菌,即基因工程改造或修饰的细菌。由这种细菌细胞产生和分泌β-半乳糖苷酶可以是组成型的或可以是诱导型的。
在本文中,术语"基因表达"用于指DNA转录而形成编码具体蛋白质的RNA分子或由多核苷酸序列编码的蛋白质的翻译。换句话说,本申请中的术语"基因表达水平"包括由感兴趣基因编码的mRNA水平和蛋白质水平。
在本申请中,术语"分离的"核酸分子是指该核酸分子与通常与该核酸分子关联在一起的其它核酸分子分离开来。因此,"分离的"核酸分子包括但不限于,不含在分离的核酸所来源的生物体的基因组中天然地位于该核酸分子的一端或两端的核苷酸序列的核酸分子(例如,通过PCR或限制性内切核酸酶消化产生的cDNA或基因组DNA片段)。为了便于操作或产生融合核酸分子,通常将这种分离的核酸分子引入载体(例如克隆载体或表达载体)中。此外,分离的核酸分子可以包括工程化的核酸分子,例如重组的或合成的核酸分子。存在于例如核酸文库(例如,cDNA或基因组文库)或含有限制性消化的基因组DNA的凝胶(例如,琼脂糖或聚丙烯胺)中的数百至数百万个其它核酸分子中的核酸分子不是"分离的"核酸。
术语"核酸"或"多核苷酸"是指单链或双链形式的脱氧核糖核酸(DNA)或核糖核酸(RNA)及它们的聚合体。除非特别限定,该术语包括含有天然核苷酸的已知类似物的核酸,这样的核酸具有与参考核酸相似的结合特性,并且以与天然存在的核苷酸相似的方式被代谢。除非另有说明,一个具体的核酸序列还隐含地包括其保守修饰的变体(例如简并密码子取代)、等位基因、直系同源物,单核苷酸多态性(SNP)和互补序列,以及明确指出的序列。具体而言,简并密码子取代可以通过以下方式来实现:产生其中一个或多个选择的(或所有的)密码子的第三位被混合碱基和/或脱氧肌苷残基取代的序列(Batzer et al.,NucleicAcid Res.19:5081(1991);Ohtsuka et al.,J.Biol.Chem.260:2605-2608(1985);andRossolini et al.,Mol.Cell.Probes 8:91-98(1994))。术语核酸可与基因、cDNA和基因编码的mRNA互换使用。
术语“基因”是指参与产生多肽链的DNA片段;其包括在基因产物的转录/翻译和转录/翻译的调节中涉及的编码区之前和之后的区域(前导序列和尾随序列),以及在各个编码区(外显子)之间的插入序列(内含子)。
在本申请中,术语"多肽"、"肽"和"蛋白质"在本文中可互换使用,是指氨基酸残基的聚合体。该术语适用于其中一个或多个氨基酸残基是相应天然存在的氨基酸的人工化学模拟物的氨基酸聚合体,以及天然存在的氨基酸聚合体和非天然存在的氨基酸聚合体。在本文中,以上术语涵盖任何长度的氨基酸链,包括全长蛋白质(例如,源自嗜热链球菌的β-半乳糖苷酶),其中氨基酸残基通过共价肽键连接。
术语"氨基酸"是指天然存在的和合成的氨基酸,以及以类似于天然存在的氨基酸的方式起作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的氨基酸,以及随后被修饰的氨基酸,例如羟脯氨酸,γ-羧基谷氨酸和O-磷酸丝氨酸。为了本申请的目的,氨基酸类似物是指与天然存在的氨基酸具有相同的基本化学结构的化合物,即,与氢、羧基、氨基和R基团结合的碳,例如,高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸甲基锍。此类类似物具有经修饰的R基团(例如正亮氨酸)或经修饰的肽主链,但保持与天然存在的氨基酸相同的基本化学结构。为了本申请的目的,氨基酸模拟物是指具有与氨基酸的一般化学结构不同的结构,但以类似于天然存在的氨基酸的方式起作用的化合物。
氨基酸可包括具有非天然存在的D-手性的氨基酸,如WO01/12654中所公开,其可改善包含一个或多个此类D-氨基酸的多肽的稳定性(例如半衰期)、生物利用度和其它特征。在一些情况下,治疗性多肽的一个或多个氨基酸以及可能所有的氨基酸具有D-手性。
氨基酸在本文中可以通过公知的三字母符号或IUPAC-IUB生化命名委员会推荐的单字母符号来提及。同样,核苷酸可以用它们通常接受的单字母码来表示。
在本申请中,"增加"或"减少"是指相比于比较对照(例如,已建立的标准对照),量上可检测的正变化或负变化。增加是正变化,其通常为对照值的至少10%、或至少20%、或50%、或100%,并且可以高达对照值的至少2倍、或至少5倍、或甚至10倍。类似地,降低是负变化,其通常为对照值的至少10%、或至少20%、30%或50%,或甚至高达对照值的至少80%或90%。在本申请中,表示相比于比较基础的量的变化或差异的其它术语,诸如“更多”、“更少”、“更高”和“更低”,以与上述相同的方式使用。相比之下,术语“基本上相同”或“基本上没有变化”表示与标准对照值相比,量的变化很小或没有变化,通常在标准对照的±10%内,或在标准对照的±5%、2%、1%内,或甚至更少的变化。
本文所用的术语“抑制”是指对目标生物过程的任何可检测的负面影响,目标生物过程例如RNA转录、蛋白表达、细胞增殖、细胞信号转导、细胞增殖、致瘤性、转移潜能和疾病/病症的复发。通常,抑制反映为:当与未施用抑制剂的对照相比时,在施用抑制剂时,目标过程(例如,CRC细胞增殖率)降低至少10%、20%、30%、40%或50%。
本申请中使用的术语“处理”描述的是实现相关病症的任何症状的消除、减少、减轻、逆转或预防或延迟发作或复发的行为。换句话说,"处理"病症包括对该病症的治疗和预防性干预。
本文所用的术语"有效量"是指在量上足以产生所需效果的给定物质的量。例如,嗜热链球菌培养物或其组分(特别是包含源自嗜热链球菌的β-半乳糖苷酶的组分)的有效量是实现以下的所述培养物或其组分的量:目标过程(例如CRC细胞增殖或活力)水平降低,使得在已经给予嗜热链球菌培养物或其组分用于治疗和/或预防目的的患者中,结肠癌的风险、症状、严重性和/或复发变化被降低、逆转、消除、预防或延迟发生。足以实现此目的的量定义为"治疗有效剂量"。剂量范围随所施用的治疗剂的性质和其它因素(例如施用途径和患者病症的严重程度)而变化。
本文所用的术语“个体”或“需要处理的个体”包括由于结肠癌的风险或实际罹患结肠癌而寻求医学帮助的个体。个体还包括当前正在进行治疗的寻求治疗方案的操作的个体。需要处理的个体包括显示结肠癌症状或处于患有结肠癌或其症状的风险中的个体。例如,需要处理的个体包括具有遗传倾向或风险因素的个体,所述遗传倾向或风险因素包括结肠癌的家族史或个人病史和/或生活方式选择,例如本申请中描述的倾向于引起疾病风险增加的风险因素、过去已经经历相关症状的风险因素、已经暴露于触发物质或事件的风险因素以及患有病症的慢性或急性症状的风险因素。“需要处理的个体”可以处于任何生命年龄。
发明详细描述
I.介绍
当在结直肠癌患者的晚期阶段检测到该疾病时,结直肠癌患者经常面临不良的预后。因此,结肠直肠癌的早期检测和处理(包括预防性处理)对于改善患者的临床结果是至关重要的。
本申请的发明人首次发现,分泌β-半乳糖苷酶的细菌(例如嗜热链球菌)及其分泌的一种或多种化合物(特别是β-半乳糖苷酶)可在预防和治疗结肠直肠癌(CRC)中提供显著益处。更具体地,本申请的发明人揭示了,益生菌嗜热链球菌及其含有β-半乳糖苷酶的条件化培养基(
II.结肠癌的处理
通过展示分泌β-半乳糖苷酶的细菌(例如嗜热链球菌)及其分泌的化合物(例如β-半乳糖苷酶)对癌细胞(例如结肠癌细胞)的抑制作用,本申请提供了用于处理已诊断患有癌症(例如结肠癌)的患者以及尚未诊断患有该疾病、但处于发展癌症的增加的风险中的个体的新方法,增加的风险例如由于遗传倾向,癌症(特别是结肠癌)的家族史,和/或个人特征和医学背景,例如年龄(50岁或更大)、性别(男性)、糖尿病、肥胖和炎性肠病,以及吸烟和某些饮食选择(例如,纤维摄入不足,高摄入酒精、红肉和高盐/高脂肪食物)。根据本申请内容,产生β-半乳糖苷酶的细菌培养物(例如嗜热链球菌培养物)或包含所述细菌和/或其分泌的化合物(例如β-半乳糖苷酶)的培养物的提取物或组分,特别是包含由细菌细胞分泌的分子量大于100kDa的分子并且特别是包含β-半乳糖苷酶的提取物,可以用于向所述个体施用,以用于在预防性应用中在风险个体中预防或降低结肠癌升高的风险,以及在治疗应用中处理结肠癌患者,从而抑制结肠癌细胞生长和转移,也可能结合其它常规治疗方案,例如手术干预、化疗、放射治疗、免疫治疗或其任何组合。
A.细菌培养物和提取物
可以根据本领域已知的和本文描述的方法在适当的条件下建立分泌β-半乳糖苷酶的细菌(其可以是天然存在的细菌物种,如嗜热链球菌,或通过人工引入一种或多种编码该酶的外源基因或增强内源性β-半乳糖苷酶的表达而产生的重组细菌细胞系)的培养物。通常,可通过在含有必需营养物的液体培养基中、在适当温度下培养细菌12-24小时,以允许细菌细胞在培养基中增殖来获得活的分泌β-半乳糖苷酶的细菌(例如嗜热链球菌)培养物。活的细菌(例如嗜热链球菌)培养物可直接用于生产适于向有需要的个体施用的配方或形式的组合物。或者,可使用分泌β-半乳糖苷酶的细菌(例如嗜热链球菌)的这种活培养物的提取物或组分来代替完全培养物用于配制。为此目的,可以从活的培养物产生无细菌的培养物提取物,例如,在通过离心和/或过滤处理完全培养物以基本上除去所有的主要细菌细胞(如嗜热链球菌)和可能存在于培养物中的其它细菌之后。此外,基本上不含细菌细胞(如嗜热链球菌或其它细菌)、但含有细菌细胞(如嗜热链球菌)分泌的优选分子量范围内的所有化合物的分泌β-半乳糖苷酶的细菌培养物(如嗜热链球菌培养物)的提取物可以通过使用合适的孔径大小的膜的过滤方法获得。例如,可以在过滤中使用截留分子量为100kDa的膜,该膜将此分子量之上的化合物保留在膜(渗余物部分)上,同时允许该分子量之下的化合物通过膜(滤液部分)。活的分泌β-半乳糖苷酶的细菌培养物(例如嗜热链球菌培养物)的其它可能的提取物或组分可以包括具有特定类型的分子(例如蛋白质)全部被去除或富集的提取物或组分。例如,一种提取物在其培养物中可以具有高度富集的由分泌β-半乳糖苷酶的细菌(例如嗜热链球菌)分泌的β-半乳糖苷酶。
B.β-半乳糖苷酶
如本申请的发明人所示,β-半乳糖苷酶是分泌β-半乳糖苷酶的细菌能够提供的抗癌活性所必需的化合物。因此,本申请的一个方面是β-半乳糖苷酶用于治疗和预防目的的用途。
蛋白β-半乳糖苷酶可以通过多种方式获得,包括但不限于,通过工程改造的原核或真核细胞重组生产β-半乳糖苷酶,从来源如分泌β-半乳糖苷酶的细菌培养物中分离/纯化或部分分离/富集天然存在的蛋白β-半乳糖苷酶。因此,不仅来自任何细菌培养物的天然存在的β-半乳糖苷酶,包括其具有相同类型的酶活性(作为能够通过断裂糖苷键来催化β-半乳糖苷水解成单糖的糖苷水解酶)的变体或同系物,可以用于本申请要求保护的方法和组合物中,也可以使用任何一种重组形式的β-半乳糖苷酶蛋白。这包括不同形式的重组β-半乳糖苷酶蛋白,其可以包含序列修饰,例如一个或多个氨基酸残基的缺失、插入或取代,或者可以包括一个或多个异源肽序列(来自与β-半乳糖苷酶的来源不同的来源),例如亲和性或表位标签,但是其仍然保留催化β-半乳糖苷水解的相同类型的酶活性。
C.药物组合物
1.制剂
β-半乳糖苷酶,能够产生β-半乳糖苷酶的活细菌培养物(例如嗜热链球菌培养物),或培养物的提取物,特别是含有β-半乳糖苷酶的提取物,可用于制备药物组合物或药物。可以将药物组合物或药物施用于个体以处理结肠癌,特别是预防结肠癌。
在本申请的处理方法中使用的β-半乳糖苷酶、产生β-半乳糖苷酶的细菌培养物(如嗜热链球菌培养物)、或培养物的提取物可用于制备药物组合物或药物或食品,包括饮料或食品补充剂,它们可以与一种或多种生理学上可接受的适于施用的赋形剂或载体结合或混合。
用于这种治疗用途的示例性药物组合物包含(i)有效量的β-半乳糖苷酶、分泌β-半乳糖苷酶的细菌的活培养物(例如嗜热链球菌培养物)、或如本文所述的提取物,和(ii)药学上可接受的赋形剂或载体。术语“药学上可接受”和“生理学上可接受”在本文中同义使用。
用于本申请的药物组合物或药物可以使用一种或多种生理学上可接受的载体或赋形剂通过标准技术来配制。合适的药物载体描述于本文和E.W编著的"Remington'sPharmaceutical Sciences"中。马丁。本申请的化合物和药剂以及它们的生理学上可接受的盐和溶剂化物可以被配制用于通过任何合适的途径给药,包括通过吸入、局部、经鼻、经口、肠胃外或经直肠,这取决于用于递送的解剖部位,例如在癌症存在或可能出现的部位,例如对于结肠癌而言的结肠、对于胃癌而言的胃和对于皮肤癌而言的皮肤。
用于局部施用的典型制剂包括霜剂、软膏剂、喷雾剂、洗剂和贴剂。然而,药物组合物可以配制用于任何类型的施用,例如,真皮内、真皮下、静脉内、肌内、鼻内、脑内、气管内、动脉内、腹膜内、膀胱内、胸膜内、冠状动脉内或肿瘤内注射,可以使用注射器或其它装置。本申请还考虑到用于通过吸入给药(例如气溶胶)或用于口服、直肠或阴道给药的制剂。
2.给药途径
用于局部施用(例如施用于皮肤和眼睛)的合适制剂优选是本领域熟知的水溶液、软膏、乳膏或凝胶。这样的制剂可以含有增溶剂、稳定剂、张力增强剂、缓冲剂和防腐剂。
用于透皮施用的合适的制剂包含有效量的本申请组合物和一种或多种载体。优选的载体包括可吸收的药理学上可接受的溶剂,以帮助通过宿主的皮肤。例如,透皮装置可以是绷带的形式,其包括背衬构件、含有化合物和任选的载体的贮器、任选的速率控制屏障,以在较长的时间段内以受控的和预定的速率将化合物递送至宿主的皮肤,以及将装置固定至皮肤的部件。还可以使用基质透皮制剂。
对于口服给药,药物组合物或药物或食品或食品补充剂可以采取例如片剂或胶囊的形式,片剂或胶囊可以通过常规方法用药学上可接受的赋形剂制备。优选片剂和明胶胶囊,其包含活性成分,即β-半乳糖苷酶、分泌β-半乳糖苷酶的细菌培养物(如嗜热链球菌培养物),或培养物的提取物,尤其包含β-半乳糖苷酶的提取物,以及(a)稀释剂或填充剂,例如乳糖,右旋糖,蔗糖,甘露糖醇,山梨糖醇,纤维素(例如乙基纤维素,微晶纤维素),甘氨酸,果胶,聚丙烯酸酯和/或磷酸氢钙,硫酸钙,(b)润滑剂,例如二氧化硅,滑石,硬脂酸,硬脂酸镁或钙盐,硬脂酸金属盐,胶体二氧化硅,氢化植物油,玉米淀粉,苯甲酸钠,乙酸钠和/或聚乙二醇;对于片剂,还可以有(c)粘合剂,例如硅酸镁铝,淀粉糊,明胶,黄蓍胶,甲基纤维素,羧甲基纤维素钠,聚乙烯吡咯烷酮和/或羟丙基甲基纤维素;如果需要还可以有(d)崩解剂,例如淀粉(例如马铃薯淀粉或淀粉钠),乙醇酸,琼脂,海藻酸或海藻酸钠盐,或泡腾混合物;(e)润湿剂,例如月桂基硫酸钠,和/或(f)吸收剂、着色剂、调味剂和甜味剂。
片剂可以根据本领域已知的方法进行薄膜包衣或肠溶包衣。用于口服给药的液体制剂可以采取例如溶液,糖浆或悬浮液的形式,或者它们可以作为干燥产品提供,用于在使用前用水或其它合适的媒介物复原。这种液体制剂可以通过常规方法用药学上可接受的添加剂制备,所述添加剂例如悬浮剂,例如山梨醇糖浆、纤维素衍生物或氢化食用脂肪;乳化剂,例如卵磷脂或阿拉伯胶;非水性媒介物,例如杏仁油,油酯,乙醇或分馏植物油;和防腐剂,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯或山梨酸。制剂还可以适当地含有缓冲盐,调味剂,着色剂和/或甜味剂。如果需要,可以适当地配制用于口服给药的制剂以提供活性化合物的控制释放。为了在食品中使用,本申请的组合物或活性成分(例如,β-半乳糖苷酶、能够产生β-半乳糖苷酶的细菌细胞、细菌细胞的活培养物或培养物的含有β-半乳糖苷酶的提取物)可以直接添加到常规食品(如补充剂)中或可以混合到饮料或零食中。
本申请的活性化合物和活性剂可以配制用于通过注射(例如通过推注或连续输注)的肠胃外给药。用于注射的制剂可以单位剂型提供,例如在安瓿或多剂量容器中,可以添加防腐剂。可注射组合物优选为水性等渗溶液或悬浮液,栓剂优选由脂肪乳剂或悬浮液制备。组合物可以是经过灭菌的和/或含有辅剂,例如防腐剂,稳定剂,湿润剂或乳化剂,溶解促进剂,用于调节渗透压的盐和/或缓冲剂。或者,活性成分(例如,β-半乳糖苷酶、能够产生β-半乳糖苷酶的细菌细胞、细菌细胞的活培养物或含有β-半乳糖苷酶的培养物提取物)可以为粉末形式,用于在使用前用合适的媒介物(例如无菌无热原水)复原。此外,它们还可以含有其它有治疗价值的物质。组合物可以分别根据常规的混合、制粒或包衣方法制备,并且含有约0.1%至75%,优选约1%至50%,或约5%至25%的源自产生β-半乳糖苷酶的细菌培养物(例如嗜热链球菌培养物)的组合物或活性成分,例如β-半乳糖苷酶。
为了通过吸入给药,可以使用合适的推进剂(例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其它合适的气体),以来自加压包装或喷雾器的气溶胶喷雾形式方便地递送来自产生β-半乳糖苷酶的细菌培养物(如嗜热链球菌培养物)的组合物或活性成分,例如,β-半乳糖苷酶。在加压气溶胶的情况下,剂量单位可以通过提供递送计量的量的阀来确定。用于吸入器或吹入器的例如明胶的胶囊和药筒可以配制成含有化合物和合适的粉末基质(例如乳糖或淀粉)的粉末混合物。
本申请的化合物或活性成分还可以配制成直肠组合物,例如栓剂或保留灌肠剂,例如含有常规栓剂基质,例如可可脂或其它甘油酯。
此外,化合物或活性成分可以配制为贮库制剂。这种长效制剂可通过植入(例如皮下或肌内)或通过肌内注射给药。因此,例如,化合物或活性成分可以与合适的聚合物或疏水材料(例如作为在可接受的油中的乳液)或离子交换树脂一起配制,或作为微溶衍生物,例如作为微溶盐配制。
在一些情况下,本申请的药物组合物或药物包含(i)有效量的如本文所述的组合物,其能抑制癌细胞(尤其是结肠癌细胞)的增殖或促进癌细胞死亡,和(ii)另一种治疗剂,尤其是已知的抗癌药物,例如针对癌症(包括结肠癌)的化疗剂。当与本申请的组合物或活性成分一起使用时,此类治疗剂可单独、相继或与一种或多种其它此类治疗剂(例如,第一治疗剂、第二治疗剂和本申请的组合物)组合使用。施用可以通过相同或不同的施用途径,或在相同的药物制剂中一起施用。
III.组合物和套装产品
本申请提供了用于实施本文所述的方法以处理个体的癌症(特别是结肠癌)或降低癌症发展的风险的组合物和套装产品。例如,用于治疗或预防应用的组合物通常含有(1)有效量的β-半乳糖苷酶,活的分泌β-半乳糖苷酶的细菌(如嗜热链球菌),分泌β-半乳糖苷酶的细菌培养物(如嗜热链球菌培养物),或培养物的提取物,特别是含有β-半乳糖苷酶的提取物;和(2)载体或赋形剂,尤其是适于口服给药的制剂的载体或赋形剂。例如,这种细菌培养物(如嗜热链球菌培养物)的一种提取物是基本上不含细菌细胞(例如,嗜热链球菌和/或其它细菌细胞),但保留由分泌β-半乳糖苷酶的细菌(例如,嗜热链球菌)分泌的分子量大于100kDa的化合物(包括β-半乳糖苷酶)的提取物。在一些情况下,组合物被配制用于口服给药或直肠栓剂。任选地,组合物还包含第二治疗有效药剂,例如已知对癌症治疗有效的化疗剂。
用于实施本申请的处理方法的套装产品通常包括(1)含有本申请的组合物的第一容器,例如,所述组合物包含有效量的β-半乳糖苷酶、分泌β-半乳糖苷酶的活细菌(如嗜热链球菌)、分泌β-半乳糖苷酶的细菌培养物(如嗜热链球菌培养物)或此类培养物的提取物,例如,所述提取物基本上不含细菌(例如,嗜热链球菌和/或其它细菌细胞),但保留由嗜热链球菌分泌的分子量大于100kDa的化合物(包括β-半乳糖苷酶)的提取物;和(2)第二容器,其含有有效量的第二治疗有效剂,例如已知有效用于癌症治疗的化疗剂。套装产品还可以包括指导使用者适当地分配组合物的说明书手册。
实施例
以下实施例仅以举例说明的方式提供,而不是以限制的方式提供。本领域的技术人员能容易认识到可改变或修改以产生基本上相同或类似结果的各种非关键参数。
实施例1:嗜热链球菌及其对CRC的抑制作用
说明
本申请的发明人已经将嗜热链球菌及其分泌的分子鉴定为用于预防或治疗CRC的新预防剂或治疗剂。更具体地,本申请的发明人证实,将嗜热链球菌与结肠细胞共培养可以在体外和体内抑制癌细胞增殖。细菌分泌的化合物在体外和体内可以具有相同的效果。此外,分泌的分子可以诱导程序性细胞死亡,并在G0/G1期引起细胞周期停滞。施用这种特异性益生菌可以防止动物中CRC的形成。因此,嗜热链球菌及其分泌的分子可用于预防和治疗CRC。
材料和方法
菌株和培养条件
嗜热链球菌[ATCC 19258]购自美国组织培养物保藏中心(Manassas,VA)并在脑心浸液(Brain Heart Infusion,BHI)培养基(CM1135B;Thermo Fisher Scientific,WestPalm Beach,FL)在有氧条件下37℃培养24小时。将非致病性人共生肠细菌大肠杆菌菌株MG1655用作对照,并在与嗜热链球菌相同的条件下培养。通过同源重组构建突变嗜热链球菌(LacZ敲除),并在选择性抗生素(50μg/ml卡那霉素)BHI培养基中培养。
细胞培养物
CRC细胞系HCT116、HT29和Caco-2获自美国典型培养物保藏中心。人正常结肠上皮细胞系NCM460获自INCELL Corporation(San Antonio,TX)。所有细胞系在补充10%(体积/体积)胎牛血清(FBS)、1%青霉素/链霉素的高葡萄糖DMEM(Gibco BRL,Grand Island,NY)中在含有5%CO
条件化培养基的制备
当细菌密度达到A600nm处OD=0.5时,将细菌培养基离心(1,000×g,15min),并通过0.2μm孔径过滤器过滤,得到条件化培养基。
抗肿瘤分子的分离
用分子量截止型离心柱(Merck KGaA,Darmstadt,德国)对制备的条件化培养基进行分离。通过使条件化培养基离心通过100,000NMWL膜来获得>100Kda的组分。
抗肿瘤分子的表征
使抗肿瘤分子被蛋白酶K在55℃下消化2小时或在100℃下热灭活30分钟。然后将蛋白酶K在95℃灭活10分钟。
质谱用银染
用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(5%)(SDS-PAGE)分离抗肿瘤分子。按照制造商(Thermo Scientific,Rockford,USA)提供的说明进行银染。染色后,取出>100KDa组分条带,并进行凝胶内消化。对获得的上清液进行MS分析。
质谱仪
将组分在甲醇中稀释,并以3μl/min注入到Nano Frontier eID液相色谱质谱仪(日立高技术公司,日本)中。根据已有的数据库对检测到的信号进行分析。
集落形成试验
在用St.CM(1%St.CM,配制于DMEM)处理后,将结肠细胞(每孔1000个)接种在六孔板。脑心灌注(BHI)和大肠杆菌的条件化培养基(Ec.CM)用作对照。每3天更换一次处理培养基。培养14-18天后,用70%乙醇固定细胞并用0.5%结晶紫溶液染色。计数具有超过50个细胞的集落。所有实验按照三个平行样品进行三次。
细胞活力测定
通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑(MTT)实验确定细胞活力。对于96孔板中的每个孔,接种1000个细胞,并用1%体积/体积的细菌条件化培养基或直接用细菌处理细胞。在24、48和72小时后,将10μL MTT(5mg/ml)试剂分别加入到培养基中。然后将细胞在37℃下孵育,直至细胞内紫色甲瓒晶体可见,然后将其用DMSO溶解。在570nm处测量样品的吸光度。
流式细胞术
对于细胞周期分析,用70%乙醇固定处理过的细胞过夜。然后将细胞用50μg/mL碘化丙啶(PI)(BD Pharmingen,San Jose,CA,USA)在4℃在黑暗中染色30分钟。通过FACSAria细胞分类器(BD Biosciences,Franklin Lakes,NJ,USA)计数10000个细胞,并通过ModFit3.0软件(Verity Software House,Topsham,ME,USA)分析细胞周期分布。使用膜联蛋白V细胞凋亡测定评价细胞凋亡细胞的比例。收集经处理的细胞并重悬于100μL膜联蛋白结合缓冲液(10mM HEPES、140mM NaCl、2.5mM CaCl
Ki-67染色
通过用抗Ki-67抗体(ab833;Abcam,Cambridge,UK)的免疫过氧化物酶染色测定细胞增殖。通过用非免疫血清替换第一抗体来实施阴性对照。通过将阳性染色细胞的数目计数为肿瘤细胞总数的百分比来确定增殖指数。每次计数至少1000个肿瘤细胞。
Western印迹分析
用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(6%-12%)(SDS-PAGE)分离总蛋白。然后将SDS-PAGE中的蛋白质转移到聚偏二氟乙烯(PVDF)膜(EMD Millipore,Billerica,MA,USA)上约1-2小时,然后在室温下用含10%脱脂奶的0.05%Tris-基盐水-Tween 20封闭2小时。将膜与第一抗体在4℃孵育过夜,然后与第二抗体在RT孵育1小时。通过ECL+Plus蛋白质印迹检测试剂(GE Healthcare)检测蛋白质条带强度。
组织病理学
在动物实验结束时,将新鲜组织在滤纸上压平,并在10%缓冲福尔马林中固定过夜,用于组织病理学评估。5μm的切片用H&E染色,由有经验的病理学家的组织学诊断。根据世界卫生组织对消化系统肿瘤的最新分类确定异型增生。
体内致瘤性-异种移植肿瘤模型
将HCT116(含1×10
体内致瘤性-结肠炎相关癌症模型
对6周龄雄性常规C57BL/6野生型小鼠进行6次AOM连续注射(10mg/kg,腹膜内注射),每次注射间隔1周,然后在饮用水中添加或不添加抗生素混合物(0.1g/L万古霉素,0.1g/L新霉素,0.1g/L青霉素和0.2g/L甲硝唑),持续2周。然后每天给小鼠喂饲1×10
体内致瘤性-APC
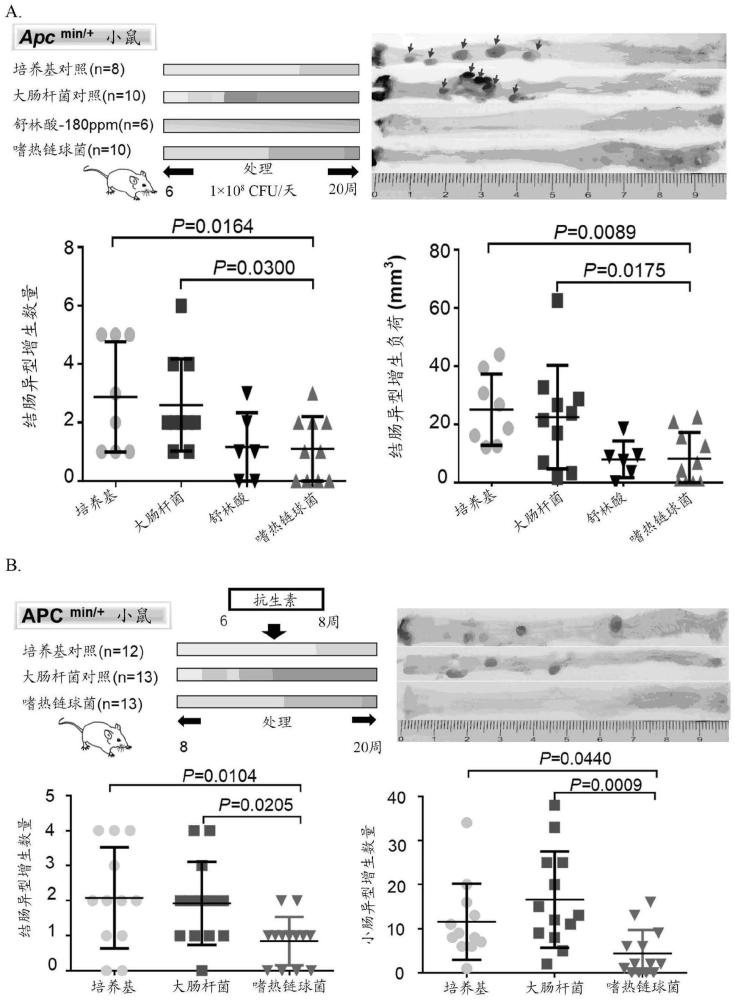
从Jackson Laboratory(Bar Harbor,ME,USA)购买C57BL/6J-APCMin/J小鼠,这种小鼠在肿瘤抑制基因APC中具有种系突变并自发发育肠息肉,并且目前在香港中文大学的动物设施中饲养。通过常规等位基因特异性PCR测定进行基因分型。在8周龄的雄性APC
统计分析
数据表示为来自3个独立实验的平均值±标准偏差(SD)。使用独立的学生t检验比较两组之间的差异。使用单向方差分析(ANOVA)比较多个组之间的差异。P值<0.05的差异被认为是统计学上显著的。使用GraphPad Prism6.0版进行所有测试。
嗜热链球菌突变株构建
通过同源重组构建了突变嗜热链球菌(LacZ敲除)。从pCR2.1-TOPO质粒扩增卡那霉素抗性基因片段。从嗜热链球菌的基因组DNA中分别扩增出大约1kb的上游和下游的序列,具有500bp空间。随后,用限制性内切酶切割3个DNA片段,包括编码β-半乳糖苷酶的LacZ基因上游1kb左右的序列和900bp卡那霉素抗性基因和LacZ基因下游1kb左右的序列,然后依次连接。使用T-A克隆技术将重组DNA片段连接到pCR2.1-TOPO质粒中。通过电穿孔(1.8kV,200Ω和25μF)将重组pCR2.1-TOPO质粒转化到嗜热链球菌的感受态细胞中。通过将嗜热链球菌暴露于含有20mM D-L苏氨酸的50ml BHI培养液2-2.5小时以达到0.2-0.3的光密度(OD)600来构建感受态细胞。将细胞沉淀(4500×g,15分钟)用5ml电穿孔缓冲液(7mMHEPES,1mM MgCl
结果
嗜热链球菌降低发生或不发生微生物群耗竭的Apc
为了评价嗜热链球菌在小鼠体内是否具有抗致瘤作用。6周龄非肠道菌群缺乏和肠道菌群缺乏的APC
嗜热链球菌降低小鼠中AOM诱导的结肠肿瘤发生
为了进一步观察嗜热链球菌是否能减轻小鼠的肿瘤发生,在6次AOM注射后给小鼠喂饲嗜热链球菌20周。在实验结束时检查每只小鼠的整个肠道。与APC
嗜热链球菌抑制结肠癌细胞增殖
为了证实嗜热链球菌对结肠细胞的抗肿瘤作用,进行MTT以检测细胞活力。结肠癌细胞系HCT116、HT29和Caco-2以及正常结肠上皮细胞系NCM460用嗜热链球菌(感染复数(MOI)=50、100、200)处理4小时。大肠杆菌菌株MG1655和PBS用作对照。如图3所示,嗜热链球菌以时间(B图)和MOI(A图)依赖性方式造成结肠癌细胞系中细胞增殖的显著降低。然而,对于正常上皮细胞,抑制作用没有显著差异。
杀死的嗜热链球菌无效果
为了确定抗肿瘤作用是由嗜热链球菌本身还是其产物引起的,通过高压灭菌杀死活的嗜热链球菌,然后将杀死的细菌暴露于结肠细胞。然而,没有观察到结肠癌细胞的活力降低(图4,其中A图按MOI梯度,B图按时间梯度),这表明抗肿瘤作用需要活的嗜热链球菌。
嗜热链球菌的条件化培养基(St.CM)抑制结肠癌细胞的增殖
为了阐明细菌产物的抗肿瘤作用,通过离心和使用0.22μm膜的过滤除去培养物上清液中的所有细菌体和碎片以获得条件化培养基。将结肠癌细胞HCT116、HT29、Caco-2和正常结肠上皮细胞系NCM460与条件化培养基以不同剂量(12.5、25、50%)共培养连续4天。MTT测定表明,St.CM以时间(图5中A图)和剂量(图5中B图)依赖性方式抑制结肠癌细胞的增殖。所有这些数据揭示了分泌的分子表现出生长抑制作用,而不是细菌体或碎片。
St.CM促进结肠癌细胞凋亡
肿瘤细胞活力的抑制通常与伴随的细胞死亡途径的活化有关。使用膜联蛋白V和碘化丙啶(PI)双重染色的流式细胞术检查细胞凋亡对所观察到的St.CM的生长抑制的贡献。结果显示,与BHI或Ec.CM处理的细胞相比,St.CM处理的细胞中的凋亡细胞数目增加(图6)。在正常结肠上皮细胞系NCM460中也观察到这种效果。这些发现表明St.CM诱导的细胞凋亡在结肠癌细胞的抗肿瘤作用有贡献。
肿瘤抑制性益生菌分泌分子的分离
为了进一步测定源自嗜热链球菌的抗肿瘤组分,使用100-KDa分子量截断(MWCO)膜分离St.CM。然后将细胞分别暴露于1%(体积/体积)的>100-KDa组分或<100-KDa组分24小时。
St.CM>100-KDa组分抑制结肠癌细胞的活力
如图7中A图所示,MTT测定显示,St.CM>100-KDa组分显示出显著的抗肿瘤作用,这表明从嗜热链球菌释放的St.CM>100-KDa分子抑制结肠癌细胞的活力。图7中B、C和D图中的集落形成、增殖细胞核抗原(PCNA)蛋白水平和Ki-67免疫染色都揭示了相同的结果。
St.CM>100-KDa组分促进结肠癌细胞凋亡
在用膜联蛋白V和碘化丙啶(PI)染色处理的细胞之后,使用流式细胞仪检测St.CM>100-KDa组分对细胞凋亡的影响。如图8中A图所示,与BHI>100-KDa组分处理组相比,St.CM>100-KDa组分处理的HCT116细胞中的凋亡细胞数量显著增加。在Caco-2细胞中也观察到这种作用,与对照组相比,凋亡细胞的比例也显著增加。与这一发现一致,St.CM>100-KDa组分也导致HCT116和HT29细胞系中切割的半胱天冬酶3和裂解的聚(ADP-核糖)聚合酶(PARP)的蛋白表达的增强(图8中B图)。这些数据证实了St.CM>100-KDa组分对细胞活力的抑制作用。
St.CM>100-KDa组分在G0/G1期停滞细胞周期
为了确定St.CM>100-KDa组分抑制细胞增殖的分子机理,在碘化丙啶(PI)染色后,通过流式细胞术评价St.CM>100-KDa组分对细胞周期分布的影响。如图9所示,St.CM>100-KDa组分的处理导致HCT116和Caco-2细胞的S期和G2期的数目减少,两种细胞系的G0/G1期细胞的增加(P<0.001)。这些发现表明,由St.CM>100-KDa组分所诱导的细胞凋亡连同细胞周期停滞在结肠癌细胞的生长抑制中有贡献。
St.CM>100-KDa组分抑制裸鼠中皮下异种移植模型的肿瘤生长
为了证实St.CM>100-KDa组分在CRC中的肿瘤抑制作用,测试St.CM>100-KDa组分是否能够抑制裸鼠体内CRC细胞的生长。将3×10
嗜热链球菌分泌的>100-KDa组分的表征
进一步表征St.CM>100-KDa组分中的抗肿瘤化合物。首先,用蛋白酶K(PK,50μg/mL)消化St.CM>100-KDa组分,通过MTT测定,在细胞生长培养基中以1%(vol/vol)的浓度评价PK灭活的St.CM>100-KDa组分的24小时抑制作用。如图11中A图所示,St.CM>100-KDa组分的抑制作用仅存在于未消化的组中。在PK处理组中,BHI>100-KDa组分与St.CM>100-KDa组分之间没有显著差异,表明St.CM>100-KDa组分中的抗肿瘤分子是蛋白质。为了进一步验证该结果,将St.CM>100-KDa组分在100℃水浴中煮沸30分钟以使分离的组分中的蛋白质失活。再次进行MTT测定,结果示于图11中B图中,得到相同的结论:St.CM>100-KDa组分中的抗肿瘤分子是蛋白质。
益生菌分泌蛋白的鉴定
为了揭示哪种或哪些蛋白质具有抗肿瘤作用,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(5%)(SDS-PAGE)分离分泌的蛋白质,并在凝胶消化中再回收,然后进行质谱分析。HPLC光谱表明该蛋白是β-半乳糖苷酶(图12中A图)。为了验证该结果,测定了益生菌分泌的>100-KDa组分中β-半乳糖苷酶的活性。如图12中B图所示,与Ec.CM、BHI>100-Kda、BHI<100-KDa和St.CM<100-KDa相比,St.CM>100-KDa组分中β-半乳糖苷酶的活性显著更高。这些结果表明,从St.CM分离的抗肿瘤组分含有大量的β-半乳糖苷酶。
嗜热链球菌的抗肿瘤作用由β-半乳糖苷酶的分泌介导
为了确定β-半乳糖苷酶的功能参与性,本申请的发明人通过同源重组构建了嗜热链球菌突变株(LacZ敲除),该突变株在功能上消除了嗜热链球菌的β-半乳糖苷酶的产生。如图13所示,将LacZ敲除的嗜热链球菌(ST-KO)口服管饲到APC
将本申请中引用的所有专利、专利申请和其它出版物(包括GenBank登录号或等同物)通过援引方式整体并入本文,用于所有目的。
参考文献列表
1.Siegel RL,Miller KD,Jemal A.Cancer Statistics,2017.CA:a cancerjournal for clinicians.Jan2017;67(1):7-30.
2.Siegel RL,Miller KD,Fedewa SA,et al.Colorectal cancer statistics,2017.CA:a cancer journal for clinicians.May 062017;67(3):177-193.
3.Daniel SG,Ball CL,Besselsen DG,Doetschman T,Hurwitz BL.FunctionalChanges in the Gut Microbiome Contribute to Transforming Growth Factor beta-Deficient Colon Cancer.mSystems.Sep-Oct 2017;2(5).
4.Healy AR,Herzon SB.Molecular Basis of Gut Microbiome-AssociatedColorectal Cancer:A Synthetic Perspective.Journal of the American ChemicalSociety.Oct 12 2017.
5.Purcell RV,Visnovska M,Biggs PJ,Schmeier S,Frizelle FA.Distinct gutmicrobiome patterns associate with consensus molecular subtypes of colorectalcancer.Scientific reports.Sep14 2017;7(1):11590.
6.Golombos DM,Ayangbesan A,O'Malley P,et al.The Role of GutMicrobiome in the Pathogenesis of Prostate Cancer:a Prospective,PilotStudy.Urology.Sep 06 2017.
7.Vogtmann E,Hua X,Zeller G,et al.Colorectal Cancer and th eHuman GutMicrobiome:Reproducibility with Whole-Genome Shotgun Sequencing.PloSone.2016;11(5):e0155362.
8.Denipote FG,Trindade EB,Burini RC.[Probiotics and prebiotics inprimary care for colon cancer].Arquivos de gastroenterologia.Jan-Mar 2010;47(1):93-98.
9.Ohara T,YoshinoK,Kitajima M.[Pre-and probiotics increase host-cellimmunological competence,improve bowel movement,and prevent the onset ofcolon cancer--an analysis based on movements of intestinal microbiota].Rinshobyori.The Japanese journal of clinical pathology.Jun 2009;57(6):533-541.
10.Liong MT.Roles of probiotics and prebiotics in colon cancerprevention:Postulated mechanisms and in-vivo evidence.International journalof molecular sciences.May 2008;9(5):854-863.
11.Roller M,Clune Y,Collins K,Rechkemmer G,Watzl B.Consumption ofprebiotic inulin enriched with oligofructose in combination with theprobiotics Lactobacillus rhamnosus and Bifidobacterium lactis has minoreffects on selected immune parameters in polypectomised and colon cancerpatients.The British journal of nutrition.Apr 2007;97(4):676-684.
