FBXL20在抑郁症诊治中的应用
文献发布时间:2024-01-17 01:21:27
技术领域
本发明属于生物医药和分子生物学技术领域,具体FBXL20在抑郁症诊治中的应用。
背景技术
本发明背景技术中公开的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
抑郁症是以持续的情绪低落、兴趣减退、思维迟缓等为主要特征的一类常见的精神障碍。抑郁症具有高度异质性和复杂性,并且具有很高的复发性和自杀率。尽管抑郁症的治疗方法包括抗抑郁药物、抗精神药物、循证心理治疗、非药物躯体治疗和一系列增强策略等多种多样的治疗方式,但是相当大比例的患者的治疗效果不佳。因此,急需进一步探究抑郁症的发病机制,寻找更有效的治疗方式。
抑郁症存在众多发病机制的假说,包括单胺类假说、神经营养因子假说、突触可塑性假说等。但是这些发病机制并不能完全解释抑郁症患者的临床表现,仍有相当大比例的患者治疗效果不佳。因此,抑郁症可能具有更加复杂的发病机制。近年来的研究发现,突触可塑性可能参与抑郁症的发生发展。那么,突触可塑性是如何导致抑郁样行为的产生呢?以及应激状态下导致突触可塑性损伤的机制又是什么呢?这些都尚未阐明。为了探究突触可塑性在抑郁症发生发展中的作用,本发明利用正常和抑郁样大鼠海马CA1区组织进行了蛋白组学检测,进一步分析发现与突触囊泡转运谷氨酸功能相关的蛋白VGLUT1以及突触囊泡在突触前膜活动区着位功能相关的蛋白VAMP1有显著的差异性表达。
VGLUT1(Slc17a7/BNPI)是谷氨酸转运蛋白,位于谷氨酸能神经元突触前末梢的突触囊泡膜上,能介导谷氨酸进入突触囊泡,在杏仁核、海马、大脑皮层等脑区表达。已有文献报道,尸检研究结果显示VGLUT1还表达减少。这表明VGLUT1在抑郁症发病发展中有重要作用,但是具体作用机制不清。
VAMP1(Synaptobrevin1/Syb1)在大脑广泛性表达,主要存在于兴奋性和抑制性神经元突触末梢,通过其C末端结构域锚定在囊泡膜中,并在与突触囊泡对接到突触前膜活动区之前与突触素相互作用。当对接发生时,与突触融合蛋白以及SNAP-25结合,形成SNARE复合体,参与突触囊泡膜与突触前膜的融合断裂以及神经递质释放。因此,VAMP1可以影响突触可塑性,但是VAMP1在抑郁症发病发展中的具体作用机制不清。
发明内容
针对现有技术中的不足,本发明的目的在于提供靶向FBXL20在抑郁症治疗中的应用。本发明通过研究发现,FBXL20参与抑郁症的发生发展,靶向调控FBXL20,可有效改善抑郁行为,发挥保护作用,改善疾病进程,实现抗抑郁疗效。基于上述研究成果,从而完成本发明。
具体的,本发明技术方案如下:
本发明的第一个方面,提供检测FBXL20编码基因及其表达产物的物质在制备筛查、(辅助)诊断、监测和预测抑郁症进展的产品中的应用。
其中,所述FBXL20编码基因的表达产物显然可以是FBXL20蛋白(F-box andleucine-rich repeat protein 20,亦称SCRAPPER),其是一种可以结合底物以响应各种刺激的E3泛素连接酶,含有F盒,富含亮氨酸重复序列和C端结构域,属于F-box蛋白家族,在皮质和海马体的神经元胞体和突触前末梢表达。本发明通过研究证明,抑郁大鼠海马CA1区FBXL20表达显著增加,从而表明FBXL20参与了抑郁的发生发展。
本发明的第二个方面,提供一种用于筛查、(辅助)诊断、监测和预测抑郁症进展的系统,所述系统包括:
i)分析模块,所述分析模块包含:用于确定受试者的待测样品中选自FBXL20表达水平的检测物质,以及;
ii)评估模块,所述评估模块包含:根据i)中确定的所述FBXL20表达水平判断所述受试者的患病情况。
本发明的第三个方面,提供上述FBXL20作为靶点在制备和/或筛选抑郁症药物中的应用。
其中,所述筛选抑郁症药物的方法包括:
1)采用候选物质处理表达和/或含有所述FBXL20的体系;设置不采用候选物质处理的平行对照;
2)完成步骤1)后,检测体系中所述FBXL20的表达水平;与平行对照相比,如果采用候选物质处理的体系中所述FBXL20的表达量显著降低,所述候选物质可作为候选的抑郁症药物。
本发明的第四个方面,提供抑制FBXL20编码基因及其表达产物表达的物质物质在如下任意一种或多种中的应用:
a1)制备抑制VGLUT1和/或VAMP1表达的产品。
a2)制备维持突触传递正常化以及修复突触可塑性损伤的产品。
a3)制备修复神经元结构和功能异常的产品。
a4)制备预防和/或治疗抑郁症的产品。
上述一个或多个技术方案的有益技术效果:
(1)上述技术方案首次证实FBXL20-VGLUT1/VAMP1信号通路参与调控大鼠海马突触可塑性及抑郁样行为的发生。
(2)上述技术方案首次靶向FBXL20,对其进行基因调控,证实其在抑郁症治疗中的有益应用。
(3)上述技术方案完善了抑郁症的发病机制,为抑郁症临床治疗药物的研发提供了潜在的新靶点及研究依据,开发FBXL20-VGLUT1/VAMP1信号通路的用途具有更大的临床和社会实用价值。
附图说明
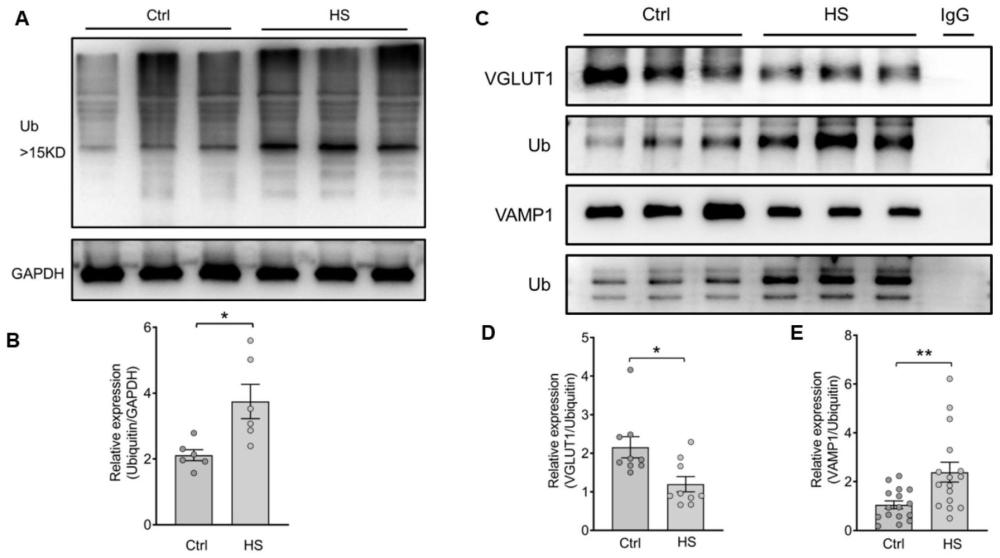
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。图1为本发明实施例中抑郁样大鼠海马VGLUT1和VAMP1蛋白表达降低的示意图;其中,(A)蛋白质组学分析得到的差异蛋白热图。(B)火山图表明差异表达的蛋白质。FC,差异倍数。(C)海马CA1区VGLUT1和VAMP的代表性荧光图像。(D)不同组间VGLUT1和VAMP荧光强度分析[VGLUT1,F(2,15)=76.66,P<0.0001];[VAMP1,F(2,15)=108.4,p<0.0001。N=6/组]。ns组差异无统计学意义(P>0.05);***P<0.05,P<0.01,******P<0.001,P<0.0001。Ctrl,:正常对照组大鼠;LS:低敏感亚群大鼠;HS:高敏感亚群大鼠,即抑郁样大鼠。图2为本发明实施例中抑郁样大鼠VGLUT1和VAMP1表达的降低可能是泛素化增加导致的示意图;其中,(A)转录组学中mRNA表达火山图。FC,差异倍数。(B)VGLUT1和VAMP1 mRNA表达的Q-PCR验证。(C)火山图显示差异表达的蛋白质。FC,差异倍数。(D)GO功能分类注释提示差异表达蛋白可能与翻译后修饰通路相关。(E、F)CUMS暴露增加了FBXL20蛋白表达水平[F(2,18)=3.904,P=0.039,每组N=7];(G-I)HS组大鼠泛素化VGLUT1和VAMP1水平升高(t=2.829,P=0.0121;t=3.062,P=0.0046)。(J-L)皮质酮(CORT)诱导的神经元应激模型中泛素化VAMP1和VAMP1水平升高(t=5.762,P=0.0045;t=3.011,P=0.0395)。*p<0.05,**p<0.01。Ctrl:正常对照组大鼠;LS:低敏感亚群大鼠;HS:高敏感亚群大鼠,即抑郁样大鼠。
图3为本发明实施例中(A,B)在CORT诱导的神经元应激模型中泛素化蛋白的水平明显增加[t=2.980,P=0.0138,每组N=6]。(C,D,E)CORT诱导的神经元应激模型中泛素化VGLUT1和VAMP1水平升高(t=5.762,P=0.0045;t=3.011,P=0.0395)。ns为无显著性差异(P>0.05),*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
图4为本发明实施例中敲低大鼠海马CA1区FBXL20,增加VGLUT1和VAMP1的表达并逆转大鼠的抑郁样行为的示意图;其中,(A)抑郁样大鼠病毒注射方案。(B)AAV载体的构建示意图。(C)AAV载体双侧海马注射部位示意图。比例尺,2nm。(D,E)FBXL20敲低效率验证[F(3,44)=5.851,P=0.0019,每组N=12]。ns为无显著性差异(P>0.05),*P<0.05,**P<0.01,***P<0.001,****P<0.0001。(F,G)免疫蛋白印迹实验代表性图片和柱状统计图显示在大鼠海马CA1区敲低FBXL20后VGLUT1表达量[F(3,20)=7.975,P=0.0011,每组N=6]。(H,I)免疫蛋白印迹实验代表性图片和柱状统计图显示敲低FBXL20后VAMP1表达量[F(3,24)=7.664,P=
0.0009,每组N=7]。(J)蔗糖偏好实验显示在大鼠海马CA1区敲低FBXL20增加了HS组大鼠在SPT中的蔗糖消耗。[F(3,40)=71.68,P<0.0001,每组N=11]。(K)强迫游泳实验显示在大鼠海马CA1区敲低FBXL20降低了HS组大鼠在FST中的不动时间[F(3,40)=230.5,P<0.0001,每组N=11]。(L)各组大鼠在旷场实验中的代表性轨迹图。(M)各组大鼠在旷场实验中央区停留的时间[F(3,40)=31.31,P<0.0001]。(N)各组大鼠在旷场实验中移动的总路程[F(3,40)=3.266,P=0.311,每组N=11]。ns为无显著性差异(P>0.05),*P<0.05,**P<0.01,***P<0.001,****P<0.0001。WT:野生型对照组;LS低敏感亚群;HS:高敏感亚群,即抑郁样大鼠。
图5为本发明实施例中敲低大鼠海马FBXL20,挽救抑郁样大鼠突触可塑性损伤的示意图;其中,(A)大鼠海马CA1区代表性电镜图像。比例尺:500nm。(B)在抑郁样大鼠海马CA1区敲低FBXL20增加HS组大鼠CA1区突触数量[F(3,20)=106.4,P<0.0001;N=6/组]。(C)不同组别的代表性电镜图像。比例尺:250nm(上方图);60nm(下方图)。(D)突触前膜活性区长度的变化[F(3,100)=18.38,P<0.0001;N=26/组]。(E)突触前膜活性区突触囊泡(SV)数量的变化[F(3,100)=79.29,P<0.0001;N=26/组]。***P<0.05,P<0.01,******P<0.001,P<0.0001。WT对照组;LS低敏感亚群;HS:高敏感亚群,即抑郁样大鼠。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
如前所述,VGLUT1和VAMP1在抑郁症发病发展中有重要作用,但是具体作用机制不清。
为了探究VGLUT1和VAMP1蛋白表达水平降低的原因,进行了转录组学检测,结果发现VGLUT1和VAMP1的mRNA没有显著性差异表达,这提示VGLUT1和VAMP1的降低可能是转录后或翻译后修饰导致的。然后,对蛋白测序的结果进行了二次分析,发现确实有较多的差异性表达蛋白富集在翻译后修饰途径。进一步分析发现参与泛素介导的降解途径的E3泛素连接酶FBXL20的表达水平升高,因此推测,FBXL20是否通过泛素化途径降解VGLUT1和VAMP1。
进一步实验发现:外界环境改变所产生的慢性应激刺激通过上调抑郁症大鼠海马CA1脑区的E3泛素连接酶-FBXL20的表达水平,导致突触相关蛋白-VGLUT1和VAMP1的降解增加。VGLUT1表达水平的降低导致突触囊泡对神经递质-谷氨酸的摄取减少,VAMP1表达水平的降低导致突触囊泡在突触前膜上的着位以及突触囊泡膜与突触前膜的融合断裂减少;这些变化使突触前膜释放到突触间隙的谷氨酸减少,导致突触可塑性损伤的产生,最终使抑郁样大鼠产生抑郁样行为。
即上述结果揭示了环境压力源可以通过FBXL20/VGLUT1和/或FBXL20/VAMP1信号通路,转化为大鼠海马CA1脑区突触结构和功能的损伤,最终导致抑郁样行为的产生,进一步完善抑郁症的发病理论。采用基因治疗的方式靶向FBXL20,通过基因调控技术使其表达上调或下调,从多个角度证明FXL20在抑郁症发病及治疗中的关键作用,为临床抗抑郁治疗提供了新策略。
有鉴于此,本发明的一个典型具体实施方式中,提供检测FBXL20编码基因及其表达产物的物质在制备筛查、(辅助)诊断、监测和预测抑郁症进展的产品中的应用。
其中,所述FBXL20编码基因的表达产物显然可以是FBXL20蛋白(F-box andleucine-rich repeat protein 20,亦称SCRAPPER),其是一种可以结合底物以响应各种刺激的E3泛素连接酶,含有F盒,富含亮氨酸重复序列和C端结构域,属于F-box蛋白家族,在皮质和海马体的神经元胞体和突触前末梢表达。本发明通过研究证明,抑郁大鼠海马CA1区FBXL20表达显著增加,从而表明FBXL20参与了抑郁的发生发展。
所述检测FBXL20编码基因及其表达产物的物质包括但不限于基于高通量测序方法和/或基于定量PCR方法和/或基于探针杂交方法检测FBXL20编码基因转录的物质;或基于免疫检测方法检测FBXL20蛋白表达情况的物质。
本发明的一个或多个具体实施方式中,可以采用包括但不限于基因测序法、液相杂交、Northern Blot、miRNA表达谱芯片、原位杂交检测FBXL20编码基因的转录;采用包括但不限于Western Blot、ELISA、胶体金试纸条、蛋白芯片检测FBXL20蛋白的表达情况。
所述产品可以以引物、探针、核酸膜条、(基因或蛋白)芯片、制剂、试剂盒、检测装置和设备等任意现有已知形式存在。本领域技术人员可通过实际情况在不付出创造性劳动的前提下实现上述产品,因此上述产品均属于本申请的保护范围之内。
本发明的第二个方面,提供一种用于筛查、(辅助)诊断、监测和预测抑郁症进展的系统,所述系统包括:
i)分析模块,所述分析模块包含:用于确定受试者的待测样品中选自FBXL20表达水平的检测物质,以及;
ii)评估模块,所述评估模块包含:根据i)中确定的所述FBXL20表达水平判断所述受试者的患病情况。
其中,所述受试者可以为人或非人哺乳动物(如大鼠等),所述待测样品包括但不限于外周血以及脑相关组织及细胞(如海马体、神经元细胞)等。
本发明的第三个方面,提供上述FBXL20作为靶点在制备和/或筛选抑郁症药物中的应用。
所述抑郁症药物包括预防和/或治疗抑郁症的药物。
其中,所述筛选抑郁症药物的方法包括:
1)采用候选物质处理表达和/或含有所述FBXL20的体系;设置不采用候选物质处理的平行对照;
2)完成步骤1)后,检测体系中所述FBXL20的表达水平;与平行对照相比,如果采用候选物质处理的体系中所述FBXL20的表达量显著降低,所述候选物质可作为候选的抑郁症药物。
本发明的又一具体实施方式中,所述体系可为细胞体系、溶液体系、组织体系、器官体系或动物体系。
本发明的又一具体实施方式中,所述细胞体系中的细胞可以为神经元细胞;
本发明的又一具体实施方式中,所述组织体系中的组织可以为海马体;
本发明的又一具体实施方式中,所述器官体系中的器官可以为大脑;
本发明的又一具体实施方式中,所述动物体系中的动物可以为哺乳动物,如人、大鼠、小鼠、豚鼠、兔、猴、猩猩等。
本发明的第四个方面,提供抑制FBXL20编码基因及其表达产物表达的物质物质在如下任意一种或多种中的应用:
a1)制备抑制VGLUT1和/或VAMP1表达的产品。
a2)制备维持突触传递正常化以及修复突触可塑性损伤的产品。
a3)制备修复神经元结构和功能异常的产品。
a4)制备预防和/或治疗抑郁症的产品。
其中,所述抑制FBXL20编码基因及其表达产物的物质包括但不限于针对FBXL20的RNA干扰分子或反义寡核苷酸、小分子抑制剂、shRNA、siRNA,实施慢病毒感染或基因敲除(如CRISPR/Cas9)的物质以及针对FBXL20蛋白本身或其上下游分子的特异性抗体,如抗FBXL20抗体。
所述产品可以为药物、细胞(动物)模型或用于制备所述细胞(动物)模型的物质,所述物质可以为相关实验试剂(或试剂盒),所述实验试剂(或试剂盒)可供抑郁症的相关基础研究使用。
根据本发明,当所述产品为药物时,所述药物还包括至少一种药物非活性成分。
所述药物非活性成分可以是药学上通常使用的载体、赋形剂及稀释剂等。而且,根据通常的方法,可以制作成粉剂、颗粒剂、片剂、胶囊剂、混悬剂、乳剂、糖浆剂、喷雾剂等的口服剂、外用剂、栓剂及无菌注射溶液形式的剂型使用。
本发明的又一具体实施方式中,本发明的药物可通过已知的方式施用至体内。例如通过静脉全身递送或者局部注射递送到感兴趣组织中。可选地经由静脉内、经皮、鼻内、粘膜或其他递送方法进行施用。这样的施用可以经由单剂量或多剂量来进行。本领域技术人员理解的是,本发明中有待施用的实际剂量可以在很大程度上取决于多种因素而变化,如靶细胞、生物类型或其组织、待治疗受试者的一般状况、给药途径、给药方式等等。
本发明的又一具体实施方式中,所述药物施用对象可以是人和非人哺乳动物,如小鼠、大鼠、豚鼠、兔、狗、猴、猩猩等。
现结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可从商业途径得到。
实施例
实验方法
1.动物
从山东大学动物中心获得体重为160-180克雄性Wistar大鼠,将其分组并安置在可以自由地获得食物和水的12小时光照/12小时黑暗循环的笼子中。实验开始前,让大鼠适应这种环境1周。
2.动物模型
雄性Wistar大鼠通过6周慢性温和应激刺激,包括食物剥夺(24小时)、水剥夺(24小时)、足底电击(0.5mA,0.5秒)、笼子倾斜(45°,8小时)、湿被褥(24小时)、昼夜颠倒(24小时)、夹尾(1分钟)、冷水游泳(4℃,5分钟)和身体约束(2小时)。在6周的时间内每天将这些应激源随机安排给CUMS组。在CUMS的最后2周,给药组小鼠腹腔注射氟西汀(Sigma-Aldrich)。对照组大鼠不做任何处理。
3.药物治疗
氟西汀以10mg/ml的浓度溶解在无菌无内毒素盐水(NaCl,0.9%)中,连续2周腹腔内(ip)注射给药。
4.行为学测试
4.1.蔗糖偏好测试(SPT)在适应阶段,给予被单独安置的大鼠2瓶1%蔗糖溶液24小时,在随后的24小时内用含有白开水的瓶子替换1瓶1%蔗糖溶液,紧接着剥夺大鼠24小时的食物和水。在测试阶段,大鼠可以从两个不同的瓶子里自由获得白开水或1%蔗糖溶液,并记录下3小时内每种液体的摄入量。蔗糖偏好指数被定义为百分比(消耗的1%蔗糖溶液的体积/消耗的水和1%蔗糖溶液的总体积)来评价大鼠的快感缺失表型。
4.2.强迫游泳测试(FST)将每只大鼠单独放置在盛水的白色桶(高度,80厘米;直径,30厘米;温度,25℃)中进行15分钟游泳训练,并在24小时后进行5分钟的游泳测试。记录每只大鼠挣扎时间、游泳时间和静止时间。静止时间被用“行为绝望”的标准。
4.3.高架十字迷宫实验(EPM)高架十字迷宫距地面的高度约为50cm,由两个开臂(10*50cm
4.4.旷场试验(OFT)实验采用100cm*100cm*50cm的敞箱,内壁涂黑。实验时将大鼠如敞开的箱子的中心区域,令其自由探索5分钟,使用视频跟踪分析软件记录并分析大鼠的活动情况。大鼠的行走的总路程被定义为活动指标,中心区域的路程被定义为焦虑指标。
5.动物筛选
大鼠接受CMS治疗6周,然后将其细分为HS或LS动物组。如果CUMS大鼠在SPT、EPM、OFT中的测试值低于对照组大鼠的平均值与标准偏差的差值,则认为其为HS组大鼠,即具有抑郁样行为的大鼠。反之,该动物就被认为是LS组大鼠,因为它们表现出与无压力小鼠相当的行为。如果CUMS大鼠在FST中的测试值高于于对照组大鼠的平均值与标准偏差之和,则认为其为HS组大鼠,即具有抑郁样行为的大鼠。反之,动物就被认为是LS,组大鼠因为它们表现出与无压力小鼠相当的行为。
6.电子显微镜观察海马突触形态
大鼠在行为学测试后,用10%戊巴比妥钠(150mg/kg,ip)麻醉大鼠,取出双侧海马组织,修剪成1mm
7.蛋白质组学分析
取大鼠海马组织后进行裂解,分离蛋白质,然后使用荧光肽进行定量。在定量结果的基础上,取1μg样品进行液相色谱-串联质谱分析。酶解产物采用毛细管高效液相色谱法分离,然后使用Q Exactive HF-X质谱仪(Thermo Fisher Scientific)进行质谱分析。数据库从UniProt数据库下载。
8.转录组学分析
RNA富集是在海马组织裂解和蛋白质分离后进行的。Nanodrops去除rRNA以保证RNA的纯度,Qubit用于RNA浓度的精确定量,Agilent 2100用于RNA的精确检测。然后合成和纯化cDNA,进行PCR扩增,并使用AMPure XP珠子纯化PCR产物。得到了链特异性的cDNA文库。文库构建后,使用Qubit 3.0进行初步定量,将文库稀释至1ng/uL,使用Q-PCR精确定量文库的有效浓度(文库有效浓度>2nM)。对文库进行鉴定后,进行HiSeq测序。根据映射数据,使用插入长度和随机性测试以及随后的分析来评估测序库的质量。
9.Western Blot
准确称量海马组织重量,根据重量加入裂解液进行组织匀浆,随后4℃、12000rmp离心20分钟,取上清液转移到离心管中。按照BCA试剂盒步骤测定蛋白浓度,向蛋白原液中加入上样缓冲液,100℃煮沸5分钟,然后进行SDS-PAGE电泳后将蛋白转移到PVDF膜上。用5%脱脂牛奶室温封闭1小时。用一抗和二抗进行蛋白定量测定。使用ImageJ软件量化蛋白质条带密度。
10.免疫荧光测定
将大鼠麻醉后进行心脏灌流后取出完整大脑,将大脑在PFC浸泡过夜。在进行分级脱水后切成连续冠状切片(30μm)。将切片与一抗共同孵育12小时后再与荧光偶联的二抗共同孵育1小时。最后用DAPI复染5分钟后用激光扫描共聚焦显微镜(LSM880,卡尔蔡司)拍摄图片。使用ImageJ软件量化荧光密度和阳性细胞数。
11.神经元细胞原代培养
根据之前所述进行神经元培养。将出生3天内的乳鼠的大脑皮层和海马体取出并放置在DMEM培养基中,在显微镜下剔除上面的血管和脑膜。将组织剪碎并吹打成细胞悬液后进行离心(4℃,1000rmp,5min)。将细胞沉淀用DMEM-F12(含10% FBS,100U/ml青霉素和100mg/ml链霉素)吹打混合成细胞悬液后用血细胞计数仪进行细胞计数。将细胞悬液种植到孔板和培养皿中,6小时后用神经基础培养基(含2% B27补充剂(Gibco)、1% GlutaMax(Gibco)谷氨酰胺、100U·mL
12.慢病毒转染
用于敲除VGLUT1和VAMP1的重组慢病毒购自Gene Chem(上海,中国),并根据基因表达载谱将其转染到原代神经元细胞中,感染72小时后,进行后续实验和分析。用于检测谷氨酸释放强度的hSyn-Sf-iGluSnFR.A184S重组慢病毒购自和元生物技术公司(上海,中国),并根据基因表达载谱将其转染到原代神经元细胞中,感染72小时后,进行后续实验和分析。
13.实时定量PCR
根据制造商的说明,使用RNA快速提取试剂盒(Aidlab)提取海马的RNA,用超微量核酸分析仪测定RNA的浓度。利用逆转录试剂盒(Vazyme,南京),将RNA逆转录成cDNA。用特异性引物扩增扩增cDNA,使用Bio-Rad IQ5实时荧光定量PCR系统进行定量实时荧光定量PCR。GAPDH在每个组中充当对照。利用ΔΔCT的方法对实验结果进行统计分析。
14.免疫沉淀
根据制造商的说明,使用Pierce
15.AAV载体的立体定位注射
构建AAV9-Fbxl20-RNAi载体以降低FBXL20的表达。以下引物序列用于降低FBXL20片段:ACCGCTAGCTAACTGGAGGCTTGCTGAAGGCTGTATGCTGTTTGCAAGTTCAAAGTCACCAGTTTTGGCCACTGACTGACTGGTGACTGAACTTGCAAACAGGACACAAGGCCTGTTACTAGCACTCACATGGAACAAATGGCCCAAGCTTGGT(SEQ ID NO.1,Gene Chem,中国)。在AAV中表达FBXL20的序列,产生AAV9-CaMKIIap-EGFP-MIR155(MCS)-SV40 PolyA载体,以降低FBXL20蛋白的产生。对于病毒注射,用戊巴比妥钠麻醉大鼠并置于立体定位仪(Stoelting,美国)中。用组织剪在大鼠耳朵之间剪一个长约1.5厘米的前后切口,暴露露骨后用棉签清洁头骨表面。以前卥点为零点坐标,根据大鼠脑图谱中海马区域的坐标(-3.24mm,±2.0mm,-3.0mm)确定海马位置。使用电动骨钻(WPI,美国)在注射点钻孔。微量注射仪吸取1-1.5μL AAV(4.84×10
实验结果
1.在CUMS大鼠中,VGLUT1和VAMP1表达降低与抑郁有关
为了探究可能与CUMS大鼠突触可塑性失调相关的特定蛋白分子,我们对从CUMS提取的大鼠海马组织进行了蛋白组学测序。图1A显示了海马体中差异蛋白表达水平,使用火山图(图1B)过滤显示这两组之间的差异表达蛋白,发现了与突触囊泡转运相关的蛋白有显著的差异性表达。越来越多研究表明,突触前可塑性可能涉及突触结构变化、突触前蛋白质合成和跨突触信号传递等多个方面。突触前可塑性还可以改变神经递质释放。因此,关于突触囊泡的一系列神经活动对突触前可塑性可能会有较大影响。此外,突触前长期可塑性是学习形式的基础,其失调参与精神分裂症、智力障碍、自闭症、神经退行性疾病等多种神经精神疾病。所以,我们重点关注了与突触囊泡摄取神经递质有关的分子-VGLUT1和突触囊泡介导神经递质释放相关的蛋白分子-VAMP1。哺乳动物中的囊泡谷氨酸转运蛋白家族由三种高度同源的蛋白质组成:VGLUT1、2、3;其中,VGLUT1占比最大。VAMP1参与突触前神经末梢的突触小泡循环,并且在多种神经系统性疾病的发生发展发挥作用。
2.在CUMS中VGLUT1和VAMP1表达降低可能是泛素化增高的结果
为了探究VGLUT1和VAMP1降低的原因,我们进行了转录组学检测(RNA-Seq),结果显示VGLUT1和VAMP1的mRNA并没有显著性差异表达,然后我们又用PCR实验对此结果进行了验证,发现PCR实验结果与转录组学检测结果一致。因此,我们推测VGLUT1和VAMP1降低可能是由于转录后或翻译后调控所致;所以,我们对蛋白组学检测结果再次进行分析,发现许多有显著差异性表达的蛋白质与泛素介导的降解途径有关,F-box/LRR-repeat protein20(FBXL20,也称为SCRAPPER)在前20个上调蛋白中。FBXL20是一种可以结合底物以响应各种刺激的E3泛素连接酶,在皮质和海马体的神经元胞体和突触前末梢表达。
免疫蛋白印记实验结果显示,与对照组大鼠相比,HS组大鼠的FBXL20表达水平显著性增加,这与测序结果一致。因此,我们假设观察到的VGLUT1和VAMP1降低可能是与CUMS大鼠中FBXL20介导的泛素降解途径有关。为了研究这种可能性,我们首先测量了从CUMS大鼠大脑中提取的蛋白质的泛素化水平,并与对照组进行比较。免疫蛋白印记实验结果显示,与对照组大鼠相比,CUMS大鼠中的泛素表达水平显著增高,同样,用从培养的海马原代神经元中提取的蛋白质进行免疫蛋白印记实验,其结果显示CORT组的泛素表达水平显著增高(图3D,E)。接下来,我们用抗VGLUT1抗体和抗VAMP1抗体分别沉淀VGLUT1和VAMP1,然后用抗泛素抗体进行Western blot分析,以检测CUMS大鼠中泛素化的GLUT1H和VAMP1的水平。免疫沉淀结果显示,尽管直接免疫沉淀的VGLUT1和VAMP1显著降低,但在CUMS大鼠中泛素化的VGLUT1和VAMP1的水平显著增高,与VGLUT1和VAMP1的表达降低一致。为了进一步验证,我们在培养的海马原代神经元上也进行相同实验,结果显示与体内实验结果一致。这些结果表明VGLUT1和VAMP1降低可能与CUMS大鼠中泛素化水平上调有关。
3.FBXL20敲低可增加VGLUT1和VAMP1的表达并改善大鼠抑郁样行为
为了进一步探究FBXL20与VGLUT1和VAMP1之间的关系,我们将AAV9-Fbxl20-RNAi病毒注射到大鼠的双侧海马CA1区,以降低FBXL20在此区域的表达(图4A-C)。用免疫蛋白印记实验验证FBXL20敲低效率。敲低FBXL20改善了CUMS大鼠中VGLUT1和VAMP1的表达降低,免疫蛋白印记实验和免疫荧光实验与对照组无显著性差异。敲低FBXL20可抑制CUMS大鼠的抑郁相关行为;蔗糖偏好实验,强迫游泳实验,旷场实验,高架十字迷宫实验与对照组无显著性差异。以上结果说明,FBXL20可能通过介导VGLUT1和VAMP1的降解来促进抑郁样行为的产生。
4.FBXL20敲低可挽救由CUMS引起的大鼠突触可塑性损伤
为了探究FBXL20/VGLUT1和FBXL20/VAMP1通路在抑郁症中的病理意义,我们用透射电子显微镜在超微结构水平上对大鼠海马组织进行了分析。与抑郁样大鼠相比,敲低FBXL20的抑郁样大鼠的不对称突触的数量显著性增加(图5A,B),这说明FBXL20表达降低可以逆转抑郁样大鼠不对称突触的数量的减少;此外,与抑郁样大鼠相比,敲低FBXL20的抑郁样大鼠的突触前膜活动区的长度并显著性增加(图5C,D),这说明FBXL20表达降低可以改善抑郁样大鼠突触前膜活动区的缩短;与抑郁样大鼠相比,敲低FBXL20的抑郁样大鼠的突触前膜活动区停靠的突触囊泡数量显著性增加(图5C,E),说明下调抑郁样大鼠的FBXL20表达可有效逆转突触前膜活动区着位囊泡数目的减少。以上实验结果表明,FBXL20可通过泛素化降解VGLUT1和VAMP1,进而使突触囊泡对谷氨酸的摄取以及突触囊泡在突触前膜上的着位减少,突触前膜对谷氨酸的释放减少,进而影响突触传递效率,从而促进突触可塑性损伤,最终导致抑郁样行为的产生。
综上所述,本研究发现慢性应激刺激促进大鼠海马CA1区突触可塑性损伤,导致大鼠产生抑郁样行为。抑郁样大鼠海马CA1区的E3泛素连接酶FBXL20表达上调,通过泛素化降解突触囊泡相关蛋白VGLUT1和VAMP1,导致神经元突触囊泡对谷氨酸的摄取减少以及突触囊泡在突触前膜上的着位减少,进而使突触前膜释放谷氨酸减少,从而影响突触传递效率,造成突触可塑性损伤,最终促进大鼠抑郁样行为的产生。在抑郁样大鼠海马CA1区敲低FBXL20可以显著改善神经元突触数目的减少、突触前膜活动区的缩短、突触前膜活动区着位的突触囊泡数目的减少等可塑性损伤,并改善大鼠快感缺失和行为绝望等抑郁样表现。本研究证实FBXL20-VGLUT1/VAMP1信号通路参与调控大鼠海马突触可塑性及抑郁样行为的发生,为阐明抑郁症的发病机制提供了新思路,同时也为抑郁症的临床治疗提供了潜在的新靶点及研究依据。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 精子中miRNA在制备抑郁症检测产品、抗抑郁症药物中的应用
- 精子中miR-199a-3p在制备抑郁症检测产品、抗抑郁症药物中的应用
