VND3207在防治放射性肺纤维化中的应用
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及生物技术领域,具体涉及VND3207在防治放射性肺纤维化中的应用。
背景技术
放射性肺纤维化一般是因为对胸部肿瘤如乳腺癌、食管癌、肺癌和其它恶性肿瘤,进行放射治疗后,在放射野内的正常肺组织发生放射性损害,形成了广泛的肺纤维化。临床上常见到刺激性干咳、气急和胸疼,时有发烧。病情重者其干咳持续存在,气急明显,活动后增剧。免疫功能下降严重,且易发生呼吸道感染,甚则并发右心衰竭。
VND3207是一种香兰素衍生物。香兰素又名香草醛、香荚兰醛,具有特殊香气,作为食品添加剂被广泛使用。多年以来,香兰素在医药领域的应用研究也受到关注。已有的资料显示,香兰素对机体和培养细胞的毒性很小、几乎没有遗传或基因毒性。研究报道香兰素能抑制X射线和紫外线诱导的染色体畸变,并能抑制基因突变,减轻 DNA损伤。但香兰素抗辐射作用浓度相对较高,活性偏低。2008年我们筛选出辐射防护作用更好的香兰素衍生物—VND3207,前期试验已经证实VND3207在500μ mol/L浓度范围内对细胞没有明显毒性,且辐射防护作用范围较宽,对γ射线致人正常淋巴母细胞AHH-1基因组损伤和细胞凋亡具有保护作用。
目前尚无VND3207用于放射性肺纤维化防治的相关报道。
发明内容
本发明的目的是提供VND3207在防治放射性肺纤维化中的应用。
第一方面,本发明要求保护VND3207在制备用于预防和/或治疗放射性肺纤维化的产品中的应用。
第二方面,本发明要求保护VND3207在如下任一中的应用:
(A1)制备用于缓解放射受照区域毛发脱落的产品;
(A2)制备用于在放射早期(如1个月)减少肺部炎性渗出,减少放射晚期(如 5个月)胶原沉积的产品;
(A3)制备用于缓解放射引起的肺间隔增宽、断裂,减少肺泡腔中渗出物含量的产品;
(A4)制备用于缓解放射引起的肺组织胶原增多的产品。
在本发明的具体实施方式中,上文所述产品的用途为预防性应用。
上文所述应用均为通过在体内(如肺泡内)激活DNA依赖性蛋白激酶催化亚基(DNA-PKcs)的自磷酸化活性起作用的。
相应的,在所述应用中,接受放射的机体需要为DNA-PKcs能够正常表达的机体。
第三方面,本发明要求保护VND3207在如下任一中的应用:
(B1)制备用于促进放射后肺上皮细胞的增殖活性的产品;
(B2)制备用于抑制放射诱导的肺上皮细胞凋亡的产品;
(B3)制备用于抑制放射诱导的肺上皮细胞焦亡的产品;
(B4)制备用于抑制放射诱导的肺上皮细胞EMT的产品。
在本发明的具体实施方式中,上文所述产品的用途为预防性应用。
上文所述应用均为通过DNA-PKcs起作用的。
相应的,在所述应用中,所述肺上皮细胞中的DNA-PKcs需要能够正常表达。
在本发明的具体实施方式中,所述肺上皮细胞为A549细胞。
第四方面,本发明要求保护VND3207和能够促进DNA-PKcs正常表达的物质在制备用于预防和/或治疗放射性肺纤维化的产品中的应用。
第五方面,本发明要求保护VND3207和能够促进DNA-PKcs正常表达的物质在如下任一中的应用:
(A1)制备用于缓解放射受照区域毛发脱落的产品;
(A2)制备用于在放射早期(如1个月)减少肺部炎性渗出,减少放射晚期(如 5个月)胶原沉积的产品;
(A3)制备用于缓解放射引起的肺间隔增宽、断裂,减少肺泡腔中渗出物含量的产品;
(A4)制备用于缓解放射引起的肺组织胶原增多的产品。
在本发明的具体实施方式中,上文所述产品的用途为预防性应用。
上文所述应用均为通过在体内(如肺泡内)激活DNA-PKcs的自磷酸化活性起作用的。
第六方面,本发明要求保护VND3207和能够促进DNA-PKcs正常表达的物质在如下任一中的应用:
(B1)制备用于促进放射后肺上皮细胞的增殖活性的产品;
(B2)制备用于抑制放射诱导的肺上皮细胞凋亡的产品;
(B3)制备用于抑制放射诱导的肺上皮细胞焦亡的产品;
(B4)制备用于抑制放射诱导的肺上皮细胞EMT的产品。
在本发明的具体实施方式中,上文所述产品的用途为预防性应用。
上文所述应用均为通过DNA-PKcs起作用的。
在本发明的具体实施方式中,所述肺上皮细胞为A549细胞。
第七方面,本发明要求保护具有如下(1)-(10)中任一所示功能的产品,由VND3207和能够促进DNA-PKcs正常表达的物质组成;
(1)预防和/或治疗放射性肺纤维化;
(2)缓解放射受照区域毛发脱落;
(3)在放射早期(如1个月)减少肺部炎性渗出,减少放射晚期(如5个月) 胶原沉积;
(4)缓解放射引起的肺间隔增宽、断裂,减少肺泡腔中渗出物含量;
(5)缓解放射引起的肺组织胶原增多;
(6)促进放射后肺上皮细胞的增殖活性;
(7)抑制放射诱导的肺上皮细胞凋亡;
(8)抑制放射诱导的肺上皮细胞焦亡;
(9)抑制放射诱导的肺上皮细胞EMT。
在上述各方面中,所述产品均可为药品。
在本发明的具体实施方式中,所述放射为γ射线照射。进一步,具体为20Gy(67.6cGy/min)
在上述各方面中,所述VND3207结构式如下:
在本发明中,所述能够促进DNA-PKcs正常表达的物质可以为能够在细胞或机体中促进DNA-PKcs正常表达的任何物质,如能够编码DNA-PKcs的编码基因或含有所述编码基因的表达盒或重组载体。
实验证明,在本发明中VND3207在放射性肺损伤中表现出潜在防护作用,本发明发现VND3207不仅能够通过促进细胞增殖和抗细胞凋亡来抵抗肺上皮细胞的辐射损伤,对辐射诱导的细胞炎症性死亡—细胞焦亡也有一定的抑制作用,这对肺组织炎症反应有着重要的意义。此外,过度的炎症反应会导致肺组织上皮细胞发生EMT,进而发展为放射性肺纤维化。本发明的研究结果表明,VND3207可以通过 DNA-PKcs/AKT1/Twist轴抑制辐射诱导的EMT过程,从而有效抑制放射性肺纤维化的形成。因此VND3207作为DNA-PKcs的活性激动剂,对于放射性肺纤维化的防治具有较大的临床应用价值。
附图说明
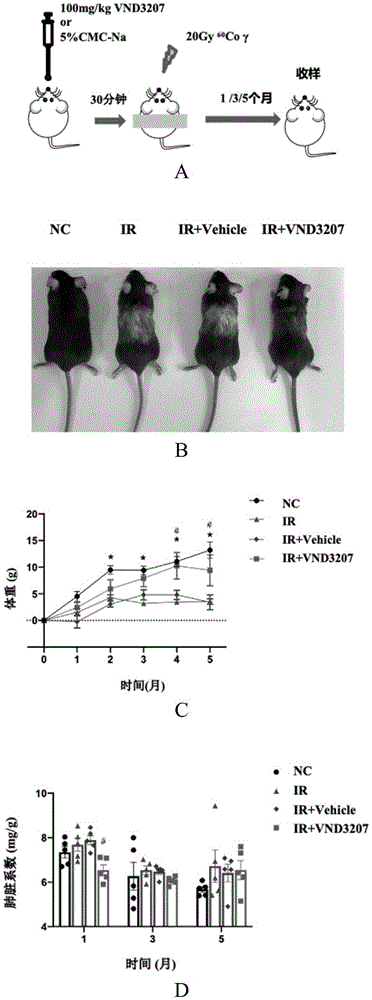
图1为VND3207缓解辐射诱导的肺纤维化。A为小鼠给药及照射模式示意图; B为20Gy全胸照射后5个月小鼠全身情况;C为照射后5个月内小鼠体重动态变化; D为照射后1个月、3个月和5个月肺脏系数;E为照射后1个月、3个月和5个月肺组织HE染色,标尺为50μm;F为照射后1个月、3个月和5个月肺组织Masson 染色,标尺为50μm;G为E图肺组织HE染色中肺脏病理半定量法评分;H为F图肺组织masson染色中胶原定量(数据代表mean±SEM,n=5,
图2为VND3207在体内外激活肺组织中DNA-PKcs的自磷酸化活性。A为用或未用100mg/kg VND3207处理小鼠并在20Gy全胸照射0h、1h、6h和24h后肺组织中DNA-PKcsSer2056磷酸化焦点形成;B为用或未用40μM VND3207处理人肺泡上皮细胞A549在6Gy照射0-7h后DNA-PKcs Ser2056磷酸化焦点形成;C和D分别为A和B图中每个细胞中焦点数量(每组统计>80个细胞,
图3为VND3207通过DNA-PKcs促进辐射后细胞增殖能力。A为慢病毒浸染后 72h细胞中GFP荧光表达(100X)。B为Western blot实验验证A中DNA-PKcs敲低效果。C为用或未用40μM VND3207处理shNC和shDNA-PKcs细胞,在照射后2 周左右观察不同剂量下细胞克隆形成能力。D为用或未用40μM VND3207处理shNC 和shDNA-PKcs细胞,在6Gy照射后48h进行EDU荧光检测观察细胞增殖能力。E 为C图中细胞克隆形成率。F为D图中EDU阳性细胞比例(实验重复三次,数据代表mean±SEM,*P<0.05)。图中的shDPK即表示shDNA-PKcs。
图4为VND3207通过DNA-PKcs抑制辐射后细胞凋亡。A为用或未用40μM VND3207处理shNC和shDNA-PKcs细胞,在6Gy照射后24h检测细胞凋亡;B为细胞凋亡率(实验重复三次,数据代表mean±SEM,*P<0.05)。图中的shDPK即表示shDNA-PKcs。
图5为VND3207通过DNA-PKcs抑制辐射后细胞焦亡。A为用或未用40μM VND3207处理shNC和shDNA-PKcs细胞,在6Gy照射后0h、24h、48h检测培养基上清中乳酸脱氢酶含量;B为用或未用40μM VND3207处理shNC和shDNA-PKcs 细胞,在6Gy照射后0h、24h和48h检测培养基上清中IL-1β含量;C为用或未用 40μM VND3207处理shNC和shDNA-PKcs细胞,在6Gy照射后0h、24h和48h检测细胞焦亡相关蛋白表达(实验重复三次,数据代表mean±SEM,*P<0.05,ns代表差异没有统计学意义)。图中的shDPK即表示shDNA-PKcs。
图6为VND3207通过DNA-PKcs抑制辐射后细胞EMT过程。A为用或未用40 μMVND3207处理A549细胞在6Gy照射0-7h后DNA-PKcs总蛋白和Ser2056位点磷酸化蛋白表达水平;B为用或未用40μM VND3207处理shNC和shDNA-PKcs细胞在6Gy照射48h后EMT相关蛋白变化。图中的shDPK即表示shDNA-PKcs。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、VND3207在防治放射性肺纤维化中的应用
一、实验材料
1、实验动物
本实验用C57BL/6小鼠购买自北京斯贝福生物技术有限公司,雄鼠,周龄为6-8周,体重20g左右。
2、实验细胞
本实验用细胞为人肺泡II型上皮细胞A549细胞由本实验室保存提供,细胞使用高糖DMEM培养基进行培养,培养基中添加10%FBS(胎牛血清)为细胞提供营养,添加1%青霉素-链霉素防止细胞污染。
3、抗体,如表1。
表1、主要实验抗体
4、试剂,如表2。
表2、主要实验试剂
5、仪器设备,如表3。
表3、主要仪器设备
6、实验耗材,如表4。
表4、主要实验耗材
7、主要试剂配制
(1)4%多聚甲醛
多聚甲醛:20g;0.1M PBS:400ml。在磁力搅拌器上加热搅拌溶解(温度低于 60℃),未完全溶解可加入少量NaOH助溶,将PH调整为7.4,最后使用0.1M PBS 定容至500ml,充分混匀,4℃保存。
(2)10×1.5mM Tris-EDTA(pH9.0)
Tris-HCl:30.27g;EDTA(乙二胺四乙酸):1.461g;双蒸水:定容至500ml。混匀后室温保存。
(3)0.3%PBS-Triton-100
0.1M PBS:1L;Triton-100:1.5ml;混匀后室温保存。
(4)0.1%PBS-Tween-20
0.1M PBS:1L;Tween-20:0.5ml;混匀后室温保存。
(5)10×电泳缓冲液
甘氨酸:188g;Tris-Base:30g;SDS:10g;双蒸水:定容至1L;混匀后室温保存。
(6)10×转膜液
甘氨酸:18.30g;Tris-Base:36.34g;SDS:2.31g;双蒸水:定容至1L;混匀后室温保存,稀释成1×转膜液时加入10-20%甲醇再使用。
(7)10×TBS
Tris-Base:30.28g;NaCl:87.66g;双蒸水:定容至1L;混匀后室温保存。
(8)1×TBST
10×TBS:100ml;双蒸水:900ml;Tween-20:1ml;混匀后室温保存。
(9)5%封闭液
脱脂奶粉:5g;1×TBST:100ml;混匀后-20℃保存。
(10)30%丙烯酰胺
丙烯酰胺:145g;N,N’-亚甲双丙烯酰胺:5g;双蒸水:定容至500ml;混匀后用滤纸过滤,4℃保存,注意避光。
(11)10%SDS(十二烷基硫磺钠)
SDS:10g;双蒸水:定容至500ml;55℃加热溶解,充分混匀后室温保存。
(12)1.0M Tris·HCl(pH=6.8)
Tris-Base:60.58g;双蒸水:400ml;混匀后调节pH至6.8左右,最后双蒸水定容至500ml,室温保存。
(13)1.5M Tris·HCl(pH=8.8)
Tris-Base:90.86g;双蒸水:400ml;混匀后调节pH至8.8左右,最后双蒸水定容至500ml,室温保存。
(14)10%APS(过硫酸铵)
APS:1g;双蒸水:5ml;混匀后4℃保存,一周内使用。
(15)5×SDS上样缓冲液
SDS(十二烷基硫磺钠):10g;溴酚蓝:0.5g;β-巯基乙醇:5ml;1M Tris-HCl(pH6.8):25ml;双蒸水:10ml;充分混匀,过滤后加入25ml甘油,混匀后分装, -20℃保存。
(16)40mM VND3207溶液(1000×)(细胞培养用):VND3207取7.2868mg; DMSO取1ml;混匀,分装后-20℃避光保存。
(17)0.5%CMC-Na:CMC-Na取1g;双蒸水取200ml;少次多量地加入CMC-Na,边加边搅拌,然后再加热搅拌充分溶解,冷却到室温,离心取上清使用。
(18)5mg/mL VND3207溶液(小鼠灌胃用):VND3207取0.5g;0.5%CMC-Na 取100ml。
二、实验方法
(一)小鼠实验
1、小鼠饲养
小鼠由军事医学研究院动物中心饲养,饲养条件如下:标准饲料饲养,湿度 60%,温度(22±2)℃,每天给予12h光照。适应性饲养一周后进行后续实验。
2、小鼠分组及照射
为探究VND3207在放射性肺纤维化中的潜在防治作用及机制,将小鼠按照体重均匀分为4组,每组20只:正常对照组(NC组)、单纯照射组(IR组)、溶剂照射组(IR+Vehicle组)和加药照射组(IR+VND3207组)。照射前按照50mg/kg的剂量通过腹腔注射1%的戊巴比妥钠进行麻醉处理。IR+Vehicle组在麻醉前30min通过灌胃给予5%羧甲基纤维素钠(CMC-Na)溶液作为溶剂对照,IR+VND3207组在麻醉前30min通过灌胃给予100mg/kg VND3207溶液。
3、组织标本留取
照射后观察、记录小鼠情况,并在照射后1个月和5个月时收取肺组织。腹腔注射1%的戊巴比妥钠进行麻醉处理后,采用摘眼球取血的方法去除小鼠体内血液。脱颈处死后打开胸腔取出全肺,在预冷的PBS中清洗多余血迹,滤纸吸干肺部表面水分后称重,计算肺脏系数,公式为肺湿重(mg)/体重(g)×100%。肺脏组织一分为二,左肺用预冷的4%多聚甲醛固定过夜,用于石蜡包埋和切片;剩余肺组织装入EP 管内放入液氮中速冻后转移至-80℃保存备用。
4、苏木精-伊红染色法(Hematoxylin-eosin staining,HE)
(1)烤片:65℃,1h。
(2)脱蜡、水化:迅速从烤箱中转移至二甲苯中,二甲苯I 30min,二甲苯II 30min,无水乙醇5min,95%乙醇5min,90%乙醇5min,85%乙醇5min,80%乙醇5 min,75%乙醇5min,70%乙醇5min。
(3)染色:流水冲洗5min,苏木素染色10min,流水冲洗10min,1%盐酸酒精分化2s,流水冲1min,PBS返蓝1min,流水冲洗1min,伊红染色30s。
(4)脱水、透明:75%乙醇30s,80%乙醇5min,85%乙醇1min,90%乙醇5min, 95%乙醇5min,无水乙醇5min,二甲苯I10min,二甲苯II 10min。
(5)封片:在通风橱内用中性树胶封片,通风1h挥发二甲苯。
5、Masson染色
(1)切片脱蜡至水,同HE染色。
(2)丽春红品红染色液染色10min。
(3)0.3%乙酸溶液清洗1min。
(4)磷钼酸溶液洗2min。
(5)0.3%乙酸溶液清洗1min。
(6)苯胺蓝染色液染色2min。
(7)0.3%乙酸溶液清洗1min。
(8)95%乙醇快速脱水,无水乙醇脱水3次,每次5s。
(9)二甲苯透明3次,每次2min。
(10)中性树胶封片。
6、组织免疫荧光染色
(1)切片脱蜡至水,同HE染色。
(2)水化后纯水摇洗3次,每次3min。
(3)抗原修复:配制Tris-EDTA(pH9.0)抗原修复液工作液,微波炉预热,放入切片,高火煮至沸腾后转中火维持10min,放至室温。
(4)PBS摇洗3次,每次5min。
(5)透膜:将切片转入0.3%PBS-Triton-100中,室温反应15min。
(6)PBS摇洗3次,每次5min。
(7)封闭:组化笔圈出组织,圈内滴加100μl左右封闭血清,室温孵育1-2h;
(8)抗原抗体反应:一抗4℃孵育过夜,0.1%PBS-Tween-20摇洗3次,每次 5min,滴加对应荧光二抗在室温下避光孵育1h,0.1%PBS-Tween-20摇洗3次,每次5min。
(9)染核及封片:使用含DAPI的封片剂进行封片,在激光共聚焦显微镜下观察拍照。
7、肺组织蛋白提取,以下操作均在冰上进行:
(1)安装好放置样品管的适配器,提前打开低温研磨机对适配器及仪器内部进行制冷。
(2)从-80℃冰箱取出肺脏组织,迅速剪下10mg左右肺脏组织于2ml EP管中,用剪刀尽量将肺组织剪碎。
(3)加入500μl组织裂解液(含蛋白酶抑制剂及磷酸酶抑制剂)和研磨球。
(4)将准备好的样品管按照重量对称放入适配器中,拧紧固定装置。
(5)设定研磨参数并开始研磨:运行温度-30℃,研磨频率65HZ,研磨时间60s,间隔时间60s,研磨次数2次。
(6)仪器完全停止运行后,取出样品管,此时肺组织研磨成组织匀浆,无肉眼可见组织块。
(7)将肺组织匀浆转移至新EP管中,大约400μl,在冰上裂解30min,中间每隔10min震荡混匀一次,然后将组织匀浆离心,4℃,12000r/min,离心15min,收集上清即为所得蛋白提取液。
(8)BCA法测定蛋白浓度:
1)配制BCA工作液:现配先用,将A液:B液按照50:1比例混匀。
2)配制浓度梯度标准蛋白液:先用蒸馏水将2mg/ml标准蛋白液稀释成0.5mg/ml标准蛋白液,再按照表5所示梯度稀释:
表5、稀释梯度
3)稀释样品:取2μl样品加入18μl蒸馏水,即将样品稀释10倍。
4)上样并设置复孔:将稀释好的标准蛋白液及待测样品加入96孔板,周围一圈加上PBS防止出现边缘效应,同时设置3个复孔,每孔加入200μl BCA工作液。
5)充分混匀,37℃孵育30min。
6)酶标仪测定562nm波长的吸光度值。
7)绘制标准曲线,显示拟合方程及相关系数(R值>0.99可认为拟合效果较好),根据所得方程计算样品浓度(mg/ml),注意乘以稀释倍数即为原样品浓度。
(9)取出100μl蛋白提取液加入5×SDS上样缓冲液,100℃沸水中煮10min 使蛋白变性,-20℃保存备用,其余蛋白样品分装后转移至-80℃保存。
8、Western blot
(1)配制SDS-PAGE凝胶,DNA-PKcs采用6%分离胶,其他蛋白采用10%分离胶(单块胶用量)。如表6所示。
表6、SDS-PAGE凝胶配制
(2)样品准备及上样:从-20℃冰箱取出组织蛋白样品,100℃沸水中复煮3min 以去除蛋白的亚稳态聚合。
(3)电泳:首先80V电泳30min,待maker条带分离,溴酚蓝跑入分离胶后,加大电压至120V,继续电泳1h左右,当溴酚蓝接近凝胶底部时停止电泳。
(4)转膜:提前将转膜液放入冰箱预冷,裁剪合适大小的NC膜,与厚滤纸一并放入转膜液中平衡10min左右。按照从正极到负极组织转膜夹板:垫片→滤纸→NC 膜→SDS-PAGF胶→滤纸→垫片。膜两边的滤纸不能相互接触,避免发生短路。将夹板放入转膜槽,并将转膜槽置于冰水浴中,设置电压100V电转2h-2.5h(DNA-PKcs 分子量较大,会适当延长转膜时间)。
(5)封闭:转膜结束后先用TBST摇洗膜上残留的转膜液和其他杂质,再用5%封闭液室温封闭2-3h或4℃封闭过夜。
(6)抗原抗体反应:用TBST摇洗膜上残留的封闭液,加入相应一抗,4℃孵育过夜。回收一抗,TBST摇洗3次,每次10min。加入相应二抗,室温孵育1-2h, TBST摇洗3次,每次10min。
(7)化学发光法显影:等体积混合试剂A、B配制成显影工作液,吸干膜表面多余水分,取适量显影工作液均匀滴于膜上,反应30s左右,放入显影仪中进行显影。
9、病理切片分析及蛋白条带定量
对于HE染色结果进行肺脏病理半定量评分来量化肺损伤程度,评分标准参考Wang(2021),对于每只小鼠3个切片分值取平均值,每组5只小鼠再取平均值,最终得到该组小鼠肺纤维化评分分数。对于Masson染色结果使用Image J软件进行定量分析,按照HE染色同样的方法取平均值。对于Western Blot结果使用Image J软件进行灰度值分析。
10、统计学分析
使用SPSS V25.0软件对数据进行分析,数据表示为mean±SEM,多组样本间差异分析采用单因素方差分析,并进一步进行两两比较,当P<0.05时,差异具有统计学意义。
(二)细胞实验
1、细胞培养
(1)使用含10%胎牛血清与1%青霉素-链霉素的DMEM高糖培养基(以下称为完全培养基),在含5%CO2、湿度适宜的37℃恒温培养箱中培养。
(2)细胞换液与传代:当培养基颜色变黄时进行换液,吸去旧培养基,加入适量PBS溶液清洗1-2遍,去除细胞碎片杂质,加入提前平衡到室温的新鲜完全培养基。对于贴壁细胞而言,当细胞密度达到90%左右时进行传代,吸去旧培养基,加入适量 PBS溶液清洗1-2遍,加入适量胰蛋白酶,37℃消化1min左右,观察到细胞形状变为圆形时加入等量完全培养基(胎牛血清可终止胰蛋白酶作用)终止消化。用枪头轻轻吹下皿底的细胞,注意在液面一下吹打,避免产生气泡,转移细胞悬液至无菌离心管中,室温下900r/min离心3min弃上清,加入适量无菌PBS重悬细胞后再次离心弃上清,用新鲜的完全培养基重悬混匀细胞。按照试验需要取适量细胞悬液接种于含新培养皿中,补充适量完全培养基,摇晃均匀后放入细胞培养箱中。
(3)细胞冻存与复苏:选择生长状态良好的细胞进行冻存,冻存液按照培养基:血清:DMSO=7:2:1比例配制,胰酶消化收集细胞,用冻存液重悬,取1.5ml细胞悬液至冻存管内,封口并做好标记,放入装有异丙醇的冻存盒中,再放入-80℃冰箱中缓慢冻存过夜,第二天转移至液氮中长期保存。复苏细胞时操作要快速,从液氮中取出后迅速在37℃水浴锅中摇动解冻。将细胞悬液转移至装有3ml完全培养基的无菌离心管中,室温下900r/min离心3min弃上清,加入适量无菌PBS重悬细胞后再次离心弃上清,用新鲜的完全培养基重悬混匀细胞,接种至培养皿中,放入培养箱培养12h以上,更换完全培养基以去除残留的DMSO和无法贴壁的细胞及细胞碎片,传代2次以上用于实验。
2、慢病毒稳定敲低DNA-PKcs细胞系构建
DNA-PKcs敲低慢病毒由上海吉玛合成、包装,详细方法见官网手册 (https://www.genepharma.com/operation_manual2.php?cateid=151)。本发明中使用载体为LV3(带GFP),shNC序列为5’-TTCTCCGAACGTGTCACGT-3’;shDNA-PKcs 序列为5’-GGGCGCTAATCGTACTGAA-3’;病毒滴度为1×10
(1)取生长状态良好的A549细胞提前一天接种至60mm培养皿中,每皿约2×10
(2)配制慢病毒感染体系:将5ml完全培养基、20μl对照(shNC)或者敲低病毒液(shDNA-PKcs)和5μl polybrene,充分混匀。
(3)慢病毒浸染:弃去旧培养基,加入配制好的病毒浸染培养基,培养24h。
(5)筛选稳转细胞系:更换含2μg/ml嘌呤霉素的完全培养基,继续培养,其中未转染慢病毒的细胞在嘌呤霉素的作用下开始死亡,连续培养一周左右直至细胞不再死亡,期间正常传代。
(6)验证稳转细胞系:慢病毒载体带有GFP荧光,浸染48-72h后在荧光显微镜下观察到细胞内表达GFP荧光即为浸染成功,嘌呤霉素筛选后GFP荧光阳性细胞数可达到90%以上,通过Western blot可进一步验证DNA-PKcs敲低效果。验证成功后,更换0.5μg/ml嘌呤霉素的完全培养基维持培养,用于后续实验。
3、细胞照射
照射前2h换液或给药,使用不同剂量
4、细胞总蛋白提取及Western blot
(1)处理细胞后,按照实验需要在不同时间点终止培养,吸掉旧培养基,加入预冷的PBS清洗2遍,最后加入1ml PBS,用细胞刮快速刮下细胞,并将细胞混合液转移至1.5mlEP管中,操作全程在冰上进行。
(2)4℃,3000r/min,离心5min,丢弃上清,收集细胞沉淀。
(3)向细胞沉淀中加入100μl NETN裂解液(含蛋白酶抑制剂和磷酸酶抑制剂),吹打混匀,冰上裂解30min,期间每隔10min震荡混匀一次以充分裂解。
(4)4℃,12000r/min,离心15min,所得上清即为蛋白提取液。
(5)使用BCA法测蛋白浓度(方法同前)。
(6)加入5×SDS上样缓冲液,沸水中煮10min,进行Western blot或-20℃保存。
5、细胞免疫荧光
(1)爬片铺板:提前一天接种约2×10
(2)收样:按照实验需要终止培养,用PBS清洗细胞3遍,去除细胞杂质和 DNA片段。
(3)固定:每孔加入1ml预冷的4%多聚甲醛,室温固定30min;
(4)PBS摇洗3次,每次5min。尽量洗净,避免醛基残留,影响后续染色。
(5)透膜:使用0.3%PBS-Triton-100,室温孵育30min。
(6)PBS摇洗3次,每次5min。
(7)封闭:使用5%BSA,室温孵育1-2h;
(8)抗原抗体反应:一抗4℃孵育过夜,0.1%PBS-Tween-20摇洗3次,每次5min,滴加对应荧光二抗在室温下避光孵育1h,0.1%PBS-Tween-20摇洗3次,每次5min。 (使用5%BSA配制抗体)
(9)染核及封片:使用含DAPI的封片剂进行封片,在激光共聚焦显微镜下观察拍照。
6、细胞克隆形成实验
细胞克隆形成率即细胞接种存活率,表示接种细胞后贴壁的细胞成活并形成克隆的数量。克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。
(1)根据照射剂量不同接种相应细胞数量于6孔板中,0Gy接种500个细胞, 2Gy接种750个细胞,4Gy接种1000个细胞,6Gy接种1500个细胞。每组设置3 个重复对照。
(2)照射前6h将细胞接种至6孔板中,待细胞贴壁后进行照射。
(3)照射后置于细胞培养箱中继续培养,观察细胞生长状态,当一个细胞团超过50个细胞时可认为形成了一个克隆,此时终止培养。
(4)吸弃旧培养基,用PBS清洗细胞表面2遍,每孔加入1ml 4%多聚甲醛将细胞在室温下固定30min,吸弃固定液后每孔加入1ml结晶紫染色液,室温下染色1 h,回收染液,用清水洗净孔板中的染液,倒扣晾干。
(5)显微镜下统计克隆数,并计算克隆形成率。克隆率形成率=(克隆数/接种细胞数)×100%。
7、EdU检测细胞增殖
EdU是一种胸腺嘧啶核苷类似物,能够在DNA复制时期代替胸腺嘧啶(T)渗入正在合成的DNA分子中,通过基于荧光染料与EdU的特异性反应即可直接检测出 DNA复制活性,反应细胞增殖能力。根据锐博生物公司的EdU细胞增殖检测试剂盒 (C10310-1)操作,具体操作如下:
(1)细胞培养:取生长状态良好细胞,按照每孔5×10
(2)细胞处理:40μM VND3207处理2h后进行6Gy照射,48h后终止培养。
(3)EdU标记:用完全培养基稀释EdU溶液至10μM(5000:1)。每孔加入200 μl稀释后的EdU溶液,在细胞培养箱中孵育2h,弃培养基。PBS清洗细胞2次,每次5min,以清洗多余的EdU溶液。
(4)细胞固定:每孔加入100μl 4%多聚甲醛,室温孵育30min,弃固定液;每孔加入100μl 2mg/ml甘氨酸,摇床上孵育5min,中和多余醛基,弃甘氨酸溶液;每孔加入200μlPBS,摇床清洗5min,弃PBS;每孔加入200μl 0.5%PBS-TritonX-100,摇床上孵育10min,增加细胞膜通透性,弃渗透剂;每孔加入200μl PBS,摇床清洗 5min,弃PBS。
(5)Apollo染色:按如下表7所示比例配制Apollo染色液,每孔加入200μl染色液,在摇床上室温孵育30min,注意避光,弃染色液。每孔加入200μl 0.5%PBS-TritonX-100,摇床上孵育10min,增加细胞膜通透性,弃渗透剂;每孔加入200μl PBS,摇床清洗5min,弃PBS。
表7、Apollo染色液的配制(500μl)
(6)DNA染色:用纯水稀释Hoechst33342染色液(100:1),避光保存备用。每孔加入200μl稀释后的Hoechst33342染色液,在摇床上室温孵育30min,注意避光,弃染色液。每孔加入200μl PBS,摇床清洗2次,每次5min。最后每孔加入200μl PBS 保存待用。
8、流式细胞术检测细胞凋亡
根据凯基生物公司提供的Annexin V-APC/PI细胞凋亡检测试剂盒(KGA1030) 进行检测。在正常细胞中,磷脂酰丝氨酸(PS)只分布在细胞膜脂质双层的内侧,而在细胞凋亡早期,细胞膜中的磷脂酰丝氨酸(PS)由脂膜内侧翻向外侧。Annexin V是一种Ca
(1)按照实验需求终止培养细胞。对于贴壁细胞,转移旧培养基至15ml离心管中,用PBS清洗2遍,清洗用PBS也回收至离心管中,加入胰酶消化2min,将细胞轻轻吹打下来,收集到上述离心管中。
(2)2000r/min离心5min,弃上清,PBS洗2次。
(3)加入500μl Binding Buffer重悬细胞,计数后,用Binding Buffer调整细胞密度至1×10^6/ml以内。
(4)取500μl上述细胞悬液,加入5μl Annexin V-APC,混匀,加入5μl PI染液,混匀。同时设置空白对照(两种染色液都不加)和单染组(只加其中一种染色液),用于调整荧光补偿和设置十字门位置。在室温下避光反应15min。
(5)用流式细胞仪对APC和PI两个荧光通道进行检测。
9、ELISA法检测细胞培养基上清中IL-1β含量
根据欣德盛human IL-1βELISA检测试剂盒对各处理组的培养基上清中IL-1β含量进行检测,以评估外界刺激对于细胞释放IL-1β的影响。具体操作如下:
A.试剂准备:
(1)提前20min将Washing Buffer(50×)、Dilution Buffer(1×)、TMB和Stopsolution从试剂中取出,平衡至室温。
(2)配制浓度梯度标准品:按照标签溶解标准品,冰上静置5min,用DilutionBuffer(1×)按如下表8中所示比例将标准品稀释成不同浓度。
表8、配制浓度梯度标准品
(3)用Dilution Buffer(1×)50:1稀释生物素标记抗体(Biotinylatedantibody),冰上备用。
(4)用Dilution Buffer(1×)100:1稀释带辣根过氧化物酶的链霉亲和素(streptavidin-HRP),冰上备用。
(5)用双蒸水50:1稀释Washing Buffer(50×),室温备用。
B.操作过程:
(1)细胞准备:提前一天将细胞接种至6孔板中,照射前2h给药处理,每孔加入1ml培养基。按照实验需要在不同时间点收集培养基上清,900r/min离心3min 收集上清至新EP管中。
(2)加样:每孔加入100μl不同浓度标准品溶液绘制标准曲线,每孔加入300μl 培养基上清样本,每个样品设置3个复孔,同时使用Dilution Buffer(1×)作为空白孔。
(3)抗原抗体反应:每孔加入50μl稀释好的生物素标记抗体工作液,混匀后盖上封板膜,室温孵育3h。
(4)洗板:倒扣在滤纸上轻轻拍打去除孔内液体,每孔加入300μl稀释好的Washing Buffer工作液,停留1min后弃去孔内液体,重复3次。
(5)酶反应:每孔加入100μl稀释好的链霉亲和素(streptavidin-HRP)工作液,混匀后盖上封板膜,室温孵育20min。
(6)洗板:重复步骤(4)。
(7)显色及终止:每孔加入100μl TMB显色液,室温孵育5-30min,注意避光。当孔内液体颜色由黄色变为深蓝色即可向每孔中加入100μl Stop solution终止反应。
(8)读数:终止后10min内使用酶标仪检测参考波长610nm,波长450nm处的OD值,带入标准方程后计算样品浓度。
10、LDH检测
根据Promega公司的LDH检测试剂盒(Cyto Tox
A.试剂准备:
(1)解冻Assay Buffer,取12ml,剩余迅速放回-20℃保存。平衡至室温备用,注意避光。若有沉淀,300g,离心5min去除后使用。
(2)将上述Buffer加入至substrate mix中,轻轻摇匀,溶解底物,尽快使用。
B.操作过程:
(1)细胞准备:提前一天将细胞接种至96孔板中,照射前2h给药处理,每组设置5个复孔,每孔加入100μl培养基。
(2)各孔转移50μl培养基上清至新96孔板中,同时使用没有细胞的培养基作为空白孔。
(3)每孔加入50μl Reagent,室温孵育30min,注意避光。
(4)每孔加入50μl Stop Solution终止反应。
(5)终止后10min内使用酶标仪检测波长490nm处的OD值
三、结果与分析
1、VND3207缓解放射性肺纤维化的发生发展
如图1中A所示,在照射前30min按体重给予每只小鼠100mg/kg VND3207,随后进行20Gy(67.6cGy/min)
2、VND3207在体内外激活DNA-PKcs的自磷酸化活性
为了验证VND3207是否对肺上皮细胞具有辐射防护作用,本实验在照射前30min按体重给予每只小鼠100mg/kg VND3207,随后进行20Gy(67.6cGy/min)60Coγ射线全胸照射,并在照射后1h,6h和24h收集肺组织,对肺泡中DNA-PKcs Ser2056 磷酸化水平进行免疫荧光检测,结果显示VND3207处理组中DNA-PKcs Ser2056位点磷酸化焦点数量显著高于单纯照射组小鼠(图2中A和C)。与此同时我们采用40 μM VND3207在照射前处理肺上皮细胞A549 2h,并在辐照后15min,30min,1h, 3h和7h时收集细胞进行DNA-PKcs Ser2056磷酸化的免疫荧光检测(图2中B和D)。结果显示,DNA-PKcs自磷酸化活性在照射后逐渐升高,3h达到高峰,而VND3207 处理组细胞照射后DNA-PKcs自磷酸化水平较单纯照射组细胞显著升高。
3、VND3207通过DNA-PKcs促进辐射后A549细胞的增殖活性
我们采用慢病毒体系构建DNA-PKcs稳定敲低细胞系并验证了敲低效果后进行后续实验(图3中A和B)。克隆形成实验用来测定在一个细胞群体中具有持续增殖能力的细胞数量,我们首先采用细胞克隆形成实验评估VND3207对人肺上皮细胞辐照后增殖能力的影响。结果表明VND3207显著促进辐照后人肺上皮细胞克隆形成能力,在6Gy时最为明显,而这种促进作用在shDNA-PKcs细胞中失效(图3中C和E)。 EdU是一种胸腺嘧啶核苷类似物,能够在细胞增殖时期代替T渗入正在复制的DNA 分子,通过基于EdU与
4、VND3207通过DNA-PKcs抑制放射诱导的A549凋亡
电离辐射除了直接导致DNA损伤外,还能够诱导产生自由基、活性氧类和促炎细胞因子/趋化因子等间接效应,造成DNA、线粒体损伤或细胞凋亡。为了进一步研究VND3207对肺上皮细胞的辐射防护作用,我们首先检测了VND3207处理组细胞辐射后细胞凋亡水平(图4中A和B),结果显示与正常未照射组相比,单纯辐照组细胞照射后24h细胞凋亡率从4.48%上升至12.89%,而VND3207处理组细胞照射后 24h细胞凋亡率从4.37%上升至8.43%。这表明与单纯照射组相比,VND3207能够缓解辐照引起的细胞凋亡,差异具有统计学意义(P<0.05)。然而在DNA-PKcs缺失情况下VND3207无法有效缓解辐射引起的细胞凋亡。
5、VND3207通过DNA-PKcs抑制放射诱导的A549焦亡
细胞焦亡也被称为炎性细胞坏死,参与放射引起的多种组织器官损伤过程,其中X线辐照能够引起肺组织细胞焦亡从而参与肺组织炎性反应。细胞焦亡与细胞凋亡同属于细胞程序性死亡方式,在外界刺激下,两者在调控细胞的生理活动方面相互联系。在肺上皮细胞中辐照引起的细胞凋亡和细胞焦亡是否同时存在以及VND3207对辐照引起的两种细胞程序性死亡方式的影响,是本研究关注的问题。
细胞发生焦亡时表现为细胞不断胀大直至细胞膜破裂,导致细胞内容物的释放进而激活强烈的炎症反应。研究表明,caspase-1和caspase-11/4/5通过切割穿孔素Gasdermin-D(GSDMD)是诱发细胞焦亡的主要途径,GSDMD被切割后,释放出其 N端结构域,结合膜脂并在细胞膜上打孔,导致细胞质的内容物释放,如乳酸脱氢酶 (lactatedehydrogenase,LDH)和炎性细胞因子(以caspase1剪切活化的IL-1β和IL-18 为主)。如图5中A所示,单纯照射组细胞辐射后释放至培养基中乳酸脱氢酶(LDH) 增多,当DNA-PKcs缺失时能够进一步促进辐射诱导的LDH释放。提示辐照诱导肺上皮细胞凋亡的同时可能诱导细胞焦亡过程,DNA-PKcs可能参与辐射诱导的细胞焦亡过程。与单纯照射组相比,VND3207能够减少shNC细胞辐照后LDH的释放,而在shDNA-PKcs细胞中没有作用。进一步研究表明,辐射能够促进上皮细胞中caspase1 剪切活化,促进N-GSDMD形成和IL-1β释放,介导细胞焦亡,而VND3207能够抑制辐射诱导的细胞焦亡,且依赖于DNA-PKcs的作用(图5中B和C)。
6、VND3207通过DNA-PKcs抑制放射诱导的A549 EMT
为了探究VND3207缓放射性肺纤维化的作用机制,我们进一步探究VND3207 在放射诱导的EMT中的作用。结果表示,VND3207能够增加并维持A549细胞辐照后DNA-PKcs的自磷酸化活性并促进下游AKT1磷酸化活性(图6中A),从而抑制辐射诱导的EMT过程(图6中B)。
综上所述,本发明结果表明:VND3207在放射性肺损伤中表现出潜在防护作用,我们发现VND3207不仅能够通过促进细胞增殖和抗细胞凋亡来抵抗肺上皮细胞的辐射损伤,对辐射诱导的细胞炎症性死亡—细胞焦亡也有一定的抑制作用,这对肺组织炎症反应有着重要的意义。此外,过度的炎症反应会出发肺组织上皮细胞发生EMT,进而发展为放射性肺损伤。我们的研究结果表明,VND3207可以通过 DNA-PKcs/AKT1/Twist轴抑制辐射诱导的EMT过程,从而有效抑制放射性肺纤维化的形成。因此VND3207作为DNA-PKcs的活性激动剂,对于放射性肺纤维化的防治具有较大的临床应用价值。
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
- 吲哚啉酮类化合物在制备预防治疗肺纤维化的药物中的应用及用于预防治疗肺纤维化的制剂
- 福它替尼在制备治疗放射性肺纤维化药物中的应用
