一种壳聚糖缩硫酮活性氧清除水凝胶的制备方法和产品及应用
文献发布时间:2024-04-18 19:58:26
技术领域
本发明属于医药材料制备领域,具体涉及到一种壳聚糖缩硫酮活性氧清除水凝胶的制备方法和产品及应用。
背景技术
研究已经阐明,异常的活性氧(ROS)产生是炎症发病机制中的关键介质之一,体内过量的ROS会导致各种炎症相关的病理学异常。壳聚糖水凝胶具有吸收渗出液能力、孔隙率高、机械性能好等优点,是组织工程良好的候选生物材料。壳聚糖水凝胶敷料作为一种新型生物医用敷料,因其具有可调控性、含水量高且与细胞外基质结构相似等优点得到广泛应用。
壳聚糖水凝胶拥有抗菌性能、也具有为创面提供适当的湿润环境、物理保护、非过敏、生物相容性等特点,是加速创面愈合的良好选择。不过壳聚糖在高于pH 6.5的典型近中性pH溶液中不溶解,并且高分子量的壳聚糖不溶于稀酸溶液,这就减少了阳离子的电荷和降低的生物活性。由于壳聚糖缺乏氢原子的供体,故不是一种良好的天然抗氧化剂,很大的限制了壳聚糖的应用。
壳聚糖衍生物丰富了壳聚糖的功能。研究已表明,壳聚糖衍生物在抗菌方面相较壳聚糖表现更加优越,主要原因是衍生物的基团之间的斥力弱于壳聚糖氨基基团之间的斥力,这增加了分子链的灵活性,有利于更好地与细菌包膜相互作用。
壳聚糖衍生物目前在药物递送、药物制剂、抗菌生物材料及组织工程领域都有良好抗菌、抗氧化等的报道。
但是,目前,尚无相较于壳聚糖具有良好的水溶性、抗菌性以及自由基清除能力多功能集一体的缩硫酮壳聚糖水凝胶的报道。
发明内容
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述和/或现有技术中存在的问题,提出了本发明。
因此,本发明的目的是,克服现有技术中的不足,提供一种壳聚糖缩硫酮活性氧清除水凝胶的制备方法。
为解决上述技术问题,本发明提供了如下技术方案:一种壳聚糖缩硫酮活性氧清除水凝胶的制备方法,包括,
将壳聚糖溶解于HCl溶液中,加入NaOH溶液调节壳聚糖溶液pH后,加去离子水,制得壳聚糖溶液;
将缩硫酮溶于DMF中,同时,将EDC、NHS溶解于无水乙醇后与缩硫酮液混合,制得缩硫酮、EDC和NHS的混合液;
将缩硫酮、EDC和NHS的混合液加入到壳聚糖溶液中,缓慢加入DMF,直至反应溶液澄清,制得反应液;
将反应液去离子水透析,干燥得到缩硫酮壳聚糖衍生物;
将缩硫酮壳聚糖衍生物溶解在水中,制得水凝胶。
作为本发明所述制备方法的一种优选方案,其中:所述壳聚糖与缩硫酮的摩尔比为1:1~8。
作为本发明所述制备方法的一种优选方案,其中:所述壳聚糖的分子量为1~500w。
作为本发明所述制备方法的一种优选方案,其中:所述壳聚糖的黏度为100~500mpa·s。
作为本发明所述制备方法的一种优选方案,其中:所述壳聚糖溶液中壳聚糖的浓度为1wt%~15wt%。
作为本发明所述制备方法的一种优选方案,其中:所述HCl溶液的浓度为0.1M,所述NaOH溶液的浓度为1mol/LNaOH。
作为本发明所述制备方法的一种优选方案,其中:所述EDC、NHS的摩尔比为1:1。
作为本发明所述制备方法的一种优选方案,其中:所述缩硫酮溶与EDC、NHS的摩尔比为2:1。
本发明的再一个目的是,克服现有技术中的不足,提供一种壳聚糖缩硫酮活性氧清除水凝胶的制备方法制得的壳聚糖缩硫酮活性氧清除水凝胶。
本发明的另一个目的是,克服现有技术中的不足,提供壳聚糖缩硫酮活性氧清除水凝胶在抗菌剂、活性氧清除生物医用材料和药物递送领域中的应用。
本发明有益效果:
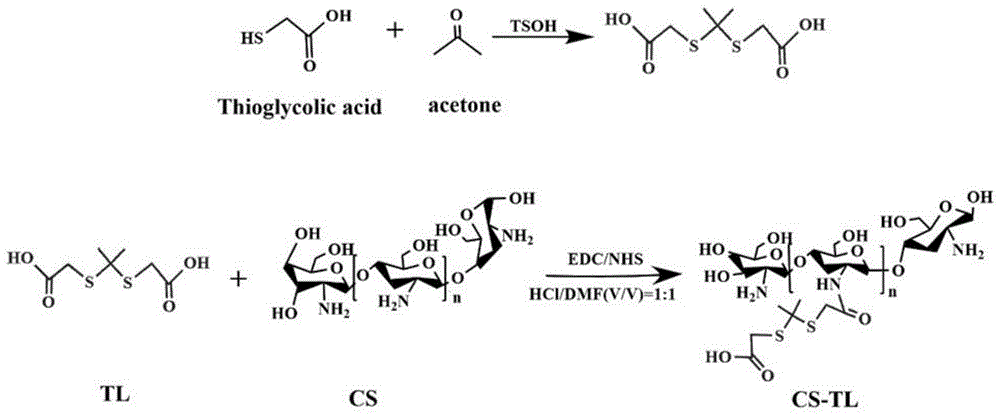
(1)相较于壳聚糖,本发明所制备的壳聚糖衍生物水凝胶呈现更加良好的自由基清除力,不同黏度的缩硫酮化壳聚糖达到IC50时,浓度大小为MCS-TL (2)本发明所制备的壳聚糖衍生物水凝胶对金黄色葡萄球菌的抑制变现为:低粘度的改性缩硫酮壳聚糖水凝胶因其良好的水溶性呈现出最优的抗菌效果,其抑菌率达到(99.93±0.105)%,高黏度改性壳聚糖水凝胶抑菌率达到(91.57±10.813)%,中黏度的改性壳聚糖抑制率为(67.09±10.426)%;对大肠杆菌的抑制率,对不同低、中、高黏度CS-TL的抑菌率分别为(96.53±5.603)%、(82.55±3.165)%、(91.87±0.55)%。相较于壳聚糖,本发明制备的壳聚糖衍生物具有水溶性,活性氧清除能力更强,抗菌效果更佳。 (3)本发明制备的水凝胶有望在抗菌、抗炎、药物递送具有潜在应用潜能。 附图说明 为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中: 图1为本发明实施例中CS-TL的合成流程图。 图2(a)为CS、TL、LCS-TL、MCS-TL、HCS-TL的FT-IR谱图;(b)为CS、TL、LCS-TL、MCS-TL、HCS-TL核磁谱图。 图3(a)为不同浓度的LCS-TL、MCS-TL、HCS-TL的DPPH清除率;(b)为不同浓度的LCS-TL、MCS-TL、HCS-TL的TMB清除率;(c)DPPH(NO·)在518nm的紫外吸收谱图;(d)TMB在652nm的紫外吸收谱图。 图4为LCS-TL、MCS-TL、HCS-TL对大肠杆菌和金黄色葡萄球菌的涂布平板计数法图。 图5(a)为LCS-TL、MCS-TL、HCS-TL对金黄色葡萄球菌的抑菌率;(b)为LCS-TL、MCS-TL、HCS-TL对大肠杆菌的抑菌率。 具体实施方式 为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合说明书实施例对本发明的具体实施方式做详细的说明。 在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。 其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。 实施例1 CS-TL衍生物及水凝胶的制备(LCS-TL): 制备CS-TL: 制备流程如图1所示:称取壳聚糖1g(分子量1W)溶于50mL 0.1M盐酸溶液,配置成壳聚糖溶液,用1mol/LNaOH溶液调节壳聚糖溶液pH(4-6),然后加入50mL去离子水; 精密称取TL(1.5g)溶于25ml DMF,EDC、NHS(191.70g/mol、115.09g/mol)摩尔质量比=1:1.2溶解于25mL无水乙醇,待溶解充分混合; 将TL与EDC/NHS混合液加到完全溶解的壳聚糖溶液中,缓慢加入100mLDMF,反应24h,去离子水透析,干燥得到CS-TL。 CS-TL水凝胶制备: 将CS-TL溶于去离子水(与去离子水的体积比为=1:400),得到CS-TL水凝胶。 实施例2 CS-TL衍生物及水凝胶的制备(MCS-TL): 制备CS-TL: 制备流程如图1所示:称取壳聚糖1g(分子量15w)溶于50mL 0.1M盐酸溶液,配置成壳聚糖溶液,用1mol/LNaOH溶液调节壳聚糖溶液pH(4-6),然后加入50mL去离子水; 精密称取TL(1.5g)溶于25ml DMF,EDC、NHS(191.70g/mol、115.09g/mol)摩尔质量比=1:1.2溶解于25mL无水乙醇,待溶解充分混合; 将TL与EDC/NHS混合液加到完全溶解的壳聚糖溶液中,缓慢加入100mLDMF,反应24h,去离子水透析,干燥得到CS-TL。 CS-TL水凝胶制备: 将CS-TL溶于去离子水(与去离子水的体积比为=1:400),得到CS-TL水凝胶。 实施例3 CS-TL衍生物及水凝胶的制备(HCS-TL): 制备CS-TL: 制备流程如图1所示:称取壳聚糖1g(分子量120w)溶于50mL 0.1M盐酸溶液,配置成壳聚糖溶液,用1mol/LNaOH溶液调节壳聚糖溶液pH(4-6),然后加入50mL去离子水; 精密称取TL(1.5g)溶于25ml DMF,EDC、NHS(191.70g/mol、115.09g/mol)摩尔质量比=1:1.2溶解于25mL无水乙醇,待溶解充分混合; 将TL与EDC/NHS混合液加到完全溶解的壳聚糖溶液中,缓慢加入100mLDMF,反应24h,去离子水透析,干燥得到CS-TL。 CS-TL水凝胶制备: 将CS-TL溶于去离子水(与去离子水的体积比为=1:400),得到CS-TL水凝胶。 实施例4 所得CS-TL水凝胶的表征: FT-IR用于产物的结构评价。 如图2a中CS-TL所示,CS-TL相比于CS在3000~2930cm 因实验通过EDC/NHS酰胺反应,红外图谱分析可看出,在1720~1680cm H1 NMR分析如图2b显示,壳聚糖δ2.06处为壳聚糖葡萄糖单元上C2位氨基的特征吸收峰,δ3.89~3.16处为壳聚糖葡萄糖单元上C2~C4位氢的特征吸收峰。相比于CS,CS-TL的核磁图谱中,δ2.06处吸收峰明显减弱,说明壳聚糖氨基发生了反应被消耗了;如图3,δ1.50~1.60处为TL甲基上的氢特征吸收峰,δ2.4~3.0处为亚甲基特征吸收峰且呈对称结构;因反应产生酰胺键,在δ8.10处出现-NH-特征吸收且未出现-COOH的氢特征吸收峰,证明了CS-TL结构。在δ1.59处为甲基吸收峰,δ3.32为亚甲基吸收峰及DMSO水吸收峰,δ12.59处峰为羧基上氢吸收峰。 实施例5 CS-TL水凝胶清除DPPH自由基的能力: 以无水乙醇为溶剂,配制浓度为0.1M的DPPH·乙醇溶液,得到DPPH·工作液。37℃避光孵育10min后,检测其吸光度。 DPPH·清除率计算公式如下: 其中,A DPPH·氧化反应如下: 如图3(a)不同黏度的缩硫酮化壳聚糖达到IC50时,浓度大小为MCS-TL 如图3(c)不同黏度的CS-TL、CS共同孵育5min后的波长图谱。在518nm处吸光度,CS也有相应的降低,这验证了壳聚糖自身有一定的抗氧化能力,不过缩硫酮壳聚糖水凝胶在相同时间内可以大幅度的降低活性自由基的能力。 实施例6 CS-TL水凝胶清除四甲基联(TMB)的能力: 等体积的H TMB氧化反应如下: TMB清除率如图3(b),结果表明MCS-TL清除率最好。说明合成的缩硫酮化壳聚糖凝胶具有活性氧、自由基的清除能力,且中黏度的活性氧清除能力最好,如图3(b)在652nm处吸光度CS也有相应的降低这验证了壳聚糖自身有一定的抗氧化能力,不过缩硫酮壳聚糖在相同时间内可以大幅度的降低活性自由基的能力。 实施例7 CS-TL水凝胶的抗菌性能: 抗菌实验过程:选用2.5mg/mL不同黏度缩硫酮壳聚糖凝胶进行大肠杆菌BL21、金黄色葡萄球菌ATCC12228抑菌实验: 以壳聚糖为空白对照,称取不同的壳聚糖产物溶于去离子水,紫外照射一夜后,备用。 将活化后的菌稀释成1×10 CS-TL水凝胶的抑菌率计算:采用平板菌落计数,计算抑菌率公式如下: 抑菌率(%)=CFU(exp.)/CFU(con.)×100% 其中,CFU(exp.)为实验组菌落数,CFU(con.)为对照组菌落数。 实验计算结果:低粘度的改性缩硫酮壳聚糖水凝胶因其良好的水溶性呈现出最优的抗菌效果,其抑菌率达到(99.93±0.105)%,高黏度改性壳聚糖水凝胶抑菌率达到(91.57±10.813)%,中黏度的改性壳聚糖抑制率为(67.09±10.426)%。 对大肠杆菌的抑制率如图4所示,对不同低、中、高黏度CS-TL的抑菌率分别为(96.53±5.603)%、(82.55±3.165)%、(91.87±0.55)%,其中抑菌率超过90%能达到杀菌效果,抑制率为70~90%是具有抑菌效果。 本发明通过大量实验摸索,制备了一种快速清除活性氧的水凝胶,通过缩硫酮改性的不同分子量壳聚糖水凝胶具有优异的抗菌活性及活性氧清除能力。CS-TL凝胶还具有优异的可注射性且具有一定的黏附性。 ROS的过度积累会诱导氧化应激,也会引起失控的炎症反应、坏死和瘢痕化等有害过程,从而延迟皮肤慢伤的愈合和受损组织的再生。本发明可为治疗活性氧堆积和细菌导致的慢性疾病如痤疮等提供参考价值,也可以对慢性创面治疗提供良好的条件。 本发明成功制备了CS-TL水凝胶。体外自由基清除、抑菌实验表明,CS-TL同时具有抗氧化,活性氧清除及抗菌多种功能,同时水溶性良好。 应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的范围当中。
- 一种含有缩硫酮键的支化聚醚酰亚胺材料及其制备方法与应用
- 一种羧乙基壳聚糖/聚乙烯醇自愈合水凝胶及其制备方法和应用
- 一种基于三维打印技术的双网络负载壳聚糖酶水凝胶敷料及其制备方法
- 壳聚糖缩羟基萘醛席夫碱和壳聚糖缩羟基萘醛席夫碱铜配合物的制备方法及其产品和应用
- 一种基于活性氧自放大降解的聚硫缩醛及其制备方法和应用
