基于天然细胞外囊泡的球形核酸及其制备方法、向细胞递送细胞外囊泡的方法
文献发布时间:2024-04-18 19:58:26
技术领域
本发明涉及生物医药技术领域,具体而言,涉及基于天然细胞外囊泡的球形核酸及其制备方法、向细胞递送细胞外囊泡的方法。
背景技术
生物外囊泡是一类具有膜结构的天然生物囊泡,直径范围在40-1000纳米之间,可以携带多种蛋白质、脂类、核酸等生物信息物质,是进化上保守的一种通讯媒介。根据生物来源的不同,生物外囊泡可分为细菌外囊泡(OMVs)和细胞外囊泡(EVs)。细胞外囊泡来源广泛,可以从细胞培养液、体液、牛奶、植物汁液等生物源性溶液中广泛获得。此外,细胞外囊泡具有纳米尺寸、高生物相容性、低免疫原性、以及跨越生物屏障的能力,可作为理想的药物递送载体。多项研究表明细胞外囊泡可以实现小分子药物、蛋白质、核酸和纳米颗粒的有效递送,治疗多种疾病。然而,天然细胞外囊泡的细胞利用率较低,极大地影响了细菌外膜囊泡进一步应用。如何提高细胞对细胞外囊泡的生物利用效率是其转化应用的关键问题。现有的改造细胞外囊泡的方法如基因工程、化学共价修饰等具有作复杂、反应条件苛刻、修饰效率低、生物相容性差等不足。
发明内容
本发明解决的技术问题是天然细胞外囊泡的细胞利用率较低,极大地影响了细菌外膜囊泡进一步应用;现有的改造天然细胞外囊泡的方法如基因工程、化学共价修饰等具有作复杂、反应条件苛刻、修饰效率低、生物相容性差等不足。
为解决上述技术问题,本发明采用的技术方案为:
一种基于天然细胞外囊泡的球形核酸的制备方法,包括以下步骤:
步骤S1、提取天然细胞外囊泡;
步骤S2、将所述天然细胞外囊泡与胆固醇修饰的单链DNA混合均匀,超滤处理,得到基于天然细胞外囊泡的球形核酸。
优选地,所述步骤S1中,所述提取天然细胞外囊泡包括:
步骤S11、取细胞外囊泡提取液,将所述细胞外囊泡提取液离心处理,取上清液,过滤处理,得到细胞上清液;
步骤S12、将所述细胞上清液超速离心,去除上清液,得到的沉淀以PBS缓冲液重悬,得到天然细胞外囊泡。
优选地,所述步骤S11中,所述离心处理包括:先将所述细胞培养液在2800-3200g的转速下,离心15-25min,将得到的上清液在9000-11000g的转速下,离心25-35min。
优选地,所述步骤S12中,所述超速离心的转速为95000-105000g,时间为1-2h。
优选地,所述步骤S1中,所述细胞外囊泡提取液包括细胞培养液、体液、牛奶、植物汁液中的一种。
优选地,所述步骤S2中,所述将所述天然细胞外囊泡与胆固醇修饰的单链DNA混合均匀包括:将所述天然细胞外囊泡与所述胆固醇修饰的单链DNA混合,室温震荡,其中,所述震荡的速度为300-700rpm,时间为3-7min。
优选地,所述步骤S2中,制备所述胆固醇修饰的单链DNA采用的单链DNA选自含有7-28个碱基的直链DNA。
本发明还提供了一种基于天然细胞外囊泡的球形核酸,采用如上所述的基于天然细胞外囊泡的球形核酸的制备方法制得。
与现有技术相比,本发明提供了一种改造天然细胞外囊泡的方法,以提高细胞对天然细胞外囊泡摄取效率;本发明采用疏水胆固醇修饰的DNA插入到天然细胞外囊泡磷脂双分子层中,在磷脂双分子层表面构筑一层致密、三维伸展的核酸外壳,从而形成天然细胞外囊泡的球形核酸。球形核酸中形成的致密的3D核酸结构,可以更好地与细胞表面的SR-A受体结合;而且,SR-A受体能显著介导细胞对球形核酸的摄取;因而本发明制备的基于天然细胞外囊泡的球形核酸,可以促使天然细胞外囊泡更高效的进入细胞。本发明提供的改造天然细胞外囊泡的方法,操作步骤简单、反应条件宽松、制作时间短、生物相容性好、修饰效率高,适合不同细胞来源的天然细胞外囊泡的改造修饰。
本发明还提供了一种向细胞递送细胞外囊泡的方法,包括:将如上所述的基于天然细胞外囊泡的球形核酸与细胞共培养,孵育处理。
优选地,所述孵育处理的温度为37℃,时间为1.5-2.5h。
与现有技术相比,本发明提供的向细胞递送细胞外囊泡的方法,细胞对细胞外囊泡的摄取效率更高。
附图说明
图1为本发明实施例中制备基于天然细胞外囊泡的球形核酸的流程图;
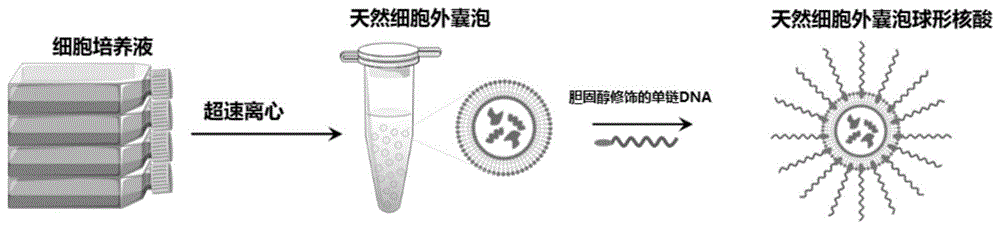
图2为本发明中制备基于天然细胞外囊泡的球形核酸的示意图;
图3为实施例1中提取的天然细胞外囊泡的透射电子显微镜图片;
图4为实施例1中制备的基于天然细胞外囊泡的球形核酸的DMi8SINFINITY TIRF全内反射荧光显微镜分析荧光共定位分析图;
图5为实施例1的制备过程中得到的天然细胞外囊泡和基于天然细胞外囊泡的球形核酸的粒径分析图;
图6为实施例1的制备过程中得到的天然细胞外囊泡和基于天然细胞外囊泡的球形核酸Zeta电位图;
图7为实施例1中制备的基于天然细胞外囊泡的球形核酸进入细胞MDA-MB-231细胞系的激光共聚焦图;
图8为对比例1中制备的天然细胞外囊泡进入细胞MDA-MB-231细胞系的激光共聚焦图;
图9为实施例1中制得的基于天然细胞外囊泡的球形核酸和对比例1中制得的天然细胞外囊泡进入细胞MDA-MB-231细胞系的统计分析对比图;
图10为对比例1和实施例1-5中细胞外囊泡进入细胞MDA-MB-231细胞系的激光共聚焦对比图;
图11为对比例1和实施例1-5中细胞外囊泡进入细胞MDA-MB-231细胞系的流式细胞分析对比图。
具体实施方式
为使本发明的上述目的、特征和优点能够更为明显易懂,下面结合附图对本发明的具体实施例做详细的说明。
需要说明的是,在不冲突的情况下,本发明中的实施例中的特征可以相互组合。术语“包含”、“包括”、“含有”、“具有”的含义是非限制性的,即可加入不影响结果的其它步骤和其它成分。以上术语涵盖术语“由……组成”和“基本上由……组成”。如无特殊说明的,材料、设备、试剂均为市售。
如图1所示,本发明实施例提供了一种基于天然细胞外囊泡的球形核酸的制备方法,包括以下步骤:
步骤S1、提取天然细胞外囊泡;
步骤S2、将所述天然细胞外囊泡与胆固醇修饰的单链DNA混合均匀,超滤处理,得到基于天然细胞外囊泡的球形核酸。
超滤处理是为了去除未反应核酸。将该天然细胞外囊泡的球形核酸与人源细胞共孵育,天然细胞外囊泡可以高效进入细胞。图2为本发明中制备基于天然细胞外囊泡的球形核酸示意图。
与现有技术相比,本发明提供了一种改造天然细胞外囊泡的方法,以提高细胞对天然细胞外囊泡摄取效率;本发明采用疏水胆固醇修饰的DNA插入到天然细胞外囊泡磷脂双分子层中,在磷脂双分子层表面构筑一层致密、三维伸展的核酸外壳,从而形成天然细胞外囊泡的球形核酸。球形核酸中形成的致密的3D核酸结构,可以更好地与细胞表面的SR-A受体结合;而且,SR-A受体能显著介导细胞对球形核酸的摄取;因而本发明制备的基于天然细胞外囊泡的球形核酸,可以促使天然细胞外囊泡更高效的进入细胞。本发明提供的改造天然细胞外囊泡的方法,操作步骤简单、反应条件宽松、制作时间短、生物相容性好、修饰效率高,适合不同细胞来源的天然细胞外囊泡的改造修饰。
本发明的实施例中,所述步骤S1中,所述提取天然细胞外囊泡包括:
步骤S11、取细胞外囊泡提取液,将所述细胞外囊泡提取液离心处理,取上清液,过滤处理,得到细胞上清液;
步骤S12、将所述细胞上清液超速离心,去除上清液,得到的沉淀以PBS缓冲液重悬,得到天然细胞外囊泡。
需要说明的是PBS缓冲液,是生物化学研究中使用最为广泛的一种缓冲液,主要成分为Na
具体而言,所述步骤S11中,所述离心处理包括:先将所述细胞培养液在2800-3200g的转速下,离心15-25min,将得到的上清液在在9000-11000g的转速下,离心25-35min。优选地,所述步骤S12中,所述超速离心的转速为95000-105000g,时间为1-2h。
本发明的实施例中,所述步骤S1中,所述细胞外囊泡提取液包括细胞培养液、体液、牛奶、植物汁液中的一种。
本发明的实施例中,所述步骤S2中,所述将所述天然细胞外囊泡与胆固醇修饰的单链DNA混合均匀包括:将所述天然细胞外囊泡与所述胆固醇修饰的单链DNA混合,室温震荡,其中,所述震荡的速度为300-700rpm,时间为3-7min。将所述天然细胞外囊泡与所述胆固醇修饰的单链DNA混合,室温震荡,更有利于二者混合均匀。
本发明的实施例中,所述步骤S2中,制备所述胆固醇修饰的单链DNA采用的单链DNA选自含有7-28个碱基的直链DNA。
本发明还提供了一种DNA功能化修饰的细菌外膜囊泡,采用如上所述的DNA功能化修饰的细菌外膜囊泡的制备方法制得。
本发明还提供了一种向细胞递送细胞外囊泡的方法,包括:将如上所述的基于天然细胞外囊泡的球形核酸与细胞共培养,孵育处理。
优选地,所述孵育处理的温度为37℃,时间为1.5-2.5h。
与现有技术相比,本发明提供的向细胞递送细胞外囊泡的方法,细胞对细胞外囊泡的摄取效率更高。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
需要说明的是,本发明实施例中使用的胆固醇修饰的单链DNA是从生工生物工程(上海)股份有限公司购买的单链DNA,序列为:5’-AAAATACGAGCTGAGAATCCT-3’,纯化方式为HPLC纯化。该单链DNA的5’端修饰有胆固醇基团。该胆固醇修饰的单链DNA可使用实验室的DNA合成仪完成,也可在购买单链DNA时进行定制;本发明实施例中是在生工生物工程(上海)股份有限公司进行定制的。
实施例1
1.1、天然细胞外囊泡的提取
1.1.1、用离心管取50mL人乳腺癌细胞培养液在3000g下离心20分钟,将离心后的上清液转移至新的离心管中,在10000g下离心30分钟,取上清液,用0.22μm的过滤器过滤,得到细胞上清液。
1.1.2、将细胞上清液以100000g超速离心90分钟,去除上清液,将离心管底部得到的沉淀以500μL PBS缓冲液重悬,得到天然细胞外囊泡。
1.2、基于天然细胞外囊泡的球形核酸的制备
将60μL天然细胞外囊泡与20μL胆固醇修饰的DNA(40μM)混合,得到胆固醇修饰的DNA浓度为10μM的混合溶液,将混合溶液在500rpm下震荡5分钟,随后通过100KD超滤离心管在5000g下离心三次,每次5分钟,滤除游离核酸,得到基于天然细胞外囊泡的球形核酸。
实施例2
与实施例1的不同之处在于,第二步中天然细胞外囊泡与胆固醇修饰的DNA混合得到的混合溶液中胆固醇修饰的DNA浓度为0.5μM。
实施例3
与实施例1的不同之处在于,第二步中天然细胞外囊泡与胆固醇修饰的DNA混合得到的混合溶液中胆固醇修饰的DNA浓度为1.0μM。
实施例4
与实施例1的不同之处在于,第二步中天然细胞外囊泡与胆固醇修饰的DNA混合得到的混合溶液中胆固醇修饰的DNA浓度为2.0μM。
实施例5
与实施例1的不同之处在于,第二步中天然细胞外囊泡与胆固醇修饰的DNA混合得到的混合溶液中胆固醇修饰的DNA浓度为15μM。
对比例1
1.1.1、用离心管取50mL人乳腺癌细胞培养液在3000g下离心20分钟,将离心后的上清液转移至新的离心管中,在10000g下离心30分钟,取上清液,用0.22μm的过滤器过滤,得到细胞上清液。
1.1.2、将细胞上清液以100000g超速离心90分钟,去除上清液,将离心管底部得到的沉淀以500μL PBS缓冲液重悬,得到天然细胞外囊泡。
实验例1
对实施例1中提取的天然细胞外囊泡进行透射电子显微镜表征,结果见图3,从图3可以看出实施例1中提取的天然细胞外囊泡粒径约为85nm囊泡状结构。对实施例1中制备的基于天然细胞外囊泡的球形核酸利用DMi8SINFINITY TIRF全内反射荧光显微镜分析荧光共定位分析,结果如图4所示,对实施例1的制备过程中得到的天然细胞外囊泡和基于天然细胞外囊泡的球形核酸利用Anton Paar Litesizer 500纳米粒径分析仪进行粒径和Zeta电位分析,结果如图5和图6所示。从图4中可以看出,DNA成功修饰在细胞外囊泡上,从图5可以看出,天然细胞外囊泡的直径为40-160nm,修饰DNA后的细胞外囊泡球形核酸的水合粒径变大,从图6可以看出天然细胞外囊泡zeta电位大小为-13.54mV。基于天然细胞外囊泡的球形核酸zeta电位为-21.36mV,进一步证实了DNA成功修饰在细胞外囊泡上了。需要说明的是,在利用DMi8SINFINITY TIRF全内反射荧光显微镜分析荧光共定位分析时,天然细胞外囊泡用ExoSparkler Exosome Membrane Labeling试剂盒标记,核酸用FAM荧光基团标记。图4中上标为“细胞外囊泡”的图片为红色荧光信号图,用于显示细胞外囊泡的分布情况,上标为“胆固醇修饰的DNA”的图片为绿色荧光信号,用于显示核酸的分布情况;上标为“共定位”的图片为红色荧光和绿色荧光信号的叠加图。图6中A对应天然细胞外囊泡,B对应基于天然细胞外囊泡的球形核酸。
实验例2
需要说明的是,为了便于对比分析,在实验例2中实施例1-5和对比例1中制得天然细胞外囊泡后即利用ExoSparkler Exosome Membrane Labeling Kit-Red试剂盒(同仁化学公司)将得到的天然细胞外囊泡标记为红色,将细胞膜用ExoSparkler PlasMem BrightGreen染料标记,带绿色荧光;细胞核用Hoechst 33342标记,带蓝色荧光。
将实施例1中制得的基于天然细胞外囊泡的球形核酸与人乳腺癌细胞系MDA-MB-231在无血清培养基孵育2小时,激光共聚焦拍摄人乳腺癌细胞对基于天然细胞外囊泡的球形核酸的摄取情况,观测结果如图7所示。将对比例1中制得的天然细胞外囊泡与人乳腺癌细胞系MDA-MB-231在无血清培养基孵育2小时,激光共聚焦拍摄人乳腺癌细胞对天然细胞外囊泡的摄取情况,观测结果如图8所述。对实施例1中和对比例1的实验结果进行统计分,析结果如图9所示,对比图7和图8可以看出,相比于对比例1中天然细胞外囊泡,实施例1中制备的基于天然细胞外囊泡的球形核酸红色荧光信号更强;实施例1中制备的基于天然细胞外囊泡的球形核酸可以更高效进入细胞。由图9可以看出,与天然细胞外囊泡相比,细胞对基于天然细胞外囊泡的球形核酸摄取明显增加,荧光强度增加约6-7倍。需要说明的是,图7和图8中,上标为“Exosomes red”的图片为激发波长561nm,发射波长570-640nm拍摄的细胞内红色荧光信号图,用于显示天然细胞外囊泡的分布情况,上标为“PlasmGreen”的图片为激发波长488nm,发射波长500-560nm拍摄的细胞内绿色荧光信号图,用于显示细胞中细胞核;上标为“共定位”的图片为红色荧光信号和绿色荧光信号两个通路信号叠加图。图9中A对应对比例1,B对应实施例1,纵坐标表示荧光强度,即Fluorescence intensity,三颗星代表实施例1和对比例1的差异很大。
为了分析细胞外囊泡表面单链DNA插入密度对细胞外囊泡球形核酸进入细胞能力的影响,将实施例1-5中制得的基于天然细胞外囊泡的球形核酸和对比例1中制得的天然细胞外囊泡分别与人乳腺癌细胞系MDA-MB-231在无血清培养基孵育2小时,激光共聚焦拍摄人乳腺癌细胞对细胞外囊泡的摄取情况,观测结果的对比分析见图10,采用流式细胞仪检测人乳腺癌细胞对细胞外囊泡的摄取情况,观测结果的对比分析见图11。从图10和图11可以看出,随着单链DNA插入密度的增加,细胞外囊泡球形核酸进入细胞的能力逐渐增强。
需要说明的是,图10中上标为“球形核酸”的图片为激发波长561nm,发射波长570-640nm拍摄的细胞内红色荧光信号图,用于显示天然细胞外囊泡的分布情况,上标为“细胞膜”的图片为激发波长488nm,发射波长500-560nm拍摄的细胞内绿色荧光信号图,用于显示细胞中细胞核;上标为“共定位”的图片为红色荧光信号和绿色荧光信号两个通路信号叠加图。在图10和图11中,系列control对应对比例1,系列10μM对应实施例1,系列0.5μM对应实施例2,系列1μM对应实施例3,系列2μM对应实施例4,系列15μM对应实施例5。图11中横坐标表示荧光强度,即Fluorescence intensity,纵坐标表示不同荧光强度对应的乳腺癌细胞数,即Counts。
另外,需要说明的是,虽然本发明披露如上,但本发明的保护范围并非仅限于此。本领域技术人员在不脱离本发明的精神和范围的前提下,可进行各种变更与修改,这些变更与修改均将落入本发明的保护范围。
- 一种基于细胞外囊泡负载的树突状细胞的肿瘤疫苗及制备方法和应用
- 一种超顺磁修饰中性粒细胞外泌体仿生囊泡药物递送生物制剂及其制备方法
