一种复合多肽的多功能止血修复海绵及其制备方法
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及医疗器械领域,尤其涉及一种具有伤口止血、抗炎及修复功能的多孔海绵制剂及其制备方法。
背景技术
伤口治疗是医学领域的一个重要方向。在创伤和外科手术等伤口处理中,止血修复材料具有广泛的应用。传统的止血材料往往只具备单一功能,且无法满足不同伤口的多方面需求。因此,开发一种具有多功能的止血修复材料具有重要的实际意义。
目前,一些具有多功能的止血修复材料已经被开发出来。例如,一些含有生物活性物质(如生长因子、抗菌药物等)的材料已经被应用于伤口治疗。此外,一些含有多种成分的材料也被用于伤口治疗中。然而,这些材料仍然存在一些问题,如生物相容性和稳定性差、成分无法控制等。因此,需要开发一种具有良好生物相容性和稳定性的多功能止血修复材料。
海绵制剂是一种常见的止血修复材料。它具有大量的孔隙结构,可与体液等液体相互作用。因此,海绵制剂具有较高的组织相容性和生物活性,可用于伤口治疗。然而,传统的海绵制剂仍然存在一些问题,如孔隙结构不稳定、未能充分利用孔隙结构等。
因此,开发一种具有良好生物相容性和稳定性的多孔海绵制剂,具有重要的实际意义。
发明内容
本发明的目的是提供一种多功能止血修复海绵及其制备方法,该海绵具有快速止血、抗炎及修复等功能,可广泛应用于伤口处理。
为实现上述目的,本发明采用以下技术方案:
一种多功能多孔止血修复海绵,所述海绵包括:
内层:由丝素蛋白和DES-1系列制备而成;中间层:由丝素蛋白和DES-2系列组成;外层:由丝素蛋白和短肽组成;
其中,所述DES-1由传明酸和有机酸制备得到;所述DES-2由精氨酸和有机酸制备得到;所述短肽的序列为KIIK(SEQ NO ID:1)、KKIIKK(SEQ NOID:2)、RRIIRR(SEQ NO ID:3)、KRIIKR(SEQ NO ID:4)、KRIIIIKR(SEQ NOID:5)、KKIIIIKK(SEQ NO ID:6)或RRIIIIRR(SEQ NO ID:7)。
在一种实施方式中,所述内层中,DES-1占丝素蛋白的质量的0.1%~3%,优选为0.5%~2.5%,可以是0.5%、1%、2%或2.5%。
在一种实施方式中,所述中间层中,DES-2占丝素蛋白的质量的0.1%~6%,优选为1%~5%,可以是1%、2%、3%或5%。
在一种实施方式中,所述外层中,短肽占丝素蛋白的质量的0.1%~5%,优选为0.5%~3%,可以是0.5%、2%或3%。
在一种实施方式中,所述内层、中间层、外层中丝素蛋白的质量比为1:2~4:2~6
在一种实施方式中,所述DES-1是按照传明酸和有机酸的摩尔比1:1-5:1制备得到,其中,所述有机酸包括苹果酸、柠檬酸、酒石酸、扁桃酸中任一种或几种,按照摩尔比1:1~5:1分别称量有机酸和传明酸溶于溶剂中,置于惰性氛围下30-80℃搅拌反应6-24h,除去多余溶剂,透析纯化得到DES-1。优选的,所述溶剂为水。
在一种实施方式中,所述DES-2是按照精氨酸和有机酸的摩尔比为1:1-5:1制备得到,有机酸包括但不限于甘草酸、苹果酸、柠檬酸、乳酸等的任一种,按照摩尔比1:1~2分别称量有机酸和精氨酸溶于溶剂中,置于惰性氛围下30-80℃搅拌反应6-24h,除去多余溶剂,透析纯化得到DES-1。优选的,所述溶剂为水。
在一种实施方式中,所述丝素蛋白可以通过以下方法提取:1、脱胶:1)将25.44g无水Na
在一种实施方式中,所述多功能多孔止血修复海绵:内层由丝素蛋白和DES-1制备而成,具有较大孔径,能够快速止血;中间层由丝素蛋白和DES-2组成,具有较小孔径,能够止血同时具有抗炎功能;外层由丝素蛋白和短肽组成,具有修复功能。
本发明还提供了上述多功能多孔止血修复海绵的制备方法,包括以下步骤:
(1)分别按照比例制备得到DES-1和DES-2;
(2)根据不同层需求将丝素蛋白分别与DES-1、DES-2、短肽混合,分别得到内层溶液、中间层溶液、外层溶液,溶剂为水;
(3)先经内层溶液冷冻;之后将冷冻后的内层结构放置于中间层溶液下,再次进行冷冻;之后将冷冻得到的结构放置在外层溶液下,进行冷冻;
(4)将步骤(3)得到的冷冻后的多孔结构进行冷冻干燥;
(5)将冷冻干燥后的海绵进行水蒸汽处理即可。
在一种实施方式中,步骤(3)中,所述冷冻优选梯度冷冻:将上述混合溶液进行梯度冷冻,分别包括-80~0℃,处理时间分别是2~72小时。
在一种实施方式中,所述内层溶液、中间层溶液、外层溶液中丝素蛋白的浓度分别为5~20wt%、5~20wt%、5~20wt%。
在一种实施方式中,步骤(3)中,所述冷冻可以是先将内层-20℃、-80℃梯度冷冻,然后在其上层浇筑中间层,-20℃、-80℃下梯度冷冻,然后外层溶液覆盖上层,梯度-20℃、-80℃冷冻。
在一种实施方式中,步骤(4)中,所述冷冻干燥(冷阱-65℃)的时间是48h-96h。
在一种实施方式中,步骤(5)中,所述蒸汽处理是指在50-60℃用水蒸气熏蒸,处理时间为12-72小时。
最后,本发明还提供了包含所述的多功能多孔止血修复海绵的医疗器械。
与现有技术相比,本发明具有以下优点:
(1)本发明所提供的方法可用于制备含有DES的海绵材料,这些材料适用于药物缓释、组织工程和生物医学应用等领域。
(2)本发明采用独特的组成和结构,结合冷冻干燥和蒸汽处理等工艺,形成了多孔的海绵结构。这些工艺能够保持DES的稳定性和活性,并且为海绵材料提供了良好的孔隙结构和生物相容性。
(3)本发明所制备的海绵材料具有良好的生物相容性和生物可降解性,能够在体内有效地缓释药物,并且促进细胞生长和修复。
附图说明
图1实施例1制备的一种复合短肽的多功能止血修复海绵的实物图。
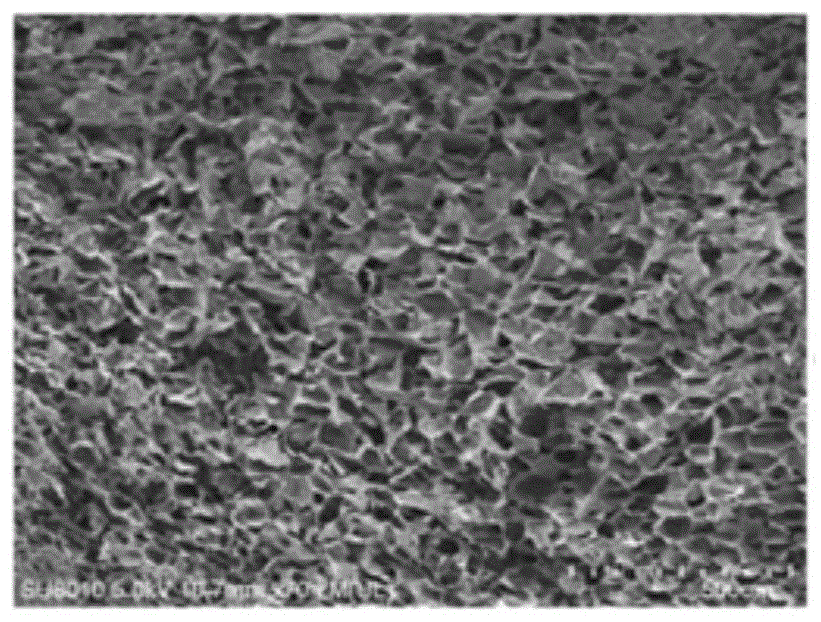
图2实施例1制备的一种复合短肽的多功能止血修复海绵的微观形貌图。
图3实施例1~2和对比例1~2制备的绵的凝血指数对比图。
图4实施例1制备的一种复合短肽的多功能止血修复海绵的细胞增殖率统计图。
具体实施方式
下面通过具体实施例进一步详细阐明本发明,但并不是对本发明的限制,仅仅作示例说明。
实施例1:
(1)提取丝素蛋白:丝素蛋白的提取:1、脱胶:1)将25.44g无水Na
DES的制备方法:按照摩尔比1:1分别称量有机酸和碱的粉末溶于样品瓶中,置于氮气氛围下加热(40℃)搅拌6h,使用旋蒸仪蒸干多余水分,透析纯化得到DES。其中,传明酸苹果酸为DES-1,精氨酸甘草酸为DES-2。
(2)内层溶液:将丝素蛋白(6%)与0.5% DES-1混合均匀,中间层溶液:将丝素蛋白(6%)与2% DES-2混合均匀,外层溶液:将丝素蛋白(6%)与0.5%的短肽(序列为KKIIIIKK)混合均匀,其中,内层、中间层、外层溶液中丝素蛋白的质量比为1:2:2;
(3)将溶液按照内层、中间层、外层的顺序进行梯度冷冻;梯度冷冻的参数为:内层在4℃冷藏2小时,-20℃冷冻5小时,-80℃冷冻10小时;中间层在-20℃冷冻5小时,-80℃冷冻10小时,外层在-20℃冷冻5小时,-80℃冷冻10小时;
(4)将冷冻后的多孔结构进行冷冻干燥72h;
(5)将冻干后的海绵进行蒸汽处理12小时。
实施例2:
(1)提取丝素蛋白:丝素蛋白的提取:1、脱胶:1)将25.44g无水Na
DES的制备方法:按照摩尔比1:2分别称量有机酸和碱的粉末溶于样品瓶中,置于氮气氛围下加热(50℃)搅拌12h,使用旋蒸仪蒸干多余水分,透析纯化得到DES。有机酸包括:扁桃酸、甘草酸,碱包括传明酸、精氨酸。传明酸扁桃酸为DES-1,精氨酸甘草酸为DES-2。
(2)内层溶液:将丝素蛋白(8%)与1% DES-1混合均匀,中间层溶液:将丝素蛋白(8%)与3% DES-2混合均匀,外层溶液:将丝素蛋白(8%)与1%的短肽(序列为RRIIIIRR)混合均匀,其中,内层、中间层、外层溶液中丝素蛋白的质量比为1:2:4;
(3)将溶液按照内层、中间层、外层的顺序进行梯度冷冻;梯度冷冻的参数为:内层在4℃冷藏4小时,-20℃冷冻7小时,-80℃冷冻15小时;中间层在-20℃冷冻5小时,-80℃冷冻10小时,外层在-20℃冷冻5小时,-80℃冷冻10小时;
(4)将冷冻后的多孔结构进行冷冻干燥96h;
(5)将冻干后的海绵进行蒸汽处理24小时。
实施例3:
(1)提取丝素蛋白:丝素蛋白的提取:1、脱胶:1)将25.44g无水Na
DES的制备方法:按照摩尔比1:2分别称量有机酸和碱的粉末溶于样品瓶中,置于氮气氛围下加热(60℃)搅拌24h,使用旋蒸仪蒸干多余水分,透析纯化得到DES。有机酸包括:柠檬酸、甘草酸,碱包括传明酸、精氨酸。传明酸柠檬酸为DES-1,精氨酸苹果酸为DES-2。
(2)内层溶液:将丝素蛋白(14%)与2% DES-1混合均匀,中间层溶液:将丝素蛋白(14%)与4%甘草酸精氨酸DES-2混合均匀,外层溶液:将丝素蛋白(10%)与1.5%的8肽(序列为KKIIIIKK)混合均匀,其中,内层、中间层、外层溶液中丝素蛋白的质量比为1:3:5;
(3)将溶液按照内层、中间层、外层的顺序进行梯度冷冻;梯度冷冻的参数为:内层在4℃冷藏6小时,-20℃冷冻9小时,-80℃冷冻18小时;中间层在-20℃冷冻5小时,-80℃冷冻10小时,外层在-20℃冷冻5小时,-80℃冷冻10小时;
(4)将冷冻后的多孔结构进行冷冻干燥72h;
(5)将冻干后的海绵进行蒸汽处理48小时。
实施例4:
(1)提取丝素蛋白:丝素蛋白的提取:1、脱胶:1)将25.44g无水Na
DES的制备方法:按照摩尔比1:2分别称量有机酸和碱的粉末溶于样品瓶中,置于氮气氛围下加热(80℃)搅拌6h,使用旋蒸仪蒸干多余水分,透析纯化得到DES。有机酸包括:柠檬酸、甘草酸,碱包括传明酸、精氨酸。传明酸柠檬酸为DES-1,精氨酸甘草酸为DES-2。
(2)内层溶液:将丝素蛋白(12%)与2.5%传明酸柠檬酸DES-1混合均匀,中间层溶液:将丝素蛋白(10%)与5%精氨酸甘草酸DES-2混合均匀,外层溶液:将丝素蛋白(17%)与2%的短肽(序列为KKIIKK)混合均匀,其中,内层、中间层、外层溶液中丝素蛋白的质量比为1:2:4;
(3)将溶液按照内层、中间层、外层的顺序进行梯度冷冻;梯度冷冻的参数为:内层在4℃冷藏5小时,-20℃冷冻8小时,-80℃冷冻16小时;中间层在-20℃冷冻5小时,-80℃冷冻16小时,外层在-20℃冷冻5小时,-80℃冷冻16小时;
(4)将冷冻后的多孔结构进行冷冻干燥72h;
(5)将冻干后的海绵进行蒸汽处理48小时。
本发明所提供的方法可用于制备含有DES的海绵材料,这些材料适用于药物缓释、组织工程和生物医学应用等领域。
对比例1
(1)提取丝素蛋白:丝素蛋白的提取:1、脱胶:1)将25.44g无水Na
(2)将丝素蛋白溶液(6%)在4℃冷藏2小时,-20℃冷冻5小时,-80℃冷冻10小时;
(3)将冷冻后的多孔结构进行冷冻干燥72h;
(4)将冻干后的海绵进行蒸汽处理48小时。
对比例2
(1)提取丝素蛋白:丝素蛋白的提取:1、脱胶:1)将25.44g无水Na
(2)内层溶液:将丝素蛋白(6%)与2%精氨酸甘草酸DES-2(制备方法同实施例1)混合均匀,外层溶液:将丝素蛋白(6%)与0.5%的短肽(序列为KKIIIIKK)混合均匀,其中,内层、外层溶液中丝素蛋白的质量比为1:1;
(3)将溶液按照内层、外层的顺序进行梯度冷冻;梯度冷冻的参数为:内层在4℃冷藏2小时,-20℃冷冻5小时,-80℃冷冻10小时;外层在-20℃冷冻5小时,-80℃冷冻10小时;
(4)将冷冻后的多孔结构进行冷冻干燥72h;
(5)将冻干后的海绵进行蒸汽处理12小时。
在本发明的实施例中,我们以丝素蛋白为模板材料,通过与不同配方的DES混合,制备出了六种不同类型的DES海绵材料。这些材料的物理性质和生物活性已在实验室中进行了测试和评估。
测定实施例1~2和对比例1~2得到的海绵材料的凝血指数和吸水率测试。
凝血指数测试(通过血红蛋白溶液的吸光度值来判断其血液凝结速率)结果见图3,其中3M是指3M公司购买的Tegaderm型号的止血海绵,正常组是指未经干预的实验情况。可见,本发明实施例1的止血效果最优,凝血指数在30s时为58%,止血速度更快。实施例2和市售3M的止血海绵水平相当,同样为凝血效果优异的海绵材料,对比例1的止血效果和正常组差异不大,基本上无有效凝血效果,对比例2中DES-2的加入能够有效提高凝血速率,但是仍然不及本发明实施例1~2和3M海绵材料。
图4为修复海绵的浸提液对L929细胞增殖的影响,方法是按照碧云天CCK-8试剂盒的属龙进行,利用酶标仪进行检测。参考标准G/B 16886,结果表明我们制备的修复海绵具有很好的生物安全性。
测定本发明实施例1~2和对比例1~2得到的海绵材料的吸水率,结果见表1。
表1本发明实施例1~2和对比例1~2得到的海绵材料的吸水率
可见,本发明的海绵材料的吸水效果优异且吸水速度快。同样的利用本发明实施例3~4制备得到的海绵材料用于上述测试时,均能取得和实施例1基本上一致的效果。
当实施例1中的短肽KKIIIIKK替换为KIIK、KKIIKK、RRIIRR、KRIIKR、KRIIIIKR或RRIIIIRR时,制备得到的海绵材料的性能和实施例1相差不大。
在本发明的实施例中,我们使用了冷冻干燥和蒸汽处理等工艺,以形成多孔的海绵结构。这些工艺能够保持DES的稳定性和活性,并且为海绵材料提供了良好的孔隙结构和生物相容性。
在实验中,我们发现所制备的海绵材料具有良好的生物相容性和生物可降解性,能够在体内有效地缓释药物,并且促进细胞生长和修复。这些数据表明,所制备的DES海绵材料具有广泛的应用前景,可以用于药物缓释、组织工程和生物医学应用等领域。
因此,本发明所提供的方法和材料,可以满足人们对高效、稳定和生物相容性的海绵材料的需求,具有重要的工业和医学应用价值。
尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
