一种定量测定肺炎球菌C多糖含量的核磁方法
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及一种定量测定肺炎球菌C多糖含量的核磁方法,属于生物医药领域。
背景技术
肺炎球菌是一种常见的致病菌,引起了许多疾病,包括肺炎、脑膜炎和中耳炎等。尤其对幼儿、老年人和免疫功能低下的人群具有较高的致病性和死亡率。荚膜是肺炎球菌的主要的致病因子,荚膜中含有荚膜多糖,是一种复杂的多糖结构,由多个糖残基组成,其具有高度的结构特异性和免疫原性是肺炎球菌的主要保护性抗原,可在正常人群中产生免疫反应。肺炎球菌的荚膜多糖已广泛应用于肺炎球菌疫苗开发。目前,已上市的疫苗有23价肺炎球菌多糖疫苗和7价/13价肺炎球菌多糖蛋白结合疫苗。不管是多糖疫苗还是多糖蛋白结合疫苗,肺炎球菌荚膜多糖都是疫苗的主要有效成分。荚膜多糖的质量直接影响疫苗的免疫效果。虽然肺炎球菌多糖疫苗已有几十年的历史,且生产工艺已逐渐迭代优化,但在肺炎球菌多糖疫苗的生产过程中一直有一种杂质持续存在,即肺炎球菌C多糖(C-Ps)。
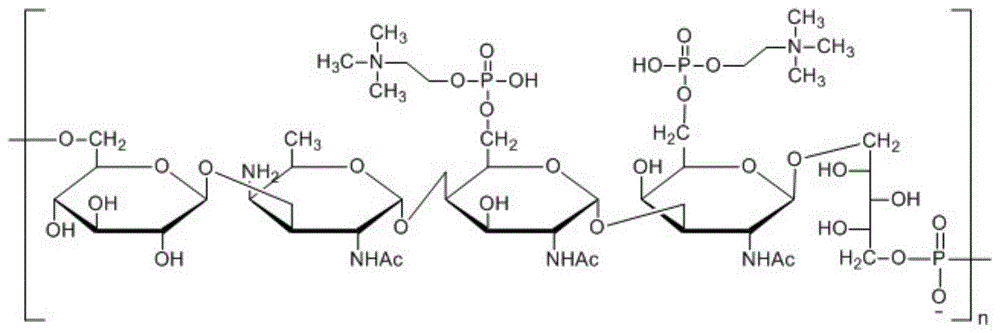
C-Ps是一种所有肺炎球菌共有的细胞壁多糖,是由一个磷酸二酯键连接的五个单糖以及2个磷酸胆碱取代基(P-Cho)组成的重复单元。其分子大小与荚膜多糖没有很大差异,因此在纯化肺炎球菌荚膜多糖时通常会残留低水平的C-Ps。残留的C-Ps通常以游离形式或与荚膜多糖共价连接的形式存在。世界卫生组织建议严格控制C-Ps含量,因为它可能与多糖抗原诱导的反应一起引入非期望的免疫反应。目前,国内疫苗审评机构以及《欧洲药典》已经开始严格关注和限制肺炎球菌荚膜多糖中C-Ps杂质的含量。
目前,检测C-Ps的方法有脉冲安培检测器的高效阴离子交换色谱法。这种方法依据C-Ps水解释放的核糖醇残基进行定量,但这意味着含有核糖醇的荚膜多糖(例如、血清型6A、6B、10A、17F、24F、35B等)无法定量。另一种方法是高性能排阻色谱(HPSEC)分析法,该方法可以对游离的C-Ps进行分离和定量,但对与荚膜多糖共价连接的C-Ps的定量检测有一定局限性。另外还有酶联免疫吸附法(ELISA),该方法需要使用C-Ps单克隆抗体以及肺炎球菌C多糖标准品,采用间接法进行测定,这导致了昂贵的测试成本,较低的准确度,并受到检测原理的限制酶联法定量限高,重复性差,对于C-Ps含量极少的肺炎球菌多糖样品难以准确检测。
核磁共振技术作为一种非破坏性、定量性强且无需特殊处理的分析方法,逐渐成为肺炎球菌荚膜多糖分析的重要手段。目前,WHO和《欧洲药典》推荐使用核磁技术对肺炎球菌荚膜多糖进行质量控制。基于核磁共振检测原理,该方法具有高准确性、高灵敏度、高重现性以及极低的变异系数,能够准确可靠的实现定量检测。其次,该方法不需要对样品进行前处理或使用额外的试剂,避免了化学法和免疫法的局限性问题。另外,核磁检测方法的测试操作简单,样品用量少且可回收,能够准确灵敏的实现痕量样品的检测。
但是,如何使用核磁共振技术对肺炎球菌荚膜多糖中的C-Ps含量进行检测现有技术没有报道。
发明内容
本发明的目的是建立一种采用核磁共振技术对肺炎球菌荚膜多糖中的C-Ps含量进行检测的方法,为此,本发明开发了基于内标定量核磁法测定C-Ps的含量。
C-Ps与荚膜多糖很相似,但本发明人发现C-Ps核磁定量信号中P-Cho基团上甲基质子信号具有特殊性,该信号能与荚膜多糖的核磁信号完全分开,使其不干扰C-Ps的检测。
另外,本发明人选择化学性质稳定、纯度高、不与荚膜多糖和C-Ps发生化学反应且核磁信号也能与荚膜多糖、C-Ps完全分开的内标物化合物。
进一步的,本发明人针对荚膜多糖、C-Ps和内标物的化学特性,提供了优化了的核磁定量参数,提出了专门针对肺炎球菌荚膜多糖中C-Ps含量测定的定量核磁方法。该方法能够避免因荚膜多糖溶液的高粘度而影响定量结果,也能够避免因待测物多糖为生物大分子,内标物为小分子,因其质子所处化学环境不同而导致定量结果误差大的问题。
本发明提供了一种定量测定肺炎球菌荚膜多糖中C-Ps含量的核磁方法,具体包括如下过程:
(1)将内标物溶于氘水中配制内标溶液;
(2)将肺炎球菌荚膜多糖溶于内标溶液中,得到多糖样品溶液;
(3)将多糖样品溶液转移至核磁管中,设置好定量核磁参数,进行检测,获得
在本发明的一种实施方式中,内标物为二甲基砜、DMSO、六甲基磷酰三胺。
步骤1中所述内标溶液的配制方法为:以0.05mg/mL DMSO溶液50mL为例,称取DMSO2.50mg,加入50.0mL氘水,涡旋混合均匀。
在本发明的一种实施方式中,肺炎球菌荚膜多糖包括1型肺炎球菌荚膜多糖、2型肺炎球菌荚膜多糖、3型肺炎球菌荚膜多糖、4型肺炎球菌荚膜多糖、5型肺炎球菌荚膜多糖、6A型肺炎球菌荚膜多糖、6B型肺炎球菌荚膜多糖、7F型肺炎球菌荚膜多糖、8型肺炎球菌荚膜多糖、9N型肺炎球菌荚膜多糖、9V型肺炎球菌荚膜多糖、10A型肺炎球菌荚膜多糖、11A型肺炎球菌荚膜多糖、12F型肺炎球菌荚膜多糖、14型肺炎球菌荚膜多糖、15A型肺炎球菌荚膜多糖、15B型肺炎球菌荚膜多糖、15C型肺炎球菌荚膜多糖、16F型肺炎球菌荚膜多糖、17F型肺炎球菌荚膜多糖、18C型肺炎球菌荚膜多糖、19A型肺炎球菌荚膜多糖、19F型肺炎球菌荚膜多糖、20型肺炎球菌荚膜多糖、22F型肺炎球菌荚膜多糖、23A型肺炎球菌荚膜多糖、23B型肺炎球菌荚膜多糖、23F型肺炎球菌荚膜多糖、24F型肺炎球菌荚膜多糖、31型肺炎球菌荚膜多糖、33F型肺炎球菌荚膜多糖、35B型肺炎球菌荚膜多糖、38型肺炎球菌荚膜多糖。
步骤2中所述样品溶液的配制方法为:以配制10mL浓度为4mg/mL的肺炎球菌多糖溶液为例,称取肺炎球菌荚膜多糖40mg,加入10.0mL内标溶液,涡旋使多糖完全溶解。
在本发明的一种实施方式中,内标溶液的浓度为0.001-0.1mg/mL,荚膜多糖样品溶液的浓度为1-10mg/mL。
在本发明的一种实施方式中,定量核磁的参数为脉冲程序zg,脉冲角为90度,实验绝对温度控制为298-302K,采样谱宽为6000Hz,灵敏度0.18Hz,采样点数为64K,线宽因子为0.3Hz,采样时间为5.45s,空扫次数不小于2次,采样次数不小于64次,脉冲延迟时间不小于40s,自动增益。
在本发明的一种实施方式中,内标物二甲基砜的核磁定量特征峰为2个甲基质子,化学位移为3.02ppm,固定积分范围为2.99-3.04ppm。内标物DMSO的核磁定量特征峰为2个甲基质子,化学位移为2.65ppm,固定积分范围为2.62-2.67ppm。内标物六甲基磷酰三胺的核磁定量特征峰为6个甲基质子,化学位移为2.71ppm,固定积分范围为2.68-2.73ppm。肺炎球菌荚膜多糖中C-Ps的核磁定量特征峰为2个P-Cho基团上的六个甲基质子,化学位移为3.15ppm,固定积分范围为3.14-3.17ppm。
在本发明的一种实施方式中,荚膜多糖中C-Ps百分含量(P)可以按照如下公式(1)计算:
公式中,P表示荚膜多糖中C-Ps百分含量;A
核磁定量参数中空扫次数、采样次数以及脉冲延迟时间属于重要参数,能够决定定量结果的准确性。空扫即真正开始采样前先采集的次数,空扫次数会影响真正开始采样时采集数据的稳定性。采样次数与数据的的重现性有关,较少的采样次数会造成数据重现性差。足够的采样次数会使数据比较稳定、重现性好,并且能提高信噪比,使谱线更加平滑。脉冲延迟时间即驰豫延迟时间(D1),合适的D1值能够保证谱峰强度不会被饱和,有利于对谱峰进行正确的积分,得到正确的结果。如果D1很短,则被激发到高能态的质子就不能通过驰豫而达到玻尔兹曼平衡,从而使累加的信号失去提高信噪比和定量积分的目的。
本发明通过加标回收实验筛选出了最优参数,空扫次数考察了0次,2次,4次,16次,通过筛选实验发现,当空扫次数≥2次时,采集的数据稳定,谱图平滑,利于积分处理。采样次数筛选实验发现,当采样次数<64次时,由于多糖为生物大分子,粘度大,配制样品的浓度不能太高,得到的核磁图谱信号弱且噪声重,不利于定量分析;当采样次数≥64次时,能有效提高信噪比,且核磁图谱信号强,谱线平滑利于定量分析。弛豫时间筛选实验考察了D1为2s,4s,8s,10s,20s,40s,60s,80s,100s时,对定量峰面积的影响,测试结果显示,当D1<40s时,被测样品与内标的积分面积比会随着D1的延长而逐渐变大,因而不能获得准确的定量结果;当D1≥40s时,样品与内标物的定量峰面积比值无明显变化,可获得准确的定量结果。因此本发明采用空扫次数不小于2次,采样次数不小于64次,脉冲延迟时间不小于40s定量参数进行分析。
本发明有益效果:
本发明的检测方法与色谱法和酶联免疫法相比,具有诸多优势如:该方法无需标准品,检测费用低;不需要对样品进行复杂的前处理,操作简单,耗时少,能够节省大量人力和时间成本;另外该方法基于核磁共振原理具有准确度高,重复性好,灵敏度高,样品可回收等优点。
附图说明
图1为C-Ps重复单元结构
图2为6A、10A、19F、33F型肺炎球菌荚膜多糖重复单元结构
图3为6A型肺炎球菌荚膜多糖核磁共振氢谱图
图4为10A型肺炎球菌荚膜多糖核磁共振氢谱图
图5为19F型肺炎球菌荚膜多糖核磁共振氢谱图
图6为33F型肺炎球菌荚膜多糖核磁共振氢谱图
具体实施方式
以下通过具体实施例进一步说明本发明。
下面结合具体实施例对本发明所述的产品及其制备方法作进一步阐述,但本发明并不限于以下实施例。所述方法如无特别说明均为常规方法。所述原材料如无特别说明均能从公开商业途径获得。
本发明涉及的定量测定肺炎球菌C-Ps含量的核磁方法,具体包括以下步骤
1.内标溶液的配制;
2.荚膜多糖样品溶液的配制;
3.将荚膜多糖样品溶液加入核磁管;
4.设置核磁参数,采集核磁数据;
5.核磁图进行相位调整和基线校正,对内标物和C-Ps
6.C-Ps含量的计算。
步骤1中内标溶液的浓度为0.05mg/mL。
步骤2中荚膜多糖样品溶液的浓度为4mg/mL。
步骤3中取荚膜多糖样品溶液0.5mL于核磁管中,室温超声1min除气泡。
步骤4中核磁参数为脉冲程序zg,脉冲角为90度,实验绝对温度控制为300K,采样谱宽为6000Hz,灵敏度0.18Hz,采样点数为64K,线宽因子为0.3Hz,采样时间为5.45s,空扫次数为4次,采样次数64次,脉冲延迟时间40s,自动增益。
步骤5中获得的核磁图首先进行相位调整和基线校正,内标物二甲基砜的核磁定量特征峰为2个甲基质子,化学位移为3.02ppm,固定积分范围为2.99-3.04ppm。内标物DMSO的核磁定量特征峰为2个甲基质子,化学位移为2.65ppm,固定积分范围为2.62-2.67ppm。内标物六甲基磷酰三胺的核磁定量特征峰为6个甲基质子,化学位移为2.71ppm,固定积分范围为2.68-2.73ppm。肺炎球菌荚膜多糖中C-Ps的核磁定量特征峰为2个P-Cho基团上的六个甲基质子,化学位移为3.15ppm,固定积分范围为3.14-3.17ppm。
实验中所用氘代试剂为D
实施例1、测定方法
内标溶液制备:称取DMSO内标1.50mg,加入30.0mL氘水中,涡旋-静置-涡旋使内标溶液混匀,得内标溶液浓度为0.05mg/mL。
多糖样品溶液制备:称取6A型荚膜多糖20mg,溶解于5mL内标溶液中,涡旋-静置-涡旋使样品溶液混匀,配成4mg/mL的6A型荚膜多糖样品溶液。
核磁样品制备:取6A型荚膜多糖样品溶液0.5mL至核磁管中,室温超声1min,除去溶液中残留的微小气泡。
仪器参数设置:脉冲程序zg,脉冲角为90度,实验绝对温度控制为300K,采样谱宽为6000Hz,灵敏度0.18Hz,采样点数为64K,线宽因子为0.3Hz,采样时间为5.45s,空扫次数为4次,采样次数64次,脉冲延迟时间40s,自动增益。
图谱处理:将6A荚膜多糖核磁氢谱图进行相位调整和基线校正后,对C-Ps和内标定量特征峰进行积分,化学位移δ2.65ppm为内标定量特征峰,积分范围为2.62-2.67ppm,积分面积定义为6。化学位移δ3.15ppm为C-Ps定量特征峰,积分范围为3.14-3.17ppm。积分面积为0.769。
内标DMSO的摩尔质量为78.1,特征峰的质子当量为13.017,C-Ps的摩尔质量为1300.2,特征峰的质子当量为72.233,根据定量峰积分面积和多糖浓度,按如下公式计算6A型肺炎球菌荚膜多糖中C-Ps的百分含量
公式中,P表示荚膜多糖中C-Ps含量;A
根据公式计算,6A型肺炎球菌荚膜多糖中C-Ps含量为0.889%。
实施例2、测定方法
内标溶液制备:称取DMSO内标2.00mg,加入40.0mL氘水中,涡旋-静置-涡旋使内标溶液混匀,得内标溶液浓度为0.05mg/mL。
多糖样品溶液制备:称取10A型荚膜多糖40mg,溶解于10mL内标溶液中,涡旋-静置-涡旋使样品溶液混匀,配成4mg/mL的10A型荚膜多糖样品溶液。
核磁样品制备:取10A型荚膜多糖样品溶液0.5mL至核磁管中,室温超声1min,除去溶液中残留的微小气泡。
仪器参数设置:脉冲程序zg,脉冲角为90度,实验绝对温度控制为300K,采样谱宽为6000Hz,灵敏度0.18Hz,采样点数为64K,线宽因子为0.3Hz,采样时间为5.45s,空扫次数为4次,采样次数64次,脉冲延迟时间40s,自动增益。
图谱处理:将10A荚膜多糖核磁氢谱图进行相位调整和基线校正后,对C-Ps和内标定量特征峰进行积分,化学位移δ2.65ppm为内标定量特征峰,积分范围为2.62-2.67ppm,积分面积定义为6。化学位移δ3.15ppm为C-Ps定量特征峰,积分范围为3.14-3.17ppm。积分面积为1.177。
内标DMSO的摩尔质量为78.1,特征峰的质子当量为13.017,C-Ps的摩尔质量为1300.2,特征峰的质子当量为72.233,根据定量峰积分面积和多糖浓度,按如下公式计算10A型肺炎球菌荚膜多糖中C-Ps的百分含量
公式中,P表示荚膜多糖中C-Ps含量;A
根据公式计算,10A型肺炎球菌荚膜多糖中C-Ps含量为1.361%。
实施例3、测定方法
内标溶液制备:称取DMSO内标1.00mg,加入20.0mL氘水中,涡旋-静置-涡旋使内标溶液混匀,得内标溶液浓度为0.05mg/mL。
多糖样品溶液制备:称取19F型荚膜多糖24mg,溶解于6mL内标溶液中,涡旋-静置-涡旋使样品溶液混匀,配成4mg/mL的19F型荚膜多糖样品溶液。
核磁样品制备:取19F型荚膜多糖样品溶液0.5mL至核磁管中,室温超声1min,除去溶液中残留的微小气泡。
仪器参数设置:脉冲程序zg,脉冲角为90度,实验绝对温度控制为300K,采样谱宽为6000Hz,灵敏度0.18Hz,采样点数为64K,线宽因子为0.3Hz,采样时间为5.45s,空扫次数为4次,采样次数64次,脉冲延迟时间40s,自动增益。
图谱处理:将19F荚膜多糖核磁氢谱图进行相位调整和基线校正后,对C-Ps和内标定量特征峰进行积分,化学位移δ2.65ppm为内标定量特征峰,积分范围为2.62-2.67ppm,积分面积定义为6。化学位移δ3.15ppm为C-Ps定量特征峰,积分范围为3.14-3.17ppm。积分面积为1.550。
内标DMSO的摩尔质量为78.1,特征峰的质子当量为13.017,C-Ps的摩尔质量为1300.2,特征峰的质子当量为72.233,根据定量峰积分面积和多糖浓度,按如下公式计算19F型肺炎球菌荚膜多糖中C-Ps的百分含量
公式中,P表示荚膜多糖中C-Ps含量;A
根据公式计算,19F型肺炎球菌荚膜多糖中C-Ps含量为1.792%。
实施例4、测定方法
内标溶液制备:称取DMSO内标1.50mg,加入30.0mL氘水中,涡旋-静置-涡旋使内标溶液混匀,得内标溶液浓度为0.05mg/mL。
多糖样品溶液制备:称取33F型荚膜多糖28mg,溶解于7mL内标溶液中,涡旋-静置-涡旋使样品溶液混匀,配成4mg/mL的33F型荚膜多糖样品溶液。
核磁样品制备:取33F型荚膜多糖样品溶液0.5mL至核磁管中,室温超声1min,除去溶液中残留的微小气泡。
仪器参数设置:脉冲程序zg,脉冲角为90度,实验绝对温度控制为300K,采样谱宽为6000Hz,灵敏度0.18Hz,采样点数为64K,线宽因子为0.3Hz,采样时间为5.45s,空扫次数为4次,采样次数64次,脉冲延迟时间40s,自动增益。
图谱处理:将33F荚膜多糖核磁氢谱图进行相位调整和基线校正后,对C-Ps和内标定量特征峰进行积分,化学位移δ2.65ppm为内标定量特征峰,积分范围为2.62-2.67ppm,积分面积定义为6。化学位移δ3.15ppm为C-Ps定量特征峰,积分范围为3.14-3.17ppm。积分面积为1.991。
内标DMSO的摩尔质量为78.1,特征峰的质子当量为13.017,C-Ps的摩尔质量为1300.2,特征峰的质子当量为72.233,根据定量峰积分面积和多糖浓度,按如下公式计算33F型肺炎球菌荚膜多糖中C-Ps的百分含量
公式中,P表示荚膜多糖中C-Ps含量;A
根据公式计算,33F型肺炎球菌荚膜多糖中C-Ps含量为2.302%。
