鉴别熊本牡蛎的特征序列、特异性鉴定引物及鉴定方法
文献发布时间:2023-06-19 10:33:45
技术领域
本发明涉及分子生物学与水产种质资源保护及应用领域,具体是一种鉴别熊本牡蛎(Crassostrea sikamea)的特征序列、特异性鉴定引物及鉴定方法。
背景技术
牡蛎,俗称蚝、蚵、蛎黄等,在世界范围内均有分布,全球年产量600多万吨,是重要的海水养殖贝类。我国牡蛎资源丰富,养殖品种多样,北方的辽宁、山东等省养殖种类主要为长牡蛎(Crassostrea gigas),福建省为福建牡蛎(C.angulata),广东广西为香港牡蛎(C.hongkongensis)和近江牡蛎(C.ariakensis)。浙江省海域面积广阔,沿海有象山港、乐清湾、三门湾等重要养殖海湾,牡蛎等滩涂贝类是主要养殖种类之一,2018年浙江省牡蛎产量达22万吨(农业部渔业局,2019)。另外,本区域内的牡蛎苗种以自然采苗为主,本发明人近来对浙江省三个主要养殖海湾的牡蛎物种鉴定结果表明,浙江沿海主要有熊本牡蛎和福建牡蛎两种牡蛎分布,其中熊本牡蛎是优势种且应该是土著种。
熊本牡蛎因最早发现于日本熊本县而得名,其与长牡蛎、福建牡蛎相比,个体较小,左壳更深。其被当作长牡蛎于上世纪四十年代从日本引进到美国西海岸,并进行了人工繁育与养殖。一般认为熊本牡蛎口感优于其他牡蛎种类,逐渐成为高端的牡蛎品种。另外,由于熊本牡蛎自然分布于日本、韩国及中国江苏南通以南沿海,群体遗传学的研究表明浙江沿海的熊本牡蛎遗传多样性显著高于日本和韩国群体,浙江沿海可能是熊本牡蛎的起源地。
由于牡蛎壳型多变,基于壳型进行牡蛎物种鉴定较为困难,且在日本及中国南部多个海区存在熊本牡蛎与其他物种同域分布的现象,另外在人工繁殖条件下其可以和福建牡蛎、香港牡蛎及近江牡蛎单向受精产生后代。来自美国的熊本牡蛎群体的教训值得我们深思,熊本牡蛎被引入美国后,由于当时缺乏物种分子鉴定方法,仅能通过壳型加以判断物种,使得熊本牡蛎的基因库因有意或无意杂交而被太平洋牡蛎污染,使得其遗传多样性下降,有效群体变小,这提醒研究人员开启其他工作前准确地进行物种鉴定是极其重要的。
在过去的十几年中,研究人员建立了一系列牡蛎物种分子鉴定方法,靶标基因包括内源转录间隔区1(internally transcribed spacer 1,ITS1),线粒体基因如细胞色素氧化酶I(COI)和16S等常用的遗传标记。鉴定方法包括使用基于Hae III和Hind III限制内切酶进行ITS1基因区分熊本牡蛎和太平洋牡蛎的方法。使用PCR-RFLP分析以区分我国南部沿海七种牡蛎的方法,基于COI基因的多重PCR的区分五种巨蛎属牡蛎种类的方法,以及基于COI的不依赖物种特异性PCR或片段长度多态性的高分辨率融解分析方法。如200710030295专利申请公开的华南沿海七种巨蛎属牡蛎的PCR-RFLP鉴别方法,主要针对多种巨牡蛎属物种,其中包括了熊本牡蛎,而其需要对PCR产物进行双酶切,酶切后条带较多,1-5条不等,使得鉴定不易开展,容易有误差。201210189381专利申请公开的牡蛎近缘物种鉴定的方法,针对多种巨牡蛎属物种,其中包括了熊本牡蛎,通过PCR扩增,利用扩增产物在高分辨率熔解曲线(HRM)中的Tm值差异进而区分牡蛎物种,该方法需要较为昂贵的高分辨率溶解曲线仪器,成本较高,且一般实验室不具备该设备。多重PCR方法(Wang等2008)针对多种巨牡蛎属物种,通过COI基因编码区多个特异性PCR引物,根据产物长度判定牡蛎物种,而在实践中需要加入多达6种引物,且COI作为编码基因,物种间差异有限,可能产生非特异性扩增导致产物条带不单一,从而鉴定失败。201610165034专利申请公开的分子鉴别近江牡蛎和熊本牡蛎的方法,仅能用于鉴别近江牡蛎和熊本牡蛎,适用范围有限。201711041921专利申请公开的基于DNA特异片段的熊本牡蛎鉴定方法,能从广泛分布的牡蛎中特异性地鉴别出熊本牡蛎,而该方法中PCR产物目的条带较短,仅100bp左右,不易与引物二聚体等非目的条带区分开。综上可见,针对性更强、更简单的鉴定重要的养殖牡蛎物种-熊本牡蛎的方法亟待建立。
发明内容
本发明所要解决的技术问题是,针对牡蛎的甘氨酸tRNA合成酶和脯氨酸tRNA合成酶之间的线粒体非编码区,提出一种鉴别熊本牡蛎的特征序列、特异性鉴定引物及鉴定方法,可在熊本牡蛎种质资源保护、人工繁殖及相关生物学研究中发挥重要作用。
本发明人通过分析数据库中已有的几种巨蛎属牡蛎的线粒体基因组序列,发现几种巨蛎属牡蛎在甘氨酸tRNA合成酶和脯氨酸tRNA合成酶之间的线粒体非编码区的序列长度有一定的差别,几种巨蛎属牡蛎的序列长度在700-815bp之间,序列多态性高。通过目的区域两侧的两个编码基因上设计通用引物对该非编码区扩增,采用的上游引物MNR-F为:5'-CTGTAAGTATATTTGTCTTCCA-3',下游引物MNR-R为:5'-GACGTTGTAAGCGTCATGTAAT-3',发现同一物种不同个体间该区域序列长度较为保守。经检测,不同物种对应的序列长度分别为:熊本牡蛎749bp,福建牡蛎739bp,长牡蛎737bp,近江牡蛎812bp,香港牡蛎704bp。但是基于序列长度的差异不足以将熊本牡蛎区分出来。本发明人通过扩增分析该区域更多数量的熊本牡蛎的序列,发现熊本牡蛎的序列在上游引物序列下游660bp左右与其他物种差异较大,可以基于该区域设计下游特异性引物。因此,本发明提出一种鉴别熊本牡蛎的特征序列、特异性鉴定引物及鉴定方法。
本发明解决上述技术问题所采用的技术方案为:鉴别熊本牡蛎的特征序列,该特征序列位于牡蛎的甘氨酸tRNA合成酶和脯氨酸tRNA合成酶之间的线粒体非编码区,该特征序列为SEQ ID NO.1所示的核苷酸序列。
鉴别熊本牡蛎的特异性鉴定引物,该特异性鉴定引物的序列为:
上游引物MNR-F:5'-CTGTAAGTATATTTGTCTTCCA-3';
下游特异性引物MNR-S-R:5'-AGGCTTTCACTCCACTTACT-3'。
鉴别熊本牡蛎的鉴定方法,基于线粒体非编码区对熊本牡蛎进行特异性鉴定,具体包括以下步骤:
(1)将采集到的熊本牡蛎解剖后,对闭壳肌组织取样,液氮速冻后低温冰箱保存;
(2)使用试剂盒进行熊本牡蛎基因组DNA提取,得到DNA原液,质检合格后将DNA原液稀释至1-10ng/μL,作为PCR模板备用;
(3)设计上游引物MNR-F和下游特异性引物MNR-S-R作为物种鉴定的特异性鉴定引物,其中,上游引物MNR-F为5'-CTGTAAGTATATTTGTCTTCCA-3',下游特异性引物MNR-S-R为5'-AGGCTTTCACTCCACTTACT-3';
(4)以步骤(2)中提取得到的熊本牡蛎基因组DNA为模板,利用设计的特异性鉴定引物进行PCR扩增反应,得到目的片段的PCR产物;
(5)将PCR产物在220V、200mA条件下进行1.2%琼脂糖凝胶电泳,得到大小660±5bp的产物条带,即为熊本牡蛎的特征序列SEQ ID NO.1。
作为优选,步骤(4)中PCR扩增反应的反应程序为:94℃预变性3分钟;再进行30个循环:94℃、30秒,50℃、30秒,72℃、50秒;最后72℃延伸10分钟。
与现有技术相比,本发明具有如下优点:本发明基于不同物种牡蛎的甘氨酸tRNA合成酶和脯氨酸tRNA合成酶之间的线粒体非编码区序列多态性高、物种间差异较大的特点,确定了熊本牡蛎的特征序列,并开发了鉴别熊本牡蛎的特异性鉴定引物及鉴定方法,可以将熊本牡蛎与其他四种巨蛎属牡蛎物种有效区分,确定的熊本牡蛎的特征序列长度为660±5bp,而其他四种巨蛎属牡蛎物种无特异性条带,可以通过此特异性条带的有无及大小判断是否为熊本牡蛎。在熊本牡蛎种质资源保护及熊本牡蛎育种领域,可在苗种繁育前对亲贝进行物种鉴定,保证繁育苗种为纯种而不受其他可能与之杂交的物种的影响。本发明鉴定方法的优势在于不依赖于昂贵仪器,无需测序,也无需对PCR产物进行酶切,操作简便、明了,可快速且特异性高地完成熊本牡蛎的鉴定,该方法与测序验证结果一致,无错误鉴定个体。
附图说明
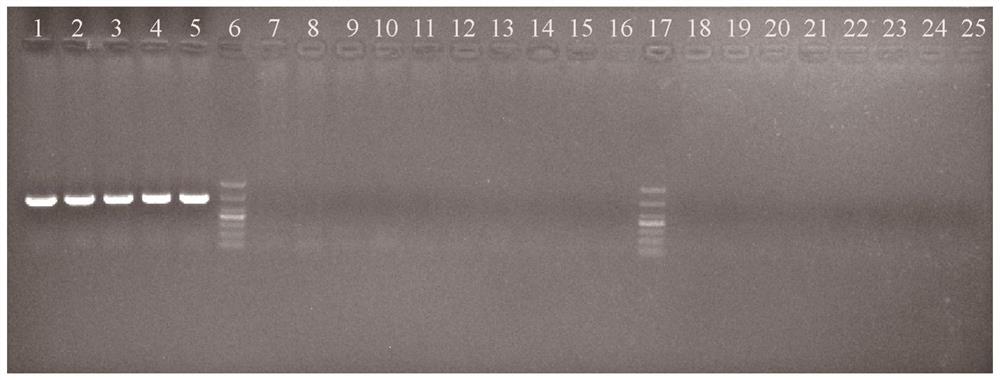
图1为实施例1中五种巨蛎属牡蛎特异性引物扩增结果;
图2为实施例1中五种巨蛎属牡蛎通用上游引物序列比对结果;
图3为实施例1中五种巨蛎属牡蛎下游特异性引物序列比对结果;
图4为实施例2中四个地点牡蛎特异性引物验证结果。
具体实施方式
以下结合附图实施例对本发明作进一步详细描述。
实施例1:
a)样品采集
采集青岛海区养殖的长牡蛎,福建海区养殖的福建牡蛎,广东海区养殖的近江牡蛎和香港牡蛎以及浙江宁波海区养殖的熊本牡蛎,每个地点牡蛎随机取样30只,牡蛎解剖后将闭壳肌放入冻存管中,液氮速冻后于-80℃冰箱保存;
b)DNA的提取
1)每个牡蛎个体取20mg左右的组织于1.5mL的灭菌的离心管中,使用DNA试剂盒进行DNA提取,得到DNA原液;
2)提取好的DNA原液进行1.2%琼脂糖凝胶电泳检测DNA的完整性,使用Nanodrop检测DNA的浓度和纯度;
3)用灭菌水将提取好的DNA原液稀释至1-10ng/μL,用于后续的PCR扩增;
c)物种分子鉴定
使用MNR及COI通用引物进行PCR以扩增序列,将PCR产物进行测序,将测序结果在NCBI数据库进行序列比对,证实了取样得到的长牡蛎、福建牡蛎、近江牡蛎、香港牡蛎及熊本牡蛎物种的正确性;
d)特异性引物PCR扩增验证
随机选取上述五种牡蛎,各5只进行特异性引物验证,上游引物MNR-F为5'-CTGTAAGTATATTTGTCTTCCA-3',下游特异性引物MNR-S-R为5'-AGGCTTTCACTCCACTTACT-3',反应体系如下表1,反应程序为:94℃预变性3分钟;再进行30个循环:94℃、30秒,50℃、30秒,72℃、50秒;最后72℃延伸10分钟。实施例1中五种巨蛎属牡蛎特异性引物扩增结果见图1。图1中,胶孔1-5为熊本牡蛎,7-11为福建牡蛎,12-16为长牡蛎,18-21为近江牡蛎,22-25为香港牡蛎,6与17为分子标尺(DL1000,最大条带为1000bp,其次条带为700bp)。图2为实施例1中五种巨蛎属牡蛎通用上游引物序列比对结果;图3为实施例1中五种巨蛎属牡蛎下游特异性引物序列比对结果。结果表明仅熊本牡蛎可扩增出特异性条带,长度为664bp,该特异性条带对应的特征序列如SEQ ID NO.1所示(其类型为核酸,链型为单链,拓扑结构为线形,分子类型为DNA),而其他物种没有特异性条带。
表1 PCR反应体系
实施例2:
a)样品采集
采集浙江沿海三个海湾-象山港、三门湾、乐清湾以及福建漳州的潮间带牡蛎样品,每个地点随机取30只,牡蛎解剖后将闭壳肌在液氮中速冻,-80℃冰箱保存用于后续验证;
b)DNA的提取及牡蛎物种分子鉴定
使用DNA试剂盒参照说明书提取DNA,检验DNA纯度及浓度后进行MNR及COI序列扩增,PCR产物测序后经NCBI Blast确定牡蛎物种,主要是熊本牡蛎和福建牡蛎两种(乐清湾仅取到熊本牡蛎);
c)特异性引物PCR扩增验证
上述四个地点的牡蛎,每个物种随机选取3只用于特异性引物验证,上游引物MNR-F为5'-CTGTAAGTATATTTGTCTTCCA-3',下游特异性引物MNR-S-R为5'-AGGCTTTCACTCCACTTACT-3',反应体系及PCR程序如实施例1。图4为实施例2中四个地点牡蛎特异性引物验证结果。图4中,胶孔1-3为象山港采集的熊本牡蛎,4-6为福建牡蛎;7-9为三门湾采集的熊本牡蛎,10-12为福建牡蛎;13-15为漳州采集的熊本牡蛎,16-18为福建牡蛎;20-22为乐清湾采集的熊本牡蛎,19为分子标尺(DL2000,最大条带为2000bp,最亮条带为750bp)。
结果表明浙江沿海三个地点及福建漳州采集的牡蛎样品进行引物验证,熊本牡蛎有特异性条带,长度为660bp左右,其他牡蛎没有特异性条带。
序 列 表
<110> 浙江万里学院宁海海洋生物种业研究院、浙江万里学院
<120>鉴别熊本牡蛎的特征序列、特异性鉴定引物及鉴定方法
<160> 3
<170> PatentIn version 3.1
<210> 1
<211> 664
<212> DNA
<213>位于牡蛎的甘氨酸tRNA合成酶和脯氨酸tRNA合成酶之间的线粒体非编码区的熊本牡蛎的特征序列(SEQ ID NO.1)
<400>1
CTGTAAGTATATTTGTCTTCCAAACAAAAGGTTTTCGTAAATGAAAAAAGCGTATGATTATATTAAAGTTGGAAGTTTAATTTTTAAGCAATCACAGCGGGTAAAAAATACTTAAAGTTAGCTTGTTACTGGGATTGCTTTAATTTTGATATTTTTAATAATCTATTTTTAAGCCTCTGTGACATGACGTAAATTTTTTGAATTTTCTTAGAATTAAGTTATTTTTACCTTATGTGTTAACCGGTTGCTTTGTGAGTTGAAATACAGCTTAAGTAAAAAAAATAAAATATCTTTTCCCTATGTAATAGTAGAATTTTAACATCTTGACTTATAGCGATTTGTGCTTAGTTTGTGGTAATATGGGGGGTAAAACTAAAGTTTGATACCGCATGAATTGCTTATAAGCAGGCTTAAAATGAGTTTGATTTATTGGATGGCAGAATTAAAAAATGTTGAAGTGAAGTTTTTTAGAAGTAGGAAGTATTAAAAATTAATTCTAGTGGTTGTATGAGTTGTAAGATTGGGTATATAATGGTAAAGGTTTAAAAGTGATAAAAGGTAAAAGGTGGGTATAATCTGTTTTGGTATAAAAATACATAGTCTTGGATCATGGGAAACTATAAAGGTGTAGTTATAAGTTTTAAAGTAAGTGGAGTGAAAGCCT
- 鉴别熊本牡蛎的特征序列、特异性鉴定引物及鉴定方法
- 鉴别熊本牡蛎的特征序列、特异性鉴定引物及鉴定方法
