增强转染的膜穿透性肽和组合物以及其使用方法
文献发布时间:2023-06-19 11:50:46
本申请为一项发明专利申请的分案申请,其母案的申请日为2014年12月12日、申请号为201480074785.5、发明名称为“增强转染的膜穿透性肽和组合物以及其使用方法”。
技术领域
本发明大体上涉及转染和细胞培养领域。确切地说,本发明提供适用作细胞穿透性肽的肽、含有所述肽的转染复合物以及其用于细胞内递送货物的用途。
本说明书中提及的所有公开、专利和专利申请都以引用的方式并入本文中,其引用的程度如每个单独的公开、专利或专利申请经特定并且单独地指示以引用的方式并入一般。
背景技术
已经发现脂质聚集体(如脂质体)适用作在实验室和临床研究环境中将大分子(如DNA、RNA、蛋白质)和小化合物(如小分子或医药学上活性分子)引入到细胞和组织中的递送剂。确切地说,已经展示包含阳离子脂质组分的脂质聚集体对于向细胞递送阴离子分子而言尤其有效。在某种程度上,认为阳离子脂质和用阳离子脂质形成的带正电荷复合物的有效性是由于对细胞亲和力增强,所述细胞中的许多携有净负电荷。另外在某种程度上,包含阳离子脂质的脂质聚集体上的净正电荷使得聚集体能够结合聚阴离子,如核酸。已知,含有DNA和RNA的脂质聚集体是用于目标细胞高效转染的有效药剂。
不同类型脂质聚集体的结构取决于形成所述聚集体的组合物和方法而变化。此类聚集体包括大小特定位于纳米至微米范围内的脂质体、单层囊泡、多层囊泡、微胞等等。制造脂质聚集体的方法是所属领域中一般已知的。使用常规含磷脂的脂质体来递送的主要缺点是脂质体组合物的净负电荷未被吸引到带负电荷的细胞表面。通过将阳离子脂质化合物与磷脂组合,带正电荷的囊泡和其它类型的脂质聚集体可以结合带负电荷的核酸,可以由目标细胞吸收,并且可以转染目标细胞。(Felgner,P.L.等人(1987)《美国国家科学院院刊(Proc.Natl.Acad.Sci.USA)》84:7413-7417;Eppstein,D.等人,美国专利第4,897,355号)。
用于将阳离子脂质并入脂质聚集体中的方法是所属领域中众所周知的。代表性方法由以下公开:Felgner等人,同前文献;Eppstein等人同前文献;Behr等人同前文献;Bangham,A.等人(1965)《分子生物学方法(M.Mol.Biol.)》23:238-252;Olson,F.et al.(1979)《生物化学与生物物理学报(Biochim.Biophys.Acta)》557:9-23;Szoka,F.et al.(1978)《美国国家科学院院刊》75:4194-4198;Mayhew,E.等人(1984)《生物化学与生物物理学报》775:169-175;Kim,S.等人(1983)《生物化学与生物物理学报》728:339-348;以及Fukunaga,M.等人(1984)《内分泌学(Endocrinol.)》115:757-761。用于制备适当大小的脂质聚集体以用作递送媒剂的常用技术包括超声处理和冷冻-解冻加挤出。参见例如Mayer,L.等人(1986)《生物化学与生物物理学报》858:161-168。当需要始终较小(50nm至200nm)且相对均一的聚集体时,使用微流体化(Mayhew,E.,同前文献)。在过去也曾使用阳离子脂质来将干扰RNA(RNAi)分子递送到细胞中(Yu等人(2002)《美国国家科学院院刊(PNAS)》99:6047-6052;Harborth等人(2001)《细胞科学杂志(Journal of Cell Science)》114:4557-4565)。
从超过15年以前引入阳离子脂质开始,其使用已经越来越受欢迎。已经在文献中描述若干种阳离子脂质,并且这些阳离子脂质中的一些是可商购的。DOTMA(氯化N-[1-(2,3-二油基氧基)丙基]-N,N,N-三甲铵)是第一个出于核酸转染目的而合成的阳离子脂质。参见Felgner等人(《美国国家科学院院刊(Proc.Nat'l Acad.Sci.)》84,7413(1987);美国专利第4,897,355号)。DOTMA可单独或可与DOPE(二油酰基磷脂酰乙醇胺)组合调配到脂质体中,并且此类脂质体可以用于将质粒递送到一些细胞中。随后已经由各种基团合成其它类别的脂质。举例来说,DOGS(5-羧基精胺基甘氨酸二(十八碳基)酰胺)是所制备的第一个聚阳离子脂质(Behr等人《美国国家科学院院刊》86,6982(1989);美国专利第5,171,678号),并且之后已经制备其它聚阳离子脂质。脂质DOSPA(2,3-二油基氧基-N-[2(精胺-甲酰胺基)乙基]-N,N-二甲基-1-丙烷铵已经描述为有效递送剂(美国专利第5,334,761号)。
在其它实例中,已经制备基于胆固醇的阳离子脂质,如DC-Chol(N,N-二甲基-N-乙基甲酰胺基胆固醇),并且将其用于转染(Gao等人《生物化学与生物物理研究通讯(Biochem.Biophys.Res.Comm.)》179,280(1991))。在另一个实例中,制备1,4-双(3-N-油烯基氨基-丙基)哌嗪并且使其与组蛋白H1组合以产生递送试剂,据报导,其毒性小于其它试剂(Wolf等人《生物技术(Bio Techniques)》23,139(1997);美国专利第5,744,335号)。若干种试剂是可商购的。一些实例包括
这些试剂没有可以对所有细胞通用的。鉴于不同类型细胞膜的组成的变化以及可限制细胞外物质进入细胞中的屏障,此可能并不出乎意料。此外,阳离子脂质将核酸递送到细胞中的机制未得到明确理解。试剂比病毒递送方法低效并且对细胞具有毒性,但毒性程度在试剂之间变化。
然而,转染剂(包括阳离子脂质)并非在所有细胞类型中普遍有效。不同细胞转染的有效性取决于特定转染剂的组成。一般来说,在转染真核细胞中,聚阳离子脂质比单阳离子脂质更高效。在许多情况下,阳离子脂质单独对转染无效或仅部分地有效。
虽然使用脂质聚集体将外源性化合物引入到细胞中(所属领域中称为“转染”的方法)已经变为许多实验室中的例行程序并且已经适于在多种多样的细胞类型和谱系中使用,但估计大致60%的常规地使用此技术研究和临床环境的细胞和细胞系被视为难以转染,意味着其通常展现小于60%的转染效率。被定义为难以转染的细胞包括原代细胞,如干细胞、祖细胞、神经元细胞和来源于神经组织的其它细胞类型、原代血细胞(“PBMC”)、HUVEC等等,以及虽然确立但难以使用可商购的转染试剂有效转染的某些细胞系。难以转染的细胞系的实例尤其包括PC12、HepG2、3T3、LNCaP、A549、Jukat以及PC3。
在最近数十年内,多种天然存在的能够促进物质通过穿过细胞膜而易位到细胞中的肽。这些所谓的“膜穿透性肽”(“MPP”)或“细胞穿透性肽”(“CPP”)已经用于促进转运蛋白、核酸、聚合物或其它功能性分子进入细胞中。
如触角足突变源性穿膜肽(Derossi等人,《生物化学杂志(J.Biol.Chem.)》,269,10444-10450,1994)和Tat肽(Vives等人,《生物化学杂志》,272,16010-16017,1997)的膜/细胞穿透性肽(CPP)已经用于使如肽、蛋白质和寡核苷酸的货物分子(Fischer等人,《生物结合化学(Bioconjug.Chem.)》,12,825-841,2001)递送到细胞中。应用领域在纯细胞生物学到生物医学研究范围内变化(Dietz和Bahr,《分子和细胞神经科学(Mol.Cell.,Neurosci)》,27,85-131,2004)。最初,认为细胞吸收通过直接穿透质膜来进行(Prochiantz,《细胞生物学新观点(Curr.Opin.Cell Biol.)》,12,400-406,2000)。近年来,已有证据指示,至少一些CPP通过促进内吞作用来增加货物的细胞吸收(综述参见Fotin-Mleczek等人,《当今制药(Curr.Pharm.Design)》,11,3613-3628,2005)。因此,考虑到这些近期结果,将肽指定为CPP/MPP不一定暗示特定细胞导入机制,而相反地是指作为肽在与货物分子共价或非共价缔合时增强货物分子的细胞吸收的功能。
需要满足以下的其它试剂:在研究和临床环境中通过改良所有细胞的转染效率来增强货物和大分子进入细胞中,尤其进入被视为“难以转染”的细胞(即,对转染具有顽抗性或展现比实验室环境中常规使用的标准转化细胞系低得多的转染效率的那些细胞)中的递送,但易于使用和制备并且充分利用目前可获得的基于阳离子脂质的转染试剂的宽阵列。
发明内容
本发明提供新颖的非天然存在的肽,其具有细胞穿透功能并且能够与货物分子和一种或多种阳离子脂质形成转染复合物。
本文公开提供使将大分子(如核酸)引入到培养物或体内组织中的细胞中的效率改良的组合物和方法。因此,本文中某些实施例提供含有呈非共价缔合形式的货物分子(如核酸分子)、转染剂和非天然存在的肽的复合物,其中所述非天然存在的肽含有膜穿透性肽序列。在某些方面,复合物含有待被引入到细胞中的大分子,如肽、蛋白质或核酸。
在本发明的一个方面,本发明的非天然存在的肽具有通式结构:
A-L-B或
B-L-A;
其中A是膜穿透性肽,L是一键或连接肽,并且B是阳离子部分或阳离子多肽。在一些优选但非限制性的实施例中,A是选自以下的肽序列:表1中所阐述的那些肽序列或其保持其至少一部分增强转染效率的能力的变异体。在一些实施例中,A的肽序列介于5到约50个氨基酸之间,并且A的特征在于其使分子进入细胞的递送改良至少50%或更大。
在一些实施例中,A的肽序列介于5到约50个氨基酸之间,并且A的特征在于其使分子进入细胞的递送改良至少75%或更大。
在一些实施例中,A与表1中所阐述的任一肽或其保持其至少一部分增强转染效率的能力的变异体至少75%一致,其中A的特征在于其使分子进入细胞的递送改良至少10%或更大。在一些实施例中,A选自由SEQ ID NO.1到SEQ ID NO.68中的任一个或其变异体组成的列表。
在本发明的一个方面,非天然存在的肽选自表4中所阐述的任一肽。
本发明的其它实施例是针对含有上文所描述的非天然存在的肽与一种或多种转染试剂组合的转染复合物,所述转染试剂可以包括一种或多种阳离子脂质和任选地一种或多种辅助和/或中性脂质。
在一些实施例中,转染复合物可以包括待被递送到细胞内部的货物,或任选地可向将受益于其投与的动物或人类患者投与。在一些示例性但非限制性的实施例中,适合用于本发明的优选的货物分子包括核酸分子,如DNA分子或RNA分子。合适的DNA分子可以包括具有可表达的核酸序列的DNA分子,如包含编码蛋白质的开放阅读框架的表达载体或cDNA分子。可在本发明的实践中充当合适货物的其它合适的分子包括RNA分子,如mRNA分子或RNAi分子。
本发明的其它实施例是针对用于制备转染复合物的方法并且是针对用于使用所述转染复合物将货物分子递送到细胞内部的方法。用于制备转染复合物的方法可以包括,在促进形成能够将货物输送到细胞内部的转染复合物的条件下,任选地在一种或多种辅助脂质和/或一种或多种中性脂质存在下,使货物分子与至少一种阳离子脂质或转染试剂和本发明的非天然存在的肽接触。
本发明的其它实施例是针对用于转染细胞的方法,其包括形成包含至少一种货物分子、至少一种阳离子脂质或转染试剂和本发明的非天然存在的肽、任选地具有一种或多种辅助脂质和/或一种或多种中性脂质的转染复合物,并且使所述转染复合物在促进所述细胞转染的条件下与细胞接触。本发明的又其它实施例是针对药物制剂,其任选地在一种或多种辅助脂质和/或一种或多种中性脂质存在下包含待被递送到动物或人类个体中的货物或药物、至少阳离子脂质或转染试剂和本发明的非天然存在的肽,以形成适合于将药物或生物活性化合物递送到需要其的动物或人类个体中以用于治疗生理学病状或病症的医药学上活性复合物。
普通技术人员鉴于本发明的以下图式和描述以及权利要求书将清楚本发明的其它实施例。
附图说明
本发明的新颖特征在所附权利要求书中细致阐述。将参考阐述其中利用本发明原理的说明性实施例和附图的以下详细描述来获得对本发明特征和优势的更好理解,在所述附图中:
图1A展示一组10种表达绿色荧光蛋白(GFP)的不同癌细胞系,其使用
图1B展示2种表达GFP的不同神经元细胞系,其使用
图1C展示2种表达GFP的不同成肌细胞细胞系,其使用
图1D展示一种表达GFP的肾脏成纤维细胞细胞系,其使用
图2展示一组六种表达GFP的不同细胞系,其使用所指定的可商购的转染试剂;
图3A是比较编码GFP的表达载体被转染到经过培养的HeLa细胞中的相对转染效率的图,所述转染使用剂量逐渐增加的三种不同的可商购脂质聚集体调配物来进行:
图3B是比较由编码GFP的表达载体转染的HeLa细胞中GFP表达强度的图,所述转染使用剂量逐渐增加的三种不同的可商购脂质聚集体调配物来进行:
图4是比较在由编码GST-STAT融合蛋白的表达载体转染的HepG2细胞中GST-STAT融合蛋白的相对表达水平的蛋白质印迹(上部图),所述转染使用以下可商购的脂质聚集体调配物来进行:
图5A是比较H9人类胚胎干细胞系(96孔培养板中每孔37,500个细胞)相对转染效率的图,所述干细胞系由剂量逐渐增加的GFP表达载体(左图50μg;中间图100μg,并且右图200μg)并且使用每孔介于0.1到0.6μl之间的
图5B是在96孔培养板中培养的H9细胞中GFP表达的代表性荧光图像,所述细胞以100微克/孔使用200μl
图6A展示如由平均橙色荧光蛋白质(OFP)强度(条形图,上图)所测量的使用可商购系统的U2OS细胞基因组修饰效率,和在使用指定量的
图6B展示如由平均OFP强度(条形图,上图)所测量的使用可商购系统的HepG2细胞基因组修饰效率,和在使用指定量的
图7A展示靶向AAVS1基因座的TALEN和CRISPR在使用
图7B展示靶向AAVS1基因座的TALEN和CRISPR在使用
图8是描绘由GFP表达载体转染的HeLa细胞的相对转染效率(上部图,以仅单个细胞%计的GFP+)或每个细胞的相对表达水平(下部图;仅单个细胞平均FL-1)的条形图,所述转染使用指定剂量(以μl为单位)的单独
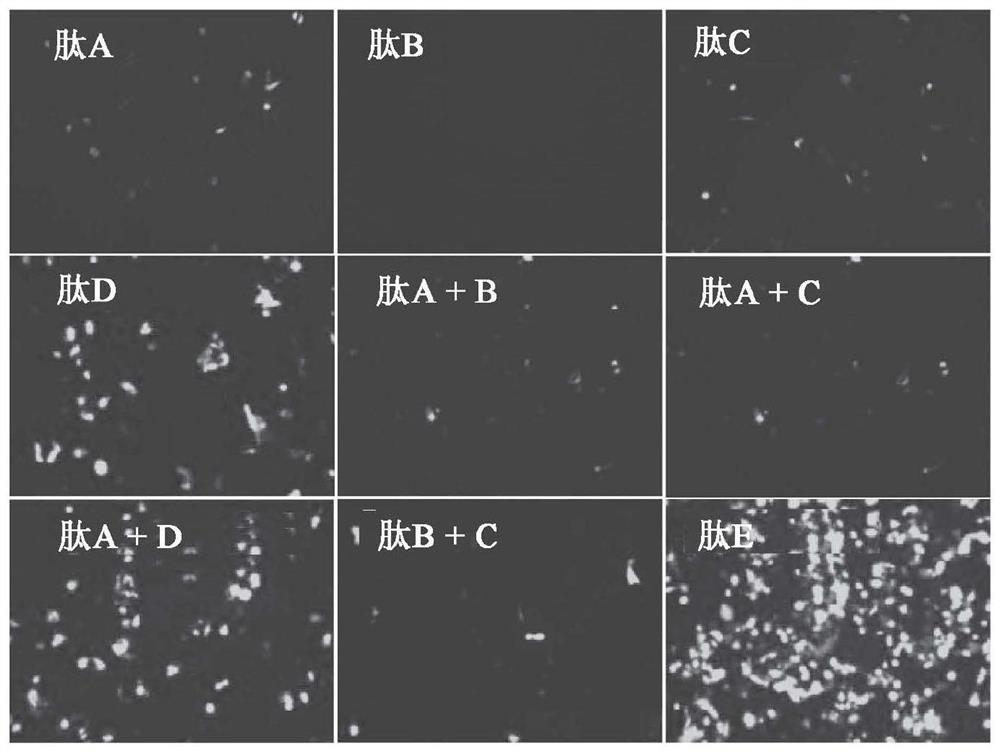
图9A是在图9B和9C中所描绘的实验中在HepG2细胞中所用的各种肽或肽片段的肽图描绘,其中肽A是单独MPP肽,肽B是单独连接肽,肽C是单独阳离子肽,肽D是连接肽与阳离子肽融合,并且肽E是具有肽A融合肽D的全长肽;
图9B描绘在经过培养的由编码GFP的表达载体转染的HepG2细胞中检测GFP表达的一系列荧光图像,所述转染使用
图9C描绘两个条形图,其展示由编码GFP的表达载体转染的HepG2细胞中的每细胞平均荧光(上部图)和转染效率(GFP+细胞%),所述转染使用
图10A是在图10B和10C中所描绘的实验中在A549细胞中所用的各种肽或肽片段的肽图描绘,其中肽A是单独MPP肽,肽B是单独连接肽,肽C是单独阳离子肽,肽D是连接肽与阳离子肽融合,并且肽E是具有肽A融合肽D的全长肽;
图10B描绘在经过培养的由编码GFP的表达载体转染的A549细胞中检测GFP表达的一系列荧光图像,所述细胞用
图10C描绘两个条形图,其展示由编码GFP的表达载体转染的A549细胞中的每细胞平均荧光(上部图)和转染效率(GFP+细胞%),所述转染使用
图11A是在图11B和11C中所描绘的实验中在MDA-MB-231细胞中所用的各种肽或肽片段的肽图描绘,其中肽A是单独MPP肽,肽B是单独连接肽,肽C是单独阳离子肽,肽D是连接肽与阳离子肽融合,并且肽E是具有肽A融合肽D的全长肽;
图11B描绘在经过培养的由编码GFP的表达载体转染的MDA-MB-231细胞中检测GFP表达的一系列荧光图像,所述细胞用
图11C描绘两个条形图,其展示由编码GFP的表达载体转染的MDA-MB-231细胞中的每细胞平均荧光(上部图)和转染效率(GFP+细胞%),所述转染使用
具体实施方式
本发明提供适合于细胞转染的改良的试剂和组合物。确切地说,本发明提供增强所有细胞(包括被视为通常难以转染的那些细胞类型)的转染效率的组合物和试剂。本发明的组合物和试剂在根据本文所描述的方法以及用所属领域普通技术人员见识内的一般知识和专长来进行使用时通常可以使其转染效率增加最多25%、最多30%、最多35%、最多40%、最多45%、最多50%、最多55%、最多60%、最多65%、最多70%、最多75%、最多80%、最多85%、最多90%、最多95%、最多100%或超过100%。本发明通过提供与如下文更详细描述的一种或多种转染脂质组合使用的包含细胞/膜穿透性肽序列的新颖肽来实现此目标。
定义
本说明书中通篇所用的术语在本发明的上下文内和在使用每一术语的特定情形下通常具有其在所属领域中的一般意义。在下文或在说明书中其它地方论述某些术语,以为从业者提供描述本发明的各种实施例以及如何形成和使用所述实施例方面的其它指导。应了解,相同概念可以用超过一种方式加以表述。因此,对于本文中所论述的术语中的任何一个或多个都可以使用替代性语言和同义词,无论本文是否详述或论述一个术语,也不赋予任何特定意义。可以提供某些术语的同义词。叙述一个或多个同义词并不排除使用其它同义词。在本说明书中任何地方使用实例(包括本文中所论述的任何术语的实例)仅是说明性的,并且绝不限制本发明或任何所例示术语的范围和意义。
术语“引入”当在将大分子引入到细胞培养物中的情形下使用时是指向培养基中提供大分子或化合物,并且理解引入所述大分子的目标是使得大分子能够从经过培养的细胞的细胞外区室转移到细胞质区室中。
术语将大分子或化合物“引入”到至少一种细胞中是指将大分子或化合物提供给细胞,以使得所述大分子或化合物变得内化在细胞中。举例来说,大分子或化合物可使用转染、转化、注射和/或脂质体引入来引入到细胞中,并且还可以使用所属领域的普通技术人员已知的其它方法来引入到细胞中。优选地,大分子或化合物是通过脂质体引入来引入到细胞中的。大分子优选地是蛋白质、肽、多肽或核酸。大分子可以是蛋白质。或者,大分子可以是肽。或者,大分子可以是多肽。大分子还可以是核酸。
术语“货物”当本文在将货物递送到细胞内部中(如借助于转染)的情形下使用时一般是指待被输送到细胞(在实验室培养物中或在动物或人类组织中)内部的任何物质。取决于应用,货物可以是大分子,如核酸、蛋白质或肽,或可以是药物或其它有机小分子。
如本文中所用,术语“大分子”涵盖生物分子。在一个实施例中,术语大分子是指核酸。在一个优选实施例中,术语大分子是指脱氧核糖核酸(DNA)和核糖核酸(RNA)。在一些实施例中,术语大分子是指DNA。DNA可以是线性DNA或环状DNA,如呈环状质粒、游离基因或表达载体形式的DNA。在某些优选但非限制性的实施例中,术语大分子是指具有可表达的核酸序列的互补DNA(cDNA),所述可表达的核酸序列包括至少一个可操作地连接于一个或多个由可表达的核酸序列转录mRNA所需的核酸序列的开放阅读框架。大分子可带电荷或不带电荷。DNA分子是带电荷大分子的一个实例。在一些情况下,如本文所用,术语“大分子”与术语“可表达的核酸”和“表达载体”可以可互换地使用。在其它实施例中,术语“大分子”是指RNA分子。RNA分子可以是任何类型的RNA分子,包括(但不限于)mRNA、siRNA、miRNA、反义RNA、核糖核酸酶或所属领域的技术人员熟悉的任何其它类型或种类的RNA分子(但不限于此),其将需要递送到细胞内部。
术语“转染”在本文中用于意味着将核酸、蛋白质或其它大分子递送到目标细胞,以使得所述核酸、蛋白质或其它大分子在所述细胞中得以表达或具有生物功能。
如本文所用的术语“可表达的核酸”与分子量无关地包括DNA和RNA两者,并且术语“表达”意味着细胞内核酸的功能性存在的任何表现,包括(但不限于)瞬时表达和稳定表达两者。功能方面包括通过寡核苷酸或蛋白质递送对表达进行抑制。
术语“核酸的表达”和其等效说法是指核酸在细胞中复制、DNA转录成信使RNA、RNA翻译成蛋白质、蛋白质的翻译后修饰和/或蛋白质在细胞中运输或其变化形式或组合。
如本文所用的术语“细胞”是指包括所有类型的真核和原核细胞。在优选实施例中,所述术语是指真核细胞,尤其培养物中生长的细胞,或在动物或人类组织中发现的细胞。在优选实施例中,细胞是指哺乳动物细胞。在某些示例性但非限制性的实施例中,术语“细胞”意欲指在研究和临床环境中常规使用的任何细胞和细胞系,并且可以包括(但不限于)永生化细胞系、经过转化的细胞系或原代细胞。
短语“难以转染”或所述短语的类似变化形式当在转染程序和试剂的情形下使用时是相关术语,其一般指当使用标准可商购转染试剂转染时通常展现小于60%转染效率的任何细胞或细胞系,所述标准可商购转染试剂如阳离子脂质(其实例包括(但不限于)
“细胞培养”或“培养”意味着在人造体外环境中维持细胞。
“重组蛋白”是指由引入到宿主细胞中的核酸编码的蛋白质。所述宿主细胞表达所述核酸。术语“表达核酸”与“从由核酸编码的RNA表达蛋白质”同义。如本文所用的“蛋白质”一般是指任何天然存在或合成的氨基酸聚合物,例如肽、多肽、蛋白质、脂蛋白、醣蛋白等。
如本文所用,术语“多肽”一般是指天然存在、重组或合成的氨基酸聚合物,其不论长度或翻译后修饰(例如断裂、磷酸化、糖基化、乙酰化、甲基化、异构化、还原、法呢基化等)都通过连续肽键彼此共价偶合。尽管“大”多肽在所属领域中通常称为“蛋白质”,但术语“多肽”和“蛋白质”常常可互换地使用。一般来说,多肽中的第一个氨基酸残基或第一组氨基酸残基称为处于所述多肽的“氨基端”或“N端”。类似地,多肽中的最后一个氨基酸残基或最后一组氨基酸残基称为处于“羧基端”或“C端”。
如本文所用的术语“肽”打算是广泛包括短肽(通常小于100个氨基酸)、多肽(通常超过100个氨基酸)和蛋白质(其含有一个或多个多肽链)的通用术语。本发明的肽通常具有超过两个氨基酸;优选的肽具有超过4个氨基酸。
当本文在本文所描述多肽的情形下使用时,术语“变异体”等等一般是指以下多肽:其在结构上与参考多肽类似,但由所述多肽与所述参考多肽之间的氨基酸序列差异(例如,具有至少10%、至少20%、至少30%、至少50%、至少75%、至少85%或至少95%序列一致性)和/或存在或不存在一种或多种生物化学修饰(例如翻译后修饰、取代、加合物加成等等)表征。虽然某些变异体的一般活性的子集可能类似,但在变异体之间出现的结构差异可导致其活性的至少一部分不重叠。“变异体”可以指在多肽序列中的一个或多个位置处相对于所述多肽分子改变(包括序列中一个或超过一个邻接氨基酸的添加、缺失、取代以及分子的共价修饰)的多肽分子。因此,在一些情况下,术语“变异体”和“同功异型物”可互换地使用。此类变异体的说明性实例将包括(仅借助于实例)其中氢基团由烷基、酰基、硫醇、酰胺或其它此类官能团替换已在一个或多个氨基酸残基处发生的多肽。变异体可具有“保守性”变化,其中被取代的氨基酸可具有类似的结构和/或化学特性(例如,非极性氨基酸残基由不同非极性氨基酸残基替换)。变异体也可以具有“非保守性”变化(例如,极性氨基酸残基由非极性或带电荷氨基酸残基替换)。变异体还可以在氨基酸序列中包括类似的次要变异,包括(但不限于)缺失、截短、插入或其组合。确定何种氨基酸残基可以在不消除或以其它方式实质上影响生物活性的情况下被取代、插入或缺失的指导是在所属领域中广泛可获得的。其它指导可以使用所属领域中众所周知的计算机程序,例如DNASTAR软件查询。一般来说并且在本发明的情形下,变异体将保留通常与已知膜穿透性肽相关联的生物学功能的至少一个子集,如有助于货物分子(例如核酸分子)跨细胞膜易位到其胞溶质区室中的能力。
如本文所用,术语“氨基酸”一般是指天然存在或合成的氨基酸,以及以与天然存在的氨基酸类似的方式起作用的氨基酸类似物和氨基酸模拟物。天然存在的氨基酸是由遗传密码编码的那些氨基酸、以及后来被修饰的那些氨基酸,例如羟基脯氨酸、γ-羧基谷氨酸以及O-磷酸丝氨酸。氨基酸类似物是指具有与天然存在的氨基酸相同的基本化学结构(即与氢、羧基、氨基以及R基团结合的α碳)的化合物,例如高丝氨酸、正亮氨酸、甲硫氨酸亚砜、甲硫氨酸以及甲基锍。此类类似物具有经过修饰的R基团(例如正亮氨酸或正缬氨酸)或经过修饰的肽主链,但保留与天然存在的氨基酸相同的基本化学结构。氨基酸模拟物是指具有与氨基酸的一般化学结构不同的结构但以与天然存在的氨基酸类似的方式起作用的化合物。术语“氨基酸”可以指氨基酸或其衍生物(例如氨基酸类似物)以及其D和L形式。此类氨基酸的实例包括甘氨酸、L-丙氨酸、L-天冬酰胺、L-半胱氨酸、L-天冬氨酸、L-谷氨酸、L-苯丙氨酸、L-组氨酸、L-异亮氨酸、L-赖氨酸、L-亮氨酸、L-谷氨酰胺、L-精氨酸、L-甲硫氨酸、L-脯氨酸、L-羟基脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸和L-缬氨酸、N-乙酰基半胱氨酸。
“试剂盒”是指转染,DNA、RNAi或其它货物(例如蛋白质或阴离子分子)递送或蛋白质表达或基因敲落(knockdown)试剂盒,其包括本发明的一种或多种试剂或其混合物。所述试剂盒可以包括本文所描述的一种或多种非天然存在的肽,任选地与一种或多种阳离子脂质或转染试剂一起。在一些实施例中,肽和脂质试剂可以单个调配物形式提供。在其它实施例中,脂质和肽可以分开地,与指导使用者在使用时组合所述试剂的说明书一起提供。此类试剂盒可以包含经过分隔而以紧密约束方式容纳一个或多个容器装置(如小瓶、试管等等)的携带装置。此类容器装置中的每一个都包含进行转染所需的组分或组分混合物。此类试剂盒可任选地包括一种或多种选自任何货物分子的组分,如核酸(优选地一种或多种表现载体、DNA分子、RNA分子或RNAi分子)、细胞、一种或多种本发明化合物、脂质聚集体形成性化合物、转染增强剂、生物活性物质等。
本发明的培养基、方法、试剂盒和组合物适合于细胞的单层或悬浮培养、转染和培育,并且适合于蛋白质在单层或悬浮培养的细胞中表达。优选地,本发明的培养基、方法、试剂盒和组合物用于细胞的悬浮培养、转染和培育,并且用于蛋白质产物在悬浮培养的细胞中表达。
“培养容器”意味着可以提供用于培养细胞的无菌环境的任何容器,例如玻璃、塑料或金属容器。
术语“组合”是指成分的混合或掺合。
如本文所用的术语“载体”打算指能够转运其已连接的另一种核酸的核酸分子。一种类型的载体是“质粒”,其是指可以接合其它DNA区段的环状双链DNA。另一种类型的载体是噬菌体载体。另一种类型的载体是病毒载体,其中其它DNA区段可以接合到病毒基因组中。某些载体能够在其被引入到其中的宿主细胞中自主复制(例如具有细菌复制起点的细菌载体和游离型哺乳动物载体)。其它载体(例如非游离型哺乳动物载体)当引入到宿主细胞中时可整合到宿主细胞的基因组中,并且由此与宿主基因组一起复制。此外,某些载体能够引导其可操作地连接的基因的表达。此类载体在本文中被称为“重组表达载体”,或简单地说是“表达载体”。一般来说,适用于重组DNA技术中的表达载体通常呈质粒形式。在本说明书中,“质粒”和“载体”可以可互换地使用,这是由于质粒是最常用的载体形式。根据本文所描述的本发明实践使用的某些载体可以是在所属领域中使用的众所周知的载体,如pCDNA 3.3或其修饰型。可适合于本发明实践的载体修饰类型的非限制性实例包括(但不限于)修饰,如加入一种或多种增强子、一种或多种启动子、一种或多种核糖体结合位点、一种或多种复制起点等等的修饰。在某些优选但非限制性的实施例中,并且本发明的实践中所用的表达载体可以包括一个或多个经选择以改良所关注蛋白质在本发明瞬时表达系统中表达的增强子元件。所选择的增强子元件可以位于用于表达所关注蛋白质的可表达的核酸序列的5'或3'。
如本文中所用,短语“含有可表达的核酸的表达载体”一般是指如上文所定义的载体,其除了一种或多种支持其在细胞或无细胞表达系统中表达所需的核酸序列或元件之外还能够容纳具有所需所关注蛋白质(所述所关注蛋白质由本发明的使用者选择)的至少一个开放阅读框架的可表达的核酸序列。可以存在于如本文所定义的表达载体中的此类其它核酸序列或元件可以包括一种或多种启动子序列、一种或多种增强子元件、一种或多种核糖体结合位点、一种或多种翻译起始序列、一种或多种复制起点或一种或多种可选标记物。服务这一目的的多种核酸序列或元件为熟练的业内人士所熟悉,并且选择其中一种或多种用于本发明的实践充分处于熟练的从业者的见识内。
术语“多核苷酸”和“核酸”在本文中可互换地使用,并且是指任何核酸,包括脱氧核糖核酸(DNA)和核糖核酸(RNA)。在优选实施例中,“核酸”是指DNA(包括基因组DNA、互补DNA(cDNA))和寡核苷酸(包括寡DNA)。在某些优选但非限制性的实施例中,“核酸”是指基因组DNA和/或cDNA。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、经过修饰的核苷酸或碱基和/或其类似物、或可通过DNA或RNA聚合酶或通过合成反应并入到聚合物中的任何底物。多核苷酸可以包含经过修饰的核苷酸,如甲基化核苷酸和其类似物。如果存在,那么可以在聚合物组装之前或之后赋予对核苷酸结构的修饰。核苷酸序列可以间杂有非核苷酸组分。多核苷酸可以包含在合成之后进行的修饰,如与标记(label)结合。其它类型的修饰包括例如“盖”,一个或多个天然存在的核苷酸由类似物取代;核苷酸间修饰,如具有不带电键(例如甲基膦酸酯、磷酸三酯、氨基磷酸酯、氨基甲酸酯等)和具有带电键(例如硫代磷酸酯、二硫代磷酸酯等)的修饰,含有侧接部分、如蛋白质(例如核酸酶、毒素、抗体、信号肽、聚L-赖氨酸等)的修饰,具有嵌入剂(例如吖啶、补骨脂素等)的修饰,含有螯合剂(例如金属、放射性金属、硼、氧化金属等)的修饰,含有烷基化剂的修饰,具有经过修饰的键(例如α异头核酸等)的修饰,以及多核苷酸的未经修饰形式。此外,通常存在于糖中的任何羟基可以例如被膦酸酯基、磷酸酯基替换,被标准保护基保护,或经过活化以制备与其它核苷酸的其它键,或可结合于固体或半固体支撑物。5'和3'端OH可以经过磷酸化或由具有1到20个碳原子的胺或有机封端基团部分取代。其它羟基也可以衍生成标准保护基。多核苷酸还可以含有所属领域中一般已知的核糖或脱氧核糖的类似形式,包括例如2'-O-甲基-核糖、2'-O-烯丙基-核糖、2'-氟基-核糖或2'-叠氮基-核糖、碳环糖类似物、α-异头糖、差向异构糖(如阿拉伯糖、木糖或来苏糖)、吡喃糖、呋喃糖、景天庚糖、非环状类似物和碱基核苷类似物(如甲基核糖苷)。一个或多个磷酸二酯键可以被替代性连接基团替换。这些替代性连接基团包括(但不限于)以下实施例,其中磷酸酯被P(O)S(“硫代酸酯”)、P(S)S(“二硫代酸酯”)、(O)NR
如本文所用,术语“RNA干扰”或“RNAi”一般是指序列特异性转录后基因沉默的方法。RNAi是使特定mRNA降解成短RNA的方法。为了介导RNAi,将与目标mRNA基本上序列一致的双链RNA(dsRNA)引入到细胞中。随后使目标mRNA在细胞中降解,导致所述mRNA和其所编码的蛋白质的水平降低。
如本文所用,术语“RNAi构筑体”一般是指小干扰RNA(siRNA)、发夹RNA以及可以在体内断裂以形成siRNA的其它RNA种类。所述术语还涵盖能够产生在细胞中形成dsRNA或发夹RNA的转录物和/或可以在体内产生siRNA的转录物的表达载体。术语“RNAi表达载体”是指可复制的核酸构筑体,其用于在其中表达所述构筑体的宿主细胞中表达(转录)产生siRNA双螺旋的RNA。
如本文所用,术语“短干扰RNA”或“siRNA”一般是指具有能够介导RNAi的限定核苷酸序列的短(长度为大致19到约25个核苷酸)双链RNA分子。
如本文所用,术语“复合反应”、“复合培养基”等一般是指其中核酸与转染试剂调配物复合的生理学上可接受的培养基或反应。通常,待被引入到细胞中以便表达蛋白质的核酸首先与合适的转染试剂(如阳离子脂质调配物)复合成脂质/核酸复合物或聚集体。
药物是指在人或动物疾病的预防、诊断、缓解、治疗或治愈中所用的除食物之外的任何治疗剂或预防剂。
多种技术和试剂可供用于将大分子在称为“转染”的过程中引入到目标细胞中。常用试剂包括例如磷酸钙、DEAE-葡聚糖以及脂质。关于使用这些类型试剂的详细方案的实例,许多参考文献文本可供使用,例如,《当前分子生物学方案(Current Protocols inMolecular Biology)》,第9章,Ausubel等人编,John Wiley and Sons,1998。用于转染细胞的其它方法是所属领域中已知的,并且可以包括电穿孔(基因电转移)、声孔作用、光学转染、原生质体融合、刺穿转染(impalefection)、磁性转染或病毒转导。
“用于将大分子引入到细胞中的试剂”或“转染试剂”是所属领域的技术人员已知的有助于大分子进入到细胞中的任何物质、调配物或组合物。举例来说,参见美国专利第5,279,833号。在一些实施例中,试剂可以是“转染试剂”并且可以是增加一种或多种核酸吸收到一种或多种目标细胞中的任何化合物和/或组合物。所属领域的技术人员已知多种转染试剂。合适的转染试剂可以包括(但不限于)一种或多种化合物和/或组合物,其包含阳离子聚合物(如聚乙二亚胺(PEI))、带正电荷氨基酸的聚合物(如聚赖氨酸和聚精氨酸)、带正电荷树枝状聚合物和断裂的树枝状聚合物、含有阳离子β-环糊精的聚合物(CD-聚合物)、DEAE-葡聚糖等。在一些实施例中,用于将大分子引入到细胞中的试剂可以包含一种或多种可为阳离子脂质和/或中性脂质的脂质。优选的脂质包括(但不限于)氯化N-[1-(2,3-二油基氧基)丙基]-N,N,N-三甲铵(DOTMA)、二油酰基磷脂酰胆碱(DOPE)、1,2-双(油酰基氧基)-3-(4'-三甲铵基)丙烷(DOTAP)、1,2-二油酰基-3-(4'-三甲铵基)丁酰基-sn-甘油(DOTB)、1,2-二油酰基-3-琥珀酰基-sn-甘油胆碱酯(DOSC)、(4'-三甲铵基)丁酸胆固醇酯(ChoTB)、溴化鲸蜡基三甲铵(CTAB)、溴化1,2-二油酰基-3-二甲基-羟乙铵(DORI)、溴化1,2-二油基氧基丙基-3-二甲基-羟乙铵(DORIE)、溴化1,2-二肉豆蔻氧基丙基-3-二甲基-羟乙铵(DMRIE)、氯化O,O'-二(十二碳基)-N-[对(2-三甲氨基乙氧基)苯甲酰基]-N,N,N-三甲铵、结合于一种或多种脂质的精胺(例如5-羧基精胺基甘氨酸二(十八碳基)酰胺(DOGS)、N,N
所属领域的技术人员应了解。上述脂质的某些组合已展示出尤其适于将核酸引入到细胞中,例如DOSPA与DOPE的3:1(w/w)组合以商标名LIPOFECTAMINE
已发现脂质聚集体(如脂质体)适用作将大分子递送到细胞中的药剂。确切地说,已证实包含一种或多种阳离子脂质的脂质聚集体在将阴离子大分子(例如核酸)递送到细胞中时极其有效。一种常用阳离子脂质是氯化N-[1-(2,3-二油酰基氧基)丙基]-N,N,N-三甲铵(DOTMA)。包含单独DOTMA或与二油酰基磷脂酰乙醇胺(DOPE)的1:1混合物的脂质体已被用于将核酸引入到细胞中。DOTMA:DOPE的1:1混合物可以商标名LIPOFECTIN
已用于将大分子引入到细胞中的另一类化合物包含与脂质连接的羧基精胺部分(参见Behr等人,(1989)《美国国家科学院院刊(Proceedings of the National Academyof Sciences,USA)》86:6982-6986和EPO 0 394 111)。这类化合物的实例包括二棕榈酰基磷脂酰乙醇胺5-羧基精胺基酰胺(DPPES)和5-羧基精胺基甘氨酸二(十八碳基)酰胺(DOGS)。DOGS可以商标名TRANSFECTAM
胆固醇的阳离子衍生物(3β-[N--(N',N'-二甲氨基乙烷)-氨基甲酰基]胆固醇,DC-Chol)已经合成并且与DOPE一起调配到脂质体中(参见Gao人,(1991)BBRC179(1):280-285)并用于将DNA引入到细胞中。由此调配的脂质体据报导有效地将DNA以低细胞毒性水平引入到细胞中。通过将聚赖氨酸结合于DOPE所形成的脂聚赖氨酸(参见Zhou等人,(1991)BBA 1065:8-14)据报导在将核酸在血清存在下引入到细胞中时有效。
已用于将核酸引入到细胞中的其它类型的阳离子脂质包括高度填充聚阳离子铵、锍和鏻脂质,如美国专利第5,674,908号和第5,834,439号和国际申请第PCT/US99/26825号(作为WO 00/27795公开)中所描述的那些阳离子脂质。根据本发明的一种尤其优选但非限制性的用于递送大分子的转染试剂是购自Life technologies的LIPOFECTAMINE2000
本发明提供适合于细胞转染的改良的试剂和组合物。确切地说,本发明提供增强所有细胞(包括被视为通常难以转染的那些细胞类型)的转染效率的组合物和试剂。本发明的组合物和试剂在根据本文所描述的方法以及用所属领域普通技术人员见识内的一般知识和专长来进行使用时通常可以使此类细胞的转染效率增加最多10%、最多15%、20%、最多25%、最多30%、最多35%、最多40%、最多45%、最多50%、最多55%、最多60%、最多65%、最多70%、最多75%、最多80%、最多85%、最多90%、最多95%、最多100%或超过100%。如下文更详细描述的,本发明通过以下来实现此目标:提供包含细胞/膜穿透性肽序列的新颖肽与一种或多种用于将货物分子(确切地说(但不限于)核酸分子,如DNA分子或RNA分子)递送到培养物中细胞或体内细胞或组织(确切地说(但不限于)被视为“难以转染”的细胞)的内部或细胞质区室中的转染脂质组合使用,。
本发明是针对与转染试剂组合使用的非天然存在的合成肽,所述转染试剂可以优选地包括(但不限于)基于脂质的转染试剂,尤其基于阳离子脂质的转染试剂,在转染复合物中包括所述肽通过增强货物分子(例如核酸分子或如所属领域的技术人员将易于清楚的任何其它合适的货物分子)跨细胞膜的转运以使所述货物分子被递送到培养物或体内组织中细胞的胞溶质区室中来部分地改良细胞的转染效率。
理想地,本发明的非天然存在的肽将用于与脂质聚集体组合物和货物分子形成多组分复合物以使得所述复合物增强所述货物分子进入细胞或组织胞溶质区室中的递送。
在本发明的一个方面,使非天然存在的肽与至少一种转染试剂和至少一种货物分子接触以形成转染复合物,其包含所述转染试剂]所述货物和所述肽,并且其特征在于与缺乏非天然存在的肽的一致转染复合物相比较改良复合物转染效率(以货物进入培养物或体内组织中细胞内部的转移改良形式进行测量)。
构成用于本发明的最优转染试剂的物质的选择取决于待被递送的货物的标识和性质、待被转染的细胞的标识和性质、转染是在培养物中还是在动物或人类体内组织中的经过分离的细胞中进行以及非天然存在的肽的标识。所有这些特征是所属领域中具有普通技术水平的从业者众所周知的,并且最优转染试剂在具体应用的具体情形下的选择以及决定构成组分最优浓度和配方的方式是此类人员在无不当实验并且不脱离本发明精神和范围的情况下易于清楚的。
在某些优选但非限制性的实施例中,根据本文所阐述的实施例选择用于形成转染复合物的转染试剂可以是阳离子脂质,确切地说,能够形成脂质聚集体的阳离子脂质。
在一些实施例中,转染复合物可以包括脂质聚集体组合物,所述脂质聚集体组合物包含至少一种阳离子脂质、任选地超过一种阳离子脂质,任选地在至少一种辅助脂质存在下与货物分子和至少一种具有以下通式结构的非天然存在的肽接触:
A-L-B或
B-L-A;
其中A是膜穿透性(MPP),L是将A连接到B的共价键或连接肽,并且其中B是共价连接到阳离子部分的阳离子多肽、阳离子部分或阳离子肽,其中所述非天然存在的肽的特征在于,非天然存在的肽作为转染复合物组分的存在使所述转染复合物的转染效率增加,其相对于缺乏所述非天然存在的肽的一致转染复合物的转染效率增强或改良最多10%、最多15%、20%、最多25%、最多30%、最多35%、最多40%、最多45%、最多50%、最多55%、最多60%、最多65%、最多70%、最多75%、最多80%、最多85%、最多90%、最多95%、最多100%、最多150%、最多200%、最多250%、最多300%、最多350%、最多400%、最多500%或超过500%。
A可以是满足以下的任何肽,不受限制且独立于所述肽进行其功能的机制功能,其已知或被证实可以增强或促进分子(如上文所定义的货物分子,确切地说,核酸分子,如DNA或RNA分子)从细胞外区室(如例如细胞培养基或间隙液或体液)跨细胞膜的转移,以使得所述货物分子被输送到细胞的细胞质区室中,其中所述货物分子可以实现至少一种可测量的生物学反应或功能。确定构成跨细胞膜转移“增强”的物质充分处于所属领域中具有普通技术水平的从业者的技术水准内,并且以此方式用于增强或促进货物分子转移的合适的肽或已知肽的变异体的鉴别是此类人员使用多种已知技术而易于清楚的。
在一些非限制性实施例中,A的肽序列可以介于约5到约75个氨基酸之间,介于约5到约60个氨基酸之间,介于约5到约50个氨基酸之间,介于约5到约40个氨基酸之间,介于约5到约30个氨基酸之间,介于约5到约20个氨基酸之间或介于约5到约15个氨基酸之间,介于约10到约75个氨基酸之间,介于约10到约60个氨基酸之间,介于约10到约50个氨基酸之间,介于约10到约40个氨基酸之间,介于约10到约30个氨基酸之间,介于约10到约20个氨基酸之间或介于约10到约15个氨基酸之间,并且其中A的特征在于,非天然存在的肽作为转染复合物组分的存在使所述转染复合物的转染效率相对于缺乏所述非天然存在的肽的一致转染复合物的转染效率增强最多10%、最多15%、20%、最多25%、最多30%、最多35%、最多40%、最多45%、最多50%、最多55%、最多60%、最多65%、最多70%、最多75%、最多80%、最多85%、最多90%、最多95%、最多100%、最多150%、最多200%、最多250%、最多300%、最多350%、最多400%、最多500%或超过500%。
在如本文所描述的非天然存在的肽中适用作MPP(即,上文所展示的结构A-L-B或B-L-A的A区)的多种肽序列是所属领域中已知的,其中的任一种都可以用于本发明的实践中(但不限于此)。已知充当MPP的代表性但非限制性的一组肽展示于表1。
在一些非限制性实施例中,A是包含选自SEQ ID NO.1-68中任一种的肽序列的肽,或其与SEQ ID NO.1-68中的任一种具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%序列相似性并且保持其增强将货物分子递送到细胞内部的功能的至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%、至少155%、大于100%、最多115%、最多120%、最多130%、最多140%、最多150%、最多160%、最多170%、最多180%的变异体。
在一些实施例中,L可以是连接A和B的共价键。
在一些实施例中,L可以包含中性(在生理pH下不带电荷)氨基酸的二肽,其中任选地,二肽中两个氨基酸中的一个包含至少一个极性侧链。在一个实施例中,L可以包含有包含至少一个极性侧链或至少一个疏水性侧链的二肽,其中所述极性或疏水性侧链优选地不是大体积侧链。在一个实施例中,L可以包含有包含至少一个甘氨酸、至少一个缬氨酸、至少一个丙氨酸、至少一个丝氨酸或至少一个苏氨酸的二肽。在一些实施例中,L可以包含选自由以下组成的列表的二肽:GG、AA、GA、AG、AS、AY、GS、GT、GV、AV、SV、TV、VG、VA以及VT。
在一些实施例中,L可以是具有介于约3到约50、约45、约40、约35、约30、约25、约20、约15、约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4个之间氨基酸的连接肽,其中至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或大于约90%的氨基酸是中性的。
在一些实施例中,L可以是具有介于约3到约50个、约5到约25个、约6到约20个、约8到约15个之间氨基酸或约4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸的连接肽,其中最多约35%的氨基酸含有中性极性侧链,且/或至少35%的氨基酸含有疏水性侧链,其中所述极性和疏水性侧链不是大体积侧链。
在一些实施例中,L可以是具有介于约3到约50个、约5到约25个、约6到约20个、约8到约15个之间氨基酸或约4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸的连接肽,其中最多约35%的氨基酸选自丝氨酸、苏氨酸、缬氨酸、异亮氨酸和亮氨酸。
在一些实施例中,L可以是具有介于约3到约50个、约5到约25个、约6到约20个、约8到约15个之间氨基酸或约4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸的连接肽,其中至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%或更多的氨基酸是甘氨酸或丙氨酸。
在一些实施例中,L可以是具有以下结构的连接肽:
其中每个X独立地是具有非极性侧链的中性氨基酸,其中每个Y独立地是具有极性侧链的中性氨基酸,并且其中m是3到10的整数,其中n是1到5的整数,并且其中当L不是一键时,p是1到20的整数。在一个实施例中,m>n。在一些实施例中,m是2并且n是1,或m是3并且n是1或2。在一些实施例中,每个X独立地是甘氨酸、丙氨酸、缬氨酸、亮氨酸或异亮氨酸。在一些实施例中,每个Y独立地是丝氨酸或苏氨酸。
在如本文所描述的非天然存在的肽中适用作连接子(即,上文所展示结构A-L-B或B-L-A的L区)的多种肽序列可以用于本发明的实践中,其中的任一种都可以用于本发明的实践中(但不限于此)。涵盖于本文所描述实施例的代表性但非限制性的一组连接子肽阐述于表2中。
在一些非限制性实施例中,L是包含选自SEQ ID NO.69-81中任一种的肽序列的肽,或其与SEQ ID NO.69-81中的任一种具有至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%序列相似性并且保持其增强将货物分子递送到细胞内部的功能的至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%、至少155%、大于100%、最多115%、最多120%、最多130%、最多140%、最多150%、最多160%、最多170%、最多180%的变异体。
在一些实施例中,B可以是共价连接到阳离子部分的阳离子多肽、阳离子部分或阳离子肽。所属领域中已知赋予分子阳离子电荷的任何阳离子部分(确切地说,肽)可以经过选择以用于本发明中(但不限于此)。适合用于本发明中的阳离子部分的优选但非限制性实例包括多元胺,如例如腐胺、尸胺、精胺、亚精胺中的一种或多种。其它阳离子部分可以包括聚-L-赖氨酸。
在一些实施例中,B可以是具有介于约3到约50个、约5到约25个、约6到约20个、约8到约15个之间氨基酸或约4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个氨基酸的连接肽,其中至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%或至少95%的氨基酸在生理pH下带正电荷。
在如本文所描述的非天然存在的肽中适用作阳离子区(即,上文所展示结构A-L-B或B-L-A的B区)的多种肽序列可以用于本发明的实践中,其中的任一种都可以用于本发明的实践中(但不限于此)。涵盖于本文所描述实施例的代表性但非限制性的一组连接子肽阐述于表3中。
表1.示例性膜穿透性肽(MPP)序列
表2.示例性连接子(L)肽序列
表3.示例性阳离子多肽(CP)序列
表4阐述可用于实践本发明的各种肽序列,但所属领域的普通技术人员应理解,仅借助于实例提供表4中的肽序列列表,并且不意欲将本发明的范围限制为仅仅是那些明确写出的序列。相反,此类人员将易于清楚的是,基于上文关于本发明肽的A]L和B区所阐述的教导内容,可能存在潜在地适用于实践本文所阐述的本发明的大量肽。此外,使用所属领域中标准技术在不需要不当实验的情况下确定既定肽序列是否属于本发明的范围内充分处于熟练的业内人士的见识内。此外,应了解,表4中出现的肽序列的各种变异体也属于本发明的范围内,只要此类变异体满足上文所阐述的结构和功能特征即可。表4中出现的肽序列变异体或未在表4中明确叙述但满足上文所阐述的结构和功能特需求的任何其它候选肽的变异体可以包括缺失、插入、使用天然存在的或非蛋白型氨基酸取代。
表4.示例性非天然存在的肽
在一些实施例中,A的肽序列介于5到约50个氨基酸之间,并且A的特征在于其使分子在基于阳离子脂质的转染试剂存在下进入细胞的递送改良至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多。
在一些实施例中,A与表1中所阐述的任一肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似,并且A的特征在于其使分子进入细胞的递送改良至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多。
在一些实施例中,A可以包含SEQ ID NO.1-68中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
在一些实施例中,A可以包含SEQ ID NO.14-35中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
在一些实施例中,A可以包含SEQ ID NO.37-43中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
在一些实施例中,A可以包含SEQ ID NO.44、45、46中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
在一些实施例中,A可以包含SEQ ID NO.52-68中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
在一些实施例中,A可以包含SEQ ID NO.1、SEQ ID NO.3、SEQ ID NO.4、SEQ.ID.NO.5、SEQ ID NO.13和SEQ ID NO.14中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
在本发明的一个方面,非天然存在的肽A可以包含表4中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
在本发明的一个方面,非天然存在的肽A可以包含SEQ.ID.NO.89-107中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
在本发明的一个方面,非天然存在的肽A可以包含SEQ.ID.NO.89-96中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
在本发明的一个方面,非天然存在的肽A可以包含SEQ.ID.NO.89、92、98、103或106中所阐述的肽序列中的任何一种或多种或其与所述肽序列至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%类似并且具有所述肽序列活性的至少10%或更多、至少15%或更多、至少20%或更多、至少25%或更多、至少30%或更多、至少35%或更多、至少40%或更多、至少45%或更多、至少50%或更多、至少55%或更多、至少60%或更多、至少65%或更多、至少70%或更多、至少75%或更多、至少80%或更多、至少85%或更多、至少90%或更多、至少95%或更多、至少100%、至少200%或更多、至少250%或更多、至少300%或更多、至少350%或更多、至少400%或更多、至少500%或更多、至少600%或更多、至少700%或更多、至少800%或更多、至少900%或更多、至少1000%或更多、至少1500%或更多或至少2000%或更多的变异体。
转染增强剂
形成于非天然存在的肽、核酸和转染剂之间的复合物可以通过包括以下部分来进一步增强:如对核或其它亚细胞定位起作用,对转运或运输起作用,是受体配位体,包含细胞粘附信号、细胞靶向信号、细胞内化信号或内吞作用信号的蛋白质或肽;以及包膜病毒病毒膜融合蛋白、病毒核定位信号、受体配位体、细胞粘附信号、细胞靶向信号、或内化或内吞作用触发信号的肽或其功能性部分。
复合物也可以任选地含有转染增强剂,如核定位蛋白质肽、膜融合肽或蛋白质、受体-配位体肽或蛋白质、转运肽或蛋白质、或在氨基酸序列中与本发明的非天然存在的肽不同的病毒肽或蛋白质。合适的病毒肽可以来源于以下病毒,如流感病毒、水泡性口炎病毒、腺病毒、α病毒、圣利基森林病毒(Semliki Forest Virus)、肝炎病毒、疱疹病毒、HIV病毒或猴病毒。转染增强剂也可以是例如胰岛素、转铁蛋白、表皮生长因子、成纤维细胞生长因子、细胞靶向抗体、乳铁蛋白、纤维粘连蛋白、腺病毒五邻体基底、结(Knob)、六邻体蛋白质、水泡性口炎病毒糖蛋白、圣利基森林病毒核心蛋白、流感红血球凝集素、B型肝炎核心蛋白、HIV Tat蛋白、单纯性疱疹病毒VP22蛋白、组蛋白、富含精氨酸的细胞渗透性蛋白质、高迁移率族蛋白和蛋白、和内化蛋白、内毒素、白喉毒素、志贺杆菌毒素、蜂毒肽、爪蟾抗菌肽、短杆菌肽、天蚕抗菌肽、防御素、抗微生物肽(protegrin)、鲎素、硫素(thionin)、吲哚里茨啶(indolicidin)、牛抗菌肽、果蝇抗真菌肽(drosomycin)、蜜蜂抗菌肽(apidaecin)、凯萨林菌素(cathelicidin)、杀菌渗透性增加性蛋白质、乳链菌肽、蟾蜍素(buforin)或其片段。转染增强剂可以是氯喹、嗜溶酶体化合物(lysosomotrophic compound)或其任何衍生物、变异体或组合。转染剂可以含有相同或不同肽或蛋白质的多聚物。
本发明的任何蛋白质或肽(或其片段或部分)都可以根据本发明,单独或与其它蛋白质或肽组合使用。在一个优选方面,在本发明中使用两种或更多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种等蛋白质和/或肽。另外,此类单个或多个蛋白质和/或肽可以与一种或多种、两种或更多种、三种或更多种、四种或更多种、五种或更多种、六种或更多种等转染剂组合使用。在另一个优选方面,至少两种肽和/或蛋白质与转染剂,优选地至少两种转染剂(如脂质)和/或聚阳离子(如树枝状聚合物或PEI)组合使用。
本发明的其它实施例是针对含有上文所描述的非天然存在的肽与一种或多种转染试剂组合的转染复合物,所述转染试剂可以包括一种或多种阳离子脂质和任选地一种或多种辅助脂质。在一些实施例中,转染复合物可以包括待被递送到细胞内部的货物,或任选地可向将受益于其投与的动物或人类患者投与。适合用于本发明的优选但非限制性的货物分子包括核酸分子,如DNA分子或RNA分子。合适的DNA分子可以包括具有可表达的核酸序列的DNA分子,如包含编码蛋白质的开放阅读框架的表达载体或cDNA分子。可在本发明的实践中充当合适货物的其它合适的分子包括RNA分子,如mRNA分子或RNAi分子。
本发明的非天然存在的肽通过所属领域的普通技术人员已知的任何先前已知肽合成方法来产生,包括(但不限于)重组方法或肽合成化学,如固相肽合成。固相合成方法(Marrifield,《美国化学学会杂志(J.Am.Chem.Soc.)》,85,2149-2154,1963)可以仅标注为此类肽合成方法的一个实例。目前,肽可以使用基于那些原理的自动通用肽合成器简单地并且在相对较短时间段内产生。另外,肽可以使用众所周知的重组蛋白产生技术来产生,所述技术是熟练的业内人士广泛已知的。
转染试剂
本发明还提供转染复合物,其包含呈非共价缔合形式的如上文所描述并且并入本文中的根据本发明的非天然存在的肽、至少一种如上文所定义并且并入本文中的货物分子、至少一种如上文所定义并且并入本文中的转染试剂。
在某些优选但非限制性的实施例中,选择用于本发明的实践中的转染试剂可以包括一种或多种阳离子脂质。在一些实施例中,所述一种或多种阳离子脂质可以任选地包括至少一种、任选地超过一种中性脂质或辅助脂质。
在一些实施例中,转染试剂可以包括一种或多种脂质,其中的一种或多种可以是阳离子脂质。在一些实施例中,转染试剂可以包括中性和阳离子脂质的混合物。在一些实施例中,转染试剂可以包括一种或多种肽和/或蛋白质,其与本发明的非天然存在的肽不同并且可以单独或与一种或多种脂质掺合来提供。借助于非限制性实例,一种此类肽可以包括如例如PLUS
在一些实施例中,适合于根据本发明使用的转染试剂可以是所属领域的技术人员已知的有助于大分子进入到细胞中的任何物质、调配物或组合物。在一些实施例中,转染试剂可以是增加一种或多种核酸或其它货物分子吸收到一种或多种目标细胞中的任何化合物和/或组合物。
所属领域的技术人员已知多种转染试剂。合适的转染试剂可以包括(但不限于)一种或多种化合物和/或组合物,其包含阳离子聚合物(如聚乙二亚胺(PEI))、带正电荷氨基酸的聚合物(如聚赖氨酸和聚精氨酸)、带正电荷树枝状聚合物和断裂的树枝状聚合物、含有阳离子β-环糊精的聚合物(CD-聚合物)、DEAE-葡聚糖等。在一些实施例中,用于将大分子引入到细胞中的试剂可以包含一种或多种可为阳离子脂质和/或中性脂质的脂质。优选的脂质包括(但不限于)氯化N-[1-(2,3-二油基氧基)丙基]-N,N,N-三甲铵(DOTMA)、二油酰基磷脂酰胆碱(DOPE)、1,2-双(油酰基氧基)-3-(4'-三甲铵基)丙烷(DOTAP)、1,2-二油酰基-3-(4'-三甲铵基)丁酰基-sn-甘油(DOTB)、1,2-二油酰基-3-琥珀酰基-sn-甘油胆碱酯(DOSC)、(4'-三甲铵基)丁酸胆固醇酯(ChoTB)、溴化鲸蜡基三甲铵(CTAB)、溴化1,2-二油酰基-3-二甲基-羟乙铵(DORI)、溴化1,2-二油基氧基丙基-3-二甲基-羟乙铵(DORIE)、溴化1,2-二肉豆蔻氧基丙基-3-二甲基-羟乙铵(DMRIE)、氯化O,O'-二(十二碳基)-N-[对(2-三甲氨基乙氧基)苯甲酰基]-N,N,N-三甲铵、结合于一种或多种脂质的精胺(例如5-羧基精胺基甘氨酸二(十八碳基)酰胺(DOGS)、N,N
所属领域的技术人员应了解。上述脂质的某些组合已展示出尤其适于将核酸引入到细胞中,例如DOSPA与DOPE的3:1(w/w)组合以商标名LIPOFECTAMINE
已发现脂质聚集体(如脂质体)适用作将大分子递送到细胞中的药剂。确切地说,已证实包含一种或多种阳离子脂质的脂质聚集体在将阴离子大分子(例如核酸)递送到细胞中时极其有效。一种常用阳离子脂质是氯化N-[1-(2,3-二油酰基氧基)丙基]-N,N,N-三甲铵(DOTMA)。包含单独DOTMA或与二油酰基磷脂酰乙醇胺(DOPE)的1:1混合物的脂质体已被用于将核酸引入到细胞中。DOTMA:DOPE的1:1混合物可以商标名LIPOFECTIN
已用于将大分子引入到细胞中的另一类化合物包含与脂质连接的羧基精胺部分(参见Behr等人,(1989)《美国国家科学院院刊》86:6982-6986和EPO 0 394 111)。这类化合物的实例包括二棕榈酰基磷脂酰乙醇胺5-羧基精胺基酰胺(DPPES)和5-羧基精胺基甘氨酸二(十八碳基)酰胺(DOGS)。DOGS可以商标名TRANSFECTAM
胆固醇的阳离子衍生物(3β-[N--(N',N'-二甲氨基乙烷)-氨基甲酰基]胆固醇,DC-Chol)已经合成并且与DOPE一起调配到脂质体中(参见Gao人,(1991)BBRC179(1):280-285)并用于将DNA引入到细胞中。由此调配的脂质体据报导有效地将DNA以低细胞毒性水平引入到细胞中。通过将聚赖氨酸结合于DOPE所形成的脂聚赖氨酸(参见Zhou等人,(1991)BBA 1065:8-14)据报导在将核酸在血清存在下引入到细胞中时有效。
已用于将核酸引入到细胞中的其它类型的阳离子脂质包括高度填充聚阳离子铵、锍和鏻脂质,如美国专利第5,674,908号和第5,834,439号和国际申请第PCT/US99/26825号(作为WO 00/27795公开)中所描述的那些阳离子脂质。
根据本发明的一种非限制性的用于递送大分子的转染试剂是购自Lifetechnologies的LIPOFECTAMINE 2000
适合于将大分子递送到细胞中的另一种优选但非限制性的转染试剂是EXPIFECTAMINE
其它合适的转染试剂包括
下文现将更详细地描述适合用于本发明的各种优选但非限制性的阳离子脂质和转染试剂。然而,应注意,明确公开一种或多种特定阳离子脂质或一种或多种阳离子脂质属不意欲排除使用能够与本发明的非天然存在的肽结合使用的其它试剂或脂质,并且替代性阳离子脂质或转染试剂的选择以及其在本发明的情形下的使用充分处于熟练技术人员的见识内,并且此类人员可以在不脱离本发明精神和范围的情况下容易地使用此类试剂。
本发明的一些实施例提供脂质聚集体,其包含一种或多种上文所描述的非天然存在的肽与一种或多种阳离子脂质组合。在不受形成本发明基础的组合物性能的任何理论或机制阐释限制或束缚并且仅仅关注提供其完全公开内容的情况下,相信本发明的非天然存在的肽当与一种或多种转染试剂,确切地说,与一种或多种阳离子转染脂质组合使用时改良包含脂质聚集体和待被递送到细胞内部的货物分子的转染复合物的能力。任选地与一种或多种辅助脂质或一种或多种中性脂质结合使用阳离子脂质可以允许脂质聚集体更大程度地包裹货物分子,并且进一步可以辅助脂质体脂质聚集体与目标细胞膜融合,由此改良增强货物分子的递送。
适用于形成本发明转染复合物的阳离子脂质可以是单价或多价阳离子脂质或阳离子脂质混合物。尤其受关注的是在所属领域中公认适用于转染方法的阳离子脂质,包括(但不限于)DOTMA、DOTAP、DDAB、DMRIE、DOSPA、DOSPER、TMTPS、DHMS、DHDMS以及其类似物或同系物。任选地,脂质聚集体可以进一步包含至少一种其它辅助脂质。辅助脂质是所属领域中已知的,并且包括(但不限于)中性脂质,优选地选自由DOPE、DOPC和胆固醇组成的群组。任选地,本发明的转染复合物可以包括可商购的含有阳离子脂质的转染试剂,如
本发明的另一个实施例提供一种阳离子脂质聚集体,其包含与上文所描述的一种或多种非天然存在的肽复合的一种或多种阳离子脂质、任选地一种或多种辅助脂质和一种或多种货物分子。货物分子可以是待被输送到实验室中培养物中或动物或人类组织中的细胞内部的任何物质。取决于应用,货物可以是大分子,如核酸、蛋白质或肽,或可以是药物或其它有机小分子。在一些实施例中,用于形成转染复合物的优选货物是核酸,如例如脱氧核糖核酸(DNA)和核糖核酸(RNA)。在一些实施例中,优选的货物可以是DNA分子。DNA可以是线性DNA或环状DNA,如呈环状质粒、游离基因或表达载体形式的DNA。在某些优选但非限制性的实施例中,术语大分子是指具有可表达的核酸序列的互补DNA(cDNA),所述可表达的核酸序列包括至少一个可操作地连接于一个或多个由可表达的核酸序列转录mRNA所需的核酸序列的开放阅读框架。在其它实施例中,优选的货物可以是RNA分子。RNA分子可以是任何类型的RNA分子(但不限于此),包括(但不限于)mRNA、siRNA、miRNA、反义RNA、核糖核酸酶或所属领域的技术人员熟悉的任何其它类型或种类的RNA分子(但不限于此),其将需要递送到细胞内部。
优选地,本发明的转染复合物可以包括如上文所描述的非天然存在的肽、至少一种货物、至少一种阳离子脂质和任选地至少一种辅助脂质。一旦形成,转染复合物在水溶液中稳定,并且可以紧接在形成之后与人类或动物的细胞组织接触,或可以在与所述细胞或组织接触之前储存一段时间。转染复合物是稳定的,并且可以储存持续至少30分钟、至少45分钟、至少1小时、至少2小时、至少3小时、至少4小时、至少5小时、至少10小时、至少15小时、至少20小时、至少24小时、至少48小时、至少72小时、至少5天、至少7天、至少14天、至少28天、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少1年的时间段。应理解,储存期可以介于这些时间段中的任一个之间,例如介于31分钟与1小时之间或介于1小时与24小时之间。
一般来说,本发明的转染复合物可以包含单价或多价的任何阳离子脂质,包括已知转染试剂中的那些阳离子脂质(参见表5)。阳离子脂质包括胺、酰胺或其衍生物的饱和和不饱和烷基和脂环族醚和酯。阳离子脂质的直链和分支链烷基和烯烃基团可以含有1到约25个碳原子。优选的直链或分支链烷基或烯烃基团具有六个或更多个碳原子。更优选的直链或分支链烷基或烯烃基团具有8到约20个碳原子。脂环族基团可以含有约6到30个碳原子,并且更优选地8到20个碳原子。优选的脂环族基团包括胆固醇和其它类固醇基团。阳离子脂质可以被制备成具有多种相对离子(阴离子),尤其包括:Cl-、Br-、I-、F-、乙酸根、三氟乙酸根、硫酸根、亚硝酸根、三氟甲磺酸根和硝酸根。
在本发明的脂质聚集体中,阳离子脂质可以任选地与非阳离子脂质(优选地中性脂质)组合以形成与经过修饰的肽-核酸复合物结合的脂质聚集体。在本发明中适用作辅助脂质的中性脂质尤其包括:卵磷脂(和其衍生物);磷脂酰基乙醇胺(和其衍生物);磷脂酰乙醇胺,如DOPE(二油酰基磷脂酰乙醇胺)、DphPE(二植烷酰基磷脂酰-乙醇胺)、DPPE(二棕榈酰基磷脂酰乙醇胺)、二棕榈酰基磷脂酰基-乙醇胺、POPE(棕榈酰基油酰基磷脂酰乙醇胺)和二硬脂酰基-磷脂酰乙醇胺;磷脂酰胆碱;磷脂酰胆碱,如DOPC(二油酰基磷脂酰胆碱)、DPPC(二棕榈酰基磷脂酰胆碱)、POPC(棕榈酰基油酰基磷脂酰胆碱)和二硬脂酰基磷脂酰胆碱;磷脂酰基-甘油;磷脂酰甘油,如DOPG(二油酰基磷脂酰甘油)、DPPG(二棕榈酰基磷脂酰甘油)和二硬脂酰基磷脂酰甘油;磷脂酰基-丝氨酸(和其衍生物);磷脂酰丝氨酸,如二油酰基-磷脂酰丝氨酸或二棕榈酰基磷脂酰丝氨酸;二磷脂酰甘油;脂肪酸酯;甘油酯;鞘脂;心磷脂;脑苷脂;和神经酰胺;以及其混合物。中性脂质还包括胆固醇和其它3βOH-固醇以及其衍生物。
以下专利文件、专利申请或参考文献以全文引用的方式并入本文中,并且确切地说,出于其对含有阳离子和中性(辅助)脂质的转染剂(其可以用于与阳离子脂质结合构成本发明脂质聚集体)的公开而并入:美国专利6,075,012;6,020,202;5,578,475;5,736,392;6,051,429;6,376,248;5,334,761;5,316,948;5,674,908;5,834,439;6,110,916;6,399,663;6,716,882;5,627,159;PCT/US/2004/000430,作为WO04063342A2公开;PCT/US/9926825,作为WO 0027795 A1公开;PCT/US/04016406,作为WO 04105697公开;以及PCT/US2006/019356,作为WO 07130073 A2公开。表5还列出包含阳离子脂质和中性脂质的转染剂,其可以用于与阳离子脂质结合构成本发明的脂质聚集体。
表5.转染试剂的非限制性实例
在一些优选但非限制性的实施例中,脂质聚集体可以包括至少一种第一阳离子脂质和任选地至少一种第一中性脂质,其中所述脂质聚集体适合于在水性条件下与核酸形成阳离子复合物,其中所述阳离子脂质具有以下结构:
R
具有8到30个碳原子并且任选地由醇、氨基醇、胺、酰胺、醚、聚醚、酯、硫醇、烷基硫基或氨基甲酰基中的一个或多个取代的烷基、烯基或炔基,或其中R
R
R
R
r、s和t是1或0以指示所指定的R基团存在或不存在,当r、s或t中的任一个是1时,所指定的R基团所连接的氮带正电荷,并且其中r、s或t中的至少一个是1;
q是介于1到6范围内的整数(包括端点);
X
L是能够共价连接两个氮的二价有机自由基,选自:(CH
{-(CH
其中R
其中R
其中当以烷基形式存在时,R
这些化合物的合成和用于制备并有所述化合物的脂质聚集体的方法可以通过所属领域的技术人员已知的任何手段来实现(但不限于此)。示例性但非限制性的合成此类化合物的方法和用于形成并有所述化合物的脂质聚集体的方法可以见于例如美国专利第7,166,745号和PCT公开第WO 00/27795号,其两者以全文引用的方式明确地并入,如同本文充分阐述一般。
在一些实施例中,形成本发明基础的脂质聚集体可以进一步任选地包括一种,任选地超过一种选自由以下组成的列表的其它阳离子脂质:TMTPS、DOGS、DPPES、DOTMA、DOTAP、DDAB、DMRIE、DOSPA以及DOSPER。
在本发明脂质聚集体的一些实施例中,用于形成本发明转染复合物中的尤其优选但非限制性的阳离子脂质可以是具有以下结构的二羟基-二肉豆蔻基精胺四盐酸盐(下文称为“DHDMS”):
在本发明脂质聚集体的一些实施例中,用于形成本发明转染复合物中的尤其优选但非限制性的阳离子脂质可以是具有以下结构的羟基-二肉豆蔻基精胺四盐酸盐(下文称为“HDMS”):
在一些实施例中,中性脂质可以选自以下:DOPE、胆固醇或DOPC。在一个实施例中,中性脂质可以是胆固醇、DOPE或DOPC中的一种。在一个实施例中,脂质是胆固醇。在一个实施例中,中性脂质是DOPE。在一个实施例中,脂质是DOPC。
在一个实施例中,任选的第二中性脂质可以是胆固醇、DOPE或DOPC中的一种,其例外之处在于所述第二中性脂质与上文所描述的第一中性脂质不相同。在一个实施例中,任选的第二中性脂质是胆固醇。在一个实施例中,任选的第二中性脂质是DOPE。在一个实施例中,任选的第二中性脂质是DOPC。
在一些实施例中,脂质聚集体中阳离子脂质的摩尔比可以在约0.1到约0.8范围内。在一些实施例中,脂质聚集体中阳离子脂质的摩尔比可以在0.1到约0.2、约0.15到约0.25、约0.2到约0.3、约0.25到约0.35、约0.3到约0.4、约0.35到约0.45、约0.4到约0.5、约0.45到约0.55、约0.5到约0.6、约0.55到约0.65、约0.6到约0.7、约0.65到约0.75、约0.7到约0.8或约0.75到约0.85之间。
在一些实施例中,脂质聚集体中DHDMS的摩尔比可以在约0.1到约0.7范围内。
在一些实施例中,脂质聚集体中阳离子脂质的摩尔比可以是约0.1、约0.2、约0.25、约0.3或约0.4或介于其间的任何范围。
在一些实施例中,DHDMS的摩尔比是约0.1到约0.4。在一些实施例中,DHDMS的摩尔比是约0.1、约0.2、约0.25、约0.3、约0.4或介于其间的任何范围。
在一些实施例中,脂质聚集体中HDMS的摩尔比可以在约0.1到约0.4范围内。在一些实施例中,脂质聚集体中第二阳离子脂质的摩尔比可以是约0.1、约0.2、约0.25、约0.3或约0.4或介于其间的任何范围。
在一些实施例中,HDMS的摩尔比是约0.1到约0.4。在一些实施例中,HDMS的摩尔比是约0.1、约0.2、约0.25、约0.3、约0.4或介于其间的任何范围。
在一些实施例中,脂质聚集体中中性脂质的摩尔比可以在约0.1到约0.8范围内。在一些实施例中,脂质聚集体中阳离子脂质的摩尔比可以在0.1到约0.2、约0.15到约0.25、约0.2到约0.3、约0.25到约0.35、约0.3到约0.4、约0.35到约0.45、约0.4到约0.5、约0.45到约0.55、约0.5到约0.6、约0.55到约0.65、约0.6到约0.7、约0.65到约0.75、约0.7到约0.8或约0.75到约0.85之间,或是介于其间的任何范围。
在一些实施例中,胆固醇的摩尔比是约0.1到约0.8。在一些实施例中,脂质聚集体中阳离子脂质的摩尔比可以在0.1到约0.2、约0.15到约0.25、约0.2到约0.3、约0.25到约0.35、约0.3到约0.4、约0.35到约0.45、约0.4到约0.5、约0.45到约0.55、约0.5到约0.6、约0.55到约0.65、约0.6到约0.7、约0.65到约0.75、约0.7到约0.8或约0.75到约0.85之间,或是介于其间的任何范围。
在一些实施例中,DOPE的摩尔比是约0.1到约0.8。在一些实施例中,脂质聚集体中阳离子脂质的摩尔比可以在0.1到约0.2、约0.15到约0.25、约0.2到约0.3、约0.25到约0.35、约0.3到约0.4、约0.35到约0.45、约0.4到约0.5、约0.45到约0.55、约0.5到约0.6、约0.55到约0.65、约0.6到约0.7、约0.65到约0.75、约0.7到约0.8或约0.75到约0.85之间,或是介于其间的任何范围。
在一些实施例中,DOPC的摩尔比是约0.1到约0.4。在一些实施例中,DOPC的摩尔比是约0.1、约0.2、约0.25、约0.3、约0.4或介于其间的任何范围。
在一些实施例中,胆固醇的摩尔比是约0.2到约0.8。在一些实施例中,胆固醇的摩尔比是约0.1、约0.2、约0.25、约0.3、约0.35、约0.4、约0.45、约0.5、约0.55、约0.6、约0.65、约0.7、约0.75、约0.8或介于其间的任何范围。
在一些实施例中,DOPE的摩尔比是约0.2到约0.8。在一些实施例中,DOPE的摩尔比是约0.1、约0.2、约0.25、约0.3、约0.35、约0.4、约0.45、约0.5、约0.55、约0.6、约0.65、约0.7、约0.75、约0.8或介于其间的任何范围。
在一些实施例中,DOPC的摩尔比是约0.2到约0.8。在一些实施例中,DOPC的摩尔比是约0.1、约0.2、约0.25、约0.3、约0.35、约0.4、约0.45、约0.5、约0.55、约0.6、约0.65、约0.7、约0.75、约0.8或介于其间的任何范围。
在一些实施例中,DHDMS的摩尔比是约0.1、0.2、0.25、0.3、0.4或0.5,并且中性脂质的摩尔比是约0.1、0.2、0.25、0.3、0.4或0.5。
在一些实施例中,HDMS的摩尔比是约0.1、0.2、0.25、0.3、0.4或0.5,并且中性脂质的摩尔比是约0.1、0.2、0.25、0.3、0.4或0.5。
根据本发明的若干非限制性实施例的多种脂质调配物的组成提供于表I中。提供这些示例性实施例决不意欲将本发明的范围限制为仅仅是所公开的那些调配物。相反,其仅意欲提供可以用于实践本发明的多种可能的脂质聚集体调配物。尽管如此,所属领域的技术人员将易于清楚的是,可以对调配物进行变化或改变,并且可以添加其它组分(如例如其它阳离子或中性脂质、肽靶向部分等等),或可以任选地去除表I中所阐述的所述中性脂质中的一种,并且所得调配物将处于如本文所描述的本发明精神和范围内。
含有非天然存在的肽的复合物的制备和用途
本发明的另一个实施例提供一种用于将聚阴离子(如核酸分子)递送到一种或多种细胞中的方法,其中所述方法包含形成包含一种或多种阳离子脂质和一种或多种中性脂质的脂质聚集体,优选地脂质体;使所述脂质聚集体与聚阴离子接触,所述聚阴离子已经借助在本发明的非天然存在的肽中存在的阳离子区B而与所述非天然存在的肽复合,由此形成中性或带正电荷的聚阴离子-肽-脂质聚集体复合物;以及将一种或多种细胞与所述复合物一起培育。适用的阴离子包括蛋白质、肽和核酸,优选地为DNA或RNA。优选地,脂质聚集体进一步包含至少一种其它辅助脂质。任选地,在使之与一种或多种细胞之前,将聚阴离子-脂质聚集体复合物储存一段时间。聚阴离子-脂质聚集体复合物是稳定的,并且可以储存持续至少45分钟、至少1小时、至少2小时、至少3小时、至少4小时、至少5小时、至少10小时、至少15小时、至少20小时、至少24小时、至少48小时、至少72小时、至少5天、至少7天、至少14天、至少28天、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少1年的时间段,或持续介于这些时间段中的任一个之间的时间段。本发明尤其适用于递送RNAi,包括siRNA、短发夹RNA(shRNA)和小时间调节型RNA(stRNA),其任选地经过化学修饰。
本发明的方法涉及使任何细胞(优选地真核细胞)与如上文所描述的包含至少一种非天然存在的肽、转染剂和核酸的转染复合物接触。复合物任选地也可以含有一种或多种其它肽或蛋白质,如膜融合肽或蛋白质、膜渗透性肽或蛋白质、转运或运输亚细胞定位肽或蛋白质或受体-配位体肽或蛋白质。这些其它肽或蛋白质任选地可以结合于核酸结合性基团,或任选地结合于转染剂(脂质或聚阳离子聚合物),其中所述肽或蛋白质或经过修饰的肽或蛋白质以非共价方式与核酸缔合。在不受任何理论束缚的情况下,申请人认为本发明的复合物是通常含有脂质体或脂质聚集体结构的脂质聚集体,但这些结构的精确性质不是目前已知的。因此,在某些说明性实例中,本发明的复合物是脂质体复合物。可以例如使用所属领域中众所周知的逆向蒸发方法来将整个复合物或复合物的一部分(如脂质部分,例如式I脂质)调配到脂质体中。或者,可以通过其它众所周知的用于脂质体形成的方法(如超声处理或微流体化)来调配复合物的脂质部分或整个复合物。这些脂质体调配物对于将DNA转染到经过培养的细胞中有效。
在一个实施例中,首先形成含有本发明的非天然存在的肽或蛋白质和核酸的复合物(其中所述非天然存在的肽或蛋白质可以任选地结合于核酸结合性基团),并且随后使其与阳离子脂质(如式I脂质)组合以用于转染。在相关实施例中,任选地将肽-脂质或蛋白质-脂质结合物与其它脂质(包括任何适当的阳离子脂质)组合,并且随后与核酸组合以用于转染。在另一个相关实施例中,形成核酸-脂质复合物,并且随后使其与非天然存在的肽或蛋白质组合以用于转染。如上文所论述,这些实施例中的任一个的含脂质复合物可以是脂质体或非脂质体调配物。此外,在这些实施例中形成的复合物中的任一种在转染细胞之前都可以储存例如持续5分钟到1年,或持续15分钟到6个月,或持续1小时到3个月。在肽-脂质或蛋白质-脂质结合物的情况下,此类结合物在与核酸组合之前可以储存例如持续5分钟到1年,或持续15分钟到6个月,或持续1小时到3个月。
在另一个实施例中,形成含有非天然存在的肽或蛋白质和核酸的复合物(其中所述非天然存在的肽或蛋白质可以结合于核酸结合性基团),并且随后使其与聚阳离子聚合物组合以用于转染。在一个相关实施例中,使肽-聚阳离子聚合物结合物任选地与另一个聚阳离子聚合物组合,并且随后使其与核酸组合以用于转染。在另一个相关实施例中,形成核酸-聚阳离子聚合物复合物,并且随后使其与肽或蛋白质组合以用于转染。可以将聚阳离子聚合物和/或与肽结合的聚阳离子聚合物与阳离子脂质和阳离子脂质组合物组合以获得改良的核酸转染组合物。根据本发明,可以添加多种肽和/或蛋白质以实现转染。
本发明的包含肽-脂质或蛋白质-脂质结合物和核酸的转染组合物可以进一步包括已知进一步增强转染的其它非肽或非蛋白质药剂。
本发明的包含肽-聚阳离子或蛋白质-聚阳离子聚合物结合物和核酸的转染组合物可以进一步包括已知进一步增强聚阳离子聚合物转染的其它非肽药剂,举例来说,聚阳离子聚合物转染可以通过添加DEAE-葡聚糖和/或氯喹来得到增强。
在一个优选但非限制性的实施例中,本发明的非天然存在的肽可以首先通过非共价缔合来结合于待被引入到细胞中的核酸或其它货物。随后将肽-核酸复合物与转染剂(或转染剂混合物)掺合,并且采用所得混合物来转染细胞。优选的转染剂是阳离子脂质组合物,如(但不限于)含有式(I)脂质的那些组合物;尤其单价和多价阳离子脂质组合物;更尤其由以下构成的阳离子脂质组合物:阳离子脂质与DOPE的1:1到4:1混合物、和阳离子脂质与胆固醇的1:1到4:1混合物、以及阳离子脂质与DOPC的1:1到4:1混合物;更尤其由以下构成的阳离子脂质组合物:二羟基-二肉豆蔻基精胺四盐酸盐与DOPE的1:1到4:1混合物、和二羟基-二肉豆蔻基精胺四盐酸盐与胆固醇的1:1到4:1混合物、以及二羟基-二肉豆蔻基精胺四盐酸盐与DOPC的1:1到4:1混合物、以及羟基-二肉豆蔻基精胺四盐酸盐与DOPE的1:1到4:1混合物、和羟基-二肉豆蔻基精胺四盐酸盐与胆固醇的1:1到4:1混合物、以及羟基-二肉豆蔻基精胺四盐酸盐与DOPC的:1到4:1混合物
在另一个任选的实施例中,可以在核酸与待被引入到细胞中的本发明非天然存在的肽复合的同时或紧接在其之后,使一种或多种增强转染的肽、蛋白质或蛋白质片段(包括膜融合肽或蛋白质、转运或运输肽或蛋白质、受体-配位体肽或蛋白质、或核定位肽或蛋白质和/或其经过修饰的类似物(例如,经过精胺修饰的肽或蛋白质))与所述核酸复合。随后使肽-核酸复合物与转染剂掺合,并且采用所得混合物来转染细胞。在某些实施例中,增强转染的肽、蛋白质或蛋白质片段的混合物在使其与核酸复合之前加以储存。
在另一个任选的实施例中,转染剂的组分(脂质、中性脂质、辅助脂质、阳离子脂质、树枝状聚合物或PEI)可以直接或一个连接或间隔基团而共价结合于所选择的肽、蛋白质或蛋白质片段。在此实施例中尤其受关注的是本身为来自非包膜病毒的非天然存在膜融合蛋白质的肽或蛋白质,如所属领域中已知的。
含有非包膜病毒非天然存在的肽的复合物示例性用途
采用本发明脂质聚集体或其混合物的递送方法可以体外、离体和体内应用于细胞,尤其用于转染真核细胞或组织,包括动物细胞、人类细胞、非人类动物细胞、昆虫细胞、植物细胞、禽类细胞、鱼类细胞、哺乳动物细胞等等。使待被递送到细胞中的聚阴离子与脂质聚集体在如上文所描述的天然存在肽的存在下接触,以形成聚阴离子-脂质-多肽聚集体复合物。随后将一种或多种目标细胞与复合物一起培育,或对于体内应用,向生物体投与复合物以使得所述复合物接触目标细胞或组织。本发明化合物也可以结合于多种适用分子和物质或与其混合或与其结合使用,所述分子和物质也被称作转染辅助物,如增强细胞靶向、吸收、内化、核靶向和表达的蛋白质、肽、生长因子等等。
本发明的复合物和方法,尤其涉及包括本文所提供复合物的转染组合物的那些复合物和方法可以用于细胞(尤其真核细胞)的体外和体内转染,并且更尤其用于高等真核细胞(包括动物细胞)的转染。本发明的方法可以用于产生表达适用基因产物的经过转染的细胞。本发明的方法也可以用作产生转殖基因动物中的步骤。本发明的方法可以适用作需要将核酸引入到细胞中的任何治疗方法中的步骤,所述治疗性方法包括基因治疗方法和病毒抑制方法以及用于将反义或反基因核酸、核糖核酸酶、RNA调节序列、siRNA、RNAi、
包含肽、蛋白质、肽或蛋白质片段或经过修饰的肽或经过修饰的蛋白质的本发明转染组合物和方法也可以在出于研究目的进行的真核细胞任何转染中用作研究剂。
因此,本文提供一种将大分子引入到细胞中的方法,其包括形成转染组合物,所述转染组合物包括核酸和包含转染剂与融合剂的复合物,其中所述融合剂包括来源于非包膜病毒融合蛋白的促进融合的氨基酸序列;和使真核细胞与所述转染组合物接触。本文在实例部分中提供用于使用本发明组合物转染真核细胞的说明性方案。如本文所公开的,说明性实例中的融合剂是膜融合肽(MPP),有利地是长度在5与50个氨基酸之间的融合肽,其中融合肽的至少5个邻接氨基酸与表1中所阐述的任何肽至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%类似。
另一个实施例提供一种用核酸体内转染细胞或组织的方法,其中所述方法包含形成脂质聚集体(优选地脂质体),其包含一种或多种阳离子脂质、任选地一种或多种中性脂质和任选地一种或多种辅助脂质;使所述脂质聚集体与核酸-肽复合物接触,所述核酸-肽复合物通过使所述核酸与本发明的非天然存在的肽在足以促进所述肽与所述核酸之间稳定非共价相互作用的条件下接触来形成,由此形成中性或带正电荷的脂质聚集体-核酸复合物;以及向生物体投与所述脂质聚集体-核酸复合物以使得所述复合物接触目标细胞或组织。
脂质聚集体-肽-核酸复合物的投与可以经口、静脉内或通过皮下或肌肉内注射或局部施用于组织或实验室环境培养物中的细胞来实现。
任选地,聚阴离子-肽-脂质聚集体复合物在与一种或多种细胞接触以用于转染之前储存一段时间。聚阴离子-肽-脂质聚集体复合物是稳定的,并且可以储存持续至少30分钟、至少45分钟、至少1小时、至少2小时、至少3小时、至少4小时、至少5小时、至少10小时、至少15小时、至少20小时、至少24小时、至少48小时、至少72小时、至少5天、至少7天、至少14天、至少28天、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月或至少1年的时间段,或持续介于这些时间段中的任一个之间的时间段。
在另一个实施例中,在多孔培养板的孔中提供本发明的脂质聚集体(大致介于1μl与2000μl之间)。选择待被递送到目标细胞中的目标聚阴离子分子,并且将其添加到孔中以形成聚阴离子-肽-脂质聚集体复合物,随后使其与目标细胞接触。脂质聚集体在每个孔中的组成和浓度可以相同,或脂质聚集体组成和/或浓度可以在孔之间变化。在聚阴离子是核酸,如DNA或RNA的情况下,可以将所述核酸添加到孔中,并且任选地在与目标细胞接触之前加以储存。
本发明的方法任选地包含在使核酸-肽复合物与一种或多种阳离子脂质接触以形成包裹所述核酸-肽的脂质聚集体之前或同时,使所述一种或多种阳离子脂质与一种或多种辅助或中性脂质接触的步骤。所述方法还任选地包含在与核酸接触之前使脂质聚集体形成为脂质体。在其它实施例中,脂质体通过微流体化、挤出或所属领域中已知的其它手段来形成。核酸优选地是抑制目标基因表达的DNA或RNA。优选地,核酸与基因转录物缔合以实现抑制。优选地,核酸是RNAi、siRNA、shRNA或stRNA,并且任选地经过化学修饰。
核酸或其它大分子的体积和浓度、本文所提供转染复合物的体积和浓度、稀释剂的体积和组成以及细胞的体积和浓度可以使用用于此类优化和滴定的标准实验方法来确定,所述方法包括例如利用细胞毒性分析的方法和/或采用转染使用表达报道基因的核酸表达载体(如β半乳糖苷酶、荧光素酶和/或荧光蛋白)的方法。此外,细胞密度可以使用标准方法来加以优化,并且用于使用本文所提供转染复合物转染的细胞密度可以在高密度>75%到低密度<50%的范围内。
举例来说,用于复合反应的示例性稀释剂包括血清减少或无血清的培养基,如D-MEM和RPMI 1640和OptiPro
应理解,在本文所提供的复合物、组合物和方法中可以使用广泛浓度的转染剂和融合剂。举例来说,在包括阳离子脂质与非天然存在的肽的复合物的组合物的说明性非限制性实例中,所述组合物中阳离子脂质和非天然存在的肽的总示例性非限制性组合浓度可以介于1mg/ml与4mg/ml之间。以1mg/ml向脂质中添加的肽的范围可以在100μg/ml与3mg/ml之间。阳离子脂质与辅助脂质的比率可以在0.5/1.0(摩尔浓度)与纯化合物之间。
可以根据本发明加以转染的细胞包括例如几乎任何真核细胞,包括原代细胞,培养物中的细胞以及经过培养的组织中的细胞,尤其被视为难以转染的细胞。细胞可以是附着细胞或处于悬浮状态的细胞。在某些说明性方面,细胞是悬浮CHO-S细胞和悬浮293-F细胞。悬浮细胞培养物尤其非常适合于本文所提供的蛋白质生产方法。可以使用本发明的药剂和方法来加以转染的其它细胞包括(但不限于)293(如GripTite 293MSR(InvitrogenCorporation))、CHO、Cos7、NIH3T3、Hela、原代成纤维细胞、A549、Be2C、SW480、Caco2、原代神经元、Jurkat、C6、THP1、IMR90、HeLa、ChoK1、GT293、MCF7、HT1080、LnCap、HepG2、PC12、SKBR3和K562 cells,或在表6中列出的任何细胞。
在本文所提供的某些实施例中,转染增强剂包括于用于转染细胞的复合物中。举例来说,转染增强剂可以是核定位肽。在一个例子中,转染增强剂是PLUS
在另一个实施例中,本文提供一种用于产生蛋白质的方法,其包含:用编码所述蛋白质的核酸分子转染细胞,培育所述细胞以产生所述蛋白质,以及收集所述蛋白质,其中所述转染通过使所述细胞与包括本发明非天然存在的肽的转染组合物接触来进行。用于转染细胞的组合物可以是如本文所提供的任何组合物。示例性组合物包括编码所关注蛋白质的核酸分子(与本发明的非天然存在的肽复合),任选地包括融合剂和转染剂。
在说明性实施例中,所编码的蛋白质是抗体分子、或抗原结合片段或其衍生部分,例如单链Fv片段。在这些实施例中,所述方法可以进一步包括分离蛋白质,例如通过在抗体结合柱上使用亲和纯化来分离。在某些实例中,使用本文所提供的转染组合物将编码抗体两个链的核酸转染到细胞中。
应理解,编码蛋白质的核酸可以是表达载体。表达载体通常具有可操作地连接于一个或多个编码一种或多种蛋白质链的核酸序列的启动子。在所产生的蛋白质是医药产品的情况下,所述蛋白质可以例如在适当选择生理培养基的情况下相应地加以调配。
本文所提供的转染组合物也可以用于使用所属领域中已知的方法将肽和蛋白质等等引入到细胞中。先前已经描述使用阳离子脂质用于肽和蛋白质递送的方法。另外,转染组合物可以用于将核酸、肽和蛋白质等等体内递送到组织中。先前已经描述使用脂质将化合物体内递送到组织中的方法。转染组合物可以在适当选择生理培养基的情况下用于治疗和诊断应用中。
本发明进一步是针对在至少一个第一合适容器中含有至少一种根据本发明的非天然存在的肽的试剂盒。本发明的试剂盒可以进一步包含一个或多个容器,所述容器包含有助于引入至少一种大分子的试剂(例如阳离子转染试剂)、任选地一种或多种辅助脂质或中性脂质,并且可以任选地具有货物,如核酸或如上文所定义的其它货物。优选的转染试剂包括(但不限于)阳离子脂质等等。
本发明转染组合物的组分可以提供于试剂盒中。试剂盒可以含有转染剂和本发明的非天然存在的肽。此试剂盒也可以任选地包括转染增强剂,如增强转染的肽、蛋白质或其片段或增强转染的化合物。当存在时,转染剂、非天然存在的肽和任选的转染增强剂可以各自以混合物的形式包括在内(即,在单个容器中,通常是试管和/或小瓶),或可以单独部分的形式包括在内(即,在单独容器中,例如单独的小瓶和/或试管)。应理解,本发明的试剂盒通常包括容器,如小瓶和/或试管,其被包装在一起,例如在卡纸板箱或其它包装中。试剂盒可以从供应商运送给客户。举例来说,在本文所提供的一个实例中是包括小瓶的试剂盒,所述小瓶包括有包括转染剂的脂质体调配物和增强转染的肽。试剂盒也可以包括例如单独的容器,所述容器包括转染增强剂,如增强转染的肽,例如Plus Reagent
在一个实施例中,试剂盒包含以下的单独部分或其混合物:阳离子脂质(如(但不限于)式I脂质),其任选地与一种或多种辅助脂质和/或一种或多种中性脂质组合;和本发明的肽、蛋白质或其片段或经过修饰的肽、蛋白质或其片段。在另一个实施例中,试剂盒包含以下的单独部分或其混合物:聚阳离子聚合物;和本发明的肽、蛋白质或其片段或经过修饰的肽、蛋白质或其片段。阳离子脂质转染试剂盒可以任选地包括中性脂质以及其它转染增强剂或其它添加剂,并且可以调整试剂盒中组分的相对量以有助于制备转染组合物。试剂盒组分可以包括用于其它试剂盒组分的适当培养基或溶剂。
阳离子脂质转染试剂盒包含单阳离子或聚阳离子脂质组合物,如(但不限于)式I脂质,并且优选的是进一步包括中性脂质和本发明的肽或蛋白质。
树枝状聚合物转染试剂盒可以任选地包括其它转染增强剂,如DEAE-葡聚糖和/或氯喹以及其它添加剂,并且可以调整试剂盒中组分的相对量以有助于制备转染组合物。
本发明提供的试剂盒包括包含以下的那些试剂盒:包含DOSPA和DOPE的聚阳离子脂质组合物或包含DOTMA和DOPE的单阳离子脂质组合物的单独部分,和经过修饰的肽(任选地,经过精胺或亚精胺修饰的肽)的部分。本发明提供的试剂盒包括包含以下的那些试剂盒:聚阳离子聚合物的单独部分;和经过精胺修饰的肽的部分。
在相关实施例中,本发明的试剂盒可以包含肽-脂质或蛋白质-脂质结合物或肽-聚阳离子或蛋白质-聚阳离子聚合物结合物,其与非结合脂质、非结合聚阳离子聚合物以及其它有助于转染的药剂组合。
本发明的试剂盒可以包括适用于诊断方法的那些试剂盒,例如,除转染剂和转染增强剂(例如,蛋白质、肽和片段以及肽和蛋白质的修饰)以外还可以含有诊断核酸的诊断试剂盒。诊断核酸是可以用于在细胞中检测另一种物质(最一般来说,被分析物)的存在的任何核酸的通用术语。举例来说,当被转染到细胞中时,诊断核酸可以响应于细胞中另一种物质(例如,蛋白质、小分子、类固醇、激素或另一种核酸)的存在而增加或减少其中的基因表达。诊断核酸还包括将一些标记(label)或以其它方式可检测的标记物(marker)携带到特定目标细胞或目标组织中以用于检测目标细胞或组织或用于检测目标细胞或组织中物质的那些核酸。
可以通过本发明方法加以转染的核酸包括具有任何大小、来自任何来源、包含天然碱基或非天然碱基的DNA和RNA,并且包括编码治疗性蛋白质或以其它方式适用的蛋白质并且能够在细胞中表达所述蛋白质的那些核酸、在细胞中抑制非所需核酸表达的那些核酸、抑制非所需酶活性或活化所需酶的那些核酸、催化反应(核糖核酸酶)的那些核酸以及在诊断分析中起作用的那些核酸(例如诊断核酸)。治疗性核酸包括编码治疗学上适用的蛋白质、肽或多肽或可以在细胞中表达所述蛋白质、肽或多肽的那些核酸,在细胞中抑制非所需核酸表达的那些核酸,以及在细胞中抑制非所需酶活性或活化所需酶的那些核酸。
也可以容易地鉴于本文的公开内容来使本文所提供的组合物和方法适于将除核酸之外的生物活性大分子(尤其包括多胺、多胺酸、多肽和蛋白质)引入到真核细胞中。适用作例如治疗剂、诊断物质、研究试剂的其它物质,其可以与肽和经过修饰的肽结合并且通过本发明方法引入到真核细胞中。
式I脂质可以用作上文所描述的试剂盒的阳离子阳离子,并且可以独立地提供于试剂盒中。一般来说,试剂盒在合适容器中含有式(I)脂质。脂质可以例如处于有机溶剂(如乙醇)的溶液中、缓冲液中或溶剂/缓冲液混合物中。另外,试剂盒可以包括(但不限于)合适溶剂或缓冲液中的式(I)脂质和来自非天然存在的蛋白质(其增强或促进脂质体载体与细胞膜的膜融合)的氨基酸序列。
在一个实施例中,试剂盒可以包含以下的单独部分或其混合物:例如式(I)脂质或其它阳离子脂质;和肽、蛋白质或其片段或经过修饰的肽、蛋白质或其片段。包括式(I)脂质或其它阳离子脂质的试剂盒可以任选地包括中性脂质以及其它转染增强剂或其它添加剂,并且可以调整试剂盒中组分的相对量以有助于制备转染组合物。试剂盒组分可以包括用于其它试剂盒组分的适当培养基或溶剂。
包括式(I)脂质或其它阳离子脂质、中性脂质和经过修饰的肽或蛋白质的试剂盒是优选的。本发明提供的试剂盒包括包含以下的那些组合物:式(I)脂质的单独部分、DOPE以及肽(尤其经过精胺修饰的肽)的部分。本发明提供的试剂盒包括包含以下的那些试剂盒:式(I)脂质的单独部分;和含有一段基本氨基酸(如赖氨酸、鸟氨酸或精氨酸)的经过修饰的肽的部分。
销售方法
还提供一种用于销售本文所提供的非天然存在的肽、脂质、转染复合物、转染组合物和/或试剂盒的方法,其包含:向客户提供识别本文所提供的非天然存在的肽、脂质、复合物和/或转染组合物和/或试剂盒的识别符,和向客户提供获取用于使用所述识别符购买本文所提供的非天然存在的肽、脂质、转染复合物、转染组合物和/或试剂盒的购买功能的途径。识别符通常作为订购系统的一部分提供给客户。订购系统可以包括用于识别所需产品的输入功能,和用于购买所识别的所需产品的购买功能。订购系统通常处于提供商的直接或间接控制下。如本文所用,客户是指希望获得生物学研究产品和服务的任何个体、机构、公司、大学或组织。如本文所用,提供商是指希望提供生物学研究产品和服务的任何个体、机构、公司、大学或组织。
本发明还提供一种用于销售本文所提供的非天然存在的肽、脂质、转染复合物、转染组合物和/或试剂盒的方法,其包含:向客户提供电话订购系统的输入功能和/或向客户提供作为计算机系统一部分的数据输入区或可选项目列表,其中所述非天然存在的肽、脂质、转染复合物、转染组合物和/或试剂盒使用所述输入功能来加以识别。在所述输入功能是计算机系统的一部分(如显示在因特网网站的一个或多个页面上)的情况下,通常向客户提供线上购买功能(如线上购物车),其中所述客户使用所述购买功能来购买所识别的非天然存在的肽、脂质、转染复合物、转染组合物和.或试剂盒在一个方面,向客户提供多个识别符,其各自识别不同的本文所提供的非天然存在的肽、脂质、复合物和/或转染组合物和/或试剂盒,或不同体积或重量的本文所提供的非天然存在的肽、脂质、复合物和/或转染组合物和/或试剂盒。方法可以进一步包含激活购买功能以购买本文所提供的脂质、转染复合物、转染组合物和/或试剂盒。所述方法可以再进一步包含将所购买的本文所提供的非天然存在的肽、脂质、转染复合物、转染组合物和/或试剂盒运送给客户。非天然存在的肽、脂质、转染复合物、转染组合物和/或试剂盒可以由提供商运送给客户。提供者通常控制输入功能,并且可以控制为了获取购买本文所提供的非天然存在的肽、脂质、转染复合物、转染组合物和/或试剂盒的输入功能而进入的网站。
医药组合物
本发明的转染剂和转染增强剂可以多种医药组合物和剂型提供以用于治疗应用。举例来说,含有这些复合物的可注射调配物、鼻内调配物以及用于静脉内和/或病灶内投与的调配物可以用于疗法。
一般来说,本发明的医药组合物应含有足够的转染剂和任何增强剂(肽、蛋白质等)以提供将足够充分高水平的核酸引入到目标细胞或目标组织中以使得核酸在其中具有所需治疗效果。目标细胞或组织中将在治疗学上有效的核酸水平将取决于抑制或其它生物学功能的效率以及核酸必须影响的位点数目。
向患者投与的本文所描述转染组合物的剂量将取决于多种其它因素,包括投药方法和位点、患者年龄、体重和病状。所属领域的普通技术人员可以容易地针对既定投药类型、既定患者和既定治疗应用调整剂量。
所属领域的普通技术人员应了解,转染组合物应含有最少量的抑制性组分(如血清或高盐含量),所述抑制性组分可能抑制核酸进入细胞中的引入或以其它方式干扰转染或核酸复合。还应了解,取决于特定应用,任何医药或治疗性组合物应含有最少量的可能在患者中引起有害副作用的组分。
本文所描述的转染组合物可以被调配成组合物,所述组合物包括医药活性剂和用于所述医药活性剂的医药学上可接受的稀释剂、赋形剂或载体。此类组合物可以呈单位剂型,如片剂、丸剂、胶囊(包括持续释放或延迟释放调配物)、散剂、颗粒剂、酏剂、酊剂、糖浆和乳液、无菌非经肠溶液或悬浮液、气雾剂或液体喷雾剂、滴剂、安瓿、自注射器裝置或栓剂;用于经口、非经肠(例如静脉内、肌内或皮下)、鼻内、舌下或经直肠投与,或用于藉由吸入或吹入投与,并且可以用适当方式并且根据公认实践(如《雷明顿氏药物科学(Remington's Pharmaceutical Sciences)》(Gennaro编,Mack Publishing Co.,宾夕法尼亚州伊斯顿(Easton Pa.),1990,以引用的方式并入本文中)中所公开的那些)来调配。
合适的载体、赋形剂和稀释剂的一些实例包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、淀粉、阿拉伯胶、磷酸钙、海藻酸盐、黄蓍、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯和丙酯、滑石、硬脂酸镁以及矿物油。调配物可以另外包括润滑剂、湿润剂、乳化和悬浮剂、防腐剂、甜味剂或调味剂。当载体充当稀释剂时,其可以是充当活性成分媒剂、赋形剂或培养基的固体、半固体或液体物质。在注射的情况下,有可能制备本发明一种或多种脂质于药学上可接受的载剂(如水性或非水性溶剂)中的溶液或脂质体。可以使用的溶剂的实例是注射用蒸馏水、生理盐水溶液、林格氏溶液、植物油、合成脂肪酸甘油酯、高级脂肪酸酯、丙二醇等等。
提供以下实例以说明本发明的某些方面并且辅助所属领域的技术人员实践本发明。这些实例决不应被视为以任何方式限制本发明的范围。
实例1.制备脂质聚集体/多肽复合物并转染经过培养的细胞
所有细胞都在美国典型培养物保藏中心(ATCC)向每个细胞系建议的标准培养条件进行培养。在转染之前大约24小时,接种细胞以使得其在转染当天将70%-90%汇合。以下指导原则一般是可适用的,但如所属领域的技术人员将容易了解的,存在细微变化,并且所述指导原则取决于细胞系的标识、其生长特征和需要以及其在贴壁培养(adherentculture)中的形态。一般来说,对于96孔培养板,每孔接种介于1×10
根据制造商方案制备用于将DNA转染到培养物中细胞中的转染复合物。
为了制备含有上文所描述的非天然存在的肽的转染复合物,合成具有以下序列SRRARRSPRESGKKRKRKRGGGSGGGSGGGSRRRRRRRRRRR(SEQ ID NO.89)的肽1并且以干粉形式提供。在无菌超纯水中复原干粉达到4.35mg/ml的最终浓度,并且使其完全溶解。将此储备肽溶液放在一旁以用于下一步骤。
为了制备脂质聚集体-DNA-肽复合物,获得
在单独的Eppendorf管中,将5μl(对于96孔培养板的每个孔)、25μl(对于24孔培养板的每个孔)或125μl(对于6孔培养板的每个孔)的
对于96孔培养板的每个孔,向经过稀释的DNA混合物中添加0.2μl储备肽,对于24孔培养板的每个孔,向其中添加1μl储备肽,并且对于6孔培养板的每个孔,向其中添加5μl储备肽,并且使肽/DNA混合物良好混合并在室温下培育大致1分钟。
对于96孔培养板的每个孔,将5μl经过稀释的DNA/肽混合物与5μl经过稀释的
在培育之后,向在前一天用新鲜生长培养基接种的细胞中添加脂质-肽-DNA复合物;对于96孔培养板,向细胞中添加10μl脂质-肽-DNA,对于24孔培养板,向细胞中添加50μl脂质-肽-DNA混合物,对于6孔培养板,向细胞中添加250μl脂质-肽-DNA。在脂质-肽-DNA存在下培育细胞大致24-48小时,并且分析。
实例2.转染各种细胞系
根据实例1中所阐述的方法,用pcDNAEF1a/emGFP(一种编码GFP的表达载体)转染一组10种难以转染的癌细胞系(HepG2、Hepa1-6、Hep3B、HUH7、MCF-7、MDA-MB-23、SKBR3、LNCaP、Bend3和T986)、两种难以转染的神经元细胞系(PC12和Neuro2A)、两种难以转染的成肌细胞细胞系(H9C2和C2C12)以及一种难以转染的肾脏成纤维细胞细胞系(Vero)。在于转染复合物存在下持续24小时之后,使用荧光显微法在适当波长下观测细胞。
GFP在癌细胞系中的表达展示于图1A中,在神经元细胞中的表达展示于图1B中,在成肌细胞中的表达展示于图1C中,并且在肾脏成纤维细胞中的表达展示于图1D中。
实例3.比较各种转染试剂
使用
为了扩展本研究,如上使用
表6.如通过相对转染效率和与
实例4.转染试剂剂量对转染效率和蛋白质表达的影响
将HeLa细胞接种在96孔培养板中,并且使用0.1μl、0.2μl、0.3μl或0.4μl的
图3A是比较编码GFP的表达载体被转染到经过培养的HeLa细胞中的相对转染效率的图,所述转染使用剂量逐渐增加的三种不同的可商购脂质聚集体调配物来进行:
图3B是比较由编码GFP的表达载体转染的HeLa细胞中GFP表达强度的图,所述转染使用剂量逐渐增加的三种不同的可商购脂质聚集体调配物来进行:
实例5.与三种可商购转染试剂相比较的蛋白质表达改良
在24孔培养板中使用
图4是比较在由编码GST-STAT融合蛋白的表达载体转染的HepG2细胞中GST-STAT融合蛋白的相对表达水平的蛋白质印迹(上部图),所述转染使用以下可商购的脂质聚集体调配物来进行:
实例6.转染H9人类胚胎干细胞系
将H9人类胚胎干细胞系以37500个细胞/孔的密度接种在96孔培养板的每个孔中,并且使用每孔0.1μl到0.6μl
图5A是比较H9人类胚胎干细胞系(96孔培养板中每孔37,500个细胞)相对转染效率的图,所述干细胞系由剂量逐渐增加的GFP表达载体(左图50μg;中间图100μg,并且右图200μg)并且使用每孔介于0.1到0.6μl之间的
图5B是在96孔培养板中培养的H9细胞中GFP表达的代表性荧光图像,所述细胞以100微克/孔使用200μl
实例7.使用CRISPR核酸酶载体系统的细胞基因组修饰
质粒设计和制备:使用生命技术
在解冻之后使用
在每种细胞类型中比较用
通过流式细胞测量术和显微法测定来自CRISPR载体的OFP表达。具有RFP滤波器的
图6展示在U2OS细胞(图6A)和HepG2细胞(图6B)中使用CRISPR载体的转染效率和蛋白质表达。载体含有OFP报道基因,并且用
基因组断裂检测:
图7A展示靶向AAVS1基因座的TALEN和CRISPR在使用
图7B展示靶向AAVS1基因座的TALEN和CRISPR在使用
结论:用
实例8.脂质转染试剂和肽是增强转染所需的
将HeLa细胞接种到96孔培养板上,并且使用0.05μl、0.1μl、0.2μl、0.3μl、0.4μl或0.5μl的单独
图8展示描绘由GFP表达载体转染的HeLa细胞的相对转染效率(上部图,以仅单个细胞%计的GFP+)或每个细胞的相对表达水平(下部图;仅单个细胞平均FL1-H)的两个条形图,所述转染使用指定剂量(以μl为单位)的单独
实例9.全长肽是最优转染所需的
以下肽示意性地概述于图9A、图10A和图11A中,如实例1中对肽1所描述进行合成并溶解于超纯水中。肽A(对应于本发明的非天然存在的肽的MPP区)并且具有肽序列SRRARRSPRESGKKRKRKR(SEQ ID NO.1);肽B(对应于本发明的非天然存在的肽的连接区)并且具有肽序列GGGSGGGSGGGS(SEQ ID NO.69);肽C(对应于本发明的非天然存在的肽的阳离子区)并且具有肽序列CP1 RRRRRRRRRRR(SEQ ID NO.82);肽D(对应于本发明的非天然存在的肽中连接区与阳离子区融合)并且具有肽序列GGGSGGGSGGGSRRRRRRRRRRR(SEQ IDNO.108);以及肽E,对应于肽1并且具有序列SRRARRSPRESGKKRKRKRGGGSGGGSGGGSRRRRRRRRRRR(SEQ ID NO.89)。
将HepG2、A549和MDA-MB-231细胞接种在24孔培养板中,并且使用以下由1μgpcDNAEF1a/emGFP转染48小时:
图9B描绘在经过培养的由编码GFP的表达载体转染的HepG2细胞中检测GFP表达的一系列荧光图像,所述转染使用
图9C描绘两个条形图,其展示由编码GFP的表达载体转染的HepG2细胞中的每细胞平均荧光(上部图)和转染效率(GFP+细胞%),所述转染使用
图10A是在图10B和10C中所描绘的实验中在A549细胞中所用的各种肽或肽片段的肽图描绘,其中肽A是单独MPP肽,肽B是单独连接肽,肽C是单独阳离子肽,肽D是连接肽与阳离子肽融合,并且肽E是具有肽A融合肽D的全长肽。
图10B描绘在经过培养的由编码GFP的表达载体转染的A549细胞中检测GFP表达的一系列荧光图像,所述细胞用
图10C描绘两个条形图,其展示由编码GFP的表达载体转染的A549细胞中的每细胞平均荧光(上部图)和转染效率(GFP+细胞%),所述转染使用
图11A是在图11B和11C中所描绘的实验中在MDA-MB-231细胞中所用的各种肽或肽片段的肽图描绘,其中肽A是单独MPP肽,肽B是单独连接肽,肽C是单独阳离子肽,肽D是连接肽与阳离子肽融合,并且肽E是具有肽A融合肽D的全长肽。
图11B描绘在经过培养的由编码GFP的表达载体转染的MDA-MB-231细胞中检测GFP表达的一系列荧光图像,所述细胞用
图11C描绘两个条形图,其展示由编码GFP的表达载体转染的MDA-MB-231细胞中的每细胞平均荧光(上部图)和转染效率(GFP+细胞%),所述转染使用
相关领域的普通技术人员将易于清楚的是,对本文所描述的方法和应用的其它合适修改和改编是显而易见的,并且可以在不脱离本发明或其任何实施例的范围的情况下进行。在现已详细描述本发明的情况下,通过参考以下实例将更清楚地理解本发明,所述实例仅出于说明的目的特此包括在内并且并不打算限制本发明。
本说明书中所提及的所有公开、专利和专利申请都在本文中以全文引用的方式并入本说明书中,程度如同每一单独的公开、专利或专利申请被专门并且单独地指示以引用的方式并入本文中一般。倘若有冲突,则将以本文说明书(包括定义)为准。对本申请中任何参考文献的引用或确认不应被解释为承认此类参考文献可供用作本发明的现有技术。
- 增强转染的膜穿透性肽和组合物以及其使用方法
- 增强转染的膜穿透性肽和组合物以及其使用方法
