抗猪伪狂犬病毒感染的中和性单克隆抗体及应用
文献发布时间:2023-06-19 12:24:27
技术领域
本发明涉及一种抗猪伪狂犬病毒感染的中和性单克隆抗体及应用,属于单克隆抗体技术领域。
背景技术
猪伪狂犬病(PorcinePseudorabies,PR),是一种由猪疱疹病毒I型(Pseudorabiesvirus,PRV)引起的以发热、流产、死胎等为主要临床症状的接触性、急性传染病。妊娠母猪主要症状为流产、产弱仔、死胎以及木乃伊胎等;新生仔猪多呈现急性致死性,表现为典型的神经症状、麻痹、死亡率近100%;成年猪多为隐性感染,影响猪的生产水平。PRV在世界范围内已广泛流行,给养猪业带来巨大的经济损失,是影响养猪业健康发展的重大传染病之一。
针对PRV的抗体评价主要包括如琼脂扩散试验、间接ELISA、乳胶凝集试验、血凝抑制试验等,以总的特异性抗体检测为主,并不能准确评价猪体内中和抗体水平,难以对猪的免疫保护水平进行准确判断。基于中和性单克隆抗体的竞争性ELISA检测方法,能够有效评估猪体内PRV中和抗体水平,并对免疫保护效果进行准确评价。
目前,针对PRV感染并没有特效药物。在抗病毒研究领域,单克隆抗体是一种良好的候选靶标,具有抗病毒起效快、治愈率高等优点。基于单克隆抗体特异性强、纯度高、均一性好的特点,建立血清学检测方法,使抗体在体内阻断病毒感染等方面具有良好的治疗效果。因此,研究中和性单克隆抗体在PRV病毒检测和治疗方面具有巨大的潜力,对于PR的预防和治疗具有十分重要的应用意义。
发明内容
针对现有技术的不足,本发明的目的是提供一种抗猪伪狂犬病毒感染的单克隆抗体及应用。
为了实现上述目的,本发明所采用的技术方案是:
一种抗猪伪狂犬病毒感染的单克隆抗体的杂交瘤细胞株,所述杂交瘤细胞株为杂交瘤细胞株7B6,已保藏于中国典型培养物保藏中心,保藏编号为CCTCCNO:C202192,保藏地址为武汉大学,保藏时间为2021年5月27日。
所述的杂交瘤细胞株制备的单克隆抗体7B6。
所述单克隆抗体的重链为IgG1型,轻链为Kappa型。
所述的单克隆抗体在猪伪狂犬病毒中和性抗体检测中的应用。
所述的单克隆抗体在制备抗伪狂犬病感染的药物中的应用。
本发明有益效果:
本发明方法获得的抗猪伪狂犬病毒感染的单克隆抗体,产量高,稳定性好,生产成本低,中和活性高。其中,单抗7B6可以识别PRV病毒中和性抗原表位,能够高效中和PRV病毒在体外和体内的感染,可以用于PRV中和抗体的竞争性检测及抗病毒治疗,是一种潜在的治疗PRV感染的候选药物,在PRV病毒检测和治疗方面拥有巨大的潜力,对于PR的预防和防治具有十分重要的应用意义。
附图说明
图1为IPMAs分析PRV-gD的单克隆抗体与PRV的反应示意图;
其中,单克隆抗体4D6(A)、5B2(B)、6H7(C)、7D8(D)、8B9(E)、9C11(F)、7B6(G)、12F4(H)和13F8(I);比例尺:100μm;
图2为PRV-gD单克隆抗体与PRV病毒的反应示意图;
其中,单克隆抗体3D3(A)、9C11(B)、7B6(C)、12F4(D)、4D6(E)、5B2(F);比例尺:100μm;
图3为PRV-gD单克隆抗体与gD蛋白反应的示意图;
其中,单克隆抗体3D3(A)、9C11(B)、7B6(C)、12F4(D);
图4为PRV-gD的单克隆抗体上清的中和效价示意图;
图5为单克隆抗体7B6(A)和12F4(B)IC
其中,圆点代表有补体,三角代表无补体;
图6为单克隆抗体7B6的抗病毒效果示意图;
其中,A,攻毒后小鼠体重变化;B,攻毒后小鼠的存活率;C,攻毒后7天小鼠脑部和肺部的PRV病毒载量;
图7为单克隆抗体7B6在攻毒之后的治愈效果示意图;
其中,A,攻毒后小鼠体重变化;B,攻毒后小鼠的存活率;C,攻毒后7天小鼠脑部和肺部的PRV病毒载量;
图8为单克隆抗体7B6抑制PRV对BHK-21细胞和Vero细胞的吸附的示意图;
其中,WesternBlot(A)、绝对定量PCR(B)和流式细胞仪(C);
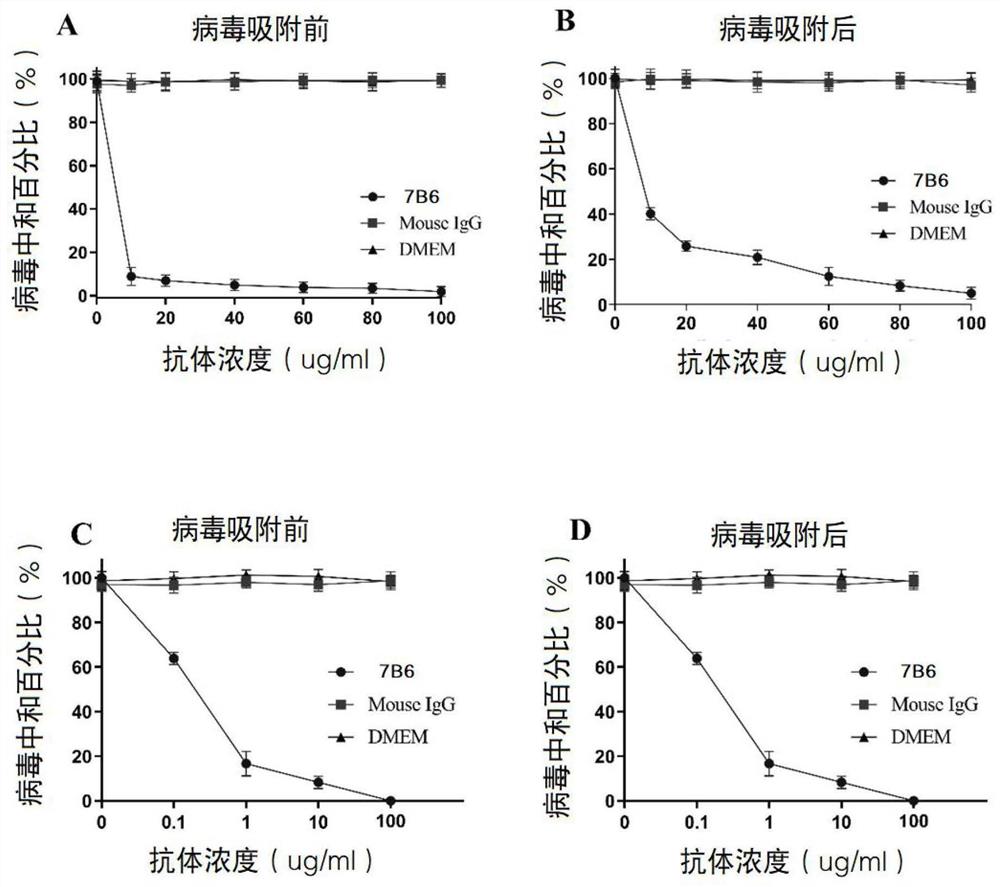
图9为单克隆抗体7B6在PRV吸附前后对病毒的中和作用示意图;
其中,A和C:吸附前,B和D:吸附后。
具体实施方式
以下结合实施例对本发明的具体实施方式作进一步详细说明。
实施例1 BALB/c小鼠免疫
免疫小鼠:取3只4-6周大小的雌性BALB/c小鼠,在实验室过度一周后,取杆状病毒重组表达的猪伪狂犬病毒gD蛋白(由河南省农业科学院动物免疫学重点实验室制备、保存、提供)与弗氏完全佐剂(体积比1:1)乳化后,皮下多点注射,100ug/只,两周后用弗氏不完全佐剂乳化的猪伪狂犬病毒gD蛋白(体积比1:1)按同样方式加强免疫,再过两周后再次加强免疫。
超免:加强免疫后的小鼠血清IPMA效价升高至20000以上后,进行超免,取表达纯化的猪伪狂犬病毒gD蛋白,用无菌PBS缓冲液稀释至0.2μg/μL,然后直接进行腹腔注射500μL进行超免。
小鼠血清效价检测:免疫三次后的小鼠剪尾采血,每只采5μL加入195μLPBS缓冲液中,5000rpm离心6min分离血清;从1:1000开始,用PBS缓冲液连续倍比稀释,采用IPMA方法测定血清抗体效价。
IPMA方法如下:
提前一天用PK-15细胞铺板96孔板,等第二天细胞长至60-70%时,接入100TICD
实施例2单克隆抗体的细胞融合与亚克隆
单克隆细胞株融合过程如下:
(1)实施例1中小鼠超免后的第三天,再次用IPMA进行血清效价测定,第4天或第5天对效价最高的小鼠用无菌镊子摘除眼球,充分放血,收集血液后分离并保存血清,然后对小鼠进行脱颈处死并将尸体完全浸泡于体积分数为75%的乙醇中进行消毒;
(2)将消毒后的小鼠尸体放在超净台中,用高压处理过的手术剪和镊子剖开小鼠,摘出脾脏放在洁净的200目的滤网上,用灭菌过的另一双剪刀把脾脏充分剪成小碎块,用无血清的1640培养基冲刷,使单个分散的脾细胞穿透滤网流入洁净的玻璃烧杯内;
(3)收集2×10
(4)将步骤(2)得到的单个脾细胞加入洁净的离心管内,添加无血清的1640培养基到40mL,1100rpm离心10min;
(5)弃去上清,轻轻摇散细胞团,分别向步骤(4)得到脾细胞悬液和步骤(3)得到sp/20细胞悬液中各添加无血清的1640培养基10mL,轻轻混匀后,把脾细胞悬液和sp/20细胞悬液混在一起,添加无血清的1640培养基补充至40mL,1100rpm离心10min,吸尽上清;
(6)轻柔拍打离心管分散细胞团后,一滴一滴的添加1mL的50%(体积分数)的PEG1500融合剂,开始缓慢滴加,随后逐渐加快,1min加完,静止90s;接着缓慢逐滴加入15mL无血清的1640培养基终止融合,先慢后快:前30s内滴加1mL,接着的30s内滴加3mL,最后逐渐加快滴加剩余的11mL;把细胞悬液放在37℃水浴中固定5min,然后无菌条件下添加无血清的1640培养基至40mL,1100rpm离心10min;
(7)弃掉上清,轻轻摇散细胞团,加入含HAT的1640培养基,轻轻的混匀细胞悬液,不要过于使劲,避免融合细胞受到挫伤;
(8)添加含有HAT的1640培养基,把分散充分的悬浮细胞按照250μL/孔加入到20个左右的96孔板中,静置放入37℃培养箱中;
(9)3-4天后在显微镜下可以观察到小的细胞团,6-10天继续观察细胞团长大至占据60%的培养孔时,对杂交瘤细胞的上清用IPMA的方法进行检测,并对阳性孔进行记录。
单克隆细胞株亚克隆过程如下:
将筛选到的阳性孔,转至24孔板中继续扩大培养,并进行进一步的阳性筛选,等24孔板的细胞长成明显可见的细胞团后,对阳性孔进一步亚克隆。取饲养细胞铺板96孔板,将每一个阳性孔细胞吹散混匀后,进行计数,取100个细胞稀释至10mL的1640培养基中,然后100μL/孔添加到已经铺有饲养细胞的96孔板中,在37℃温箱中生长5天左右,每天观察并标记出只有一个克隆的孔,并且该克隆明显来源于一个细胞。
具体表现为:克隆呈现圆形,靠近孔边缘时会成半圆形,并且边缘光滑,明显呈现一条弧形线条;若克隆边缘明显是由两条弧线交叉或者不规则,则该克隆是来源于2个或者更多个细胞,非单克隆细胞;当克隆长至清晰可见,大小适宜时,对上清再次进行IPMA阳性鉴定,鉴定出阳性孔,然后把阳性孔的克隆转入24孔板继续亚克隆。重复三次亚克隆后的阳性单克隆细胞,即为单抗单克隆细胞系,标记并冻存于液氮中保存。
实施例3 PRV-gD单克隆抗体的筛选
经过亚克隆和IPMA再次鉴定之后,一共得到13株PRV-gD阳性单克隆抗体细胞,根据亚克隆的顺序和位置命名为:1C8、2B9、3D3、4D6、5B2、6H7、7D8、8B9、9C11、7B6、11C9、12F4和13F8。IPMA结果显示这些单克隆抗体都能在细胞病变部位,特异性的对细胞上的病毒染色,经过AEC显色以后呈红色(图1为其中9株单克隆抗体的反应情况)。
PRV-HeNLH/2017的扩毒:本发明所用毒株为PRV-HeNLH/2017(GenbankID:MT775883)。将PK-15细胞接种到5个T75瓶中,当细胞长到70%,于无菌条件下倒掉培养基,用无菌PBS缓冲液洗三遍后,添加12mL维持液(血清体积含量为2%的DMEM培养基),然后按照千分之一接毒,在37℃温箱中培养24-48h至90%细胞病变后,连同T75细胞瓶一起反复冻融三次,然后转移到无菌的50mL离心管中,8000rpm、4℃、离心15min,取上清,用0.22μm过滤器过滤后,分装600μL/管至无菌的1.5mLEP管中,冻存于-80℃冰箱备用。
PRV-HeNLH/2017的TCID
培养48h以后,病变的孔数不再发生变化,根据显微镜下观察记录的病变情况(表1):
表1 PRV-HeNLH/2017感染48h的病变情况
使用Karber法,通过公式:lgTCID
lgTCID
PRV-HeNLH/2017的TCID
实施例4 PRV-gD的单克隆抗体的鉴定
PRV-gD的单克隆抗体与病毒的IFA反应鉴定:由于PRV-gD的单克隆抗体报道较少,为了给PRV-gD的研究提供可视化的工具,随机挑选6株,验证了单克隆抗体(3D3、4D6、5B2、9C11、7B6和12F4)与PRV反应的IFA情况。以上结果证明,单克隆抗体可以很好的与感染细胞的病毒发生特异性反应(图2)。
PRV-gD的单克隆抗体与gD蛋白的反应鉴定:为了验证筛到单抗不仅可以和PRV病毒反应也可以和gD蛋白反应,随机选4个筛到的单克隆抗体上清作为一抗,通过Western-Blot的方法与gD蛋白进行反应,结果显示:在gD位置处,均有一条特异性黑色条带,表明他们都可以与gD特异性反应(图3)。
PRV-gD的单克隆抗体亚型的鉴定:用筛到的13株单克隆抗体细胞培养上清,通过Mouse单克隆抗体亚型鉴定试剂盒(proteintech),根据说明书操作,鉴定单抗亚型。结果显示:13株单克隆抗体重链都是IgG1型,它们的轻链都是Kappa型。
实施例5 PRV-gD的单克隆抗体中和活性的检测
腹水的制备与纯化:提前10天在10周以上的雌性BALB/c小鼠的腹腔内接种500μL灭菌过的液体石蜡,然后将培养状态良好的单抗细胞,用无菌PBS洗三遍后重悬,按5×10
本发明腹水纯化均在Akta纯化仪上操作。
(1)配制PH2.7的0.1M的甘氨酸、PH9.0的1MTris-Hcl、20mMPH7.0的PB,然后所有的缓冲液均用0.22μm的滤膜除杂,用20mM的PB缓冲液对采集的腹水进行10-20倍稀释,并用0.22μm滤膜过滤;
(2)GE的ProteinG柱子首先用水清洗5-10个柱体积,然后用20mMPH7.0的PB缓冲液平衡5-10个柱体积;
(3)上样,将稀释并过滤过的腹水上样ProteinG进行富集;
(4)洗杂,用20mMPH7.0的PB缓冲液洗除杂蛋白10个柱体积以上直至UV指示线平衡;
(5)洗脱,用PH2.7的0.1M的甘氨酸进行洗脱,收集到IgG以后立刻用PH9.0的1MTris-Hcl按照1:10(V/V)进行中和;
(6)储存柱子,洗脱完以后用双蒸水洗涤10个以上柱体积,然后用20%的乙醇冲洗,最后将柱子内充满20%的乙醇并封存。
中和效价的检测:本发明所有的中和效价都是通过以下方法检测:提前一天用PK-15细胞铺板96孔板,第二天等到细胞长到60-70%时弃掉培养基,用无菌PBS缓冲液洗三遍后,加入维持液备用;把待检样品(血清或者单抗)在56℃水浴锅放置30min以灭活补体,然后12000rpm,15min,取50μL上清用维持液在96孔板中做倍比稀释,一般8个梯度,一个96孔板检测十个样品,留两排:一排作为阳性对照,另一排作为阴性对照,然后加入50μL(200TCID
对13株单克隆抗体上清的中和试验结果显示,4株单抗上清(3D3、8B9、7B6、12F4)具有中和活性,9株单抗上清不具有中和活性(图4)。单抗上清的中和效价最高可达到2
实施例6 7B6和12F4单克隆抗体IC
将纯化的腹水,用Nanodrop按照IgG的测量方法进行定量,然后按照以下方法测定7B6和12F4单克隆抗体的IC
(1)提前一天用PK-15铺96孔板,当细胞生长到60-70%时,倒掉上清,用高压灭菌的PBS缓冲液洗三遍后添加维持液备用;
(2)将单抗从100μg/mL开始倍比稀释,然后50μL/孔,8个孔/梯度,加入96孔板,然后在96孔板中加入50μL200TCID
(3)把在37℃温育过的抗体病毒混合物加入铺有PK-15细胞的96孔板中,每个96孔板检测11个梯度,最后一排4个孔只加维持液作为阴性对照,另外4个孔只加200TCID
中和实验表明单克隆抗体7B6和12F4,在有补体和无补体参与时都可以有效中和病毒,证明两株单抗的中和活性都是非补体依赖型的。无补体参与时7B6和12F4的IC
其中分泌单克隆抗体7B6的杂交瘤细胞株7B6,已保藏于中国典型培养物保藏中心,保藏编号为CCTCCNO:C202192,保藏地址为武汉大学,保藏时间为2021年5月27日。
实施例7 PRV-HeNLH/2017毒株LD
为了准确衡量在模式动物小鼠上致死剂量,为后续的免疫攻毒保护试验提供参考,我们首先测定了PRV-HeNLH/2017毒株的LD
表2 PRV-HeNLH/2017不同剂量攻毒后7天的死亡情况
使用Karber法,通过公式:lgLD
lgLD
PRV-HeNLH/2017的LD
实施例8 7B6单克隆抗体预防PRV致死性剂量的攻毒实验
为了进一步检测7B6在体内的抗病毒效果,我们在小鼠模型上对PRV病毒进行了攻毒保护实验。如图6所示:7B6可以为PRV的致死性攻毒,提供保护作用,且呈现剂量依赖效应。7B6在低剂量(2.5mg/kg)时有62.5%的保护作用,且随着剂量的增加保护作用增强。剂量达到15mg/kg后,7B6提供100%的保护。正常小鼠IgG免疫的,无论免疫剂量的高低均未起到保护作用,小鼠在攻毒后体重快速降低,到第五天几乎全部死亡(图6A和B)。每组随机取四只小鼠测定其脑和肺的病毒含量,Q-PCR的结果表明:与对照比较,7B6接种剂量为2.5mg/kg和5mg/kg的小鼠,脑和肺的病毒载量大约减少了3倍,而当剂量为15mg/kg时,在脑和肺组织中未检到病毒(图6C)。以上结果说明,7B6作为预防性抗体,可以在小鼠体内保护PRV的致死性感染。
实施例9 7B6单克隆抗体在PRV致死性剂量攻毒实验后的治疗效果
为了进一步检测7B6在攻毒之后是否具有中和效果,在小鼠攻毒之后的6h、24h和48h分别通过腹腔注射15mg/kg剂量的7B6。结果显示经过三次不同时间点接种7B6的小鼠,全部存活。相反,所有用正常小鼠IgG注射的小鼠全部死亡(图7B)。此外,7B6处理的小鼠在攻毒后7天,没有观察到明显的体重减轻,相反体重略有增加,且在小鼠的肺和脑组织中未检测明显的病毒拷贝(图7A和图7C)。以上结果表明,PRV致死性剂量感染小鼠后,7B6作为治疗性抗体,可以快速发挥中和作用,保护小鼠免受病毒的感染。
实施例10 7B6单克隆抗体对PRV吸附Vero细胞的抑制作用
附着到易感细胞上是PRV入侵的第一步,同样是必不可少的一步。因此,阻断病毒吸附是单抗发挥中和活性的重要途径之一,本研究采用WesternBlot,Q-PCR和流式三种方法来验证7B6是否可以抑制PRV对Vero和BHK-21细胞的吸附作用。图8A显示,1μg和10μg的7B6可以有效抑制PRV病毒的吸附,而0.1μg7B6和各种不同浓度的正常小鼠IgG不能阻断PRV对于BHK-21细胞和Vero细胞的吸附。同样如图8B所示,绝对定量PCR的结果与WesternBlot的结果一致,表明1μg和10μg的7B6可以有效抑制PRV病毒对于两种细胞的吸附。为了进一步证明7B6可以阻断PRV病毒的吸附,我们采用流式细胞仪的方法进行进一步验证。结果显示:7B6处理的病毒的荧光相对于正常小鼠IgG的荧光峰值明显左移,这说明7B6可以有效抑制PRV病毒对于两种细胞的吸附(图8C)。
实施例11 PRV-HeNLH/2017毒株的噬斑计数
病毒的计数方法有很多种,噬斑计数(pfu/mL)对于能形成噬斑的病毒是最常用的技术方法,为了后续鉴定7B6的中和作用发生附着前还是附着后,我们首先对测定了PRV-HeNLH/2017的噬斑单位,方法如下:
(1)提前一天用Vero细胞铺板12孔板,等到第二天细胞长至95%左右即形成单层细胞时,倒净培养基,无菌PBS洗3次后添加血清体积含量为2%的维持液放入37℃培养箱中备用;
(2)将PRV-HeNLH/2017用维持液做10倍倍比梯度稀释(10
(3)甩净12孔板的维持液,加入500μL/孔的各个稀释梯度的PRV-HeNLH/2017毒株,每个梯度三个重复,留三个孔加入500μL/孔的维持液作为对照,37℃培养箱孵育1h;
(4)孵育结束后,用无菌PBS洗三遍,洗掉未吸附的病毒,然后将无菌的2%低熔点琼脂糖(提前85℃融化),等体积加入2X的DMEM(含4%体积含量的血清)中,混匀后,在感觉不到明显烫手的时,迅速加入,12孔板,500μL/孔,然后在生物安全柜的通风口吹至完全凝固后,放入37℃培养箱中,倒置培养48h;
(5)培养结束之后,在12孔板中加入,单蒸水,室温放置5min,然后甩掉单蒸水的同时甩掉孔中的琼脂糖凝胶,添加体积含量为4%的多聚甲醛,反应15min后,弃掉并用PBS洗3次,然后添加结晶紫显色10min后,弃掉结晶紫,用单蒸水清洗三遍后,肉眼可见明显的白色噬斑,计数并分析。该实验重复三次,统计分析得到PRV-HeNLH/2017毒株的噬斑单位。
实施例12 7B6单克隆抗体在病毒吸附前后对PRV感染Vero细胞的中和作用
为了进一步验证7B6可以在PRV病毒吸附之前发挥中和作用,同时验证在PRV病毒吸附到细胞上之后,抗体能否发挥中和作用,采用噬斑中和的方法进一步确认。我们对比了7B6在Vero细胞上对于PRV病毒吸附前和吸附后的中和效果。结果显示,在PRV病毒吸附前和吸附后阶段,7B6浓度为100μg/mL时,PRV感染几乎完全被抑制(图9A和B)。为了进一步确认7B6的中和效果,我们检测了7B6在浓度为0.1、1和10μg/mL时的中和作用。结果表明,7B6浓度为1μg/mL时,在吸附前阶段可阻断80%的PRV感染,而在吸附后阶段仅抑制40%的PRV感染(图9C和D)。同时阴性对照,DMEM组和正常小鼠IgG在病毒孵育前后均无中和能力。以上结果表明:7B6在PRV吸附细胞前和后都能中和病毒,并且具有剂量依赖效应。
- 抗猪伪狂犬病毒感染的中和性单克隆抗体及应用
- 具有中和活性的抗尼帕病毒单克隆抗体及应用
