表达趋化因子CXCL10、CXCL13、CCL19的免疫细胞及其制备方法与应用
文献发布时间:2023-06-19 19:21:53
技术领域
本发明属于医药领域,具体涉及表达趋化因子的免疫细胞及其制备方法,以及其在制备用于提高过继性免疫治疗功效药物中的应用。
背景技术
肿瘤通过形成抑制性微环境抑制免疫细胞的功能,这是肿瘤免疫逃逸的重要原因之一,严重影响免疫疗法的反应率。改善肿瘤免疫微环境,增加肿瘤浸润T细胞有利于提高免疫治疗的效果。肿瘤微环境是肿瘤细胞和宿主免疫系统相互作用的主要场所,不同的免疫细胞亚群可以通过趋化因子和趋化因子受体之间的相互作用被招募到肿瘤微环境中,从而影响着肿瘤进展和免疫治疗结果。因此,选择性的靶向趋化因子及其受体信号可以作为提高免疫疗法疗效的策略。
趋化因子是一种微小的分泌蛋白,以介导免疫细胞运输和淋巴组织发育而闻名,根据其蛋白质序列中前两个半胱氨酸残基的位置,可进一步细分为四个主要类别:CC-趋化因子、CXC-趋化因子、C-趋化因子和CX3C-趋化因子。在肿瘤微环境中,肿瘤细胞和其他细胞,包括免疫细胞和基质细胞都可以表达趋化因子。在特定趋化因子的作用下,不同的免疫细胞亚群会迁移到肿瘤微环境中,通过直接和间接影响肿瘤免疫,影响肿瘤进展、治疗效果和患者预后。CD8+T细胞、表达IFN-γ的Th1细胞和NK细胞等其他免疫细胞通过趋化因子-趋化因子受体信号通路被募集到肿瘤微环境中,如CXCR3及其配体CXCL9和CXCL10在驱动Th1细胞、CD8+T细胞和NK细胞进入肿瘤微环境中起着关键作用。此外,CXCL9和CXCL10水平的增加与肿瘤浸润CD8+T细胞数量增加呈正相关,从而降低卵巢癌和结肠癌患者肿瘤转移水平,提高生存率。而CCL20/CCR6信号通路则能促进Th17细胞的募集。抗原呈递细胞,如巨噬细胞和树突状细胞也可被招募到肿瘤微环境中,这些细胞可以激活和局部扩大免疫效应细胞,从而促进肿瘤消退。
然而,目前仍不清楚何种趋化因子或趋化因子组合适合用于抗肿瘤免疫治疗。如何找到合适的趋化因子,并通过不同趋化因子组合来提高过继性免疫治疗,是目前急需解决的问题。
发明内容
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提供了一种表达趋化因子CXCL10、CXCL13、CCL19的免疫细胞及其制备方法和应用。
本发明通过筛选具有抑制肿瘤生长作用的趋化因子,将其基因编码序列构建到趋化因子过表达质粒中,再将趋化因子过表达质粒进行病毒包装,感染免疫细胞,将该免疫细胞应用于过继性免疫治疗(包括CAR-T(Chimeric Antigen Receptor T cells,嵌合抗原受体T细胞)治疗、TCR-T(T cell receptor-engineered T cells,T细胞受体工程化T细胞)治疗、TIL细胞(Tumor Infiltrating Lymphocytes,肿瘤浸润淋巴细胞)治疗等)中,发现表达趋化因子CXCL10、CXCL13、CCL19的免疫细胞在过继性免疫治疗中可明显提高对肿瘤的免疫治疗功效,并对肿瘤的生长具有良好的抑制效果,从而为利用趋化因子进行肿瘤相关的免疫治疗提供了新的思路和治疗手段。
本发明的第一方面,提供了一种免疫细胞,该免疫细胞表达至少一种趋化因子。优选地,所述趋化因子包括以下任意一种或者多种:CXCL10、CXCL13、CCL19。
根据本发明实施例,所述免疫细胞表达趋化因子CXCL10、CXCL13、CCL19中的其中一种,或者同时表达趋化因子CXCL10、CXCL13、CCL19中的任意两种,或者同时表达趋化因子CXCL10、CXCL13、CCL19中的全部三种。
根据本发明具体实施例,所述免疫细胞表达趋化因子CXCL10。根据本发明具体实施例,所述免疫细胞表达趋化因子CXCL13。根据本发明具体实施例,所述免疫细胞表达趋化因子CCL19。根据本发明具体实施例,所述免疫细胞表达趋化因子CXCL10与CXCL13。根据本发明具体实施例,所述免疫细胞表达趋化因子CXCL10与CCL19。根据本发明具体实施例,所述免疫细胞表达趋化因子CXCL13与CCL19。根据本发明具体实施例,所述免疫细胞表达趋化因子CXCL10、CXCL13与CCL19。
根据本发明实施例,所述免疫细胞包括但不限于嵌合抗原受体T细胞(CAR-T细胞)、T细胞受体工程化T细胞(TCR-T细胞)、肿瘤浸润淋巴细胞(TIL细胞)、外周血单个核细胞(PBMC细胞)、NK细胞、NKT细胞、γδT细胞、巨噬细胞、树突状细胞、B细胞。
根据本发明实施例,所述免疫细胞包含趋化因子过表达质粒。根据本发明具体实施例,通过将趋化因子过表达质粒进行病毒包装,然后使用该病毒感染免疫细胞,使免疫细胞包含趋化因子过表达质粒。优选地,所述病毒包括逆转录病毒和慢病毒。
根据本发明实施例,所述趋化因子过表达质粒包含编码趋化因子的基因序列。优选地,所述趋化因子过表达质粒包含编码CXCL10、CXCL13和CCL19中至少一种趋化因子的基因序列。
根据本发明具体实施例,编码CXCL10趋化因子的基因序列为:(i)SEQ ID NO.1的核苷酸序列或与SEQ ID NO.1的核苷酸序列具有至少80%、85%、90%、95%、99%序列同一性的核苷酸序列;或者(ii)SEQ ID NO.2的核苷酸序列或与SEQ ID NO.2的核苷酸序列具有至少80%、85%、90%、95%、99%序列同一性的核苷酸序列。
人类趋化因子CXCL10的基因编码序列(SEQ ID NO.1):
ATGAATCAAACTGCCATTCTGATTTGCTGCCTTATCTTTCTGACTCTAAGTGGCATT CAAGGAGTACCTCTCTCTAGAACTGTACGCTGTACCTGCATCAGCATTAGTAATCAACCTGTTAATCCAAGGTCTTTAGAAAAACTTGAAATTATTCCTGCAAGCCAATTTTGTCCACGTGTTGAGATCATTGCTACAATGAAAAAGAAGGGTGAGAAGAGATGTCTGAATCCAGAATCGAAGGCCATCAAGAATTTACTGAAAGCAGTTAGCAAGGAAAGGTCTAAAAGATCTCCTTAA。
小鼠趋化因子CXCL10的基因编码序列(SEQ ID NO.2):
ATGAACCCAAGTGCTGCCGTCATTTTCTGCCTCATCCTGCTGGGTCTGAGTGGGACTCAAGGGATCCCTCTCGCAAGGACGGTCCGCTGCAACTGCATCCATATCGATGACGGGCCAGTGAGAATGAGGGCCATAGGGAAGCTTGAAATCATCCCTGCGAGCCTATCCTGCCCACGTGTTGAGATCATTGCCACGATGAAAAAGAATGATGAGCAGAGATGTCTGAATCCGGAATCTAAGACCATCAAGAATTTAATGAAAGCGTTTAGCCAAAAAAGGTCTAAAAGGGCTCCTTAA。
根据本发明具体实施例,编码CXCL13趋化因子的基因序列为:(i)SEQ ID NO.3的核苷酸序列或与SEQ ID NO.3的核苷酸序列具有至少80%、85%、90%、95%、99%序列同一性的核苷酸序列;或者(ii)SEQ ID NO.4的核苷酸序列或与SEQ ID NO.4的核苷酸序列具有至少80%、85%、90%、95%、99%序列同一性的核苷酸序列。
人类趋化因子CXCL13的基因编码序列(SEQ ID NO.3):
ATGAAGTTCATCTCGACATCTCTGCTTCTCATGCTGCTGGTCAGCAGCCTCTCTCCAGTCCAAGGTGTTCTGGAGGTCTATTACACAAGCTTGAGGTGTAGATGTGTCCAAGAGAGCTCAGTCTTTATCCCTAGACGCTTCATTGATCGAATTCAAATCTTGCCCCGTGGGAATGGTTGTCCAAGAAAAGAAATCATAGTCTGGAAGAAGAACAAGTCAATTGTGTGTGTGGACCCTCAAGCTGAATGGATACAAAGAATGATGGAAGTATTGAGAAAAAGAAGTTCTTCAACTCTACCAGTTCCAGTGTTTAAGAGAAAGATTCCCTGA。
小鼠趋化因子CXCL13的基因编码序列(SEQ ID NO.4):
ATGAGGCTCAGCACAGCAACGCTGCTTCTCCTCCTGGCCAGCTGCCTCTCTCCAGGCCACGGTATTCTGGAAGCCCATTACACAAACTTAAAATGTAGGTGTTCTGGAGTGATTTCAACTGTTGTCGGTCTAAACATCATAGATCGGATTCAAGTTACGCCCCCTGGGAATGGCTGCCCCAAAACTGAAGTTGTGATCTGGACCAAGATGAAGAAAGTTATATGTGTGAATCCTCGTGCCAAATGGTTACAAAGATTATTAAGACATGTCCAAAGCAAAAGTCTGTCTTCAACTCCCCAAGCTCCAGTGAGTAAGAGAAGAGCTGCCTGA。
根据本发明具体实施例,编码CCL19趋化因子的基因序列为:(i)SEQ ID NO.5的核苷酸序列或与SEQ ID NO.5的核苷酸序列具有至少80%、85%、90%、95%、99%序列同一性的核苷酸序列;或者(ii)SEQ ID NO.6的核苷酸序列或与SEQ ID NO.6的核苷酸序列具有至少80%、85%、90%、95%、99%序列同一性的核苷酸序列。
人类趋化因子CCL19的基因编码序列(SEQ ID NO.5):
ATGGCCCTGCTACTGGCCCTCAGCCTGCTGGTTCTCTGGACTTCCCCAGCCCCAACTCTGAGTGGCACCAATGATGCTGAAGACTGCTGCCTGTCTGTGACCCAGAAACCCATCCCTGGGTACATCGTGAGGAACTTCCACTACCTTCTCATCAAGGATGGCTGCAGGGTGCCTGCTGTAGTGTTCACCACACTGAGGGGCCGCCAGCTCTGTGCACCCCCAGACCAGCCCTGGGTAGAACGCATCATCCAGAGACTGCAGAGGACCTCAGCCAAGATGAAGCGCCGCAGCAGTTAA。
小鼠趋化因子CCL19的基因编码序列(SEQ ID NO.6):
ATGGCCCCCCGTGTGACCCCACTCCTGGCCTTCAGCCTGCTGGTTCTCTGGACCTTCCCAGCCCCAACTCTGGGGGGTGCTAATGATGCGGAAGACTGCTGCCTGTCTGTGACCCAGCGCCCCATCCCTGGGAACATCGTGAAAGCCTTCCGCTACCTTCTTAATGAAGATGGCTGCAGGGTGCCTGCTGTTGTGTTCACCACACTAAGGGGCTATCAGCTCTGTGCACCTCCAGACCAGCCCTGGGTGGATCGCATCATCCGAAGACTGAAGAAGTCTTCTGCCAAGAACAAAGGCAACAGCACCAGAAGGAGCCCTGTGTCTTGA。
根据本发明实施例,通过将编码趋化因子的基因序列插入到载体中构建趋化因子过表达质粒。
优选地,所述载体包括逆转录病毒载体、慢病毒载体。所述载体可以选用本领域普通技术人员已知的逆转录病毒载体或慢病毒载体。根据本发明具体实施例,所述逆转录病毒载体可以选用购自addgene公司的逆转录病毒载体pMSCV-IRES-GFP-mThy1.1(货号:52107)。根据本发明另一具体实施例,所述慢病毒载体可以选用购自上海柯雷生物科技有限公司的慢病毒载体pHAGE-CMV-MCS-IRES-ZsGreen1(货号:KL-ZL3147)。
本发明的第二方面,提供了本发明第一方面所述的免疫细胞的制备方法,包括以下步骤:构建趋化因子过表达质粒,将该趋化因子过表达质粒进行病毒包装,用该病毒感染免疫细胞。
根据本发明实施例,所述免疫细胞包括但不限于嵌合抗原受体T细胞(CAR-T细胞)、T细胞受体工程化T细胞(TCR-T细胞)、肿瘤浸润淋巴细胞(TIL细胞)、外周血单个核细胞(PBMC细胞)、NK细胞、NKT细胞、γδT细胞、巨噬细胞、树突状细胞、B细胞。
根据本发明实施例,所述病毒包括逆转录病毒和慢病毒。
根据本发明实施例,所述构建趋化因子过表达质粒包括以下步骤:通过PCR方法扩增出编码趋化因子的基因序列,再通过酶切位点插入到病毒载体中,构建趋化因子过表达质粒。
优选地,所述病毒载体包括逆转录病毒载体、慢病毒载体。所述载体可以选用本领域普通技术人员已知的逆转录病毒载体或慢病毒载体。
根据本发明具体实施例,当感染小鼠细胞时,选用逆转录病毒进行感染,选用逆转录病毒载体构建趋化因子过表达质粒。根据本发明另一具体实施例,当感染人类细胞时,选用慢病毒进行感染,选用慢病毒载体构建趋化因子过表达质粒。
优选地,所述酶切位点为BamH I+Mlu I。
优选地,所述编码趋化因子的基因序列包括编码CXCL10、CXCL13和CCL19中至少一种趋化因子的基因序列。根据本发明具体实施例,所述编码趋化因子的基因序列包括编码CXCL10、CXCL13和CCL19中至少两种趋化因子的基因序列,不同趋化因子的基因序列之间可以采用本领域技术人员已知的方法进行连接,使包含趋化因子过表达质粒的免疫细胞可同时表达CXCL10、CXCL13和CCL19中至少两种趋化因子。根据本发明具体实施例,所述编码趋化因子的基因序列包括编码CXCL10、CXCL13和CCL19三种趋化因子的基因序列。根据本发明具体实施例,不同趋化因子的基因序列之间可以采用2A肽进行连接。
本发明的第三方面,提供了本发明第一方面所述的免疫细胞在制备增强抗肿瘤免疫反应同时抑制肿瘤生长药物中的应用。
根据本发明实施例,所述肿瘤包括良性肿瘤和恶性肿瘤,包括但不限于肠癌、肺癌、黑色素瘤、胃癌、鳞状细胞癌、纤维瘤、胰腺癌、脂肪瘤、血管内皮瘤、骨肉瘤、血管球瘤、骨瘤、巨细胞瘤、脑膜瘤、淋巴瘤、甲状腺癌、肝癌、卵巢癌、头颈癌、乳腺癌、宫颈癌、肾癌、膀胱癌、前列腺癌、食管癌、卵巢癌、和胆管癌。优选地,所述肿瘤选自肠癌、肺癌、黑色素瘤中的至少一种。
根据本发明实施例,所述免疫细胞表达以下任意一种或者多种趋化因子:CXCL10、CXCL13、CCL19。
根据本发明实施例,所述免疫细胞包括但不限于CAR-T细胞、TCR-T细胞、TIL细胞、PBMC细胞、NK细胞、NKT细胞、γδT细胞、巨噬细胞、树突状细胞、B细胞。
根据本发明实施例,提供了所述免疫细胞在制备用于提高过继性免疫治疗肿瘤功效药物中的应用。
根据本发明具体实施例,提供了所述免疫细胞在制备用于提高CAR-T治疗肿瘤功效药物中的应用。
根据本发明具体实施例,提供了所述免疫细胞在制备用于提高TCR-T治疗肿瘤功效药物中的应用。
根据本发明具体实施例,提供了所述免疫细胞在制备用于提高TIL治疗肿瘤功效药物中的应用。
本发明的第四方面,提供了趋化因子在制备增强抗肿瘤免疫反应同时抑制肿瘤生长药物中的应用。
根据本发明实施例,所述肿瘤包括良性肿瘤和恶性肿瘤,包括但不限于肠癌、肺癌、黑色素瘤、胃癌、鳞状细胞癌、纤维瘤、胰腺癌、脂肪瘤、血管内皮瘤、骨肉瘤、血管球瘤、骨瘤、巨细胞瘤、脑膜瘤、淋巴瘤、甲状腺癌、肝癌、卵巢癌、头颈癌、乳腺癌、宫颈癌、肾癌、膀胱癌、前列腺癌、食管癌、卵巢癌、和胆管癌。优选地,所述肿瘤选自肠癌、肺癌、黑色素瘤中的至少一种。
根据本发明实施例,所述趋化因子包括但不限于CXCL10、CXCL13、CCL19中的任意一种、两种或者三种。
根据本发明实施例,提供了所述趋化因子在制备用于提高过继性免疫治疗肿瘤功效药物中的应用。
根据本发明具体实施例,提供了所述趋化因子在制备用于提高CAR-T治疗肿瘤功效药物中的应用。
根据本发明具体实施例,提供了所述趋化因子在制备用于提高TCR-T治疗肿瘤功效药物中的应用。
根据本发明具体实施例,提供了所述趋化因子在制备用于提高TIL治疗肿瘤功效药物中的应用。
本发明的第五方面,还提供了一种用于促进抗肿瘤免疫治疗功效的药物组合物,其包括表达趋化因子的免疫细胞。
根据本发明实施例,所述肿瘤包括良性肿瘤和恶性肿瘤,包括但不限于肠癌、肺癌、黑色素瘤、胃癌、鳞状细胞癌、纤维瘤、胰腺癌、脂肪瘤、血管内皮瘤、骨肉瘤、血管球瘤、骨瘤、巨细胞瘤、脑膜瘤、淋巴瘤、甲状腺癌、肝癌、卵巢癌、头颈癌、乳腺癌、宫颈癌、肾癌、膀胱癌、前列腺癌、食管癌、卵巢癌、和胆管癌。优选地,所述肿瘤选自肠癌、肺癌、黑色素瘤中的至少一种。
根据本发明实施例,所述趋化因子包括但不限于CXCL10、CXCL13、CCL19中的任意一种、两种或者三种。
优选地,所述药物组合物还包括药学上可接受的辅料。优选地,该辅料包括药学上可接受的稀释剂、赋形剂、载体、粘合剂、润滑剂、悬浮剂、包衣剂、增溶剂。该药物组合物可以是多种形式,包括分散体、混悬剂。在本发明的一些具体实施例中,该药物组合物为可注射的混悬剂。
根据本发明实施例,所述药物组合物应用于免疫治疗方法,所述免疫治疗方法包括但不限于嵌合抗原受体T细胞治疗(CAR-T)、T细胞受体工程化T细胞治疗(TCR-T)、肿瘤浸润淋巴细胞治疗(TIL)的方法。
本发明的有益效果是:
(1)本发明首次发现表达趋化因子CXCL10、CXCL13、CCL19的免疫细胞对肿瘤的生长具有显著的抑制效果,可明显减小肿瘤体积;而且能有效增强抗肿瘤免疫反应,促进过继性免疫治疗肿瘤的功效。
(2)本发明建立以趋化因子CXCL10、CXCL13、CCL19作为靶点的免疫治疗方法,发现通过将不同组合的趋化因子构建到免疫细胞中,并将该免疫细胞应用于抗肿瘤免疫治疗,可提高现有过继性免疫治疗的疗效和反应率,从而有助于开发肿瘤治疗的新方法、新手段。
附图说明
结合以下附图对实施例进行描述,将使本发明的上述和/或附加的方面和优点变得明显和容易理解,其中:
图1示出了不同趋化因子载体包装逆转录病毒感染OT-I T细胞。
图2示出了B16-OVA/OT-I模型筛选具有抑制肿瘤生长的趋化因子。图2中,各小图的横坐标为肿瘤接种后的天数,纵坐标为肿瘤体积(mm
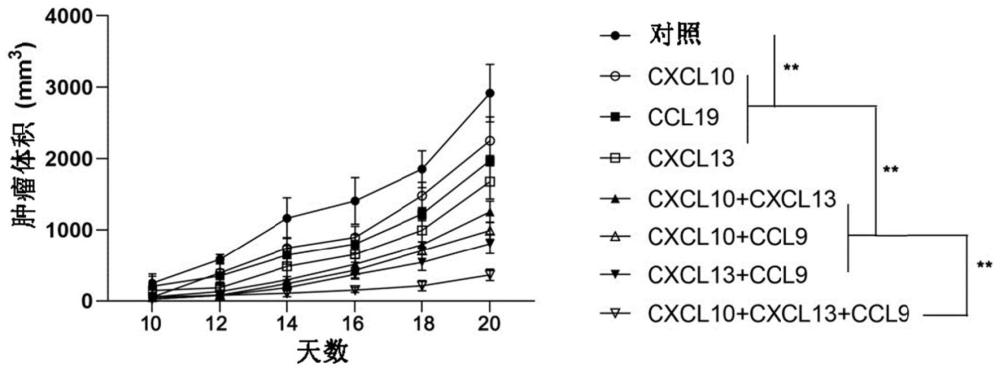
图3示出了表达趋化因子CXCL10、CXCL13以及CCL19不同组合的免疫细胞对CAR-T治疗效果的影响。**p<0.01。
图4示出了表达趋化因子CXCL10、CXCL13以及CCL19不同组合的免疫细胞对TCR-T治疗效果的影响。**p<0.01。
图5示出了表达趋化因子CXCL10、CXCL13以及CCL19不同组合的免疫细胞对TIL治疗效果的影响。**p<0.01。
具体实施方式
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明,而非用于限制本发明的范围。
在本发明中,首先研究趋化因子对T细胞功能的影响。利用B16-OVA/OT-I动物模型,在小鼠体内筛选能够促进T细胞抗肿瘤免疫反应的趋化因子CXCL10、CXCL13、CCL19。然后将筛选出的趋化因子CXCL10、CXCL13、CCL19,通过两两组合或者三个组合探索不同组合方式对肿瘤生长的影响。最后,将筛选出的趋化因子CXCL10、CXCL13、CCL19构建到过继性免疫治疗CAR-T(EGFR VIII)和TCR-T(NYESO-1)载体上感染免疫细胞,探索不同组合方式对过继性免疫治疗效果的影响。同时将筛选出的趋化因子CXCL10、CXCL13以及CCL19构建到慢病毒载体上感染TIL细胞,探索对TIL治疗效果的影响。通过一系列的实验,明确表达趋化因子CXCL10、CXCL13以及CCL19不同组合的免疫细胞在过继性免疫治疗中的作用,建立了高效的免疫治疗新方法。
本发明围绕趋化因子CXCL10、CXCL13以及CCL19作为增强抗肿瘤免疫反应的重要靶标作用所展开。本发明的成功实施,将有望建立一个以趋化因子CXCL10、CXCL13以及CCL19作为靶点的免疫治疗新方法,并通过构建表达不同组合趋化因子的免疫细胞,提高现有过继性免疫治疗的疗效和反应率。
实施例1:筛选具有抑制肿瘤生长作用的趋化因子
1)趋化因子载体包装逆转录病毒感染OT-I T细胞
如图1所示,通过PCR方法(采用PCR试剂盒Q5 High-Fidelity DNA Polymerase(NEB,货号M0491S))扩增出趋化因子的基因编码序列(CDS序列),再通过酶切位点(BamH I+Mlu I;BamH I:购自NEB,货号R0136V;Mlu I:购自NEB,货号R0198V)插入到逆转录病毒载体(pMSCV-IRES-GFP-mThy1.1,购自addgene公司,货号52107)中,构建趋化因子过表达质粒。用构建好的趋化因子质粒进行逆转录病毒包装并感染OT-I小鼠T细胞,用流式分析仪检测细胞感染的阳性率,所有表达趋化因子的阳性率均大于95%(对细胞进行染色,流式分析仪检测mThy1.1的表达),提示趋化因子成功感染OT-I T细胞,可以用于后续实验。
用于PCR方法中的各引物名称与序列如下:
人类CXCL10:
F:AAAAAAGGATCCATGAATCAAACTGCCATTC(SEQ ID NO.7);
R:AAAAAAACGCGTAGGAGATCTTTTAGACCTTTCC(SEQ ID NO.8);
小鼠CXCL10:
F:AAAAAAGGATCCATGAACCCAAGTGCTG(SEQ ID NO.9);
R:AAAAAAACGCGTAGGAGCCCTTTTAGACCTTTTTTG(SEQ ID NO.10);
人类CXCL13:
F:AAAAAAGGATCCATGAAGTTCATCTCG(SEQ ID NO.11);
R:AAAAAAACGCGTGGGAATCTTTCTCTTAAAC(SEQ ID NO.12);
小鼠CXCL13:
F:AAAAAAGGATCCATGAGGCTCAGCACAG(SEQ ID NO.13);
R:AAAAAAACGCGTGGCAGCTCTTCTCTTACTCACTG(SEQ ID NO.14);
人类CCL19:
F:AAAAAAGGATCCATGGCCCTGCTACTGGC(SEQ ID NO.15);
R:AAAAAAACGCGTGGCAGCTCTTCTCTTACTCACTG(SEQ ID NO.16);
小鼠CCL19:
F:AAAAAAGGATCCATGGCCCCCCGTGTG(SEQ ID NO.17);
R:AAAAAAACGCGTAGACACAGGGCTCCTTCTGGTG(SEQ ID NO.18)。
构建表达趋化因子的OT-I T细胞的方法包括以下步骤:使用基因重组的方法将编码小鼠CXCL10(SEQ ID NO.2)、小鼠CXCL13(SEQ ID NO.4)、小鼠CCL19(SEQ ID NO.6)的基因序列分别构建到逆转录病毒载体pMSCV-IRES-GFP-mThy1.1上;采用293T细胞包装逆转录病毒:将构建好的逆转录病毒质粒以及包装质粒pCL-Eco转染293T细胞(PEI转染),48小时后收集逆转录病毒。小鼠OT-I T细胞经CD3-28抗体(5ng/ml)激活48小时,加入逆转录病毒,2000rpm离心1小时后,去除上清,添加正常T细胞培养基,继续培养48小时,取部分细胞流式染色检测mThy1.1的表达,确定阳性细胞的比例,分选阳性细胞,即为表达趋化因子的OT-IT细胞。
2)B16-OVA/OT-I模型筛选具有抑制肿瘤生长作用的趋化因子
如图2所示,将B16-OVA(小鼠黑色素瘤细胞-鸡OVA基因修饰)荷瘤小鼠随机分为两组,通过尾静脉注射(1000,000个细胞/100μL/只小鼠)成功感染趋化因子的OT-I T细胞(表达趋化因子的OT-I T细胞),监测肿瘤生长情况,每隔一天测量一次,直至肿瘤直径达到约2cm,绘制生长曲线。发现注射表达CXCL10免疫细胞组别、注射表达CXCL13免疫细胞组别、注射表达CCL19免疫细胞组别的小鼠肿瘤体积偏小,提示表达这3种趋化因子的免疫细胞对肿瘤的生长具有良好的抑制效果,后续将探索表达这3种趋化因子不同组合的免疫细胞对肿瘤生长的影响。
实施例2:表达趋化因子CXCL10、CXCL13以及CCL19不同组合的免疫细胞对CAR-T治疗效果的影响
如图3所示,构建A549(肺癌人类肺泡基底上皮细胞)-EGFR VIII稳定表达细胞系,皮下接种到NSG小鼠上(200,000个细胞/100μL/只小鼠),随机分为8组,通过尾静脉注射成功感染趋化因子的EGFR VIII CAR-T细胞(1000,000个细胞/100μL/只小鼠):对照组(没有感染趋化因子的EGFR VIII CAR-T细胞)、CXCL10组、CXCL13组、CCL19组、CXCL10+CXCL13组、CXCL10+CCL19组、CXCL13+CCL19组以及CXCL10+CXCL13+CCL19组,监测肿瘤生长情况,每隔天测量一次,直至对照组中任意一只小鼠的肿瘤直径达到约2cm,实验结束,绘制肿瘤生长曲线(参见“无胸腺(裸)小鼠皮下肿瘤大小的测定”;Tomayko,M.M.;Reynolds,C.P.,Determination of subcutaneous tumor size in athymic(nude)mice.CancerChemother Pharmacol 1989,24,(3),148-54.)。对比不同组别的肿瘤体积,发现两两联合组的治疗效果优于单独施用组,三种趋化因子联合组的治疗效果最佳。
构建表达趋化因子的EGFR VIII CAR-T细胞(成功感染趋化因子的EGFR VIIICAR-T细胞)的方法与实施例1构建表达趋化因子的OT-I T细胞的方法类似,不同之处在于:将编码趋化因子的基因序列构建到慢病毒载体(pHAGE-CMV-MCS-IRES-ZsGreen1,购自上海柯雷生物科技有限公司,货号KL-ZL3147)上,并进行慢病毒包装和感染EGFR VIII CAR-T细胞。其中,当制备表达趋化因子两两组合的免疫细胞时,将两种不同趋化因子的序列用2A肽连接,插入同一载体上,其余步骤与制备表达单一趋化因子免疫细胞的方法相同。类似地,当制备表达三种趋化因子组合的免疫细胞时,将三种不同趋化因子的序列用2A肽连接,插入同一载体上,其余步骤与制备表达单一趋化因子免疫细胞的方法相同。
实施例3:表达趋化因子CXCL10、CXCL13以及CCL19不同组合的免疫细胞对TCR-T治疗效果的影响
如图4所示,构建A549-NYESO-1稳定表达细胞系,皮下接种到NSG小鼠上,随机分为8组,通过尾静脉注射成功感染趋化因子的NYESO-1TCR-T细胞(1000,000个细胞/100μL/只小鼠):对照组(没有感染趋化因子的NYESO-1TCR-T细胞)、CXCL10组、CXCL13组、CCL19组、CXCL10+CXCL13组、CXCL10+CCL19组、CXCL13+CCL19组以及CXCL10+CXCL13+CCL19组,监测肿瘤生长情况,每隔一天测量一次,直至对照组中任意一只小鼠的肿瘤直径达到约2cm,实验结束,绘制生长曲线。对比不同组别的肿瘤体积,发现两两联合组的治疗效果优于单独施用组,三种趋化因子联合组的治疗效果最佳。
构建表达趋化因子的NYESO-1TCR-T细胞(成功感染趋化因子的NYESO-1TCR-T细胞)的方法与实施例2构建表达趋化因子的EGFR VIII CAR-T细胞的方法类似,不同之处在于:感染的细胞为NYESO-1TCR-T细胞。
实施例4:表达趋化因子CXCL10、CXCL13以及CCL19不同组合的免疫细胞对TIL治疗效果的影响
如图5所示,将A549细胞皮下接种到NSG小鼠,小鼠随机分为8组,通过尾静脉注射成功感染趋化因子的TIL细胞(1000,000个细胞/100μL/只小鼠):对照组(没有感染趋化因子的TIL细胞)、CXCL10组、CXCL13组、CCL19组、CXCL10+CXCL13组、CXCL10+CCL19组、CXCL13+CCL19组以及CXCL10+CXCL13+CCL19组,监测肿瘤生长情况,每隔一天测量一次,直至对照组中任意一只小鼠的肿瘤直径达到约2cm,实验结束,绘制生长曲线。对比不同组别的肿瘤体积,发现两两联合组的治疗效果优于单独施用组,三种趋化因子联合组的治疗效果最佳。
构建表达趋化因子的TIL细胞(成功感染趋化因子的TIL细胞)的方法与实施例2构建表达趋化因子的EGFR VIII CAR-T细胞的方法类似,不同之处在于:感染的细胞为TIL细胞。
以上所使用的实验材料和试剂,若无特别说明,均为常规可从商业途径所获得的耗材和试剂。
以上所述实施方式,只是本发明的较佳实施方式,并非来限制本发明实施范围,故凡依本发明申请专利范围所述的构造、特征及原理所做的等效变化或修饰,均应包括在本发明专利申请保护范围内。
