一种粪便DNA提取试剂盒及粪便DNA提取方法
文献发布时间:2024-04-18 19:52:40
技术领域
本申请涉及体外诊断技术领域,尤其涉及一种粪便DNA提取试剂盒及粪便DNA提取方法。
背景技术
粪便核酸检测是近年来兴起的一种新的检测项目,是临床上一项重要的常规检查,通过检测粪便中的宿主游离核酸及肠道微生物核酸,可了解胃肠道及肝脏、胆道、胰腺等器官的一些病理生理变化,从而用于胃肠道疾病的诊断和治疗,如结直肠癌无创早期诊断、腹泻鉴别诊断、粪便菌群移植治疗等。“粪便基因检测”早在2014年就获得美国食品和药物管理局(FDA)批准,在美国的治疗指南里,已经被建议作为风险人群的大肠癌筛查手段。随着分子生物学和核酸检测技术的日益发展,粪便核酸检测为研究肠道与人体健康疾病之间的关系提供了有力的检测分析手段。
在临床检验中,获取高质量、高纯度、完整的核酸样本是进行基因分子诊断、基因序列分析的成败关键之一。但粪便样本中含有的基质背景类型多样,成分复杂,其中含有大量多糖、胆酸等对人基因组DNA检测可产生抑制作用的成分,而且含有的大量核酸酶会对粪便DNA造成严重降解。如果不能有效地从样本中高质量、高效地获取核酸,检测结果会受到极大地影响。
目前临床分子诊断采用的核酸提取方法通常包括:离心柱法、密度梯度离心以及免疫磁珠法,但这些研究方法对粪便取样要求苛刻、粪便样本保存要求高、对耗材和设备要求高、操作流程繁琐而耗时、成本高,对于核酸含量低、样品量较大的粪便样本而言,不但需要大量的提取试剂,而且提取时间过长,不利于核酸的提取。虽然市面上已有一些粪便DNA提取试剂盒,不但不能完全解决这些难题,最终提取核酸的实际质量并不能达到官方公开的指标,另外价格也比较昂贵,难以实现在分子检测的应用。
发明内容
本申请的目的在于提供一种粪便DNA提取试剂盒及粪便DNA提取方法,旨在解决现有核酸提取方法对粪便取样要求苛刻、粪便样本保存要求高、对耗材和设备要求高、操作流程繁琐而耗时、成本高的问题。
为实现以上目的,本申请提供一种粪便DNA提取试剂盒,包括:样品处理液和核酸提取液;
所述样品处理液包括:蛋白酶K溶液、第一样品处理液、第二样品处理液、第三样品处理液;
所述第一样品处理液包括:50-150mM/L的柠檬酸钠缓冲液;
所述第二样品处理液包括:50-150mM/L的NaCl、400-600mM/L的Tris-HCl、600-800mM/L的十二烷基硫酸钠和水;
所述第三样品处理液包括:2.0-4.0M/L的氯化钾溶液。
优选地,所述核酸提取溶液包括:裂解结合液、磁珠液、洗涤液和洗脱液;
所述裂解结合液包括:30-80mM/L的Tris-HCl、3-8M/L的盐酸胍、10-300mM/L的乙二胺四乙酸二钠、15-35mM/L的NaCl,以及体积百分比为0.05%-0.15%的TritonX-100和水。
优选地,所述洗涤液包括:第一洗涤液和第二洗涤液;
所述第一洗涤液包括:80-120mM/L的Tris-HCl、3-8M/L的盐酸胍、15-35mM/L的NaCl和水;
所述第二洗涤液为水。
优选地,所述磁珠液的浓度为3.5-5.0mg/ml,pH为8.1-8.3;
所述洗脱液包括:80-120mM/L的Tris-HCl和水,pH为8.5-8.7。
优选地,所述蛋白酶K溶液的浓度为40-50mg/ml。
优选地,所述粪便DNA提取试剂盒还包括:离心管,所述离心管内含有陶瓷颗粒。
本申请还提供一种粪便DNA提取方法,使用上述的粪便DNA提取试剂盒进行提取。
优选地,所述制备方法包括:
向含有粪便样本和陶瓷颗粒的离心管中加入第一样品处理液、第二样品处理液和蛋白酶K溶液,对离心管进行孵育、击打使细胞破碎、离心,得到第一上清液;
将所述第一上清液与第三样品处理液混匀、离心,得到第二上清液;
将所述第二上清液与裂解结合液、磁珠混匀进行裂解,以使核酸释放并结合在所述磁珠上;
使用洗涤液对结合核酸的磁珠进行洗涤;
使用洗脱液将洗涤后的磁珠上的核酸进行洗脱,得到粪便DNA提取液。
优选地,所述“将所述第二上清液与裂解结合液、磁珠混匀进行裂解,以使核酸释放并结合在所述磁珠上”,所需的时间为10~20min,所需的温度为60~70℃。
优选地,所述孵育的温度为60-70℃,孵育的时间为8-15min。
与现有技术相比,本申请的有益效果包括:
本申请提供的粪便DNA提取试剂盒包括样品处理液和核酸提取液,样品处理液包括蛋白酶K溶液、第一样品处理液、第二样品处理液和第三样品处理液,通过分步对样品进行处理,可以对样品进一步剔除杂质,纯化样本提取的核酸,从而从粪便样本中得到高质量核酸。该试剂盒组成简单易得、毒副作用小;操作简便、易于储存运输、省时省力;提取核酸的纯度更高,特异性更强;可配合核酸自动提取仪进行提取粪便核酸;可进行大批量样本自动化提取,提取效率更高;对粪便样本的提取效率更高;其溶液更稳定,可重复性高。
附图说明
为了更清楚地说明本申请实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本申请的某些实施例,因此不应被看作是对本申请范围的限定。
图1为实施例2目的基因检测和核酸琼脂糖凝胶电泳的示意图;
图2为本申请的粪便DNA提取方法的流程示意图。
具体实施方式
如本文所用之术语:
“由……制备”与“包含”同义。本文中所用的术语“包含”、“包括”、“具有”、“含有”或其任何其它变形,意在覆盖非排它性的包括。例如,包含所列要素的组合物、步骤、方法、制品或装置不必仅限于那些要素,而是可以包括未明确列出的其它要素或此种组合物、步骤、方法、制品或装置所固有的要素。
连接词“由……组成”排除任何未指出的要素、步骤或组分。如果用于权利要求中,此短语将使权利要求为封闭式,使其不包含除那些描述的材料以外的材料,但与其相关的常规杂质除外。当短语“由……组成”出现在权利要求主体的子句中而不是紧接在主题之后时,其仅限定在该子句中描述的要素;其它要素并不被排除在作为整体的所述权利要求之外。
当量、浓度、或者其它值或参数以范围、优选范围、或一系列上限优选值和下限优选值限定的范围表示时,这应当被理解为具体公开了由任何范围上限或优选值与任何范围下限或优选值的任一配对所形成的所有范围,而不论该范围是否单独公开了。例如,当公开了范围“1~5”时,所描述的范围应被解释为包括范围“1~4”、“1~3”、“1~2”、“1~2和4~5”、“1~3和5”等。当数值范围在本文中被描述时,除非另外说明,否则该范围意图包括其端值和在该范围内的所有整数和分数。
在这些实施例中,除非另有指明,所述的份和百分比均按质量计。
“质量份”指表示多个组分的质量比例关系的基本计量单位,1份可表示任意的单位质量,如可以表示为1g,也可表示2.689g等。假如我们说A组分的质量份为a份,B组分的质量份为b份,则表示A组分的质量和B组分的质量之比a:b。或者,表示A组分的质量为aK,B组分的质量为bK(K为任意数,表示倍数因子)。不可误解的是,与质量份数不同的是,所有组分的质量份之和并不受限于100份之限制。
“和/或”用于表示所说明的情况的一者或两者均可能发生,例如,A和/或B包括(A和B)和(A或B)。
本申请提供一种粪便DNA提取试剂盒,包括:样品处理液和核酸提取液;样品处理液包括:蛋白酶K溶液、第一样品处理液、第二样品处理液、第三样品处理液。
其中,第一样品处理液包括:50-150mM/L的柠檬酸钠缓冲液,柠檬酸钠缓冲液的浓度例如可以为50、60、70、80、90、100、110、120、130、140或150mM/L。
其中,第二样品处理液包括:50-150mM/L的NaCl、400-600mM/L的Tris-HCl、600-800mM/L的十二烷基硫酸钠和水。NaCl的浓度例如可以为50、60、70、80、90、100、110、120、130、140或150mM/L。Tris-HCl的浓度例如可以为410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590或600mM/L。十二烷基硫酸钠的浓度例如可以为600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790或800mM/L。
其中,第三样品处理液包括:2.0-4.0M/L的氯化钾溶液,氯化钾溶液的浓度例如可以为(2.0、2.52、2.4、2.6、2.8、3.5、3.2、3.4、3.6、3.8或4.0)M/L。
本申请提供的粪便DNA提取试剂盒包括样品处理液和核酸提取液,样品处理液包括蛋白酶K溶液、第一样品处理液、第二样品处理液和第三样品处理液,通过分步对样品进行处理,可以对样品进一步剔除杂质,纯化样本提取的核酸,从而从粪便样本中得到高质量核酸。该试剂盒组成简单易得、毒副作用小;操作简便、易于储存运输、省时省力;提取核酸的纯度更高,特异性更强;可配合核酸自动提取仪进行提取粪便核酸;可进行大批量样本自动化提取,提取效率更高;对粪便样本的提取效率更高;其溶液更稳定,可重复性高。
在一优选实施例中,核酸提取溶液包括:裂解结合液、磁珠液、洗涤液和洗脱液;裂解结合液包括:30-80mM/L的Tris-HCl、3-8M/L的盐酸胍、10-30mM/L的乙二胺四乙酸二钠、15-35mM/L的NaCl,以及体积百分比为0.05%-0.15%的TritonX-100和水。
由于样品前处理阶段去除了大量的杂质,通过改变裂解结合液组成,增加胍盐的含量,加强了裂解细胞的能力;改变裂解结合液的组成,有助于去除蛋白的干扰,加强核酸的保护能力,防止其降解。
其中,裂解结合液中,Tris-HCl的浓度例如可以为(30、40、50、60、70或80)mM/L;盐酸胍的浓度例如可以为(3、4、5、6、7或8)M/L;乙二胺四乙酸二钠的浓度例如可以为(12、14、16、18、20、22、24、26、28或30)μM/L;NaCl的浓度例如可以为(15、17、20、22、25、26、27、29、30、33或35)mM/L;TritonX-100的体积百分比例如可以为0.05%、0.08%、0.1%、0.13%或0.15%。
更优选地,洗涤液包括:第一洗涤液和第二洗涤液;第一洗涤液包括:80-120mM/L的Tris-HCl、3-8M/L的盐酸胍、15-35mM/L的NaCl和水;第二洗涤液为水。
本实施例优化了洗涤液组成物质,去除了醇溶液,降低了洗涤液的毒害作用;增加胍盐的含量,增加NaCl含量,降低Tris-HCl含量,不仅加强了蛋白和核酸的分离能力,而且有助于核酸的保存。
其中,第一洗涤液中,Tris-HCl的浓度例如可以为(80、90、100、110或120)mM/L;盐酸胍的浓度例如可以为(3、4、5、6、7或8)M/L;NaCl的浓度例如可以为(15、16、17、19、20、21、22、23、24、25、26、27、29、30、32或35)mM/L。
优选地,所述磁珠液的浓度为3.5-5.0mg/ml,例如可以为3.5、4.0、4.2、4.5、4.7或5.0mg/ml,磁珠液的pH为8.1-8.3;所述洗脱液包括:80-120mM/L的Tris-HCl和水,例如可以为(80、90、100、110或120)mM/L,pH为8.5-8.7。
更优选地,蛋白酶K溶液的浓度为40-50mg/ml,例如可以为(40、41、42、43、44、45、46、47、48、49或50)mg/ml。
优选地,粪便DNA提取试剂盒还包括:离心管,所述离心管内含有陶瓷颗粒。通过在离心管中增加陶瓷颗粒研磨珠,可以加强样本的研磨和破碎,有助于核酸的释放。
本申请还提供一种粪便DNA提取方法,使用上述的粪便DNA提取试剂盒进行提取。该粪便DNA提取方法可以通过核酸提取仪完成,也可以通过人工提取完成。
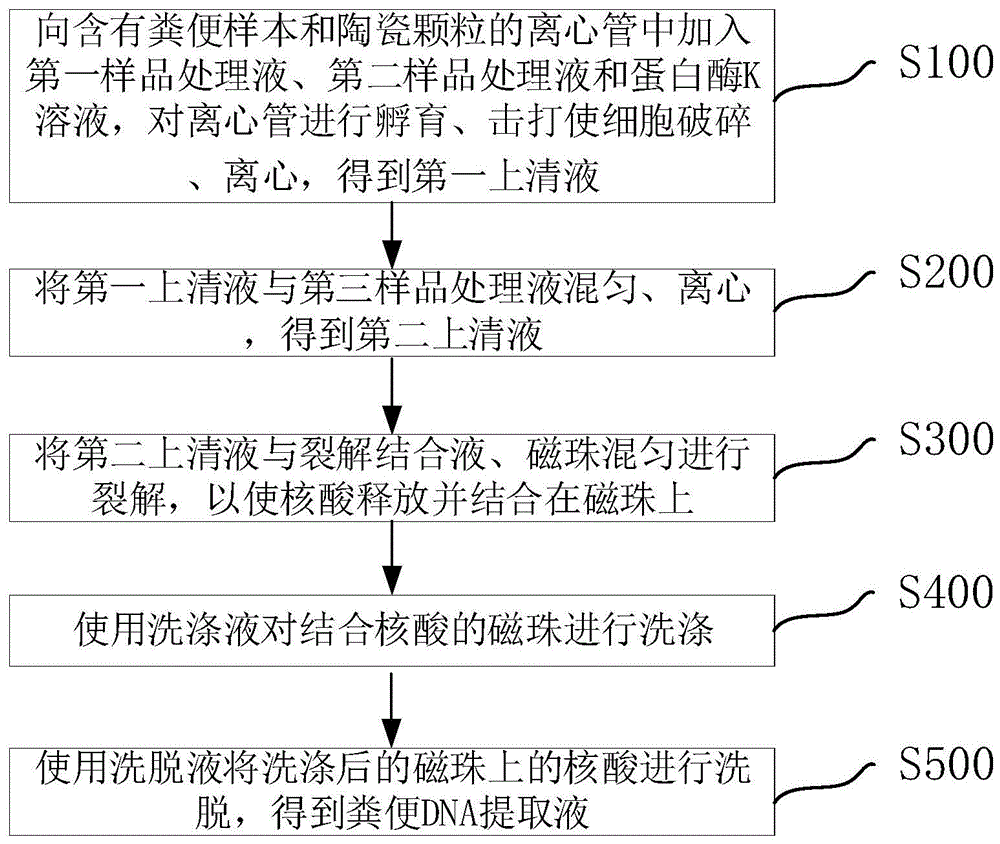
在一具体实施例中,请参阅图2,所述粪便DNA制备方法包括:
S100:向含有粪便样本和陶瓷颗粒的离心管中加入第一样品处理液、第二样品处理液和蛋白酶K溶液,对离心管进行孵育、击打使细胞破碎、离心,得到第一上清液。
其中,离心管的孵育温度为60-70℃,例如可以为(60、61、62、63、64、65、66、67、68、69或70)℃,孵育的时间为8-15min,例如可以为(8、9、10、11、12、13、14、或15)min。
S200:将所第一上清液与第三样品处理液混匀、离心,得到第二上清液。
S300:将第二上清液与裂解结合液、磁珠混匀进行裂解,以使核酸释放并结合在磁珠上。
其中,该步骤裂解结合所需的时间为10~20min,例如可以为10min、11min、12min、13min、14min、15min、16min、17min、18min、19min或20min;裂解结合所需的温度为60~70℃,例如可以为60℃、61℃、62℃、63℃、64℃、65℃、66℃、67℃、68℃、69℃或70℃。
S400:使用洗涤液对结合核酸的磁珠进行洗涤。
该步骤对结合核酸的磁珠进行洗涤所需的洗涤次数为1~3次,例如可以为1次,或2次,或3次,优选为3次,尽量除去杂质;每次洗涤所需的时间为1~3min,例如可以为1min、1.5min、2min、2.5min或3min。
S500:使用洗脱液将洗涤后的磁珠上的核酸进行洗脱,得到粪便DNA提取液。
其中,该步骤将洗涤后的磁珠上的核酸进行洗脱所需的时间为1~3min,例如可以为1min、1.5min、2min、2.5min或3min;所述的温度为50~60℃,例如可以为50℃、51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃或60℃。
下面将结合具体实施例对本申请的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本申请,而不应视为限制本申请的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
实施例1的粪便DNA提取试剂盒采用如下配置:
1、离心管(含陶瓷颗粒):2.5g钇稳定氧化锆珠。
2、32T蛋白酶K溶液:45mg/ml的蛋白酶K溶液。
3、样品处理MA溶液(第一样品处理液):100mM/L的柠檬酸钠缓冲液(pH=8),总体积500μl。
4、样品处理MB溶液(第二样品处理液):100mM/L的NaCl、500mM/L的Tris-HCl(pH8.0)、700mM/L的十二烷基硫酸钠和纯化水,总体积250μl。
5、样品处理MC溶液(第三样品处理液):3M/L的氯化钾溶液,总体积250μl。
二.核酸提取溶液
裂解结合液:50mM/L的Tris-HCl(pH8.0)、5M/L的盐酸胍、20mM/L的乙二胺四乙酸二钠、25mM/L的NaCl,以及体积百分比为0.1%的TritonX-100和纯化水,总体积600μl,pH6.4-7.0;
磁珠液:浓度为4.2mg/ml的水溶液,总体积500μl,pH 8.1-8.3;
洗涤液1(第一洗涤液):100mM/L的Tris-HCl、5M/L的盐酸胍、25mM/L的NaCl和纯化水,总体积600μl,pH 7.1-7.3;
洗涤液2(第二洗涤液):纯化水,总体积600μl;
洗脱液:100mM/L的Tris-HCl和纯化水,总体积60μl,pH 8.5-8.7。
采用实施例1的粪便DNA提取试剂盒对六个粪便样本分别进行核酸提取,步骤如下:
(一)、溶液配制与分装
1、研磨珠及样品处理液配制:精密称重/量取各类原料配制成研磨珠,MA、MB、MC溶液;
2、核酸提取液配制与分装:精密称重/量取各类原料配制成裂解结合液、磁珠液、洗涤液及洗脱液,并分装至96深孔板,组分加样顺序如表1所示。
表1核酸提取液加样顺序
(二)、样品预处理
(1)取250mg粪便加入到含有陶瓷颗粒的2mL离心管中,加入500ul溶液MA和250ul溶液MB;加入25ul蛋白酶K溶液;
(2)65℃孵育10min后,在匀浆机上60Hz条件下击打60s,15000g离心1min;
(3)取上清600ul,加入250ul溶液MC,振荡5s,15000g离心2min,取上清300ul加入到96深孔板的第一列孔位中(裂解孔)。
(三)、核酸提取
将96深孔板卡入达安smart32核酸提取仪的卡槽中,套好磁棒套,点击预先设置的程序,如表2所示,并运行。
表2核酸提取程序参数
具体运行步骤:
第一步至第三步:磁棒套先将吸取磁珠从2/8号转移至1/7号孔,并将磁珠与1/7号孔内的裂解结合液、菌液混匀并在70℃下进行裂解5分钟后,降温至65℃再裂解10分钟,使核酸得以释放出来结合在磁珠孔上;
第四步至第六步:磁棒套再吸取磁珠,将其转移依次转移至3/9孔位(装有洗涤液1)洗涤1分钟、再依次吸取磁珠转移至4/10、5/11号孔分别洗涤1分钟,尽可能洗去除核酸外的其他杂质;
第七步至第八步:最后磁棒套吸取磁珠转移至6/12号孔(装有洗脱液)内,在规定温度下将提取的核酸洗脱出来,用于后续实验。
程序运行完毕后,即提取完成,第六列(第十二列)为提取好的核酸,使用移液枪吸取洗脱液保存在PCR管中,留存待测。
(四)、核酸测定
使用提取得到的粪便样本的DNA通过酶标仪进行浓度和纯度的测定,结果如表4所示。
对比例1
对比例1的粪便DNA提取试剂盒为现有市面上的产品,采用如下配置:
一.样品处理液
32T蛋白酶K溶液:45mg/ml蛋白酶K溶液;
粪便处理液配方:2M/L的盐酸胍、体积百分比10%的chelex-100、2M/L的MBSU(苯磺酰肼)、0.1M/L的IDU(碘苷)、0.5M/L的glycine(甘氨酸)、0.2M/L的bestain(氨肽酶抑制剂),总体积400μl。
二.核酸提取溶液
裂解结合液配方:2M/L的盐酸胍、5M/L的Tris-HCl、3M/L的十四烷基硫酸钠和纯化水,总体积600μl;
磁珠液:浓度为4.2mg/ml的水溶液,总体积500μl,pH 8.1-8.3;
洗涤液1:2M/L的盐酸胍,体积百分比40%的醇溶液,纯化水,总体积为600μl;
洗涤液2:1M/L的Tris-HCl,体积百分比40%的醇溶液和纯化水,总体积600μl;
洗脱液:2M/L的Tris-HCl和纯化水,总体积60μl,pH 8.5-8.7。
采用对比例1的粪便DNA提取试剂盒对实施例1相同的六个粪便样本分别进行核酸提取,步骤如下:
(一)、溶液配制与分装
1、样品处理液配制:精密称重/量取各类原料配制成粪便处理液;
2、核酸提取液配制与分装:精密称重/量取各类原料配制成裂解结合液、磁珠液、洗涤液及洗脱液,并分装至96深孔板,组分加样顺序如表1所示。
(二)、样品预处理
(1)往EP管加入400ul粪便处理液,在常温下振荡混匀,12000rpm离心10min;
(2)将经过样品处理液处理后的上层水层,加入到粪便DNA快速提取试剂盒的预分装板的第一列和第七列;
(3)向第一列和第七列加入50μl蛋白酶K溶液。
(三)、核酸提取
将96深孔板卡入达安smart32核酸提取仪的卡槽中,套好磁棒套,点击预先设置的程序,如表3所示,并运行,具体运行步骤与实施例1相同。
表3核酸提取程序参数
(四)、核酸测定
使用对比例1提取得到的粪便样本的DNA通过酶标仪进行浓度和纯度的测定,结果如表4所示。
表4实施例1和对比例1提取的粪便DNA的浓度和纯度对比
从表4中可知,实施例1中提取到的DNA浓度和纯度都更高。表中第四和八列(ng/μl)表示所提取的DNA浓度,260/280的比值表示了蛋白质等有机物的污染程度,高质量的核酸样品260/280的比值应在1.8-2.0之间。通过比较相同样本不同核酸提取试剂盒的核酸提取浓度,可以得出本发明的粪便DNA提取试剂盒提取的核酸比传统法提取的核酸更纯,浓度更高,表明本发明的核酸提取效率更高。
实施例2
分别采用实施例1和对比例1的粪便DNA提取试剂盒对鼠伤寒沙门氏杆菌感染的患者的临床粪便样本进行DNA提取,核酸提取步骤与实施例1相同,实施例2提取得到的核酸样品进行PCR扩增检测步骤验证核酸提取效果。
PCR扩增:
(1)检测目的基因:invA
引物:Sal-F:CACCTAGCTATTCTGGTTGATT;Sal-R:GAACGACCCCAGATCGGTAA,该目的基因片段为110bp。
(2)选择PCR体系为50微升体系,向50微升管中依次加入1微升dNTPs、0.5微升正向引物、0.5微升反向引物、10微升PCR buffer缓冲液,0.2微升GP66D酶和0.1微升GP68R酶,2.7微升双蒸水,35微升DNA模板,盖紧盖子后震荡混匀,然后使用低速离心机1000转每分钟离心1分钟。
(3)将离心后的PCR管转移到PCR仪上,盖紧盖子,运行程序:预变性95℃,5min;变性95℃,10s;退火60℃,35s;进行45个循化,得到PCR扩增产物。
电泳检测PCR产物:
(1)称取0.5g琼脂糖,溶于50ml TE电泳缓冲液中,加入1微升溴化乙锭后混匀,放入微波炉中中高火加热2分钟至琼脂糖全部溶解呈透明;
(2)取出融化的琼脂糖倒入插有大梳子的电泳版上,冷却至琼脂糖凝固成凝胶,拔出梳子后将电泳版放入电泳槽;
(3)从装有PCR产物的PCR管中吸取5微升扩增产物和1微升溴酚蓝混匀,然后用移液枪将上述混合物转加到琼脂糖的点样孔里,160伏电泳30分钟;
(4)电泳结束后,取出琼脂糖凝胶转到暗室、使用紫外透射分析仪观察条带结果,并拍摄照片,结果如图1所示。
图1为实施例2目的基因检测和核酸琼脂糖凝胶电泳图;M为500bp Marker,1-3为对比例1的粪便DNA提取试剂盒的核酸提取的PCR扩增产物电泳结果,4-6为实施例1的粪便DNA提取试剂盒提取的核酸的PCR扩增产物电泳结果。由图1可知,实施例1的粪便DNA提取试剂盒提取的核酸的目的基因检测条带较亮,通过对核酸PCR扩增产物跑胶发现核酸没有明显的拖带以及弥散现象。说明采用本发明的粪便DNA提取试剂盒提取的核酸纯度、浓度和效率较高。
对比例2
对比例2与对比例1的区别在于:对比例2的粪便DNA提取试剂盒的样品处理液配方为实施例1的粪便DNA提取试剂盒的样品处理液,对比例2的核酸提取步骤中的样品预处理步骤与实施例1相同,其他组分和核酸提取步骤与对比例1相同,在此不再赘述。
浓度、260/280结果:如表5所示,对比例2提取的的粪便核酸的浓度和纯度相对于对比例1都更高,且样品处理溶液更稳定,重复性更高。
表5对比例1和对比例2提取的核酸的浓度、260/280结果
对比例3
对比例3与对比例1的区别在于:对比例3的粪便DNA提取试剂盒的裂解结合液配方为实施例1的粪便DNA提取试剂盒的裂解结合液,其他组分和核酸提取步骤与对比例1相同,在此不再赘述。
浓度、260/280结果:如表6所示,对比例3提取的的粪便核酸的浓度和纯度相对于对比例1都更高,且样品处理溶液更稳定,重复性更高。
表6对比例1和对比例3提取的核酸的浓度、260/280结果
对比例4
对比例4与对比例1的区别在于:对比例4的粪便DNA提取试剂盒的洗涤液1和洗涤液2配方为实施例1的粪便DNA提取试剂盒的洗涤液1和洗涤液2,其他组分和核酸提取步骤与对比例1相同,在此不再赘述。
浓度、260/280结果:如表7所示,对比例4提取的的粪便核酸的浓度和纯度相对于对比例1都更高,且样品处理溶液更稳定,重复性更高。
表7对比例1和对比例4提取的核酸的浓度、260/280结果
最后应说明的是:以上各实施例仅用以说明本申请的技术方案,而非对其限制;尽管参照前述各实施例对本申请进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本申请各实施例技术方案的范围。
此外,本领域的技术人员能够理解,尽管在此的一些实施例包括其它实施例中所包括的某些特征而不是其它特征,但是不同实施例的特征的组合意味着处于本申请的范围之内并且形成不同的实施例。例如,在上面的权利要求书中,所要求保护的实施例的任意之一都可以以任意的组合方式来使用。公开于该背景技术部分的信息仅仅旨在加深对本申请的总体背景技术的理解,而不应当被视为承认或以任何形式暗示该信息构成已为本领域技术人员所公知的现有技术。
