用于治疗或预防由冠状病毒引起的人或动物的病毒感染的菠萝蛋白酶、菠萝酶、木菠萝素类凝集素、来自菠萝植物茎和/或果的提取物、组合制剂、菠萝蛋白酶抑制剂、蛋白质-蛋白酶混合物和外源性非酶糖化产生的糖化菠萝酶蛋白
文献发布时间:2024-04-18 19:52:40
鉴于COVID-19疫情的持续,仍然迫切需要提供额外的活性成分或活性成分类别来治疗病毒性疾病。
因此,本发明的目的是提供活性成分类别,利用这些活性成分类别可以治疗由冠状病毒引起的人或动物的病毒性疾病。这方面的治疗包括对已经存在的病毒性疾病的急性治疗及其预防。
根据第一方面,本发明涉及菠萝蛋白酶(同义词“菠萝酶”),其用于治疗或预防由冠状病毒引起的人或动物的病毒感染。菠萝蛋白酶特别是选自茎菠萝酶(SBM)(EC3.4.22.32,CASNo.:37189-34-7)、果菠萝酶(EC 3.4.22.33,CAS No.:9001-00-7)、ananain(EC 3.4.22.31)及其混合物和组合的菠萝蛋白酶。
从菠萝植物(Ananas comosus)的茎或果实中制备和分离菠萝蛋白酶,特别是茎菠萝酶(SBM)(EC 3.4.22.32)和果菠萝酶(EC 3.4.22.33)在现有技术中是已知的,例如Rowan,A.D.,Buttle,D.J.&Barrett,A.J.在Arch.Biochem.Biophys.267,262-270(1988)或在ARCHIVES OF BIOCHEMISTRY AND BIOPHYSICS,Vol.267,No.1,November 15,pp.262-270(1988)中所描述的。
除了直接的抗病毒作用,所述菠萝蛋白酶还具有整体上有助于治疗病毒感染的全身作用。特别是以下这些作用:抑制过度免疫反应的抗炎作用、抗水肿作用例如消除肺部水肿、以及抵消炎症和/或过度活跃的凝血系统引起的血栓形成的抗凝血作用。
根据第二方面,本发明涉及木菠萝素类凝集素,其用于治疗或预防由冠状病毒引起的人或动物的病毒感染。
这里木菠萝素类凝集素特别地选自甘露糖特异性凝集素和葡萄糖特异性凝集素。
木菠萝素类凝集素特别优选选自菠萝凝集素(来自菠萝的木菠萝素类凝集素(AcmJRL))、木菠萝素凝集素、桂木黄酮凝集素、MPA凝集素、菊芋凝集素、红藻凝集素及其混合物和组合。
本发明的第三方面还涉及菠萝植物的茎和/或果的提取物,其用于治疗或预防由冠状病毒引起的人或动物的病毒感染。
菠萝植物特别是凤梨和菠萝。这样的提取物包含一种或多于一种先前提到的菠萝蛋白酶和/或ananain。
根据第四方面,本发明还涉及包含至少一种菠萝蛋白酶和至少一种木菠萝素类凝集素的组合制剂,其用于治疗或预防由冠状病毒引起的人或动物的病毒感染。
在优选的实施方案中,至少一种菠萝蛋白酶的总量与至少一种木菠萝素类凝集素的总量的重量比为50:50至0.1:99.9,优选40:60至1:99,更优选30:70至2:98,更优选20:80至3:97,特别优选10:90至5:95。
更有利地,根据本发明的组合制剂包含至少一种菠萝蛋白酶,在提取物或组合制剂中所有菠萝蛋白酶的总浓度优选为0.01重量%至50.0重量%,更优选0.1重量%至20.0重量%,特别优选1.0重量%至10.0重量%。
此外,有利地,组合制剂包含至少一种木菠萝素类凝集素,在提取物中至少一种木菠萝素类凝集素的总浓度优选为0.01重量%至60.0重量%,更优选1.5重量%至50.0重量%,特别优选2.0重量%至30重量%。
1973年,Perlstein&Kezdy在菠萝酶基粉(BBP)中发现了蛋白酶抑制剂,该基粉是从菠萝植物的茎中获得的菠萝酶(Perlstein&Kezdy,Struct.,Vol.1,249-254)。这些蛋白酶抑制剂可以抑制BBP中菠萝蛋白酶的酶活性。
这些菠萝蛋白酶抑制剂的七种异形体最初描述于1973年(Perlstein&Kezdy,Struct.,Vol.1,249-254)。1975年,Reddy等人完全揭示了异形体VII的一级结构,并指出了七种分离的异形体的微观不均一性(Reddy等人,J.Biol.Chem.,Vol.250,1741-1750)。
Lenarcic等人在1992年揭示了另一种菠萝蛋白酶抑制剂的一级结构,并且还揭示了其对组织蛋白酶L的抑制作用(Lenarcic等人,Biol.Chem.,Vol.373,459-464)。
Hatano等人于1995年(Hatano等人,Eur.J.Biochem.,Vol.232,335-343)发表了菠萝蛋白酶抑制剂VI的一级结构和二级结构。在接下来的一年中,菠萝蛋白酶抑制剂VI与已经被描述过的Bowman-Birk胰蛋白酶抑制剂的相似性被揭示了(Hatano等人,Biochemistry,Vol.35,5379-5384)。Hatano等人于1998年最终发表了所有先前描述的菠萝蛋白酶抑制剂七种异形体的氨基酸序列(Hatano等人,J.Biochem.,Vol.124,457-461)。
先前在文献中描述过的所有菠萝蛋白酶抑制剂的分离过程都使用两步色谱法。这种方法的基本原理已经由Perlstein&Kezdy于1973年发表(Perlstein&Kezdy,Struct.,Vol.1,249-254)。在第一维度中,即在第一纯化步骤中,色谱法应用尺寸排阻色谱(SEC)。可以使用SEC将BBP中所含的分子根据它们的不同尺寸彼此分离。菠萝蛋白酶(约25kDa)和菠萝蛋白酶抑制剂(约6kDa)尤其可以由此分离。
根据Perlstein&Kezdy的方法,阴离子交换色谱(例如弱阴离子交换色谱=WAX)通常用于第二次色谱分离。利用这种方法,Perlstein&Kezdy成功地从BBP中分离出七种菠萝蛋白酶抑制剂(七种不同的异形体)。
已经有报告表明使用该方法从1g BBP中获得了约3mg菠萝蛋白酶抑制剂异形体VII或1mg菠萝蛋白酶抑制剂异形体VI(Reddy等人,Biol.Chem.,Vol.250,1741-1750;Hatano等人,Eur.J.Biochem.,Vol.232,335-343)。
Perlstein&Kezdy发表的纯化方法也可以称为SEC/WAX,其缺点是未能成功分离出高纯度或纯形式的菠萝蛋白酶抑制剂异形体。
人们一致认为,所有先前纯化的菠萝蛋白酶抑制剂异形体实际上都是菠萝蛋白酶抑制剂的不同异形体的混合物(Hatano等人,Biol.Chem.,Vol.383,1151-1156)。
此外,SEC/WAX方法扩大到工业规模并不经济划算。这里决定性的是SEC方法在第一维度,即在第一纯化步骤中的使用。与吸附色谱蛋白质纯化方法相比,SEC的容量和分离能力都更小。这一点在Hatano等人曾三次重复第一SEC步骤用于分离1mg菠萝酶蛋白酶抑制剂变得尤为明显,其表示了即使在这种小规模(1g BBP)下也需要花费大量的时间(Hatano等人,1995,Eur.J.Biochem.,Vol.232,335-343)。
由于三个色谱步骤被认为是经济性上限,重复SEC色谱对于工业应用来说是不经济的。举例来说,使用SEC/WAX方法获得约1g的菠萝蛋白酶抑制剂必须使用体积约为100升的SEC柱。因此,无论从技术材料方面还是从时间经济性方面来看,SEC/WAX方法都是不经济的,对商业用途来说没什么价值。
对于菠萝蛋白酶的纯化,文献中已经描述了不同的方法(Rowan等人,Arch.Biochem.Biophys.,Vol.267,262-270;Harrach等人,Protein Chem.,Vol.14,41-52)。
因此,本发明的目的还在于提供分离菠萝蛋白酶抑制剂和菠萝蛋白酶的改进方法,并且进一步提供高纯度且具有丰富生物活性的菠萝蛋白酶抑制剂和菠萝蛋白酶混合物。
在第五方面,本发明因此涉及菠萝蛋白酶抑制剂,其用于治疗或预防由冠状病毒引起的人或动物的病毒感染,所述菠萝蛋白酶抑制剂包含或组成为具有与SEQ ID NO:1至SEQ ID NO:7中的一个序列具有至少90%、优选95%、特别优选100%同一性的氨基酸序列的至少一种肽,其中至少一种肽优选具有至少80重量%、特别优选至少95重量%的纯度。
根据本发明,同样提供了纯化至少一种菠萝蛋白酶抑制剂的方法,其特征在于用阳离子交换色谱纯化含有溶解的菠萝的茎提取物的水溶液,该水溶液的pH值为6.5至9.5,阳离子交换材料在该pH值内结合菠萝蛋白酶,并且色谱通过物中包含至少一种菠萝蛋白酶抑制剂。
可用于阳离子交换色谱的水溶液和/或其它溶液(例如洗脱缓冲液)任选地包含在pH值为6.5至9.5具有缓冲作用的缓冲物质。
使用强阳离子交换色谱或弱阳离子交换色谱(SCX或WCX)可以用于高容量和分离效率,即使用强离子交换材料或弱离子交换材料的阳离子交换色谱。
优选地选择缓冲条件使得在阳离子交换色谱中,来自菠萝植物的茎提取物的菠萝蛋白酶抑制剂起初不与阳离子交换材料(阳离子交换柱)结合,但所有菠萝蛋白酶都与阳离子交换材料结合。菠萝蛋白酶抑制剂因此位于阳离子交换色谱的通过物中,该通过物可被收集并进行进一步的色谱步骤。
在优选的实施方案中,选择缓冲条件,使得阳离子交换色谱在5.0至10、优选7.0至9.5的pH下进行。该方法中的水溶液可以包含缓冲物质,例如选自TRIS、HEPES、磷酸钠、和/或磷酸钾的缓冲物质。在优选实施方案中,水溶液具有弱导电性。水溶液中包含的缓冲物质的浓度可以为5mM至100mM,优选10mM至50mM。
与阳离子交换材料结合的菠萝蛋白酶可以从阳离子交换材料中释放并在进一步的步骤中分离。这可以通过使用合适的洗脱缓冲液洗脱菠萝蛋白酶来完成。
选择洗脱缓冲液中的缓冲条件,以解除菠萝蛋白酶与阳离子交换材料的结合。缓冲液可以具有0.01M至1.0M、优选0.10M至0.5M的盐(例如NaCl或KCl)浓度。可选地,可以通过洗脱缓冲液从阳离子缓冲材料进行洗脱,该洗脱缓冲液的pH高于水溶液的pH或高于洗涤缓冲液的pH。
可以采用阶梯梯度或线性梯度进行洗脱。如果提供菠萝蛋白酶的至少一个其他的纯化步骤,则优选以线性梯度进行洗脱。在特别优选的实施方案中,在此过程中分离洗脱液的各个部分。阶梯梯度的洗脱产生具有与BBP相比富集的生物活性的菠萝蛋白酶混合物。
阳离子交换材料的洗脱液包含基本上不含抑制剂的菠萝蛋白酶。在这方面,菠萝蛋白酶可以含有相对于总肽质量的小于5.0重量%、优选小于2.0重量%、进一步优选小于1.0重量%、更优选小于0.5重量%、更优选小于0.2重量%、特别优选小于0.1重量%的菠萝蛋白酶抑制剂。菠萝蛋白酶的纯度可以通过SEC-HPLC或RP-HPLC测定。
如果要进一步纯化菠萝蛋白酶抑制剂,则可以在随后的第二步中通过阴离子交换色谱(AX)、疏水色谱(HIC)、反相HPLC(RP-HPLC)、或SEC纯化含有菠萝蛋白酶抑制剂的阳离子交换材料通过物。
选择缓冲液的条件使得至少一种菠萝蛋白酶抑制剂与阴离子交换材料、疏水色谱的材料或RP-HPLC的材料结合,然后分离。除SEC外,分离优选使用一种缓冲液进行洗涤,随后用另一种缓冲液进行洗脱。由于菠萝蛋白酶抑制剂根本不与SEC色谱材料结合,因此这一步骤在SEC中是不必要的。本领域技术人员从现有技术中已知用于相应材料的合适缓冲条件(用于肽或蛋白质的结合、洗涤和/或洗脱)。
本领域技术人员熟悉术语“洗涤”。“洗涤”优选地理解为色谱材料与缓冲液的接触,该缓冲液削弱了不期望的材料与色谱柱的结合,特别优选完全消除了这种结合,同时保持了菠萝蛋白酶抑制剂与色谱材料的结合。
可以采用阶梯梯度或线性梯度进行洗脱,洗脱液可任选地收集在单独的部分中。
根据菠萝蛋白酶抑制剂的所需品质,可以在第二步骤之后进行第三色谱步骤。在该第三步骤中进行进一步纯化,其中通过RP-HPLC、AX、或SEC纯化至少一种分离的菠萝蛋白酶抑制剂,选择缓冲条件使得至少一种菠萝蛋白酶抑制剂与RP-HPLC的材料或阴离子交换材料结合,然后分离。除SEC外,分离优选使用一种缓冲液进行洗涤,然后用另一缓冲液进行洗脱。由于菠萝蛋白酶抑制剂不与SEC材料结合,因此不需要洗涤或洗脱(流动缓冲液就足够了)。
在根据本发明的所有方法中,阳离子交换材料可以选自强阳离子交换材料和弱阳离子交换材料;阴离子交换材料可以选自强阴离子交换材料和弱阴离子交换材料;疏水色谱的材料可以选自碳数为C3至C20的直链、环状、非芳香族和芳香族配体;RP-HPLC的材料可以选自链长为C4至C18的直链、环状、非芳香族和芳香族配体(优选直链配体);凝胶过滤色谱的材料可以是Superdex材材料(例如GE Healthcare的Superdex30Prepgrade)。
在根据本发明的方法的优选实施方案中,来自菠萝植物茎的提取物是BBP。
根据本发明的方法的优点是获得了菠萝蛋白酶抑制剂异形体的混合物,其不含菠萝植物的茎提取物的其他成分。
通过所述方法可以提供菠萝蛋白酶抑制剂混合物(即所有菠萝蛋白酶抑制剂异形体的全部),其产率为菠萝酶基粉(BBP=市售的菠萝植物的茎提取物)的起始物质的约为1重量%至50重量%,优选5重量%至30重量%。由于在现有技术中已经报道的单独的菠萝酶蛋白酶抑制剂异形体为0.1重量%或0.3重量%,这意味着根据本发明的方法对现有技术有很大的改进。因此,根据本发明的从BBP中分离菠萝蛋白酶抑制剂异形体的方法比现有技术的方法更有效和经济。
还可能提供单独的超纯菠萝蛋白酶抑制剂异形体。这可以通过在第二维度(=第二步)中进行AX色谱和在第三维度(=第三步)中进行RP-HPLC色谱来实现。因此,可以从菠萝植物的茎提取物中分离出单独的超纯菠萝蛋白酶抑制剂异形体。
本发明包括菠萝蛋白酶抑制剂,其包含或组成为具有与SEQ ID NO.1至SEQ IDNO.7之一的序列具有至少90%、优选95%、特别优选100%同一性的氨基酸序列(已知的菠萝蛋白酶抑制剂I至VII的序列)的至少一种肽。
根据本发明,菠萝蛋白酶抑制剂中的至少一种肽(例如菠萝蛋白酶抑制剂的至少一个异形体)相对于污染分子和其他菠萝蛋白酶异形体可以具有至少80重量%、优选至少90重量%、特别优选至少95重量%的纯度。
根据本发明,还可以提供菠萝蛋白酶抑制剂,其是至少两种、优选至少三种、特别优选至少四种菠萝蛋白酶抑制剂异形体的混合物。混合物可以任选地包括所有七种已知的菠萝蛋白酶抑制剂异形体(参见SEQ ID NO.1至SEQ ID NO.7)。相比于单独的菠萝蛋白酶抑制剂异形体,多种菠萝蛋白酶抑制剂异形体的混合物的优点是可以结合更大范围的分子靶标,因此具有更好的效果。
在其他优选实施方案中,根据本发明的菠萝蛋白酶抑制剂至少包括菠萝蛋白酶抑制剂异形体IV(SEQ ID NO.4)和/或菠萝蛋白酶抑制剂异形体V(SEQ ID NO.5)。
对于菠萝蛋白酶抑制剂与非菠萝蛋白酶抑制剂的污染分子(例如菠萝蛋白酶)的比率,该混合物可以具有至少80重量%、优选至少90重量%、特别优选至少95重量%的纯度。
根据本发明的菠萝蛋白酶抑制剂中的至少一种肽还可以:
a)包含菠萝植物特有的翻译后修饰,优选糖基化;和/或
b)不包含任何翻译后修饰。
根据本发明的菠萝蛋白酶抑制剂可以优选使用根据本发明的方法制备。
根据本发明的菠萝蛋白酶抑制剂可用于医学,优选用于治疗和/或预防以至少一种细胞蛋白酶、优选至少一种半胱氨酸蛋白酶的强化表达为特征的疾病。
本发明还包括菠萝蛋白酶的混合物,其含有相对于总肽质量的小于0.5重量%、优选小于0.2重量%、特别优选小于0.1重量%的菠萝蛋白酶抑制剂。本领域技术人员可以例如通过分析性SEC或RP-HPLC测定菠萝蛋白酶混合物中菠萝蛋白酶抑制剂的残留含量。
根据本发明的菠萝蛋白酶混合物可以根据根据本发明方法的变体制备。
在第六方面,本发明涉及菠萝蛋白酶混合物,其用于治疗或预防冠状病毒引起的人或动物的病毒感染,所述菠萝蛋白酶混合物包含相对于总肽质量的小于5.0重量%、优选小于2.0重量%、更优选小于1.0重量%、更优选小于0.5重量%、更优选小于0.2重量%、特别优选小于0.1重量%的菠萝蛋白酶抑制剂。
在第七方面,本发明还涉及糖化的菠萝酶蛋白,其包含至少一个与菠萝酶蛋白共价结合的糖单元。所述糖化的菠萝酶蛋白通过外源性非酶糖化产生,特别是糖化的木菠萝素类凝集素、糖化的菠萝蛋白酶、糖化的菠萝酶蛋白酶抑制剂、或其混合物产生。
优选使用糖化的菠萝蛋白酶用于治疗或预防由冠状病毒引起的人或动物的病毒感染。
这里更优选的实施方案中,至少一个与菠萝酶蛋白共价结合的糖单元选自单体己糖或低聚己糖,特别是葡萄糖、半乳糖、和/或其混合物和组合。
1个至10个、优选1个至5个、特别优选1个、2个或3个糖单元通过美拉德反应与菠萝酶蛋白共价结合。
上述糖化的菠萝酶蛋白尤其可以通过将至少一种菠萝酶蛋白与至少一种还原糖混合并通过进行美拉德反应来制备。
冠状病毒可以选自例如正冠状病毒,优选α冠状病毒、β冠状病毒、γ冠状病毒或δ冠状病毒、以及letovirus,优选alphaletovirus,特别是milecovirus,例如microhylaletavirus1(MLev-1)。
这里,正冠状病毒特别选自:
α冠状病毒,选自冠状病毒,例如蝙蝠冠状病毒CDPHE15;decacovirus,例如马铁菊头蝠α冠状病毒HuB-2013;Duvinacovirus,例如人冠状病毒229E(HCov229E);luchacovirus,例如鹿城褐家鼠冠状病毒;minacovirus,例如雪貂冠状病毒或水貂冠状病毒1;minunacovirus,例如长翼蝠冠状病毒1或长翼蝠冠状病毒HKU8;myotacovirus,例如大足鼠耳蝠α冠状病毒Sax-2011或中华山蝠α冠状病毒SC-2013;pedacovirus,例如猪流行性腹泻病毒(PEDV)或黄蝠冠状病毒512;Rhinacovirus,例如菊头蝠冠状病毒HKU2或猪急性腹泻综合征冠状病毒(SADS-CoV);Setracovirus,例如人冠状病毒NL63(HCov-NL63)或NL63相关蝙蝠冠状病毒株BtKYNL63-9b;Tegacovirus,例如α冠状病毒1,特别是犬冠状病毒(CCoV)、猫冠状病毒(FCoV)或传染性胃肠炎病毒(TGEV);
β冠状病毒选自sarbecovirus,例如重症急性呼吸综合征相关冠状病毒(“SARS相关冠状病毒”,特别是重症急性呼吸综合症冠状病毒2型(SARS-CoV-2)及其同义或非同义突变体,包括变体B.1.1.7、B.1.351、B.1.617、P.1、P.2、B.1.525、B.1.427、B.1.429、L452R、Fin-796H、B.1.526、S:H66D、S:G142V、S:D215G、S:V483A、S:D614G、S:H655Y、S:G669S、S:Q949R、S:N1187D、ORF6:K23-、ORF6:V24-、ORF6:S25-、ORF6:I26-、ORF6:W27-、ORF6:N28-、ORF6:L29-、ORF6:D30-、ORF6:Y31-、S:Y144-、E484K、VOC 20I/484Q、B.1、R.1、A.2.5、C.36,B.1.1.318,B.1.621,B.1.623,重症急性呼吸综合征冠状病毒(SARS-CoV,SARS冠状病毒,也称SARS-CoV-1),Embecovirus,例如β冠状病毒1,特别是牛冠状病毒(BCoV)、马冠状病毒(ECoV-NC99)、人冠状病毒OC43(HCoV-OC43)、猪血凝性脑脊髓炎病毒(HEV)、Puffinosis冠状病毒(PCoV)、人肠道冠状病毒(HECoV);中国家鼠冠状病毒HKU24;人冠状病毒HKU1(HCoV-HKU1);鼠冠状病毒例如小鼠肝炎病毒(MHV)或大鼠冠状病毒(RtCoV);hibecovirus,例如蹄蝠β冠状病毒浙江2013;merbecovirus(以前是MERS相关冠状病毒,MERSr-CoV),例如刺猬冠状病毒1、中东呼吸综合征相关冠状病毒(MERS-CoV)、伏翼蝠冠状病毒HKU5、扁颅蝠冠状病毒HKU4;Nobecovirus,例如果蝠冠状病毒GCCDC1或果蝠冠状病毒HKU9;或BatCoV RaTG13、Manis-CoV SRR10168377和SRR10168378;
γ冠状病毒选自cegavirus,例如白鲸冠状病毒SW1;或igacovirus,例如禽冠状病毒,特别是火鸡冠状病毒(TCov)、野鸡冠状病毒(PhCoV)、传染性支气管炎病毒(IBV);和
δ冠状病毒选自andecovirus,例如赤颈鸭冠状病毒HKU20;buldecovirus,例如夜莺冠状病毒HKU11(BuCoV HKU11)、冠状病毒HKU15、文鸟冠状病毒HKU13(MunCoV HKU23)、绣眼鸟冠状病毒HKU16、或鸫冠状病毒HKU12(ThCoV HKU2);herdecovirus,如夜鹭冠状病毒HKU19;和moordecovirus,例如黑水鸡冠状病毒HKU21。
根据本发明,如上所述的菠萝蛋白酶、木菠萝素类凝集素、提取物、组合制剂、菠萝蛋白酶抑制剂、菠萝蛋白酶混合物或糖化的菠萝酶蛋白,均适合根据本发明的用于治疗由冠状病毒感染引起的症状,所述症状特别是发热、咳嗽、肺炎、淋巴细胞减少的社区获得性肺炎(L-CAP)、胸膜炎、呼吸困难、不适和/或疲劳、痰、嗅觉丧失和/或味觉缺失、呼吸短促、肌肉炎和/或咽喉炎、关节痛、胸痛、咽痛、头痛、背痛、疟疾、恶心和/或呕吐、畏寒、腹泻、咳血、淋巴细胞减少、手、脚或口腔皮疹、两侧非化脓性结膜炎、肌张力低下、休克、高酪氨酸血症、心肌功能障碍、心包炎和/或心瓣膜炎症、凝血功能障碍、儿童多系统炎症综合征(MIS-C)和结膜肿胀。
有利地,前述的提取物或组合制剂中,至少一种菠萝蛋白酶的总量与至少一种木菠萝素类凝集素的总量的重量比为1:99至99.9:0.1,优选50:50至99:1,更优选60:40至98:2,更优选70:30至97:3,更优选80:20至96:4,特别优选90:10至95:5。
权利要求10至12中限定了JRL/菠萝酶的重量比或量,例如它们存在于天然产物(提取物)中或以其天然比例使用时。提取物或组合制剂优选包含菠萝蛋白酶,所有菠萝蛋白酶在提取物或组合制剂中的总浓度优选为0.1重量%至80.0重量%,更优选1.0重量%至50.0重量%,特别优选5.0重量%至20.0重量%。
更有利地,提取物或组合制剂包含至少一种木菠萝素类凝集素,该至少一种木菠萝素类凝集素在提取物中的总浓度优选为0.01重量%至50.0重量%,更优选0.1重量%至10.0重量%,特别优选2.0重量%至8.0重量%。
有利地,所有上述实施方案中的菠萝蛋白酶、木菠萝素类凝集素、提取物、组合制剂、菠萝蛋白酶抑制剂、菠萝蛋白酶混合物或糖化的菠萝酶蛋白,其为以下形式或作为以下形式的组分:散剂、颗粒剂、片剂,特别是薄膜片剂、硬胶囊、软胶囊、泡腾片剂、溶液,特别是注射溶液或输注溶液、乳剂、混悬剂、药膏、乳膏、膏剂、凝胶、酊剂、滴眼剂、粉雾剂、鼻喷雾剂、栓剂或透皮贴剂。
同样有利地,在本发明的上述各个方面中,提取物、菠萝蛋白酶、木菠萝素类凝集素、菠萝蛋白酶抑制剂、菠萝蛋白酶混合物或糖化的菠萝酶蛋白经口或口服,通过静脉注射、皮下注射或肌肉注射,通过输注到鼻黏膜、口黏膜或咽黏膜上,通过吸入,通过施用到眼表、直肠,和/或通过透皮贴剂进行施用。
根据本发明各个方面的示例性的实施方案:施用每周一次至每小时一次、优选每天一次至每天10次、特别优选每天1至3次、或连续进行。
根据本发明的主题将参考以下附图和以下实施例更详细地解释,但不限于这里所示的
具体实施方案
图1示出了先前已知的菠萝蛋白酶抑制剂异形体的一级结构和分子量(根据Hatano等人,(2002)Biol.Chem.,Vol.3831151-1156);
图2示出了BBP的强阳离子交换色谱(SEC)洗脱曲线;
图3示出了BBP的尺寸排阻色谱(SCX)纯化曲线;
图4示出了HCov229E测试的示意图;
图5示出了HCoV229E报告病毒筛选中具有抗冠状病毒活性的凝集素;A)至F)将化合物(指定起始浓度)与HCoV229E病毒以1:10的比例预孵育30分钟(表2),然后在靶细胞Huh-7.5-FLuc上连续滴定并孵育48小时。测定了RLuc和FLuc的活性,作为残留感染性和细胞活力的指标。将数据标准化为TBS对照。黑色箭头标记了图6中标准化的1:500稀释或1:2500稀释;
图6示出了HCoV229E报告病毒筛选中具有抗冠状病毒活性的凝集素。将化合物与HCoV229E病毒以1:10的比例预孵育30分钟(表2),然后沿靶细胞滴定。A)HCoV229E病毒复制和细胞活力的值显示为以1:500稀释的(图5中的黑色箭头)相对于TBS对照的标准化值。B)1:2500稀释的标准化表示;
图7示出了HCoV229E报告病毒筛选中具有抗冠状病毒活性的凝集素。将化合物与HCoV229E病毒以1:2的比例预孵育30分钟(表2),然后沿靶细胞滴定。Remdesivir作为阳性对照,DMSO作为阴性对照。A)从1:500稀释开始对凝集素进行剂量作用滴定。左侧示出了HCoV229E病毒的传染性(绝对值),右侧示出了Huh-7.5-FLuc细胞的相应细胞活力(对数值)。B)以1:500稀释或以1:2500稀释(A中的红色矩形)的HCoV229E病毒复制和细胞活力的值显示为相对于BSA对照的标准化值;
图8示出了各种制备的菠萝凝集素批次的示例性UV/VIS光谱;
图9示出了通过形成二阶导数对示例性菠萝凝集素UV/VIS光谱的详细评估。UV/VIS光谱的最大值为280.0nm;显著子带以红色示出;它们对应于芳香族氨基酸Phe、Tyr、和Trp的典型吸收层;
图10示出了代表性的凝集素批次的SDS-PAGE分析。显示如下:泳道1至3:(5.6/11.1/22.2)μg HZI 2-09。泳道4:4.5μl SERVAChrom蛋白质标准III。泳道5至7:(8.9/17.8/35.6)μg HZI 2-10。(T=14%,C=5%;使用样品前用DTT还原并且加入SDS在95℃下加热变性3分钟);
图11示出了菠萝凝集素批次HZI 2-09的RP-HPLC UV色谱。在λ=214nm(蓝色)和λ=280nm(红色)处检测吸收;
图12示出了SARS-CoV-2-刺突蛋白和从菠萝酶A)HZI 2-05、(B)HZI 02-06、C)HZI2-09、D)HZI 2-10、和E)Acm JRL 2分离的不同凝集素批次的表面等离子体共振光谱(SPR)结合动力学和亲和力测试。注入浓度不断增加的配体(最高浓度:A)100μM,B)80μM,C+D)50μM,E)20μM,从51:1稀释开始)进行单循环测量。传感器图显示凝集素与刺突蛋白的结合比解离更快(结合与解离速率)。在不同之间用80%乙二醇再生含有刺突蛋白的表面;
图13示出了表面等离子体共振光谱(SPR)的结合动力学以及ACE-2受体和凝集素HZI2-09的亲和力测试。注入浓度增加的配体(最高浓度:50μM,从5 1:1稀释开始)进行单循环测量;
图14示出了重组SARS-CoV-2刺突(显示在顶部)和用PNGase F消化的重组SARS-CoV-刺突(显示在底部)的去卷积质谱图,以检测糖基化;
图15示出了用于检测重组SARS-CoV-2刺突水解降解和HZI 2-07抑制功能的SDS-PAGE。SARS-CoV-2刺突和菠萝蛋白酶(HTI 2-08)和菠萝蛋白酶抑制剂(HZI 2-07)的物质比例为1:1:1。1)PageRuler预染。矩形标记了约150kDa的完整刺突蛋白;虚线矩形示出了约24kDa的刺突降解产物;
图16示出了用于检测重组SARS-CoV-2刺突水解降解和HZI 2-07对菠萝蛋白酶分离部分HZI 2-08的抑制功能的SDS-PAGE。SARS-CoV-2刺突和菠萝蛋白酶分离部分HZI 2-08和菠萝蛋白酶抑制剂HZI 2-07的物质比例为1:1:1和1:1:10。1)PageRuler预染。矩形标记了约150kDa的完整刺突蛋白;
图17示出了用于检测重组SARS-CoV-2刺突水解降解和HZI 2-07对菠萝蛋白酶分离部分HZI 2-08的抑制功能的SDS-PAGE。SARS-CoV-2刺突和菠萝蛋白酶(HZI 2-08)的物质比例为10:1和100:1,SARS-CoV刺突和菠萝蛋白酶HZI 2-08和菠萝蛋白酶抑制剂HZI 2-07的物质比例是1:1:0.5。1)PageRuler预染。矩形标记了约150kDa的完整刺突蛋白;虚线矩形示出了约24kDa的刺突降解产物;
图18示出了重组SARS-CoV-2刺突的总离子色谱和去卷积质谱,刺突与菠萝蛋白酶分离部分HZI-2-08以100:1的物质比例在37℃孵育了10分钟。箭头标记了约150kDa的完整刺突蛋白;
图19示出了重组SARS-CoV-2刺突的总离子色谱和去卷积质谱,刺突与菠萝蛋白酶分离部分HZI-2-08以100:1的物质比例在37℃孵育了2小时。右侧箭头标记了约150kDa的完整刺突蛋白;左侧箭头显示24kDa的刺突降解产物;
图20示出了重组SARS-CoV-2刺突的总离子色谱和去卷积质谱,刺突与菠萝蛋白酶分离部分HZI-2-08以1:1的物质比例在37℃孵育了2小时。右侧箭头标记了约150kDa的完整刺突蛋白;左侧箭头显示24kDa的刺突降解产物;
图21示出了重组SARS-CoV-2刺突的总离子色谱和去卷积质谱,刺突与菠萝蛋白酶分离部分HZI 2-08以及菠萝酶抑制剂HZI 2-07以1:1:1的物质比例在37℃孵育了2小时。箭头标记了约150kDa的完整刺突蛋白;
图22示出了SDS PAGE凝胶,其中应用了与菠萝酶(原始部分)孵育的重组SARS-CoV-2刺突蛋白;还示出了未使用菠萝酶孵育的SARS-CoV-2刺突蛋白用于比较。SDS-PAGE分析详情:泳道1:2μg凝集素批次HZI 2-09。泳道2:2μg凝集素批次HZI 2-10。泳道4:40μg菠萝酶(Ursapharm)。泳道5至6:1μg重组SARS-CoV-2刺突和0.4μg菠萝酶,在37℃下孵育1小时后(物质比例为蛋白质:蛋白酶约1:1)。泳道7/8:1/1.5μg重组SARS-CoV-2刺突。泳道9:2μg辣根过氧化物酶泳道3/10:3.5μl SERVA三色蛋白标准III。(T=14%,C=5%;使用样品前用DTT还原并且加入SDS在95℃下加热变性并离心3分钟)。
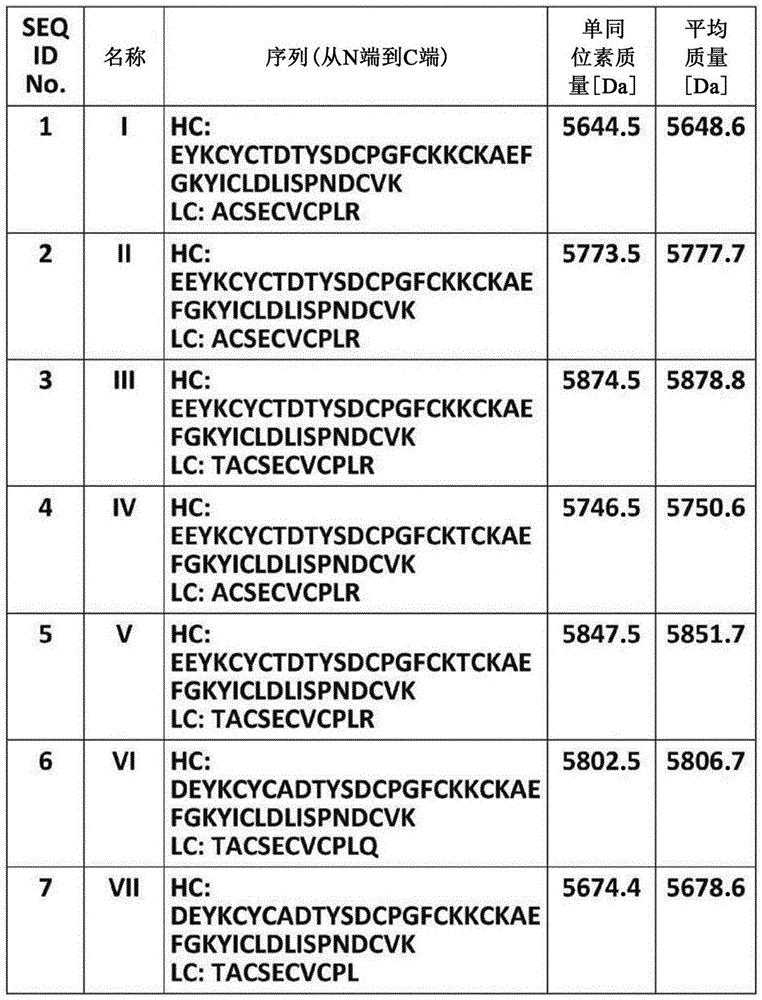
图1以表格形式示出了七种已知菠萝蛋白酶抑制剂I、菠萝蛋白酶抑制剂II、菠萝蛋白酶抑制剂III、菠萝蛋白酶抑制剂IV、菠萝蛋白酶抑制剂V、菠萝蛋白酶抑制剂VI、和菠萝蛋白酶抑制剂VII的一级结构(氨基酸序列)。此外,还分别给出了每种异形体的平均分子质量和单一同位素分子质量,以Dalton为单位。
图2示出了应用于制备级SEC的BBP的洗脱曲线。y轴代表214nm处的吸收强度,而x轴反映洗脱体积。洗脱曲线的第一信号(1)是分子量约为24kDa的BBP组分,其被确定为菠萝蛋白酶。洗脱曲线的第二信号(2)是分子量约为6kDa的BBP组分,其被确定为菠萝蛋白酶抑制剂的混合物。(3)处的两个信号是第二信号(2)的合并分离部分的第一和第二次再次色谱的结果。
图3(a)示出了在强阳离子交换柱(SCX)上纯化BPP的曲线。y轴表示280nm处的吸收信号,而x轴表示洗脱缓冲液的体积。(a)在SCX柱通过物中出现强信号(信号I),即分子明显不与SCX柱结合。可以通过SDS-PAGE和质谱确定这些分子为菠萝蛋白酶抑制剂。在更高体积的洗脱缓冲液和更高离子浓度(线性梯度)下,出现另一个信号(信号II)。SDS-PAGE和质谱证实了该信号处的分子是菠萝蛋白酶。(b)在与第一次运行相同的条件下,使用相同的SCX柱对第一信号(信号I)的合并分离部分(即第一次色谱的通过物)进行再次色谱,结果表明第二信号(峰II)不再出现。因此,代表第二信号的菠萝蛋白酶可以与菠萝蛋白酶抑制剂分离。
实施例1
菠萝酶对α冠状病毒HCoV229E有效性的检测
1.样品制备
将菠萝酶溶于pH为7.3(10mg/ml)的TRIS缓冲盐水溶液(TBS)中。将干燥的物质(HZI2-01至-03)溶解在TBS缓冲液中。将悬浮液短暂离心以使不溶性组分形成颗粒。样品HZI2-01和HZI 2-02不可溶,不用于进一步测试。将HZI 2-07悬浮于200mM NaCl、20mMTRIS、pH8.0的溶液中。
/>
表1几乎所有使用的样品。
表1
/>
MMTS:甲基硫代磺酸甲酯;RP-HPLC:反相高效液相色谱;
TBS:TRIS缓冲盐水溶液(pH7.3)
2.菠萝蛋白酶、分离部分、和凝集素对HCoV229E的体外抗病毒活性试验的实施
将菠萝酶和凝集素溶解在TBS中。将悬浮液短暂离心以使不溶性组分形成颗粒。萤火虫荧光素酶表达的Huh 7.5FLuc细胞在DMEM培养基(Gbico#41965-039)+10%胎牛血清(FCS)+1%青霉素/链霉素+1%L-谷氨酰胺+2%非必需氨基酸(=DMEM完全培养基)+5mg/ml杀稻瘟素中培养。实验前24小时将2x10
将含有海肾荧光素酶(RLuc)的α冠状病毒HCoV229E与化合物在室温下以10:1的比例(90μl病毒+10μl化合物)预孵育30分钟。用于所有实验的病毒储备溶液的滴定度为3.41x10
以1:2的比例(10μl病毒+10μl化合物)进行预孵育,以进行进一步的实验。萤火虫荧光素酶表达的Huh 7.5FLuc细胞在播种一天后,在指定浓度的化合物存在下,用HCoV229E感染[细胞的连续滴定(1:5)]。根据原始样品中的起始浓度,病毒起始稀释度为1:500,并在表2中显示。储备浓度为10mg/ml的菠萝酶样品的规格与HZI 2-03样品类似,没有单独列出。
/>
在接种以及在33℃和5%的CO
3.菠萝蛋白、分离部分、和凝集素对HCoV229E的体外抗病毒活性试验的结果
菠萝酶和凝集素批次首先使用对HCoV229E感染具有高渗透性的Huh-7.5-FLuc细胞由HCoV229E海肾荧光素酶报告病毒(α冠状病毒)进行测试。这些细胞被设计成表达萤火虫荧光素酶报告基因,从而可以在双荧光素酶报告分析中评估细胞活力。所有的凝集素样品都是由来自菠萝酶的不同凝集素分离物组成的。样品HZI 2-01和2-02由于不溶于水而没有使用。2mg/ml或10mg/ml的菠萝蛋白酶用作对照。
能够证明,菠萝酶和凝集素对HCoV229E报告病毒显示出有希望的抗病毒活性(图5)。
高浓度的菠萝酶(图5E和图5F)导致细胞活力小。在100%的细胞活力下(虚线表示的),可以观察到菠萝酶的α冠状病毒HCoV229E的病毒复制减少约50%(圆点)。黑色箭头标志着在图6中施用用的标准化的1:500稀释液或1:2500稀释液;1:2500稀释液由于化合物浓度降低而显示出较小的细胞毒性,从而可以更好地证明任何出现的抗病毒作用,从而也可以提高细胞活力。
根据样品Acm-JR 1和HZI 2-05中约100%细胞活力的结果标准化,也可以在1:500稀释度下识别出减少约25%的病毒复制。HZI 2-03显示出病毒复制约20%的减少,而HZI2-04没有活性。菠萝酶在两种浓度(2mg/ml和10mg/ml)下都伴随着细胞活力的极大降低,因此不能得出病毒复制减少的有效结论。细胞活力的降低主要是由菠萝酶的活性引起的,由此发生细胞与孔基的分离。随后的荧光素酶分析只包括黏附的细胞,而不能区分漂浮在培养基中的死细胞和活细胞,因此出现了细胞存活率的错误结果。
在所有凝集素的1:2500稀释液中,在大约100%的细胞活力下,可以确认病毒的复制减少了大约20%至25%。菠萝酶在2mg/ml的储存浓度下,细胞活力>100%时甚至显示出大约45%至50%的减少。只有储存浓度为10mg/ml的高浓度菠萝酶显示出减少的细胞活力,因此不能得出病毒复制减少的有效结论。然而,这里也可以记录到病毒复制的下降。
这些结果应在进一步的试验中由凝集素来证实。此外,在预孵育中使用更高的物质与病毒比例(1:2而不是1:10)应能放大抗病毒作用。滴定1:500的起始浓度被进一步设定为与第一批试点试验相对应。实验中使用了样品Acm-JRL 1、HZI 2-03、和HZI 2-05。Remdesivir(1μM在TBS中)、DMSO(1:40在TBS中)、和BSA(5mg/ml在TBS中)作为对照(图7A)。
阳性对照remdesivir带来的是病毒复制的完全减少。在1:500的稀释度下,凝集素Acm-JRL 1和HZI 2-05对HCoV229E报告病毒显示出适度的抗病毒作用(图7B),而HZI 2-03没有抗病毒作用。样品Acm-JRL 1和HZI 2-05在>100%的细胞活力下显示出HCoV229E病毒复制减少约25%。如果以1:2500的稀释度来看,样品HZI 2-05在>100%的细胞活力下示出了病毒复制减少50%至60%。
前述的试验结果在这次试验中得到了证实。更高浓度的凝集素可以进一步减少HZI 2-05样品中的病毒复制[比例1:2大约减少50%至60%,而1:10大约减少20%HCoV229E的复制(如图6B所示)]。
可以证明,在体外试验中可以防止HCoV229E的感染。
实施例2
样品HZI 2-09和HZI 2-05的分离
将1200mg菠萝酶(Merck,订单号:1.01651,批号:K38171251719)以40mg/ml的浓度溶于30ml缓冲液A(50mM TRIS,500mM NaCl,pH 7.2),并在9000g下离心15分钟。将该溶液的5ml等分试样以大约2ml/分钟的流速装入先前用缓冲液A平衡过的尺寸为10mm×50mm的D-甘露糖色谱柱(填充体积4ml)。用至少25CV(“柱体积”)冲洗柱,直到再次达到原始基线或获得恒定的基线。现在通过切换到缓冲液B(50mM TRIS,500mM NaCl,1MD-甘露糖,pH7.2)来洗脱菠萝凝集素,收集分离部分。重复多次例如5次这种5ml等分样品的使用。洗脱并收集的分离部分被汇集在一起,并装入MWCO 3.5kDa的渗析管中。一个洗脱的分离部分的量约为7ml。在稳定的搅拌下,在室温下或在4℃下用2升缓冲液C(50mM TRIS,150mM NaCl,pH7.2)进行渗析,多次更换缓冲液,直到渗析的甘露糖浓度达到≤1mM。渗析后通过离心或过滤分离絮凝物。通过MWCO 5kDA或小于5kDA的超滤膜将多余的量减少到更小的体积,这样渗析后的原始蛋白质浓度就会增加至数倍。蛋白质浓度可以通过280nm处的UV吸收以第一近似值计算,例如根据www.uniprot.org通过理论计算的菠萝凝集素的摩尔消光系数,这里就是这样做的。图8示出了示例批次的典型UV/VIS光谱,图9示出了通过形成二阶导数的详细评估。
图10显示的是示例性菠萝凝集素批次通过SDS-PAGE电泳分析的结果。这两批样品示出了一条大约15kDa的主带和多条子带;这些子带尤其可以通过第3泳道和第7泳道的重凝胶过载来识别。
图11示出了一个代表性批次的RP-HPLC分析;通过LC-MS耦合和通过去卷积计算,确定主要质量1为15388Da(约15.38kDa)。此外,还可以测量到+162Da的种类,表示糖化的蛋白质,见Gross等人(2020)J.Pharm.Biomed.Anal.181,113075。
实施例3
菠萝酶与SARS CoV-2病毒的刺突蛋白的结合检验
1.样品制备
1.1SARS-CoV-2刺突蛋白的克隆、表达、和纯化
SARS-CoV-2刺突蛋白(1-1213)的细胞外结构域的核苷酸序列是从Eurofins MWG获得的合成基因。该基因通过PCR方法扩增,并提供了限制性接口5′-BamHI/XhoI-3′。随后在真核表达载体pCAGGS中通过T4 DNA连接酶的黏性末端克隆将该基因连接起来(BamHI再次连接)。刺突蛋白的表达是在HEK293细胞中进行的。为此,HEK293细胞在超滤器(生长面积1720cm2)中培养,在DMEM complete(37℃,5%CO
将培养物上清液应用于5ml GHisTrap HP柱,以纯化SARS-CoV-2刺突蛋白。用裂解缓冲液(200mM NaCl,20mM TRIS,pH8.0,20mM咪唑)彻底洗涤后,用洗脱缓冲液(200mMNaCl,20mM TRIS pH8.0,500mM咪唑)洗脱蛋白质。随后通过HiLoad 16/600Superdex 200PG进一步分离获得的蛋白质,并以60ml至70ml的洗脱体积收集峰值。
1.2SPR结合和亲和力测试
凝集素的结合动力学和亲和力测试是在Biacore X100系统(GE Healthcare)上进行的。刺突蛋白(1-1213)的纯化的细胞外结构域和ACE-2受体(Sigmal Aldrich,#SAE0064)的纯化的细胞外结构域通过10mM乙酸钠缓冲液(pH4.5)中的氨基耦连被共价固定在CM5传感器芯片上,最终刺突蛋白为9600,ACE-2受体为4000。在1x HBS-EP(150mM NaCl,10mMHEPES pH 7.4,3mM EDTA,0.005%吐温20)中以30μl/分钟的流速进行表面等离子体共振(SPR)测定。注入浓度升高的凝集素(1.25μM至20μM)进行单周期测量(接触时间120s,解离时间180s)。
1.3SARS-CoV-2SDS-PAGE和LC-MS分析
用酶催化地证明重组获得的刺突的糖基化:20μg SARS-CoV-2刺突在200mM NaCl,20mM TRIS,pH8.0的溶液中。用2μl(1000IU)PNGAse F进行缓冲,并按照New England
将样品与SDS染料(1.2g SDS,6mg溴酚蓝,4ml甘油,0.6ml 1M TRIS,pH8.0,5.4mlH
用于LC-MC分析的样品提取:样品立即冷冻在液氮中,储存在-80℃,并在LC-MS测量前在冰上解冻几分钟。
10μl准备好的样品装载于含有12体积%聚丙烯酰胺部分的SDS-PAGE。装入6μl“PageRuler预染蛋白梯”(Thermo Fisher Scientific)以监测SDS-PAGE的进展,并估计凝胶染色后分离的蛋白质的大致量。电泳是在“
直接的完整蛋白质UPLC-ESI-MS分析是在UltiMate 3000UPLC系统上进行的,该系统与带有Apollo II ESI源的MaXis4G Q-ToF质谱仪相连。测量是在正向模式下进行的。样品通过Aeris Widepore XB-C8柱(3.6μm,150x2.1mm;Phenomenex)分离。分离以0.3ml/分钟的流速(洗脱液A:去离子水加0.1体积%的醋酸,洗脱液B:蒸馏乙腈加0.1体积%的醋酸),在45℃下以2%B的梯度进行30秒,然后在10分钟内线性梯度到75%B,再在3分钟内保持75%B进行。在进入离子源之前,流速被调节到75μl/分钟。质谱在2Hz、150m/z至2500m/z的质心模式下产生。质谱离子源的参数设置为:500V的端板偏移,4000V的毛细管电压,1.1巴的雾化器气体压力,6升/分钟的干气流量,180℃的干燥温度。蛋白质的质量通过总离子色谱仪从保留时间段6.5分钟到9分钟,对带有和不带有菠萝酶抑制剂(HZI 2-07)的菠萝蛋白酶分离部分(HZI 2-08)检测进行汇总,以证明7.0分钟至7.6分钟的糖基化,并以仪器分辨率为8000的最大熵去卷积算法在高分辨率下用Compass Data Analysis对自然质量去卷积。
2.结果
2.1.SARS-CoV-2刺突蛋白结合分析
SARS-Co-2刺突蛋白的结合分析是借助SPR在体外对从菠萝酶中不同地分离出来的凝集素进行的。为此,纯化的SARS-CoV-2刺突蛋白通过氨基偶联固定在CM5芯片上。随后测试了与木菠萝素类凝集素的结合;确定了它们的解离常数和结合动力学。在这方面,观察到了不同的结合特性和结合速率/解离速率,这将在下文中更详细地展示。
通过SPR技术对不同批次的菠萝蛋白酶分离出的凝集素(HZI 2-05、HZI 2-06、HZI2-09、HZI 2-10、和Acm-JRL 2)在结合分析中的特性进行了研究。在这方面,能够确定这些批次的细微差别,首先是结合速率和解离速率的变化。这里能够观察到,HZI 2-09和Acm-JRL 2的结合凝集素从刺突蛋白中解离的速度比能够测量的结合速度要慢,因此芯片上的测量值以恒定的速度增加。图12中示出了不同批次凝集素的测量值与时间的关系。在各次测量之间,用80%乙二醇对含有结合的刺突蛋白的表面进行再生。
结合动力学和亲和力测试的SPR分析的传感图显示了SARS-CoV2刺突蛋白和从菠萝蛋白酶中分离的不同凝集素批次(HZI 2-05、HZI 2-06、HZI 2-09、HZI 2-10、Acm-JRL 2)的浓度增加。使用Biacore X100软件计算了K
表3SARS-CoV2刺突蛋白和从菠萝蛋白酶中分离出来的不同凝集素批次的表面等离子体共振光谱(SPR)的结合动力学和亲和力测试。以下示出了用Biacore X100软件计算的数值。
在进一步的试验中,进行了SPR分析,用于分析凝集素在ACE-2受体上的结合动力学和亲和力测试(图13)。为此,使用的凝集素的浓度为3.125μM至50μM。
图13示出了浓度增加的ACE-2受体和凝集素批次HTI 2-9的结合动力学和亲和力测试的SPR分析的传感器图。从感应图中可以得出结论,解离常数为100μM或大于100μM。此外,还示出了与结合速率/解离速率有关的不同结合特征。
K
2.2SARS-CoV-2刺突SDS-PAGE和LC-MS分析
通过LC-MS分析,证明了刺突蛋白的糖基化。图14示出了去卷积质谱。PNGase F从糖蛋白中去除N结合的寡糖。在这方面,分裂发生在寡糖的最内层GlC-NAc和天冬酰胺残基之间。在用PNGase F消化重组SARS-CoV-2刺突蛋白后,可以在质谱图中识别出质量变化,这是由刺突蛋白中的寡糖损失引发的。
SDS-PAGE和液相色谱及质谱联用,用于分析证明菠萝蛋白酶分离部分HZI 2-08的蛋白水解活性和从菠萝酶中获得的肽HZI 2-07的抑制功能。重组SARS-CoV2刺突的片段化和HZI 2-07的抑制功能能够通过SDS-PAGE证明(图15至图17)。质谱和由此解卷积的中性质量同样可以证明该片段化(图18至图21)。
图15中的第2泳道至第7泳道可以看出SARS-CoV-2刺突蛋白被蛋白酶(HTI 2-08)蛋白水解降解的情况。不能证明完整的刺突蛋白的主要分子量约为150kDa。然而,主要的降解产物的分子量可以被识别于大约24kDa(图15的虚线矩形)。加入HZI 2-07(=抑制剂)后,抑制功能变得明显-刺突蛋白的降解被抑制了。这导致在第8泳道至第10泳道出现大约150kDa的条带(图15中的矩形)。
抑制剂对蛋白酶(HZI 2-08)的抑制作用在较长的试验时间段内保持不变;试验进行最多120分钟。这可以在图16中用矩形标记的完整的刺突蛋白处确认。
图17示出了刺突蛋白的蛋白水解降解动力学。在刺突与蛋白比例为10:1的情况下,经过10分钟的培养,可以发现一条大约150kDa的明显条带(第2行),这表明完整的刺突蛋白。经过120分钟的长时间孵育(第5行),可以看出该条带已经基本消失,片段化程度增加。在比例为100:1时(泳道3和泳道6),情况并非如此。在120分钟的孵育后,这里也可以看到完整的蛋白质,这表明蛋白酶HZI 2-08的作用不足。因此,刺突与蛋白酶的最佳比例为1:1,其结果如图15和图16所示。可以进一步得出结论,1:1:0.5的比例(刺突:蛋白酶:抑制剂)是不利的,因为刺突的降解不能被抑制。1:1:1的比例在这里是最合适的(图16)。
图18示出了SARS-CoV-2刺突蛋白的总离子色谱(TIC)和质谱。加入蛋白酶(HZI 2-08;刺突与蛋白酶比例为100:1)后,10分钟后在150kDa处不能显示质量峰(箭头)。出现的片段表明在加入蛋白酶后刺突蛋白的有效降解。这证实了已经通过SDS-PAGE的方式表示的结果(图15)。
与蛋白酶(HZI 2-08;刺突:蛋白酶比例为100:1)孵育120分钟后,在150kDa处也没有质量峰(右箭头,图19)。这表明在至少120分钟的时间内,蛋白酶的蛋白水解作用保持不变。此外,现在在m/z 24392处可以看到一个质量峰,它代表了刺突蛋白的主要降解产物。这证实了已经通过SDS-PAGE的方式表示的结果(图15)。
图17中,蛋白酶(HZI 2-08)的蛋白水解作用再次变得清晰。这里出现了与蛋白酶的比例为1:1的刺突:孵育120分钟后,降解产物的峰值(左箭头)非常明显。
加入抑制剂HZI 2-07后,完整的刺突蛋白在m/z 145196处变得可见(图21)。不能检测到24kDa的降解产物。这证实了图15的结果,其中已经能够证明抑制剂抑制了蛋白酶(HZI2-08)。因此,刺突蛋白不能被降解。
图22示出了重组SARS-CoV-2刺突蛋白在37℃下用菠萝酶基粉消化1小时后的SDS-PAGE分析(材料量比例为蛋白质:蛋白酶约1:1,泳道5和泳道6)。未与菠萝蛋白酶孵育的SARS-CoV-2刺突蛋白也被显示出来以进行比较。(泳道7和泳道8)。结果表明,菠萝酶基粉也能够消化刺突蛋白。
因此能够证明,菠萝酶能与冠状病毒的刺突蛋白结合,而且菠萝酶中含有的凝集素(占菠萝酶总量的5%)既能与刺突蛋白结合,也能与甘露糖结合,但不能以类似的K
