鉴别湿加松营养生长不同时期的标记基因Pt7G61650及其应用方法
文献发布时间:2024-04-18 19:53:33
技术领域
本发明属于分子生物学检测技术领域,具体涉及一种鉴别湿加松营养生长不同时期的标记基因Pt7G61650及其应用方法。
背景技术
松树是世界上最重要的工业用材树种之一,在我国南方,湿加松(Pinuselliottii×P.caribaea)是重要的经济林和人工林松树树种。自上世纪90年代起,广东省开始了湿加松育种和无性系选育工作,湿加松以湿地松(P.elliottii)为母本,加勒比松(P.caribaea)为父本,具有生长快、分枝及干型良好、耐性及抗病虫能力强等优点,在澳大利亚及美洲多国作为速生丰产林被广泛种植。
高等植物在种子萌发后需要经历营养生长阶段(vegetative stage)和生殖生长阶段(reproductive stage),当植物在营养生长到一定时期后,才能开花、结实而进入生殖阶段,营养生长阶段进一步可分为两个不同的时期,即幼年期(juvenility)和成年期(adult stage),在林业生产实践中,湿加松需要以幼年期的枝条为材料进行无性系造林,才能使繁殖后代成活并保持良好的长势;而在专营林的生产时需要进入生殖阶段的材料。然而,长期以来确定树木尤其是松树从幼年期向成年期转变的时间存在诸多困难,一直无法活体检定,因此,利用分子生物学检测技术,在活体状态下准确鉴别松树植株甚至所选枝条所处的发育时期对于提高林业生产效率至关重要。
发明内容
有鉴于此,本发明的目的在于鉴别湿加松营养生长不同时期的标记基因Pt7G61650及其应用方法,所述基因可用于鉴别湿加松营养生长不同时期,为林业生产和林分管理提供指导。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种鉴别湿加松营养生长不同时期的标记基因Pt7G61650,所述标记基因Pt7G61650的核苷酸序列如SEQ ID NO.1所示。
优选的,所述湿加松营养生长不同时期包括营养生长幼年期和营养生长成年期;
湿加松处于营养生长幼年期时,树木无开花或维持开花的能力,枝条的顶端分生组织无有性生殖能力,枝条具有较强的不定根发生能力,适合用于扦插等无性繁殖;
湿加松处于营养生长成年期时,树木获得了开花的能力或潜力,枝条的顶端分生组织失去营养状态,枝条失去不定根发生能力,适合用于性状选优、材性测定等。
本发明还提供了上述标记基因Pt7G61650在鉴别湿加松营养生长不同时期中的应用。
本发明还提供了一种鉴别湿加松营养生长不同时期的方法,包括以下步骤:提取湿加松待测组织和对照样品的总RNA,反转录后,分别测定上述标记基因Pt7G61650的表达量;
如对照样品为0.5~5年实生湿加松的样品时:当待测组织样品标记基因Pt7G61650的表达量无显著差异,则所述待测组织处于营养生长幼年期;当待测组织样品标记基因Pt7G61650的表达量大于对照样品表达量的2倍,则所述待测组织处于营养生长成年期。
如对照样品为大于6.5年实生湿加松的样品时:当待测组织样品标记基因Pt7G61650的表达量为对照样品表达量的二分之一以内,则所述待测组织处于营养生长幼年期;当待测组织样品标记基因Pt7G61650的表达量与对照样品表达量无显著差异,则所述待测组织处于营养生长成年期。
优选的,测定表达量所用的引物包括上游引物和下游引物,所述上游引物的核苷酸序列如SEQ ID NO.2所示,所述下游引物的核苷酸序列如SEQ ID NO.3所示。
优选的,所述对照样品包括营养生长幼年期对照样品和营养生长成年期对照样品。
优选的,所述对照样品包括0.5~5年生湿加松最下层枝条中距末梢10cm~12cm处的嫩茎。
优选的,所述对照样品包括10年生湿加松最下层枝条中距末梢10cm~12cm处的嫩茎。
优选的,测定表达量时还包括内参Pt18S,所述内参Pt18S的引物对核苷酸序列如SEQ ID NO.4和SEQ ID NO.5所示。
优选的,利用qRT-PCR测定表达量,所述qRT-PCR的程序包括:95℃2min预变性;94℃5s、60℃30s,39个循环的PCR反应;65~95℃每5s增加0.5℃的熔解曲线分析。
本发明还提供了一种鉴别湿加松营养生长不同时期的试剂盒,包括针对上述标记基因Pt7G61650设计的特异性引物对,所述特异性引物对包括上游引物和下游引物,所述上游引物的核苷酸序列如SEQ ID NO.2所示,所述下游引物的核苷酸序列如SEQ ID NO.3所示。
有益效果:本发明提供了一种鉴别湿加松营养生长不同时期的标记基因Pt7G61650,利用Pt7G61650基因可鉴别湿加松营养生长不同时期,该基因的序列如SEQ IDNO.1所示。本发明通过对树木组织的微量取材,通过qRT-PCR技术分析Pt7G61650基因在湿加松组织中的表达量,高效、精准地鉴别湿加松植株甚至所选枝条所处的营养生长不同时期(即幼年期或成年期),为林业生产和林分管理提供指导。
附图说明
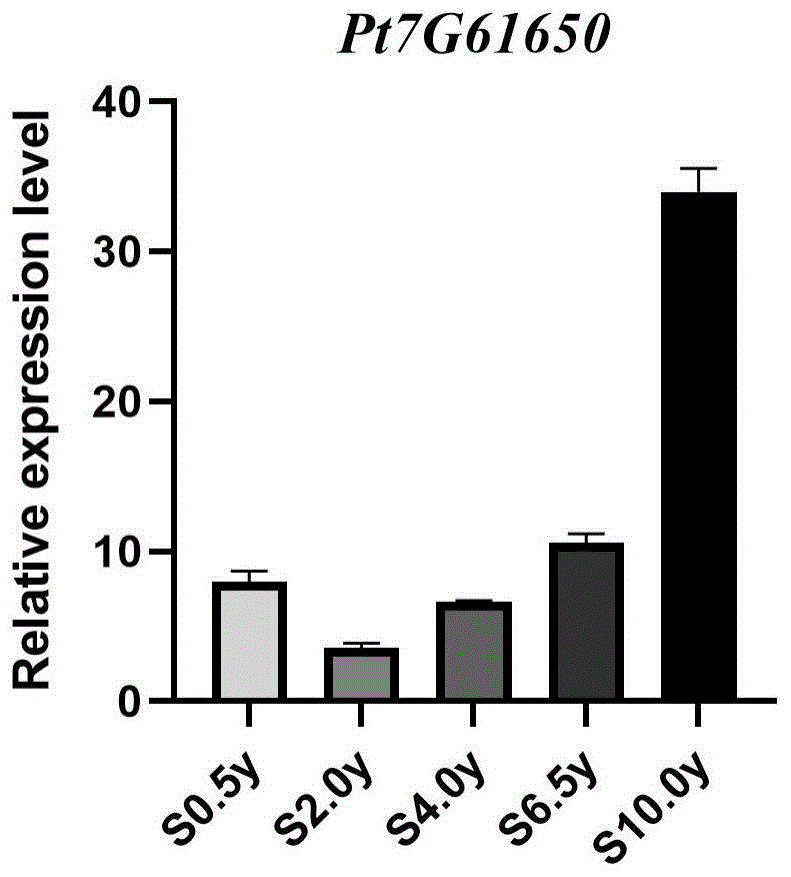
图1为0.5年、2年、4年、6.5年、10年生湿加松最下层枝条中Pt7G61650基因表达量;
图2为待测样品与对照样品中Pt7G61650基因表达量。
具体实施方式
本发明提供了一种鉴别湿加松营养生长不同时期的标记基因Pt7G61650,所述标记基因Pt7G61650的核苷酸序列如SEQ ID NO.1所示。
本发明所述标记基因Pt7G61650的优选来源于湿加松,且所述标记基因Pt7G61650在湿加松的营养生长不同时期,表达量表现出极显著差异,因此可将其用于鉴别营养生长幼年期和营养生长成年期。在本发明中,所述营养生长幼年期为:树木处于该时期时,无开花或维持开花的能力,枝条的顶端分生组织无有性生殖能力,枝条具有较强的不定根发生能力,适合用于扦插等无性繁殖;所述营养生长成年期为:树木处于该时期时,获得了开花的能力或潜力,枝条的顶端分生组织失去营养状态,枝条失去不定根发生能力,适合用于性状选优、材性测定等。在生产实践及相关研究中,大多数处于营养生长幼年期的针叶树树龄小于6.5年,大多数处于营养生长成年期的针叶树树龄大于6.5年。本发明实施例1中步骤3)对此进行了实验验证。
本发明还提供了上述标记基因Pt7G61650在鉴别湿加松营养生长不同时期中的应用。
本发明还提供了一种鉴别湿加松营养生长不同时期段的方法,包括以下步骤:提取湿加松待测组织和对照样品的总RNA,反转录后,分别测定上述标记基因Pt7G61650的表达量;
如对照样品为0.5~5年实生湿加松的样品时:当待测组织样品标记基因Pt7G61650的表达量无显著差异,则所述待测组织处于营养生长幼年期;当待测组织样品标记基因Pt7G61650的表达量大于对照样品表达量的2倍,则所述待测组织处于营养生长成年期。
如对照样品为大于6.5年实生湿加松的样品时:当待测组织样品标记基因Pt7G61650的表达量为对照样品表达量的二分之一以内,则所述待测组织处于营养生长幼年期;当待测组织样品标记基因Pt7G61650的表达量与对照样品表达量无显著差异,则所述待测组织处于营养生长成年期。
本发明对所述RNA的提取方法并没有特殊限定,优选利用Trizol法提取样品的总RNA,且在提取组织或样品的RNA时,根据样品的可提取量进行取样,最终提取总RNA可应用于qRT-PCR即可。本发明所述待测组织优选包括不同湿加松或同一湿加松的不同位置的枝条,因此基于本发明所述方法,可鉴别不同湿加松的营养生长不同时期,甚至可用于鉴别同一棵树不同部位的营养生长不同时期,具体包括湿加松针叶、枝条、形成层等器官或组织的营养生长不同时期等。
本发明所述对照样品优选包括已知树龄且处于营养生长幼年期的湿加松,以及已知树龄且处于营养生长成年期的湿加松;其中营养生长幼年期的对照样品更优选取材自0.5~5年生湿加松最下层枝条中距末梢10cm~12cm处的嫩茎,营养生长成年期的对照样品更优选取材自10年生湿加松最下层枝条中距末梢10cm~12cm处的嫩茎。
本发明分别对提取自待测组织和对照样品的总RNA进行反转录,本发明对所述反转录的方法并没有特殊限定,利用本领域的常规试剂盒进行反转录即可。本发明以反转录得到的cDNA为模板,采用qRT-PCR的方法测定所述标记基因Pt7G61650的表达量,测定表达量所用的引物优选包括上游引物和下游引物,所述上游引物的核苷酸序列优选如SEQ IDNO.2所示,所述下游引物的核苷酸序列优选如SEQ ID NO.3所示。本发明在测定表达量时,优选还包括内参Pt18S,所述内参Pt18S的引物对核苷酸序列优选如SEQ ID NO.4所示:CGGCTACCACATCCAAGGAA,和SEQ ID NO.5所示:GCTGGAATTACCGCGGCT。
本发明利用qRT-PCR测定表达量,所述qRT-PCR的优选采用两步法进行反应,其程序优选设计为:95℃2min预变性;94℃5s、60℃30s,39个循环的PCR反应;65~95℃每5s增加0.5℃的熔解曲线分析反应。本发明所述表达量优选为基于2
本发明还提供了一种鉴别湿加松营养生长不同时期的试剂盒,包括针对上述标记基因Pt7G61650设计的特异性引物对,所述特异性引物对包括上游引物和下游引物,所述上游引物的核苷酸序列如SEQ ID NO.2所示,所述下游引物的核苷酸序列如SEQ ID NO.3所示。
本发明所述试剂盒中优选还包括Pt18S,以及进行qRT-PCR的其他常规试剂,如TransStart Top Green qPCR SuperMix和RNase-Free Water。
下面结合实施例对本发明提供的鉴别湿加松营养生长不同时期的标记基因Pt7G61650及其应用方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
1)参考样品采集
于广东省台山市红岭种子园(112°49′N,22°9′W)采集0.5年、2年、4年、6.5年、10年树龄的湿加松的最下层末梢枝条,将所采枝条距末梢10cm~12cm的嫩茎段作为样品材料,在采集后均立即用液氮速冻,并于-80℃超低温冰箱中保存。
2)参考样品转录组测序及分析
通过Trizol法提取参考样品的总RNA,经过质检后使用NEB#7530试剂盒(#E7530,New England Biolabs)进行转录组文库构建,在文库质检合格后,送至广州基迪奥生物科技有限公司,在Illumina nova-6000平台上进行高通量测序。
以湿加松的近缘物种油松(Pinus tabuliformis)的高质量基因组Chinese pinegenome(https://www.ncbi.nlm.nih.gov/bioproject/PRJNA784915)作为参考基因组,以TPM(Transcript per million)的归一方法表征Pt7G61650基因的表达量,并实现数据可视化(图1)。
3)对照样品年龄区间设定
如图1所示,处于幼年期的0.5年、2年、4年、6.5年树龄的湿加松样品中,Pt7G61650基因在3个生物学重复样品中的TPM平均值依次为165.1、99.5、110.4、125.1,而处于成年期的10年树龄的湿加松样品中,Pt7G61650基因在3个生物学重复样品中的TPM平均值为547.7。该结果反映出Pt7G61650基因的表达量在营养生长幼年期和营养生长成年期湿加松中差异极显著,该基因能够有效反映并鉴别湿加松所处的营养生长不同时期,故0.5~6.5年树龄的湿加松最下层枝条均可作为营养生长幼年期的对照样品,10年树龄的湿加松最下层枝条可作为营养生长成年期的对照样品。
4)引物设计
根据年龄标记基因PtAP2L3的CDS序列,利用NCBI的在线引物设计网站Primer-BLAST进行引物设计,引物序列为SEQ ID NO.2及SEQ ID NO.3。
5)被测样品及对照样品采集
采集人工林中湿加松较高冠层的枝条,取距末梢10cm~12cm的嫩茎段为被测样品;同时,采集已知树龄的10年生湿加松的最下层枝条,取距末梢10cm~12cm的嫩茎段作为对照样品材料。上述材料在采集后均立即用液氮速冻,并于-80℃超低温冰箱中保存。
6)被测样品及对照样品总RNA的提取
应用天根生化科技(北京)有限公司RNAprep Pure多糖多酚植物总RNA提取试剂盒(DP441)提取步骤5)采集的被测样品及对照样品的总RNA。RNA浓度和完整性分别用Nano微量分光光度计和1%琼脂糖凝胶电泳测定。
7)被测样品及对照样品总RNA的反转录
在RNase free PCR管中,完成步骤6)中获得的总RNA的反转录反应,并去除基因组DNA。按照表1配制反转录体系,将配制好的体系轻轻混匀,于PCR仪中42℃孵育15min,之后85℃加热5s使RT/RI Enzyme和gDNA Remover彻底失活,产物保存在-20℃。
表1反转录体系
8)Pt7G61650基因的实时荧光定量PCR(qRT-PCR)检测
将步骤7)中反转录生成的cDNA稀释70倍后作为模板,按照表2所述qRT-PCR反应体系和反应条件进行qRT-PCR实验,采用SYBR Green嵌合荧光法进行反应,预变性反应程序设置为95℃2min,PCR反应程序设置为94℃5s、60℃30s,39个循环;熔解曲线分析反应程序设置为65~95℃每5s增加0.5℃。每个样品进行3次技术重复和3次生物学重复,每板样品加入独立的内参Pt18S。
最终获得被测样品及对照样品中Pt7G61650基因的表达量(图2)。
表2 qRT-PCR反应体系
9)被测样品营养生长不同时期鉴别
根据被测样品及对照样品实时荧光定量PCR后Pt7G61650基因的表达量判断被测样品的营养生长不同时期,结果如图2所示。对照样品为10年生、处于营养生长成年期的样品,待测样品中Pt7G61650基因的表达量小于对照样品表达量的二分之一,因此,待测样品所处的营养生长时期为营养生长幼年期。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
