抗菌肽TC-LAR-18及其在制备抗细菌感染药物中的应用
文献发布时间:2024-01-17 01:28:27
技术领域
本发明涉及抗菌肽技术领域,特别是涉及抗菌肽TC-LAR-18及其在制备抗细菌感染药物中的应用。
背景技术
由于抗生素、抗菌药物的大量使用或滥用,导致细菌对抗生素的耐药性越来越强,催生了大量的“超级细菌”,如广泛耐药的鲍曼不动杆菌(Acinetobacter baumannii)及金黄色葡萄球菌(Staphylococcus aureus)等。为了应对全球日益严重的抗生素耐药问题,避免无有效抗生素使用的后抗生素时代的到来,急需开发新型的抗菌药物分子。
抗菌肽是一类具有抗菌活性的多肽类小分子,表现出良好且广谱的抗菌活性。由于抗菌肽具有分子量小、热稳定性强、水溶性好、无免疫原性、不易产生耐药性、抗菌谱广等特点使其成为了最优的抗生素替代分子。Cathelicidins家族抗菌肽是脊椎动物特有的一个重要抗菌肽家族,该家族抗菌肽往往具有广谱抗菌,免疫调节等功能。双亲性α螺旋结构是抗菌肽发挥抗菌作用的重要的基础,多数Cathelicidins家族抗菌肽成熟肽部分往往包含α螺旋结构,该结构也是该家族抗菌肽能够杀菌的重要结构基础。但天然抗菌肽序列相对较长,合成成本偏高。
发明内容
为了解决上述问题,本发明提供了抗菌肽TC-LAR-18及其在制备抗细菌感染药物中的应用。本发明的抗菌肽TC-LAR-18仅包含18个氨基酸,且所有氨基酸均为L型氨基酸,大幅降低了生成成本。
为了实现上述目的,本发明提供如下技术方案:
本发明提供了一种抗菌肽TC-LAR-18,氨基酸序列如SEQ ID NO.1所示。
优选的,所述抗菌肽TC-LAR-18的碳端进行酰胺化修饰。
本发明还提供了上述技术方案所述的抗菌肽TC-LAR-18在制备抗细菌感染药物中的应用。
优选的,所述细菌包括革兰氏阴性菌和/或革兰氏阳性菌。
优选的,所述革兰氏阴性菌包括鲍曼不动杆菌(Acinetobacter baumannii)、绿脓杆菌(Pseudomonas aeruginosa)和大肠杆菌中(Escherichia coli)的一种或多种。
优选的,所述革兰氏阳性菌包括金黄色葡萄球菌(Staphylococcus aureus)。
本发明还提供了一种抗细菌感染药物,所述抗细菌感染药物的有效成分包括上述技术方案所述的抗菌肽TC-LAR-18。
优选的,所述抗菌肽TC-LAR-18的最小抑菌浓度为2.34~4.69μg/mL。
有益效果:
本发明提供了一种抗菌肽TC-LAR-18,氨基酸序列如SEQ ID NO.1所示。本发明提供的抗菌肽TC-LAR-18是可以形成双亲性α螺旋结构的多肽,可以靶向破坏细菌细胞膜发挥杀菌作用,具有广谱抗菌活性,无细胞毒性和溶血作用;所述抗菌肽TC-LAR-18仅包含18个氨基酸,且所有氨基酸均为L型氨基酸,可以大幅降低生成成本,有望成为新型广谱性抗菌候选药物,在抗“超级细菌”方面具有良好的应用前景。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍。
图1为抗菌肽TC-LAR-18和多肽TC-LAE-18的helical wheel模型;
图2为抗菌肽TC-LAR-18在0~32mM浓度SDS时的圆二色谱图结果;
图3为抗菌肽TC-LAR-18对人角质化细胞HaCaT的细胞毒性实验结果;
图4为抗菌肽TC-LAR-18对人红细胞的溶血作用实验结果;
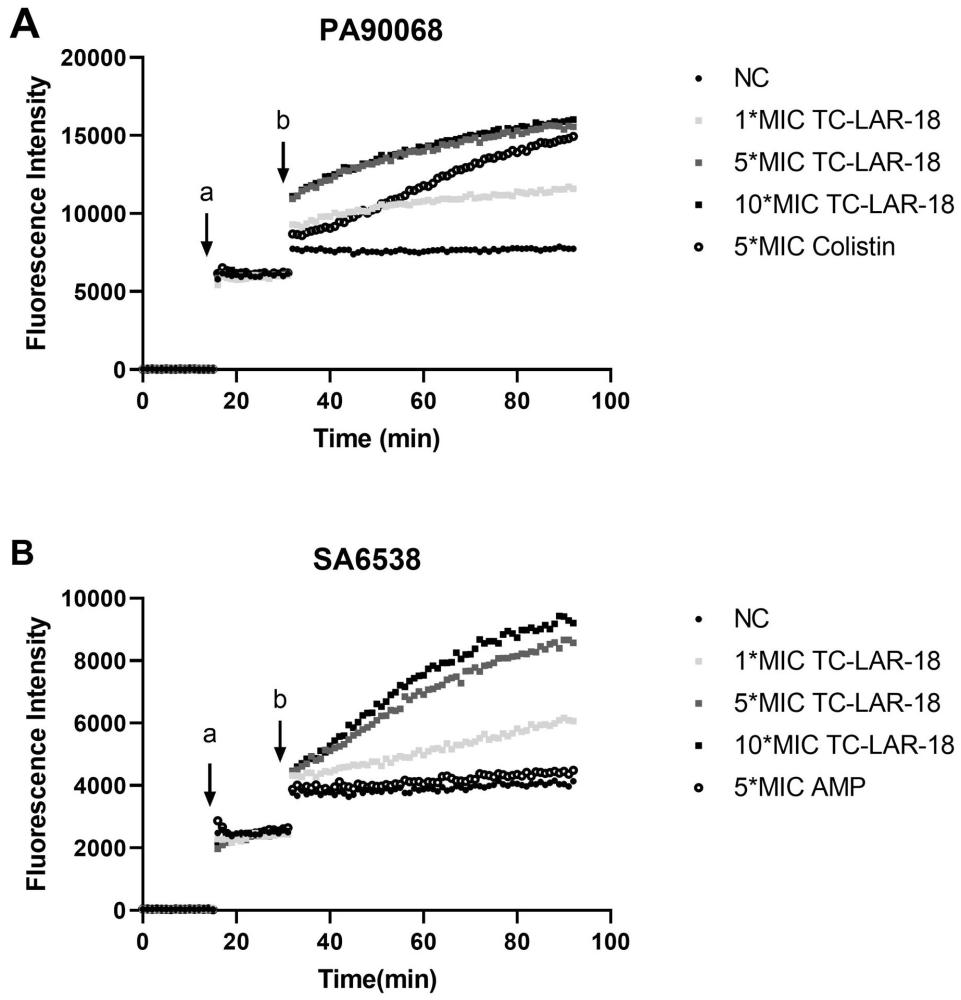
图5为抗菌肽TC-LAR-18对绿浓杆菌90068和金黄色葡萄球菌ATCC6538细胞膜破膜的影响结果。
具体实施方式
本发明提供了一种抗菌肽TC-LAR-18,氨基酸序列如SEQ ID NO.1所示,具体为LARKFRKIGQKIKNFFRK。
本发明提供的抗菌肽TC-LAR-18是可以形成双亲性α螺旋结构的短序列,包含18个氨基酸,分子量为2277.82道尔顿,等电点为12.32,为直链多肽,所有氨基酸均为L型。体外抑菌实验表明,TC-LAR-18具有广谱抗菌活性,对鲍曼不动杆菌、绿浓杆菌、大肠杆菌和金黄色葡萄球菌的标准菌株和临床来源菌株均表现较好的抗菌作用,最小抑菌浓度(MIC)值为2.34~4.69μg/mL。抗菌机理实验表明TC-LAR-18可靶向破坏细菌的细胞膜;同时,该多肽无细胞毒性和溶血作用。
在本发明中,所述抗菌肽TC-LAR-18的制备方法优选包括多肽固相合成法。本发明对所述多肽固相合成法没有特殊要求,采用本领域技术人员所熟知的方法即可。
在本发明中,优选在所述抗菌肽TC-LAR-18的碳端进行酰胺化修饰。本发明对所述酰胺化修饰的方法没有特殊要求,采用本领域技术人员所熟知的方法即可。
本发明提供了上述技术方案所述的抗菌肽TC-LAR-18在制备抗细菌感染药物中的应用。
在本发明中,所述细菌优选包括革兰氏阴性菌和/或革兰氏阳性菌;所述革兰氏阴性菌包括鲍曼不动杆菌、绿脓杆菌和大肠杆菌中的一种或多种;所述革兰氏阳性菌包括金黄色葡萄球菌。
本发明提供了一种抗细菌感染药物,所述抗细菌感染药物的有效成分包括上述技术方案所述的抗菌肽TC-LAR-18。
在本发明中,所述抗菌肽TC-LAR-18的最小抑菌浓度优选为2.34~4.69μg/mL。
为了进一步说明本发明,下面结合附图和实施例对本发明提供的抗菌肽TC-LAR-18及其在制备抗细菌感染药物中的应用进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例1
TC-LAR-18序列及其制备,具体如下:
委托吉尔生化(上海)有限公司,通过多肽固相合成法合成SEQ ID No.1所述的多肽,并在其C端进行酰胺化修饰,最后通过HPLC反相柱层析脱盐纯化,得到抗菌肽TC-LAR-18。
对比例1
多肽TC-LAE-18,其氨基酸序列如SEQ ID No.2所示,具体为:LAEKFEKIGQKIKNFFRK;TC-LAE-18的制备方法同实施例1,区别在于,氨基酸序列不同。
对比应用例1
通过网站:https://heliquest.ipmc.cnrs.fr构建实施例1所述TC-LAR-18和对比例1所述TC-LAE-18的helical wheel模型,结果如图1所示,该图显示TC-LAR-18呈现更为典型的双亲性结构。
对比应用例2
抗菌肽TC-LAR-18及多肽TC-LAE-18对鲍曼不动杆菌、绿脓杆菌、大肠杆菌和金黄色葡萄球菌标准菌株及临床来源菌株的最小抑菌浓度(MIC)测试,具体如下:
待测鲍曼不动杆菌菌种为:鲍曼不动杆菌标准菌株ATCC19606以及临床来源编号为10769和0357的菌株;
待测绿脓杆菌菌种为:绿脓杆菌标准菌株ATCC27853以及临床来源编号为90068和17068的菌株;
待大肠杆菌菌种为:大肠杆菌标准菌株ATCC8739以及临床来源编号为0894和0357的菌株;
待测金黄色葡萄球菌菌种为:金黄色葡萄球菌标准菌株ATCC6538以及临床来源编号为220823和15775的菌株;
将待测菌种接种到LB固体平板上,待菌落长出后挑取单菌落转接到LB液体培养基中,置于37℃,180rpm的条件下震荡培养5h,在紫外分光光度计下测定菌液OD
表1 抗菌肽TC-LAR-18以及多肽TC-LAE-18对测试菌株的最小抑菌浓度值
由表1可知,TC-LAE-18对所测试菌种无明显抑菌作用(MIC>100μg/mL,即在最大测试浓度时无抑菌作用),不做进一步研究;TC-LAR-18对鲍曼不动杆菌标准菌株(ATCC19606)和临床来源菌株(编号为10769和0357)均表现出较好的抑菌作用,MIC值为2.34~4.69μg/mL;TC-LAR-18对大肠杆菌标准菌株(ATCC8739)和临床来源菌株(编号为0894和0357)也表现出较好的抑菌作用,MIC值为2.34~4.69μg/mL;TC-LAR-18对绿脓杆菌标准菌株(ATCC27853)和临床来源菌株(编号为90068和17068)也表现出较好的抑菌作用,MIC值均为4.69μg/mL;TC-LAR-18对金黄色葡萄球菌标准菌株(ATCC6538)和临床来源菌株(编号为220823和15775)均表现出较好的抑菌作用,MIC值为2.34~4.69μg/mL。
实施例2
实施例1所述TC-LAR-18的圆二色谱分析,具体如下:
在开氏温度298K时,选用型号为J-810的圆二色谱仪(日本分光,JASCO)测定TC-LAR-18在不同SDS浓度溶液环境中的CD光谱,所述SDS浓度分别为:0mM、4mM、8mM、16mM和32mM,测定条件如下:扫描范围:190~250nm;扫描速度:100nm/min;带宽:1nm;样品池长:0.1cm;反应时间:1s;每个样品进行3次连续扫描。结果见图2。
由图2可知,TC-LAR-18在SDS的浓度为0Mm,即在纯水中,TC-LAR-18的CD谱在198nm附近有一负峰,在220~230nm范围内有一小而宽的正峰,表明在纯水中TC-LAR-18为无规卷曲的构象;在加入SDS之后,TC-LAR-18的CD谱在192nm附近有一正峰,在208nm、222nm处呈两个负的特征肩峰,此峰形为典型的α-螺旋结构,表明TC-LAR-18在SDS溶液中形成典型的α-螺旋结构,即TC-LAR-18在亲水性环境中为无规卷曲的构象,在结合到细菌的细胞质膜由于疏水性的增加转变为两亲性的α-螺旋构象,该构象为TC-LAR-18的杀菌作用提供了重要依据。
实施例3
实施例1所述TC-LAR-18的细胞毒性检测,具体如下:
检测抗菌肽TC-LAR-18样品对人角质形成细胞Hacat的细胞毒作用,该细胞使用DMEM培养基培养,方法如下:待细胞长至培养瓶80%时先用PBS洗涤3次,再用0.25%胰酶消化细胞,用DMEM培养液配成5×10
实施例4
实施例1所述TC-LAR-18的溶血作用测试,具体如下:
将新鲜人全血与阿氏液按照1:1的体积比混合,1000rpm离心5min,将上清液弃去,红细胞用生理盐水洗涤,重复3次,至上清液不再出现红色为止,得到洗涤好的红细胞;
将所述洗涤好的红细胞用生理盐水稀释到1×10
实施例5
实施例1所述TC-LAR-18对细菌的破膜作用测试,具体如下:
选取对比应用例2中所述的编号为90068绿脓杆菌(记为PA90068)和金黄色葡萄球菌ATCC6538(记为SA6538)作为测试菌株,检测TC-LAR-18对这两株细菌的破膜作用,实验方法如下:
将处于对数期生长的菌液在1500g条件下离心5min,弃上清,所得的菌体沉淀用生理盐水洗涤2次后,继续用生理盐水重悬菌液,调整菌液浓度为2×10
将配制好的菌液加入到黑色透明底的96孔板,每孔100μL,用酶标仪连续检测溶液在15min内的荧光强度,检测条件:激发波长Ex为535nm,发射波长Em为615nm,读数间隔为1min;
检测结束后加入10μL碘化丙啶(PI)溶液,使之终浓度为2.5μg/mL,用酶标仪连续检测溶液在15min内的荧光强度,继续加入100μL梯度浓度的多肽溶液或等体积的对照溶液,用酶标仪连续检测溶液在60min内的荧光强度;多肽样品的终浓度分别为对各菌株相应最小抑菌浓度(见表1)的1、5、10倍,即1×MIC、5×MIC、10×MIC;测试菌株为金黄色葡萄球菌时,阳性对照为氨苄青霉素(AMP)溶液,AMP的终浓度为5×MIC;测试菌株为绿脓杆菌时,阳性对照为克利斯汀(Colistin)溶液,Colistin的终浓度为5×MIC;阴性对照为等体积的生理盐水。
结果如图5所示,其中a指加入10μL碘化丙啶溶液,b指加入多肽样品或对照。由该结果可知,TC-LAR-18对绿脓杆菌和金黄色葡萄球菌表现出浓度依赖的破膜作用。
综上所述,本发明提供的抗菌肽TC-LAR-18具有广谱抗菌活性,无细胞毒性和溶血作用,有望成为新型广谱性抗菌候选药物,在抗“超级细菌”方面具有良好的应用前景。
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
