一种用于肿瘤放疗增敏的钙离子纳米调节器及其制备方法与应用
文献发布时间:2024-04-18 19:52:40
技术领域
本发明涉及纳米生物医药材料领域,涉及一种肽基钙离子(Ca
背景技术
近年来,我国癌症的发病数和死亡数逐年攀升,2022年国内癌症的死亡病例估计将达到美国的五倍,癌症负担的加重严重影响着社会公共卫生安全和国民经济增长。放疗作为三大传统治疗手段之一,在肿瘤的临床治疗中占据着举足轻重的地位,超过70%的癌症患者会接受放疗或放疗联合治疗。然而,肿瘤组织异质性引起的放疗抵抗以及辐射可造成正常组织损伤等问题始终是各种放疗手段难以突破的瓶颈。因此,开发能够特异性提高肿瘤细胞放射敏感性,同时降低正常组织受损的放疗增敏剂对于提高放疗疗效具有重要意义。
肿瘤细胞在放疗过程中可通过多种机制产生耐受,以规避放疗造成的直接及间接损伤。其中,照射引起的内质网应激是肿瘤发生放疗抵抗的主要原因之一。具体来说,内质网上的钙调蛋白在Ca
目前,已有多个研究团队设计了负载Ca
发明内容
本发明旨在开发一种CAP和NO共递送的肽基Ca
为了实现本发明的目的,本发明的技术方案如下:
一种用于肿瘤放疗增敏的Ca
结构式I。
本发明进一步公开了用于肿瘤放疗增敏的Ca
将5−15 mg CAP-GA-GFFpY-Pen-NO溶解于1−3 mL PBS,加入Na
多肽衍生物CAP-GA-GFFpY-Pen-NO的制备步骤如下:
(1)将100−200 mg CAP-GA-GFFpY-Pen溶解于2−4 mL无水N,N-二甲基甲酰胺(DMF),然后在氮气保护下-10−0℃预冷0.5−1h;
(2)避光条件下向体系(1)中缓慢滴加100−200μL亚硝酸叔丁酯,氮气保护下-10−0℃避光反应2−4 h;
(3)将反应混合物滴加入30−60mL冰乙醚中,析出浅绿色沉淀,8000−10000 rpm离心10−15 min,用冰乙醚重悬反复洗涤三次以除去残余的DMF,注意全程避光操作;
(4)离心得到的固体经过真空干燥便可得到浅绿色粉末状CAP-GA-GFFpY-Pen-NO纯品。
所述的CAP-GA-GFFpY-Pen,其特征在于,
(1)其通过固相合成法制备;
(2)其化学结构如结构式II所示;
结构式II。
本发明同时也公开了用于肿瘤放疗增敏的Ca
本发明更加详细的描述如下:
通过酯化反应合成CAP-GA,采用经典的固相合成法合成多肽衍生物CAP-GA-GFFpY-Pen,进一步与亚硝酸叔丁酯进行亲核取代反应生成负载NO的多肽衍生物CAP-GA-GFFpY-Pen-NO,其在ALP催化下自组装形成具有三维网状纳米纤维微观结构的肽基Ca
一种用于肿瘤放疗增敏的Ca
将5−15 mg CAP-GA-GFFpY-Pen-NO溶解于1−3 mL PBS,加入Na
(1)将100−200 mg CAP-GA-GFFpY-Pen溶解于2−4 mL无水N,N-二甲基甲酰胺(DMF),然后在氮气保护下-10−0℃预冷0.5−1h;
(2)避光条件下向体系(1)中缓慢滴加100−200μL亚硝酸叔丁酯,氮气保护下-10−0℃避光反应2−4 h;
(3)将反应混合物滴加入30−60mL冰乙醚中,析出浅绿色沉淀,8000−10000 rpm离心10−15 min,用冰乙醚重悬反复洗涤三次以除去残余的DMF,注意全程避光操作;
(4)离心得到的固体经过真空干燥便可得到浅绿色粉末状CAP-GA-GFFpY-Pen-NO纯品。
其中所述的CAP-GA-GFFpY-Pen的制备方法,步骤如下:
(1)称取0.5−1g二氯树脂于固相合成管,加入10−20 mL二氯甲烷(DCM)浸泡5−10min,使树脂充分溶胀,用洗耳球挤压出合成管中的DCM;
(2)称取Fmoc-S-Trityl-L-Penicillamine(0.5−1mmol,306−712 mg)于西林瓶,依次加入10−20 mLDCM和催化剂N,N-二异丙基乙胺(DIEA)(1−2mmol,200−400μL),充分溶解后加入固相合成管,室温反应2−4 h;
(3)挤压出反应液,用DCM清洗五次,加入10−20 mL封闭液(DCM:CH
(4)先后用DCM和DMF各清洗五次,加入20%的哌啶(15−30 mL)脱除Fmoc-S-Trityl-L-Penicillamine上的Fmoc保护基,裸露出活性胺基;
(5)用DMF清洗五次,称取Fmoc-Tyr(H
(6)重复上述步骤(4)和(5),依次偶联Fmoc-Phe-OH、Fmoc-Phe-OH、Fmoc-Gly-OH和CAP-GA。用DMF和DCM依次清洗去除未反应的氨基酸、催化剂及偶联剂,之后加入95%的三氟乙酸(TFA)(H
(7)旋蒸除去TFA,向得到的粘稠液体中加入无水乙醚沉淀并收集得到多肽粗品。最后通过高效液相色谱(HPLC)分离纯化得到CAP-GA-GFFpY-Pen纯品。
更进一步的,所述的CAP-GA的制备步骤如下:
(1)将戊二酸酐(GA)(5−10mmol,570−1140mg)和辣椒素(CAP)(1.5−3mmol,440−880mg)加入到20−40 mL无水吡啶中,室温下反应18−24 h;
(2)反应结束后,旋转蒸发除去溶剂,搅拌下加入1 N盐酸析出固体,过滤后得到滤饼,最后经过冷水洗涤和真空干燥得到CAP-GA纯品。
本发明涉及到的原料或试剂均为普通市售产品,涉及到的操作如无特殊说明均为本领域常规操作。
本发明的有益效果在于:
本发明制备了一种CAP和NO共递送的肽基Ca
附图说明
此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本发明的实施例,并与说明书一起用于解释本发明的原理;
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,对于本领域普通技术人员而言,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图;
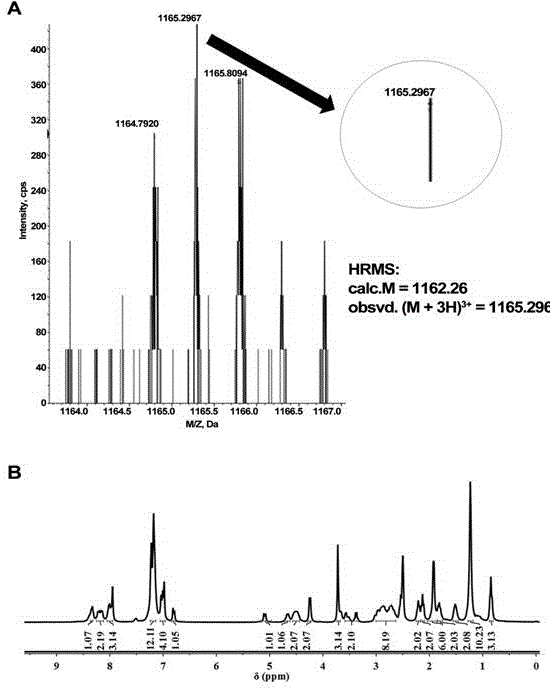
图1为本发明实施例3所制备的CAP-GA-GFFpY-Pen-NO的高分辨质谱(A)和核磁共振氢谱(B)测试结果;
图2为多肽衍生物CAP-GA-GFFpY-Pen-NO通过酶促自组装的方法形成的水凝胶样Ca
图3为水凝胶样Ca
图4为CAP-P-NO的药物释放曲线。其中A为CAP-P-NO在不同GSH浓度下NO的释放曲线,B为CAP-P-NO在不同pH条件下CAP的释放曲线;
图5为ICP-MS测定与CAP-P-NO作用后细胞内及线粒体内的Ca
图6为胰腺癌Panc-1细胞与CAP-P-NO或PBS共孵育并给予不同剂量的放射后的克隆形成图像(A)及细胞生存曲线(B)。
具体实施方式
为了能够更清楚地理解本发明的上述目的、特征和优点,下面将对本发明的方案进行进一步描述。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但本发明还可以采用其他不同于在此描述的方式来实施;显然,说明书中的实施例只是本发明的一部分实施例,而不是全部的实施例。
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
CAP-GA的制备方法,步骤如下:
(1)将戊二酸酐(GA)(5mmol,570mg)和辣椒素(CAP)(1.5mmol,440mg)加入到20 mL无水吡啶溶液中,室温下反应18 h;
(2)反应结束后,旋转蒸发除去溶剂,搅拌下加入1 N盐酸析出固体,过滤后得到滤饼,最后经过冷水洗涤和真空干燥得到CAP-GA纯品。
实施例2
CAP-GA-GFFpY-Pen的制备方法,步骤如下:
(1)称取0.5g二氯树脂于固相合成管,加入10 mL二氯甲烷(DCM)浸泡5 min,使树脂充分溶胀,用洗耳球挤压出合成管中的DCM;
(2)称取Fmoc-S-Trityl-L-Penicillamine(0.5mmol,306 mg)于西林瓶,依次加入10 mL DCM和催化剂N,N-二异丙基乙胺(DIEA)(1mmol,200 μL),充分溶解后加入固相合成管,室温反应2 h;
(3)挤压出反应液,用DCM清洗五次,加入10 mL封闭液(DCM:CH
(4)先后用DCM和DMF各清洗五次,加入20%的哌啶(15 mL)脱除Fmoc-S-Trityl-L-Penicillamine上的Fmoc保护基,裸露出活性胺基;
(5)用DMF清洗五次,称取Fmoc-Tyr(H
(6)重复上述步骤(4)和(5),依次偶联Fmoc-Phe-OH、Fmoc-Phe-OH、Fmoc-Gly-OH和CAP-GA。用DMF和DCM依次清洗去除未反应的氨基酸、催化剂及偶联剂,之后加入95%的三氟乙酸(TFA)(H
(7)旋蒸除去TFA,向得到的粘稠液体中加入无水乙醚沉淀并收集得到多肽粗品。最后通过高效液相色谱(HPLC)分离纯化得到CAP-GA-GFFpY-Pen纯品。
通过核磁共振氢谱确证了CAP-GA-GFFpY-Pen的化学结构,其核磁数据如下:
1
实施例3
CAP-GA-GFFpY-Pen-NO的制备方法,步骤如下:
(1)将100 mg CAP-GA-GFFpY-Pen溶解于2 mL无水N,N-二甲基甲酰胺(DMF),然后在氮气保护下0℃预冷0.5h;
(2)避光条件下向体系(1)中缓慢滴加100 μL亚硝酸叔丁酯,氮气保护下0 ℃避光反应2 h;
(3)将反应混合物滴加入30mL冰乙醚中,析出浅绿色沉淀,8000 rpm离心10 min,用冰乙醚重悬反复洗涤三次以除去残余的DMF,注意全程避光操作;
(4)离心得到的固体经过真空干燥便可得到浅绿色粉末状CAP-GA-GFFpY-Pen-NO纯品。
参见附图1,使用高分辨质谱(A)和核磁共振氢谱(B)对所得产物进行检测,验证了所得多肽衍生物化学结构正确,其核磁数据如下:
实施例4
一种用于肿瘤放疗增敏的Ca
将5 mg CAP-GA-GFFpY-Pen-NO溶解于1 mL PBS,加入Na
实施例5
CAP-P-NO的理化性质表征,步骤如下:
(1)临界组装浓度测定:取10 μL尼罗红工作液(1×10
(2)微观形貌观察:根据实施例4的方法制备浓度为5 mg/mL的水凝胶,吸取制备好的水凝胶10 μL滴加到透射电镜铜网上并静置2 min,然后用滤纸吸去多余凝胶,并用醋酸双氧铀负染2min,干燥之后在透射电镜下观察其微观形貌。
参见附图3A,CAP-GA-GFFpY-Pen-NO的临界组装浓度为181.5 μM左右,说明其在较低浓度下即可发生组装,具备良好的酶促自组装性能。进一步通过透射电镜观察其微观形貌,如图3B显示,CAP-P-NO的微观形貌为致密的三维网络纳米纤维结构。
实施例6
GSH响应的NO释放和弱酸响应的CAP释放,步骤如下:
(1)GSH响应的NO释放:根据实施例4的方法制备浓度为5mg/mL的水凝胶CAP-P-NO,吸取100 μL至透明西林瓶中,作为待测样品。在水凝胶表面加入50 μL含GSH(0μM、2μM、10mM)的PBS,并将西林瓶置于37℃敷箱。在预定时间点吸取50 μL上清于96孔板,依次加入50μLGriess试剂1和50 μLGriess试剂2,充分混匀后用酶标仪测定溶液在540 nm处的吸光度,并根据浓度-吸光度标准曲线计算NO的释放率。注意每次取出上清液后补加相同体积的含GSH的新鲜PBS。
(2)弱酸响应的CAP释放:根据实施例4的方法制备浓度为5mg/mL的水凝胶CAP-P-NO,吸取200 μL至透明西林瓶中,作为待测样品。在水凝胶表面加入50μL不同pH(7.4、6.5)的PBS,并将西林瓶置于37℃敷箱。在预定时间点吸取50μL上清与50μL甲醇充分混合后进行HPLC检测,并根据浓度-峰面积标准曲线计算CAP的释放率。注意每次取出上清液后补加相同体积的pH7.4或6.5的新鲜PBS。
图4A即为不同条件下NO的累计释放曲线,可以看出,随着时间的延长NO逐渐从CAP-P-NO中释放,且释放速率具有明显的GSH浓度依赖性。与单纯PBS或GSH(2μM)共孵育24h后,CAP-P-NO仅可释放出不到20%的NO。而在GSH(10 mM)条件下,NO的释放速度明显加快,24h后CAP-P-NO的NO累积释放率高达95%。
CAP-P-NO的CAP累计释放曲线如图4B所示,在pH为7.4时,经16 h后CAP-P-NO可释放出约36%的CAP。而在pH为6.5时,CAP的释放速度明显加快,16 h后CAP的累积释放率高达96%以上。
实施例7
ICP-MS测定细胞内及线粒体内的Ca
将胰腺癌Panc-1细胞与CAP-P-NO(50 μM)或纯PBS共孵育4 h后,消化、离心、收集细胞并计数,各组取相同数量细胞消解后通过ICP-MS测定细胞内的Ca
参见附图5,与CAP-P-NO作用后,细胞和线粒体内的Ca
实施例8
克隆形成实验评价CAP-P-NO的放疗增敏效果,步骤如下:
(1)将胰腺癌Panc-1细胞以500个/孔的密度接种于12孔板,并在CO
(2)将培养基替换为新鲜的含/不含CAP-P-NO(25 μM)的无血清培养基,继续孵育12 h;
(3)将培养基替换成新鲜的完全培养基,然后给予不同剂量的γ-射线照射(0、2、4、6 Gy),之后继续培养7天左右;
(4)待克隆团长到肉眼可见大小时,用0.25%的结晶紫乙醇溶液对克隆团进行染色;
(5)拍照并对克隆团进行计数,根据克隆团数量计算放疗增敏比值。
如图6所示为克隆形成图像(A)及细胞生存曲线(B),未经照射时CAP-P-NO与PBS组的克隆团数量几乎无差别,而经CAP-P-NO预处理后再进行照射,可以观察到克隆团数量的明显减少,且经过低剂量(2Gy)照射后,细胞增殖便受到明显抑制,证明CAP-P-NO在破坏Ca
