一种ELP-Ⅲ型胶原蛋白的纯化方法及应用
文献发布时间:2023-06-19 10:16:30
技术领域
本发明涉及生物技术领域,尤其是一种ELP-Ⅲ型胶原蛋白的纯化方法及应用。
背景技术
类弹性蛋白多肽(ELPs)是一种经过人工改造的、具有弹性且随温度变化会发生相变的基因工程多肽,因其在结构上以五肽重复序列单元串联构成而形成聚合物,即(Val-Pro-Gly-Xaa-Gly,VPGXG),其中,可以Xaa是除了脯氨酸以外的任何一种氨基酸,通常为缬氨酸(Val,V),丙氨酸(Ala,A),甘氨酸(Gly,G)亮氨酸(Leu,L)异亮氨酸(Ile,I),赖氨酸(Lys,K),苯丙氨酸(Phe,F),组氨酸(His,H)等几种氨基酸类型,重复单元n通常为20-120不等。目前主要合成的方法有两种,一种化学合成法合成多肽,另一种是基因重组合成法。与化学合成法相比,基因重组合成法具有以下优点:1.通过基因编码精确控制ELPs的氨基酸序列、分子量、空间折叠结构以及相应的生化性质;2.构建所得包含ELPs基因的质粒载体可长久保存于表达菌株,进行可持续生产;3.ELPs能够在宿主菌折叠机制的辅助作用下正确折叠成具有活性的二级结构或三级结构,通过后期可溶性蛋白的纯化,可直接进行应用研究。ELPs有个最大的特性:温度敏感性。在低温时,ELPs可溶于水,聚合物链保持无序的结构,且相当伸展。当温度升高到一个临界温度,ELPs将不溶于水,含水的多肽链结构就会瓦解并开始聚集,最终以富含ELPs的聚集物的形式沉淀析出,这个临界温度称为ELPs的相变温度(transition temperature,Tt),这个过程是可逆的,所以经常采用逆相变循环(Inverse transition cycling,ITC)来对含有ELP标签的融合蛋白进行纯化。本发明根据本公司发表专利申请号20181003668.1描述的pRELPN载体促进克隆在ELP融合蛋白后起始密码ATG后的外源目的基因独立高表达,该融合蛋白本身极少表达,并且轻微抑制大肠杆菌或真核细胞等宿主自身蛋白的表达,促进外源目的基因的重组蛋白积聚和高表达,从而有助于解决普通表达载体对外源基因或外源基因与ELP组成的融合基因的低表达或不表达导致不能产业化的问题。
III型胶原蛋白是一种成纤维胶原,在血管中的含量很高,起着重要作用。一方面它能增强血管的强度与弹性,另一方面它提供细胞充足的营养。III型胶原蛋白还能直接与血管母细胞结合,从而形成新血管。III型胶原蛋白是维持皮肤饱满、润滑、有光泽的重要元素。III型胶原蛋白进入人体后,能迅速被人体吸收,补充皮肤中随着年龄的增加而逐渐减少的胶原蛋白。从而使得皮肤具有弹性、水分充足并且能够明显减少人的鱼尾纹与抬头纹。目前主要有以下几种途径生产胶原蛋白:传统提取法、化学合成法、现代生物技术生产法。传统提取主要是通过酸法、碱法和酶法从动物皮毛和结缔组织中获得,所获得的胶原蛋白活性较低,且带有安全隐患。随着基因工程和生物技术的发展,从19世纪80年代以来,人们开始利用生物技术方法生产胶原蛋白,并得到推广,以满足人们对胶原蛋白的迫切需求,同时也节约成本,为工业生产胶原蛋白带来更大的经济效益。但依然存在许多问题,比如:蛋白纯化复杂,需要经过离子交换、分子排阻等一系列层析方法纯化,成本高昂。
发明内容
本发明要解决的技术问题是:为了解决上述背景技术中存在的问题,提供一种改进的ELP-Ⅲ型胶原蛋白的纯化方法及应用,解决上述背景技术中存在的问题。
本发明解决其技术问题所采用的技术方案是:一种ELP-Ⅲ型胶原蛋白的纯化方法,包含下列步骤:
第一步:合成ELP100基因序列,并构建pET28a-BamH-ELP100-NdeI重组载体,并导入到DH5a大肠杆菌中,然后构建pRELPN-BamH-ELP100-NdeI重组质粒,并导入到DH5a大肠杆菌中;
第二步:合成III型胶原蛋白基因,构建pRELPN-BamHI-ELP100-NdeI-CLP Ⅲ-XhoI重组质粒,并转染到大肠杆菌BL21(DE3)中表达;
第三步:对大肠杆菌进行均质破碎得到含有目的蛋白的包涵体,利用非色谱的方法对目的蛋白进行粗纯和精纯;
第四步:通过滴定稀释法来对包涵体进行复性,再用超滤对复性的目的蛋白进行浓缩;
第五步:利用逆相变循环(Inverse transition cycling,ITC)来对复性后的融合蛋白进行纯化;
第六步:用MTT法对ITC纯化后的ELP和III型胶原蛋白的融合蛋白进行活性检测。
所述的Ⅲ型胶原蛋白是一个含30个氨基酸的八个重复片段组成(CLP III),Ⅲ型胶原蛋白分子质量为27kDa。
所述的ELP为由100个串联的五肽重复单元(Val-Pro-Gly-His-Gly,VPGHG)通过酶切位点间隔连接或克隆形成的类弹性蛋白多肽。
所述的融合蛋白是由ELP标签和Ⅲ型胶原蛋白组成的,中间通过BamHI酶切位点连接,其相对分子量为73kDa。
所述pRELPN-BamHI-ELP100-NdeI-CLP Ⅲ-XhoI重组质粒的构建方式如下:
(1)合成ELP100基因,并将其插在pET28a载体的BamHI和NdeI酶切位点之间,形成pET28a-BamH-ELP100-NdeI载体。
(2)利用PCR扩增出BamHI-ELP100-NdeI片段,将其连接到载体pRELPN上,构成pRELPN-BamHI-ELP100-NdeI重组载体。
(3)合成出Ⅲ型胶原蛋白基因,将其插入在pRELPN-BamHI-ELP100-NdeI重组载体的NdeI和XhoI酶切位点之间,构成pRELPN-BamHI-ELP100-NdeI-CLP Ⅲ-XhoI重组质粒。
一种ELP-Ⅲ型胶原蛋白的应用,所述的ELP100-CLP Ⅲ融合蛋白具有促进细胞生长作用。
本发明的有益效果是:
本发明的一种改进的ELP-Ⅲ型胶原蛋白的纯化方法及应用可用于在工业上大规模制备类人胶原蛋白,不仅适用于ELP-III型胶原蛋白的纯化和复性,也可用于其他以包涵体形式存在的重组蛋白质的分离、纯化以复性,包括如下步骤:菌种的收集与破碎,洗除杂蛋白、脂质和核酸,蛋白精纯化,滴定稀释法复性,ITC纯化和MTT细胞法活性鉴定,本方法纯化得率高、方法简单,适合于大规模生产。
附图说明
下面结合附图和实施例对本发明进一步说明。
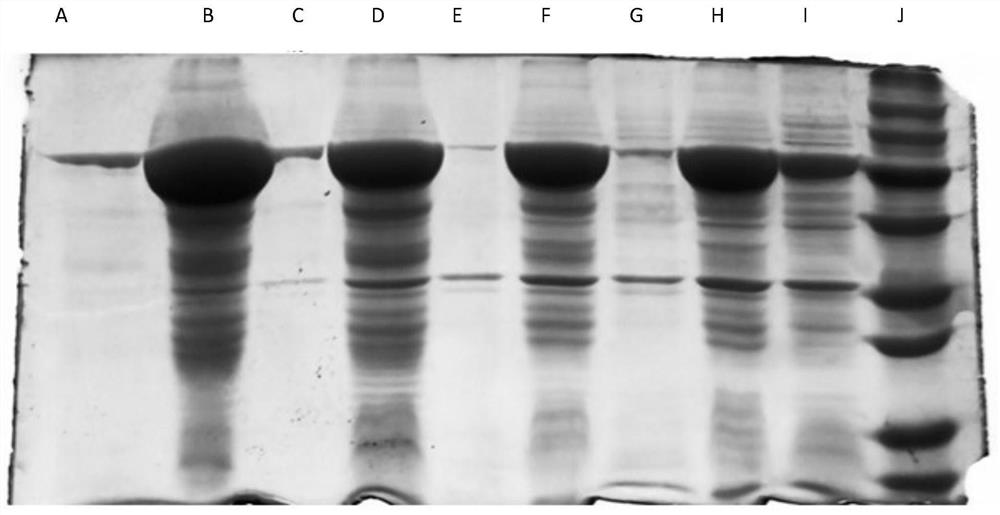
图1 ELP-III型胶原蛋白纯化蛋白电泳图。
图2 ELP-III型胶原蛋白复性及ITC纯化图。
图3明胶或ELP-III型胶原蛋白融合蛋白对细胞增殖的促进率。
图4不同条件处理L929细胞24h后的细胞形态对比图。
图5培养72h后不同浓度ELP-Ⅲ型胶原蛋白融合蛋白对细胞增殖的促进率。
图6不同浓度ELP-III型胶原蛋白融合蛋白处理L929细胞24h后的细胞形态对比图。
具体实施方式
现在结合附图对本发明作进一步详细的说明。这些附图均为简化的示意图,仅以示意方式说明本发明的基本结构,因此其仅显示与本发明有关的构成。
图1、图2、图3、图4、图5和图6所示的一种改进的ELP-Ⅲ型胶原蛋白的纯化方法及应用,本发明的具体步骤如下:
一、ELP100-CLP III融合蛋白表达载体的构建
(1)合成ELP100基因,并将其插在pET28a载体的BamHI和NdeI酶切位点之间,形成pET28a-BamH-ELP100-NdeI载体,并导入到DH5a大肠杆菌中。
(2)提取pET28a载体并利用PCR扩增出BamHI-ELP100-NdeI片段,将其连接到载体pRELPN上,构成pRELPN-BamHI-ELP100-NdeI重组载体,并导入到DH5a大肠杆菌中。
(3)合成出Ⅲ型胶原蛋白基因,将其插入在pRELPN-BamHI-ELP100-NdeI重组载体的NdeI和XhoI酶切位点之间,构建pRELPN-BamHI-ELP100-NdeI-CLP Ⅲ-XhoI重组质粒。
其中①构建(ELP)100基因:
人工合成类弹性蛋白多肽(ELP)n。(VPGXG)n五肽重复单元串联的X为组氨酸,n为100。具体操作为委托某生物科技有限公司提前分别合成ELP100基因,并预先插在pET28a载体的BamHI和NdeI之间,形成pET28a-ELP100载体。III型胶原蛋白单聚体氨基酸的序列为:
Val Val Gly Glu Arg Gly Glu Arg Gly Glu Arg Gly Ala Ser Gly Glu ArgGly Asp Leu Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly;
ELP100氨基酸序列表
Val Tyr Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His GlyVal Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly HisGly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro GlyHis Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val ProGly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly ValPro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His GlyVal Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly HisGly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro GlyHis Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val ProGly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly ValPro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His GlyVal Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly HisGly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro GlyHis Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val ProGly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly ValPro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His GlyVal Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly HisGly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro GlyHis Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val ProGly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly ValPro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His GlyVal Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly HisGly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro GlyHis Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val ProGly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly ValPro Gly His Gly Val Pro Gly His Gly Val Pro Gly His Gly Val Pro Gly His GlyVal Pro Gly His Gly Val Pro Pro Arg。
②构建III型胶原蛋白(CLP III)基因:
基于人源III型胶原蛋白重复序列和特征,设计并人工合成一段人源III型胶原蛋白基因。其前端带有NdeI和XhoI酶切序列,构成NdeI-CLP III-XhoI片段。预先插在pET28a载体的XhoI和NdeI之间,构成pET28a-NdeI-CLP III-XhoI重组质粒。
III型胶原蛋白基因序列表为:
GGATCCCACCACCCTCTCGCGCCTCTCGCGCCTCTCGCGCCTCGTAGGCCTCTCGCGCCTCTGGACCCTGGTGTTCCTTAACGTCCTGTTGCGCCCCACCACCCTCTCGCGCCTCTCGCGCCTCTCGCGCCTCGTAGGCCTCTCGCGCCTCTGGACCCTGGTGTTCCTTAACGTCCTGTTGCGCCCCACCACCCTCTCGCGCCTCTCGCGCCTCTCGCGCCTCGTAGGCCTCTCGCGCCTCTGGACCCTGGTGTTCCTTAACGTCCTGTTGCGCCCCACCACCCTCTCGCGCCTCTCGCGCCTCTCGCGCCTCGTAGGCCTCTCGCGCCTCTGGACCCTGGTGTTCCTTAACGTCCTGTTGCGCCCCACCACCCTCTCGCGCCTCTCGCGCCTCTCGCGCCTCGTAGGCCTCTCGCGCCTCTGGACCCTGGTGTTCCTTAACGTCCTGTTGCGCCCCACCACCCTCTCGCGCCTCTCGCGCCTCTCGCGCCTCGTAGGCCTCTCGCGCCTCTGGACCCTGGTGTTCCTTAACGTCCTGTTGCGCCCCACCACCCTCTCGCGCCTCTCGCGCCTCTCGCGCCTCGTAGGCCTCTCGCGCCTCTGGACCCTGGTGTTCCTTAACGTCCTGTTGCGCCCCACCACCCTCTCGCGCCTCTCGCGCCTCTCGCGCCTCGTAGGCCTCTCGCGCCTCTGGACCCTGGTGTTCCTTAACGTCCTGTTGCGCCCCTCGAG;
III型胶原蛋白氨基酸序列表
Pro Arg Val Val Gly Glu Arg Gly Glu Arg Gly Glu Arg Gly Ala Ser GlyGlu Arg Gly Asp Leu Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly
Val Val Gly Glu Arg Gly Glu Arg Gly Glu Arg Gly Ala Ser Gly Glu ArgGly Asp Leu Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly
Val Val Gly Glu Arg Gly Glu Arg Gly Glu Arg Gly Ala Ser Gly Glu ArgGly Asp Leu Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly
Val Val Gly Glu Arg Gly Glu Arg Gly Glu Arg Gly Ala Ser Gly Glu ArgGly Asp Leu Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly
Val Val Gly Glu Arg Gly Glu Arg Gly Glu Arg Gly Ala Ser Gly Glu ArgGly Asp Leu Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly
Val Val Gly Glu Arg Gly Glu Arg Gly Glu Arg Gly Ala Ser Gly Glu ArgGly Asp Leu Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly
Val Val Gly Glu Arg Gly Glu Arg Gly Glu Arg Gly Ala Ser Gly Glu ArgGly Asp Leu Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly
Val Val Gly Glu Arg Gly Glu Arg Gly Glu Arg Gly Ala Ser Gly Glu ArgGly Asp Leu Gly Pro Gln Gly Ile Ala Gly Gln Arg Gly Glu Leu;
③构建pRELPN-BamHI-ELP100-NdeI重组载体:
利用PCR扩增出pET28a-ELP100载体中的BamHI-ELP100-NdeI片段。利用BamHI、NdeI酶切割pRELPN质粒,再将BamHI-ELP100-NdeI片段连接到切割后的pRELPN质粒上,构成pRELPN-BamHI-ELP100-NdeI重组质粒,导入到DH5a大肠杆菌中。
④构建pRELPN-NdeI-ELP100-BamHI-CLP III-XhoI重组载体:
利用PCR扩增出pET28a-NdeI-CLP III-XhoI重组质粒的NdeI-CLP III-XhoI。大量培养含有pRELPN-BamHI-ELP100-NdeI重组质粒的大肠杆菌,纯化出pRELPN-BamHI-ELP100-NdeI重组质粒。利用NdeI、XhoI酶切、T4连接酶连接,构建出pRELPN-NdeI-ELP100-BamHI-CLP III-XhoI重组质粒。
⑤将pRELPN载体转染到BL21(DE3)大肠杆菌中,培养和诱导表达。
二、重组质粒导入到BL21(DE3)大肠杆菌中,并优化培养和表达的条件
(1)将pRELPN-BamHI-ELP100-NdeI-CLPⅢ-XhoI重组质粒转染到大肠杆菌表达菌BL21(DE3)中,利用卡那霉素筛选出阳性单克隆,挑出并进行扩大培养再利用IPTG诱导表达,收集并均质破碎,SDS-PAGE电泳鉴定。
(2)本发明所述的培养和表达的条件为:配置500mL的LB培养基,向里接种200μl的菌液以及添加终浓度为50μg/mL的卡那霉素溶液,37℃摇菌过夜,当OD600值达到0.4-0.6时候,放入4℃冰箱预冷30min,后经15℃培养30min,加入IPTG至1mmol/L,15℃摇菌表达40h。
(3)收集菌体,800bar、5min均质破碎,13000rpm、20min离心收集下层菌泥,得到包涵体状态的III型胶原蛋白粗提物,置于-20℃冰箱备用。
三、ELP100-CLP III融合蛋白的粗纯和精纯
(1)粗纯化
将得到的包涵体用5-10倍体积的洗涤液(tris 0.05M、EDTA 2mM、尿素2M、pH 8.0)悬浮洗涤,再以8000rpm、20min。重复洗涤3次。通过SDS-PAGE电泳,检验蛋白提取纯度。
(2)精纯化
将粗纯化的包涵体用0.5体积的溶解液(tris 0.05M、EDTA 5mM、盐酸胍6M、巯基乙醇1%、pH 8.0)溶解0.5h,以12000rpm、20min离心,留上清,将得到的沉淀可以再用溶解液溶解。通过SDS-PAGE电泳,检验蛋白提取纯度。
四、ELP100-CLP III融合蛋白的复性
将用溶解液溶解得到的精纯包涵体蛋白逐滴(2mL/min)滴加到用磁力搅拌器搅拌的复性液(tris 0.05M、EDTA 2mM、尿素2M、0.5M精氨酸、4mM还原性谷胱甘肽、0.4M氧化性谷胱甘肽、pH 8.0)中,比例为1:50。用锡纸包裹避光搅拌过夜。
搅拌结束后,以12000rpm、20min离心,留上清去沉淀。再用10KD的超滤管以8000rcf、15min离心浓缩。最后在含10%甘油的无菌PBS中透析8h,完成复性操作。13000rpm、4℃离心20min,收集可溶性ELP-CLPⅢ蛋白,SDS-PAGE凝胶电泳验证,蛋白含量和纯度,-20℃保存蛋白。
五、利用逆相变循环(Inverse transition cycling,ITC)来对复性后的融合蛋白进行纯化
(1)取适量的复性后的融合蛋白溶液,加入终浓度为1.5mol/L的NaCl,在4℃中放置1h;
(2)样品取出,13000rpm离心20min,留上清;
(3)向上清中加入终浓度为10mg/mL的PEG2000,在37℃水浴锅中水浴20min;
(4)样品取出,13000rpm离心20min,保留沉淀;
(5)用pH7.40的PBS溶液对沉淀进行溶解,SDS-PAGE凝胶电泳验证蛋白含量和纯度,-20℃保存蛋白。
六、利用MTT法测定复兴后目的蛋白的活性
III型胶原蛋白是一种细胞外基质蛋白,对细胞粘附和细胞增殖活性影响较为重要,通过对小鼠成纤维细胞(L929)的粘附性和增殖活性测定重组III型胶原蛋白的生物活性,并建立体外活性测定方法。
①细胞培养。小鼠成纤维细胞L929用含10%胎牛血清的DMEM(低糖)培养基,置于37℃,5%CO2浓度的二氧化碳培养箱中进行培养。细胞长至80%~90%时,用0.25%的胰酶将细胞消化下来,1000rpm离心5min收集细胞,PBS洗涤两次,然后用培养基(含2.5%胎牛血清)配成5×104个/ml的细胞悬液备用。
②铺板。配置无菌的0.5%明胶、0.07%明胶和0.07%Ⅲ型胶原蛋白,取一块96孔板,将待铺细胞的孔均分为四组,分别为实验组(0.07%Ⅲ型胶原蛋白)、阳性对照组(0.5%明胶和0.07%明胶)和空白对照组。铺细胞前,分别于96孔板中预先加入100μl 0.5%明胶、0.07%明胶和0.07%Ⅲ型胶原蛋白,空白对照组则不加,置于37℃二氧化碳培养箱中静置1h成膜。吸除孔内液体,开盖于超净台上静置3-5min,将浓度为5×104个/ml的细胞悬液接种于96孔板中,每孔100μl,于37℃,5%CO2条件下培养72h。
③培养结束后,将96孔板从培养箱中取出,每孔加入10μl配置好的MTT溶液(5mg/mL),混匀,放入细胞培养箱继续孵育4h。
④吸弃孔内培养液,每孔加入100μl DMSO,轻轻敲打96孔板框架使其充分溶解,用酶标仪在490nm处测定吸光度值。
⑤按下式计算细胞增殖率(PI)
实验结果如图所示,ELP100-CLPⅢ融合蛋白具有促进细胞生长作用。
其中图1中A为精纯后的上清、B为第三次洗涤后沉淀、C为第三次洗涤后上清、D为第二次洗涤后沉淀、E为第二次洗涤后上清、F为第一次洗涤后沉淀、G为第一次洗涤后上清、H为破碎离心后沉淀、I为破碎离心后上清、J为Marker。
图2中A为超滤的上清经过1个ITC纯化后的上清、B为超滤后的上清、C为复性结束后离心的沉淀、D为复性结束后离心的上清、E为复性后上清、F为Marker、G为精纯后的沉淀。
图4中(a)为0.5%明胶;(b)为0.07%Ⅲ型胶原蛋白胶原蛋白融合蛋白;(c)为0.07%明胶;(d)为空白对照。
图6中(a)(b)(c)(d)依次为25、50、100、200u g/mI型胶原蛋白融合蛋白作用下的细胞;(e)为空白对照。
以上述依据本发明的理想实施例为启示,通过上述的说明内容,相关工作人员完全可以在不偏离本项发明技术思想的范围内,进行多样的变更以及修改。本项发明的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定其技术性范围。
- 一种ELP-Ⅲ型胶原蛋白的纯化方法及应用
- 一种从人胎盘中提取纯化I型胶原蛋白的优化方法
