三萜皂苷类似物
文献发布时间:2023-06-19 11:03:41
本申请是分案申请,母案的申请号为201680078068.9(国际申请号PCT/US2016/060564),申请日为2016年11月4日,发明名称为“三萜皂苷类似物”。
通过引用并入的相关专利申请
本申请基于2015年11月6日提交的美国临时申请美国序列No.62/252,296和2015年12月17日提交的美国临时申请美国序列No.62/268,837,并根据35U.S.C.§119(e)要求它们的优先权,所述美国临时申请全部内容通过引用整体并入本文。
政府支持
本申请中主题的一些实施方案是在国家健康研究院(National Institutes ofHealth)授予的基金GRANT11540722的美国政府支持下完成的。美国政府对本申请的主题拥有某些权利。
技术领域
本申请涉及三萜糖苷皂苷衍生的佐剂、其合成及其中间体。本申请还提供了包含本发明化合物的药物组合物以及使用所述化合物或组合物治疗感染性疾病的方法。
背景技术
针对感染性疾病的疫苗继续改善全世界的公共健康。随着对病因病原体和必要的免疫反应的知识的增加,产生了日益明确或靶向的疫苗。乙型肝炎、DTaP、HPV、肺炎球菌和其它广泛使用的疫苗需要使用免疫佐剂明矾。然而,80多年前引入的明矾是差的佐剂,限制了这些疫苗中的一些的效力并需要更高或更多剂量的其它疫苗。作为远比明矾更有效的佐剂的先导候选物是天然皂苷佐剂QS-21,尽管存在以下三个主要缺点仍被广泛使用:剂量限制毒性,差的稳定性和优质产品有限的可获得性。
皂苷是作为类固醇和三萜类的二级代谢产物生成的糖苷化合物。它们广泛分布于植物物种和一些海洋无脊椎动物中。皂苷的化学结构赋予广泛的药理学和生物学活性,包括一些强效和有效的免疫学活性。来自南美皂树(South American Quillaja saponariaMolina tree)皮的半纯化皂苷提取物(皂树皂苷)显示出显著的免疫佐剂活性。由于皂树皂苷被发现是至少一百种结构相关的皂苷类糖苷的混合物,所以它们的分离和离析即便不是不可能的,也通常是困难的。已发现这些提取物中称为QS-21的最活性级分包括两种主要异构三萜糖苷皂苷的混合物,每种均含有皂皮酸三萜核心,任一侧具有复合低聚糖和富立体化学的糖基化脂肪酰基链。
几十项近期和正在进行的疫苗临床试验(黑色素瘤、乳腺癌、小细胞肺癌、前列腺癌、HIV-1、疟疾)中QS-21的效力及其有利的毒性特征已将其确定为有前景的用于免疫反应增强和剂量节约的新型佐剂。然而,QS-21在癌症患者中的耐受剂量不超过100-150μg,超过该剂量会出现显著的局部和全身副作用。健康(非癌症)成人和儿童接受者中实际可耐受的最高剂量是25-50mcg,这是免疫次佳剂量。因此,非癌症疫苗的临床成功继续关键地取决于确定和获得更耐受的新型强效佐剂。
获得其它强效的皂树皂苷受到从皂树皂苷提取物获得纯物质的困难的阻碍。此外,许多皂树皂苷的结构特征仍然只是假定的。具有强效的佐剂活性和低毒性的新型皂树皂苷及相关类似物的发现对化学合成和药物领域提出了挑战。
发明内容
本发明包括认识到QS-21作为佐剂的临床使用由于在较高剂量下的毒性而受到限制,并且QS-7(相关的皂树皂苷)难以以纯形式分离。此外,QS-21、QS-7和其它三萜糖苷皂苷的合成途径受其结构复杂性的阻碍。本申请提供了作为QS-21和QS-7的类似物的化合物。
一方面,本申请提供了式I的化合物:
或其药学上可接受的盐,其中
W是-CHO;
V是氢或OR
Y是CH
Z是氢;环状或非环状、任选取代的选自以下的部分:酰基、脂族、杂脂族、芳基、芳基烷基、杂酰基和杂芳基;或具有以下结构的碳水化合物结构域:
其中每次出现的R
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
R
R
R
其中
X是-O-、-NR-或T-R
T是共价键或二价C
R
每次出现的R
每次出现的R独立地是氢、选自以下的任选取代的基团:酰基、芳基烷基、6-10元芳基、C
相同氮原子上的两个R与该氮原子一起形成具有1-2个独立选自氮、氧和硫的杂原子的4-7元杂环。
一方面,本申请提供了式II的化合物:
或其药学上可接受的盐,其中
W是ME、-CHO或
V是氢或OR
Y是CH
Z是氢;环状或非环状、任选取代的选自以下的部分:酰基、脂族、杂脂族、芳基、芳基烷基、杂酰基和杂芳基;或具有以下结构的碳水化合物结构域:
其中每次出现的R
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
R
R
R
其中
X是-O-、-NR-或T-R
T是共价键或二价C
R
每次出现的R
R
R
每次出现的R
两个R
每次出现的R独立地是氢、选自以下的任选取代的基团:酰基、芳基烷基、6-10元芳基、C
相同氮原子上的两个R与该氮原子一起形成具有1-2个独立选自氮、氧和硫的杂原子的4-7元杂环。
本领域普通技术人员将理解,本申请的化合物包括但不一定限于本文所述种类中包含的那些化合物。本申请所涵盖的化合物包括至少在整个说明书整体中公开的所有化合物,包括每一类中的所有各个物类。
另一方面,本发明提供了用于合成QS-7、QS-21及相关类似物的新的半合成方法,所述方法包括将三萜化合物与包含糖的化合物偶联以形成式II的化合物。在一些实施方案中,该方法包括以下步骤:
(a)提供式III的化合物:
其中:
Y′是氢、卤素、烷基、芳基、OR、OR
W是Me、-CHO、-CH
V是氢或-OR
R
每次出现的R
两个R
每次出现的R独立地是氢、选自以下的任选取代的基团:酰基、芳基烷基、6-10元芳基、C
每次出现的R
(b)在适当的条件下用式V的化合物处理所述式III的化合物:
LG-Z
(V)
其中:
Z是氢;环状或非环状、任选取代的选自以下的部分:酰基、脂族、杂脂族、芳基、芳基烷基和杂芳基;或具有以下结构的碳水化合物结构域:
其中:
每次出现的R
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
R
R
R
其中
X是-O-、-NR-或T-R
T是共价键或二价C
R
R
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
每次出现的R
LG是选自以下的适当的离去基团:卤素、亚氨酸酯、烷氧基、磺酰基氧基、任选取代的烷基磺酰基、任选取代的烯基磺酰基、任选取代的芳基磺酰基和重氮鎓部分;
(c)得到本文所述的式I的化合物。
在一些实施方案中,所述方法包括以下步骤:
(a)提供式IV的化合物:
其中:
Y′是氢、卤素、烷基、芳基、OR、OR
W是Me、-CHO、-CH
V是氢或-OR
R
R
每次出现的R
两个R
每次出现的R独立地是氢、选自以下的任选取代的基团:酰基、芳基烷基、6-10元芳基、C
每次出现的R
(b)在适当的条件下用式V的化合物处理所述式IV的化合物:
LG-Z
(V)
其中:
Z是氢;环状或非环状、任选取代的选自以下的部分:酰基、脂族、杂脂族、芳基、芳基烷基和杂芳基;或具有以下结构的碳水化合物结构域:
其中:
每次出现的R1是Rx或具有以下结构的碳水化合物结构域:
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
R
R
R
其中
X是-O-、-NR-或T-R
T是共价键或二价C
R
R
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
每次出现的R
LG是选自以下的适当的离去基团:卤素、亚氨酸酯、烷氧基、磺酰基氧基、任选取代的烷基磺酰基、任选取代的烯基磺酰基、任选取代的芳基磺酰基和重氮鎓部分;
(c)得到本文所述的式II化合物。
根据本主题的另一方面,本申请中公开的化合物已被表明可用作佐剂。另一方面,本申请提供了制备根据本申请实施方案的化合物的方法。另一方面,本发明提供了增强对抗原的免疫应答的方法,包括向受试者施用有效量的提供的疫苗以增强所述受试者对所述抗原的免疫应答。
另一方面,本发明提供接种受试者的方法,包括向所述受试者施用提供的疫苗。在一些实施方案中,受试者是人。在一些实施方案中,疫苗作为注射剂施用。
另一方面,本发明提供了包含本发明化合物和药学上可接受的赋形剂的药物组合物。在某些实施方案中,药物组合物是包含抗原和本发明佐剂的疫苗。
另一方面,本发明提供了包含本发明化合物的药物组合物的药盒。在一些实施方案中,药盒包含开药信息。在一些实施方案中,此类药盒包括本发明的佐剂化合物与另一种免疫治疗剂的组合。这些药剂可以分开包装或一起包装。该药盒任选包含开药的说明。在某些实施方案中,药盒包括多剂量的每种药剂。该药盒可包含足够量的每种组分以治疗受试者一周、两周、三周、四周或数月。在某些实施方案中,药盒包括一轮免疫疗法。在某些实施方案中,药盒包括足够量的药物组合物以长期免疫受试者对抗抗原。
如本文所用,除非另有说明,否则应适用以下定义。
本文使用的术语“脂族”或“脂族基团”是指完全饱和的或包含一个或多个不饱和单元的直链(即非支链)或支链的、取代或未取代的烃链,或完全饱和的或包含一个或多个不饱和单元的但不是芳族的单环烃或双环烃(本文也称为“碳环”、“环脂族”或“环烷基”),其具有与分子的其余部分单一的连接点。除非另有说明,脂族基团含有1-12个脂族碳原子。在一些实施方案中,脂族基团含有1-6个脂族碳原子。在一些实施方案中,脂族基团含有1-5个脂族碳原子。在其它实施方案中,脂族基团含有1-4个脂族碳原子。在其它实施方案中,脂族基团含有1-3个脂族碳原子,并且在其它实施方案中,脂族基团含有1-2个脂族碳原子。在一些实施方案中,“环脂族”(或“碳环”或“环烷基”)是指完全饱和的或包含一个或多个不饱和单元的但不是芳族的单环C3-C6烃,其具有与分子的其余部分单一的连接点。合适的脂族基团包括但不限于直链或支链、取代或未取代的烷基、烯基、炔基及其杂混物,如(环烷基)烷基、(环烯基)烷基或(环烷基)烯基。
术语“低级烷基”是指C
术语“低级卤代烷基”是指被一个或多个卤素原子取代的C
术语“杂原子”是指氧、硫、氮、磷或硅中的一种或多种(包括氮、硫、磷或硅的任何氧化形式;任何碱性氮的季铵化形式或杂环的可取代的氮,例如N(如在3,4-二氢-2H-吡咯基中),NH(如在吡咯烷基中)或NR+(如在N-取代的吡咯烷基中))。
如本文所用,术语“不饱和”是指部分具有一个或多个不饱和单元。
如本文所用,术语“二价C
术语“亚烷基”是指二价烷基。“亚烷基链”是多亚甲基基团,即-(CH2)n-,其中n是正整数,优选1至30,1至28,1至26,1至24,1至22,1至20,1至18,1至16,1至14,1至12,1至10,1至8,1至6,1至4,1至3,1至2,或2至3。取代的亚烷基链是其中一个或多个亚甲基氢原子被取代基代替的多亚甲基。合适的取代基包括下面关于取代的脂族基团描述的那些。
术语“亚烯基”是指二价烯基。取代的亚烯基链是含有至少一个双键的多亚甲基,其中一个或多个氢原子被取代基代替。合适的取代基包括下面关于取代的脂族基团描述的那些。
术语“亚炔基”是指二价炔基。取代的亚炔基链是含有至少一个双键的多亚甲基,其中一个或多个氢原子被取代基代替。合适的取代基包括下面关于取代的脂族基团描述的那些。
单独使用或作为较大部分的一部分使用的术语“酰基”是指通过从羧酸中除去羟基而形成的基团。
术语“卤素”是指F、Cl、Br或I。
术语“芳烷基”和“芳基烷基”可互换使用,并指其中氢原子已被芳基代替的烷基。这样的基团包括但不限于苄基、肉桂基和二氢肉桂基。
单独或作为如“芳烷基”、“芳烷氧基”或“芳基氧基烷基”中较大部分的一部分使用的术语“芳基”是指具有总共5至14个环成员的单环或双环环系统,其中该系统中的至少一个环是芳族的,并且其中该系统中的每个环包含3至7个环成员。术语“芳基”可以与术语“芳基环”互换使用。
在本发明的某些实施方案中,“芳基”是指芳族环系统,包括但不限于可带有一个或多个取代基的苯基、联苯基、萘基、蒽基等。此外,如本文所用,术语“芳基”的范围内包括芳族环与一个或多个非芳族环稠合的基团,例如茚满基、邻苯二甲酰亚胺基、萘二甲酰亚胺基(naphthimidyl)、菲啶基或四氢萘基等。
单独或作为较大部分(例如“杂芳烷基”或“杂芳烷氧基”)的一部分使用的术语“杂芳基”和“杂芳-”是指具有5至10个环原子,优选5、6或9个环原子;具有在环阵列中共享的6、10或14个π电子;并且除了碳原子之外还具有1至5个杂原子的基团。术语“杂原子”是指氮、氧或硫,并且包括氮或硫的任何氧化形式,以及碱性氮的任何季铵化形式。杂芳基基团包括但不限于噻吩基、呋喃基、吡咯基、咪唑基、吡唑基、三唑基、四唑基、噁唑基、异噁唑基、噁二唑基、噻唑基、异噻唑基、噻二唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、吲嗪基、嘌呤基、萘啶基和蝶啶基。如本文所用,术语“杂芳基”和“杂芳-”还包括其中杂芳族环与一个或多个芳基、环脂族或杂环基环稠合的基团,其中连接基或连接点位于杂芳族环上。非限制性实例包括吲哚基、异吲哚基、苯并噻吩基、苯并呋喃基、二苯并呋喃基、吲唑基、苯并咪唑基、苯并噻唑基、喹啉基、异喹啉基、噌啉基、酞嗪基、喹唑啉基、喹喔啉基、4H-喹嗪基、咔唑基、吖啶基、吩嗪基、吩噻嗪基、吩噁嗪基、四氢喹啉基、四氢异喹啉基和吡啶并[2,3-b]-1,4-噁嗪-3(4H)-酮。杂芳基可以是单环或双环的。术语“杂芳基”可以与术语“杂芳基环”、“杂芳基基团”或“杂芳族”互换使用,其中任何术语包括任选被取代的环。术语“杂芳烷基”和“杂芳基烷基”是指被杂芳基部分取代的烷基,其中烷基和杂芳基部分独立地任选被取代。
如本文所用的术语“杂脂族”是指其中一个或两个碳原子独立地被氧、硫、氮或磷中的一种或多种所代替的脂族基团。杂脂族基团可以是取代或未取代的、支链或非支链的、环状或非环状的,并且包括“杂环”、“杂环基”、“杂环脂族”或“杂环”基团。
如本文所用,术语“杂环”、“杂环基”、“杂环基团”和“杂环环”可互换使用,是指稳定的5至7元单环或7-10元双环杂环部分,其为饱和的或部分不饱和的,并且除了碳原子之外还具有一个或多个,优选1至4个如上所定义的杂原子。当涉及杂环的环原子使用时,术语“氮”包括取代的氮。作为实例,在具有0-3个选自氧、硫或氮的杂原子的饱和或部分不饱和环中,氮可以是N(如在3,4-二氢-2H-吡咯基中)、NH(如在吡咯烷基中)或+NR(如在N-取代的吡咯烷基中)。
杂环可以在导致稳定结构的任何杂原子或碳原子处连接至其侧基,并且任何环原子可以任选被取代。这类饱和或部分不饱和杂环基的实例包括但不限于四氢呋喃基、四氢噻吩基、吡咯烷基、哌啶基、吡咯啉基、四氢喹啉基、四氢异喹啉基、十氢喹啉基、噁唑烷基、哌嗪基、二噁烷基、二氧戊环基、二氮杂
如本文所用,术语“部分不饱和”是指包含至少一个双键或三键的环部分。术语“部分不饱和”旨在涵盖具有多个不饱和位点的环,但不旨在包括如本文所定义的芳基或杂芳基部分。
另一方面,本发明提供了“药学上可接受的”组合物,其包含与一种或多种药学上可接受的载体(添加剂)和/或稀释剂一起配制的治疗有效量的一种或多种本文所述的化合物。如详细描述的,本发明的药物组合物可以特别配制用于注射给药。
本文使用的短语“药学上可接受的”是指在合理的医学判断范围内适合用于与人类和动物的组织接触而没有过度毒性、刺激性、过敏反应或其它问题或并发症,具有合理的利益/风险比的那些化合物、材料、组合物和/或剂型。
本文使用的短语“药学上可接受的载体”是指涉及将主题化合物从一个器官或身体的一部分携带或运输到另一个器官或身体的一部分的药学上可接受的材料、组合物或媒介,例如液体或固体填充剂、稀释剂、赋形剂或溶剂包封材料。每种载体在与制剂的其它成分相容且对患者无害的意义上必须是“可接受的”。可用作药学上可接受的载体的材料的一些例子包括:糖,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;粉状黄蓍胶;麦芽;明胶;滑石;赋形剂,如可可脂和栓剂蜡;油,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;二醇类,如丙二醇;多元醇,如甘油、山梨醇、甘露醇和聚乙二醇;酯,如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,如氢氧化镁和氢氧化铝;海藻酸;无热原水;等渗盐水;Ringer's溶液;乙醇;pH缓冲溶液;聚酯,聚碳酸酯和/或聚酐;和药物制剂中使用的其它无毒相容物质。
如本文所用,术语“药学上可接受的盐”是指在合理的医学判断范围内适合用于与人类和低等动物的组织接触而没有过度毒性、刺激性、过敏反应等,具有合理的利益/风险比的那些盐。药学上可接受的盐在本领域中是公知的。例如,S.M.Berge等在J.Pharmaceutical Sciences,1977,66,1-19中详细描述了药学上可接受的盐,该文献通过引用并入本文。本发明化合物的药学上可接受的盐包括衍生自合适的无机和有机酸和碱的那些盐。药学上可接受的无毒酸加成盐的实例为与无机酸如盐酸、氢溴酸、磷酸、硫酸和高氯酸或与有机酸如乙酸、草酸、马来酸、酒石酸、柠檬酸、琥珀酸或丙二酸或通过使用本领域中使用的其它方法如离子交换形成的氨基的盐。其它药学上可接受的盐包括己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、柠檬酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、葡糖酸盐、半硫酸盐、庚酸盐、己酸盐、氢碘酸盐、2-羟基乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、对甲苯磺酸盐、十一烷酸盐、戊酸盐等。
在其它情况下,本发明的化合物可以含有一个或多个酸性官能团,因此能够与药学上可接受的碱形成药学上可接受的盐。这些情况中的术语“药学上可接受的盐”是指本发明化合物的相对无毒的无机和有机碱加成盐。这些盐同样可以在施用媒介中或剂型制造过程中原位制备,或者通过单独使纯化的化合物以其游离酸形式与合适的碱(例如药学上可接受的金属阳离子的氢氧化物、碳酸盐或碳酸氢盐),与氨或与药学上可接受的有机伯胺、仲胺、叔胺或季胺反应制备。衍生自适当碱的盐包括碱金属盐、碱土金属盐、铵盐和N+(C
除非另有说明,否则本文描述的结构还意味着包括该结构的所有异构形式(例如,对映体、非对映体和几何异构体(或构象异构体));例如,每个立构中心的R和S构型、Z和E双键异构体以及Z和E构象异构体。因此,本发明化合物的单一立体化学异构体以及对映体、非对映体和几何(或构象)异构体混合物均在本发明的范围内。除非另有说明,否则本发明化合物的所有互变异构形式都在本发明的范围内。
所提供的化合物可以包含一个或多个糖部分。除非另有说明,否则D-和L-构型以及它们的混合物都在本发明的范围内。除非另有说明,否则α-和β-连接的实施方案及其混合物均被本发明所考虑。
例如,如果需要本发明化合物的特定对映体,则其可以通过不对称合成、手性色谱法或通过用手性助剂衍生而制备,其中所得非对映体混合物被分离且辅助基团被裂解以提供纯的所需对映体。或者,在分子含有碱性官能团如氨基或酸性官能团如羧基的情况下,用合适的光学活性酸或碱形成非对映体盐,接着通过本领域公知的分级结晶或色谱手段拆分由此形成的非对映体,并随后回收纯对映体。
另外,除非另有说明,否则本文所述的结构还意味着包括仅有的不同之处在于存在一个或多个同位素富集的原子的化合物。例如,包括用氘或氚代替氢或用富含13C或14C的碳代替碳的具有本发明结构的化合物也在本发明的范围内。这些化合物可用作例如分析工具、生物测定中的探针或根据本发明的治疗剂。
本领域的普通技术人员将会理解,如本文所述的合成方法利用多种保护基团。如本文所用,术语“保护基”是指特定官能部分例如O、S或N被掩蔽或封闭,如果需要,允许反应选择性地在多官能化合物的另一反应位点进行。在优选的实施方案中,保护基团以良好收率选择性地反应以产生对预计反应稳定的被保护底物;保护基团优选可通过容易获得的优选无毒的试剂选择性地除去,所述试剂不攻击其它官能团;保护基团形成可分离的衍生物(更优选不产生新的立体中心);并且保护基团将优选具有最少的附加官能度以避免进一步的反应位点。如本文详述,可以使用氧、硫、氮和碳保护基团。作为非限制性实例,羟基保护基包括甲基、甲氧基甲基(MOM)、甲硫基甲基(MTM)、叔丁硫基甲基、(苯基二甲基甲硅烷基)甲氧基甲基(SMOM)、苄氧基甲基(BOM)、对甲氧基苄氧基甲基(PMBM)、(4-甲氧基苯氧基)甲基(p-AOM)、愈创木酚甲基(GUM)、叔丁氧基甲基、4-戊烯氧基甲基(POM)、甲硅烷氧基甲基、2-甲氧基乙氧基甲基(MEM)、2,2,2-三氯乙氧基甲基、双(2-氯乙氧基)甲基、2-(三甲基甲硅烷基)乙氧基甲基(SEMOR)、四氢吡喃基(THP)、3-溴四氢吡喃基、四氢硫代吡喃基、1-甲氧基环己基、4-甲氧基四氢吡喃基(MTHP)、4-甲氧基四氢硫代吡喃基、4-甲氧基四氢硫代吡喃基S,S-二氧化物、1-[(2-氯-4-甲基)苯基]-4-甲氧基哌啶-4-基(CTMP)、1,4-二噁烷-2-基、四氢呋喃基、四氢噻吩基、2,3,3a,4,5,6,7,7a-八氢-7,8,8-三甲基-4,7-甲桥苯并呋喃-2-基、1-乙氧基乙基、1-(2-氯乙氧基)乙基、1-甲基-1-甲氧基乙基、1-甲基-1-苄氧基乙基、1-甲基-1-苄氧基-2-氟乙基、2,2,2-三氯乙基、2-三甲基甲硅烷基乙基、2-(苯基氢硒基)乙基、叔丁基、烯丙基、对氯苯基、对甲氧基苯基、2,4-二硝基苯基、苄基、对甲氧基苄基、3,4-二甲氧基苄基、邻硝基苄基、对硝基苄基、对卤代苄基、2,6-二氯苄基、对氰基苄基、对苯基苄基、2-吡啶甲基、4-吡啶甲基、3-甲基-2-吡啶甲基N-氧化物、二苯基甲基、p,p′-二硝基二苯甲基、5-二苯并环庚基、三苯基甲基、α-萘基二苯基甲基、对甲氧基苯基二苯基甲基、二(对甲氧基苯基)苯基甲基、三(对甲氧基苯基)甲基、4-(4′-溴苯甲酰甲基氧基苯基)二苯基甲基、4,4′,4″-三(4,5-二氯苯二甲酰亚氨基苯基)甲基、4,4′,4″-三(4-氧代戊酰基氧基苯基)甲基、4,4′,4″-三(苯甲酰基氧基苯基)甲基、3-(咪唑-1-基)双(4′,4″-二甲氧基苯基)甲基、1,1-双(4-甲氧基苯基)-1′-芘基甲基、9-蒽基、9-(9-苯基)呫吨基、9-(9-苯基-10-氧代)蒽基、1,3-苯并二硫杂环戊烷-2-基、苯并异噻唑基S,S-二氧化物、三甲基甲硅烷基(TMS)、三乙基甲硅烷基(TES)、三异丙基甲硅烷基(TIPS)、二甲基异丙基甲硅烷基(IPDMS)、二乙基异丙基甲硅烷基(DEIPS)、二甲基新己基甲硅烷基、叔丁基二甲基甲硅烷基(TBDMS)、叔丁基二苯基甲硅烷基(TBDPS)、三苄基甲硅烷基、三-对二甲苯基甲硅烷基、三苯基甲硅烷基、二苯基甲基甲硅烷基(DPMS)、叔丁基甲氧基苯基甲硅烷基(TBMPS)、甲酸酯、苯甲酰基甲酸酯、乙酸酯、氯乙酸酯、二氯乙酸酯、三氯乙酸酯、三氟乙酸酯、甲氧基乙酸酯、三苯基甲氧基乙酸酯、苯氧基乙酸酯、对氯苯氧基乙酸酯、3-苯基丙酸酯、4-氧代戊酸酯(4-氧代戊酸酯)、4,4-(亚乙基二硫代)戊酸酯(4-氧代戊酰基二硫代乙缩醛)、新戊酸酯、金刚烷酸酯、巴豆酸酯、4-甲氧基巴豆酸酯、苯甲酸酯、对苯基苯甲酸酯、2,4,6-三甲基苯甲酸酯(trimethylbenzoate)(2,4,6-三甲苯甲酸酯(mesitoate))、烷基甲基碳酸酯、9-芴基甲基碳酸酯(Fmoc)、烷基乙基碳酸酯、烷基2,2,2-三氯乙基碳酸酯(Troc)、2-(三甲基甲硅烷基)乙基碳酸酯(TMSEC)、2-(苯基磺酰基)乙基碳酸酯(Psec)、2-(三苯基磷鎓基)乙基碳酸酯(Peoc)、烷基异丁基碳酸酯、烷基乙烯基碳酸酯烷基烯丙基碳酸酯、烷基对硝基苯基碳酸酯、烷基苄基碳酸酯、烷基对甲氧基苄基碳酸酯、烷基3,4-二甲氧基苄基碳酸酯、烷基邻硝基苄基碳酸酯、烷基邻硝基苄基碳酸酯、烷基S-苄基硫代碳酸酯、4-乙氧基-1-萘基碳酸酯、甲基二硫代碳酸酯、2-碘苯甲酸酯、4-叠氮丁酸酯、4-硝基-4-甲基戊酸酯、邻(二溴甲基)苯甲酸酯、2-甲酰基苯磺酸酯、2-(甲硫基甲氧基)乙基、4-(甲硫基甲氧基)丁酸酯、2-(甲硫基甲氧基甲基)苯甲酸酯、2,6-二氯-4-甲基苯氧基乙酸酯、2,6-二氯-4-(1,1,3,3-四甲基丁基)苯氧基乙酸酯、2,4-双(1,1-二甲基丙基)苯氧基乙酸酯、氯二苯基乙酸酯、异丁酸酯、单琥珀酸酯、(E)-2-甲基-2-丁烯酸酯、邻(甲氧基羰基)苯甲酸酯、α-萘甲酸酯、硝酸酯、烷基N,N,N′,N′-四甲基磷酰二胺(phosphorodiamidate)、烷基N-苯基氨基甲酸酯、硼酸酯、二甲基膦酰硫基、烷基2,4-二硝基苯基亚磺酸酯、硫酸酯、甲烷磺酸酯(甲磺酸酯)、苄基磺酸酯、和甲苯磺酸酯(Ts)。为了保护1,2-或1,3-二醇,保护基包括亚甲基缩醛、亚乙基缩醛、1-叔丁基亚乙基缩酮、1-苯基亚乙基缩酮、(4-甲氧基苯基)亚乙基缩醛、2,2,2-三氯亚乙基缩醛、丙酮化物、亚环戊基缩酮、亚环己基缩酮、亚环庚基缩酮、亚苄基缩醛、对甲氧基亚苄基缩醛、2,4-二甲氧基亚苄基缩酮、3,4-二甲氧基亚苄基缩醛、2-硝基亚苄基缩醛、甲氧基亚甲基缩醛、乙氧基亚甲基缩醛、二甲氧基亚甲基原酸酯、1-甲氧基亚乙基原酸酯、1-乙氧基亚乙基原酸酯、1,2-二甲氧基亚乙基原酸酯、α-甲氧基亚苄基原酸酯、1-(N,N-二甲基氨基)亚乙基衍生物、α-(N,N′-二甲基氨基)亚苄基衍生物、2-氧杂亚环戊基原酸酯、二-叔丁基亚甲硅烷基(DTBS)、1,3-(1,1,3,3-四异丙基亚二硅杂氧杂环戊烷基)衍生物(TIPDS)、四-叔丁氧基二硅氧烷-1,3-二亚基衍生物(TBDS)、环碳酸酯、环硼酸酯、乙基硼酸酯和苯基硼酸酯。氨基保护基包括甲基氨基甲酸酯、乙基氨基甲酸酯、9-芴基甲基氨基甲酸酯(Fmoc)、9-(2-磺基)芴基甲基氨基甲酸酯、9-(2,7-二溴)芴基甲基氨基甲酸酯、2,7-二-叔丁基-[9-(10,10-二氧代-10,10,10,10-四氢噻吨基)]甲基氨基甲酸酯(DBD-Tmoc)、4-甲氧基苯甲酰甲基氨基甲酸酯(Phenoc)、2,2,2-三氯乙基氨基甲酸酯(Troc)、2-三甲基甲硅烷基乙基氨基甲酸酯(Teoc)、2-苯基乙基氨基甲酸酯(hZ)、1-(1-金刚烷基)-1-甲基乙基氨基甲酸酯(Adpoc)、1,1-二甲基-2-卤乙基氨基甲酸酯、1,1-二甲基-2,2-二溴乙基氨基甲酸酯(DB-t-BOC)、1,1-二甲基-2,2,2-三氯乙基氨基甲酸酯(TCBOC)、1-甲基-1-(4-联苯基)乙基氨基甲酸酯(Bpoc)、1-(3,5-二-叔丁基苯基)-1-甲基乙基氨基甲酸酯(t-Bumeoc)、2-(2′-和4′-吡啶基)乙基氨基甲酸酯(Pyoc)、2-(N,N-二环己基甲酰胺基)乙基氨基甲酸酯、叔丁基氨基甲酸酯(BOC)、1-金刚烷基氨基甲酸酯(Adoc)、乙烯基氨基甲酸酯(Voc)、烯丙基氨基甲酸酯(Alloc)、1-异丙基烯丙基氨基甲酸酯(Ipaoc)、肉桂基氨基甲酸酯(Coc)、4-硝基肉桂基氨基甲酸酯(Noc)、8-喹啉基氨基甲酸酯、N-羟基哌啶基氨基甲酸酯、烷基二硫代氨基甲酸酯、苄基氨基甲酸酯(Cbz)、对甲氧基苄基氨基甲酸酯(Moz)、对硝基苄基氨基甲酸酯、对溴苄基氨基甲酸酯、对氯苄基氨基甲酸酯、2,4-二氯苄基氨基甲酸酯、4-甲基亚磺酰基苄基氨基甲酸酯(Msz)、9-蒽基甲基氨基甲酸酯、二苯基甲基氨基甲酸酯、2-甲硫基乙基氨基甲酸酯、2-甲基磺酰基乙基氨基甲酸酯、2-(对甲苯磺酰基)乙基氨基甲酸酯、[2-(1,3-二噻烷基)]甲基氨基甲酸酯(Dmoc)、4-甲基噻吩基氨基甲酸酯(Mtpc)、2,4-二甲基噻吩基氨基甲酸酯(Bmpc)、2-磷鎓基乙基氨基甲酸酯(Peoc)、2-三苯基磷鎓基异丙基氨基甲酸酯(Ppoc)、1,1-二甲基-2-氰基乙基氨基甲酸酯、间氯对酰基氧基苄基氨基甲酸酯、对(二羟基硼烷基)苄基氨基甲酸酯、5-苯并异噁唑基甲基氨基甲酸酯、2-(三氟甲基)-6-色酮基甲基氨基甲酸酯(Tcroc)、间硝基苯基氨基甲酸酯、3,5-二甲氧基苄基氨基甲酸酯、邻硝基苄基氨基甲酸酯、3,4-二甲氧基-6-硝基苄基氨基甲酸酯、苯基(邻硝基苯基)甲基氨基甲酸酯、吩噻嗪基-(10)-羰基衍生物、N′-对甲苯磺酰基氨基羰基衍生物、N′-苯基氨基硫代羰基衍生物、叔戊基氨基甲酸酯、S-苄基硫代氨基甲酸酯、对氰基苄基氨基甲酸酯、环丁基氨基甲酸酯、环己基氨基甲酸酯、环戊基氨基甲酸酯、环丙基甲基氨基甲酸酯、对癸基氧基苄基氨基甲酸酯、2,2-二甲氧基羰基乙烯基氨基甲酸酯、邻(N,N-二甲基甲酰胺基)苄基氨基甲酸酯、1,1-二甲基-3-(N,N-二甲基甲酰胺基)丙基氨基甲酸酯、1,1-二甲基丙炔基氨基甲酸酯、二(2-吡啶基)甲基氨基甲酸酯、2-呋喃基甲基氨基甲酸酯、2-碘乙基氨基甲酸酯、异硼烷基氨基甲酸酯、异丁基氨基甲酸酯、异烟酰基氨基甲酸酯、对(p′-甲氧基苯基偶氮)苄基氨基甲酸酯、1-甲基环丁基氨基甲酸酯、1-甲基环己基氨基甲酸酯、1-甲基-1-环丙基甲基氨基甲酸酯、1-甲基-1-(3,5-二甲氧基苯基)乙基氨基甲酸酯、1-甲基-1-(对苯基偶氮苯基)乙基氨基甲酸酯、1-甲基-1-苯基乙基氨基甲酸酯、1-甲基-1-(4-吡啶基)乙基氨基甲酸酯、苯基氨基甲酸酯、对(苯基偶氮)苄基氨基甲酸酯、2,4,6-三-叔丁基苯基氨基甲酸酯、4-(三甲基铵)苄基氨基甲酸酯、2,4,6-三甲基苄基氨基甲酸酯、甲酰胺、乙酰胺、氯乙酰胺、三氯乙酰胺、三氟乙酰胺、苯基乙酰胺、3-苯基丙酰胺、吡啶甲酰胺、3-吡啶基甲酰胺、N-苯甲酰基苯基丙氨酰衍生物、苯甲酰胺、对苯基苯甲酰胺、邻硝基苯基乙酰胺、邻硝基苯氧基乙酰胺、乙酰乙酰胺、(N′-二硫代苄基氧基羰基氨基)乙酰胺、3-(对羟基苯基)丙酰胺、3-(邻硝基苯基)丙酰胺、2-甲基-2-(邻硝基苯氧基)丙酰胺、2-甲基-2-(邻苯基偶氮苯氧基)丙酰胺、4-氯丁酰胺、3-甲基-3-硝基丁酰胺、邻硝基肉桂酰胺、N-乙酰蛋氨酸衍生物、邻硝基苯甲酰胺、邻(苯甲酰基氧基甲基)苯甲酰胺、4,5-二苯基-3-噁唑啉-2-酮、N-邻苯二甲酰亚胺、N-二硫杂琥珀酰亚胺(Dts)、N-2,3-二苯基马来酰亚胺、N-2,5-二甲基吡咯、N-1,1,4,4-四甲基二甲硅烷基氮杂环戊烷加合物(STABASE)、5-取代的1,3-二甲基-1,3,5-三氮杂环己烷-2-酮、5-取代的1,3-二苄基-1,3,5-三氮杂环己烷-2-酮、1-取代的3,5-二硝基-4-吡啶酮、N-甲基胺、N-烯丙基胺、N-[2-(三甲基甲硅烷基)乙氧基]甲基胺(SEM)、N-3-乙酰氧基丙基胺、N-(1-异丙基-4-硝基-2-氧代-3-吡咯啉-3-基)-胺、季铵盐、N-苄基胺、N-二(4-甲氧基苯基)甲基胺、N-5-二苯并环庚基胺、N-三苯基甲基胺(Tr)、N-[(4-甲氧基苯基)二苯基甲基]胺(MMTr)、N-9-苯基芴基胺(PhF)、N-2,7-二氯-9-芴基亚甲基胺、N-二茂铁基甲基氨基(Fcm)、N-2-吡啶甲基氨基N′-氧化物、N-1,1-二甲硫基亚甲基胺、N-亚苄基胺、N-对甲氧基亚苄基胺、N-二苯基亚甲基胺、N-[(2-吡啶基)2,4,6-三甲苯基]亚甲基胺、N-(N′,N′-二甲基氨基亚甲基)胺、N′,N′-亚异丙基二胺、N-对硝基亚苄基胺、N-亚水杨基胺、N-5-氯亚水杨基胺、N-(5-氯-2-羟基苯基)苯基亚甲基胺、N-亚环己基胺、N-(5,5-二甲基-3-氧代-1-环己烯基)胺、N-硼烷衍生物、N-二苯基次硼酸衍生物、N-[苯基(五羰基铬-或钨)羰基]胺、N-铜螯合物、N-锌螯合物、N-硝基胺、N-亚硝基胺、胺N-氧化物、二苯基亚膦酰胺(Dpp)、二甲基硫代亚膦酰胺(Mpt)、二苯基硫代亚膦酰胺(Ppt)、二烷基氨基磷酸酯(phosphoramidate)、二苄基氨基磷酸酯、二苯基氨基磷酸酯、苯亚磺酰胺、邻硝基苯亚磺酰胺(Nps)、2,4-二硝基苯亚磺酰胺、五氯苯亚磺酰胺、2-硝基-4-甲氧基苯亚磺酰胺、三苯基甲基亚磺酰胺、3-硝基吡啶亚磺酰胺(Npys)、对甲苯磺酰胺(Ts)、苯磺酰胺、2,3,6,-三甲基-4-甲氧基苯磺酰胺(Mtr)、2,4,6-三甲氧基苯磺酰胺(Mtb)、2,6-二甲基-4-甲氧基苯磺酰胺(Pme)、2,3,5,6-四甲基-4-甲氧基苯磺酰胺(Mte)、4-甲氧基苯磺酰胺(Mbs)、2,4,6-三甲基苯磺酰胺(Mts)、2,6-二甲氧基-4-甲基苯磺酰胺(iMds)、2,2,5,7,8-五甲基色烷-6-磺酰胺(Pmc)、甲烷磺酰胺(Ms)、β-三甲基甲硅烷基乙烷磺酰胺(SES)、9-蒽磺酰胺、4-(4′,8′-二甲氧基萘基甲基)苯磺酰胺(DNMBS)、苄基磺酰胺、三氟甲基磺酰胺和苯甲酰甲基磺酰胺。示例性的保护基团在本文中详述,然而,应该理解的是,本发明不打算局限于这些保护基团;相反,使用上述标准可以容易地确定多种其它等同的保护基团并将其用于本发明的方法中。此外,Greene和Wuts(同上)描述了各种保护基团。
如本文所述,本发明的化合物可含有“任选取代的”部分。通常,术语“取代的”,无论是否之前有术语“任选”,是指指定部分的一个或多个氢被合适的取代基代替。除非另外指明,否则“任选取代的”基团可以在该基团的每个可取代位置具有合适的取代基,并且当任何给定结构中的多于一个位置可以被选自特定组的多于一个取代基取代时,在每个位置上的取代基可以相同或不同。本发明所设想的取代基的组合优选为导致形成稳定的或化学上可行的化合物的那些。如本文所用,术语“稳定的”是指当经历条件以允许其生产、检测并且在某些实施方案中允许其回收、纯化和用于一个或多个在此公开的目的时不显著改变的化合物。
“任选取代的”基团的可取代的碳原子上的合适的单价取代基独立地为卤素;-(CH
在R
“任选取代的”基团的饱和碳原子上的合适的二价取代基包括以下基团:=O、=S、=NNR
R*的脂族基团上的合适的取代基包括卤素、-R
“任选取代的”基团的可取代的氮上的合适的取代基包括
本文使用的短语“肠胃外施用”和“肠胃外地施用”是指除肠内和局部施用外的施用模式,通常通过注射,并且包括但不限于静脉内、肌内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内和胸骨内注射和输注。
如本文所用,短语“全身施用”、“全身地施用”、“外周施用”和“外周地施用”是指化合物、药物或其它物质除了直接施用进入中枢神经系统的施用方式,使得其进入患者系统,因此受到新陈代谢和其它类似过程的影响,例如皮下施用。
如本文所用的术语“富集的”是指具有增加比例的一种或多种物质的混合物。在一些实施方案中,在增加混合物中一种或多种所需物质的比例的方法之后使混合物“富集”。在一些实施方案中,所需物质大于混合物的10%。在一些实施方案中,所需物质大于混合物的25%。在一些实施方案中,所需物质大于混合物的40%。在一些实施方案中,所需物质大于混合物的60%。在一些实施方案中,所需物质大于混合物的75%。在一些实施方案中,所需物质大于混合物的85%。在一些实施方案中,所需物质大于混合物的90%。在一些实施方案中,所需物质大于混合物的95%。这种比例可以以任何方式测量,例如,以摩尔比、体积比或重量比测量。
术语“纯的”是指基本上不含有相关非目标结构的化合物或化学前体(当化学合成时)的化合物。这种品质可能被测量或表达为“纯度”。在一些实施方案中,目标化合物具有小于约30%,20%,10%,5%,2%,1%,0.5%和0.1%的非目标结构或化学前体。在某些实施方案中,本发明的纯化合物仅为一种前皂苷元化合物(即,将目标前皂苷元与其它前皂苷元分离)。
术语“碳水化合物”是指糖或糖的聚合物。术语“糖”、“多糖”、“碳水化合物”和“低聚糖”可以互换使用。大多数碳水化合物是具有许多羟基的醛或酮,通常在分子的每个碳原子上有一个羟基。碳水化合物通常具有分子式C
当与附图一起考虑时,本申请的进一步的目的、特征和优点将由在下面阐述的详细内容变得明显。
附图简单说明
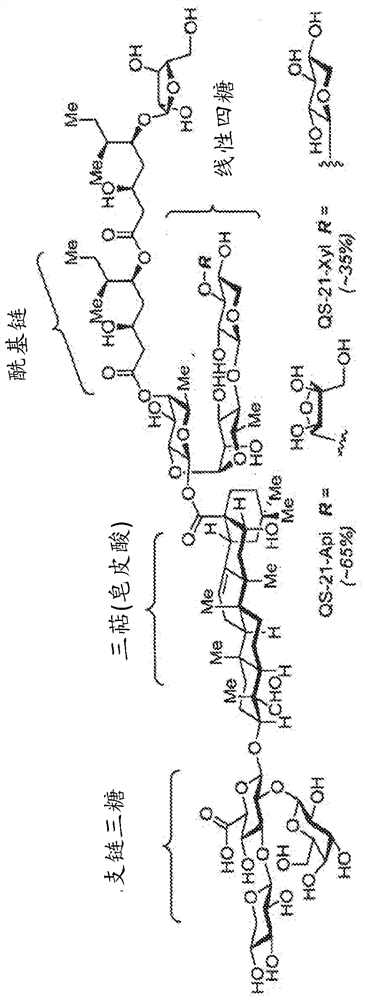
图1描述了QS-21-Api和QS-21-Xyl的化学结构。百分比对应于QS-21的分离提取物中每种异构体的天然丰度。
图2描述了显示高或低剂量的Prevnar-13或Lym2-CRM197缀合物与合成的QS-21(SQS-21)或化合物I-4(TiterQuil-1-0-5-5/TQL-1055)组合的免疫原性的数据。
图3描述了显示Adacel单独或与化合物I-4(TiterQuil-1-0-5-5/TQL-1055)或QS-21组合的免疫原性的数据(Pharm/tox研究)。
图4描述了显示Engerix-B单独或与10、30、100或300mcg化合物I-4(TiterQuil-1-0-5-5/TQL-1055)组合的免疫原性的数据。
图5描述了显示2uM、5uM和20uM的QS-21和20uM、100uM和200uM化合物I-4(TiterQuil-1-0-5-5/TQL-1055)的溶血活性的数据。以Triton-X100/SDS裂解对照的%记录%溶血活性。
图6描述了获得用于化合物I-4(TiterQuil-1-0-5-5/TQL-1055)的全合成中的中间体的一种合成途径。
图7描述了获得用于化合物I-4(TiterQuil-1-0-5-5/TQL-1055)的全合成中的中间体的一种合成途径。
图8描述了获得化合物I-4(TiterQuil-1-0-5-5/TQL-1055)的全合成。在该图中,“半纯化的树皮提取物”是来自Quillaja saponaria的半纯化的提取物(可作为Quil-A市售得到,Accurate Chemical and Scientific Corporation,Westbury,NY)。
具体实施方式
抗癌、抗病毒和抗微生物疫苗的临床成功关键取决于确定和获得具有减少毒性的新型强效佐剂。在这种情况下,来自皂树(QS)树皮提取物的特定级分已被证明是免疫治疗中非常有效的佐剂。QS-21级分(Kensil,C.R.;Patel,U.;Lennick,M.;Marciani,D.J.Immunol.1991,146,431-437)包含复合三萜糖苷皂苷的异构形式(Soltysik,S.;Wu,J.Y.;Recchia,J.;Wheeler,D.A.;Newman,M.J.;Coughlin,R.T.;Kensil,C.R.Vaccine1995,13,1403-1410;Kensil,C.R.Crit.Rev.Ther.Drug Carrier Syst.1996,13,1-55),之前已经被视为最有希望的免疫增强剂(Kim,S.K.;Ragupathi,G.;Musselli,C.;Choi,S.J.;Park,Y.S.;Livingston,P.O.Vaccine 2000,18,597-603),用于抗多种肿瘤(黑素瘤、乳腺癌、小细胞肺癌、前列腺癌)(Livingston,P.O.;Ragupathi,G.Hum.Vaccines 2006,2,137-143)和感染性疾病(HIV,疟疾)疫苗疗法(Sasaki,S.;Sumino,K.;Hamajima,K.;Fukushima,J.;Ishii,N.;Kawamoto,S.;Mohri,H.;Kensil,C.R.;Okuda,K.J.Virol.1998,72,4931-4939;Evans,T.G.,et al.Vaccine 2001,19,2080-2091;Kashala,O.,et al.Vaccine2002,20,2263-2277;Carcaboso,A.M.;Hernandez,R.M.;Igartua,M.;Rosas,J.E.;Patarroyo,M.E.;Pedraz,J.L.Vaccine 2004,22,1423-1432)。
然而,QS-21在癌症患者中的耐受剂量通常不超过100-150μg,高于此剂量会出现明显的局部红斑和全身性流感样症状。QS-21固有的不稳定性会导致与其降解有关的毒性。也已知QS-21是溶血性的,并且此溶血活性之前已被设想为至少一些QS-21的佐剂活性与其溶血性质有关。通过用乳液(AS02,来自GlaxoSmithKline(GSK),或脂质体(AS01,GSK))配制,部分解决了QS-21的各种缺点中的一些,然而,这些溶液是次优的并且仍然强烈需要改良的佐剂,其显示良好的佐剂性能,同时保持高度的耐受性和/或减少的副作用。
现在,令人惊讶的是,本发明主题的发明人已经发现,本申请的化合物(其在一些实施方案中为QS-21和其它QS萃取级分如QS-7的合成类似物)具有显著的独立佐剂活性,以及高度的耐受性和/或减少的副作用。这些新的佐剂化合物的生产比天然QS-21更具成本效益,更稳定,更有效且毒性更低,用于预防性和治疗性疫苗接种计划。一些实施方案在剂量接近可能的1000mcg人剂量的小鼠的药理学/毒理学研究中没有可检测的毒性。一些实施方案令人惊讶地完全非溶血性,同时仍保留其佐剂性质。这是令人惊讶的,部分是因为最初认为QS-21的毒性和效力与QS-21相关的溶血和其它细胞毒性有关。本申请的一些实施方案通过用非常稳定的酰胺键代替QS-21中酰基链的不稳定酯键而产生更高的稳定性和更低的溶血活性,从而产生QS-21的佐剂活性类似物。尽管与QS-21相比具有简化的结构,一些实施方案也保留了佐剂活性,导致与合成的QS-21相比更高的合成产率和显著减少的合成步骤和生产成本。
本申请还提供了合成本申请化合物的有效半合成方法,由此显著减少了获得这种有效类型的佐剂所需的合成步骤的数量。
本申请还包括包含本申请化合物以及免疫有效量的与细菌或病毒相关的抗原的药物组合物。包括在本申请主题中的细菌或病毒由与乙型肝炎、肺炎球菌、白喉、破伤风、百日咳或莱姆(Lyme)病有关的细菌或病毒组成,包括密切相关的包柔氏螺旋体(Borrelia)属的螺旋原虫,例如B.burgdorferi、B.garinii、B.afzelli和B.japonica。
本申请还包括接种人类患者的方法,包括施用免疫有效量的本申请的药物组合物或化合物。本申请还包括增加对疫苗的免疫应答的方法,包括施用免疫有效量的本申请的药物组合物或化合物。
化合物
本发明的化合物包括上文一般性描述的那些化合物,并且通过本文公开的类别、亚类和种类进一步说明。在一些实施方案中,提供的化合物是天然存在的三萜糖苷皂苷的类似物及其中间体。为了本发明的目的,化学元素根据元素周期表,CAS版,化学和物理手册(Handbook of Chemistry and Physics),第75版确定。此外,有机化学的一般原理描述于Organic Chemistry,Thomas Sorrell,University Science Books,Sausalito:1999,和March's Advanced Organic Chemistry,第5版:Smith,M.B.和March编辑,J.,John Wiley&Sons,New York:2001,其全部内容通过引用结合于此。
示例性化合物的描述
在一些实施方案中,提供的化合物是皂树皂苷(Quillaja saponins)的类似物。在一些实施方案中,提供的化合物是前皂苷元。在某些实施方案中,提供的化合物是QS-7和QS-21的类似物并且具有有效的佐剂活性。
一方面,本申请提供了式I的化合物:
或其药学上可接受的盐,其中
W是-CHO;
V是氢或OR
Y是CH
Z是氢;环状或非环状、任选取代的选自以下的部分:酰基、脂族、杂脂族、芳基、芳基烷基、杂酰基和杂芳基;或具有以下结构的碳水化合物结构域:
其中每次出现的R
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
R
R
R
其中
X是-O-、-NR-或T-R
T是共价键或二价C
R
每次出现的R
每次出现的R独立地是氢、选自以下的任选取代的基团:酰基、芳基烷基、6-10元芳基、C
相同氮原子上的两个R与该氮原子一起形成具有1-2个独立选自氮、氧和硫的杂原子的4-7元杂环。
一方面,本申请提供了式II的化合物:
或其药学上可接受的盐,其中
W是ME、-CHO或
V是氢或OR
Y是CH
Z是氢;环状或非环状、任选取代的选自以下的部分:酰基、脂族、杂脂族、芳基、芳基烷基、杂酰基和杂芳基;或具有以下结构的碳水化合物结构域:
其中每次出现的R
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
R
R
R
其中
X是-O-、-NR-或T-R
T是共价键或二价C
R
每次出现的R
R
R
每次出现的R
两个R
每次出现的R独立地是氢、选自以下的任选取代的基团:酰基、芳基烷基、6-10元芳基、C
相同氮原子上的两个R与该氮原子一起形成具有1-2个独立选自氮、氧和硫的杂原子的4-7元杂环。
一方面,本申请提供了式I的化合物:
或其药学上可接受的盐,其中
W是-CHO;
V是-OH;
Y是-O-;
其中Z是具有以下结构的碳水化合物结构域:
其中:
R
R
R
R
其中:
X是-O-、-NR-或T-R
T是共价键或二价C
R
本领域普通技术人员将会理解,本申请的化合物包括但不一定限于包含在作为本部分的一部分阐述的种类定义中的那些化合物。本申请所涵盖的化合物包括作为整体在整个说明书中公开的至少所有化合物,包括每个种类内的所有各个种类。
在某些实施方案中,V是OR
在某些实施方案中,Y是-O-。在某些实施方案中,Y是-NH-。在某些实施方案中,Y是-NR-。在某些实施方案中,Y是CH
在某些实施方案中,Z是氢。在某些实施方案中,Z是环状或非环状、任选取代的部分。在某些实施方案中,Z是酰基。在某些实施方案中,Z是脂族。在某些实施方案中,Z是杂脂族。在某些实施方案中,Z是芳基。在某些实施方案中,Z是芳基烷基。在某些实施方案中,Z是杂酰基。在某些实施方案中,Z是杂芳基。在某些实施方案中,Z是具有以下结构的碳水化合物结构域:
在一些实施方案中,Z是具有以下结构的碳水化合物结构域:
其中:
R
R
R
R
在一些实施方案中,R
在一些方面,每次出现的a、b和c独立地是0、1或2。在一些实施方案中,d是1-5的整数。在一些实施方案中,各d括号内的结构可以相同。在一些实施方案中,各d括号内的结构可以不同。在一些实施方案中,d括号内的结构表示呋喃糖或吡喃糖部分。在一些实施方案中,b和c的总和是1或2。
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,X是-O-。在一些实施方案中,X是-NR-。在一些实施方案中,X是T-R
在一些实施方案中,T是共价键或二价C
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R是氢。在一些实施方案中,R是酰基。在一些实施方案中,R是芳基烷基。在一些实施方案中,R是6-10元芳基。在一些实施方案中,R是C
在一些实施方案中,R
式I的示例性化合物如以下表1所述:
应该理解,本主题的目的不是要求保护作为天然存在的前皂苷元或皂苷的分离或降解研究的结果的现有技术中公开的化合物。
化合物的合成
如授权为美国专利8,283,456的U.S.序号12/420,803(及其母/子美国申请和公开)中所述,QS-21及其至少一些类似物的合成可部分通过从Quillaja saponaria(可作为Quil-A市售得到,Accurate Chemical and Scientific Corporation,Westbury,NY)获得半纯化提取物来进行,Quillaja saponaria包含至少50种不同的皂苷物质的混合物(vanSetten,D.C.;Vandewerken,G.;Zomer,G.;Kersten,G.F.A.Rapid Commun.MassSpectrom.1995,9,660-666)。许多所述皂苷物质包括在免疫活性皂树皂苷中发现的三萜三糖亚结构,例如QS-21和QS-7。将这些皂苷物质暴露于碱水解,得到富含前皂苷元A、B和C(如下所示)的混合物。
授权为美国专利8,283,456的U.S.序号12/420,803(及其母/子美国申请和公开)提出了一种策略,其允许通过硅胶色谱法容易地分离衍生的前皂苷元A、B和C。应该理解的是,本申请的一些实施方案可以部分地使用授权为美国专利8,283,456的U.S.序号12/420,803(及其母/子美国申请和公开)中所述的方法,特别是涉及容易分离衍生的前皂苷元A、B和C的方法来进行。在一个方面,分离的衍生的前皂苷元A、B和/或C然后可用于使用本文所述的方法合成QS-21或其类似物。
在一个实施方案中,本申请提供了用于合成QS-7、QS-21和相关类似物的半合成方法,所述方法包括将三萜化合物与包含糖的化合物偶联以形成式I或式II的化合物。在一些实施方案中,该方法包括以下步骤:
(a)提供式III的化合物:
其中:
Y′是氢、卤素、烷基、芳基、OR、OR
W是Me、-CHO、-CH
V是氢或-OR
R
每次出现的R
两个R
每次出现的R独立地是氢、选自以下的任选取代的基团:酰基、芳基烷基、6-10元芳基、C
每次出现的R
(b)在适当的条件下用式V的化合物处理所述式III的化合物:
LG-Z
(V)
其中:
Z是氢;环状或非环状、任选取代的选自以下的部分:酰基、脂族、杂脂族、芳基、芳基烷基和杂芳基;或具有以下结构的碳水化合物结构域:
其中:
每次出现的R1是Rx或具有以下结构的碳水化合物结构域:
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
R
R
R
其中
X是-O-、-NR-或T-R
T是共价键或二价C
R
每次出现的R
LG是选自以下的适当的离去基团:卤素、亚氨酸酯、烷氧基、磺酰基氧基、任选取代的烷基磺酰基、任选取代的烯基磺酰基、任选取代的芳基磺酰基和重氮鎓部分;
(c)得到本文所述的式I的化合物。
在一些实施方案中,所述方法包括以下步骤:
(a)提供式IV的化合物:
其中:
Y′是氢、卤素、烷基、芳基、OR、OR
W是Me、-CHO、-CH
V是氢或-OR
R
R
每次出现的R
两个R
每次出现的R独立地是氢、选自以下的任选取代的基团:酰基、芳基烷基、6-10元芳基、C
每次出现的R
(b)在适当的条件下用式V的化合物处理所述式IV的化合物:
LG-Z
(V)
其中:
Z是氢;环状或非环状、任选取代的选自以下的部分:酰基、脂族、杂脂族、芳基、芳基烷基和杂芳基;或具有以下结构的碳水化合物结构域:
其中:
每次出现的R1是Rx或具有以下结构的碳水化合物结构域:
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
R
R
R
其中
X是-O-、-NR-或T-R
T是共价键或二价C
R
每次出现的R
LG是选自以下的适当的离去基团:卤素、亚氨酸酯、烷氧基、磺酰基氧基、任选取代的烷基磺酰基、任选取代的烯基磺酰基、任选取代的芳基磺酰基和重氮鎓部分;
(c)得到本文所述的式II化合物。
在另一方面,本申请提供了合成方法,包括:
(a)提供式III的化合物:
其中:
Y′是氢、卤素、烷基、芳基、OR、OR
W是-CHO;
V是-OR
R
(b)在适当的条件下用式V的化合物处理所述式III的化合物:
LG-Z
(V)
其中:
Z是具有以下结构的碳水化合物结构域:
其中:
R
R
R
R
其中:
X是-O-、-NR-或T-R
T是共价键或二价C
R
(c)得到本文所述的式I的化合物。
另一方面,本申请提供了合成式I的化合物或其中间体的方法,包括以下步骤:
(a)提供式III的化合物:
其中:
Y′是氢、卤素、烷基、芳基、OR、OR
W是-CHO;
V是-OH;
其中式III的化合物的一个或多个取代基任选被保护;
(b)使式III的化合物与式X的化合物反应:
其中:
R
R
R
其中:
X是-O-、-NR-或T-R
T是共价键或二价C
R
R
R独立地是氢、选自以下的任选取代的基团:酰基、芳基烷基、6-10元芳基、C
相同氮原子上的两个R与该氮原子一起形成具有1-2个独立选自氮、氧和硫的杂原子的4-7元杂环;
R
其中:
每次出现的a、b和c独立地是0、1或2;
d是1-5的整数,其中各d括号内的结构可以相同或不同;前提是d括号内的结构表示呋喃糖或吡喃糖部分,b和c的总和是1或2;
R
每次出现的R
在一个实施方案中,式X的化合物是:
在一个实施方案中,所述方法包括使步骤(b)的产物或另外的下游产物与R
另一方面,本申请提供了合成式I的化合物或其中间体的方法,其包括以下步骤中的至少一个:
其中C-1是:
其中C-2是OH-C(O)-(CH
另一方面,本申请公开了用于化合物I-4(TQL-1055/TiterQuil-1-0-5-5)的合成途径,例如如图6-8所示。本领域普通技术人员将理解,可以根据本领域普通技术人员的知识修改或调整这些图中描述的化合物I-4及其中间体的合成以获得其它分子。本领域普通技术人员将理解的是,根据本领域普通技术人员的知识,可以修改或调整这些图中所述的化合物I-4及其中间体的合成,以改变得到化合物I-4(TQL-1055/TiterQuil-1-0-5-5)的途径。
在主题的另一方面中,QS-21、QS-7和/或这些化合物的类似物的合成可以通过使用本申请中描述的实施例(包括实施例1-10)中公开的一种或多种方法进行。虽然在这些实施例中公开了几种化合物的合成,但是本领域的普通技术人员将会理解,可以根据本领域普通技术人员的知识修改或调整这些方法以获得其它分子。
另一方面,本申请还包括用于获得本申请的化合物的方法,其包括提供根据本申请的化合物和第二物质,并且随后通过除去至少一部分第二物质来纯化本申请的化合物。
佐剂
大多数蛋白和糖蛋白抗原单独给药时免疫原性差或无免疫原性。对这种抗原的强适应性免疫应答通常需要使用佐剂。免疫佐剂是当施用于受试者时增加对抗原的免疫应答或增强来自免疫系统的细胞的某些活性的物质。佐剂还可以允许使用较低剂量的抗原在受试者中获得有用的免疫应答。
常见的佐剂包括明矾、弗氏(Freund's)佐剂(具有死分枝杆菌的水包油乳剂)、具有MDP的弗氏佐剂(具有胞壁酰二肽MDP的水包油乳剂,胞壁酰二肽MDP是分枝杆菌的成分)、明矾加百日咳博德特氏菌(Bordetella pertussis)(具有杀死的百日咳博德特氏菌的氢氧化铝凝胶)。这种佐剂被认为是通过延缓抗原的释放和增强巨噬细胞的摄取来起作用的。免疫刺激复合物(ISCOM)是通常具有约40nm直径的开放笼状复合物,其由胆固醇、脂质、免疫原和皂苷如Quil-A(皂树皂苷提取物)构建。ISCOM将抗原递送至胞质溶胶,并且已被证明在多种实验动物模型中促进抗体应答和T辅助细胞的诱导以及细胞毒性T淋巴细胞应答。
天然皂苷佐剂QS-21远比目前使用的佐剂如明矾更有效。已经证明QS-21相对于超过20种在临床前模型中测试的其它佐剂以及7种在临床中使用的其它佐剂的优越性。因此,尽管QS-21有三种主要缺点:剂量限制毒性、差的稳定性和优质产品有限的可获得性,QS-21仍已被广泛使用。
QS-21作为佐剂的使用与显著的不利的生物学效应有关。在人类中,QS-21显示出局部和全身毒性。癌症患者的最大剂量为100-150微克,健康患者的最大剂量通常为50微克(免疫学次优剂量)。因此,非癌症疫苗的临床成功取决于确定更耐受的新型有效佐剂。
本申请包括认识到QS-21和相关皂树皂苷的合成通道和结构修饰可以提供具有高佐剂效力和低毒性并且具有更高的稳定性和更具成本效益的化合物。
疫苗
本申请中的组合物可用作疫苗来诱导受试者对抗原的主动免疫。任何可能会经历本申请的组合物的有益效果的动物都在可以治疗的受试者的范围内。在一些实施方案中,受试者是哺乳动物。在一些实施方案中,受试者是人。
本申请的疫苗可用于通过被动或主动免疫赋予对感染的抗性。当本申请的疫苗用于通过主动免疫赋予抗性时,将本申请的疫苗施用于动物以引发保护性免疫应答,该应答防止或减轻增殖性或感染性疾病。当本申请的疫苗用于通过被动免疫赋予对感染的抗性时,将疫苗提供给宿主动物(例如人、狗或小鼠),并且回收由该疫苗引发的抗血清并直接提供给怀疑具有感染或疾病或暴露于致病生物体的接受者。
因此,本申请涉及并提供了用于预防或减轻由生物体引起的增殖性疾病的方式,该生物体具有被响应本申请疫苗中包含的免疫原性抗原产生的抗血清识别和结合的抗原。如本文所用,如果疫苗对动物的施用导致疾病的症状或病症的全部或部分减轻(即抑制),或导致动物对疾病的全部或部分免疫,则称所述疫苗预防或减轻疾病。
疫苗(或其引发的抗血清)的施用可以用于“预防”或“治疗”目的。当预防性地提供时,在增殖性疾病的任何症状之前提供疫苗。预防性施用疫苗用于预防或减轻任何随后的疾病表现。当治疗性提供时,在检测到指示动物可能感染病原体的症状时或之后提供疫苗。疫苗的治疗性施用用于减轻任何实际的疾病表现。因此,可以在疾病增殖开始之前(为了预防或减轻预期的感染)或开始实际增殖之后提供疫苗。
因此,本申请的一个方面提供了包含与以下相关的抗原的疫苗:乙型肝炎、肺炎球菌、白喉、破伤风、百日咳或莱姆病,包括密切相关的包柔氏螺旋体属的螺旋原虫,例如B.burgdorferi、B.garinii、B.afzelli和B.japonica。
本领域普通技术人员将会理解,疫苗可以任选地包含药学上可接受的赋形剂或载体。因此,根据另一方面,提供的疫苗可以包含一种或多种抗原,该抗原任选地与药学上可接受的赋形剂或载体结合。在一些实施方案中,所述一种或多种抗原共价结合至药学上可接受的赋形剂。在其它实施方案中,所述一种或多种抗原与药学上可接受的赋形剂非共价缔合。
如上所述,佐剂可用于增加对抗原的免疫应答。根据本申请,所提供的疫苗在被施用于受试者时可用于引发免疫应答。在某些实施方案中,通过向受试者施用增强所述受试者对所述抗原的免疫应答有效量的提供的疫苗,可以增强针对抗原的免疫应答。
制剂
本申请的化合物可以与药学上可接受的赋形剂组合以形成药物组合物。在某些实施方案中,本申请的制剂包括可注射制剂。在某些实施方案中,药物组合物包含药学可接受量的本申请化合物。在某些实施方案中,本申请的化合物和抗原形成活性成分。在某些实施方案中,本申请的化合物单独形成活性成分。可以与载体材料组合以产生单一剂型的活性成分的量将根据待治疗的宿主和特定的施用方式而变化。可以与载体材料组合以产生单一剂型的活性成分的量通常是产生治疗效果的化合物的量。通常,该量范围为约1%至约99%活性成分,优选约5%至约70%,最优选约10%至约30%,或约1%至99%,优选10%至90%,20%至80%,30%至70%,40%至60%,45%至55%,或约50%。
润湿剂、乳化剂和润滑剂如月桂基硫酸钠和硬脂酸镁,以及着色剂、脱模剂、涂层剂、甜味剂、调味剂和芳香剂、防腐剂和抗氧化剂也可以存在于组合物中。
药学上可接受的抗氧化剂的非限制性实例包括:水溶性抗氧化剂,例如抗坏血酸、半胱氨酸盐酸盐、硫酸氢钠、焦亚硫酸钠、亚硫酸钠等;油溶性抗氧化剂,例如棕榈酸抗坏血酸酯、丁基化羟基茴香醚(BHA)、丁基化羟基甲苯(BHT)、卵磷脂、没食子酸丙酯、α-生育酚等;和金属螯合剂,如柠檬酸、乙二胺四乙酸(EDTA)、山梨糖醇、酒石酸、磷酸等。
除活性化合物之外,悬浮液可含有悬浮剂,例如乙氧基化异硬脂醇、聚氧乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄蓍胶及其混合物。
可用于本申请的药物组合物中的合适的水性和非水性载体的非限制性实例包括水、醇(包括但不限于甲醇、乙醇、丁醇等)、多元醇(包括但不限于甘油、丙二醇、聚乙二醇等)及其合适的混合物、植物油(例如橄榄油)和可注射的有机酯(例如油酸乙酯)。例如,通过使用涂覆材料如卵磷脂,通过在分散体的情况下维持所需的粒径,以及通过使用表面活性剂,可维持适当的流动性。
这些组合物还可以含有添加剂,例如防腐剂、润湿剂、乳化剂和分散剂。通过包含各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚山梨酸等可以确保防止微生物对主题化合物的作用。将等渗剂例如糖、氯化钠等包含在组合物中也可能是合乎需要的。另外,可通过包含延迟吸收的试剂例如单硬脂酸铝和明胶来引起可注射药物形式的延长吸收。
在一些情况下,为了延长制剂的效果,期望减缓从皮下或肌内注射的药物吸收。这可以通过使用具有差的水溶性的结晶或无定形材料的液体悬浮液来完成。药物的吸收速率则取决于其溶解速率,其溶解速率继而可取决于晶体大小和结晶形式。
无论选择何种给药途径,本申请的化合物(其可以以合适的水合形式使用)和/或本申请的药物组合物通过本领域的技术人员已知的常规方法配制成药学上可接受的剂型。
本申请的药物组合物中活性成分的实际剂量水平可以变化,以获得有效实现对于特定患者、组合物和给药方式的所需治疗反应的活性成分而没有对患者的毒性的量。
所选的剂量水平将取决于多种因素,包括所用本申请的具体化合物或其酯、盐或酰胺的活性,给药途径,给药时间,所用的具体化合物排泄或代谢的速率,治疗持续时间,与所用具体化合物组合使用的其它药物、化合物和/或物质,所治疗患者的年龄、性别、体重、状况、一般健康状况和既往病史,以及医学领域众所周知的类似因素。
具有本领域普通技术的医生或兽医可以容易地确定和开出所需药物组合物的有效量。例如,医师或兽医可以低于达到所需治疗效果所需的水平开始药物组合物中使用的本申请化合物的剂量,然后逐渐增加剂量直至达到所需效果。
在一些实施方案中,本申请的化合物或药物组合物被长期提供给受试者。长期治疗包括长时间重复给药的任何形式,例如重复给药一个或多个月,一个月至一年,一年或多年或更长时间。在许多实施方案中,长期治疗包括在受试者的整个生命周期中重复给予本申请的化合物或药物组合物。优选的长期治疗包括定期施用,例如一天一次或多次,一周一次或多次,或一个月一次或多次。通常,合适的剂量,例如本申请化合物的日剂量,将是有效产生治疗效果的最低剂量的化合物的量。这种有效剂量通常取决于上述因素。
通常,本申请化合物用于患者的剂量当出于指定效果的目的而使用时,范围为约0.0001至约100mg每千克体重每天。优选地,日剂量范围为0.001至50mg化合物每千克体重,甚至更优选0.01至10mg化合物每千克体重。然而,可以使用更低或更高的剂量。在一些实施方案中,施用于受试者的剂量可以被修改,因为受试者的生理学由于年龄、疾病进展、体重或其它因素而改变。
在一些实施方案中,提供的本申请的佐剂化合物作为药物组合物或疫苗施用。在某些实施方案中,预期所施用的佐剂化合物的量将为1-2000μg。在某些实施方案中,预期所施用的佐剂化合物的量将为1-1000μg。在某些实施方案中,预期所施用的佐剂化合物的量将为1-500μg。在某些实施方案中,预期所施用的佐剂化合物的量将为1-250μg。在某些实施方案中,预期所施用的佐剂化合物的量将为100-1000μg。在某些实施方案中,预期所施用的佐剂化合物的量将为100-500μg。在某些实施方案中,预期所施用的佐剂化合物的量将为100-200μg。在某些实施方案中,预期所施用的佐剂化合物的量将为250-500μg。在某些实施方案中,预期所施用的佐剂化合物的量将为10-1000μg。在某些实施方案中,预期所施用的佐剂化合物的量将为500-1000μg。在某些实施方案中,预期所施用的佐剂化合物的量将为50-250μg。在某些实施方案中,预期所施用的佐剂化合物的量将为50-500μg。
在一些实施方案中,提供的本申请的佐剂化合物作为药物组合物或疫苗施用。在某些实施方案中,预期所施用的佐剂化合物的量将为1-2000mg。在某些实施方案中,预期所施用的佐剂化合物的量将为1-1000mg。在某些实施方案中,预期所施用的佐剂化合物的量将为1-500mg。在某些实施方案中,预期所施用的佐剂化合物的量将为1-250mg。在某些实施方案中,预期所施用的佐剂化合物的量将为100-1000mg。在某些实施方案中,预期所施用的佐剂化合物的量将为100-500mg。在某些实施方案中,预期所施用的佐剂化合物的量将为100-200mg。在某些实施方案中,预期所施用的佐剂化合物的量将为250-500mg。在某些实施方案中,预期所施用的佐剂化合物的量将为10-1000mg。在某些实施方案中,预期所施用的佐剂化合物的量将为500-1000mg。在某些实施方案中,预期所施用的佐剂化合物的量将为50-250mg。在某些实施方案中,预期所施用的佐剂化合物的量将为50-500mg。在某些实施方案中,预期所施用的佐剂化合物的量将为0.01-215.4mg。
在某些实施方案中,预期所施用的佐剂的量将为1000-5000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为1000-4000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为1000-3000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为1000-2000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为2000-5000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为2000-4000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为2000-3000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为3000-5000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为3000-4000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为4000-5000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为1-500μg/kg。在某些实施方案中,预期所施用的佐剂的量将为500-1000μg/kg。在某些实施方案中,预期所施用的佐剂的量将为1000-1500μg/kg。在某些实施方案中,预期所施用的佐剂的量将为1mg/kg。在某些实施方案中,预期所施用的佐剂的量将为2mg/kg。在某些实施方案中,预期所施用的佐剂的量将为3mg/kg。在某些实施方案中,预期所施用的佐剂的量将为4mg/kg。在某些实施方案中,预期所施用的佐剂的量将为5mg/kg。在某些实施方案中,预期所施用的佐剂的量将为0.0029-5mg/kg。在某些实施方案中,在雌性中施用的佐剂的量小于在雄性中施用的佐剂的量。在某些实施方案中,给予婴儿的佐剂的量小于给予成人的佐剂的量。在某些实施方案中,给予小儿接受者的佐剂的量小于给予成人的佐剂的量。在某些实施方案中,给予免疫受损接受者的佐剂的量大于给予健康接受者的佐剂的量。在某些实施方案中,给予老年接受者的佐剂的量大于给予非老年接受者的佐剂的量。
如果需要,活性化合物的有效剂量可以在一天内以适当的间隔分开施用2、3、4、5、6或更多个亚剂量,任选以单位剂量形式施用。
虽然本申请化合物可以单独施用,但在某些实施方案中,化合物作为如上所述的药物制剂或组合物施用。
与其它药物类似,根据本申请的化合物可以配制以便以任何方便的方式给药,用于人或兽医学。
本申请提供了包含本申请化合物的药物制剂或组合物的药盒。在某些实施方案中,此类药盒包括式I和/或II化合物与抗原的组合。这些药剂可以分开包装或一起包装。该药盒任选包含开出该药物的说明书。在某些实施方案中,药盒包括多剂量的每种药剂。药盒可包含足够量的每种成分以治疗一个或多个受试者一周、两周、三周、四周或数月。该药盒可能包括完整的免疫疗程。在一些实施方案中,药盒包括含有一种或多种细菌或病毒相关抗原以及一种或多种所提供的化合物的疫苗。
实施例
与实施例1-9中的化合物相关的编号不意味着与在该申请全部的其余部分,包括附图、权利要求或实施例10出现的其它通式或化合物编号对应。
实施例1:皂皮酸三萜的分离和选择性保护
A部分:从Quil-A分离皂皮酸三萜9。
1.在装有回流冷凝器的250mL圆底烧瓶中,将Quil A(5g)悬浮于蒸馏水(25mL)中,并加入浓HCl(17mL)。
2.将混合物缓慢加热至回流7小时(加热应缓慢进行以避免接近回流时发生泡沫溢出),然后从热中移出,并通过滤纸过滤。将深棕色固体用热(~65℃)蒸馏水(2×50mL)洗涤,收集并在高真空下干燥过夜。
3.将干燥的固体放入Soxhlet套管中并用乙醚(200mL)连续萃取24小时。
4.将乙醚溶液浓缩,将残余物溶于MeOH(20mL)中,并加入活性炭(~5g)。将混合物通过硅藻土过滤,固体用MeOH(50mL)洗涤,并通过旋转蒸发除去溶剂。
5.通过硅胶色谱法(CHCl
部分B:通过皂皮酸的C28羧酸的烯丙基化来合成皂皮酸烯丙酯10。
1.在50mL圆底烧瓶中,将皂皮酸三萜9(100mg,0.20mmol,1.0当量)溶于DMF(5mL)中并将溶液冷却至0℃。
2.加入碳酸氢钾(205mg,2.05mmol,10当量)和烯丙基溴(23μL,0.27mmol,1.3当量),搅拌混合物并使其温热至室温(rt)过夜。
3.将反应物用水(25mL)稀释并用己烷/EtOAc(1:1)(3x15mL)萃取。将有机提取物合并,用盐水(15mL)洗涤,用无水Na
4.通过硅胶色谱法(己烷/EtOAc,8:1至2:1)纯化,得到作为白色固体的皂皮酸烯丙酯10(77mg,71%)。
部分C:通过皂皮酸烷基酯10的C3和C16羟基基团的甲硅烷基化合成被保护的皂皮酸三萜11
1.在25mL改良Schlenk烧瓶中,将皂皮酸烯丙酯10(77mg,0.15mmol,1.0当量)溶于DCM(5mL)中并将溶液冷却至0℃。加入2,6-二甲基吡啶(0.17mL,1.46mmol,10当量),然后通过气密注射器加入TESOTf(0.17mL,0.73mmol,5.0当量),搅拌混合物,同时允许冰浴融化。
2.使用CHCl
3.将反应混合物用水(10mL)稀释并将水相用EtOAc(10mL×3)萃取。将合并的有机相干燥(无水Na
4.通过硅胶色谱法(己烷/丙酮,1:0至10:1)纯化,得到TES-保护的皂皮酸烯丙酯11(93mg,84%),为白色固体。
部分D:通过被保护的皂皮酸的去烯丙基化合成TES保护的皂皮酸三萜12
1.在10mL圆底烧瓶中,将完全保护的皂皮酸11(93mg,0.12mmol,1.0当量)溶于DCM(2mL)中并加入吡咯烷(51μL,0.61mmol,5.0当量)随后加入Pd(PPh3)4(7.0mg,0.006mmol,0.05当量)。
2.将反应混合物搅拌15分钟,然后直接通过硅胶色谱法(己烷/EtOAc,2:1)进行纯化,得到TES-保护的皂皮酸12(88mg,>99%),为白色固体。
实施例2:截短的直链低聚糖结构域的合成
部分A:由D-木糖合成选择性保护的单糖前体2,3,4-三-O-苄基-D-木糖15
1.步骤A:通过D-木糖的选择性烯丙基化合成1-O-烯丙基-D-木糖13。在500mL圆底烧瓶中,将烯丙醇(50mL,0.74mol,9.0当量)和AcCl(12.7mL,0.17mol,2.1当量)的溶液冷却至-10℃,然后添加固体D-木糖(12.3g,0.08mol,1.0当量)。
2.一旦添加了所有的木糖,就移除冷却浴并将反应混合物在室温下搅拌19小时。
3.加入固体NaHCO
4.使残余物通过用DCM/MeOH(9:1)洗脱的硅胶塞,浓缩洗脱液得到异头烯丙基木糖13(11.5g),其不经进一步纯化即用于下一步。
5.步骤B:通过1-O-烯丙基-D-木糖13的苄基化合成1-O-烯丙基-2,3,4-三-O-苄基-D-木糖14。在500mL圆底烧瓶中,将烯丙基木糖13(11.5g,60.5mmol,1.0当量)溶于DMF(200mL)中,然后将溶液冷却至0℃。添加氢化钠(60%油中分散体,15.7g,0.39mol,6.5当量)(小心:氢化钠与水剧烈反应)并将反应混合物搅拌10分钟。
6.在0℃下滴加苄基溴(47mL,0.39mol,6.5当量),并将所得悬浮液在室温下搅拌16小时。
7.将反应混合物冷却至0℃,通过缓慢加入MeOH(150mL),然后加水(600mL)猝灭。用己烷/EtOAc(1:1)(3×250mL)萃取混合物,合并的有机层用水(100mL),盐水(100mL)洗涤,用无水MgSO
8.通过硅胶色谱法(己烷/EtOAc,9:1)纯化,得到完全保护的木糖14(23g,83%)。
9.步骤C:通过1-O-烯丙基-2,3,4-三-O-苄基-D-木糖14的去烯丙基化合成选择性保护的2,3,4-三-O-苄基-D-木糖15。在用铝箔覆盖的100mL圆底烧瓶中,将PPh
10.通过套管转移加入完全保护的木糖14(5.0g,10.9mmol,1.0当量)在DCM(100mL)中的溶液,并将反应混合物在30℃搅拌18小时。
11.将溶液通过用己烷/EtOAc(1:1)洗脱的硅胶塞并浓缩洗脱液。
12.通过硅胶色谱法(己烷/EtOAc,8:2至7:3)纯化,得到2,3,4-三-O-苄基木糖15(4.1g,90%),为端基异构体混合物(α:β,2:1)。
部分B:由L-鼠李糖合成选择性保护的单糖前体1-O-烯丙基-2,3-O-亚异丙基-L-鼠李糖16
1.在250mL圆底烧瓶中,将烯丙醇(34mL,0.50mol,9.0当量)和AcCl(8.1mL,0.12mol,2.1当量)的溶液在-10℃下冷却,然后加入L-鼠李糖一水合物(10g,0.055mol,1.0当量)。
2.将混合物在室温下搅拌20小时,用Et
3.将残余物溶于甲苯中并浓缩溶液以除去烯丙醇;这个过程再重复两次。
4.将残余的浆料溶解于无水丙酮(75mL)中,加入DMP(27mL,0.22mol,4.0当量)和pTsOH一水合物(95mg,0.5mmol,0.01当量)。
5.将反应混合物在室温下搅拌16小时,然后加入Et3N。
6.将反应混合物浓缩并通过硅胶色谱法(己烷/EtOAc,8:2)纯化,得到1-O-烯丙基-2,3-O-亚异丙基-α-L-鼠李糖(16)(8.9g,66%),为无色油状物。
部分C:从D-己烯糖合成选择性保护的单糖前体4-叠氮基-4-脱氧-3,6-二-O-苄基-1-O-三异丙基甲硅烷基-D-半乳糖21
1.步骤A:通过选择性保护D-己烯糖合成3,6-二-O-苯甲酰基-4-O-甲磺酰基-D-己烯糖17。在500mL圆底烧瓶中,将D-己烯糖(10.0g,67.1mmol,1.0当量)溶于吡啶(165mL)中并将溶液冷却至0℃,然后滴加BzCl(17mL,0.15mol,2.2当量)。
2.将反应混合物在0℃下搅拌1.5小时,然后加入MsCl(10.3mL,0.13mol,2.0当量)。将反应混合物搅拌0.5小时,同时使冰浴温热至室温,然后在0℃下缓慢加入MeOH(20mL)猝灭(小心:放热反应)。
3.浓缩混合物并将残余物在EtOAc(200mL)和水(200mL)之间分配。将有机层用水(100mL),盐水(100mL)洗涤,用无水MgSO
4.通过硅胶色谱法(己烷/EtOAc,8:2)纯化,得到3,6-二-O-苯甲酰基-4-O-甲磺酰基-D-己烯糖(17)(19.4g,67%),为浆状物。
5.步骤B:通过甲磺酸酯17的叠氮化物取代合成4-叠氮基-4-脱氧-3,6-二-O-苯甲酰基-D-半乳醛18。在250mL圆底烧瓶中,将甲磺酰基-己烯糖17(5.1g,11.8mmol,1.0当量)溶解于甲苯(55mL)中,然后加入叠氮化钠(注意:叠氮化钠是有毒有害物质,其不应该被酸化以避免有毒爆炸性的叠氮酸(HN
6.将反应混合物加热至回流(110℃)20小时。所得棕色悬浮液用水(2×100mL)洗涤,用无水MgSO
7.通过硅胶色谱法(己烷/EtOAc,19:1至8:2)纯化,得到4-叠氮基-4-脱氧-3,6-二-O-苯甲酰基-D-半乳醛(18)(2.9g,66%),为淡黄色油状物。
8.步骤C:通过二苯甲酸酯18的皂化和苄基化合成4-叠氮基-4-脱氧-3,6-二-O-苄基-D-半乳醛19。在250mL圆底烧瓶中,将苯甲酰基保护的叠氮基半乳醛18(2.9g,8.1mmol,1.0当量)溶于MeOH(40mL)中并将溶液冷却至0℃。
9.加入氢氧化钠(0.12g,2.9mmol,0.36当量)并将反应混合物在室温下搅拌14小时。
10.将反应混合物浓缩,得到粘性棕褐色固体,然后再从甲苯(7mL)中蒸发以除去痕量溶剂。
11.将DMF(40mL)加入到残余物中,并将所得棕色悬浮液冷却至0℃。加入氢化钠(60%在矿物油中的分散体,0.98g,24.4mmol,3.0当量)(小心:氢化钠与水剧烈反应),然后加入苄基溴(4.8mL,40.3mmol,5.0当量),并将该混合物在0℃下搅拌3小时。
12.将所得橙色悬浮液在室温再搅拌16小时,并将反应用MeOH(20mL)猝灭,用DCM(100mL)稀释并用水(100mL)洗涤。
13.将水层用DCM(80mL)萃取,合并的有机层用水(100mL)洗涤,用无水MgSO
14.通过硅胶色谱法(己烷/EtOAc,9:1至4:1)纯化,得到4-叠氮基-4-脱氧-3,6-二-O-苄基-D-半乳醛(19)(2.2g,78%),为黄色油状物。
15.步骤D:通过半乳醛19的二羟基化合成4-叠氮基-4-脱氧-3,6-二-O-苄基-D-半乳糖20。将苄基保护的叠氮基半乳醛19(5.8g,16.5mmol,1.0当量)溶于水/THF/tBuOH(1:3:7)(400mL)的混合物中,然后加入OsO
16.将反应混合物在室温下搅拌过夜,然后用饱和Na
17.在5分钟后,分离各相,水层用EtOAc(2×75mL)和DCM(2×50mL)萃取。将合并的有机相用无水硫酸钠干燥,过滤并浓缩。
18.通过硅胶色谱法(己烷/EtOAc,4:1至1:1)纯化,得到为无色油状物的4-叠氮基-4-脱氧-3,6-二-O-苄基-D-半乳糖(20)(5.5g,88%)。
19.步骤E:通过二醇20的选择性甲硅烷基化合成4-叠氮基-4-脱氧-3,6-二-O-苄基-1-O-三异丙基甲硅烷基-D-半乳糖21。在10mL改良的Schlenk烧瓶中,将半乳糖二醇20(0.96g,2.5mmol,1.0当量)溶解于DMF(2.5mL)中,然后加入咪唑(0.41g,6.0mmol,2.4当量)和DMAP(29mg,0.24mmol,0.1当量)。
20.加入TIPSCl(0.63mL,3.0mmol,1.2当量),并将反应混合物在室温下搅拌19小时。
21.将黄色溶液浓缩并通过硅胶色谱法(己烷/EtOAc,19:1至9:1)纯化,得到4-叠氮基-4-脱氧-3,6-二-O-苄基-1-O-三异丙基甲硅烷基-D-半乳糖(21)(0.8g,59%),为无色油状物。
部分D:从被保护的D-木糖15和被保护的L-鼠李糖16合成被保护的木糖-鼠李糖二糖半缩醛23([2,3,4-三-O-苄基-β-D-吡喃木糖基-(1→4)]2,3-二-O-亚异丙基-L-鼠李吡喃糖)。
1.步骤A:用被保护的木糖15(22)对被保护的鼠李糖16进行脱水糖基化:在25mL改良的Schlenk烧瓶中,将共沸干燥的2,3,4-三-O-苄基木糖(15)(52mg,0.12mmol,1.7当量)、Ph
2.将溶液冷却至-78℃,通过气密注射器加入Tf
3.然后将被保护的鼠李糖16(17mg,70μmol,1.0当量)在甲苯(1mL)中的预冷却溶液从火焰干燥的10mL改良Schlenk烧瓶用套管转移,然后添加另外的甲苯(1mL)以冲洗源烧瓶并转移至反应烧瓶。
4.将反应混合物在-60℃下搅拌12小时,在-42℃下搅拌30分钟,最后在0℃下搅拌2分钟。
5.通过加入-42℃下的Et3N(0.1mL)将反应猝灭,用DCM(90mL)稀释并转移至分液漏斗。将有机层用饱和NaHCO
6.通过硅胶色谱法(己烷/EtOAc,50:1至25:1)纯化,得到O-烯丙基[2,3,4-三-O-苄基-β-D-吡喃木糖基-(1→4)]-2,3-O-亚异丙基-L-鼠李吡喃糖苷(22),为澄清油状物(32.1mg,产率71%)。
7.步骤B:被保护的木糖-鼠李糖二糖(23)的异头去烯丙基化:在配有三角形搅拌棒的5mL梨形Schlenk烧瓶中,放置PPh
8.将溶解在DCM(0.4mL)中的烯丙基保护的二糖22(29mg,43μmol,1.0当量)用套管转移到反应Schlenk烧瓶中,并将源烧瓶用另外的DCM(0.2mL)冲洗,将其转移到反应烧瓶。
9.通过执行三次冻融泵循环使溶液脱气(该脱气技术包括在液氮下冷冻溶剂,抽空顶部空间4-5分钟,并让溶剂在静态真空下解冻,从而让捕集在溶剂中的任何气泡逸出到烧瓶的顶部空间中。最后一次循环后,用Ar重新填充烧瓶),然后在30℃下搅拌18小时,此时混浊溶液变为澄清,呈深黄色。
10.将反应混合物通过用己烷/EtOAc(2:1,50mL)洗脱的硅胶塞,浓缩洗脱液,得到粗产物,为亮黄色油状物(29mg)。
11.通过硅胶色谱法(己烷/EtOAc,2:1)纯化,得到二糖半缩醛(23),为不可分离的异头物混合物(α:β,9:1),为澄清油状物(25.9mg,>99%)。
步骤E:合成被保护的木糖-鼠李糖-叠氮基半乳糖三糖亚氨酸酯26(O-三氯亚氨代乙酰基{[2,3,4-三-O-苄基-β-D-吡喃木糖基-(1→4)]-2,3-O-亚异丙基-L-鼠李吡喃糖基-(1→2)}-4-叠氮基-4-脱氧-3,6-O-苄基-β-D-吡喃半乳糖苷)。
1.步骤A:通过用被保护的木糖-鼠李糖二糖23(24)将被保护的4-叠氮基-4-脱氧半乳糖21脱水糖基化来合成被保护的木糖-鼠李糖-叠氮基半乳糖三糖24:在25mL改良的Schlenk烧瓶中,将Ph
2.共沸干燥的二糖的预冷溶液
将在DCM(1mL)中的半缩醛23(185mg,0.30mmol,1.1当量)由火焰干燥的5mL梨形Schlenk烧瓶通过套管加入到-42℃下的反应混合物中;然后加入另外的DCM(1mL)以冲洗源烧瓶并转移至反应烧瓶。
3.将反应混合物在-42℃搅拌15分钟,然后加入TBP(190mg,0.77mmol,3.0当量),并将混合物在-42℃下进一步搅拌1小时。
4.将被保护的4-叠氮基-4-脱氧半乳糖21(141mg,0.26mmol,1.0当量)在DCM(1mL)中的预冷的溶液通过套管从火焰干燥的5mL梨形Schlenk烧瓶加入到反应混合物中,此时产生白烟。加入额外的DCM(1mL)以冲洗源烧瓶并转移至反应烧瓶。
5.将反应混合物在-42℃搅拌16.5小时,并在0℃搅拌1小时,然后浓缩。
6.通过硅胶色谱法(己烷/EtOAc,99:1至50:1至6:1)纯化得到单糖起始物质(21)和三糖产物(24)的混合物,为黄色油状物(460mg)。通过硅胶色谱法(己烷/EtOAc,10:1至6:1)另外纯化该混合物,得到被保护的三糖24(231mg,79%),为澄清油状物。
7.步骤B:通过被保护的木糖-鼠李糖-叠氮基半乳糖三糖24的异头脱甲硅烷基化合成三糖半缩醛25。在250mL改良的Schlenk烧瓶中,将被保护的三糖24(575mg,0.51mmol,1.0当量)溶解于THF(50mL)中并将溶液冷却至0℃。
8.将市售TBAF(1M,在THF中)(0.76mL,0.76mmol,1.5当量)和AcOH(35μL,0.61mmol,1.2当量)在THF(50mL)中的预冷(0℃)溶液在0℃经过50分钟经由套管滴加至反应烧瓶。
9.将反应混合物在0℃再搅拌5分钟,然后通过加入饱和NaHCO
10.将内容物转移到分液漏斗中,加入EtOAc(125mL)和盐水(50mL),分离有机相。将水层用EtOAc(2×200mL)萃取并将合并的有机相经无水硫酸镁干燥,过滤并浓缩。
11.使得到的油状物通过用EtOAc洗脱的硅胶塞,浓缩洗脱液,得到三糖半缩醛25(402mg,82%),为白色泡沫状物,将其直接用于下一步而无需进一步纯化。
12.步骤C:通过活化被保护的木糖-鼠李糖-叠氮基半乳糖三糖25,合成被保护的木糖-鼠李糖-叠氮基半乳糖三糖三氯亚氨代乙酸酯26。在100mL圆底烧瓶中,将半缩醛25(200mg,0.21mmol,1.0当量)溶于DCM(32mL)中并将溶液冷却至0℃。
13.加入Cl
14.搅拌13.5小时后,浓缩混合物得到油状物。
15.通过硅胶色谱法(己烷/EtOAc,6:1,具有0.5vol%Et
实施例3:皂苷结构域片段的模块化、会聚组装(convergent assembly)
部分A:被保护的氨基半乳糖皂苷的合成
步骤A:通过用被保护的木糖-鼠李糖-叠氮基半乳糖线性三糖26将被保护的皂皮酸12糖基化来合成被保护的叠氮基半乳糖皂苷29。在25mL改良的Schlenk烧瓶中,将选择性保护的皂皮酸三萜12(38mg,49μmol,1.05当量)和三糖亚氨酸酯26(52mg,47μmol,1.0当量)与甲苯(3x 1mL)在高真空下共沸,然后溶解于DCM(7mL)中,并向该溶液中加入粉末状的4
2.将该混合物在室温下搅拌30分钟,然后冷却至-42℃。通过气密注射器注射新蒸馏的BF
3.加入Et
4.通过硅胶色谱法(具有0.5vol%Et
5.步骤B:通过还原被保护的叠氮基半乳糖皂苷29合成被保护的氨基半乳糖皂苷30。在50mL改良的Schlenk烧瓶中,将PhSeSePh(187mg,0.6mmol,1.0当量)溶于THF(6mL)中并通过注射器加入H
6.将该黄色溶液在40℃加热1小时直至其变为无色。
7.将反应混合物从热中移出,用苯(6mL)和蒸馏水(6mL)稀释,并在Ar下剧烈搅拌5分钟。用玻璃吸管除去所得两相悬浮液的下层水相,并在搅拌下用无水硫酸钠干燥剩余的有机层。
8.然后将此新鲜制备的PhSeH溶液(~1.1mmol,30当量)在Ar下套管转移到100mLSchlenk反应烧瓶中,该烧瓶含有共沸干燥的皂苷叠氮化物29(62mg,37μmol,1.0当量)在Et
9.将反应混合物在38℃下搅拌8小时,然后浓缩,得到黄白色固体。
10.通过硅胶色谱法(苯/EtOAc,90:10至85:15)纯化,得到截短的皂苷胺30(49mg,80%),为玻璃状固体。
部分B:被保护的氨基酰基皂苷32的合成
1.在10mL梨形Schlenk烧瓶中,将6-(Boc-氨基)己酸(45.0mg,0.20mmol,11.5当量)溶于THF(2.5mL)中,然后加入Et
2.将得到的混浊白色混合物在0℃下搅拌2.5小时,然后在0℃套管转移到10mLSchlenk烧瓶中,该烧瓶含有共沸干燥的(3×1mL甲苯)皂苷胺30(28mg,17.0μmol,1.0当量)的纯的膜。
3.将浑浊的白色反应混合物在0℃下搅拌1.5小时,然后用水(0.2mL)猝灭,得到澄清的无色溶液。
4.将混合物用饱和NaHCO
5.通过硅胶色谱法(己烷/EtOAc,2:1,具有0.5vol%Et3N)纯化(用9:1至5:1苯/EtOAc(0.5vol%Et3N)洗脱也可用于硅胶色谱法纯化)得到截短的完全保护的氨基酰基皂苷32(28mg,88%),为白色玻璃状固体。
实施例4:被保护的氨基酰基化皂苷的全部去保护
部分A:通过被保护的氨基酰基皂苷32的氢解和酸水解合成氨基酰基皂苷34(化合物I-6)
1.在50mL圆底烧瓶中,将完全被保护的截短皂苷32(68mg,36.6μmol,1.0当量)溶于THF/EtOH(1:1)(20mL)中,然后加入10%(基于干重)Pd/C(湿Degussa型E101 NE/W)(390mg,0.18mmol,5.0当量)。
2.使用高压气罐反应器将反应混合物在H
3.通过0.45μm尼龙注射器式过滤器过滤悬浮液,用MeOH(3×30mL)洗涤并浓缩。通过在甲醇-d
4.在25mL圆底烧瓶中,将所得的粗混合物溶解于TFA/水(3:1)(8mL)的预冷(0℃)溶液中。
5.将反应混合物在0℃下搅拌2小时,然后在0℃高真空下浓缩,得到白色固体残余物。
6.将该粗产物溶于水/MeCN(4:1)(20mL)中并用经15分钟的30→70%MeCN/水(0.05vol%TFA)的线性梯度通过RP-HPLC纯化。完全去保护的截短的皂苷34作为主要的单峰洗脱,冻干后获得蓬松的白色固体(28mg,74%)。
实施例5:酰基链结构域胺的后期酰化形成完全精制的皂苷4(化合物I-8)
步骤A:通过氨基酰基皂苷34中游离胺的选择性4-碘苯甲酰化合成缺乏支链三糖结构域的完全精制的皂苷4(化合物I-8)
1.在配备有装有Ar入口针的橡胶隔膜的5mL梨形烧瓶中,将胺终止的截短皂苷34(2.1mg,2.0μmol,1.0当量)溶于DMF(0.4mL)中。注射Et
2.将反应混合物在室温下搅拌2小时,然后用30%MeCN/水(2.3mL)稀释,并通过RPHPLC使用30→70%MeCN/水(0.05vol%TFA)的线性梯度经15分钟直接纯化。
3.冷冻干燥后获得完全精制的截短皂苷4(化合物I-8)(1.7mg,67%),为白色粉末。
实施例6:支链的三糖-三萜前皂苷元的分离和选择性保护
部分A:从Quil A分离支链的三糖-三萜前皂苷元。
1.在配备有回流冷凝器的250mL圆底烧瓶中,将Quil A(1.15g)和氢氧化钾(0.97g,17mmol)悬浮于EtOH/水(1:1)(50mL)中,然后将混合物加热至80℃持续7小时。
2.将反应冷却至0℃,用1.0N HCl中和,并浓缩至约一半体积(必须注意避免过度起泡和爆沸;水浴应保持在35℃,压力缓慢下降)。
3.将混合物冷冻并冻干,所得干燥固体通过硅胶色谱法(CHCl
4.通过用甲苯(2×20mL)共沸除去溶剂来干燥所得固体,并在MeCN/水(1:1)(3×15mL)中冻干以提供前皂苷元混合物(5:6,2.5:1),为浅棕褐色泡沫状物(~0.55g,50%质量收率)。这些含有木糖和鼠李糖的前皂苷元5和6分别对应于QS皂苷中发现的两种最丰富的三糖-三萜片段,并且不经进一步纯化就进入下一个保护步骤。
部分B:通过选择性保护前皂苷元羟基合成三乙基甲硅烷基(TES)保护的前皂苷元
1.在25mL改良的Schlenk烧瓶中,前皂苷元5和6的固体混合物(~0.55g)与吡啶(5mL)共沸,然后加入另外的吡啶(8mL),然后加入TESOTf(2.0mL,8.8mmol)。
2.将反应混合物搅拌2.75天,然后加入TESOTf(0.3mL,1.3mmol),然后分别在24小时和48小时后再添加两次(各0.1mL,各0.44mmol)(TESOTf的最后额外添加依情况而定,只有在前4天后反应仍不完全的情况下才需要)。
3.总共5天后,浓缩混合物并通过用己烷/EtOAc(4:1至2:1)洗脱的短硅胶塞。将洗脱液浓缩,将所得黄色油状物溶于MeOH/THF(1:1)(20mL)中,并将溶液搅拌3.5天以通过溶剂分解除去甲硅烷基酯。
4.将反应混合物浓缩并通过硅胶色谱法(己烷/EtOAc,4:1至2:1)分离含有木糖和鼠李糖的(TES)
部分C:通过被保护的前皂苷元7中葡萄糖醛酸羧酸的选择性酯化合成被保护的皂树前皂苷元8
1.在10mL改良的Schlenk烧瓶中,将前皂苷元二酸7(81mg,41μmol,1.0当量)溶于DCM(0.7mL)中,并加入吡啶(30μL,0.37mmol,9.0当量)和TBP(102mg,0.41mmol,10当量),然后加入氯甲酸苄酯(15μL,0.11mmol,2.6当量)。
2.将反应物搅拌6小时,加入另外的氯甲酸苄酯(3.0μL,21μmol,0.51当量)(在前6小时后额外加入CbzCl取决于每个具体情况中的反应进程;当通过硅胶色谱法纯化时,也可以考虑用苯/EtOAc(100:0至24:1)洗脱),并将反应再搅拌20小时。
3.将混合物浓缩并通过硅胶色谱法(己烷/EtOAc,20:1至7:1)纯化,得到选择性葡萄糖醛酸保护的前皂苷元8(58mg,68%),为白色固体。
实施例7:皂苷结构域片段的模块化、会聚组装
部分A:被保护的氨基半乳糖皂苷28的合成
1.步骤A:通过用被保护的木糖-鼠李糖-叠氮基半乳糖线性三糖26将支链三糖-三萜前皂苷元8糖基化来合成被保护的叠氮基半乳糖皂苷27。在50mL改良的Schlenk烧瓶中,将选择性保护的前皂苷元8(653mg,0.32mmol,1.5当量)和三糖亚氨酸酯26(230mg,0.21mmol,1.0当量)与甲苯(3×3mL)在高真空下共沸干燥,然后溶于DCM(10mL)中。
2.加入粉末4
3.将反应混合物在-78℃下搅拌6小时,通过硅胶塞,浓缩滤液。
4.通过硅胶色谱法(己烷/EtOAc,9:1至4:1)纯化,得到玻璃状固体的前皂苷元-线性三糖缀合物27(322mg,73%)。
5.步骤B:通过还原被保护的叠氮基半乳糖皂苷27合成被保护的氨基半乳糖皂苷28。在50mL改良的Schlenk烧瓶中,将PhSeSePh(313mg,1.0mmol,1.0当量)(注意:硒化合物剧毒,有难闻的气味。苯硒醇本身是非常有毒的。通过还原二苯基二硒化物原位制备苯硒醇溶液避免了直接处理苯硒醇的需要,但是将要加入到反应烧瓶中的含硒化物溶液的操作是必要的。处理硒试剂时应小心,所有操作应在通风橱中进行,并戴上防护手套和安全眼镜,包括称量二苯基二硒化物起始物质时。应提前准备漂白溶液,以处理所有用过的玻璃器具以及可能的早期柱级分,以氧化任何剩余的痕量硒化物。漂白溶液也应该放置在旋转蒸发器的溶剂收集器中,使用后应彻底清洁并理想地将其包含在通风橱中)溶于THF(8mL),并再通过注射器加入H
6.将该黄色溶液在40℃加热1小时直至其变为无色。
7.将反应混合物从热中移出,用苯(8mL)和蒸馏水(8mL)稀释,并在Ar下剧烈搅拌5分钟。在Ar的正压下通过注射器(或玻璃吸管)除去所得两相悬浮液的下层水相,并将无水硫酸钠加入Schlenk烧瓶中以在搅拌下干燥剩余的有机层。
8.然后将此新制备的PhSeH溶液(~1.9mmol)通过套管转移在Ar下加入到250mL反应Schlenk烧瓶中,该烧瓶含有共沸干燥的皂苷叠氮化物27(322mg,0.11mmol,1.0当量)的Et
9.将反应混合物在40℃下搅拌3小时,然后浓缩,得到黄白色固体。
10.通过硅胶色谱法(己烷/EtOAc,4:1至EtOAc,具有0.5vol%Et
部分B:保护氨基酰基皂苷31的合成
1.在5mL梨形Schlenk烧瓶中,将市售的6-(Boc-氨基)己酸(HO
2.混浊的白色混合物在0℃下搅拌3小时。然后加入前皂苷元-线性三糖皂苷胺28(26mg,8.6μmol,1.0当量),并将反应物在室温下搅拌1.5小时。
3.加入水(0.1mL)猝灭反应,此时溶液由浑浊白色变为澄清黄色。加入更多的水(0.1mL)后,浓缩所得不混溶的混合物。
4.通过硅胶色谱法(甲苯/EtOAc,20:1至11:1)纯化,得到含氨基酰基支链三糖的皂苷31(22mg,81%),为白色玻璃状固体。
实施例8:被保护的氨基酰基化皂苷的全部去保护
部分A:通过被保护的氨基酰基皂苷31的氢解和酸水解合成氨基酰基皂苷33
1.在100mL圆底烧瓶中,将完全保护的含支链三糖的皂苷31(240mg,75μmol,1.0当量)溶于THF/EtOH(1:1)(20mL)中,然后加入10%(基于干重)Pd/C(湿的Degussa型E101 NE/W)(140mg,66μmol,0.9当量)(注意:氢解反应造成显著的火灾危险。处理易燃的钯/碳和氢气时要小心,这会增加爆炸风险。)。
2.使用高压气罐反应器将反应混合物在室温下在H
3.用MeOH(3×100mL)彻底洗涤钯并浓缩澄清的滤液。通过在甲醇-d
4.在50mL圆底烧瓶中,将得到的部分脱甲硅烷基化产物的粗混合物溶解于TFA/水(4:1)(10mL)的预冷(0℃)溶液中。
5.将反应混合物在0℃下搅拌3小时,然后在0℃高真空下浓缩,得到白色固体残余物(140mg)。
6.将该粗产物溶于水/MeCN(4:1)溶液中,并使用20→35%MeCN/水(0.05vol%TFA)经10分钟的线性梯度通过RP-HPLC纯化。收集含有主要单峰的级分并冻干至干,得到完全脱保护的含游离胺的皂苷33(88mg,78%),为蓬松的白色固体。
实施例9:酰基链结构域胺的后期酰基化形成完全精制的皂苷3
部分A:通过氨基酰基皂苷33中游离胺的选择性4-碘苯甲酰基化合成完全精制的皂苷3
1.在装配有装有Ar入口针的橡胶隔膜的10mL圆底烧瓶中,将胺终止皂苷33(9.0mg,6.0μmol,1.0当量)溶于DMF(2.0mL)中,并通过气密注射器注射Et
2.将混合物在室温下搅拌50分钟,然后在Ar下通过注射器从装有橡胶隔膜的5mL梨形烧瓶滴加溶于DMF(0.6mL)中的市售可得的4-碘苯甲酸N-琥珀酰亚胺基酯(20mg,60μmol,10当量)。
3.将反应混合物在室温下搅拌1小时,用水/MeCN(4:1)(10mL)稀释,并经30分钟使用20→70%MeCN/水的线性梯度通过RP-HPLC直接纯化。
4.收集对应于如质谱分析评估的含所需产物的峰的级分并冻干至干,得到完全精制的皂苷3(5.4mg,52%),为白色粉末。
实施例10:化合物I-4的全合成(TQL-1055)
化合物I-4(TiterQuil-1-0-5-5/TQL-1055)的全合成描绘于本申请的图6-8。与该实施例中的化合物相关的编号不意味着与在该申请全部的其余部分,包括其它附图、权利要求或实施例1-9出现的其它通式或化合物编号对应。
实施例11:具有合成皂苷作佐剂的Prevnar-13-CRM197缀合物疫苗
测试了合成的QS-21和TQL-1055(化合物I-4)对由FDA批准的人类pmeumococcal-CRM197缀合物疫苗Prevnar-13诱导的抗体滴度的影响。在两种不同Prevnar剂量水平(0.04mcg和0.2mcg)的合成皂苷佐剂存在或不存在的情况下,用Prevnar-13免疫小鼠。小鼠在第0天免疫一次并在第21天取血以进行血清分析。本申请的图2记录了本研究获得的数据,显示高或低剂量的Prevnar-13或Lym2-CRM197缀合物连同合成的QS-21(SQS-21)或TQL-1055(化合物I-4)的免疫原性。
实施例11:TQL-1055(化合物I-4)和QS-21对Tdap疫苗Adacel免疫原性的影响
使用间隔4周的2次接种皮下(SC,无免疫佐剂)给予每只小鼠含有1、0.3和0.1mcg百日咳毒素的Adacel剂量,分别产生在第二次接种后2周抽取的每毫升血清中平均1,618mcg、898mcg和107mcg的抗PT抗体。0.1mcg的剂量与未接种的对照(96mcg/ml)不可区分。选择0.5mcg剂量的Adacel进行药理学/毒理学(药理/毒理学)研究。本研究的血清学结果总结于本申请的图3中。与单独用Adacel进行免疫相比,第2次SC免疫后2周5只小鼠组中的抗体水平被TiterQuil-1055(TQL-1055/化合物I-4)放大至70倍(726至52,344)(并且在2周后进一步增加),被QS-21放大至10倍。接受50mcg的TiterQuil-1055的小鼠没有检测到体重减轻,而20mcg QS-21注射的小鼠体重减少了8-9%。
实施例12:TiterQuil-1-0-5-5和QS-21对乙型肝炎疫苗Engerix-B免疫原性的影响
在10只小鼠组中用Engerix-B(HBV成人疫苗)进行实验。最初测试每只小鼠3mcg、1mcg、0.3mcg、0.1mcg和0.03mcg Engerix-B剂量。平均得到的抗-HBsAg抗体水平分别为92,512mcg/ml、64,255mcg/ml、24,847mcg/ml、3,682mcg/ml和910mcg/ml,0.03剂量与对照(821mcg/ml)不可区分。选择0.3mcg剂量的Engerix-B用于进一步研究,并将该剂量与各种剂量的TiterQuil-1055(TQL-1055/化合物I-4)混合使用。得到的几何平均抗体浓度总结在本申请的图4中。尽管10mcg的TiterQuil-1055似乎没有血清学效应,但与单独的Engerix-B比较,30和100mcg TiterQuil-1055与Engerix-B的混合物使抗体水平分别增加至>6倍和5倍。一致地发现,在高于50mcg/只小鼠的TiterQuil-1055剂量下缺乏抗体增加或减少反应。在30mcg TiterQuil-1055剂量下没有看到体重减轻,在100和300mcg剂量下只有4%和5%的体重减轻。
实施例13:Adacel QS-21和TiterQuil-1055的中试药理学/毒理学结果
在7组5只小鼠中进行药理/毒理学研究:1)单独的PBS,2)50mcg TiterQuil-1055,3)20mcg QS-21,4)Adacel 2.5mcg百日咳毒素(1/5人类剂量),5)Adacel+QS-21(20mcg QS-21),6)Adacel+TiterQuil-1055(50mcg),7)Adacel+TiterQuil-1055(50mcg)。小鼠在第1天和第15天SC接种,每天称重,并在第22天取血并处死,不同之处在于第7组在第29天处死。在任何组中均未见血液化学或血液学结果变化。在第3组和第5组的所有小鼠中都观察到7-9%的体重减轻(与QS-21的先前结果一致)并且没有其它小鼠出现体重减轻。对所有小鼠进行33种不同组织的组织病理学检查。检测到的异常仅限于肝脏。在组4-6中的所有小鼠中观察到中度到严重的肝细胞胞质空泡形成(完全归因于该剂量的百日咳疫苗,组5和6不比组4更严重),但在组1或组2中没有这样的小鼠。这种异常是短暂的,并且在组7中没有检测到,组7在组1-6后1周被处死。在第3组(单独的QS-21)的所有小鼠中观察到轻微的空泡变化。第1组和第2组(PBS和TiterQuil-1055)完全没有变化。
实施例14:化合物I-4的稳定性和溶血活性(TQL-1055/TiterQuil-1-0-5-5)
测试天然和合成的QS-21(SQS-21或SAPONEX
- 三萜皂苷类似物
- 三萜皂苷类似物
