猪星状病毒的多重RT-PCR引物组、试剂盒及应用
文献发布时间:2023-06-19 11:05:16
技术领域
本发明属于生物技术领域,具体涉及了一种用于检测猪星状病毒的多重RT-PCR引物组、试剂盒及其应用。
背景技术
猪星状病毒最早于1980通过电子显微镜在猪粪便中检查发现。猪星状病毒不仅是人兽共患传染病,而且与多种动物的肠道腹泻疾病相关,从鸟类到哺乳动物,在到人类都有感染。猪星状病毒常常感染年幼的,年老的及免疫力低下的动物。与此同时,在猪星状病毒的阳性样本中经常检查到轮状病毒、冠状病毒、杯状病毒及其他肠道病毒混合感染造成急性胃肠炎。此外,猪星状病毒基因型繁多,目前已发现有5个基因型(PAstV1-PAstV5),各基因型序列同源性很低,表明来源于不同的进化分支。虽然各基因型遗传背景差异显著,然而却能够在同一地区,甚至同一头猪体内检出,不同基因型PAstVs混合感染现象普遍。除此之外,不同基因型PAstV的共感染常常导致基因重组现象,具有跨种间传播和人兽共患的可能性。而且PAstV各基因组之间,常常出现多基因型混合感染的情况,有二种或二种以上的基因型感染,进一步加速病毒的遗传变异,为猪星状病毒的监控带来挑战。值得一提的是,猪星状病毒种间屏障可能并不严格,遗传进化分析结果提示猪星状病毒可能跨越了人及其他动物的种间屏障。研究者发现,人星状病毒与猪星状病毒部分ORF2基因存在重组现象,表明猪星状病毒在进化过程中与人星状病毒有密切的关系。所以,建立高效快捷的检测方法,弄清猪星状病毒在猪群中的感染及不同毒株之间的变异,关系对星状病毒的生物学特性,致病机理和预防人兽共患星状病毒感染具有重要的公共卫生学意义。
在当今集约化管理的生产中,猪星状病毒常常出现多基因型混合感染的情况,有二种或二种以上的基因型感染,由于检测方法的单一,同时能检测到是困难的。猪星状病毒的流行病学监测是一项长期的、十分有必要的工作,那么建立一种快速、准确的诊断方法成为PAstV监控的必要条件之一。相比而言,建立多重PCR检测技术能同时扩增多种基因片段,且成本低,快速、价格廉价,无疑是当前最好的检测手段。
发明内容
本发明为解决单RT-PCR操作繁琐、交叉污染风险高的问题,提供一种操作简便、避免叉污染,节约检测时间、试剂消耗、针对性强和灵敏度高的用于检测猪星状病毒多重RT-PCR引物组、试剂盒及其应用,具体方案如下:
用于检测猪星状病毒的多重RT-PCR引物组,包括五对特异性引物,分别是引物PAstV1-F和PAstV1-R、引物PAstV2-F和PAstV2-R、引物PAstV3-F和PAstV3-R、引物PAstV4-F和PAstV4-R、引物PAstV5-F和PAstV5-R,它们分别具有序列表SEQ.ID.No.1至SEQ.ID.No.10的碱基序列。
用于检测猪星状病毒的多重RT-PCR试剂盒,所述试剂盒包括多重RT-PCR引物组。
所述试剂盒还包括5×buffer、dNTPMix、M-MLVReverseTranscriptae、RNA酶抑制剂、RNA、TarakaEx×Taq、10×ExTaqBuffer、dNTPMix、TemplatecDNA和ddH
所述的用于检测猪星状病毒的多重RT-PCR引物组在RT-PCR扩增中的应用。
所述RT-PCR扩增反应体系为多重RT-PCR引物组各0.8μmol/L、TarakaEx×Taq0.25μL、10×ExTaqBuffer5μL、dNTPMix4μL、cDNA模板各2.5μL、灭菌后ddH
所述RT-PCR扩增反应条件为98℃变性10s,55℃退火30s,72℃延伸1min,30个循环。
本发明的优点
1、针对目前缺乏对多基因型的猪星状病毒同时进行检测和诊断的有效可靠的技术,发明人研究设计了五对特异性引物,分别是引物PAstV1-F和PAstV1-R、引物PAstV2-F和PAstV2-R、引物PAstV3-F和PAstV3-R、引物PAstV4-F和PAstV4-R、引物PAstV5-F和PAstV5-R,并建立了制备了相应的RT-PCR试剂盒并建立相应的RT-PCR检测方法。该RT-PCR检测方法能对同一份检测样品的总RNA获取的cDNA为模板,进行PCR扩增,根据扩增产物的大小,通过琼脂糖凝胶电泳判断待检测样品感染病毒的基因型,实现在同一个反应体系中同时扩增病毒的五种基因型进行鉴别,对早期检测和有效防控猪星状病毒的发生与蔓延具有重要的实际作用。
2、本发明在实际操作中简便,减少了操作次数,极大的避免了交叉污染,节约检测时间和试剂消耗。由于建立的检测方法针对的病毒保守区基因扩增,针对性强,灵敏度高。在临床实验中能够达到简便、经济、便捷和准确的检验要求。对了解猪星状病毒的流行情况、疾病的预防和控制提供了技术支持。为监测猪星状病毒1~5型的流行及混合感染情况和分子生物学快速诊断奠定了基础。
附图说明
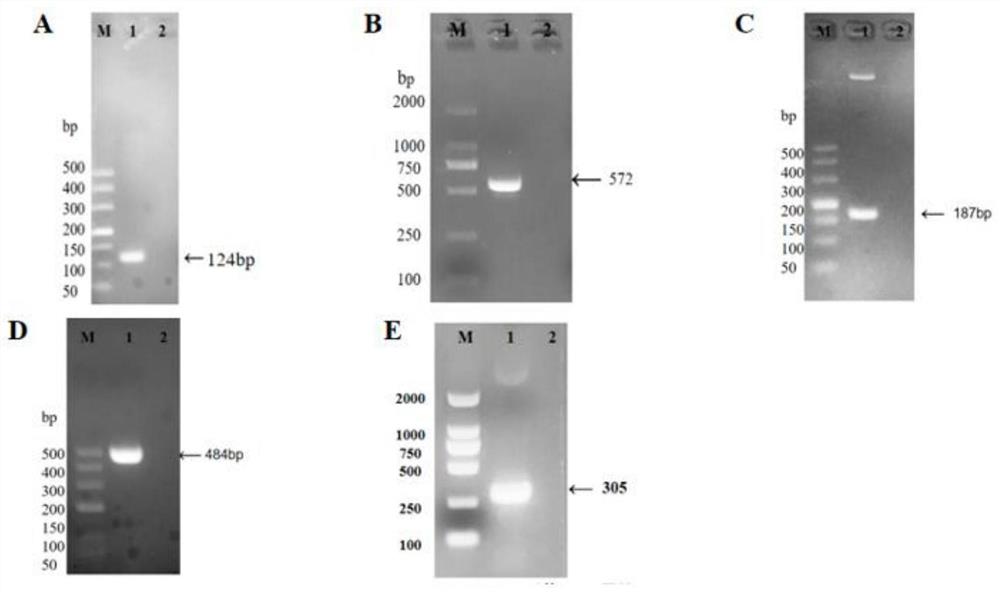
图1是PAstV1、PAstV2、PAstV3、PAstV4和PAstV5对应的特异性引物检测图,图中泳道从左到右依次为M:M:DL2000DNAMsrker;A、B、C、D、E依次为PAstV1、PAstV2、PAstV3、PAstV4、PAstV5;
图2是多重RT-PCR引物浓度优化图,其中M:DL2000DNAMsrker;1,2,3,4,5的引物浓度依次为0.2μmol/L、0.4μmol/L、0.6μmol/L、0.8μmol/L、1.0μmol/L。
图3是多重RT-PCR退火温度的优化图,其中M:DL2000DNAMsrker;1,2,3,4,5的退火温度分别为53℃;54℃;55℃;56℃;57℃。
图4是本发明同时检测PAstV1、PAstV2、PAstV3、PAstV4和PAstV5对应的引物特异性检测结果图,图中泳道从左至右依次为:M:DL2000DNAMsrker;1:PAstV1;2:PAstV2;3:PAstV3;4:PAstV4;5:PAstV5;6:PAstV1、PAstV2、PAstV3、PAstV4及PAstV5;7-13非靶标基因;14:阴性对照。
图5是本发明同时检测PAstV1、PAstV2、PAstV3、PAstV4和PAstV5单一敏感性实验结果图,泳道从左到右依次为:1:10
图6是同时检测多重RT-PCR敏感性的检测结果图,图中泳道从左到右依次为:M:DL2000Marker;1:10
具体实施方式
下面结合附图和具体实施例对本发明作进一步的解释和说明,下列具体实施例不限定本发明的保护范围。若未特别指明,实施例中的技术手段为本领域技术人员所熟知的常规手段。
实施例1
1.1试验用毒株及临床样本
猪星状病1型、猪星状病毒2型、猪星状病毒3型、猪星状病毒4型、猪星状病毒5型、猪肠道病毒、猪塞内卡病毒、猪伪狂犬病病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒的阳性核酸样本,均由本实验室鉴定,并在-80℃保存。猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒三联活疫苗(哈尔滨维科生物技术开发公司)、猪日本乙脑病毒(武汉科前生物股份有限公司)。临床粪便样本均来自2020年广西地区某猪场,共计275份。
1.2引物设计与合成
根据GenBank上已报道的PAstV1、PAstV2、PAstV3、PAstV4和PAstV5的全基因组序列,对不同毒株基因组的对比和分析,筛选其较为保守的核酸片段,应用Pirmer5.0引物设计软件设计了五对针对上述五种病毒的特异性引物,并通过NCBI对五对引物进行在线分析。最终筛选出五对引物(表1),引物由生工生物工程(上海)股份有限公司合成。五对引物能够特异性的扩增出119(PAstV1)、572(PAstV2)、187(PAstV3)、484(PAstV4)、305(PAstV5)的特异性片段。
表1多重RT-PCR引物序列表
实施例2cDNA模板制备
2.1待检测样品RNA的提取:采集猪粪便,用PBS将粪便样品进行漩涡震荡稀释,8000r/min4℃离心,取上清,-80℃保存。
2.2反转录反应条件:42℃反应1h,得到的cDNA保存于-20℃,用于PCR扩增。
2.3表2反转录PCR体系
2.4cDNA提取:按照常规的传统发提取PAstV1、PAstV2、PAstV3、PAstV4和PAstV5的DNA,-20℃保存。
实施例3单一PCR扩增序列验证
取实施例2保存的PAstV1、PAstV2、PAstV3、PAstV4和PAstV5的cDNA为模板,利用实施例1中设计的五对特异性引物分别进行单一PCR扩增。单一PCR扩增体系如表3。反应条件为98℃变性10s;55℃退火30s;72℃延伸1min;30个循环。RT-PCR产物经1.5%琼脂糖凝胶电泳检测。试验结果如图1所示,将上述PCR产物经纯化试剂盒纯化目的基因,由生工生物工程(上海)股份有限公司测序。测序结果显示其与对应毒株的核苷酸序列一致。
表3 RT-PCR反应体系
实施例4多重RT-PCR反应
4.1多重RT-PCR反应体系及优化条件;
在反应条件不变的情况下(98℃变性10s;55℃退火30s;72℃延伸1min;30个循环),将相同浓度的PAstV1、PAstV2、PAstV3、PAstV4和PAstV5混合后作为多重RT-PCR模板,对多重RT-PCR反应条件,包括引物浓度、反应体系进行优化。
引物浓度筛选:所用反应体系:上下游引物各1.0μL;TarakaEx×Taq0.25μL;10×ExTaqBuffer5μL;dNTPMix4μL;cDNA模板各2.5μL;灭菌后ddH
退火稳定优化:退火温度选取53℃;54℃;55℃;56℃;5:57℃5个不同梯度进行PCR扩增,选取最佳退火温度,结果如图3所示。
4.2多重RT-PCR特异性;
在建立多重RT-PCR反应条件下对PAstV1、PAstV2、PAstV3、PAstV4和PAstV5的混合cDNA模板及PEV、PRRSV、SVV、CSFV、JEV及猪三联活疫苗(PEDV、RV、TGEV)阳性样本的cDNA及PRV阳性样本的DNA模板进行扩增,扩增结果显示(如图4),只有PAstV1、PAstV2、PAstV3、PAstV4和PAstV5单一cDNA和PAstV1、PAstV2、PAstV3、PAstV4和PAstV5混合cDNA扩增出与目的片段大小符合的条带。
4.3单一/多重RT-PCR敏感性实验
利用分光光度计分别测定PAstV1、PAstV2、PAstV3、PAstV4和PAstV5的cDNA浓度分别为2.3×10
如图5,将5病毒基因型质粒单一进行敏感性扩增,该方法对PAstV1、PAstV2、PAstV3、PAstV4和PAstV5的cDNA最小检出量分别为2.3×10
如图6,将5病毒基因型质粒混合进行敏感性扩增,该方法对PAstV1、PAstV2、PAstV3、PAstV4和PAstV5的cDNA最小检出量分别为2.3×10
实施例5临床样品初步运用
利用本发的多重RT-PCR引物进行如下样品的RT-PCR检测,对2020年在广西地区各猪场采集的275份粪便进行检测。
表4临床样品检测结果
猪星状病毒作为肠道致病性病毒,自首次发现以来,已经在全球多个国家进行流行,在相当一段时间内,认为只是散发的轻微腹泻,星状病毒的致病性并未引起重视。随着检测手段的发展,对星状病毒有了更深入的了解,而且还存在肾炎、肝炎、神经症状的现象。还有研究指出该病毒可以和人的星状病毒发生基因重组。
猪肉作为我国的主要肉食之一,随着集约化的快速发展,猪肉价格的不断上涨。养殖业的分布范围广、养殖规模大等特点,规模化的养殖方式使得星状病毒感染力居高不下。虽然,导致猪腹泻病毒的原因不仅仅只有星状病毒,但是星状病毒常常与其他腹泻病毒混合感染,在腹泻病毒中常常起“帮凶”的作用等。而且星状病毒存在多基因型混合感染,使得腹泻症状加剧,或者引发神经或脑炎症状,常常给养殖户造成经济损。目前针对星状病毒的诊断检测多停留在单重RT-PCR或者双重RT-PCR的检测层面,而其他检测方法如:直接免疫荧光试验、电镜检查、琼脂免疫扩散试验这些方法价格昂贵,并不适合规模的临床检测。因此,针对不同基因型建立多重RT-PCR的检测方法,效率高效、节约成本。
本发明针对区别猪星状病毒各基因型的混合感染情况,建立多重RT-PCR检测试剂盒。检测对象涉及AstV1、PAstV2、PAstV3、PAstV4和PAstV5。上述各基因有部分基因型在猪群中危害较大,其潜在的公共卫生学意义尤为重要,对检测疫病的流行情况和预防具有重要的价值。
本发明建立的多重RT-PCR灵敏度高,最低检测量达到10
综上所述,本发明提供了一种可以特异性、灵敏地检测PAstV1、PAstV2、PAstV3、PAstV4和PAstV5各基因型的检测和鉴别及混合感染情况,公共流行病学调查等具有重要的应用价值。
以上所述之实施例为本发明的较佳实施例而已,仅仅用以解释本发明,并非限制本发明范围,对于本技术领域的技术人员来说,能根据本说明书中所公开技术内容,通过置换或改变的方式轻易做出其他实施方式,故凡在本发明的原理上所作是变化和改进,均应包括本发明申请专利范围内。
序列表
<110> 广西大学
<120> 用于检测猪星状病毒的多重RT-PCR引物组、试剂盒及其应用
<130> LWY2021009
<160> 10
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
ggccgtggca ggagcagatc 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
gactgaggtt taccccgtct 20
<210> 3
<211> 16
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
accaccgcgc aggagg 16
<210> 4
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
tgttgytcaa grgcagc 17
<210> 5
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
gatgtgatga ccctctatgg g 21
<210> 6
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
gccggtcaag catctcatca g 21
<210> 7
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
tggggtcctg aagcatttgc 20
<210> 8
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
tgtggatggt ccccatt 17
<210> 9
<211> 17
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
aatgtgcgkg tgaaaga 17
<210> 10
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
tgaaatgtga cttcacctga 20
- 用于检测猪星状病毒的多重RT-PCR引物组、试剂盒及其应用
- 实时荧光定量检测四种猪腹泻病毒的多重RT-PCR引物探针组、试剂盒及其检测方法
