一种中山杉体细胞胚胎发生的方法
文献发布时间:2023-06-19 12:10:19
技术领域
本发明属于林木细胞工程技术领域,具体涉及一种中山杉体细胞胚胎发生的方法。
背景技术
落羽杉属(Taxodium Rich.)属于杉科(Taxodiaceae),属内主要分3个种,落羽杉(Taxodium distichum(Linn.)Rich.)、池杉(T.ascendens Brongn)和墨西哥落羽杉(T.mucronatum Tenore)。落羽杉属均为高大乔木,由于扎根深、根系庞大,扩基快,在欧美等国广泛用于湿地造林、防风固土和填充沟壑。中山杉(Taxodium‘Zhongshanshan’)也称杂交落羽杉,主要是落羽杉,墨西哥落羽杉,池杉3个树种种间杂交得到的优良无性系的总称。中山杉兼具了落羽杉属树种间的主要优点:半常绿高大乔木,树干挺拔、树形优美、枝叶茂盛、树冠紧凑圆满、落叶期极短,生长快,抗风,耐盐碱,耐水淹,成材率好,观赏价值高等。目前在江苏、浙江、重庆、云南等十多个沿海、内陆省(市)累计造林示范面积超过1.9×10
中山杉虽能自然结实,但出苗率极低,育种周期长,良种繁育目前主要采用传统的扦插繁育技术,但是受自然环境和季节性限制较大,长期持续生产非常困难。目前虽有中山杉关于不定芽增殖的报道,但增殖率低,生根困难,不足以短期满足苗木市场的巨大需求。
林木体细胞胚发生技术是目前林木繁殖效率最高,最具有应用前景的技术。林木体胚发生技术是在人工条件下通过诱导体细胞转向胚性细胞发育,获得胚性细胞,然后经过人工控制条件诱导形成体细胞胚,然后体细胞胚萌发进一步形成完整再生植株,原则上一个胚性细胞(团)发育成一株苗,具有无限性。在林木体胚发生技术中,胚性愈伤组织的诱导和胚性细胞维持和增殖是体胚发生体系的关键起始步骤。因此,首先建立一种高效、稳定的胚性愈伤组织的诱导、维持和增殖方法的十分必要。
发明内容
针对现有技术存在的上述问题,本发明所要解决的技术问题在于提供一种中山杉体细胞胚胎发生的方法。
为了解决上述技术问题,本发明所采用的技术方案如下:
一种中山杉体细胞胚胎发生的方法,包括以下步骤:
1)采集中山杉未成熟球果,取发育至早期子叶胚的种子,经表面灭菌后,无菌条件下,分离出未成熟合子胚;
2)在无菌条件下,将未成熟合子胚接种至诱导固体培养基中诱导培养获得含胚性胚柄细胞团的胚性愈伤组织;
3)在无菌条件下,将步骤2)获得的胚性愈伤组织转入维持和增殖固体培养基中,经继代培养,获得大量增殖的胚性愈伤组织;
4)在无菌条件下,将步骤3)获得的胚性愈伤组织转移到体细胞胚胎诱导培养基至诱导出中山杉体细胞胚胎。
进一步的,步骤1)中,8月中下旬至9月中旬采集中山杉未成熟球果,取发育至早期子叶胚的种子,经75%乙醇和2.5%次氯酸钠进行表面灭菌后,无菌条件下,分离出未成熟合子胚。
进一步的,步骤1)中,8月中下旬采集中山杉未成熟球果,取发育至早期子叶胚的种子。
进一步的,步骤2)中,所述诱导固体培养基的配方为改良DCR基本培养基添加有NAA、6-BA、L-Glu、Pro、Inositol、Maltose和琼脂;
步骤3)中,所述维持和增殖固体培养基的配方为3/4改良DCR基本培养基添加有NAA、6-BA、KT、Pro、Inositol、CH、Maltose和琼脂;
步骤4)中,所述体细胞胚胎诱导培养基的配方为改良DCR基本培养基添加有ABA、KT、茉莉酸甲酯、聚乙二醇8000、Inositol、LH、Vc、Maltose和琼脂。
进一步的,改良DCR基本培养基是以DCR基本培养基为基础,在其它成分不变的条件下调整以下组分的含量为:NH
进一步的,步骤2)中,所述诱导固体培养基的配方为:改良DCR基本培养基+NAA2.0~4.0mg/L+6-BA 0.5~1.5mg/L+L-Glu 0.3g/L+Pro 0.2g/L+Inositol 0.2g/L+Maltose 25g/L+琼脂8.5g/L。
进一步的,步骤3)中,所述维持和增殖固体培养基的配方为:3/4改良DCR基本培养基+NAA 1.0~2.0mg/L+6-BA 0.2~0.5mg/L+KT 1.0mg/L+Pro0.2g/L+Inositol 0.2g/L+CH0.5g/L+Maltose 30g/L+琼脂8.5g/L。
进一步的,步骤4)中,所述体细胞胚胎诱导培养基的配方为:改良DCR基本培养基+ABA 2.0~4.0mg/L+KT 1.0~4.0mg/L+茉莉酸甲酯0.2g/L+聚乙二醇8000100g/L+Inositol0.5g/L+LH 1g/L+Vc 15mg/L+Maltose 20g/L+琼脂8.5g/L。
进一步的,步骤2)中,诱导培养的条件为:黑暗条件,控温23℃,培养20~25天;
步骤3)中,继代培养的条件为:黑暗条件,控温23℃,每隔18~20天继代一次;
步骤4)中,体细胞胚胎诱导培养的条件为:黑暗条件,控温23~25℃,每隔35~40天继代一次。
有益效果:相比于现有技术,本发明的优点为:
本发明针对当前中山杉不定芽增殖生根困难、植株再生率低、扦插繁育难以长期持续生产,较难满足生产应用需要等问题,提供了一种利用中山杉未成熟胚诱导胚性愈伤组织,不受季节和外部环境的限制,可以提高外植体愈伤组织诱导率,能够短期内获得大量白色且质地紧实的胚性愈伤组织,并诱导出体细胞胚胎。为中山杉优良品系的快速繁殖提供了一种高效途径,不仅有利于优良种质资源的保存,而且可以实现大量繁殖优质种苗的目标,极大满足市场需求。
附图说明
图1为中山杉未成熟合子胚图;
图2为未成熟胚诱导出的初始胚性愈伤组织图;
图3为增殖和维持培养中的胚性愈伤组织图;
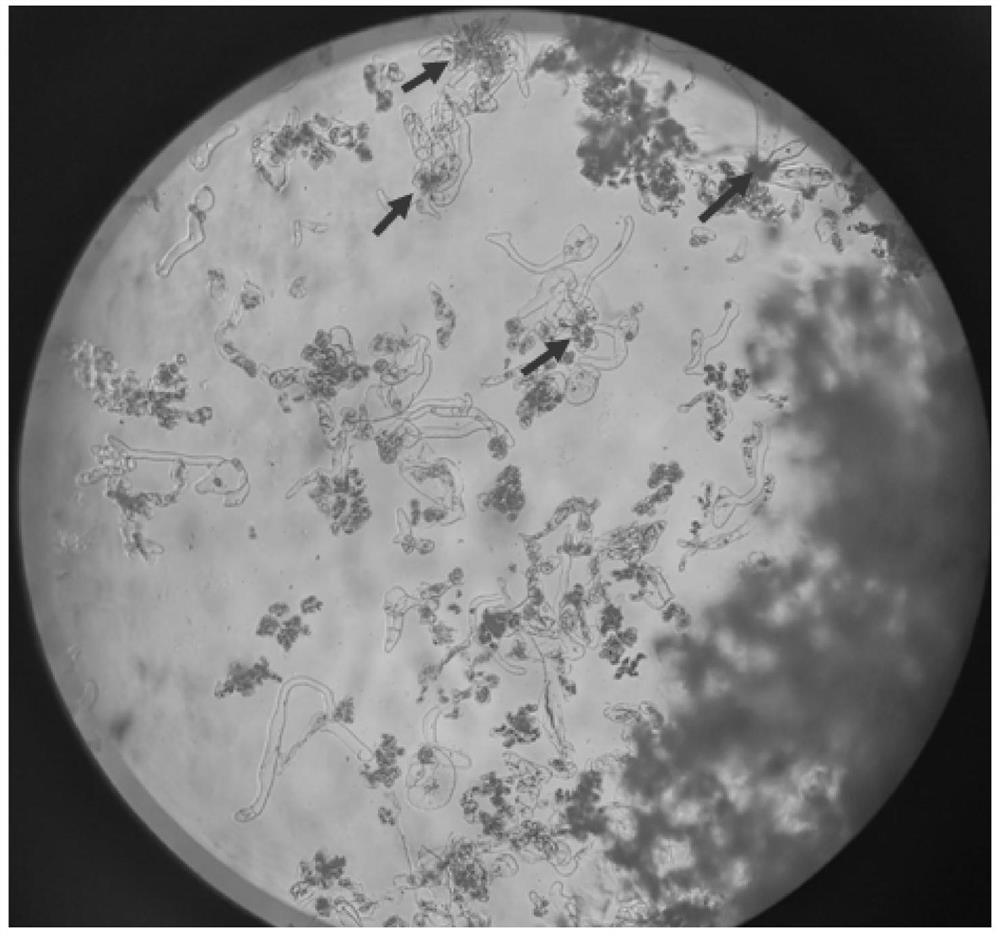
图4为胚性愈伤组织显微照片,箭头为胚性胚柄细胞团;
图5为胚性愈伤组织诱导出的体细胞胚胎,图中,短箭头为体胚成熟前期胚状结构,长箭头为成熟子叶体细胞胚。
具体实施方式
下面结合具体实施例对本发明进一步进行描述。这些实施例仅用于说明本发明而不用于限制本发明的范围。以下实施例中如无特殊说明,所用实验方法均为常规方法。
以下实施例中所用到的改良DCR基本培养基配方为:NH
实施例1
(1)中山杉未成熟合子胚的准备
8月下旬至9月中旬每隔7天采集中山杉未成熟球果,迅速置于4℃冷藏保存。取出合子胚于解剖镜下观察,取发育至早期子叶胚的种子,用75%乙醇先浸泡45~60秒,然后用2.5%次氯酸钠溶液灭菌18~20分钟,最后用无菌水冲洗3~4遍,随后在无菌条件下中,在解剖镜下用无菌手术刀和镊子件下剥掉种子外面的硬质种皮,取出未成熟合子胚,接种于固体的胚性愈伤诱导培养基中,每培养皿接种8~10粒。中山杉未成熟合子胚如图1所示。
(2)胚性愈伤组织的诱导
在无菌条件下,将未成熟合子胚接种至诱导固体培养基中,培养20~25天,黑暗条件,控温23℃,诱导获得胚性愈伤组织,如图2。其中诱导固体培养基为:改良DCR基本培养基+NAA 2.0mg/L+6-BA 0.5mg/L+L-Glu 0.3g/L+Pro 0.2g/L+Inositol 0.2g/L+Maltose25g/L+琼脂8.5g/L,pH 5.6。
其中,NAA为萘乙酸,6-BA为6-苄氨基嘌呤,L-Glu为L-谷氨酰胺,Pro为脯氨酸,Inositol为肌醇,Maltose为麦芽糖。
L-谷氨酰胺能有效地抑制愈伤组织和培养基的褐化,显著改善愈伤组织的生长。
脯氨酸一方面可以作为氨基酸补充养分,另一方面可以提高组织的抗性,增加愈伤组织的成活率。
肌醇主要参与了碳水化合物和磷脂代谢及离子平衡等生理活动,在适当情况下使用能够促进愈伤组织的生长、胚状体的形成。
麦芽糖为诱导固体培养基提供碳源。
8月下旬至9月中旬不同采集时间下未成熟胚诱导胚性愈伤组织状态如表1所示,8月中下旬采集的种子适宜用来诱导胚性愈伤组织,诱导率达到87%以上,且愈伤状态良好。9月份可能由于胚发育较为成熟,分化状态较高,虽能诱导出愈伤组织,但愈伤组织状态较差,不适宜作为起始外植体。
表1不同采集时间下未成熟胚诱导胚性愈伤组织状态统计
(3)胚性愈伤组织维持与增殖阶段
在无菌条件下,将步骤(2)中诱导获得的胚性愈伤组织转入维持和增殖固体培养基中,黑暗条件,控温23℃,每隔18~20天继代一次,可获得大量增殖胚性愈伤组织,此处胚性愈伤组织在显微镜下可观察到是有体细胞起始物胚性胚柄细胞团。其中维持与增殖培养基为:3/4改良DCR基本培养基+NAA 1.0mg/L+6-BA 0.2mg/L+KT 1.0mg/L+Pro 0.2g/L+Inositol 0.2g/L+CH 0.5g/L+Maltose 30g/L+琼脂8.5g/L。
其中,NAA为萘乙酸,6-BA为6-苄氨基嘌呤,KT为6-糠氨基嘌呤,Pro为脯氨酸,Inositol为肌醇,CH为水解酪蛋白,Maltose为麦芽糖。
6-糠氨基嘌呤具有促进细胞分裂和组织分化的作用,用于组织培养,与生长素配合促进细胞分裂,诱导愈伤组织的分化。
水解酪蛋白一方面可以作为氨基酸补充养分,另一方面对胚状体的形成具有良好的促进作用。
(4)体细胞胚胎的诱导与发育
在无菌条件下,将步骤(3)获得的胚性愈伤组织转移到体细胞胚胎诱导培养基中,黑暗条件,控温23~25℃,每隔35~40天继代一次,可诱导出中山杉体细胞胚胎,如图5所示。其中体细胞胚胎诱导培养基为:改良DCR培养基为基本培养基+ABA 2.0mg/L+KT 1.0mg/L+茉莉酸甲酯0.2g/L+PEG8000 100g/L+Inositol 0.5g/L+LH 1g/L+Vc 15mg/L+Maltose20g/L+琼脂8.5g/L,pH 6.0。
其中,ABA为脱落酸,KT为6-糠氨基嘌呤,PEG8000为聚乙二醇8000,Inositol为肌醇,LH为水解乳蛋白,Maltose为麦芽糖。
茉莉酸甲酯在植物发育过程和抵御不良环境中,起着重要的内源激素作用,可以以信号分子的形式参与到植物次生代谢。
水解乳蛋白在适宜的浓度范围内能够促进愈伤组织的生长,且有效的抑制愈伤组织的褐化程度。
实施例2
与实施例1基本相同,不同的是步骤(2)中诱导固体培养基为:改良DCR基本培养基+NAA 4.0mg/L+6-BA 1.5mg/L+L-Glu 0.3g/L、Pro 0.2g/L+Inositol 0.2g/L+Maltose25g/L+琼脂8.5g/L,pH 5.6。
步骤(3)中维持与增殖培养基为:3/4改良DCR基本培养基+NAA2.0mg/L+6-BA0.5mg/L+KT 1.0mg/L+Pro 0.2g/L+Inositol 0.2g/L+CH 0.5g/L+Maltose 30g/L+琼脂8.5g/L,pH 5.8。
步骤(4)中体细胞胚胎诱导培养基为:改良DCR培养基为基本培养基+ABA 2.0mg/L+6-糠氨基嘌呤(KT)2.0mg/L+茉莉酸甲酯0.2g/L+聚乙二醇8000(PEG8000)100g/L+Inositol 0.5g/L+LH 1g/L+Vc 15mg/L+Maltose 20g/L+琼脂8.5g/L),pH 6.0。其他各步骤和控制条件均和实施列1相同,结果表明,亦能达到实施列1的诱导效果。
实施例3
与实施例1基本相同,不同的是步骤(4)中体细胞胚胎诱导培养基为:改良DCR培养基为基本培养基+ABA 3.0mg/L+6-糠氨基嘌呤(KT)2.0mg/L+茉莉酸甲酯0.2g/L+聚乙二醇8000(PEG8000)100g/L+Inositol 0.5g/L+LH 1g/L+Vc15mg/L+Maltose 20g/L+琼脂8.5g/L),pH 6.0。其他各步骤和控制条件均和实施列1相同,结果表明,亦能达到实施列1的诱导效果。
实施例4
与实施例1基本相同,不同的是步骤(4)中体细胞胚胎诱导培养基为:改良DCR培养基为基本培养基+ABA 3.0mg/L+6-糠氨基嘌呤(KT)4.0mg/L+茉莉酸甲酯0.2g/L+聚乙二醇8000(PEG8000)100g/L+Inositol 0.5g/L+LH 1g/L+Vc15mg/L+Maltose 20g/L+琼脂8.5g/L),pH 6.0。其他各步骤和控制条件均和实施列1相同,结果表明,亦能达到实施列1的诱导效果。
实施例5
与实施例1基本相同,不同的是步骤(4)中体细胞胚胎诱导培养基为:改良DCR培养基为基本培养基+ABA 4.0mg/L+6-糠氨基嘌呤(KT)4.0mg/L+茉莉酸甲酯0.2g/L+聚乙二醇8000(PEG8000)100g/L+Inositol 0.5g/L+LH 1g/L+Vc15mg/L+Maltose 20g/L+琼脂8.5g/L),pH 6.0。其他各步骤和控制条件均和实施列1相同,结果表明,亦能达到实施列1的诱导效果。
实施例6
与实施例1基本相同,不同的是步骤(4)中体细胞胚胎诱导培养基为:改良DCR培养基为基本培养基+ABA 4.0mg/L+6-糠氨基嘌呤(KT)3.0mg/L+茉莉酸甲酯0.2g/L+聚乙二醇8000(PEG8000)100g/L+Inositol 0.5g/L+LH 1g/L+Vc15mg/L+Maltose 20g/L+琼脂8.5g/L),pH 6.0。其他各步骤和控制条件均和实施列1相同,结果表明,亦能达到实施列1的诱导效果。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间,各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
以上详细描述了本发明的优选实施方式,但是,本发明并不局限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
- 一种中山杉体细胞胚胎发生的方法
- 一种普通油茶成熟胚通过体细胞胚胎发生方式获得再生植株的方法
