一种pH响应型防龋疫苗
文献发布时间:2023-06-19 19:28:50
技术领域
本发明属于疫苗技术领域,具体涉及一种pH响应型防龋疫苗。
背景技术
变异链球菌(Streptococcus mutans,S.mutans)是主要的致龋菌之一,其最主要的表面抗原为表面蛋白抗原(Streptococcus mutans surface protein,PAc)、葡糖基转移酶(glucosyltransferases,GTF)等。所以近年来针对变异链球菌的防龋疫苗从早期的疫苗类型,逐渐转变为DNA疫苗和抗原蛋白亚单位疫苗。
然而,目前所存在的防龋疫苗仍面临免疫原性弱、防龋效果有所不足的缺陷,因而本发明希望提出一种具有更显著防治龋齿效果的新型疫苗产品。
发明内容
本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种pH响应型防龋疫苗。该pH响应型防龋疫苗具有响应酸性pH释放的特点,且具有显著的防龋效果,有着广阔的应用前景。
本发明提供了一种pH响应型防龋疫苗,包括ZIF-8和变异链球菌表面蛋白抗原(PAc)。
ZIF-8(沸石咪唑酯骨架)是一种金属有机框架材料(MOFs),由Zn
优选地,所述变异链球菌表面蛋白抗原为重组抗原,所述重组抗原由SEQ ID NO:1所示的抗原片段1、SEQ ID NO:2所示的抗原片段2和连接肽组成。
更优选地,所述连接肽的氨基酸序列如SEQ ID NO:3所示。当连接肽的氨基酸序列为SEQ ID NO:3时,此时所述变异链球菌表面蛋白抗原的氨基酸序列如SEQ ID NO:4所示。
优选地,所述pH响应型防龋疫苗中ZIF-8和变异链球菌表面蛋白抗原的质量比为(5-40):1。
更优选地,所述pH响应型防龋疫苗中ZIF-8和变异链球菌表面蛋白抗原的质量比为(5-20):1。
进一步优选地,所述pH响应型防龋疫苗中ZIF-8和变异链球菌表面蛋白抗原的质量比为10:1。
优选地,所述ZIF-8的制备方法为:将六水合硝酸锌与2-甲基咪唑置于醇溶液中进行反应,收集沉淀,醇洗,干燥。
更优选地,所述醇溶液为甲醇溶液。
优选地,所述pH响应型防龋疫苗中还包括防腐剂、乳化剂、稳定剂或稀释剂中的至少一种。
优选地,所述pH响应型防龋疫苗包括皮下注射疫苗或滴鼻疫苗。
相对于现有技术,本发明的有益效果如下:
本发明将ZIF-8和PAc蛋白结合作为防龋疫苗,表现出高负载量和响应酸性pH变化释放的特性,具有显著的防龋效果。
附图说明
图1为重组变异链球菌表面蛋白PAc的过程中各阶段的电泳情况。其中,A为pac基因的PCR扩增结果;B为菌液PCR验证试验,1-8号为不同的单克隆,3号为阴性克隆;C为pac测序验证;D为Marker,1:全蛋白,2:杂蛋白,3:10mM咪唑,4:25mM咪唑,5:50mM咪唑,6:100mM咪唑,7:500mM咪唑的电泳结果;E为Marker,1:HisA-PAc融合蛋白,2-3:通过肠激酶切HisA标签蛋白过柱纯化后的PAc蛋白电泳结果。
图2为ZIF-8和ZIF-8@PAc相关表征结果。其中,A、B分别为通过SEM测定ZIF-8纳米材料和ZIF-8@PAc的粒径大小;C-D为通过TEM测定ZIF-8的内部情况;E-F为通过TEM测定ZIF-8@PAc的内部情况;H为PAc蛋白与ZIF-8纳米材料在不同质量比时的吸附程度;I为ZIF-8@PAc在不同pH下的释放能力。
图3为大鼠抗体滴度、菌含量变化和器官指数结果。其中,A为IgG抗体滴度;B为IgA抗体滴度;C为菌含量变化统计图;D-H分别为心肝脾肺肾器官指数统计图。
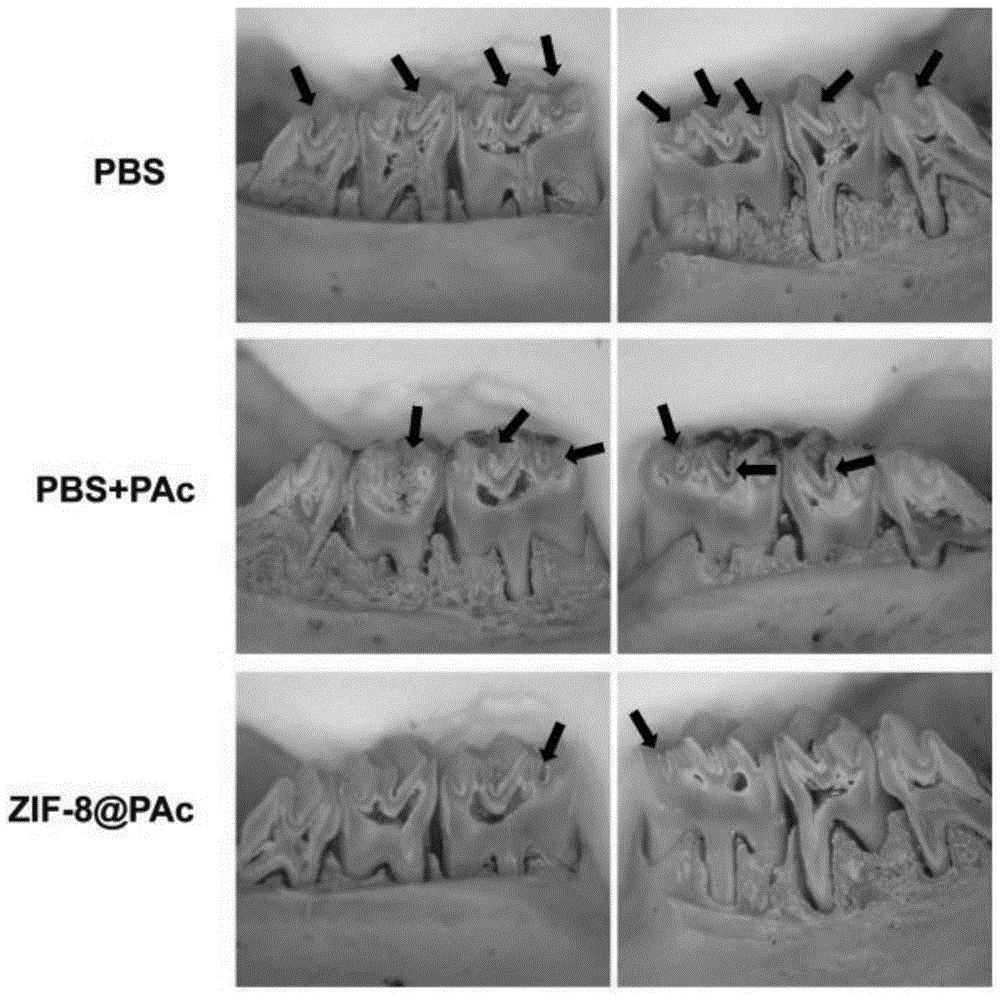
图4为PBS、PBS+PAc、ZIF-8@PAc对于大鼠的防龋结果。
具体实施方式
为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。需要指出的是,以下实施例仅为本发明的优选实施例,对本发明要求的保护范围不构成限制作用,任何未违背本发明的精神实质和原理下所做出的修改、替代、组合,均包含在本发明的保护范围内。
以下实施例中所用的原料、试剂或装置如无特殊说明,均可从常规商业途径得到,或者可以通过现有已知方法得到。
实施例1:ZIF-8纳米材料的合成
1、将六水合硝酸锌/Zn(NO
2、将溶有六水合硝酸锌的甲醇溶液在搅拌条件下(1000rpm)滴加至2-甲基咪唑的甲醇溶液中,室温下搅拌反应1h,反应过程中可观察到白色沉淀物的生成。
3、反应结束后,将混合液平均分成四管进行离心(8000rpm,10min)收集白色沉淀,分别用50mL甲醇洗3次,60℃烘箱过夜干燥,得ZIF-8白色固体。
实施例2:变异链球菌表面蛋白抗原(PAc)的制备
本实施例提供一种变异链球菌表面蛋白抗原(PAc),由SEQ ID NO:1所示的抗原片段1、SEQ ID NO:2所示的抗原片段2、如SEQ ID NO:3所示的连接肽组成,最终所得变异链球菌表面蛋白抗原的氨基酸序列如SEQ ID NO:4所示。
VKTAEEAVQKETEIKEDYTKQAEDIKKTTDQYKSDVAAHEAEVAKIKAKNQATKEQYEKDMAAHKAEVERINAANAASKTAYEAKLAQYQADLAAVQKTNAANQAAYQKALAAYQAELKRVQEANAAAKAAYDTAVAANNAKNTEIAAANEEIRKRNATAKAEYETKLAQYQAELKRVQEANAANEADYQAKLTAYQTELARVQKANADAKAAYEAAVAANNAKNAALTAENTAIKQRNENAKATYEAALKQYEADLAAVKKANAANEADYQAKLTAYQTELARVQKANADAKAAYEAAVAANNAANAALTAENTAIKKRNADAKADYEAKLAKYQADLAKY(SEQ ID NO:1);
VNVPKVTKEKPTPPVKPTAPTKPTYETEKPLKPAPVAPNYEKEPTPPTRTPDQAEPNKPTPPTYETEKPLEPAPVEPSYEAEPTPPTRTPDQAEPNKPTPPTYETEKPLEPAPVEPSYEAEPTPPTPTPDQPEPNKPVEPTYEVIPTPPTDPVYQDLPTPPSVPTVHF(SEQ ID NO:2);
STSTGSTSTG(SEQ ID NO:3);
VKTAEEAVQKETEIKEDYTKQAEDIKKTTDQYKSDVAAHEAEVAKIKAKNQATKEQYEKDMAAHKAEVERINAANAASKTAYEAKLAQYQADLAAVQKTNAANQAAYQKALAAYQAELKRVQEANAAAKAAYDTAVAANNAKNTEIAAANEEIRKRNATAKAEYETKLAQYQAELKRVQEANAANEADYQAKLTAYQTELARVQKANADAKAAYEAAVAANNAKNAALTAENTAIKQRNENAKATYEAALKQYEADLAAVKKANAANEADYQAKLTAYQTELARVQKANADAKAAYEAAVAANNAANAALTAENTAIKKRNADAKADYEAKLAKYQADLAKYSTSTGSTSTGVNVPKVTKEKPTPPVKPTAPTKPTYETEKPLKPAPVAPNYEKEPTPPTRTPDQAEPNKPTPPTYETEKPLEPAPVEPSYEAEPTPPTRTPDQAEPNKPTPPTYETEKPLEPAPVEPSYEAEPTPPTPTPDQPEPNKPVEPTYEVIPTPPTDPVYQDLPTPPSVPTVHF(SEQID NO:4)。
该变异链球菌表面蛋白抗原(PAc)的制备方法为:
(1)根据GenBanK数据库得到变异链球菌SM UA159菌株pac基因中A区+P区基因序列,并在A区和P区之间设计序列为TCCACCTCCACCGGATCCACCTCCACCGGA的核苷酸,并送往生工生物工程(上海)股份有限公司进行合成(1563bp)。再将其与pGEX-4T-1连接,得到pGEX-4T-pac重组载体。
(2)以pGEX-4T-pac重组载体为模板,设计相应的pac上下游引物(如SEQ ID NO:5-6所示)扩增目的基因,PCR反应体系为:Prime STARHS(Premix):25μL、上、下游引物各2μL、模板2μL、ddH
上游引物:5’-CGATGGGGATCCGAGCTCGTTAAAACACCTGAAGAAGC-3’(SEQ ID NO:5);
下游引物:5’-TCGAATTCCCATATGTTAGAAATGAACAGTTGGATCAG-3’(SEQ ID NO:6)。
(3)对PCR扩增得到的目的基因进行胶回收,接着利用限制性内切酶SacⅠ和KpnⅠ对空载质粒pBAD/HisA进行双酶切(37℃,30min)。PCR产物和双酶切产物分别利用胶回收试剂盒进行回收,测定浓度,将纯化后的PCR扩增目的片段和线性载体pBAD/HisA根据无缝克隆试剂盒进行连接,其目的片段与载体的摩尔比在2:1-3:1之间(50℃反应20min)。连接产物(即重组质粒pBAD/HisA-pac)转化大肠杆菌Top10感受态细胞,涂布于含100μg/mL氨苄青霉素的LB平板上,37℃过夜培养。在LB平板上随机挑取8个单菌落置于LB液体培养基中(含100μg/mL氨苄青霉素)培养一定时间,分别取菌液进行PCR鉴定,阳性克隆送至生工生物工程(上海)股份有限公司测序,测序结果与之前合成的pac进行BLAST。
(4)将BLAST正确无误的含重组质粒pBAD/HisA-pac的菌液接种于10mL LB液体培养基(含100μg/mL氨苄青霉素)中,200r/min,37℃过夜培养。次日,按照2%-5%接种量扩大培养,37℃,200r/min摇床培养至OD
图1所示为重组变异链球菌表面蛋白PAc的过程中各阶段的电泳情况。其中,A为pac基因的PCR扩增结果;B为菌液PCR验证试验,1-8号为不同的单克隆,3号为阴性克隆;C为pac测序验证;D为Marker,1:全蛋白,2:杂蛋白,3:10mM咪唑,4:25mM咪唑,5:50mM咪唑,6:100mM咪唑,7:500mM咪唑的电泳结果;E为Marker,1:HisA-PAc融合蛋白,2-3:通过肠激酶切HisA标签蛋白过柱纯化后的PAc蛋白电泳结果。
实施例3:pH响应型防龋疫苗
本实施例提供一种pH响应型防龋疫苗,包括ZIF-8和变异链球菌表面蛋白抗原,其制备方法为:在PBS缓冲液中加入实施例1中ZIF-8纳米材料和实施例2中的变异链球菌表面蛋白抗原(PAc),经静电吸附实现结合,得到ZIF-8@PAc。
通过SEM测定ZIF-8纳米材料和ZIF-8@PAc的粒径大小,测试结果分别如图2中A、B所示;再通过TEM测定ZIF-8和ZIF-8@PAc的内部情况,ZIF-8纳米材料的检测结果如图2中C-D所示,ZIF-8@PAc的检测结果如图2中E-F所示;通过激光纳米粒径仪测得ZIF-8、PAc和ZIF-8@PAc的电位,结果如图2中G所示。
为了得出PAc蛋白与ZIF-8纳米材料的最佳吸附条件,通过控制PAc蛋白的浓度,改变ZIF-8纳米材料的浓度进行结合。ZIF-8纳米材料和PAc两者的质量比分别为0:1,0.5:1,1:1,2:1,5:1,10:1,20:1,40:1(n=3)。两者通过静电吸附的原理进行结合,在25℃,震荡结合60min,8000rpm离心2min,测定上清残余蛋白浓度,从而得出PAc蛋白与ZIF-8纳米材料的吸附比例。由图2中H可知,当ZIF-8与PAc的质量比约为(5-40):1时,两者具有良好的吸附和结合效果。
用最佳吸附条件(即ZIF-8与PAc的质量比为10:1)制备好ZIF-8@PAc,将ZIF-8@PAc置于PBS缓冲液中进行PAc蛋白释放,设置3个不同pH条件,分别为pH 7.2、pH 6.0和pH5.0,并在1h、2h、3h、6h、9h、12h、24h等时间段进行取样,离心,取上清液测定残余蛋白浓度,计算释放率(n=3)。根据图2中I可知,ZIF-8@PAc在酸性环境下释放能力更强,具有pH响应性,更有利于疫苗在酸性细胞环境下发挥作用。
实施例4:大鼠龋齿实验
采用18d龄雌性SD大鼠为实验动物,刚开始饲喂不含抗生素的Keyes 2000diet龋齿饲料,在第20d在龋齿饲料中加入氯霉素、氨苄青霉素和羧苄青霉素(均为1g/kg),在饮用水中加青霉素200μg/mL、链霉素1500μg/mL,连喂3d。第23d开始免疫,分别设置3组(PBS、PBS+PAc、ZIF-8@PAc)(n=5),其中PBS组是每只大鼠免疫100μL PBS,而PBS+PAc和ZIF-8@PAc两个组分别对每只大鼠免疫50μg PAc,总体积用PBS稀释到100μL。采用皮下多点免疫,共免疫3次,每次间隔14天。24-26d在牙齿上涂变异链球菌(UA159)(1×10
采用ZIF-8@PAc进行免疫的大鼠在实验期间并未发生死亡现象,根据图中3D-H器官指数表明ZIF-8@PAc具有良好的安全性。而根据图3中A-C抗体滴度和菌含量变化以及图4的大鼠龋齿结果可知,ZIF-8@PAc龋齿预防效果显著强于单独使用PAc抗原。
上面结合附图对本申请实施例作了详细说明,但是本申请不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本申请宗旨的前提下作出各种变化。此外,在不冲突的情况下,本申请的实施例及实施例中的特征可以相互组合。
